 图 1
山竹醇、8-烯丙基山竹醇、Clusianone、Oblongifolin A的化学结构
Figure 1.
Chemical structure of garcinol, 8-allyl garcinol, clusianone and oblongifolin A
图 1
山竹醇、8-烯丙基山竹醇、Clusianone、Oblongifolin A的化学结构
Figure 1.
Chemical structure of garcinol, 8-allyl garcinol, clusianone and oblongifolin A

Citation: Cao Jing, Han Chaoming, Zhang Guilian, Zhou Xinying, Li Shuwen, Du Yinduan, Zhao Shuai, Zhang Xinyan, Chen Xin. Synthesis and Anticancer Activity of 8-Allyl Garcinol[J]. Chinese Journal of Organic Chemistry, 2017, 37(8): 2086-2093. doi: 10.6023/cjoc201701017

8-烯丙基山竹醇的合成及其抗癌活性研究
-
关键词:
- 山竹醇
- / Effenburger环化
- / 合成
- / 结构改造
English
Synthesis and Anticancer Activity of 8-Allyl Garcinol
-
Key words:
- garcinol
- / Effenburger cyclization
- / synthesis
- / structural modification
-
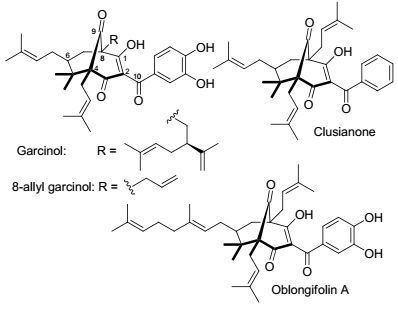
山竹醇, 英文名Garcinol, 为多聚异戊二烯基苯甲酮[1], 是从印度藤黄的干果皮中提取出来的一种黄色晶体化合物[2].在印度和东南亚地区, 印度藤黄的干果皮用来作为一种香料, 常用于一些民间医学, 印度藤黄的干果皮在治疗糖尿病、肥胖、溃疡和其它疾病有着重要作用[3~5].山竹醇的化学结构与含有酚羟基和β-二酮的姜黄素类似, 都具有很强的抗氧化活性[6, 7].山竹醇还具有抗炎, 抗癌活性[8~10], 同时是组蛋白乙酰转化酶p300抑制剂[11].此外, 在细胞培养研究中, 山竹醇还表现出抗增殖作用, 诱导细胞凋亡作用, 也是环氧化酶-2抑制剂, 5-脂氧化酶(5-LOX)抑制剂[3, 9, 12].
我们曾报道, 山竹醇通过抑制5-LOX, 对7, 12-二甲基苯并蒽(DMBA)引导的急性炎症和仓鼠口腔颊囊的口腔鳞状细胞癌有化学预防作用[13].计算机建模预测, 山竹醇与5-LOX的活性位点相结合从而抑制5-LOX, 并且, 山竹醇的13和14位的两个羟基对抑制5-LOX起着至关重要的作用[13].我们近期研究表明, 这两个羟基也是山竹醇抗癌活性的必需官能团[14].计算机建模还表明, 山竹醇结构中C(8) 位置上的过大支链可能会阻碍山竹醇与5-LOX的活性位点相结合, 进而不能有效抑制5-LOX.这个过大的支链还可能会导致山竹醇的抗癌活性降低, 膜渗透性变差[13].因此, 我们计划对山竹醇的C(8) 位置进行结构改造, 用烯丙基代替过大的5-甲基-2-(1-甲基乙烯基)-4-己烯基支链, 合成8-烯丙基山竹醇(8-allyl garcinol) (图 1).
 图 1
山竹醇、8-烯丙基山竹醇、Clusianone、Oblongifolin A的化学结构
Figure 1.
Chemical structure of garcinol, 8-allyl garcinol, clusianone and oblongifolin A
图 1
山竹醇、8-烯丙基山竹醇、Clusianone、Oblongifolin A的化学结构
Figure 1.
Chemical structure of garcinol, 8-allyl garcinol, clusianone and oblongifolin A
目前, 8-烯丙基山竹醇还未见报道, 合成山竹醇及其衍生物的文献也不多. Socolsky等[15]以乙酰丙酮作为起始原料, 经过aldol缩合、Tsuji-Trost烷基化、Claisen环化等多步反应合成得到山竹醇. Biber等[16]从乙酰丙酮开始, 通过α-亚甲基化、Michael加成、Knoevenagel缩合、烷基化、Dieckmann缩合等反应, 合成了与8-烯丙基山竹醇结构相似的Oblongifolin A[15] (图 1). Rodeschini等[17]和Nuhant等[18]合成了与山竹醇结构相似的Clusianone (图 1).
1 结果与讨论
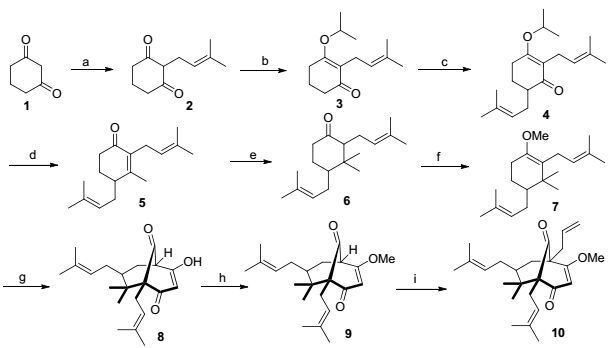
8-烯丙基山竹醇的合成路线如Scheme 1所示.参考Nuhant等[18]合成Clusianone的方法, 我们以1, 3-环己二酮作为原料, 以N, N-二异丙基乙胺(DIEA)作为碱, 与3, 3-二甲基烯丙基溴发生烷基化反应生成3-羟基-2-(3-甲基-2-丁烯基)环己-2-烯酮(2). 2与2-碘丙烷进行烷基化, 得到3-异丙氧基-2-(3-甲基-2-丁烯基)环己-2-烯酮(3), 两步产率为60%.在二异丙基氨基锂(LDA)作用下, 3再与3, 3-二甲基烯丙基溴发生烷基化, 得到3-异丙氧基-2, 6-双(3-甲基-2-丁烯基)环己-2-烯酮(4), 产率为71%.化合物4与甲基锂反应并酸化后, 以70%产率生成3-甲基-2, 4-双(3-甲基-2-丁烯基)环己-2-烯酮(5).接着, 5与甲基铜锂进行Michael加成, 得到双甲基化产物3, 3-二甲基-2, 4-双(3-甲基丁-2-烯基)环己酮(6).经过Me2SO4作用, 环己酮6被转化为甲醚化合物7.该中间体无需纯化, 直接与丙二酰氯发生环化反应, 得到关键的三环中间体8, 两步产率为27%.在对甲苯磺酸催化下, 8在甲醇中与原甲酸三甲酯反应, 将其中的羟基保护为甲醚9, 以便在下一步中, 在C(8) 位引入烯丙基生成10.
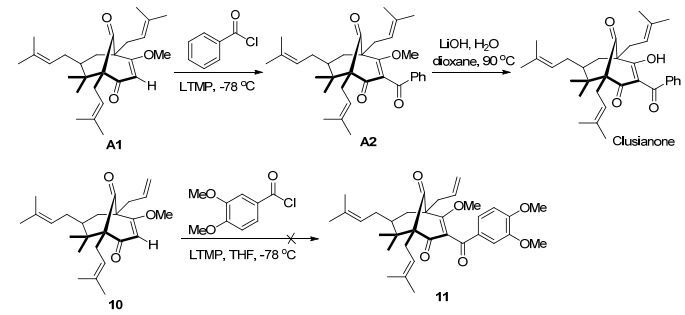
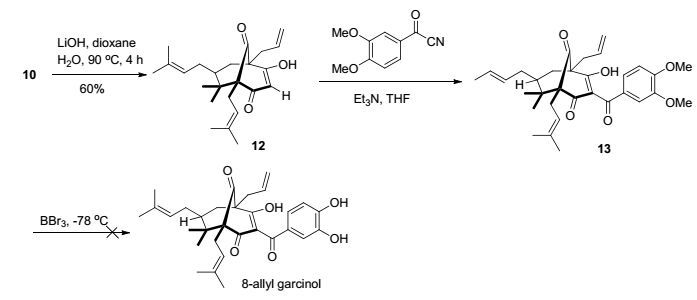
Rodeschini等[17]利用三环化合物1-甲氧基-5, 5-二甲基-4, 6, 8-三(3-甲基-丁-2-烯基)二环[3.3.1]壬-2-烯-3, 9-二酮(A1)与苯甲酰氯在强碱2, 2, 6, 6-四甲基哌啶锂(LTMP)作用下进行酰基化反应, 所得产物2-苯甲酰基-1-甲氧基-5, 5-二甲基-4, 6, 8-三(3-甲基-丁-2-烯基)二环[3.3.1]壬-2-烯-3, 9-二酮(A2)再经过LiOH水解而得到Clusianone (Scheme 2).然而, 在此条件下, 我们尝试了10与3, 4-二甲氧基苯甲酰氯反应, 却无法得到预期的酰基化产物11.我们将10在LiOH作用下进行水解, 以60%产率得到12 (Scheme 3).此反应看似简单, 却易导致很低的产率, 关键是要控制好反应温度和反应时间, 因为10不太容易被水解, 但温度过高或者反应时间过长, 却可能使三环中间体分解.用3, 4-二甲氧基苯甲酰氰[18]取代3, 4-二甲氧基苯甲酰氯后, 在三环化合物12 C2位上可以顺利进行酰化.对于3, 4-二甲氧基苯甲酰氰和相应酰氯同三环中间体(10和12)亲电反应的差异, 我们推测其可能原因是“氰基效应”[19], 也就是酰氰化合物的氰基能与烯醇化合物形成氢键, 而且在有机溶剂中呈现强碱性质, 因此, 酰氰比酰氯更有利于亲电取代反应.
不过, 所得产物13在进行去甲基化反应时, 并未得到目标产物(Scheme 3).可能的原因是, 13在低温(-78 ℃)下反应不完全, 单羟基和双羟基化产物混在一起, 不易有效分离; 但若提高反应温度, 三溴化硼则会破坏三环骨架.
最终, 我们改变了酚羟基的保护基, 用3, 4-二乙酰氧基苯甲酰氰代替3, 4-二甲氧基苯甲酰氰, 再与化合物12进行酰基化反应, 以73%产率得到了酰基化物14. 最后, 14在碳酸钾和甲醇体系中进行水解, 以64%产率顺利得到目标产物8-烯丙基山竹醇(Scheme 4).
1.2 山竹醇和8-烯丙基山竹醇的生物活性比较
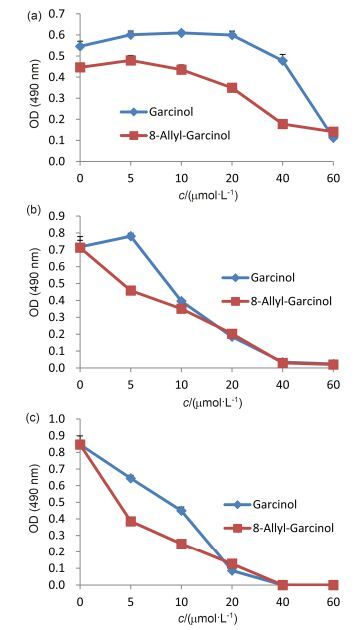
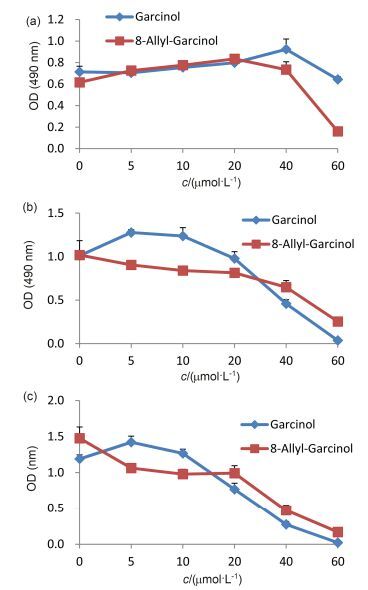
我们利用噻唑蓝(MTT)法, 比较了山竹醇和8-烯丙基山竹醇对口腔鳞癌细胞SCC-15和CAL-27细胞增殖的抑制活性.与阴性对照组相比, 山竹醇和8-烯丙基山竹醇均能够显著抑制口腔鳞癌细胞SCC-15和CAL-27细胞的增殖, 差异具有统计学意义(P<0.01).随着山竹醇和8-烯丙基山竹醇浓度的增高和作用时间延长, 对SCC-15和CAL-27细胞的抑制作用逐渐增强, 呈一定浓度和时间依赖关系(图 1和图 2).本研究发现, 在药物低至中浓度(5~20 μmol/L)时, 8-烯丙基山竹醇的抑制效果优于山竹醇(P<0.01).
2 结论
以1, 3-环己二酮为起始原料, 采用了Effenburger环化为关键步骤, 经过12步反应得到了8-烯丙基山竹醇, 总产率为1.2%.该方法避免了使用贵重试剂和有毒试剂, 操作简单, 为山竹醇新衍生物的合成提供了参考, 具有潜在的应用价值.并且, 利用MTT法测得8-烯丙基山竹醇对人口腔鳞癌细胞具有显著的抑制增殖作用.
3 实验部分
3.1 仪器与试剂
熔点使用上海申光公司的显微熔点仪, 型号为SGW X-4B; NMR用Bruker (300和400 MHz)型核磁共振仪测定(CDCl3, DMSO-d6作溶剂, TMS为内标); HRMS用Thermo Orbitrap Elite测定; 昆山市超声仪器有限公司SQ-5200型超声波清洗器; 160~200目硅胶(青岛海洋化工厂生产); 薄层色谱使HSGF-254(购自烟台江友硅胶开发有限公司).试剂均为分析纯.
3.2 实验方法
3.2.1 3-羟基-2-(3-甲基-2-丁烯基)环己-2-烯酮(2)的合成
取1, 3-环己二酮(50 g, 446.2 mmol)溶于水中(100 mL), 冷却至0 ℃, 向其中缓慢加入N, N-二异丙基乙胺(57.53 g, 446.2 mmol), 之后再缓慢加入3, 3-二甲基烯丙基溴(73.08 g, 491 mmol), 在室温搅拌过夜(TLC监测反应进程).反应毕, 向反应液加入2 mol/L NaOH溶液, 调节pH≈11, 分液, 水相用乙酸乙酯萃取(300 mL), 之后用冰醋酸酸化, 直到白色固体不再析出, 此时pH≈3.抽滤, 并放在真空干燥箱干燥, 得到白色固体2 (48.16 g, 产率60%). m.p. 141~145 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 5.00 (t, J=7.1 Hz, 1H), 2.81 (d, J=7.0 Hz, 2H), 2.31~2.28 (m, 4H), 1.85~1.78 (m, 2H), 1.63 (s, 3H), 1.59 (s, 3H); 13C NMR (100 MHz, DMSO-d6) δ:129.74, 124.23, 114.70, 33.01, 26.06, 21.25, 21.13, 18.18; HRMS calcd for C11H17O2[M+H]+ 181.1223; found 181.1229..
3.2.2 3-异丙氧基-2-(3-甲基-2-丁烯基)环己-2-烯酮(3)的合成
取化合物2 (35.27 g, 196 mmol)溶于丙酮(300 mL)中, 加入异丙基碘(116.62 g, 686 mmol)和碳酸钾(64.04 g, 784 mmol), 在60 ℃下反应4 h, TLC检测.反应结束后温度降至室温, 浓缩得到粗产物, 向粗产物中加入水(400 mL)和二氯甲烷(400 mL)溶解粗产物.溶液分液, 水相用二氯甲烷萃取(300 mL×3), 合并有机相, 有机相用饱和碳酸钠溶液洗(200 mL), 水洗(200 mL), 饱和食盐水洗(200 mL), 无水硫酸钠干燥, 浓缩, 并进行柱层析纯化[洗脱剂: V(石油醚):V(乙酸乙酯)=10:1], 得到黄色液体3 (40.4 g, 产率93%). 1H NMR (300 MHz, CDCl3) δ: 5.06~5.02 (m, 1H), 4.57~4.51 (m, 1H), 2.94 (d, J=7.2 Hz, 2H), 2.50 (t, J=6.2 Hz, 2H), 2.33 (t, J=6.2, 2H), 2.03~1.91 (m, 2H), 1.69 (s, 3H), 1.62 (s, 3H), 1.28 (s, 3H), 1.26 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 197.24, 169.64, 129.46, 121.93, 119.38, 69.15, 35.63, 24.71, 24.65, 22.00, 20, 19, 20.51, 16.80; HRMS calcd for C14H23O2[M+H]+ 223.1693; found 223.1699.
3.2.3 3-异丙氧基-2, 6-双(3-甲基-2-丁烯基)环己-2-烯酮(4)的合成
量取THF (100 mL)加入烧瓶中, 在氮气保护下, 加入二异丙胺(10.39 g, 103 mmol), 温度降至-78 ℃, 之后缓慢滴加正丁基锂(2.5 mol/L in Et2O, 41.1 mL, 103 mmol), 搅拌30 min, 再缓慢加入溶于THF化合物3 (20.74 g, 93 mmol).在-78 ℃下搅拌1 h后缓慢加入3, 3-二甲基烯丙基溴(16.7 g, 112 mmol), 在此温度下继续搅拌1 h后缓慢升至室温, 搅拌过夜, TLC监测.反应结束后, 用饱和氯化铵溶液淬灭反应, 分液, 减压浓缩有机相, 水相用乙酸乙酯萃取(300 mL×3), 合并有机相, 有机相用水洗, 饱和食盐水洗, 无水硫酸钠干燥.减压浓缩, 粗产品通过柱层析纯化[洗脱剂: V(石油醚):V(乙酸乙酯)=50:1]得到黄色液体4 (18.9 g, 产率71%). 1H NMR (300 MHz, CDCl3) δ: 5.10~5.04 (m, 1H), 5.06~5.02 (m, 1H), 4.52~4.48 (m, 1H), 2.95 (d, J=4.3 Hz, 2H), 2.60~2.54 (m, 2H), 2.48~2.40 (m, 1H), 2.18~1.12 (m, 1H), 2.08~2.00 (m, 2H), 1.70 (s, 3H), 1.69 (s, 3H), 1.63 (s, 3H), 1.60 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 199.78, 169.66, 133.09, 130.43, 122.41, 122.16, 119.91, 45.33, 28.34, 25.87, 25.75, 25.67, 24.77, 24.50, 21.89, 17.72; HRMS calcd for C19H31O2[M+H]+291.2319, found 291.2321.
3.2.4 3-甲基-2, 4-双(3-甲基-2-丁烯基)环己-2-烯酮(5)的合成
取化合物4 (31 g, 106.8 mmol)加入到烧瓶中, 在氮气保护下加入无水THF (250 mL), 在0 ℃缓满滴加甲基锂(1.3 mol/L in Et2O, 124 mL, 160.2 mmol)后, 直接在室温中反应30 min, 随后再次将反应液冷却至0 ℃并缓慢滴加稀盐酸, 调节至弱酸性并搅拌30 min, TLC监测.反应毕, 分液, 减压浓缩有机相, 水相用乙酸乙酯萃取(200 mL×3), 合并有机相, 有机相用水洗, 饱和食盐水洗, 无水硫酸钠干燥, 减压浓缩并柱层析纯化[洗脱剂: V(石油醚):V(乙酸乙酯)=150:1], 得到黄色液体5 (23.52 g, 产率71%). 1H NMR (400 MHz, CDCl3) δ: 5.11~5.06 (m, 1H), 4.89~4.82 (m, 1H), 3.03~2.92 (m, 2H), 2.41 (ddd, J=17.3, 12.2, 5.2 Hz, 1H), 2.29 (dt, J=17.2, 4.9 Hz, 1H), 2.25~2.09 (m, 2H), 2.14~2.11 (m, 1H), 1.98~1.90 (m, 1H), 1.94 (s, 3H), 1.85~1.80 (m, 1H), 1.83 (s, 3H), 1.82 (s, 3H), 1.81 (s, 3H), 1.80 (s, 3H); 13C NMR (100 MHz, CDCl3)δ: 198.91, 159.53, 135.64, 134.27, 132.09, 123.08, 122.83, 42.35, 34.45, 30.40, 26.50, 26.37, 26.21, 25.15, 20.68, 18.51; HRMS calcd for C17H27O [M+H]+ 247.2056; found 247.2061.
3.2.5 3, 3-二甲基-2, 4-双(3-甲基丁-2-烯基)环己酮(6)的合成
取溴化亚铜二甲硫醚(0.512 g, 2.5 mmol)于反应瓶中, 在氮气保护下加入无水THF (250 mL), -78 ℃滴加甲基溴化镁(3 mol/L in Et2O, 250 mmol)和六甲基磷酰三胺(17.92 g, 100 mmol), 搅拌20 min后, 通过注射器滴加溶于THF的5 (12.26 g, 50 mmol)和三甲基氯硅烷(10.86 g, 100 mmol), -78 ℃下搅拌2 h后, 滴加稀盐酸至酸性, 搅拌30 min, 升至室温搅拌10 min, TLC监测.反应毕分液, 减压浓缩有机相, 水相用乙酸乙酯萃取(300 mL×3), 合并有机相, 有机相用水洗, 饱和食盐水洗, 无水硫酸钠干燥.减压浓缩, 粗产物通过柱层析分离[洗脱剂: V(石油醚):V(乙酸乙酯)=400:1], 得到黄色液体6 (11.35 g, 产率86%). 1H NMR (300 MHz, CDCl3) δ: 5.05~5.01 (m, 1H), 4.95~4.90 (m, 1H), 2.36~2.32 (m, 1H), 2.26~2.20 (m, 2H), 2.23~2.09 (m, 1H), 2.17 (dd, J=9.5, 2.0 Hz, 1H), 2.08~1.99 (m, 2H), 1.71 (s, 3H), 1.69~1.66 (m, 1H), 1.63 (s, 6H), 1.64 (s, 3H), 1.55~1.48 (m, 1H), 1.41~1.35 (m, 1H), 1.18 (s, 3H), 0.56 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 211.32, 131.35, 130.29, 123.23, 122.69, 60.96, 47.03, 42.26, 41.29, 28.55, 27.85, 27.43, 25.70, 25.60, 20.75, 16.78, 16.45, 14.38; HRMS calcd for C18H31O [M+H]+ 263.2369; found 263.2368.
3.2.6 甲醚化合物7的合成
取化合物6 (8 g, 30.5 mmol)溶于干燥的DMSO (70 mL), 并向其中加入叔丁醇钾(5.13 g, 45.8 mmol), 在室温下搅拌30min, 随后缓慢滴加Me2SO4 (5.78 g, 45.8 mmol), 搅拌1 h, 之后向其中加入石油醚(200 mL), 分液, DMSO层用石油醚萃取(100 mL×2), 石油醚相用水洗, 饱和食盐水洗, 无水硫酸钠干燥.浓缩直接投下一步.
3.2.7 (±)-4-羟基-8, 8-二甲基-1, 7-双(3-甲基-丁-2-烯基)-二环[3.3.1]壬-3-烯-2, 9-二酮(8)的合成
取混合物7 (5.94 g, 21.6 mmol)溶于乙醚(12 mL)中, 在氮气保护下缓慢加入丙二酰氯(2.1 mL, 21.6 mmol), -20 ℃搅拌过夜后, 再加入氢氧化钾水溶液(4.84 g, 86.4 mmol)和苄基三乙基氯化铵(329 mg, 1.1 mmol), 之后在室温下搅拌5 h.反应毕, 向反应液加入水(200 mL)和石油醚(200 mL), 并滴加氢氧化钠溶液调节至强碱性, 分液, 水相用石油醚萃取(250 mL×3), 合并有机相, 用无水硫酸钠干燥, 减压浓缩, 得到化合物6.水相冰浴, 用稀盐酸酸化至强碱性, 随后用二氯甲烷萃取(400 mL×3), 合并有机相, 无水硫酸镁干燥, 减压浓缩, 粗产物柱层析分离纯化[洗脱剂: V(二氯甲烷):V(甲醇)=200:1], 得到黄色固体8 (1.94 g). m.p. 166~170 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.73 (s, 1H, OH), 5.85 (s, 1H), 4.96~4.92 (m, 1H), 4.64~4.60 (m, 1H), 3.71~3.68 (m, 1H), 3.15~3.11 (m, 1H), 2.47~2.44 (m, 2H), 2.05~2.02 (m, 2H), 1.82~1.70 (m, 3H), 1.65 (s, 3H), 1.64 (s, 3H), 1.56 (s, 3H), 1.55 (s, 3H), 1.04 (s, 3H), 0.73 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 207.21, 191.08, 183.32, 132.74, 132.25, 121.43, 118.81, 108.34, 67.01, 55.15, 44.73, 40.04, 31.87, 27.15, 24.91, 24.81, 22.73, 22.16, 17.08, 16.87, 14.98; HRMS calcd for C21H31O3[M+H]+331.2268, found 331.2272.
3.2.8 (±)-1-甲氧基-5, 5-二甲基-4, 6-二-(3-甲基-丁-2-烯基)-二环[3.3.1]壬-2-烯-3, 9-二酮(9)的合成
称取化合物8 (500 mg, 1.51 mmol)加入到反应瓶中, 溶于无水甲醇(20 mL)中, 在氮气保护下加入对甲苯磺酸(23 mg, 0.134 mmol)和原甲酸三甲酯(4.3 mL, 39 mmol), 在50 ℃回流, TLC监测.反应毕, 滴加两滴三乙胺, 减压浓缩, 粗产物通过柱层析分离纯化[洗脱剂: V(石油醚):V(乙酸乙酯)=30:1], 得到化合物微黄固体9 (420 mg, 产率81%). m.p. 65~70 ℃; 1H NMR (300 MHz, CDCl3) δ: 5.67 (s, 1H), 4.87~4.85 (m, 1H), 4.62~4.57 (m, 1H), 3.69 (s, 3H), 3.12 (s, 1H), 2.53 (dd, J=14.0, 6.8 Hz, 1H), 2.35 (dd, J=14.0, 6.5 Hz, 1H), 2.09~2.05 (m, 1H), 2.03~2.02 (m, 1H), 1.97~1.96 (m, 3H), 1.94 (2s, 6H), 1.59 (s, 3H), 1.52 (s, 3H), 1.02 (s, 3H), 0.71 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 208.99, 197.33, 175.04, 134.12, 133.74, 123.27, 120.80, 107.28, 71.45, 57.31, 53.86, 46.92, 41.66, 33.35, 28.55, 26.57, 26.49, 24.71, 23.29, 18.76, 18.54, 16.65; HRMS calcd for C22H33O3 [M+H]+ 345.2430, found 345.2424.
3.2.9 (±)-1-甲氧基-8-烯丙基-5, 5-二甲基-4, 6-二-(3-甲基-丁-2-烯基)-二环[3.3.1]壬-2-烯-3, 9-二酮(10)的合成
取二异丙胺(0.8 mL, 5.56 mmol)于反应瓶中, 用无水THF (16 mL), 在-78 ℃下缓慢加入正丁基锂(1.6 mol/L in Et2O, 3.5 mL, 5.56 mmol), 加毕反应30 min后, 再缓慢加入溶于THF的化合物9 (372 mg, 1.11 mmol), 搅拌40 min后, 加入3-溴丙烯(0.5 mL, 5.56 mmol).反应30 min后用饱和氯化铵溶液淬灭反应, 分液, 减压浓缩有机相, 水相用乙酸乙酯萃取, 合并有机相, 有机相用水洗, 饱和食盐水洗, 无水硫酸钠干燥, 减压浓缩, 粗产品通过柱层析分离纯化[洗脱剂: V(石油醚):V(乙酸乙酯)=30:1], 得到化合物黄色液体10 (307 mg, 产率72%). 1H NMR (300 MHz, CDCl3) δ: 5.82~5.68 (m, 2H), 5.07~4.90 (m, 2H), 4.60 (td, J=5.6, 1.3 Hz, 1H), 3.71 (s, 1H), 2.61~2.54 (m, 2H), 2.42~2.39 (m, 2H), 2.08~2.05 (m, 1H), 1.88~1.82 (m, 1H), 1.68~1.65 (m, 1H), 1.65 (s, 6H), 1.62~1.58 (m, 1H), 1.55 (s, 3H), 1.52 (s, 3H), 1.39~1.32 (m, 1H), 1.03 (s, 3H), 0.70 (s, 3H); 13C NMR (75 MHz, CDCl3)δ: 208.17, 195.95, 175.66, 134.22, 133.18, 133.07, 122.71, 120.41, 117.74, 107.64, 71.03, 56.61, 55.91, 46.16, 41.97, 39.65, 35.29, 27.91, 25.96, 25.88, 24.46, 22.77, 18.14, 17.94, 15.88; HRMS calcd for C25H37O3 [M+H]+ 385.2737, found 385.2740.
3.2.10 (±)-1-羟基-8-烯丙基-5, 5-二甲基-4, 6-二-(3-甲基-丁-2-烯基)-二环[3.3.1]壬-2-烯-3, 9-二酮(12)的合成
取化合物10 (260 mg, 0.68 mmol)于反应瓶中, 加入二氧六环溶解, 再加入氢氧化锂(142 mg, 3.38 mmol)和水, 在氮气保护下90 ℃回流, 反应4 h.反应毕, 将反应液冰浴, 滴加稀盐酸至酸性, 分液, 减压浓缩有机相, 水相用乙酸乙酯萃取, 合并有机相, 饱和食盐水洗, 无水硫酸钠干燥, 减压浓缩, 粗产物经过柱层析分离纯化[洗脱剂: V(石油醚):V(乙酸乙酯)=7:1], 得到白色固体12 (127 mg, 60%产率). m.p. 115~118 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 5.71 (s, 1H), 5.68~5.60 (m, 1H), 5.03~4.94 (m, 3H), 4.66~4.63 (m, 1H), 2.45 (d, J=7.0, 2H), 2.36 (d, J=6.7, 2H), 2.06~2.02 (m, 1H), 1.71~1.68 (m, 2H), 1.65 (s, 3H), 1.62 (s, 3H), 1.55 (s, 3H), 1.53 (s, 3H), 1.35~1.25 (m, 2H), 1.04 (s, 3H), 0.67 (s, 3H); 13C NMR (75 MHz, DMSO-d6) δ: 208.30, 134.73, 132.40, 131.65, 123.06, 121.05, 117.71, 108.92, 44.60, 41.65, 34.79, 27.92, 25.94, 25.71, 23.81, 23.14, 18.09, 17.76, 15.67; HRMS calcd for C24H33O3 [M+H]- 369.2435, found 369.2467.
3.2.11 中间体14的合成
取化合物12 (77 mg, 0.21mmol)溶于无水THF中, 在氮气保护下缓慢加入三乙胺(87 μL, 0.63 mmol)和溶于THF的3, 4-二乙酰氧基苯甲酰氰(233 mg, 0.95 mmol), 搅拌过夜.反应毕, 加入饱和的氯化铵溶液, 分液, 减压浓缩有机相, 水相用乙酸乙酯萃取, 合并有机相, 有机相用水洗, 饱和食盐水洗, 无水硫酸钠干燥, 减压浓缩, 粗产物经过柱层析分离纯化[洗脱剂: V(二氯甲烷):V(甲醇)=400:1], 得到淡黄色固体14 (76 mg, 产率73%). m.p. 89~91 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.52~7.41 (m, 2H), 7.22~7.18 (m, 1H), 5.94~5.81 (m, 1H), 5.21~5.10 (m, 2H), 4.99~4.66 (m, 2H), 2.78~2.65 (m, 2H), 2.62~2.44 (m, 2H), 2.35~2.32 (m, 1H), 2.30 (s, 3H), 2.29 (s, 3H), 2.17~1.99 (m, 2H), 1.72 (m, 1H), 1.69 (s, 3H), 1.68~1.65 (m, 1H), 1.61 (d, J=4.4 Hz, 3H), 1.57~1.54 (m, 1H), 1.53 (s, 3H), 1.40~1.37 (m, 1H), 1.24~1.22 (m, 3H), 1.05~1.01 (m, 1H), 0.70~0.66 (m, 3H); 13C NMR (CDCl3, 100 MHz) δ: 207.15, 195.54, 192.33, 167.84, 167.53, 145.66, 141.36, 135.38, 134.87, 134.64, 133.53, 133.21, 127.94, 124.85, 122.75, 122.07, 120.31, 118.80, 115.95, 71.18, 59.22, 48.62, 47.77, 42.46, 41.67, 29.70, 26.08, 24.84, 23.75, 22.62, 20.77, 20.61, 18.15, 17.92, 16.19; HRMS calcd for C35H43O8Na[M+Na]+ 613.6772, found 613.6773.
3.2.12 (±)-8-烯丙基山竹醇的合成
取化合物14 (76 mg, 0.13 mmol)用无水甲醇(3 mL)溶解后, 在氮气保护下加入碳酸钾(71 mg, 0.51 mmol), 室温搅拌10 min.反应完全后, 加入饱和的氯化铵溶液, 用乙酸乙酯萃取三次, 合并有机相, 有机相用饱和食盐水洗, 无水硫酸钠干燥, 减压浓缩, 粗产物柱层析分离纯化[洗脱剂: V(二氯甲烷):V(甲醇)=80:1], 得到产物 (23 mg, 产率64%). 1H NMR (400 MHz, CDCl3) δ: 7.06~7.01 (m, 2H), 6.61 (d, J=8.2 Hz, 1H), 5.92~5.86 (m, 1H), 5.20~5.07 (m, 2H), 4.96~4.78 (m, 2H), 2.73~2.70 (m, 2H), 2.65~2.60 (m, 2H), 2.11~1.99 (m, 2H), 1.70 (s, 3H), 1.66 (s, 3H), 1.63 (s, 3H), 1.54 (s, 3H), 1.28~1.23 (m, 5H), 1.13~1.10 (m, 1H), 0.79~0.77 (m, 3H); 13C NMR (CDCl3, 100 MHz) δ: 195.88, 149.37, 143.54, 134.94, 133.64, 129.93, 128.75, 123.91, 122.10, 118.99, 116.51, 114.50, 42.84, 35.94, 31.92, 29.22, 27.23, 26.03, 25.29, 22.70, 18.17, 17.94, 16.29, 14.14; HRMS calcd for C31H37O6[M+H]- 505.2596, found 505.2591.
3.2.13 细胞增殖分析
MTT法检测细胞增殖:将对数生长期的SCC-15和CAL-27细胞悬液调整浓度至1×104个/mL后, 接种到96孔培养板, 每孔200 μL, 细胞贴壁后, 根据预实验结果, 分别加入不同浓度的Garcinol和8-烯丙基Garcinol (5、10、20、40、60 μmol/L).每个浓度设置6个复孔, 同时设置不加细胞的调零孔和不加药物的阴性对照孔.在37 ℃ 5% CO2分别孵育24、48、72 h, 每孔加入20 μL MTT溶液(5 mg/mL), 继续培养4 h后终止培养, 吸去孔内培养液, 每孔加入150 μL二甲基亚砜, 置摇床上低速振荡10 min, 使结晶物充分溶解.在酶联免疫检测仪波长OD 490 nm处测量各孔的吸光值.应用SPSS 17.0 for windows统计软件进行统计分析.采用ANOVA检验, 以α=0.05作为检验水准.
辅助材料(Supporting Information) 目标化合物的1H NMR, 13C NMR, 和MS数据.这些材料可以免费从本刊网站(http://siocjournal.cn/)上下载.
-
-
[1]
Aggarwal, S.; Das, S. N. Tumor. Biol. 2016, 37, 7175. doi: 10.1007/s13277-015-4583-8
-
[2]
Saadat, N.; Gupta, S. V. J. Oncol. 2012, 84, 647206.
-
[3]
Koeberle, A.; Northoff, H.; Werz, O. Biochem. Pharmacol. 2009, 77, 1513. doi: 10.1016/j.bcp.2009.02.005
-
[4]
Li, F.; Shanmugam, M. K.; Siveen, K. S. Oncotarget 2015, 6, 5147. doi: 10.18632/oncotarget.v6i7
-
[5]
Wu, A. T.; Lee, W. H.; Huang, C. C.; Lin, C. M.; Huang, Y. J.; Wei, L.; Ting, L. L.; Kuo, C. C.; Hsu, C.; Chiou, J. Biotechnol. Appl. Biochem. 2017, 64, 165. doi: 10.1002/bab.2017.64.issue-2
-
[6]
Liao, C. H.; Sang, S.; Liang, Y. C.; Ho, C. T.; Lin, J. K. Mol. Carcinog. 2004, 41, 140. doi: 10.1002/(ISSN)1098-2744
-
[7]
Padhye, S.; Ahmad, A.; Oswal, N.; Sarkar, F. C. J. Hematol. Oncol. 2009, 2, 38. doi: 10.1186/1756-8722-2-38
-
[8]
Tanaka, T.; Kohno, H.; Shimada, R.; Kagami, S.; Yamaguchi, F.; Kataoka, S.; Ariga, T.; Murakami, A.; Koshimizu, K.; Ohigashi, H. Carcinogenesis 2000, 21, 1183. doi: 10.1093/carcin/21.6.1183
-
[9]
Hong, J.; Sang, S.; Park, H. J.; Kwon, S. J.; Suh, N.; Huang, M. T.; Ho, C. T.; Yang, C. S. Carcinogenesis 2006, 27, 278. doi: 10.1093/carcin/bgi208
-
[10]
Ahmad, A.; Wang, Z.; Ali, R.; Maitah, M. Y.; Kong, D.; Banerjee, S.; Padhye, S.; Sarkar, F. H. J. Cell. Biochem. 2010, 109, 1134.
-
[11]
Balasubramanyam, K.; Altaf, M.; Varier, R. A.; Swaminathan, V. Ravindran, A.; Sadhale, P. P.; Kundu, T. K. J. Biol Chem. 2004, 279, 33716. doi: 10.1074/jbc.M402839200
-
[12]
Ahmad, A.; Sarkar, S. H.; Aboukameel A.; Ali, S.; Biersack, B.; Seibt, S.; Li, Y. W.; Bao, B.; Kong, D.; Banerjee, S.; Schobert, R.; Padhye, S. B.; Sarkar, F. H. Carcinogenesis 2012, 33, 2450. doi: 10.1093/carcin/bgs290
-
[13]
Chen, X.; Zhang, X. Y.; Lu, Y.; Shim, J. Y.; Sang, S.; Sun, Z.; Chen, X. X. Nutr. Cancer. 2012, 64, 1211. doi: 10.1080/01635581.2012.718032
-
[14]
Han, C. M.; Zhou, X. Y.; Cao, J.; Zhang, X. Y.; Chen, X. Bioorg. Chem. 2015, 60, 123. doi: 10.1016/j.bioorg.2015.04.010
-
[15]
Socolsky, C.; Plietker, B. Chem.-Eur. J. 2015, 21, 3053. doi: 10.1002/chem.201406077
-
[16]
Biber, N.; Plietker, B.; Mows, K. Nat. Chem. 2011, 3, 938. doi: 10.1038/nchem.1170
-
[17]
Rodeschini, V.; Ahmad, N. M.; Simpkins, N. S. Org. Lett. 2006, 8, 5283. doi: 10.1021/ol0620592
-
[18]
Nuhant, P.; David, M.; Pouplin, T.; Delpech, B.; Marazano, C. Org. Lett. 2007, 9, 287. doi: 10.1021/ol062736s
-
[19]
Peng, P.; Linseis, L.; Winter, F. R.; Schmidt, R. R. J. Am. Chem. Soc. 2016, 138, 6002. doi: 10.1021/jacs.6b02454
-
[1]
-
图式 1 三环中间体10的合成
Scheme 1 Synthetic route for tricyclic intermediate 10
Reagents and conditions: (a) 3, 3-dimethylallyl bromide, DIEA, H2O, r.t., 12 h, 60%; (b) i-PrI, K2CO3, 60 ℃, 4 h, 93%; (c) LDA, 3, 3-dimethylallyl bromide, -78 ℃, 1 h, 71%; (d) MeLi, THF, 0 ℃~r.t., 1 h; 1 mol/L HCl, r.t., 30 min, 70%; (e) CuBr.Me2S, MeMgBr, HMPA, TMSCl, THF, -78 ℃, 2 h, 86%; (f) Me2SO4, t-BuOK, DMSO, r.t., 1 h; (g) malonyl dichloride, benzyltriethylammonium chloride, ether, -20 ℃, 24 h; (h) trimethyl orthoformate, TsOH, MeOH, 50 ℃, 16 h, 81%; (i) allyl bromide, LDA, THF, -78 ℃, 1 h, 72%.
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 2454
- HTML全文浏览量: 600


 下载:
下载:






 下载:
下载:

