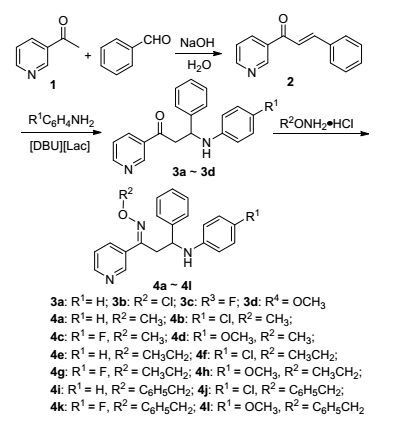
 图式1
化合物的合成路线
Scheme1.
Synthetic route of the target compounds
图式1
化合物的合成路线
Scheme1.
Synthetic route of the target compounds

Citation: Zan Ningning, Wan Fuxian, Wang Shichun, Zhang Junhui, Jiang Lin. Synthesis and Biological Activity of Novel 3-Phenylpropan-1-one Oxime Ethers Containing Pyridine Moiety[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1537-1541. doi: 10.6023/cjoc201701009

含吡啶环的3-苯基-1-丙酮肟醚的合成及生物活性
English
Synthesis and Biological Activity of Novel 3-Phenylpropan-1-one Oxime Ethers Containing Pyridine Moiety
-
Key words:
- heterocycles
- / pyridine
- / ketones
- / oxime ethers
- / biological activitity
-
含氮杂环化合物具有生物活性高、环境相容性好等特性, 已成为农药和医药创制中的研究热点[1].吡啶衍生物是一类重要的含氮杂化合物, 具有抗癌[2]、抗菌[3]、杀虫[4]、抗神经性疼痛[5]等活性.许多吡啶类化合物在农业生产中扮演着十分重要的角色, 如杀虫剂吡虫啉、氟啶脲、氯虫酰胺, 杀菌剂啶酰菌胺、氟啶胺, 除草剂啶嘧磺隆、百草枯, 植物生长调节剂吡啶醇、抗倒胺等.
肟醚类化合物具有优良和广谱生物活性, 如抗肿瘤[6]、抗病毒[7]、杀虫[8]、杀菌[9]、消炎[10]等生物活性.此外, 许多肟醚具有高效、低毒、低残留等优点, 作为一类农药活性物质得到较广泛的应用.目前农药市场中, 有含肟醚结构的杀菌剂啶斑肟、肟菌酯、肟醚菌胺, 除草剂肟草酮, 杀虫剂肟醚菊酯等.近年来, 许多农药化学工作者将一些高活性的杂环引入肟醚中来寻找新型的农药, 如日本组合化学公司开发了一种含有苄氨基甲酸酯结构的吡啶亚甲基肟醚类化合物Pyribencarb, 具有广谱杀菌活性, 尤其是对灰霉菌和菌核菌有特效[11].湖南化工研究院开展了许多具有杀虫、杀菌活性的肟醚类化合物的设计与合成研究, 获得了具有杀螨、杀菌活性的候选农药品种HNPC-A3066[12].为寻找新型的、具有优良杀菌活性的吡啶肟醚类化合物, 结合我们前期有关肟醚的研究[13], 本文采用活性亚结构连接法, 设计并合成了12种结构新颖的1-(3-吡啶基)-3-苯基-3-(4-取代苯胺基)-1-丙酮肟醚(4a~4l), 并初步测试了目标化合物的抑菌活性.合成路线见Scheme 1.
1 结果与讨论
1.1 合成方法
中间体1-(3-吡啶基)-3-苯基-3-(4-取代苯胺基)-1-丙酮是由1-(3-吡啶基)-3-苯基-2-丙烯-1-酮(氮杂查尔酮)分别与4种不同的取代苯胺发生加成反应生成.文献[14]以硝酸锂改性的天然磷酸酯(Li/NP)为催化剂, 实现了取代查尔酮与苯胺的加成, 收率大于90%;但制备催化剂时需要在900 ℃高温下煅烧1 h, 条件苛刻.文献[15]以离子液体为催化剂、采用无溶剂研磨法来提高产率.本文曾采用该方法制备氮杂查尔酮, 但研磨时容易结块, 反应不完全.后来我们将氮杂查尔酮与苯胺先用少量二氯甲烷溶解, 再加入离子液体[DBU][Lac], 室温下搅拌至固体状, 再放置过夜, 薄层色谱(TLC)检测原料点消失.反应完毕, 粗产物用少量乙酸乙酯洗涤以除去过量的苯胺以及离子液体.洗涤后的产物纯度很高, 可直接结构表征, 且产率均大于80%. 3a~3d与烷/苄氧基胺盐酸盐在碱性介质中反应生成目标化合物.
1.2 波谱解析
目标化合物的1H NMR中, 与肟醚碳相连的亚甲基质子受邻位不对称碳原子的影响, 为化学不等价质子, 并与不对称碳上的质子构成ABX系统, 分裂为两组多重峰[16], 其化学位移分别在δ 2.90和3.50附近; 而不对称碳上质子的化学位移在δ 4.53~4.63处, 呈现四重峰.苯胺基NH质子的化学位移位于δ 4.64~4.89处, 为较宽的单峰. 13C NMR中, 肟醚键上碳的化学位移在δ 147处, 其余δ在100以上的峰均为吡啶环和苯环碳的吸收峰. CH和CH2的化学位移分别在δ 56、35附近. 4a~4d中, 肟醚键上CH3的化学位移在δ 62处; 4e~4h中, 肟醚结构中CH3CH2的甲基、亚甲基碳的化学位移分别在δ 14.9、70.0处; 4i~4l肟醚键苄基的CH2化学位移在δ 77附近.
1.3 抑菌活性
由表 1可知, 大部分目标化合物对菌核菌有良好的抑制活性, 其中4b、4d、4f和4g的EC50值分别为2.46, 2.73, 2.93和1.81 µg/mL, 与对照药剂百菌清相比(EC50=3.27 µg/mL), 活性更高.从化合物的分子结构看, 苯胺基的R1为氟、氯原子或甲氧基、而肟醚键上R2为甲基或乙基时, 化合物的抑菌活性较高, 但R2为苄基时活性降低.
 表 1
目标化合物4a~4l对茄子菌核菌和番茄灰霉菌的抑制活性
Table 1.
Antifungal activity of compounds 4a~4l against S. sclerotiorum and B. cinerea
表 1
目标化合物4a~4l对茄子菌核菌和番茄灰霉菌的抑制活性
Table 1.
Antifungal activity of compounds 4a~4l against S. sclerotiorum and B. cinerea

从表 1还可以看出, 化合物4b, 4e~4g对灰霉菌有较高的抑制活性, EC50值分别为3.09, 4.19, 3.28和4.23 µg/mL, 低于百菌清的EC50值(6.12 µg/mL), 表明其活性高于百菌清.此外, 化合物4g的EC50值为6.40 µg/mL, 与百菌清活性相当.从分子结构看, 苯胺基的苯环上没有取代基或取代基为氟或氯原子、肟醚键上R2为甲基或乙基时, 化合物的抑菌活性较高.但R2为苄基时, 活性降低很多.
2 结论
本文以3-乙酰吡啶、苯甲醛、取代苯胺、烷/苄氧基胺等为原料, 合成了一系列结构新颖的含吡啶环的肟醚类化合物.初步生物活性实验表明, 肟醚键上烃基为体积较小的甲基(或乙基)的目标化合物, 对茄子菌核菌和番茄灰霉菌的有良好的抑制活性, 其活性甚至高于对照药剂百菌清.为含吡啶结构的肟醚类化合物的合成及生物活性研究提供了非常有益的参考.
3 实验部分
3.1 仪器与试剂
北京泰克仪器有限公司X-5精密显微熔点测定仪(温度计未校正); 美国Nicolet380型傅里叶变换红外光谱仪(KBr压片或液膜法); 美国Mercury Plus-400型核磁共振仪(CDCl3为溶剂, TMS为内标); 德国Elementar公司Vario EL型元素分析仪; GXZ型智能光照培养箱.
试剂为市售分析纯或化学纯. DBU乳酸盐离子液体[DBU][Lac]参考文献[17]方法制备, 1-(3-吡啶基)-3-苯基-2-丙烯-1-丙酮(2)按照文献[18]的制备.
3.2 化合物合成
3.3 抑菌活性测试
采用菌丝生长速率法测定目标化合物的离体抑菌活性[19].以茄子菌核菌(S. sclerotiorum)和番茄灰霉菌(B. cinerea)为测试菌种.按培养基与药液体积比为9:1的比例制成含药培养基(马铃薯-葡萄糖-琼脂, PDA), 充分摇匀后迅速倒入灭菌的直径为9 cm的培养皿中.供试化合物溶解后制成四个浓度梯度的PDA含药平板, 并将其置于培养皿中固化.将真菌菌饼反接到含药平板中央, 置于(25±1) ℃的培养箱中培养, 灰霉菌培养72 h, 菌核菌培养36 h.每处理重复3次.同时加入等体积的无菌水的培养基为空白对照, 以杀菌剂百菌清为对照药剂, 用十字交叉法测量菌落直径, 每个菌落测量2次, 以其平均值代表菌落的大小, 按以下计算抑制率, 最后通过Data Processing System (DPS)分析软件求出药剂的毒力回归方程及EC50值.实验结果见表 1.
菌落扩散直径=菌落平均直径-菌饼直径
抑制率(%)=(对照菌落扩散直径-处理菌落扩散直径)/对照菌落扩散直径×100%.
辅助材料(Supporting Information) 中间体3a~3d和目标化合物4a~4l的1H NMR, 13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.2 目标化合物4的合成
2 mmol中间体3和2.5 mmol烷氧基胺盐酸盐或苄氧基胺盐酸盐, 置于25 mL圆底瓶中, 加入3 mL无水吡啶, 加热回流4~10 h, TLC监测反应历程.反应完毕后, 60 ℃下减压蒸馏出过量的吡啶, 加水, 用二氯甲烷萃取, 水洗三次, 无水硫酸钠干燥, 脱溶剂得粗产物.硅胶柱层析纯化[V(石油醚):V(乙酸乙酯)=10:1]分离, 得到目标化合物4a~4l.
O-甲基-1-(3-吡啶基)-3-苯基-3-苯胺基-1-丙酮肟醚(4a):白色固体, 产率87%. m.p. 81.7~82.6 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.89~3.04 (m, 1H), 3.50~3.56 (m, 1H), 4.10 (s, 3H), 4.61 (dd, J=5.2, 9.6 Hz, 1H), 4.73 (bs, 1H), 6.40~7.37 (m, 11H), 7.82~7.84 (m, 1H), 8.56~8.58 (m, 1H), 8.76 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.7, 150.2, 147.6, 147.0, 142.9, 133.7, 131.0, 129.1, 128.8, 127.5, 126.0, 123.3, 117.3, 113.2, 62.4, 56.4, 35.4; IR (KBr) v: 3404, 1600, 1046 cm-1. Anal. calcd for C21H21N3O: C 76.11, H 6.39, N 12.68; found C 76.37, H 6.48, N 12.62.
O-甲基-1-(3-吡啶基)-3-苯基-3-(4-氯苯胺基)-1-丙酮肟醚(4b):白色固体, 产率70%. m.p. 109.2~110.5 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.94~2098 (m, 1H), 3.48~3.54 (m, 1H), 4.10 (s, 3H), 4.56 (dd, J=5.2, 9.6 Hz, 1H), 4.78 (bs, 1H), 6.31~7.35 (m, 10H), 7.80~7.82 (m, 1H), 8.55~8.57 (m, 1H), 8.76 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.6, 150.2, 147.5, 145.4, 142.3, 133.6, 130.9, 128.9, 127.6, 125.9, 123.3, 121.9, 114.3, 62.4, 56.6, 35.3; IR (KBr) v: 3396, 1599, 1048 cm-1. Anal. calcd for C21H20ClN3O: C 68.94, H 5.51, N 11.49; found C 69.04, H 5.63, N 11.47.
O-甲基-1-(3-吡啶基)-3-苯基-3-(4-氟苯胺基)-1-丙酮肟醚(4c):黄绿色粘稠液体, 产率91%.nD20 1.5189; 1H NMR (400MHz, CDCl3) δ: 2.92~2.99 (m, 1H), 3.47~3.52 (m, 1H), 4.10 (s, 3H), 4.56 (dd, J=5.2, 9.6 Hz, 1H), 4.64 (bs, 1H), 6.31~7.35 (m, 10H), 7.79~7.82 (m, 1H), 8.55~8.57 (m, 1H), 8.76 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 156.8, 154.5, 153.7, 150.2, 147.5, 143.0, 142.7, 133.6, 131.0, 128.8, 127.6, 126.0, 123.3, 115.0, 113.0, 62.4, 57.0, 35.4; IR (KBr) v: 3405, 1601, 1047 cm-1. Anal. calcd for C21H20FN3O: C 72.19, H 5.77, N 12.03; found C 71.94, H 5.42, N 12.48.
O-甲基-1-(3-吡啶基)-3-苯基-3-(4-甲氧基苯胺基)-1-丙酮肟醚(4d):黄色粘稠液体, 产率87%.nD20 1.5145; 1H NMR (400 MHz, CDCl3) δ: 2.92~2.98 (m, 1H), 3.47~3.52 (m, 1H), 3.66 (s, 3H), 4.09 (s, 3H), 4.55 (dd, J=5.2, 9.2 Hz, 1H), 6.36~7.37 (m, 10H), 7.79~7.82 (m, 1H), 8.54~8.58 (m, 1H), 8.76 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.8, 151.9, 150.1, 147.5, 143.1, 141.2, 133.7, 131.1, 128.7, 127.4, 126.1, 123.2, 114.7, 114.4, 62.4, 57.1, 55.7, 35.5; IR (KBr) v: 3405, 1604, 1045 cm-1. Anal. calcd for C22H23N3O2: C 73.11, H 6.41, N 11.63; found C 73.50, H 6.37, N 11.44.
O-乙基-1-(3-吡啶基)-3-苯基-3-苯胺基-1-丙酮肟醚(4e):白色固体, 产率72%. m.p. 86.6~88.7 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.46 (t, J=6.8 Hz, 3H), 2.94~2.98 (m, 1H, CH2), 3.52~3.58 (m, 1H, CH2), 4.37 (q, J=6.0 Hz, 2H), 4.62 (dd, J=4.8, 9.2 Hz, 1H), 4.88 (bs, 1H), 6.40~7.39 (m, 11H), 7.82~7.84 (m, 1H), 8.54~8.56 (m, 1H), 8.75 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.2, 150.1, 147.5, 147.0, 143.0, 133.6, 131.2, 129.0, 128.8, 127.5, 126.0, 123.2, 117.2, 113.1, 70.4, 56.5, 35.4, 14.9; IR (KBr) v: 3401, 1598, 1049 cm-1. Anal. calcd for C22H23N3O: C 76.49, H 6.71, N 12.16; found C 76.42, H 6.75, N 12.06.
O-乙基-1-(3-吡啶基)-3-苯基-3-(4-氯苯胺基)-1-丙酮肟醚(4f):黄绿色粘稠液体, 产率86%. nD20 1.5218; 1H NMR (400 MHz, CDCl3) δ: 1.45 (t, J=6.8 Hz, 3H), 2.95~2.99 (m, 1H), 3.50~3.53 (m, 1H), 4.37 (q, J=5.6 Hz, 2H), 4.57 (dd, J=4.8, 9.2 Hz, 1H), 4.89 (bs, 1H), 6.31~7.35 (m, 10H), 7.81~7.83 (m, 1H), 8.54~8.56 (m, 1H), 8.76 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.1, 150.1, 147.5, 145.5, 142.4, 133.6, 131.0, 128.9, 127.6, 126.0, 123.1, 121.8, 114.2, 70.5, 56.7, 35.3, 14.9; IR (KBr) v: 3403, 1599, 1046 cm-1. Anal. calcd for C22H22ClN3O: C 69.56, H 5.84, N 11.06; found C 69.14, H 6.05, N 11.45.
O-乙基-1-(3-吡啶基)-3-苯基-3-(4-氟苯胺基)-1-丙酮肟醚(4g):黄绿色粘稠液体, 产率90%. nD20 1.5272; 1H NMR (400 MHz, CDCl3) δ: 1.44 (t, J=6.8 Hz, 3H), 2.94~2.99 (m, 1H), 3.49~3.54 (m, 1H), 4.36 (q, J=5.6 Hz), 4.56 (dd, J=5.2, 9.2 Hz, 1H, ), 4.71 (bs, 1H), 6.32~7.35 (m, 10H), 7.80~7.82 (m, 1H), 8.54~8.55 (m, 1H, ), 8.76 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 156.7, 154.4, 153.2, 150.0, 147.5, 143.0, 142.7, 133.6, 131.0, 128.8, 127.6, 126.0, 123.3, 115.0, 113.0, 70.0, 57.0, 35.4, 14.9; IR (KBr) v: 3405, 1601, 1046 cm-1. Anal. calcd for C22H22FN3O: C 72.71, H 6.10, N 11.56; found C 73.03, H 6.17, N 11.79.
O-乙基-1-(3-吡啶基)-3-苯基-3-(4-甲氧基苯胺基)-1-丙酮肟醚(4h):黄绿色粘稠液体, 产率85%.nD20 1.5201; 1H NMR (400 MHz, CDCl3) δ: 1.44 (t, J=6.8 Hz, 3H), 2.93~2.98 (m, 1H), 3.49~3.57 (m, 1H), 3.66 (s, 3H), 4.34 (q, J=6.8 Hz, 2H), 4.56 (dd, J=5.2, 8.8 Hz, 1H), 4.71 (bs, 1H), 6.37~7.38 (m, 10H), 7.80~7.83 (m, 1H), 8.54~8.55 (m, 1H), 8.76 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.3, 151.8, 150.0, 147.6, 143.2, 141.3, 133.6, 131.3, 128.7, 127.4, 126.1, 123.2, 114.7, 114.3, 70.4, 57.2, 55.7, 35.5, 14.9; IR (KBr) v: 3404, 1594, 1045 cm-1. Anal. calcd for C23H25N3O2: C 73.57, H 6.71, N 11.19; found C 73.18, H 6.84, N 11.03.
O-苄基-1-(3-吡啶基)-3-苯基-3-苯胺基-1-丙酮肟醚(4i):白色固体, 产率82%. m.p. 95.5~96.3 ℃; 1H NMR (400MHz, CDCl3) δ: 2.94~2.98 (m, 1H), 3.51~3.57 (m, 1H), 4.54 (dd, J=4.8, 9.2 Hz, 1H), 5.28~5.38 (m, 2H), 6.11~7.52 (m, 16H, ), 7.77~7.80 (m, 1H), 8.53~8.55 (m, 1H), 8.75 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.9, 150.1, 147.6, 146.8, 142.8, 137.7, 133.7, 131.0, 128.9, 128.8, 128.7, 128.7, 128.5, 128.0, 126.0, 123.2, 117.2, 113.3, 77.1, 56.3, 35.4; IR (kBr) v: 3404, 1601, 1009 cm-1. Anal. calcd for C27H25N3O: C 79.58, H 6.18, N 10.31; found C 79.65, H 6.15, N 10.16.
O-苄基-1-(3-吡啶基)-3-苯基-3-(4-氯苯胺基)-1-丙酮肟醚(4j):白色固体, 产率80%. m.p. 148.8~149.7 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.95~2.99 (m, 1H), 3.51~3.57 (m, 1H), 4.54 (dd, J=4.8, 9.6 Hz, 1H), 4.70 (bs, 1H), 5.29~5.38 (m, 2H), 6.07~7.52 (m, 15H), 7.78~7.80 (m, 1H), 8.54~8.56 (m, 1H), 8.75 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 153.8, 150.2, 147.5, 145.3, 142.3, 137.0, 133.6, 130.9, 128.8, 128.8, 128.8, 128.7, 128.5, 127.6, 126.0, 123.3, 121.8, 114.2, 77.0, 56.5, 35.3; IR (KBr) v: 3395, 1599, 1008 cm-1. Anal. calcd for C27H24ClN3O: C 73.38, H 5.47, N 9.51; found C 73.12, H 5.61; N 9.68.
O-苄基-1-(3-吡啶基)-3-苯基-3-(4-氟苯胺基)-1-丙酮肟醚(4k):白色固体, 产率82%. m.p. 108.4~109.2 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.94~2.98 (m, 1H), 3.51~3.57 (m, 1H), 4.54 (dd, J=5.2, 9.2 Hz, 1H), 4.70 (bs, 1H), 5.28~5.38 (m, 2H), 6.10~7.52 (m, 15H), 7.77~7.80 (m, 1H), 8.54~8.55 (m, 1H), 8.75 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: (156.8, 154.4), 153.9, 150.2, 147.6, 143.0, 142.6, 137.1, 133.7, 131.1, 128.8, 128.8, 128.7, 128.4, 127.6, 126.0, 123.2, 115.0, 113.0, 77.2, 56.9, 35.5; IR (KBr) v: 3400, 1604, 1007 cm-1. Anal. calcd for C27H24FN3O: C 76.21, H 5.69, N 9.88; found C 76.36, H 5.54, N 10.03.
O-苄基-1-(3-吡啶基)-3-苯基-3-(4-甲氧基苯胺基)-1-丙酮肟醚(4l):黄色粘稠液体, 产率87%.nD20 1.5325; 1H NMR (400 MHz, CDCl3) δ: 2.94~2.99 (m, 1H), 3.51~3.56 (m, 1H), 3.65 (s, 3H), 4.55 (dd, J=5.2, 8.8 Hz, 1H), 5.27~5.37 (m, 2H), 6.21~7.52 (m, 15H), 7.76~7.79 (m, 1H), 8.53~8.54 (m, 1H), 8.75 (d, J=2.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 154.0, 151.8, 150.0, 147.6, 143.0, 141.1, 137.2, 133.7, 131.2, 128.7, 128.7, 128.7, 128.3, 127.4, 126.1, 123.2, 114.6, 114.3, 77.1, 57.0, 55.7, 35.6; IR (KBr) v: 3407, 1601, 1012 cm-1. Anal. calcd for C28H27FN3O2: C 76.86, H 6.22, N 9.60; found C 77.12, H 6.05, N 9.81.
3.2.1 中间体3的合成
0.64 g (3.0 mmol) 1-(3-吡啶基)-3-苯基-2-丙烯-1-酮和3.6 mmol取代苯胺置于25 mL烧瓶, 加入0.5~1 mL二氯甲烷, 微热使其溶解, 再加入0.12 g (0.4 mmol)离子液体[DBU][Lac], 室温下搅拌, 反应液很快变粘稠, 搅拌0.5~1 h后放置过夜.分三次用少量乙酸乙酯洗涤固体, 以除去过量的苯胺和离子液体, 得到的白色固体即为1-(3-吡啶基)-3-苯基-3-取代苯胺基-1-丙酮(3).
1-(3-吡啶基)-3-苯基-3-苯胺基-1-丙酮(3a):白色固体, 产率84%. m.p. 131.4~132.2 ℃; 1H NMR (400 MHz, CDCl3) δ: 3.47~3.50 (m, 2H), 4.51 (bs, 1H), 5.0 (t, J=12.4 Hz, 1H), 6.56~7.44 (m, 11H), 8.14~8.16 (m, 1H), 8.75~8.76 (m, 1H), 9.09 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 197.2, 153.7, 149.6, 146.7, 142.4, 135.5, 131.9, 129.2, 128.9, 127.6, 126.3, 123.7, 117.9, 113.7, 54.5, 46.4; IR (KBr) ν: 3383, 2916, 2868, 1675 cm-1. Anal. calcd for C20H18N2O: C 79.44, H 6.00, N 9.26; found C 79.23, H 6.22, N 8.97.
1-(3-吡啶基)-3-苯基-3-(4-氯苯胺基)-1-丙酮(3b):白色固体, 产率85%. m.p. 153.4~155.3 ℃; 1H NMR (400 MHz, CDCl3) δ: 3.46~3.48 (m, 2H), 4.57 (bs, 1H), 4.97 (t, J=12.8 Hz, 1H), 6.47~7.40 (m, 10H), 8.12~8.15 (m, 1H), 8.75~8.77 (m, 1H), 9.08 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 196.8, 153.6, 149.7, 146.9, 143.6, 135.7, 132.3, 128.7, 127.2, 126.9, 123.9, 119.9, 114.5, 53.3, 47.0; IR (KBr) ν: 3385, 2915, 2871, 1677 cm-1. Anal. calcd for C20H17ClN2O: C 71.32, H 5.09, N 8.32; found C 71.45, H 5.10, N 8.30.
1-(3-吡啶基)-3-苯基-3-(4-氟苯胺基)-1-丙酮(3c):白色固体, 产率89%. m.p. 145.3~146.9 ℃; 1H NMR (400 MHz, CDCl3) δ: 3.45~3.47 (m, 2H), 4.42 (bs, 1H), 4.96 (t, J=12.8 Hz, 1H), 6.48~7.41 (m, 10H), 8.13~8.16 (m, 1H), 8.76~8.77 (m, 1H), 9.09 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 197.0, 155.9, 153.6, 149.7, 143.9, 135.7, 132.4, 128.7, 127.2, 126.9, 124.0, 119.9, 115.3, 114.0, 53.8, 47.1; IR (KBr) ν: 3384, 2914, 2870, 1676 cm-1. Anal. calcd for C20H17FN2O: C 74.98, H 5.35, N 8.74; found C 74.82, H 5.37, N 8.69.
1-(3-吡啶基)-3-苯基-3-(4-甲氧基苯胺基)-1-丙酮(3d):黄绿色固体, 产率81%. m.p. 126.2~127.5 ℃; 1H NMR (400 MHz, CDCl3) δ: 3.45~3.47 (m, 2H), 3.68 (s, 3H), 4.95 (t, J=12.8 Hz, 1H), 6.52~7.43 (m, 10H), 8.14~8.16 (m, 1H), 8.75~8.77 (m, 1H), 9.10 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 197.3, 153.7, 152.4, 149.6, 142.6, 140.8, 135.5, 131.9, 128.9, 127.5, 126.4, 123.7, 115.4, 114.7, 55.7, 55.5, 46.6; IR (KBr) ν: 3372, 2900, 2832, 1672 cm-1. Anal. calcd for C21H20N2O2: C 75.88, H 6.06, N 8.43; found C 76.05, H 6.03, N 8.54.
-
-
[1]
Alexander, F. P.; Anatoly, T. S.; Alan, R. K. Heterocycles in Life and Society, Wiley, New York, 2011, pp. 209~246.
-
[2]
Lee, E. S.; Kwon, Y. J.; Karki, R.; Jun, K.Y.; Kadayat, T. M.; Bist, G. Eur. J. Med. Chem. 2016, 113, 228. doi: 10.1016/j.ejmech.2016.02.050
-
[3]
Demirci, F.; Khan, S.; Kaplancikli, Z. A. Eur. J. Med. Chem. 2010, 45, 2080. doi: 10.1016/j.ejmech.2009.12.023
-
[4]
Etify, A.; Mohamed, E. A.; Aly, A.; Shaban, A. A. J. Agric. Food. Chem. 2014, 62, 9982 doi: 10.1021/jf503992y
-
[5]
Pae, A.N.; Baek, D. J.; Keum, G.; Nam, M.; Kim, T. H.; Seo, S. H.; Min, S. J. Eur. J. Med. Chem. 2015, 97, 245. doi: 10.1016/j.ejmech.2015.04.060
-
[6]
Wang, H.-S; Liu, L.-X.; Qu, H.-E.; Huang, R.-Z.; Yao, G.-Y. Eur. J. Med. Chem. 2015, 95, 400. doi: 10.1016/j.ejmech.2015.03.058
-
[7]
陈玉, 王忠波, 张贤, 夏丽娟, 龚华玉, 赵洪菊, 薛伟, 有机化学, 2014, 34, 1662. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344424.shtmlChen, Y.; Wang, Z.-B.; Zhang, X.; Xia, L.-J.; Gong, H.-Y.; Zhao, H.-J.; Xue, W. Chin. J. Org. Chem. 2014, 34, 1662 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344424.shtml
-
[8]
戴红, 黄菊华, 金智超, 成晓燕, 黄凯薇, 凌勇, 汪清民, 石玉军, 有机化学, 2015, 35, 2617. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345233.shtmlDai, H.; Huang, J.-H.; Jin, Z.-C.; Cheng, X.-Y.; Huang, K.-W.; Ling, Y.; Wang, Q.-M.; Shi, Y.-J. Chin. J. Org. Chem. 2015, 35, 2617 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345233.shtml
-
[9]
Zhou, S.-F.; Li, F.-B.; Zhang, P.-Z.; Jiang, L. Res. Chem. Intermed. 2013, 39, 1735. doi: 10.1007/s11164-012-0708-5
-
[10]
Wang, Q.-M.; Sun, R.-F.; Li, Y.-Q.; Xiong, L.-X. Bioorg. Med. Chem. Lett. 2010, 20, 4693. doi: 10.1016/j.bmcl.2010.04.144
-
[11]
张亦冰, 世界农药, 2013, 35, 61. doi: 10.3969/j.issn.1009-6485.2013.02.013Zhang, Y.-B. World Pestic. 2013, 35, 61 (in Chinese). doi: 10.3969/j.issn.1009-6485.2013.02.013
-
[12]
Liu, A.; Wang, X.; Chen, C.; Pei, H.; Mao, C.; Wang, Y.; He, H.; Huang, L.; Liu, X.; Hu, Z.; Ou, X.; Huang, M.; Yao, J. Pest. Mannge. Sci. 2009, 65, 229. doi: 10.1002/ps.v65:3
-
[13]
王美岩, 曲智强, 杜丹, 姜林, 有机化学, 2013, 33, 1005. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341891.shtmlWang, M.-Y.; Qu, Z.-Q.; Du, D. Jiang, L. Chin. J. Org. Chem. 2013, 33, 1005 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341891.shtml
-
[14]
Zahouily, M; Mounir, B.; Cherki, H.; Bahlaouan, B.; Rayadh, A.; Sebti, S. Phosphorus, Sulfur Silicon Relat. Elem. 2007, 182, 1203. doi: 10.1080/10426500601160397
-
[15]
应安国, 郑人华, 武承林, 梁华定, 葛昌华, 蒋华江, 有机化学, 2011, 31, 1312. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340295.shtmlYing, A.-G.; Zheng, R.-H.; Wu, C.-L.; Liang, H.-D.; Ge, C.-H.; Jiang, H.-D. Chin. J. Org. Chem. 2011, 31, 1312 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340295.shtml
-
[16]
赵瑶星, 孙祥玉, 有机分子结构光谱鉴定, 科学出版社, 北京, 2003, p. 162.Zhao, Y.-X.; Sun, Y.-X. Spectral Identification for Organic Molecules, Science Press, Beijing, 2003, p. 162 (in Chinese).
-
[17]
应安国, 博士论文, 浙江大学, 杭州, 2010.Ying, A.-G. Ph.D. Dissertation, Zhejiang University, Hangzhou, 2010 (in Chinese).
-
[18]
Zakharychev, V. V.; Kuzenkov, A. V. Chem. Heterocycl. Compd. 2007, 43, 989. doi: 10.1007/s10593-007-0154-2
-
[19]
Li, X.-H.; Ji, M.-S.; Qi, Z.-Q.; Li, X.-W.; Shen, Y.-X.; Zhang, Y.; Wei, S.-H.; Wang, Y.-Z.; Wang, D.-Q. Pest Manage. Sci. 2011, 67, 986. doi: 10.1002/ps.v67.8
-
[1]
-
表 1 目标化合物4a~4l对茄子菌核菌和番茄灰霉菌的抑制活性
Table 1. Antifungal activity of compounds 4a~4l against S. sclerotiorum and B. cinerea

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1634
- HTML全文浏览量: 240


 下载:
下载:
 下载:
下载:

