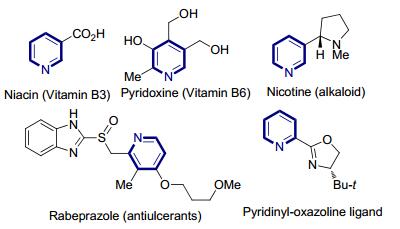
 图 1
包含吡啶单元的代表性化合物
Figure 1.
Representative compounds containing pyridine-motif
图 1
包含吡啶单元的代表性化合物
Figure 1.
Representative compounds containing pyridine-motif

Citation: Zhao Yuying, Wang Erbing, Wang Yingli. Iodine-Promoted Three-Component Reaction of β-Keto Esters, Chalcones and Ammonium Acetate for the Synthesis of Poly-substituted Pyridines[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 866-872. doi: 10.6023/cjoc201701006

单质碘促进的β-酮酸酯、查尔酮以及醋酸铵的三组分反应合成多取代吡啶
English
Iodine-Promoted Three-Component Reaction of β-Keto Esters, Chalcones and Ammonium Acetate for the Synthesis of Poly-substituted Pyridines
-
Key words:
- molecular iodine
- / muti-component reaction
- / pyridine
-
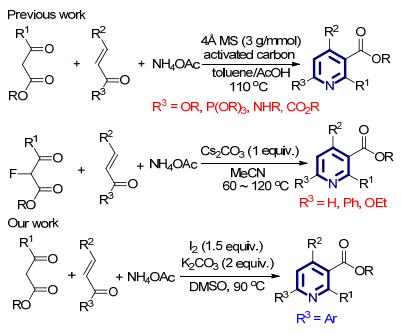
吡啶是一类广泛分布于自然界的杂环结构, 并且在药物化学、合成化学以及材料化学中都有重要的应用 (图 1).例如, 含吡啶结构的维生素B3(烟酸) 和维生素B6(吡哆素) 是人和动物所必须的维生素, 是多种辅酶的重要组成部分, 用于参与体内的重要代谢活动; 烟酰胺腺嘌呤二核苷酸磷酸 (NADP) 也是生物体内一类重要的含吡啶结构的辅酶, 在呼吸作用中参与氧化还原过程提供能量.除此之外, 在已上市的畅销药物 (如吡格列酮、雷贝拉唑、伊马替尼等)[1a], pH值荧光指示材料[1b]以及手型多齿配体[1c]中, 均可发现多取代吡啶的结构.因此, 化学家们发展了多种多样的方法学用以简便高效地构建多取代吡啶[2], 例如一些经典的人名反应如Hantzsch合成反应[3]、Chichibabin合成反应[4]、Kröhnke合成反应[5]等在合成化学中有着广泛的应用.在这些方法中, 以醋酸铵为氮源, 并直接使用β-酮酸酯与烯酮完成缩合、环化及芳香化过程是一类重要的多取代吡啶的合成方法, 近些年来受到了人们的广泛关注.例如Rodriguez小组使用α, β-烯酸酯 (酰胺)、β-酮酸酯以及醋酸铵为底物, 在4Å分子筛的作用下可以通过一锅法得到多种多样的多取代吡啶化合物[6a~6c](Scheme 1), 并且能够在吡啶产物中引入其他杂环结构[6d].然而在这类方法中通常分子筛的用量较大 (每毫摩尔底物使用3克4Å分子筛), 而且Michael受体仅仅局限于α, β-不饱和烯酸的衍生物, 对于查尔酮这种廉价易得的烯酮底物未曾涉及; 2016年, 易文斌研究小组[7]报道了一种使用α-氟代的β-酮酸酯与多种α, β-不饱和羰基化合物 (肉桂醛、肉桂酸酯和查尔酮) 以及醋酸铵的三组分反应, 可得到多种不同取代位点的吡啶结构 (Scheme 1).底物β-酮酸酯中的氟原子不但增强了其Michael加成的活性, 同时可以通过脱除HF完成二氢吡啶到吡啶的转化.尽管该转化适用范围广, 然而反应通常需要首先对酮酸酯底物进行α-位氟化, 这无疑增加了反应的成本; 而后期氟原子又以HF副产物的形式离去, 也不能满足合成化学中原子经济性的要求.
单质碘作为一类结构简单、廉价易得、对环境友好的氧化剂, 近些年来对其反应性的开发吸引了人们的广泛关注[8].特别值得一提的是, 通过与极性溶剂二甲基亚砜 (DMSO) 的组合, 单质碘可以合成多种多样的杂环化合物, 例如噁唑[9a]、噁二唑[9b]、喹唑酮[9c]以及喹啉[9d]等结构的构建.作为我们对单质碘氧化反应研究的继续[10], 本文报道一例以二甲基亚砜为溶剂, 单质碘促进的β-酮酸酯、查尔酮与醋酸铵的三组分反应合成多取代吡啶 (Scheme 1).
1 结果与讨论
1.1 反应条件优化
我们以苯甲酰乙酸乙酯 (1a)、查尔酮 (2a) 和醋酸铵为底物, 对多取代吡啶的合成条件进行了探索和优化 (表 1).在最初的实验中, 我们参考易文斌小组报道的实验条件, 尝试只使用碱促进该三组分反应, 然而并没有检测到吡啶产物的产生 (表 1, Entry 1).同时, 通过另外一个控制实验发现, 仅仅使用单质碘为促进剂也没有检测到目标产品 (表 1, Entry 2).当同时使用1 equiv.的单质碘和2 equiv.的碳酸钾时, 吡啶产物3a的收率可以得到67%(表 1, Entry 3).提高单质碘的用量至1.5 equiv.时, 可以以82%的收率得到3a(表 1, Entry 4);进一步提高单质碘的用量, 3a的收率不再有提高 (表 1, Entry 5).为了考察溶剂中的水对反应的影响, 使用4Å分子筛干燥过的DMSO进行该反应, 3a的收率几乎没有变化 (表 1, Entry 6).此外, 在无溶剂条件下该反应也能够顺利进行, 能够以相同的收率得到产物3a(表 1, Entry 7).紧接着, 我们对反应所需要的碱试剂进行了筛选:使用常见的无机碱碳酸铯 (Cs2CO3) 或者碳酸钠 (Na2CO3), 反应收率均有所降低 (表 1, Entries 8, 9);当使用有机碱三乙胺时, 没有检测到任何产品产生 (表 1, Entry 10).此外, 我们还对不同的反应溶剂进行了测试:使用极性非质子性溶剂N, N-二甲基甲酰胺 (DMF)(表 1, Entries 11, 12) 以及N-甲基吡咯烷酮 (NMP) 反应均可顺利发生, 然而目标产物3a的收率有所降低; 而在质子性溶剂乙醇 (EtOH) 中, 反应仅能得到少量的1a和2a的Michael加成产物, 却几乎检测不到3a的产生 (Entry 14);对于其他常见的高沸点溶剂, 如1, 2-二氯乙烷 (DCE)、甲苯, 反应效果均不如在DMSO中好.我们还发现, 反应温度对该转化的影响较大, 室温下进行该反应, 吡啶产物3a的收率仅有21%(表 1, Entry 17).因此, 我们最终选用的最佳条件为:单质碘1.5 equiv., 碳酸钾2.0 equiv., 二甲基亚砜为溶剂, 90 ℃条件下反应10 h, 吡啶3a的收率为82%(表 1, Entry 4).

Entry Iodine/equiv. Base (2.0 equiv.) Solvent Yieldb/% 1 — K2CO3 DMSO 0 2 1.0 — DMSO 0 3 1.0 K2CO3 DMSO 67 4 1.5 K2CO3 DMSO 82 5 2.0 K2CO3 DMSO 82 6c 1.5 K2CO3 DMSO 81 7d 1.5 K2CO3 — 82 8 1.5 Cs2CO3 DMSO 77 9 1.5 Na2CO3 DMSO 72 10 1.5 Et3N DMSO 0 11 1.5 K2CO3 DMF 75 12c 1.5 K2CO3 DMF 75 13 1.5 K2CO3 NMP 52 14 1.5 K2CO3 EtOH Trace 15 1.5 K2CO3 DCE 44 16 1.5 K2CO3 Toluene 71 17e 1.5 K2CO3 DMSO 21 a Reaction conditions: 0.2 mmol of 1a, 0.24 mmol of 2a, 0.6 mmol of NH4OAc, iodine, and base in 2 mL of solvent at 90 ℃ for 8~10 h. b Isolated yield. c The solvent was dried by 4Å molecular sieves. d The reaction was run under neat conditions. e The reaction was run at room temperature for 24 h. 表 1 反应条件优化
Table 1. Optimization of reaction conditions1.2 底物普适性考察
在得到了最佳的反应条件后, 我们开始对该三组分合成吡啶的反应进行底物拓展, 分别考察了查尔酮羰基侧的取代基 (R1)、烯基侧的取代基 (R2) 以及具有不同结构的酮酸酯 (R3).反应结果如表 2所示.对于查尔酮羰基侧的取代基, 具有供电子基团的底物反应效果较好 (表 2, Entries 2, 3);吸电子基团在该反应中也具有较好的容忍度 (表 2, Entries 4~6), 甚至在羰基一侧引入强吸电子能力的硝基 (NO2), 目标产物的收率仍可以达到74%(表 2, Entry 7);而且, 即使羰基侧引入其他芳香体系, 反应仍能顺利发生, 相应吡啶产物的收率也较为良好 (表 2, Entries 7, 8);此外, 当R1为甲基时, 反应效果较差, 产品3h的收率仅有36%(表 2, Entry 9), 这可能是烷基对烯胺中间体的稳定性较差造成的.类似的, 在查尔酮的烯基侧我们也做了各种取代基的变换, 发现无论是吸电子基团还是供电子基, 对该转化的影响不大, 吡啶产物的收率均较为良好 (表 2, Entries 10~14);值得一提的是, 对于含有吡啶基的查尔酮, 该三组分反应可以得到具有双吡啶结构的产品, 收率可以达到72%(表 2, Entry 15).接下来, 我们以标准查尔酮1a为底物, 考察了具有不同取代的酮酸酯2对该反应的影响.结果表明, 具有吸电子基团的芳香酮酸酯在该体系中的效果较好 (表 2, Entry 16), 而使用具有供电子基团的芳香酮酸酯以及乙酰乙酸乙酯为底物, 吡啶产物的收率仅为中等 (表 2, Entries 17, 18).除此之外, 我们还尝试使用肉桂醛为底物合成6位没有取代基的吡啶3q, 然而使用标准条件没有得到相应的吡啶结构 (表 2, Entry 19).

Entry R1 R2 R3 Product Yieldb/% 1 C6H5 C6H5 C6H5 3a 82 2 4-MeC6H4 C6H5 C6H5 3b 83 3 2-MeC6H4 C6H5 C6H5 3c 77 4 4-ClC6H4 C6H5 C6H5 3d 72 5 4-BrC6H4 C6H5 C6H5 3e 74 6 4-NO2C6H4 C6H5 C6H5 3f 71 7 2-Naphthyl C6H5 C6H5 3g 63 8 2-Furyl C6H5 C6H5 3h 67 9 Me C6H5 C6H5 3i 36 10 C6H5 4-MeC6H4 C6H5 3g 71 11 C6H5 4-BrC6H4 C6H5 3k 62 12 C6H5 4-ClC6H4 C6H5 3l 77 13 C6H5 4-MeOC6H4 C6H5 3m 75 14 C6H5 3-MeOC6H4 C6H5 3n 70 15 C6H5 4-Pyridinyl C6H5 3o 72 16 C6H5 C6H5 4-BrC6H4 3p 70 17 C6H5 C6H5 4-MeOC6H4 3q 54 18 C6H5 C6H5 Me 3r 63 19 H C6H5 C6H5 3s 0 a Reaction conditions: 0.2 mmol of 1, 0.24 mmol of 2, 0.6 mmol of NH4OAc, 0.3 mmol of iodine, 0.4 mmol of K2CO3, in 2 mL of DMSO, at 90 ℃ for 8~ 12 h. b Isolated yield. 表 2 三组分反应合成多取代吡啶
Table 2. Three-component reaction for the synthesis of polysubstituted pyridines而且值得一提的是, 使用上述反应得到的2, 4, 6-三苯基-2-吡啶甲酸乙酯 (3a) 为原料, 可以在碱性条件下水解脱羧得到2, 4, 6-三苯基吡啶 (4a, Eq. 1).因此, 我们目前发展的方法不但能合成2, 3, 4, 6-四取代吡啶, 同时为2, 4, 6-三取代吡啶的合成提供了一种潜在的实用方法.
1.3 反应机理推测
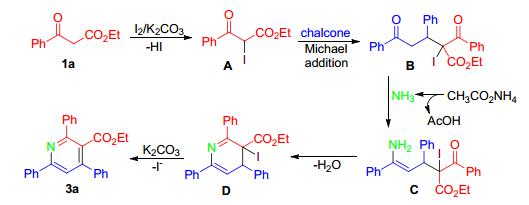
尽管目前对确切的反应机理尚不清楚, 但我们在反应中检测到了酮酸酯碘代产物A的生成, 并验证了使用中间体A在没有单质碘的存在下可以转化到吡啶产物3a[11].因此, 结合他人的相关研究报道[6, 7], 我们为该多取代吡啶的合成方法推测了一种可能的反应机理 (Scheme 2):首先在单质碘和碳酸钾的存在下, 苯甲酰乙酸乙酯首先发生碘化作用生成中间体A, 由于其α位活性高于原料1a, 因此可以进一步发生Michael加成反应形成中间体B.之后, 中间体B与体系中醋酸铵释放出来的氨分子反应形成烯胺中间体C, 并进一步发生分子内缩合形成二氢吡啶D.在碳酸钾的作用下, 碘代二氢吡啶D消除碘化氢得到最终的产物3a.
2 结论
发展了一种使用单质碘为促进剂, 以酮酸酯、查尔酮以及醋酸铵为原料合成多取代吡啶的的方法.该反应适用于多种查尔酮以及酮酸酯底物, 具有较好的官能团适用性.此外, 使用所得到的四取代吡啶产物3a, 可以通过简单的水解反应得到2, 4, 6-三苯基吡啶.因此, 本方法的建立为多种多取代吡啶的合成提供了一种简单实用的新思路.
3 实验部分
3.1 仪器与试剂
1H NMR (400 MHz) 和13C NMR (100 MHz) 采用Bruker AVANCE Ⅲ NMR核磁共振仪测定, 所用溶剂为CDCl3(内含内标物TMS), 核磁校正以CDCl3为内标; 熔点测定仪使用巩义予华仪器有限责任公司生产的XT-5型熔点测定仪; 未知化合物的高分辨数据采用micrOTOF-Q Ⅱ仪器配合ESI源测定, 已知化合物的物理数据和核磁数据氢谱均经与已知文献比对确认.实验所用试剂均为分析纯试剂, 从阿拉丁试剂公司购买; 柱层析使用200~300目硅胶, 洗脱剂为石油醚 (沸程为60~90 ℃) 和乙酸乙酯.
3.2 多取代吡啶3的合成方法
以3a合成为例.在10 mL圆底烧瓶中将查尔酮 (0.2 mmol, 42 mg)、苯甲酰乙酸乙酯 (0.24 mmol, 46 mg) 及醋酸铵 (0.6 mmol, 46 mg) 溶解于1 mL的二甲基亚砜溶剂, 室温搅拌下向混合液中加入单质碘 (0.3 mmol, 76 mg) 以及碳酸钾 (0.4 mmol, 55 mg), 并升温至90 ℃继续搅拌10 h, 用薄层色谱 (TLC) 板检测反应进度.原料消耗完毕, 将混合液降至室温, 加入30 mL乙酸乙酯稀释反应, 将有机相用蒸馏水洗涤3~5次, 并加入无水硫酸钠干燥.过滤除去干燥剂, 将有机相浓缩, 浓缩液用柱层析进行分离[洗脱剂: V(石油醚):V(乙酸乙酯)=10:1]得到2, 4, 6-三苯基3-吡啶甲酸乙酯 (3a), 收率82%, 时间10 h.白色固体, m.p. 79~81 ℃(文献值[12]: 76~77 ℃); Rf=0.41 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 600 MHz) δ: 8.15~8.12 (m, 2H), 7.77~7.74 (m, 2H), 7.73 (s, 1H), 7.51~7.43 (m, 11H), 3.98 (q, J=7.2 Hz, 2H), 0.89 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 150 MHz) δ: 168.7, 157.2, 156.7, 149.6, 140.1, 138.62, 138.56, 129.5, 128.75, 128.72, 128.67, 128.6, 128.5, 128.2, 128.1, 127.3, 126.9, 119.4, 61.3, 13.4.
2, 4-二苯基-6-对甲苯基-3-吡啶甲酸乙酯 (3b):收率83%, 时间12 h.白色固体, m.p. 77~79 ℃; Rf=0.41 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.05 (d, J=8.0 Hz, 2H), 7.75 (d, J=6.4 Hz, 2H), 7.70 (s, 1H), 7.52~7.41 (m, 8H), 7.30 (d, J=7.6 Hz, 2H), 3.98 (q, J=7.2 Hz, 2H), 2.42 (s, 3H), 0.89 (q, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.8, 157.2, 156.5, 149.5, 140.1, 139.6, 138.7, 135.7, 129.5, 128.7, 128.6, 128.5, 128.2, 128.1, 127.1, 126.5, 119.0, 61.3, 21.3, 13.4; HRMS (ESI) calcd for C27H24NO2 [M + H]+ 394.1802, found 394.1800.
2, 4-二苯基-6-邻甲苯基-3-吡啶甲酸乙酯 (3c):收率77%, 时间12 h.白色固体, m.p. 82~85 ℃; Rf=0.40 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 7.71 (dd, J=8.0, 2.4 Hz, 2H), 7.53~7.40 (m, 10H), 7.35~7.27 (m, 3H), 4.01 (q, J=7.2 Hz, 2H), 2.51 (s, 3H), 0.91 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.7, 160.2, 156.2, 148.9, 139.8, 139.6, 138.3, 136.1, 130.9, 129.8, 128.7, 128.7, 128.6, 128.6, 128.3, 128.1, 126.3, 126.0, 123.0, 61.4, 20.6, 13.5; HRMS (ESI) calcd for C27H24NO2 [M+H]+ 394.1802, found 394.1796.
2, 4-二苯基-6-对氯苯基-3-吡啶甲酸乙酯 (3d):收率72%, 时间10 h, 无色液体. Rf=0.45 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.09 (d, J=8.4 Hz, 2H), 7.75~7.71 (m, 2H), 7.69 (s, 1H), 7.51~ 7.41 (m, 10H), 3.98 (q, J=7.2 Hz, 2H), 0.89 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.5, 156.7, 155.9, 149.8, 139.8, 138.4, 136.9, 135.7, 129.0, 128.9, 128.7, 128.6, 128.5, 128.3, 128.0, 127.1, 119.1, 61.4, 13.4; HRMS (ESI) calcd for C26H21ClNO2 [M+H]+ 414.1255, found 414.1262.
2, 4-二苯基-6-对溴苯基-3-吡啶甲酸乙酯 (3e):收率74%, 时间11 h.白色固体, m.p. 54~56 ℃; Rf=0.45 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.02 (d, J=8.4 Hz, 2H), 7.76~7.71 (m, 2H), 7.70 (s, 1H), 7.61 (d, J=8.4 Hz, 2H), 7.52~7.41 (m, 8H), 3.98 (q, J=7.2 Hz, 2H), 0.89 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.5, 156.8, 155.9, 149.7, 139.8, 138.3, 137.3, 131.9, 128.9, 128.8, 128.7, 128.58, 128.57, 128.3, 128.0, 127.1, 124.1, 119.1, 61.4, 13.4; HRMS (ESI) calcd for C26H21BrNO2 [M + H]+ 460.0731, found 460.0729.
2, 4-二苯基-6-对硝基苯基-3-吡啶甲酸乙酯 (3f):收率71%, 时间7 h.白色固体, m.p. 151~153 ℃; Rf= 0.15 [V(石油醚) : V(乙酸乙酯) = 9 : 1]; 1H NMR (CDCl3, 400 MHz) δ: 8.36~8.30 (m, 4H), 7.80 (s, 1H), 7.76~7.72 (m, 2H), 7.51~7.45 (m, 8H), 4.00 (q, J=7.2 Hz, 2H), 0.90 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.2, 157.1, 154.5, 150.0, 148.4, 144.3, 139.4, 138.0, 129.1, 128.9, 128.7, 128.5, 128.4, 128.1, 128.03, 128.00, 124.0, 120.1, 61.6, 13.4; HRMS (ESI) calcd for C26H21N2O4 [M+H]+ 425.1496, found 425.1495.
2, 4-二苯基-6-(2-萘基)-3-吡啶甲酸乙酯 (3g):收率63%, 时间11 h.白色固体, m.p. 109~111 ℃; Rf=0.43 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.63 (s, 1H), 8.30 (d, J=8.0 Hz, 1H), 7.98~ 7.93 (m, 2H), 7.90~7.85 (m, 2H), 7.82~7.76 (m, 2H), 7.56~7.42 (m, 10H), 4.00 (q, J=7.2 Hz, 2H), 0.90 (t, J= 7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz): δ 168.7, 157.0, 156.8, 149.6, 140.0, 138.6, 135.8, 133.9, 133.4, 128.81, 128.79, 128.7, 128.62, 128.57, 128.5, 128.3, 128.1, 127.7, 126.9, 126.84, 126.76, 126.3, 124.7, 119.6, 61.4, 13.5; HRMS (ESI) calcd for C30H24NO2 [M+H]+ 430.1802, found 430.1805.
2, 4-二苯基-6-(2-呋喃基)-3-吡啶甲酸乙酯 (3h):收率67%, 时间9 h.黄色固体, m.p. 92~94 ℃; Rf=0.16 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 7.71~7.76 (m, 3H), 7.57~7.54 (m, 1H), 7.49~7.41 (m, 8H), 7.24 (d, J=3.2 Hz, 1H), 6.57~6.54 (m, 1H), 3.95 (q, J=7.2 Hz, 2H), 0.88 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.5, 156.9, 153.1, 149.6, 149.1, 143.9, 139.6, 138.3, 128.8, 128.65, 128.59, 128.54, 128.3, 128.0, 126.5, 117.4, 112.3, 110.4, 61.4, 13.4; HRMS (ESI) calcd for C24H20NO3 [M+H]+ 370.1438, found 370.1426.
2, 4-二苯基-6-甲基-3-吡啶甲酸乙酯 (3i):收率36%, 时间10 h.白色固体, m.p. 88~90 ℃; Rf=0.19 [V(石油醚):V(乙酸乙酯)=90:10]; 1H NMR (CDCl3, 400 MHz) δ: 7.64~7.58 (m, 2H), 7.47~7.38 (m, 8H), 7.71 (s, 1H), 3.93 (q, J=7.2 Hz, 2H), 2.68 (s, 3H), 0.85 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.6, 158.8, 156.4, 149.0, 139.6, 138.3, 128.7, 128.54, 128.49, 128.4, 128.3, 128.0, 126.0, 122.4, 61.3, 24.5, 13.4; HRMS (ESI) calcd for C21H20NO2 [M+H]+ 318.1489, found 318.1487.
2, 6-二苯基-4-对甲苯基-3-吡啶甲酸乙酯 (3j):收率71%, 时间9 h.白色固体, m.p. 64~66 ℃; Rf=0.54 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.13 (d, J=8.0 H, 2H z), 7.77~7.72 (m, 2H), 7.71 (s, 1H), 7.51~7.42 (m, 6H), 7.38 (d, J=8.0 Hz, 2H), 7.29~7.26 (m, 2H), 3.99 (q, J=7.2 Hz, 2H), 2.42 (s, 3H), 0.91 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.8, 157.2, 156.6, 149.5, 140.1, 138.60, 138.57, 135.6, 129.4, 129.3, 128.73, 128.67, 128.6, 128.2, 128.0, 127.2, 126.8, 119.4, 61.3, 21.3, 13.5; HRMS (ESI) calcd for C27H24NO2 [M+H]+ 394.1802, found 394.1802.
2, 6-二苯基-4-对溴苯基-3-吡啶甲酸乙酯 (3k):收率62%, 时间8 h.白色固体, m.p. 93~95 ℃; Rf=0.50 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 600 MHz) δ: 8.14~8.10 (m, 2H), 7.75~7.71 (m, 2H), 7.67 (s, 1H), 7.62~7.58 (m, 2H), 7.50~7.42 (m, 6H), 7.37~7.34 (m, 2H), 3.99 (q, J=7.2 Hz, 2H, ), 0.92 (t, J= 7.2 Hz, 3H); 13C NMR (CDCl3, 150 MHz) δ: 168.5, 157.4, 156.9, 148.4, 140.0, 138.4, 137.5, 131.8, 129.8, 129.6, 128.83, 128.80, 128.7, 128.3, 127.3, 126.6, 123.1, 119.0, 61.5, 13.5; HRMS (ESI) calcd for C26H21BrNO2 [M+H]+ 460.0731, found 460.0732.
2, 6-二苯基-4-对氯苯基-3-吡啶甲酸乙酯 (3l):收率77%, 时间11 h.白色固体, m.p. 94~96 ℃(文献值[13]: 97~99 ℃); Rf=0.47 [V(石油醚):V(乙酸乙酯)=95: 5]; 1H NMR (CDCl3, 600 MHz) δ: 8.14~8.10 (m, 2H), 7.76~7.72 (m, 2H), 7.68 (s, 1H), 7.51~7.40 (m, 10H), 3.99 (q, J=7.2 Hz, 2H), 0.92 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.5, 157.4, 156.8, 148.3, 139.9, 138.3, 136.9, 134.9, 129.6, 129.5, 128.83, 128.80, 128.6, 128.3, 127.2, 126.6, 125.1, 119.1, 61.5, 13.5.
2, 6-二苯基-4-对甲氧基苯基-3-吡啶甲酸乙酯 (3m):收率75%, 时间11 h.白色固体, m.p. 148~150 ℃(文献值[13]: 140~141 ℃); Rf=0.43 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.04 (d, J= 8.0 Hz, 2H), 7.77~7.72 (m, 2H), 7.70 (s, 1H), 7.50~7.41 (m, 8H), 7.29 (d, J=8.0 Hz, 2H), 3.98 (q, J=7.2 Hz, 2H), 2.42 (s, 3H), 0.89 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.8, 157.2, 156.6, 149.5, 140.1, 139.6, 138.7, 135.7, 129.5, 128.7, 128.6, 128.5, 128.2, 128.1, 127.1, 126.5, 125.1, 119.0, 61.3, 21.3, 13.4.
2, 6-二苯基-4-间甲氧基苯基-3-吡啶甲酸乙酯 (3n):收率70%, 时间10 h.白色固体, m.p. 133~136 ℃; Rf=0.45 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.12 (d, J=8.0 H, 2H z), 7.72 (dd, J=8.0, 2.0 Hz, 2H), 7.70 (s, 1H), 7.50~7.38 (m, 7H), 7.31 (dd, J=8.0, 2.0 Hz, 1H), 7.06 (t, J=8.0 Hz, 1H), 6.97 (d, J=8.4 Hz, 1H), 3.92 (q, J=7.2 Hz, 2H), 3.78 (s, 3H), 0.81 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.5, 157.0, 157.0, 156.1, 147.2, 140.6, 138.7, 130.1, 130.0, 129.4, 128.8, 128.5, 128.1, 127.4, 127.3, 127.0, 120.7, 120.5, 110.7, 60.9, 55.3, 13.4; HRMS (ESI) calcd for C25H21N2O2 [M+H]+ 438.1700, found 438.1708.
2, 6-二苯基-4-(4-吡啶基)-3-吡啶甲酸乙酯 (3o):收率72%, 时间8 h.无色液体, Rf=0.59 [V(石油醚):V(乙酸乙酯)=1:1]; 1H NMR (CDCl3, 400 MHz) δ: 8.75~ 8.71 (m, 2H), 8.15~8.10 (m, 2H), 7.76~7.71 (m, 2H), 7.68 (s, 1H), 7.52~7.44 (m, 6H), 7.42~7.38 (m, 2H), 4.00 (q, J=7.2 Hz, 2H), 0.91 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.1, 157.6, 157.1, 150.0, 146.8, 146.4, 139.6, 138.0, 129.8, 129.0, 128.8, 128.6, 128.3, 127.2, 126.1, 122.8, 118.5, 61.7, 13.4; HRMS (ESI) calcd for C25H21N2O2 [M+H]+ 381.1598, found 381.1595.
2-对溴苯基-4, 6-二苯基-3-吡啶甲酸乙酯 (3p)[13]:收率70%, 时间10 h.白色固体, m.p. 179~181 ℃(文献值[13]: 177~179 ℃); Rf=0.60 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 600 MHz) δ: 8.14~8.09 (m, 2H), 7.74 (s, 1H), 7.65~7.57 (m, 4H), 7.51~7.43 (m, 8H), 3.99 (q, J=7.2 Hz, 2H), 0.92 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.5, 157.4, 155.4, 149.7, 138.9, 138.4, 138.3, 131.4, 130.3, 129.6, 128.8, 128.7, 128.6, 128.0, 127.2, 126.7, 123.3, 119.6, 61.5, 13.5.
2-对甲氧基苯基-4, 6-二苯基-3-吡啶甲酸乙酯 (3q):收率54%, 时间12 h.白色固体, m.p. 76~78 ℃(文献值[14]: 75~77 ℃); Rf=0.20 [V(石油醚):V(乙酸乙酯)= 95:5]; 1H NMR (CDCl3, 600 MHz) δ: 8.16~8.10 (m, 2H), 7.77~7.71 (m, 2H), 7.69 (s, 1H), 7.52~7.41 (m, 8H), 7.02~6.96 (m, 2H), 4.01 (q, J=7.2 Hz, 2H), 3.87 (s, 3H), 0.93 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 169.0, 160.2, 157.0, 156.1, 149.5, 138.65, 138.57, 132.5, 130.0, 129.4, 128.7, 128.5, 128.0, 127.2, 126.4, 118.9, 113.7, 61.3, 55.3, 13.5.
2-甲基-4, 6-二苯基-3-吡啶甲酸乙酯 (3r):收率63%, 时间12 h.无色液体, Rf=0.40 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.08~8.01 (m, 2H), 7.58 (s, 1H), 7.53~7.39 (m, 8H), 4.13 (q, J=7.2 Hz, 2H), 2.74 (s, 3H), 1.01 (t, J=7.2 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 168.9, 157.3, 155.7, 149.0, 138.9, 138.7, 129.4, 128.8, 128.6, 128.5, 127.9, 127.2, 126.8, 118.6, 61.3, 23.1, 13.6; HRMS (ESI) calcd for C21H20NO2 [M+H]+ 318.1489, found 318.1485.
2, 4, 6-三苯基吡啶 (4a):收率87%, 时间4 h.白色固体, m.p. 138~140 ℃(文献值[7]: 139~141 ℃); Rf=0.50 [V(石油醚):V(乙酸乙酯)=95:5]; 1H NMR (CDCl3, 400 MHz) δ: 8.22 (d, J=8.0 Hz, 4H), 7.91 (s, 2H), 7.77 (d, J=8.0 Hz, 2H), 7.57~7.46 (m, 9H); 13C NMR (CDCl3, 100 MHz) δ: 157.5, 150.2, 139.6, 139.0, 129.1, 129.0, 129.0, 128.7, 127.2, 127.1, 117.1.
辅助材料 (Supporting Information) 产物的核磁氢谱和碳谱.这些材料可以免费从本刊网站 (http://siocjournal.cn/) 上下载.
-
-
[1]
(a) McGrath, N. A.; Brichacek, M.; Njardarson, J. T. J. Chem. Educ. 2010, 87, 1348.
(b) Tang, B.; Yu, F.; Li, P.; Tong, L.; Duan, X.; Xie, T.; Wang, X. J. Am. Chem. Soc. 2009, 131, 3016.
(c) Yoo, K. S.; Park, C. P.; Yoon, C. H.; Sakaguchi, S.; O'Neil l, J.; Jung, K. W. Org. Lett. 2007, 9, 3933. -
[2]
For selected reviews on the synthesis of pyridines, see: (a) Allais, C.; Grassot, J.-M.; Rodriguez, J.; Constantieux, T. Chem. Rev. 2014, 114, 10829.
(b) Hill, M. D. Chem. Eur. J. 2010, 16, 12052.
(c) Henry, G. D. Tetrahedron 2004, 60, 6043. For selected examples on the synthesis of pyridines, see:
(d) Zhang, X.; Ying, W.; Wu, W.; Li, J.; Hua, J. Acta Chim. Sinica 2015, 73, 272 (in Chinese). (张晓瑜, 应伟江, 武文俊, 李晶, 花建丽, 化学学报, 2015, 73, 272.)
(e) Shao, T.; Jiang, Z. Acta Chim. Sinica 2017, 75, 70 (in Chinese). (邵天举, 江智勇, 化学学报, 2017, 75, 70.)
(f) Chang, L.; Lai, J.; Yuan, G. Chin. J. Chem. 2016, 34, 887. (g) Yang, F.; Sun, J.; Yan, C. Chin. J. Chem. 2015, 33, 1371. -
[3]
Stout, D. M.; Meyers, A. I. Chem. Rev. 1982, 82, 223. doi: 10.1021/cr00048a004
-
[4]
Chichibabin, A. E.; Zeide, O. A. J. Russ. Phys.-Chem. Soc. 1906, 37, 1229.
-
[5]
(a) Zecher, W.; Kröhnke, F. Chem. Ber. 1961, 94, 690.
(b) Zecher, W.; Kröhnke, F. Chem. Ber. 1961, 94, 698. -
[6]
(a) Liéby-Muller, F.; Allais, C.; Constantieux, T.; Rodriguez, J. Chem. Commun. 2008, 4207.
(b) Allais, C.; Constantieux, T.; Rodriguez, J. Chem. Eur. J. 2009, 15, 12945.
(c) Allais, C.; Liéby-Muller, F.; Rodriguez, J.; Constantieux, T. Eur. J. Org. Chem. 2013, 4131.
(d) Allais, C.; Liéby-Muller, F.; Constantieux, T.; Rodriguez, J. Adv. Synth. Catal. 2012, 354, 2537. -
[7]
Song, Z.; Huang, X.; Yi, W.; Zhang, W. Org. Lett. 2016, 18, 5640. doi: 10.1021/acs.orglett.6b02883
-
[8]
For selected examples on the reaction catalyzed or promoted by iodine, see: (a) Ren, X.; Wang, G.; Tang, X.; Zhao, W. Chin. J. Org. Chem. 2015, 35, 1733 (in Chinese). (任相伟, 王光伟, 唐向阳, 赵温涛, 有机化学, 2015, 35, 1733.)
(b) Wang, D.; Zhang, R.; Lin, S.; Deng, R.; Yan, Z. Chin. J. Org. Chem. 2016, 36, 2757 (in Chinese). (王丁意, 张荣兴, 林森, 邓瑞红, 严兆华, 有机化学, 2016, 36, 2757.)
(c) Meng, T.; Chen, R.; Liu, L.; Wang, T.; Liu, X.; Zhao, W. Chin. J. Org. Chem. 2015, 35, 2108 (in Chinese). (孟团结, 陈荣祥, 刘澜涛, 王涛, 刘新明, 赵文献, 有机化学, 2015, 35, 2108.) For selected reviews on iodine, see:
(d) Liu, D.; Lei, A. Chem. Asian J. 2015, 10, 806.
(e) Zhao, J.; Gao, W.; Chang, H.; Li, X.; Liu, Q.; Wei, W. Chin. J. Org. Chem. 2014, 34, 1941 (in Chinese). (赵巾巾, 高文超, 常宏宏, 李兴, 刘强, 魏文珑, 有机化学, 2014, 34, 1941.)
(f) Wu, X.; Gong, J.; Qi, X. Org. Biomol. Chem. 2014, 12, 5807.
(g) Shen, S.; Xu, X.; Ji, S. Chin. J. Org. Chem. 2009, 29, 806 (in Chinese). (沈舒苏, 徐小平, 纪顺俊, 有机化学, 2009, 29, 806.) -
[9]
(a) Gao, W.-C.; Hu, F.; Huo, Y.-M.; Chang, H.-H.; Li, X.; Wei, W.-L. Org. Lett. 2015, 17, 3914.
(b) Gao, Q.; Liu, S.; Wu, X.; Zhang, J.; Wu, A. Org. Lett. 2015, 17, 2960.
(c) Yan, Y.; Xu, Y.; Niu, B.; Xie, H.; Liu, Y. J. Org. Chem. 2015, 80, 5581.
(d) Gao, Q.; Liu, S.; Wu, X.; Wu, A. Org. Lett. 2014, 16, 4582. -
[10]
赵玉英, 王二兵, 王颖莉, 有机化学, 2016, 36, 1681. http://sioc-journal.cn/Jwk_yjhx/CN/volumn/volumn_1752.shtmlZhao, Y.; Wang, E.; Wang, Y. Chin. J. Org. Chem. 2016, 36, 1681 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/volumn/volumn_1752.shtml
-
[11]
For the synthesis of intermediate A, see: Stavber, G.; Iskra, J.; Zupan, M.; Stavber, S. Adv. Synth. Catal. 2008, 350, 2921. For the conversion from A to 3a, see Supporting Information.
-
[12]
Zhang, Q.-R.; Huang, J.-R.; Zhang, W.; Dong, L. Org. Lett. 2014, 16, 1684. doi: 10.1021/ol500345n
-
[13]
Xuan, Z.; Rathwell, K.; Lee, S. Asian J. Org. Chem. 2014, 3, 1108. doi: 10.1002/ajoc.v3.10
-
[1]
-
表 1 反应条件优化
Table 1. Optimization of reaction conditions

Entry Iodine/equiv. Base (2.0 equiv.) Solvent Yieldb/% 1 — K2CO3 DMSO 0 2 1.0 — DMSO 0 3 1.0 K2CO3 DMSO 67 4 1.5 K2CO3 DMSO 82 5 2.0 K2CO3 DMSO 82 6c 1.5 K2CO3 DMSO 81 7d 1.5 K2CO3 — 82 8 1.5 Cs2CO3 DMSO 77 9 1.5 Na2CO3 DMSO 72 10 1.5 Et3N DMSO 0 11 1.5 K2CO3 DMF 75 12c 1.5 K2CO3 DMF 75 13 1.5 K2CO3 NMP 52 14 1.5 K2CO3 EtOH Trace 15 1.5 K2CO3 DCE 44 16 1.5 K2CO3 Toluene 71 17e 1.5 K2CO3 DMSO 21 a Reaction conditions: 0.2 mmol of 1a, 0.24 mmol of 2a, 0.6 mmol of NH4OAc, iodine, and base in 2 mL of solvent at 90 ℃ for 8~10 h. b Isolated yield. c The solvent was dried by 4Å molecular sieves. d The reaction was run under neat conditions. e The reaction was run at room temperature for 24 h. 表 2 三组分反应合成多取代吡啶
Table 2. Three-component reaction for the synthesis of polysubstituted pyridines

Entry R1 R2 R3 Product Yieldb/% 1 C6H5 C6H5 C6H5 3a 82 2 4-MeC6H4 C6H5 C6H5 3b 83 3 2-MeC6H4 C6H5 C6H5 3c 77 4 4-ClC6H4 C6H5 C6H5 3d 72 5 4-BrC6H4 C6H5 C6H5 3e 74 6 4-NO2C6H4 C6H5 C6H5 3f 71 7 2-Naphthyl C6H5 C6H5 3g 63 8 2-Furyl C6H5 C6H5 3h 67 9 Me C6H5 C6H5 3i 36 10 C6H5 4-MeC6H4 C6H5 3g 71 11 C6H5 4-BrC6H4 C6H5 3k 62 12 C6H5 4-ClC6H4 C6H5 3l 77 13 C6H5 4-MeOC6H4 C6H5 3m 75 14 C6H5 3-MeOC6H4 C6H5 3n 70 15 C6H5 4-Pyridinyl C6H5 3o 72 16 C6H5 C6H5 4-BrC6H4 3p 70 17 C6H5 C6H5 4-MeOC6H4 3q 54 18 C6H5 C6H5 Me 3r 63 19 H C6H5 C6H5 3s 0 a Reaction conditions: 0.2 mmol of 1, 0.24 mmol of 2, 0.6 mmol of NH4OAc, 0.3 mmol of iodine, 0.4 mmol of K2CO3, in 2 mL of DMSO, at 90 ℃ for 8~ 12 h. b Isolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1134
- HTML全文浏览量: 107


 下载:
下载:


 下载:
下载:

