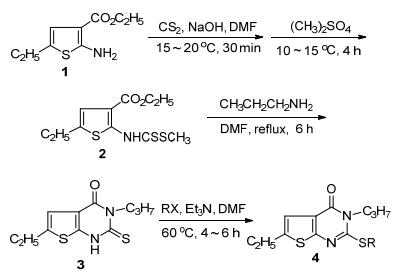
 图式1
目标化合物的合成线路
图式1.
Synthetic route of the target compound
图式1
目标化合物的合成线路
图式1.
Synthetic route of the target compound

Citation: Zhao Anlin, Liu Shu, Zhu Yongmei, Wang Tao, Luo Jin. Designed, Synthesis and Herbicidal Activity of Novel 2-Alkylthio-thieno[2, 3-d]pyrimidin-4-ones[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1877-1882. doi: 10.6023/cjoc201612048

新型2-烷硫基-噻吩并[2, 3-d]嘧啶-4-酮衍生物的设计、合成与除草活性
-
关键词:
- 噻吩并[2, 3-d]嘧啶-4(3H)-酮衍生物
- / 合成
- / 除草活性
English
Designed, Synthesis and Herbicidal Activity of Novel 2-Alkylthio-thieno[2, 3-d]pyrimidin-4-ones
-
Key words:
- thieno[2, 3-d]pyrimidin-4(3H)-ones
- / synthesis
- / herbicidal activitiess
-
噻吩并嘧啶衍生物因其在抗菌[1]、抗过敏[2]、抗炎[3]、杀菌[4]、磷酸二酯酶抑制剂[5]、抗过滤性病原体[6]、杀虫[7]及抗惊厥[8]等方面所表现的良好生物活性, 早在20世纪70年代开始就受到人们的广泛注意.近些年研究发现一些噻吩并嘧啶衍生物可以抗肿瘤[9~11]、治疗帕金森氏综合症[12]、抗血小板活性[13], 还可以作为镇定剂[14], 但在农药上的应用报道较少[15].同时有文献报道噻吩并嘧啶类衍生物(如化合物1a, 1b)通过抑制IL-1 (interleukin-1) 的增加可以防止关节中软骨退化[16~20], 软骨衰退的主要原因之一是IL-1 (interleukin-1) 通过产生大量的分解蛋白酶来刺激软骨退化.还有文献报道含有噻吩并嘧啶衍生物(如化合物1c, 1d)表现出很好的抗结核、抗哮喘活性[21~23].由此可见, 新型噻吩并嘧啶类衍生物的设计、合成及生物活性具有广阔的研究价值.
本课题组曾以2-氨基-3-乙氧羰基-5-乙基噻吩为原料制备了具有一定除草活性的噻吩并嘧啶化合物[24], 为了进一步优化噻吩并嘧啶化合物结构并系统研究其在农药上的生物活性, 本文设计合成了一系列未见文献报道的2-烷硫基-3-丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮衍生物(Scheme 1), 通过1H NMR、IR、LC-MS和元素分析确定其结构.初步测试研究了目标化合物的除草活性, 结果表明部分化合物具有优异的除草活性, 并探讨了该类噻吩并嘧啶化合物结构与活性的关系.
1 结果与讨论
1.1 合成部分
中间体2与正丙胺在N, N-二甲基甲酰胺(DMF)为溶剂高温加热回流下关环得到中间体3. DMF极性大, 溶解性好, 且沸点高, 有利于关环生成中间体3.与氢氧化钾等强碱作用下硫代烷基化相比, 本文在合成目标化合物4时是以DMF为溶剂, 三乙胺作缚酸剂, 在60 ℃恒温搅拌反应4 h即可, 既降低了反应温度, 又缩短了时间.
1.2 波谱性质
分析目标化合物的核磁共振氢谱, 发现化学位移在δ 7.05左右的单峰是噻吩环上氢, 噻吩环上连接的乙基中甲基的化学位移在δ 1.31~1.35之间而亚甲基的化学位移在δ 2.80~2.86之间.嘧啶环氮上直接相连的丙基中甲基的的化学位移在δ 0.86~1.05之间.在红外光谱图谱中, 羰基的吸收峰在1680 cm-1左右, 碳碳双键和碳氮双键的强吸收峰在1500~1600 cm-1之间.液相质谱所示目标化合物的分子量与理论值相同, 元素分析的计算值与理论值相对误差基本在0.4%范围内.
1.3 生物活性
本文采用文献[25]的离体培养皿方法测定了目标化合物在浓度为10和100 mg/L时对供试植物稗草(Barnyard grass, 单子叶杂草)和油菜(Rape, 双子叶杂草)茎长和根长的抑制率(%), 结果见表 1.
 表 1
化合物4a~4p对单、双子叶植物的抑制率(%)a
Table 1.
Inhibition percentage (%) of compounds 4a~4p to barnyard grass and rape
表 1
化合物4a~4p对单、双子叶植物的抑制率(%)a
Table 1.
Inhibition percentage (%) of compounds 4a~4p to barnyard grass and rape
化合物 R 稗草 油菜 茎 根 茎 根 10 mg/L 100 mg/L 10 mg/L 100 mg/L 10 mg/L 100 mg/L 10 mg/L 100 mg/L 4a CH3 18 84 87 94 17 27 14 77 4b C2H5 44 87 79 98 5 20 39 78 4c i-C3H7 57 85 58 92 26 46 17 90 4d n-C3H7 45 47 77 57 16 26 60 95 4e Cyclopentyl 22 100 69 100 33 56 56 100 4f Cyclohexyl 53 95 85 97 28 45 29 100 4g CH2=CHCH2 35 57 68 74 2 21 28 76 4h PhCOCH2 30 45 66 85 8 2 -22 57 4i p-O2NC6H4COCH2 60 68 82 84 51 54 45 86 4j CH2COOC2H5 26 63 65 68 60 61 -2 76 4k PhCH2 24 62 72 78 28 35 18 51 4l CH3CHCOOC2H5 8 60 81 86 15 32 44 72 4m n-C12H25 8 30 77 88 4 20 23 45 4n n-C14H29 51 92 86 100 50 61 63 98 4o n-C16H33 25 100 82 100 60 53 61 100 4p n-C18H37 56 71 83 90 15 41 24 80 a负抑制率表示促进植物生长, 活性标准: A级≥90%, B级≥70%, C级≥50%, D级<50%. 由表 1所示的测试数据表明:当浓度为100 mg/L时, 目标化合物对稗草的茎的抑制率有4个达到A级、4个B级和5个C级, 尤其是化合物4e和4o的抑制率都达到了100%.对稗草的根的抑制率8个达到A级和6个B级, 化合物4e, 4f和4o的抑制率也达到100%.浓度在10 mg/L时, 对稗草的根和茎的抑制率明显下降, 没有A级只有11个达到B级.
当浓度为100 mg/L时, 目标化合物对油菜的茎的抑制率只有5个达到C级; 对油菜的根的抑制率有6个达到A级和7个B级, 并且化合物4e, 4f和4o的抑制率均为100%.浓度在10 mg/L时, 对油菜的根和茎的抑制率只有8个达到C级, 化合物4h、4j抑制率为-22%和-2%, 即说明具有一定的促进作用.
总体上看, 随着浓度从100 mg/L降至10 mg/L, 目标化合物对稗草和油菜的根和茎长的抑制率也随之减弱.在100 mg/L浓度下, 目标化合物对稗草和油菜根长的抑制作用普遍优于其茎长的抑制作用; 化合物4e, 4f和4o对稗草和油菜根长的抑制作用非常优异, 抑制率均到达了100%.当R基团为CH3、CH3CH2、环己基和正十六烷等烷基时, 对油菜和稗草的抑制作用明显比PhCH2、PhCOCH2和CH2COOC2H5等芳基、酯基强; 而当R基团为p-O2NC6H4COCH2时, 抑制作用比PhCO-CH2好.随着R基团链长不断增大, 目标化合物对稗草和油菜的茎长和根长的抑制作用并不是很有规律的变化, 这些有可能是由于空间效应和诱导效应引起的, 进一步的优化和复筛工作正在进行之中.
2 结论
以2-氨基-3-乙氧羰基-5-乙基噻吩为原料, 经硫脲化、缩合关环以及硫代烷(芳)基化合成了16个未见文献报道的2-烷硫基-3-丙基-6-乙基噻吩并[2, 3-d]嘧啶-4-酮衍生物.除草活性测试显示, 浓度为100 mg/L时, 部分目标化合物具有优异的除草活性, 其中4e和4o对单子叶植物和双子叶植物的根长抑制活性达到了100%.从构效关系上看, 在往后的工作中可以对噻吩并[2, 3-d]嘧啶-4-酮上取代基进行不同修饰, 适当引入吸电子和供电子能力更强的基团, 以期能寻找出具有超高生物活性的农药先导.
3 实验部分
3.1 仪器与试剂
傅里叶红外光谱仪(Spectrum one型, KBr压片, 美国Perkin Elmer公司), 超导核磁共振波谱仪(AVANCE 400型, 瑞士Bruker公司, CDCl3为溶剂), 1100 LC/MSD Trap液相色谱/质谱/质谱联用仪(美国Agilent公司), X-4型显示显微熔点测定仪(北京泰克仪器有限公司, 温度未矫正).三乙胺经氢化钙干燥处理后重新蒸馏, 其他试剂均为分析纯.
3.2 实验方法
3.2.1 中间体2的合成
中间体1是根据文献[26]方法合成的, 收率70%, 熔点71~73 ℃, 与文献值相同.
中间体2的合成:在装有搅拌装置和恒压滴液漏斗的100 mL三颈烧瓶中, 分别加入中间体1 (20 mmol, 3.98 g)和DMF (40 mL), 搅拌下滴加二硫化碳(20 mmol, 19.2 mL)和氢氧化钠水溶液3.6 g/6 mL.滴加完毕, 溶液在15~20 ℃下反应30 min后, 在10~15 ℃下缓慢滴加硫酸二甲酯, 滴毕, 升至室温继续搅拌反应4 h后, 将反应液倾入大量的冰水中, 有大量固体析出, 过滤后粗产品用无水乙醇重结晶, 产率82%.
3.2.2 中间体3的合成
将中间体2 (10 mmol, 2.89 g)、正丙胺(12 mmol, 0.6 g)和10 mL DMF (30 mL)依次加入到50 mL烧瓶中, 先搅拌加热回流反应6 h, 然后在室温下继续反应24 h, 反应液倾入60 mL水中, 过滤得到粗产物白色固体, 双溶剂DMF/异丙醇重结晶即得纯品, 产率65%. 1H NMR (CDCl3, 400 MHz) δ: 7.00 (s, 1H), 4.41~4.45 (m, 2H), 2.77~2.83 (m, 2H), 1.79~1.85 (m, 2H), 1.30~1.34 (t, J=7.5 Hz, 3H), 0.99~1.03 (t, J=7.4 Hz, 3H).
3.2.3 目标化合物4的合成
向50 mL烧瓶中加入中间体3 (2 mmol, 0.508 g)、三乙胺(6 mmol)、卤代烃(2.4 mmol)和10 mL DMF, 60 ℃下搅拌反应4~6 h, 冷却至室温后将反应液倒入40 mL水中, 抽滤, 滤饼再用乙醇/DMF重结晶即得目标化合物4a~4p.
2-甲硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4a):淡黄色固体, 产率83%. m.p. 53~54 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.07(s, 1H), 4.06~4.10 (m, 2H), 2.82~2.88 (m, 2H), 2.62 (s, 3H), 1.77~1.81 (m, 2H), 1.33~1.36 (t, J=7.5 Hz, 3H), 1.00~1.04 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3065, 2958, 2872, 1681, 1552, 1502, 1383, 904, 658 cm-1; LC-MS (EI) m/z: 269 [M+1]+. Anal. calcd for C12H16N2OS2: C 53.70, H 6.01, N 10.44; found C 53.93, H 6.14, N 10.58.
2-乙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4b):淡黄色固体, 产率75%. m.p. 83~84 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.04~4.07 (m, 2H), 3.20~3.26 (m, 2H), 2.80~2.84 (m, 2H), 1.72~1.82 (m, 2H), 1.39~1.43 (m, 3H), 1.29~1.33 (m, J=7.5 Hz, 3H), 0.98~1.02 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3065, 2931, 2874, 1674, 1551, 1505, 1379, 899, 649 cm-1; LC-MS (EI) m/z: 283 [M+1]+. Anal. calcd for C13H18N2-OS2: C 55.28, H 6.42, N 9.92; found C 55.43, H 6.64, N 9.98.
2-异丙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4c):淡黄色固体, 产率64%. m.p. 55~56 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.02~4.08 (m, 3H), 2.80~2.86 (m, 2H), 1.73~1.78 (m, 2H), 1.44~1.46 (d, J=6.8 Hz, 6H), 1.31~1.34 (t, J=7.5 Hz, 3H), 0.97~1.01 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3062, 2933, 2873, 1681, 1552, 1504, 1382, 898, 670 cm-1; LC-MS (EI) m/z: 297 [M+1]+. Anal. calcd for C14H20N2OS2: C 56.72, H 6.80, N 9.45; found C 56.93, H 6.94, N 9.67.
2-正丙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4d):淡黄色固体, 产率82%. m.p. 57~58 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.05~4.09 (m, 2H), 3.19~3.23 (m, 2H), 2.80~2.86 (m, 2H), 1.76~1.79 (m, 2H), 1.73~1.75 (m, 2H), 1.31~1.35 (m, 3H), 1.05~1.09(t, J=7.5 Hz, 3H), 0.98~1.02 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3061, 2967, 2874, 1669, 1551, 1508, 1377, 903, 662 cm-1; LC-MS (EI) m/z: 297 [M+1]+. Anal. calcd for C14H20N2OS2: C 56.72, H 6.80, N 9.45; found C 56.83, H 6.94, N 9.63.
2-环戊硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4e):白色固体, 产率85%. m.p. 81~82 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.04 (s, 1H), 4.01~4.11 (m, 2H), 2.80~2.84 (m, 2H), 2.25~2.28 (m, 2H), 1.59~1.79 (m, 8H), 1.31~1.34 (t, J=7.5 Hz, 3H), 0.98~1.01 (t, J=7.4 Hz, 3H); IR (KBr) ν: 2972, 2932, 2874, 1683, 1551, 1511, 1371, 896, 667 cm-1; LC-MS (EI) m/z: 323 [M+ 1]+. Anal. calcd for C16H22N2OS2: C 59.59, H 6.88, N 8.69; found C 59.71, H 6.94, N 8.86.
2-环己硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4f):淡黄色固体, 产率62%. m.p. 84~85 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.04 (s, 1H), 4.03~4.07 (m, 2H), 3.90~3.92 (m, 1H), 2.80~2.84 (m, 2H), 2.11~2.14 (m, 2H), 1.45~1.79 (m, 10H), 1.31~1.35 (t, J=7.5 Hz, 3H), 0.98~1.01 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3065, 2931, 2874, 1682, 1553, 1504, 1381, 884, 655 cm-1; LC-MS (EI) m/z: 337 [M+1]+. Anal. calcd for C17H24N2OS2: C 60.68, H 7.19, N 8.32; found C 60.83, H 7.34, N 8.48.
2-烯丙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4g):白色固体, 产率71%. m.p. 54~55 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 5.92~6.02 (m, 1H), 5.34~5.38 (d, J=16.9 Hz, 1H), 5.19~5.21 (d, J=10 Hz, 1H), 4.04~4.08 (m, 2H), 3.89~3.90 (d, J=7.0 Hz, 2H), 2.81~2.86 (m, 2H), 1.64~1.78 (m, 2H), 1.31~1.35 (t, J=7.5 Hz, 3H), 0.98~1.02 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3064, 2958, 2874, 1680, 1505, 1495, 1384, 881, 652 cm-1; LC-MS (EI) m/z: 295 [M+1]+. Anal. calcd for C14H18N2OS2: C 57.11, H 6.16, N 9.51; found C 57.23, H 6.34, N 9.78.
2-苯甲酰乙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4h):淡黄色固体, 产率78%. m.p. 130~131 ℃; 1H NMR (CDCl3, 400 MHz) δ: 8.08~8.09 (d, J=7.2 Hz, 2H), 7.63~7.67 (m, J=7.4 Hz, 1H), 7.52~7.56 (t, J=7.6 Hz, 2H), 7.03 (s, 1H), 4.70 (s, 2H), 4.10~4.14 (m, 2H), 2.76~2.81 (m, 2H), 1.79~1.87 (m, 2H), 1.27~1.31 (t, J=7.5 Hz, 3H), 1.01~1.05 (t, J=7.4 Hz, 3H); IR (KBr) ν: 2967, 2932, 2875, 1687, 1509, 1378, 885, 647 cm-1; LC-MS (EI) m/z: 373 [M+1]+. Anal. calcd for C19H20N2O2S2: C 61.26, H 5.41, N 7.52; found C 61.33, H 5.74, N 7.77.
2-对硝基苯甲酰乙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4i):淡黄色固体, 产率69%. m.p. 95~96 ℃; 1H NMR (CDCl3, 400 MHz) δ: 8.18~8.20 (d, J=8.6 Hz, 2H), 7.61~7.63 (d, J=8.5 Hz, 2H), 7.06 (s, 1H), 4.52 (s, 2H), 4.01~4.05 (m, 2H), 2.82~2.89 (m, 2H), 1.67~1.79 (m, 2H), 1.32~1.35 (t, J=7.5 Hz, 3H), 0.97~1.00 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3065, 2966, 2876, 1689, 1606, 1510, 1494, 1377, 878, 714 cm-1; LC-MS (EI) m/z: 418 [M+1]+. Anal. calcd for C19H19N3O4S2: C 54.66, H 4.59, N 10.06; found C 54.51, H 4.74, N 10.27.
2-乙氧羰基乙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4j):白色固体, 产率86%. m.p. 74~75 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.22~4.47 (m, 2H), 4.05~4.09 (m, 2H), 3.97 (s, 2H), 2.80~2.85 (m, 2H), 1.76~1.86 (m, 2H), 1.39~1.43 (m, 3H), 1.30~1.34 (t, J=7.5 Hz, 3H), 1.00~1.03 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3069, 2930, 2874, 1744, 1687, 1555, 1512, 1497, 1379, 886, 662 cm-1; LC-MS (EI) m/z: 341 [M+1]+. Anal. calcd for C15H20N2O3S2: C 52.92, H 5.92, N 8.23; found C 53.13, H 5.84, N 8.47.
2-苄硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4k):淡黄色固体, 产率78%. m.p. 78~79 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.26~7.44 (m, 5H), 7.06 (s, 1H), 4.47 (s, 2H), 4.01~4.05 (m, 2H), 2.81~2.89 (m, 2H), 1.70~1.78 (m, 2H), 1.32~1.36 (t, J=7.5 Hz, 3H), 0.95~0.99 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3064, 2931, 2875, 1675, 1638, 1552, 1509, 1375, 896, 589 cm-1; LC-MS (EI) m/z: 345 [M+1]+. Anal. calcd for C18H20N2OS2: C 62.76, H 5.85, N 8.13; found C 62.49, H 5.94, N 8.27.
2-乙氧羰基甲基乙硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4l):白色固体, 产率82%. m.p. 39~40 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.04 (s, 1H), 4.50~4.56 (m, 1H), 4.16~4.30 (m, 2H), 4.02~4.06 (m, 2H), 2.80~2.85 (m, 2H), 1.75~1.80 (m, 2H), 1.64~1.66 (d, J=7.4 Hz, 3H), 1.29~1.34 (m, 6H), 0.99~1.03 (t, J=7.4 Hz, 3H); IR (KBr) ν: 2969, 2935, 2876, 1738, 1686, 1551, 1511, 1375, 897, 669 cm-1; LC-MS (EI) m/z: 355 [M+ 1]+. Anal. calcd for C16H22N2O3S2: C 54.21, H 6.26, N 7.90; found C 54.43, H 6.44, N 7.79.
2-正十二烷硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4m):白色固体, 产率87%. m.p. 40~41 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.05~4.09 (m, 2H), 3.20~3.24 (m, 2H), 2.80~2.84 (m, 2H), 1.70~1.80 (m, 4H), 1.42~1.45 (m, 2H), 1.26~1.35 (m, 19H), 0.98~1.02 (t, J=7.5 Hz, 3H), 0.87~0.92 (t, J=7.4 Hz, 3H); IR (KBr) ν: 2921, 2851, 1687, 1553, 1505, 1379, 876, 654 cm-1; LC-MS (EI) m/z: 423 [M+1]+. Anal. calcd for C23H38N2OS2: C 65.35, H 9.06, N 6.63; found C 65.51, H 9.24, N 6.87.
2-正十四烷硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4n):淡黄色固体, 产率85%. m.p. 44~46 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.05~4.08 (m, 2H), 3.19~3.23 (m, 2H), 2.80~2.86 (m, 2H), 1.70~1.80 (m, 4H), 1.43~1.45 (m, 2H), 1.26~1.34 (m, 23H), 0.98~1.02 (t, J=7.5 Hz, 3H), 0.86~0.90 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3067, 2920, 2850, 1686, 1552, 1503, 1380, 900, 654 cm-1; LC-MS (EI) m/z: 451 [M+1]+. Anal. calcd for C25H42N2OS2: C 66.62, H 9.39, N 6.21; found C 66.41, H 9.54, N 6.37.
2-正十六烷硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4o):白色固体, 产率90%. m.p. 51~52 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.04~4.08 (m, 2H), 3.19~3.23 (m, 2H), 2.82~2.84 (m, 2H), 1.72~1.78 (m, 4H), 1.43~1.45 (m, 2H), 1.26~1.34 (m, 27H), 0.98~1.02 (t, J=7.5 Hz, 3H), 0.86~0.90 (t, J=7.4 Hz, 3H); IR (KBr) ν: 2921, 2849, 1686, 1553, 1503, 1371, 876, 654 cm-1; LC-MS (EI) m/z: 479 [M+1]+. Anal. calcd for C27H46N2OS2: C 67.73, H 9.68, N 5.85; found C 67.52, H 9.82, N 5.97.
2-正十八烷硫基-3-正丙基-6-乙基噻吩并[2, 3-d]嘧啶-4(3H)-酮(4p):白色固体, 产率78%. m.p. 60~61 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.05 (s, 1H), 4.05~4.09 (m, 2H), 3.20~3.23 (m, 2H), 2.82~2.84 (m, 2H), 1.72~1.78 (m, 4H), 1.43~1.45 (m, 2H), 1.25~1.33 (m, 31H), 0.98~1.02 (t, J=7.5 Hz, 3H), 0.86~0.89 (t, J=7.4 Hz, 3H); IR (KBr) ν: 3067, 2920, 2849, 1685, 1553, 1503, 1371, 876, 654 cm-1; LC-MS (EI) m/z: 507 [M+1]+. Anal. calcd for C29H50N2OS2: C 68.72, H 9.94, N 5.53; found C 68.43, H 10.12, N 5.77.
辅助材料(Supporting Information) 中间体3的1H NMR谱图, 所有目标化合物4a~4p的1H NMR和IR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Ravindr, V. C.; Barsu, G. K.; Anil, S. B.; Rajesh, H. B. Eur. J Med. Chem. 2003, 34, 89.
-
[2]
Temple, D. L. US 4054656, 1977[Chem. Abstr. 1977, 88, 37830].
-
[3]
Panico, A. M.; Santagati, A.; Cardile, V. Colloids Surf. B 2003, 28, 77. doi: 10.1016/S0927-7765(02)00118-2
-
[4]
曾国平, 郑平, 化学学报, 2012, 70, 759. doi: 10.3866/PKU.WHXB201202023Zeng, G. P.; Zheng, P. Acta Chim. Sinica 2012, 70, 759(in Chinese). doi: 10.3866/PKU.WHXB201202023
-
[5]
Crespo, M. l.; Pages, L. L; Vega, A.; Segarra, V.; Lopez, M.; Domenech, T.; Miralpeix, M.; Beleta, J.; Ryder, H.; Palacios, J. M. J. Med. Chem. 1998, 41, 4021. doi: 10.1021/jm981012m
-
[6]
Samsonova, N. V.; Kharizomenova, L. A.; Givenv, A. N.; Kaplina, E. K. Pharm. Chem. J. 1981, 15, 645. doi: 10.1007/BF00760666
-
[7]
Tokio, O.; Katsutoshi, F.; Isamu, N. EP 0356158, 1990[Chem. Abst. 1990, 113, 59210].
-
[8]
Rosowsky, A.; Chaykovsk, M.; Chen, K. K. N.; Lin, M.; Modest, E. J. J. Med. Chem. 1973, 16, 185. doi: 10.1021/jm00261a002
-
[9]
Perspicace, E.; Ragno, R.; Ballante, F.; Hesse, S. Eur. J. Med. Chem. 2013, 63, 765. doi: 10.1016/j.ejmech.2013.03.022
-
[10]
陈玉, 柏舜, 贺红武, 杨光忠, 有机化学, 2014, 34, 2362. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344549.shtmlChen, Y.; Bai, S.; He, W. H.; Yang, G. Z. Chin. J. Org. Chem. 2014, 34, 2362(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344549.shtml
-
[11]
Bozorov, K.; Zhao, J. Y.; Elmuradov, B.; Pataer, a.; Aisa, H. A. Eur. J. Med. Chem. 2015, 102, 552. doi: 10.1016/j.ejmech.2015.08.018
-
[12]
John, G. R.; Joanne, L.; Elizabeth, D. C. WO 02055524, 2002[Chem. Abstr. 2002, 137, 109287].
-
[13]
Leistner, S.; Wagner, G.; Guetscharo, M.; Glusa, E. Pharmazie, 1986, 41, 54. doi: 10.1002/chin.198624215/full
-
[14]
王红梅, 郭树兵, 胡扬根, 曾小华, 杨光义, 有机化学, 2015, 35, 1075. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344760.shtmlWang, H. M.; Guo, S. B.; Hu, Y. G.; Zeng, X. H.; Yang, G. Y. Chin. J. Org. Chem. 2015, 35, 1075(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344760.shtml
-
[15]
Liu, H.; Wang, H. Q.; Liu, Z. J. Bioorg. Med. Chem. Lett. 2007, 38, 2203. http://www.ncbi.nlm.nih.gov/pubmed/17337186
-
[16]
Shield, M. Eur. J. Rheumatol. Inflammation 1993, 13, 7. http://www.ncbi.nlm.nih.gov/pubmed/7821339
-
[17]
Palmoski, M. J.; Brandt, K. D. Arthritis Rheum. 1983, 26, 528. doi: 10.1002/(ISSN)1529-0131
-
[18]
Hess, E. V.; Herman, J. H. Am. J. Med. 1986, 81, 36. http://europepmc.org/abstract/MED/3538869
-
[19]
Redini, F.; Mauviel, A.; Loyau, G.; Pujol, J. P. Agents Actions 1990, 31, 358. doi: 10.1007/BF01997632
-
[20]
Rainsford, K. D. Am. J. Med. 1999, 107, S27. http://www.ncbi.nlm.nih.gov/pubmed/10628591
-
[21]
Krell, R. D.; Aharony, D.; Buckner, C. K.; Keith, R. A.; Kusner, E.J.; Snyder, D. W.; Bernstein, P. R.; Matassa, V. G.; Yee, Y. K.; Gilles, R. E. Am. Rev. Respir. Dis. 1990, 141, 978. doi: 10.1164/ajrccm/141.4_Pt_1.978
-
[22]
Jarvis, B.; Markham, A. Drugs 2000, 59, 891 doi: 10.2165/00003495-200059040-00015
-
[23]
Krell, R. D.; Aharony, D.; Buckner, C. K; Keith, R. A.; Kusner, E. J.; Snyder, D. W.; Bernstein, P. R.; Matassa, V. G.; Yee, Y. K; Brown, F. J.; Hesp, B.; Giles, R. E. Am. Rev. Respir. Dis. 1990, 141, 978. doi: 10.1164/ajrccm/141.4_Pt_1.978
-
[24]
Wang, T.; Zheng, C. H.; Liu, S.; Chen, H. Z. Phosphorus, Sulfur Silicon Relat. Elem. 2010, 185, 1543. doi: 10.1080/10426500903127565
-
[25]
王涛, 博士论文, 华中师范大学, 武汉, 2004.Wang, T. Ph.D. Dissertation, Central China Normal University, Wuhan, 2004(in Chinese).
-
[26]
Guo, Y. C.; Li, J.; Ma, J. L.; Yu, Z. R.; Wang, H. W.; Zhu, W. J.; Liao, X. C.; Zhao, Y. F. Chin. Chem. Lett. 2015, 26, 755. doi: 10.1016/j.cclet.2015.03.026
-
[1]
-
表 1 化合物4a~4p对单、双子叶植物的抑制率(%)a
Table 1. Inhibition percentage (%) of compounds 4a~4p to barnyard grass and rape
化合物 R 稗草 油菜 茎 根 茎 根 10 mg/L 100 mg/L 10 mg/L 100 mg/L 10 mg/L 100 mg/L 10 mg/L 100 mg/L 4a CH3 18 84 87 94 17 27 14 77 4b C2H5 44 87 79 98 5 20 39 78 4c i-C3H7 57 85 58 92 26 46 17 90 4d n-C3H7 45 47 77 57 16 26 60 95 4e Cyclopentyl 22 100 69 100 33 56 56 100 4f Cyclohexyl 53 95 85 97 28 45 29 100 4g CH2=CHCH2 35 57 68 74 2 21 28 76 4h PhCOCH2 30 45 66 85 8 2 -22 57 4i p-O2NC6H4COCH2 60 68 82 84 51 54 45 86 4j CH2COOC2H5 26 63 65 68 60 61 -2 76 4k PhCH2 24 62 72 78 28 35 18 51 4l CH3CHCOOC2H5 8 60 81 86 15 32 44 72 4m n-C12H25 8 30 77 88 4 20 23 45 4n n-C14H29 51 92 86 100 50 61 63 98 4o n-C16H33 25 100 82 100 60 53 61 100 4p n-C18H37 56 71 83 90 15 41 24 80 a负抑制率表示促进植物生长, 活性标准: A级≥90%, B级≥70%, C级≥50%, D级<50%. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1371
- HTML全文浏览量: 126


 下载:
下载:
 下载:
下载:

