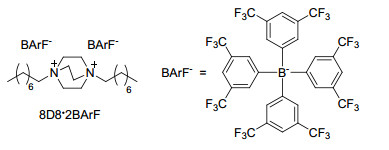
 图 1
化合物2~7和阳离子客体8D8·2BArF的结构
Figure 1.
Structures of compounds 2~7 and cation guest 8D8·2BArF
图 1
化合物2~7和阳离子客体8D8·2BArF的结构
Figure 1.
Structures of compounds 2~7 and cation guest 8D8·2BArF

Citation: Yao Huan, Sun Jiaonan, Ke Hua, Yang Liupan, Li Jiarong, Jiang Wei. Synthesis of Bis-naphthalene and Their Derivatives and Their Complexation with Organic Cation[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 603-607. doi: 10.6023/cjoc201612033

桥联双萘及其衍生物的合成以及对有机阳离子的络合作用
English
Synthesis of Bis-naphthalene and Their Derivatives and Their Complexation with Organic Cation
-
Key words:
- host-guest chemistry
- / macrocyclic chemistry
- / bis-naphthalene
-
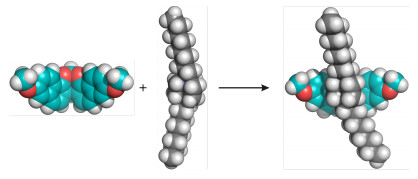
主客体化学是有机超分子化学研究的主要内容之一[1], 探索新型的主体分子对推动这一领域的发展具有重要的意义.具有一定弧度的刚性分子[2]是很好的大环受体基元, 其本身就能够识别特定的客体分子[3].如Kagan’s醚[4]、Tröger’s碱[5]和三蝶烯[6]等, 因其固定的构型和裂穴, 被广泛用于构建人工分子钳受体.同时, 还可以作为模块基元构建大环受体.如陈传峰等[6]利用三蝶烯分子多样的取代位点, 合成了三 (冠醚)、杯芳烃、内酰胺大环等大环受体以及结构更加复杂的锁烃、分子笼等.因此, 探索发现新的弧形分子势必能够为超分子主体的设计合成提供新基元, 为有机超分子化学的发展注入新的内容.
我们的研究兴趣主要集中在萘基超分子受体的设计、合成及应用[7~12].发现基于刚性桥联双萘的化合物1是很好的大环构筑基元.该化合物最初是由Whitesides等[13]以2-萘酚为原料, 在三氟乙酸催化作用下与丙二缩醛反应而成.这一化合物的空间结构存在一定的弧形弯曲, 因此Glass等[14]使用该分子构建了荧光分子管.我们对1的合成方法进行了改进[9].在反应溶剂中加入了四氢呋喃 (THF), 使底物的溶解性增加, 扩展了底物的适用范围, 得到了化合物1的衍生物以及手性分子钳 (Eq. 1, 图 1).我们还使用该弧形分子构建了一系列大环受体, 包括动态亚胺大环分子[10]和内修饰分子管[11], 利用后者实现了在非极性溶剂中对中性分子的选择性识别.最近, 我们[12]还报道了基于该弧形分子的水溶性内修饰分子管, 在水中利用氢键实现了对中性亲水溶剂分子的选择性识别.该类分子管具有荧光, 而且能够对地下水中的持久性污染物和致癌物——1, 4-二氧六环进行荧光检测, 检测限可达119 μg·L-1, 接近于世界卫生组织对饮用水中1, 4-二氧六环安全线的规定 (50 μg·L-1).
具有弧形结构的桥联双萘1是构建大环受体的优良基元.若是对这一化合物的结构进行改造, 那么所得到的新型弧形分子可以用于更加多样的大环受体.本工作将从三个方面对化合物1的结构进行改造: (1) 在化合物1的萘环增加取代基或扩展其芳香环; (2) 使用不同的萘酚作为反应原料, 例如用1-萘酚代替2-萘酚; (3) 对在化合物1中间的桥进行改造, 改变桥上碳原子的数量.同时, 我们还将研究新获得的弧形分子的主客体化学.
1 结果与讨论
我们使用1的合成条件, 合成了2~7这六种分子 (图 1).为了在化合物1的基础上改变其侧壁, 分别使用3-甲氧基-2-萘酚、2-蒽酚、1-萘酚和6-甲氧基-1-萘酚代替2-萘酚, 以2:1的比例与丙二缩醛进行反应, 得到了化合物2~5; 将1-萘酚、2-萘酚和丙二缩醛以1:1:1的比例反应, 合成了两边侧壁不对称的分子6; 为了改变化合物1中间的桥, 用乙二醛代替丙二缩醛与2-萘酚反应, 得到了桥上为2个碳的化合物7.这六种化合物中, 有1-萘酚参与反应的产率相对来说比较低, 尤其是化合物5的产率只有8%.可能是因为1-萘酚导致更多的副反应.
将化合物5的二氯甲烷 (DCM)/MeOH溶液在室温下缓慢挥发, 我们得到了化合物5的晶体结构 (图 2a).在晶体中, 化合物5形成了相对刚性的弧形结构.通过能量最优化计算, 我们得到了这七种分子的模型, 发现它们都具有一定的弧度 (图 2b).它们的静电势能表面显示弧形分子内部都是富电子的 (图 2c).由此推测, 它们或许能够通过阳离子-π相互作用, 与有机阳离子客体发生主客体络合.
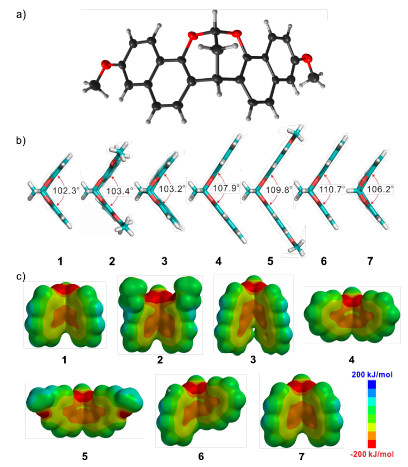 图 2
(a) 化合物5的单晶结构、(b) 化合物1~7能量最优化结构的二面角及 (c) 化合物1~7的理论计算静电势能表面
Figure 2.
(a) The single crystal structure of compound 5, (b) dihedral angles of energy-minimized structures of compounds 1~7 and (c) electrostatic potential energy surfaces of compounds 1~7 All the computations were performed at the AM1 level of theory by using Spartan'14 (Wavefunction, Inc.)
图 2
(a) 化合物5的单晶结构、(b) 化合物1~7能量最优化结构的二面角及 (c) 化合物1~7的理论计算静电势能表面
Figure 2.
(a) The single crystal structure of compound 5, (b) dihedral angles of energy-minimized structures of compounds 1~7 and (c) electrostatic potential energy surfaces of compounds 1~7 All the computations were performed at the AM1 level of theory by using Spartan'14 (Wavefunction, Inc.)
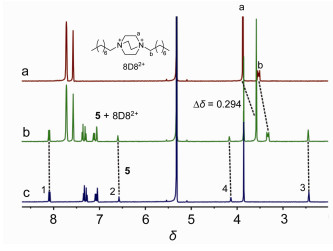
正如之前报道的[9], 我们选择了有机阳离子客体8D8·2BArF (图 1) 来进行主客体识别.如图 3所示, 当将主体5与客体8D82+以1:1的比例在CD2Cl2中混合, 它们的质子峰都发生了一定的位移.尤其是客体上DABCO的质子a向高场位移了0.294, 而烷基链上的质子位移相对较小.这说明客体的DABCO部分与主体发生了络合, 而不是烷基链.当DABCO络合在弧形空腔内, 经历了两个萘环的屏蔽效应, 所以向高场位移.其它的弧形分子与8D82+的键合也有类似的现象.
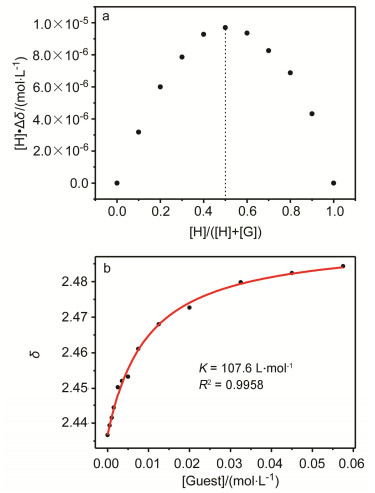
接下来, 从化合物5与8D82+的Job’s曲线可知它们之间络合的化学计量比为1:1 (图 4a).因此, 利用核磁滴定实验, 通过监测化合物5上的质子3的化学位移, 并对其进行非线性拟合, 可以测得其络合常数为107.6 L·mol-1(图 4b).利用相同的方法, 也可以测得其它几种弧形分子与8D82+的络合常数, 结果列于表 1中.
 表 1
通过1H NMR (400 MHz, CD2Cl2, 25 ℃) 滴定测得的络合常数 (主体分子的浓度都为0.5 mmol·L-1)
Table 1.
Binding constants as determined by 1H NMR titration (400 MHz, CD2Cl2, 25 ℃) (the concentrations of the hosts are fixed at 0.5 mmol·L-1)
表 1
通过1H NMR (400 MHz, CD2Cl2, 25 ℃) 滴定测得的络合常数 (主体分子的浓度都为0.5 mmol·L-1)
Table 1.
Binding constants as determined by 1H NMR titration (400 MHz, CD2Cl2, 25 ℃) (the concentrations of the hosts are fixed at 0.5 mmol·L-1)
Compd. Ka/(L·mol-1) 1 50.0±3.0 2 85.0±5.1 3 82.0±4.9 4 82.1±5.3 5 107.6±7.5 6 58.2±3.6 7 6.6±0.1 表 1 通过1H NMR (400 MHz, CD2Cl2, 25 ℃) 滴定测得的络合常数 (主体分子的浓度都为0.5 mmol·L-1)
Table 1. Binding constants as determined by 1H NMR titration (400 MHz, CD2Cl2, 25 ℃) (the concentrations of the hosts are fixed at 0.5 mmol·L-1)从表中可以看出, 化合物2和3的络合常数都高于80 L·mol-1, 比1的50.0 L·mol-1大; 5的络合常数高达107.6 L·mol-1, 大于4的82.1 L·mol-1; 6的络合常数与1相近, 而7最小.这些结果能够通过结合图 2a的静电势能表面得到解释:化合物2比1增加了给电子的乙氧基取代基, 使它更加的富电子, 与阳离子客体的相互作用增强; 3的侧壁在1的基础上多了一个苯环, 使其富电子表面增大, 从而与阳离子客体相互作用的弧形面积增加; 4的结构与1完全不同, 但它的静电势能表面的富电子区域面积更大, 导致与阳离子客体的作用增强; 同样, 化合物5比4多了给电子的甲氧基, 增强了空腔内的富电性.它与8D82+的主客体复合物的模拟结构能够看到明显的CH-π相互作用 (图 5); 6的结构是1和4的结合, 所以络合常数介于两者之间; 化合物7中间的桥太小, 导致两个萘环平面二面角变大, 而富电性没有增加, 因此与阳离子的络合能力最小.
2 结论
我们通过简单的方法合成了6种具有一定弧度的刚性分子.并且通过1H NMR滴定的方法测定了它们与有机阳离子客体的络合能力.这些新型的弧形分子大部分比已有的大环基元1具有更好的络合能力.而且其弧形的骨架结构是很好的大环受体的构筑基元.在未来的研究中, 我们将利用这些新型的弧形分子构建萘基大环受体, 进一步丰富大环受体的工具箱.
3 实验部分
3.1 仪器与试剂
薄层色谱 (TLC) 在0.25 mm烟台硅胶板 (60F-254) 上进行.柱色谱在硅胶60(青岛40~63 nm, 230~400目) 上进行. 1H NMR和13C NMR采用Bruker Avance 400 MHz核磁共振波谱仪测定.高分辨质谱用Applied Biosystems Elite ESI-QqTOF质谱仪测定. 2-蒽酚是根据文献[15]方法合成. 7a, 14c-二氢萘并[2, 1-b]萘并[1', 2':4, 5]呋喃并[3, 2-d]呋喃 (7) 是已知化合物[16], 这里以本文的方法重新合成.其它试剂均为分析纯商品化试剂.
3.2 实验方法
3.2.2 19H-9, 19-甲基二蒽并[2, 1-d:1', 2'-g][1,3]二氧环辛烷 (3) 的合成
使用与化合物2相同的合成方法, 以2-蒽酚和丙二缩醛为原料得到白色固体3, 产率36%. m.p. 298~299 ℃; 1H NMR (400 MHz, CDCl3) δ: 9.38 (s, 2H), 8.31 (s, 2H), 8.14 (d, J=8.5 Hz, 2H), 7.93 (d, J=8.4 Hz, 2H), 7.80 (d, J=9.1 Hz, 2H), 7.52 (ddd, J=8.3, 6.6, 1.2 Hz, 2H), 7.42 (ddd, J=8.0, 6.6, 1.2 Hz, 2H), 7.23 (d, J=9.1 Hz, 2H), 6.42 (q, J=2.0 Hz, 1H), 5.71 (s, 1H), 2.62 (dd, J=3.2, 2.1 Hz, 2H); 13C NMR (101 MHz, CDCl3) δ: 149.91, 131.94, 130.10, 129.98, 129.13, 128.97, 128.10, 127.91, 127.34, 126.14, 124.96, 121.35, 119.74, 117.16, 91.88, 29.87, 27.07; ESI-TOF-HRMS calcd for C31H21O2 [M+H]+ 425.1536, found 425.1530.
3.2.3 7H-7, 15-甲基二萘并[1, 2-d:2', 1'-g][1,3]二氧环辛烷 (4) 的合成
使用与化合物2相同的合成方法, 以1-萘酚和丙二缩醛为原料得到白色固体4, 产率26%. m.p. 204~205 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.27~8.21 (m, 2H), 7.74~7.68 (m, 2H), 7.46~7.42 (m, 2H), 7.42~7.39 (m, 2H), 7.37 (d, J=2.0 Hz, 4H), 6.63 (p, J=2.1 Hz, 1H), 4.18 (td, J=2.9, 1.6 Hz, 1H), 2.47 (dd, J=3.0, 2.1 Hz, 2H); 13C NMR (101 MHz, CDCl3) δ: 146.48, 133.64, 127.62, 126.06, 125.68, 125.49, 124.66, 121.85, 121.08, 121.05, 92.69, 32.00, 26.00; ESI-TOF-HRMS calcd for C23H17O2 [M+H]+ 325.1229, found 325.1222.
3.2.1 6, 10-二乙氧基-16H-8, 16-甲基二萘并[2, 1-d:1', 2'-g][1,3]二氧环辛烷 (2) 的合成
向装有3-乙氧基-2-萘酚 (2.00 g, 10.6 mmol) 的圆底烧瓶中加入18.0 mL三氟乙酸/四氢呋喃 (V:V=2:1) 的混合溶剂.在搅拌下用注射器将丙二缩醛 (0.87 mL, 5.3 mmol) 逐滴加入上述溶液中, 时间约为10 min.所得的混合物在常温下继续搅拌3 h后, 向其加入饱和的NaHCO3水溶液, 调pH=7, 淬灭反应.之后用二氯甲烷 (10 mL×3) 萃取.分离有机相并用无水硫酸钠干燥, 旋蒸除去溶剂, 得到粗产物.最后用柱层析[SiO2, V(石油醚):V(二氯甲烷)=6:1]分离得到1.18 g棕色固体2, 产率54%. m.p. 250~251 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.55 (d, J=8.5 Hz, 2H), 7.63 (dd, J=8.1, 1.2 Hz, 2H), 7.45 (ddd, J=8.3, 6.9, 1.3 Hz, 2H), 7.32 (dd, J=8.1, 6.9 Hz, 2H), 7.02 (s, 2H), 6.58 (t, J=1.8 Hz, 1H), 5.41 (q, J=2.7 Hz, 1H), 4.33~4.09 (m, 4H), 2.46 (t, J=2.6 Hz, 2H), 1.56 (t, J=7.0 Hz, 6H); 13C NMR (101 MHz, CDCl3) δ: 148.03, 142.67, 130.04, 127.48, 126.27, 124.14, 124.00, 122.78, 119.81, 107.05, 91.54, 64.28, 26.54, 22.96, 14.81; ESI-TOF-HRMS calcd for C27H25O4 [M+H]+ 413.1743, found 413.1744.
3.2.4 3, 11-二甲氧基-7H-7, 15-甲基二萘并[1, 2-d:2', 1'-g][1,3]二氧环辛烷 (5) 的合成
使用与化合物2相同的合成方法, 以6-甲氧基-1-萘酚和丙二缩醛为原料得到白色固体5, 产率8%. m.p. 251~252 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.14 (d, J=9.2 Hz, 2H), 7.31 (d, J=8.4 Hz, 2H), 7.27 (s, 4H), 7.09 (dd, J=9.2, 2.5 Hz, 2H), 7.01 (d, J=2.5 Hz, 2H), 6.58 (q, J=2.0 Hz, 1H), 4.11 (q, J=2.8 Hz, 1H), 3.87 (s, 6H), 2.45~2.41 (m, 2H); 13C NMR (101 MHz, CDCl3) δ: 157.90, 146.61, 135.00, 126.17, 123.53, 119.90, 119.41, 118.12, 105.92, 92.75, 55.38, 31.65, 29.86, 26.26; ESI-TOF-HRMS calcd for C25H21O4 [M+H]+ 385.1434, found 385.1430.
3.2.6 7a, 14c-二氢萘并[2, 1-b]萘并[1', 2':4, 5]呋喃并[3, 2-d]呋喃 (7) 的合成
使用与化合物2相同的合成方法, 以2-萘酚和乙二醛为原料得到白色固体7[16], 产率71%. m.p. 227~229 ℃; 1H NMR (400 MHz, CD2Cl2) δ: 8.31 (d, J=8.4 Hz, 2H), 7.83 (dd, J=8.3, 1.1 Hz, 2H), 7.77 (d, J=8.8 Hz, 2H), 7.54 (ddd, J=8.3, 6.9, 1.3 Hz, 2H), 7.35 (s, 2H), 7.23 (d, J=8.8 Hz, 2H), 7.13 (d, J=5.9 Hz, 1H), 5.64 (d, J=6.0 Hz, 1H); 13C NMR (101 MHz, CDCl3) δ: 156.61, 130.87, 130.61, 130.43, 129.43, 127.09, 123.79, 123.51, 118.81, 115.10, 112.42, 49.72; ESI-TOF-HRMS calcd for C22H15O2 [M+H]+ 311.1067, found 311.1063.
辅助材料 (Supporting Information) 化合物的1H NMR, 13C NMR谱、高分辨质谱、单晶结构数据、主客体1:1 1H NMR谱、络合常数1H NMR滴定谱图及络合曲线.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.5 14H-6, 14-甲基二萘并[1, 2-d:1', 2'-g][1,3]二氧环辛烷 (6) 的合成
使用与化合物2相同的合成方法, 以1-萘酚、2-萘酚和丙二缩醛为原料得到白色固体6, 产率10%. m.p. 196~197 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.41 (d, J=8.5 Hz, 1H), 8.25 (ddd, J=8.3, 1.6, 0.8 Hz, 1H), 7.76 (dt, J=8.1, 0.8 Hz, 1H), 7.71~7.68 (m, 1H), 7.66~7.55 (m, 3H), 7.48~7.32 (m, 4H), 7.16 (d, J=8.9 Hz, 1H), 6.49 (d, J=1.8 Hz, 1H), 4.88 (d, J=1.8 Hz, 1H), 2.53~2.37 (m, 2H); 13C NMR (101 MHz, CDCl3) δ: 149.09, 146.89, 133.44, 131.01, 129.74, 129.02, 128.25, 127.56, 126.87, 126.15, 125.71, 125.57, 124.66, 123.76, 121.84, 120.81, 120.39, 119.26, 118.45, 92.13, 29.86, 26.20, 25.91; ESI-TOF-HRMS calcd for C23H17O2 [M+H]+ 325.1223, found 325.1220.
-
-
[1]
(a) Tian, J.; Chen, L.; Zhang, D. W.; Liu, Y.; Li, Z. T. Chem. Commun. 2016, 52, 6351.
(b) Chi, X.; Yu, G.; Shao, L.; Chen, J.; Huang, F. J. Am. Chem. Soc. 2016, 138, 3168.
(c) Gao, B.; Tan, L. L.; Song, N.; Li, K.; Yang, Y. W. Chem. Commun. 2016, 52, 5804.
(d) Zhang, W.; Zhang, Y. M.; Li, S. H.; Cui, Y. L.; Yu, J.; Liu, Y. Angew. Chem., Int. Ed. 2016, 128, 11624.
(e) Ma, J.; Meng, Q.; Hu, X.; Li, B.; Ma, S.; Hu, B.; Li, C. Org. Lett. 2016, 18, 5740.
(f) Chen, H.; Fan, J.; Hu, X.; Ma, J.; Wang, S.; Li, J.; Li, C. Chem. Sci. 2015, 6, 197.
(g) Wang, X.; Han, K.; Li, J.; Jia, X.; Li, C. Polym. Chem. 2013, 4, 3998.
(h) Wang, Y.; Ping, G.; Li, C. Chem. Commun. 2016, 52, 9858. -
[2]
(a) Zhou, C. E.; Zhao, Z. G.; Tang, X. L. Chin. J. Org. Chem. 2007, 27, 513 (in Chinese).
(周彩娥, 赵志刚, 唐晓丽, 有机化学, 2007, 27, 513.)
(b) Peng, Y.; Mou, Q. M.; Yang, Z. X.; Chen, S. H. Chin. J. Org. Chem. 2004, 24, 399 (in Chinese).
(彭游, 牟其明, 杨祖幸, 陈淑华, 有机化学, 2004, 24, 399.) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract325770.shtml -
[3]
(a) Rebek, J. Science 1987, 235, 1478.
(b) Rebek, J. Pure Appl. Chem. 1989, 61, 1517. -
[4]
Harmata, M. Acc. Chem. Res. 2004, 37, 862. doi: 10.1021/ar030164v
-
[5]
Dolenský, B.; Havlík, M.; Král, V. Chem. Soc. Rev. 2012, 41, 3839. doi: 10.1039/c2cs15307f
-
[6]
(a) Han, T.; Chen, C. F. Org. Lett. 2006, 8, 1069.
(b) Chen, C. F. Chem. Commun. 2011, 47, 1674.
(c) Jiang, Y.; Chen, C. F. Eur. J. Org. Chem. 2011, 32, 6377.
(d) Meng, Z.; Han, Y.; Wang, L. N.; Xiang, J. F.; He, S. G.; Chen, C. F. J. Am. Chem. Soc. 2015, 137, 9739. -
[7]
Yang, L. P.; Liu, W. E.; Jiang, W. Tetrahedron Lett. 2016, 57, 3978. doi: 10.1016/j.tetlet.2016.07.077
-
[8]
(a) Jia, F.; He, Z.; Yang, L. P.; Pan, Z. S.; Yi, M.; Jiang, R. W.; Jiang, W. Chem. Sci. 2015, 6, 6731.
(b) Jia, F.; Wang, H. Y.; Li, D. H.; Yang, L. P.; Jiang, W. Chem. Commun. 2016, 52, 5666.
(c) Jia, F.; Li, D. H.; Yang, T. L.; Yang, L. Pan.; Dang, L.; Jiang, W. Chem. Commun. 2017, 53, 336.
(d) Yang, L. P.; Jia, F.; Zhou, Q. H.; Pan, F.; Sun, J. N.; Rissanen, K.; Chung, L. W.; Jiang, W. Chem.-Eur. J. 2017, 23, 1516. -
[9]
He, Z.; Yang, X.; Jiang, W. Org. Lett. 2015, 17, 3880. doi: 10.1021/acs.orglett.5b01871
-
[10]
(a) He, Z.; Ye, G.; Jiang, W. Chem. Eur. J. 2015, 21, 3005.
(b) Huang, G. B.; Jiang, W. Prog. Chem. 2015, 27, 744 (in Chinese).
(黄国宝, 蒋伟, 化学进展, 2015, 27, 744.) -
[11]
(a) Huang, G.; He, Z.; Cai, C. X.; Pan, F.; Yang, D.; Rissanen, K.; Jiang, W. Chem. Commun. 2015, 51, 15490.
(b) Huang, G.; Valkonen, A.; Rissanen, K.; Jiang, W. Chem. Commun. 2016, 52, 9078. -
[12]
Huang, G. B.; Wang, S. H.; Ke, H.; Yang, L. P.; Jiang, W. J. Am. Chem. Soc. 2016, 138, 14550. doi: 10.1021/jacs.6b09472
-
[13]
Van Allan, J. A.; Giannini, D. D.; Whitesides, T. H. J. Am. Chem. Soc. 1982, 47, 820.
-
[14]
Shorthill, B. J.; Avetta, C. T.; Glass, T. E. J. Am. Chem. Soc. 2004, 126, 12732. doi: 10.1021/ja047639d
-
[15]
Geiseler, O.; Müller, M.; Podlech, J. Tetrahedron 2013, 69, 3683. doi: 10.1016/j.tet.2013.03.013
-
[16]
Kito, T.; Yoshinaga, K.; Yamaye, M.; Mizobe, H. J. Org. Chem. 1991, 56, 3336. doi: 10.1021/jo00010a029
-
[1]
-
图 2 (a) 化合物5的单晶结构、(b) 化合物1~7能量最优化结构的二面角及 (c) 化合物1~7的理论计算静电势能表面
Figure 2 (a) The single crystal structure of compound 5, (b) dihedral angles of energy-minimized structures of compounds 1~7 and (c) electrostatic potential energy surfaces of compounds 1~7 All the computations were performed at the AM1 level of theory by using Spartan'14 (Wavefunction, Inc.)
表 1 通过1H NMR (400 MHz, CD2Cl2, 25 ℃) 滴定测得的络合常数 (主体分子的浓度都为0.5 mmol·L-1)
Table 1. Binding constants as determined by 1H NMR titration (400 MHz, CD2Cl2, 25 ℃) (the concentrations of the hosts are fixed at 0.5 mmol·L-1)
Compd. Ka/(L·mol-1) 1 50.0±3.0 2 85.0±5.1 3 82.0±4.9 4 82.1±5.3 5 107.6±7.5 6 58.2±3.6 7 6.6±0.1 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 9
- 文章访问数: 1322
- HTML全文浏览量: 208


 下载:
下载:




 下载:
下载:

