 图 1
含有苯并[4,5]咪唑并[1, 2-b]吡唑骨架的药物
Figure Figure1.
Selected drugs containing benzo[4,5]imidazo[1, 2-b]-pyrazole framework
图 1
含有苯并[4,5]咪唑并[1, 2-b]吡唑骨架的药物
Figure Figure1.
Selected drugs containing benzo[4,5]imidazo[1, 2-b]-pyrazole framework

Citation: Cui Tao, Li Congxiang, Li Ming, Wen Lirong. Efficient Copper-Catalyzed Coupling Reaction for the Synthesis of Benzo[4, 5]imidazo[1, 2-b]pyrazoles[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1487-1493. doi: 10.6023/cjoc201612029

铜催化偶联反应高效合成苯并[4,5]咪唑并[1,2-b]吡唑衍生物
-
关键词:
- 铜催化
- / C—N偶联反应
- / 杂环烯酮缩胺
- / 苯并[4,5]咪唑并[1,2-b]吡唑衍生物
English
Efficient Copper-Catalyzed Coupling Reaction for the Synthesis of Benzo[4, 5]imidazo[1, 2-b]pyrazoles
-
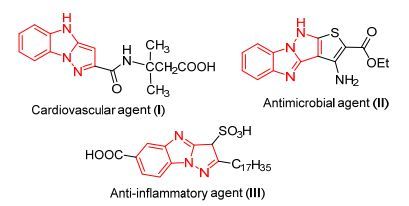
近年来, 探索发展药物的优势结构一直是药物研究的一个重要领域[1].苯并[4,5]咪唑并[1, 2-b]吡唑衍生物是一类重要的三环化合物, 具有良好的生物活性.例如, 化合物Ⅰ是心血管用药[2], 化合物Ⅱ是抗菌药物[3], 化合物Ⅲ可以增强风湿病患者用药的抗炎活性[4](图 1).因此, 建立一种高效、快速合成苯并[4,5]咪唑并[1, 2-b]吡唑衍生物的新方法具有重要意义.
 图 1
含有苯并[4,5]咪唑并[1, 2-b]吡唑骨架的药物
Figure Figure1.
Selected drugs containing benzo[4,5]imidazo[1, 2-b]-pyrazole framework
图 1
含有苯并[4,5]咪唑并[1, 2-b]吡唑骨架的药物
Figure Figure1.
Selected drugs containing benzo[4,5]imidazo[1, 2-b]-pyrazole framework
在过去的几十年里, 由过渡金属催化的交叉偶联反应构建碳-碳、碳-杂键的方法, 已经引起了科研工作者的广泛的关注[5].与钯、镍等过渡金属相比, 铜是一种廉价且低毒的金属, 铜催化的碳-碳和碳-杂偶联反应一直是构建碳-碳、碳-杂化学键的基本方法之一[6]. Buchwald[7]、马大为[8]、Taillefer[9]、Larock[10]、付华[11]和席婵娟[12]等在传统Ullmann反应的复兴中都做出了开创性的工作.他们的主要贡献在于: (1) 使用合适的配体、碱和溶剂, 使该反应在温和的条件下就可以进行; (2) 拓展了该反应形成碳-碳和碳-杂键底物的适用范围以及官能团兼容性.从中可以发现, 合适的配体在改善Ullmann反应产率和提高反应效率中起着重要作用.已被广泛使用的配体有:二胺类化合物[13]、氨基酸[14]、N-羟基酰亚胺[15]、双酮类或联苯酚类[16]、D-葡糖胺及2-吡啶基β-酮[17]等.然而, 探索新型有效的配体用于Cu催化反应仍有很大的空间.
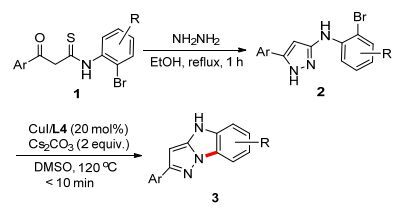
β-芳甲酰基硫代酰胺类化合物(β-Ketothioamides, KTAs)含有多个反应活性中心.并且, 由于其羰基官能团及羰基与双键的共轭效应, 使其成为功能多变的1, 3-亲电子平衡体, 是一类构建杂环化合物的重要合成子[18].杂环烯酮缩胺(Heterocyclic ketene aminals, HKAs), 由于其内在独特和多变的化学性质, 已经被证明是构建杂环化合物的重要中间体[19], 但将其应用于铜催化剂配体的报道只有一例[20]. Junjappa等[21]报道了一种以CuI/L-脯氨酸为催化剂、5-(2-溴苯胺)吡唑类化合物为前体合成苯并[4,5]咪唑并[1, 2-b]吡唑类化合物的方法.然而, 该方法需要在强碱NaH存在下, 以N, N-二甲基甲酰胺(DMF)为溶剂反应0.5~2.5 h.基于我们对KTAs和HKAs的成功应用[20, 22], 报道一种以CuI/杂环烯酮缩胺为催化体系, 在10 min内快速、高效地合成苯并[4,5]咪唑并[1, 2-b]吡唑类衍生物的新方法(Scheme 1).
1 结果与讨论
1.1 反应条件优化
取代的N-(2-溴芳基)-5-芳基-1H-吡唑-3-胺(2)是在参考文献[23]基础上合成的.反应条件的优化以N-(2-溴苯基)-5-苯基-1H-吡唑-3-胺(2a)为模型底物进行, 结果见表 1.
由表 1可见, 不加催化剂, 在K2CO3存在下, 二甲基亚砜(DMSO)溶剂中, 室温或120 ℃下搅拌5 h, 反应均不发生(Table 1, Entries 1, 2).当加入0.2 equiv.的CuCl作为催化剂时, 120 ℃反应2 h, 得到目标产物3a, 产率为42% (Entry 3).令我们高兴的是, 当以CuI (0.2 equiv.)替代CuCl时, 反应1 h, 得产率为56%的3a (Entry 4).确定CuI作为催化剂后, 其它碱被筛选, 如Cs2CO3和NaOH.结果表明, Cs2CO3是最合适的碱(Entries 5, 6).考虑到配体对铜催化反应的重要性, 三种不同类型的配体, 即N, O-, O, O-, N, N-配体, 如L-脯氨酸(L1)、戊烷-2, 4-二酮(L2)和1, 10-菲罗啉(L3)被筛选, 结果都不令人满意(Entries 7~9).然而, 当加入0.2 equiv.的杂环烯酮缩胺类化合物3-(咪唑烷-2-亚基)戊烷-2, 4-二酮(L4)作配体时, 反应在10 min内完成.而且, 3a的产率达到92% (Entry 10).确定了以0.2 equiv.的CuI/L4为催化体系后, 其它溶剂如DMF和二氧六环也被筛选.结果显示, 效果均不如DMSO (Entries 11, 12).接着, 我们对催化剂的用量进行了研究, 结果显示更低的用量(0.15 equiv.)不能有效地促进反应(Entry 13), 而更高的用量(0.3 equiv.)也没有进一步提高3a的产率(Entry 14).最后, 反应温度也被研究, 但降低温度至110 ℃, 产率明显下降(Entry 15).
最终, 确定最优反应条件为: 20 mol% CuI/L4作催化剂, 2.0 equiv.的Cs2CO3作碱, 在DMSO溶剂中, 120 ℃下反应10 min.
1.2 取代基对反应的影响
在上述最佳反应条件下, 我们对各种取代基对反应的影响进行了考察, 结果见表 2.
如表 2所示, 所有反应都进行的很顺利, 在10 min内给出优秀的产率.其中, 底物2中吡唑环上的取代基(R1), 无论是吸电子基团还是供电子基团都给出了优良的产率(3a~3i); 而与吡唑环相连的芳氨基上的取代基(R2), 则显示出给电子基团的产率比吸电子取代基稍低, 这应该是由于吸电子取代基更有利于溴负离子的离去(3j~3q).
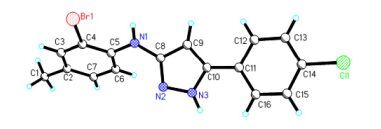
所有新化合物2和3的结构均经IR、1H NMR、13C NMR、HRMS表征, 并通过化合物2o的X射线单晶衍射分析证实(图 2, CCDC882033).
1.3 可能的反应机理
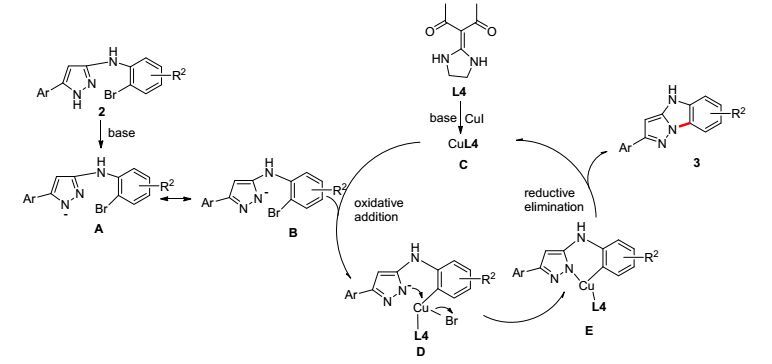
基于以上实验结果和已有文献的报道[25], 我们推测了该反应可能的机理.如Scheme 2所示.首先, 前体2在碱性条件下失去H+形成中间体A, A发生分子内电子转移形成中间体B.同时, 配体L4在碱性条件下与CuI配位形成C.然后C与B发生氧化加成反应形成D.接着中间体D发生分子内配体取代反应形成中间体E.最后, 中间体E发生还原消除反应并释放出C, 得到目标产物3.
2 结论
发展了一种铜催化N-(2-溴芳基)-5-苯基-1H-吡唑-3-胺发生分子内C—N键偶联反应合成苯并[4,5]咪唑并[1, 2-b]吡唑衍生物的新方法.该方法以CuI/杂环烯酮缩胺为催化体系, 在碳酸铯存在下, 在DMSO中, 120 ℃下反应只需10 min, 避免了强碱NaH的使用, 具有操作简单、反应时间短和产率高等优点.
3 实验部分
3.1 仪器与试剂
Nicolet iS10傅立叶变换红外光谱仪, KBr压片; Bruker AC-500型核磁共振仪, TMS为内标, CDCl3或DMSO-d6为溶剂; Bruker Esquire Hct质谱仪, ESI源(电喷雾离子源); EYELA, N-1100型旋转蒸发器(上海爱朗仪器有限公司); DLSB-10/40型低温冷却液循环泵(巩义市予华仪器有限责任公司); RY-1型毛细管显微熔点仪, 天津分析仪器厂, 温度计未校正; 薄层色谱(TLC, Thin layer chromatography)所用硅胶为GF254, 青岛海洋化工厂产品, 紫外254 nm或365 nm观察.所有溶剂和试剂均为分析纯, 使用前未经进一步纯化.
3.2 目标化合物苯并[4,5]咪唑并[1, 2-b]吡唑衍生物(3) 的合成
向50 mL圆底烧瓶中加入底物2 (0.5 mmol)、碘化亚铜(0.1 mmol)、配体L4 (0.1 mmol)、碳酸铯(1 mmol)和DMSO (2 mL), 将其置于120 ℃油浴中搅拌10 min.薄层色谱(TLC)检测反应底物消失, 反应结束.反应体系冷至室温后, 加入5 mL水, 然后用30 mL乙酸乙酯分三次进行萃取.合并有机相, 并用无水MgSO4干燥30 min, 过滤, 滤液用旋转蒸发仪浓缩得粗产物.粗产物通过硅胶柱色谱[洗脱剂V(石油醚):V(乙酸乙酯)=4:1]分离, 利用旋转蒸发仪浓缩得纯净目标产物3.
2-苯基-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3a): 107 mg白色固体, 产率92%. m.p. 251~253 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.93 (s, 1H), 7.92 (s, 1H), 7.90 (s, 1H), 7.88~7.89 (m, 1H), 7.43 (t, J=7.6 Hz, 2H), 7.32~7.35 (m, 2H), 7.27~7.28 (m, 1H), 7.23~7.25 (m, 1H), 6.11 (s, 1H); 13C NMR (CDCl3, 125 MHz) δ: 110.7, 111.4, 121.3, 123.4, 126.1, 128.0, 128.7, 134.2, 134.9, 156.6; IR (KBr) ν: 3069, 2927, 1626, 1595, 1492, 777, 742, 718 cm-1; HRMS (ESI-TOF) calcd for C15H12N3 [M+H]+ 234.1031, found 234.1039.
2-(4-氟苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3b): 108 mg棕色固体, 产率86%. m.p. 229~231 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.52 (s, 1H, NH), 7.94~7.97 (m, 2H), 7.76 (d, J=7.9 Hz, 1H), 7.42 (d, J=8.0 Hz, 1H), 7.23~7.29 (m, 3H), 7.17~7.20 (m, 1H), 6.32 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 80.3, 112.7, 114.9, 118.5 (2JC-F=21.2 Hz), 123.2, 126.3, 128.4, 130.4 (3JC-F=8.5 Hz), 133.8, 138.3, 148.0, 157.1, 164.8 (1JC-F=241.9 Hz); IR (KBr) ν: 3061, 1623, 1581, 1492, 843, 738 cm-1; HRMS (ESI-TOF) calcd for C15H11FN3 [M+H]+ 252.0937, found 252.0939.
2-(4-氯苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3c): 116 mg棕色固体, 产率87%. m.p. 253~254 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.57 (s, 1H, NH), 7.78~7.98 (m, 2H), 7.79 (d, J=10.8 Hz, 1H), 7.47~7.51 (m, 2H), 7.45 (d, J=8.4 Hz, 1H), 7.27~7.32 (m, 1H), 7.19~7.23 (m, 1H), 6.38 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 77.9, 110.2, 112.4, 120.6, 123.9, 125.8, 127.6, 129.0, 132.6, 133.6, 135.8, 145.4, 154.2; IR (KBr) ν: 3067, 1628, 1585, 1491, 1327, 836, 743 cm-1; HRMS (ESI-TOF) calcd for C15H11ClN3 [M+H]+ 268.0642, found 268.0652.
2-(4-溴苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3d): 138 mg红色固体, 产率89%. m.p. 260~261 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.55 (s, 1H, NH), 7.87~7.89 (m, 1H), 7.77 (d, J=7.85 Hz, 1H), 7.60~7.62 (m, 2H), 7.43 (d, J=7.95 Hz, 1H), 7.25~7.30 (m, 1H), 7.18~7.21 (m, 2H), 6.36 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 78.0, 110.2, 112.4, 120.7, 121.1, 123.9, 125.8, 127.9, 131.9, 134.0, 135.8, 145.4, 154.2; IR (KBr) ν: 3061, 1626, 1583, 1490, 833, 743 cm-1; HRMS (ESI-TOF) calcd for C15H11BrN3 [M+H]+ 312.0136, found 312.0142.
2-(对甲苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3e): 111 mg紫色固体, 产率90%. m.p. 265~267 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.49 (s, 1H, NH), 7.80 (d, J=7.8 Hz, 2H), 7.75 (d, J=7.8 Hz, 1H), 7.41 (d, J=7.9 Hz, 1H), 7.17~7.25 (m, 4H), 6.27 (s, 1H), 2.31 (s, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 21.4, 77.6, 110.2, 112.3, 120.6, 123.7, 125.9, 129.7, 135.7, 137.5, 145.4, 155.6; IR (KBr) ν: 3066, 1622, 1595, 1491, 825, 739 cm-1; HRMS (ESI-TOF) calcd for C16H14N3 [M+H]+ 248.1188, found 248.1192.
2-(3-氯苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3f): 123 mg棕色固体, 产率92%. m.p. 255~257 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.56 (s, 1H, NH), 7.93~7.95 (m, 2H), 7.77 (d, J=7.7 Hz, 1H), 7.46~7.48 (m, 2H), 7.43 (d, J=8.7 Hz, 1H), 7.27~7.30 (m, 1H), 7.18~7.21 (m, 1H), 6.36 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 78.1, 110.3, 112.5, 120.8, 124.0, 125.8, 127.6, 129.1, 132.7, 133.6, 135.8, 145.4, 154.2; IR (KBr) ν: 3068, 1629, 1585, 1491, 836, 743 cm-1; HRMS (ESI-TOF) calcd for C15H11ClN3 [M+H]+ 268.0642, found 268.0652.
2-(2-氯苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3g): 115 mg红色固体, 产率86%. m.p. 237~239 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.54(s, 1H, NH), 7.88 (d, J=7.3 Hz, 1H), 7.79 (d, J=7.9 Hz, 1H), 7.54 (d, J=7.7 Hz, 1H), 7.46 (d, J=7.9 Hz, 1H), 7.37~7.43 (m, 2H), 7.30 (t, J=7.7 Hz, 1H), 7.20 (t, J=7.6 Hz, 1H), 6.28 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 81.8, 110.5, 112.6, 120.7, 124.1, 125.7, 127.7, 129.8, 130.8, 131.5, 125.7, 144.6, 152.8; IR (KBr) ν: 3068, 1626, 1593, 1478, 768, 739 cm-1; HRMS (ESI-TOF) calcd for C15H11ClN3 [M+H]+ 268.0642, found 268.0653.
2-(2, 4-二氯苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3h): 131 mg绿色固体, 产率87%. m.p. 231~233 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.59 (s, 1H, NH), 7.92 (d, J=8.5 Hz, 1H), 7.80 (d, J=7.9 Hz, 1H), 7.70~7.72 (m, 1H), 7.50 (dd, J=8.5, 2.0 Hz, 1H), 7.47 (d, J=8 Hz, 1H), 7.31 (t, J=7.5 Hz, 1H), 7.21 (t, J=7.6 Hz, 1H), 6.33 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 81.7, 110.4, 112.6, 120.7, 124.2, 125.7, 127.9, 130.1, 132.2, 133.3, 135.7, 144.7, 151.6; IR (KBr) ν: 3064, 1621, 1594, 1478, 826, 787, 740 cm-1; HRMS (ESI-TOF) calcd for C15H10-Cl2N3 [M+H]+ 302.0252, found 302.0249.
2-(2, 3-二氯苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3i): 136 mg绿色固体, 产率90%. m.p. 231~233 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.63 (s, 1H, NH), 8.14 (d, J=1.7 Hz, 1H), 7.92 (dd, J=8.5, 1.7 Hz, 1H), 7.79 (d, J=7.8 Hz, 1H), 7.66 (d, J=8.4 Hz, 1H), 7.44 (d, J=8.0 Hz, 1H), 7.29 (t, J=7.6 Hz, 1H), 7.20 (t, J=7.6 Hz, 1H), 6.48 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 78.54, 110.4, 112.5, 120.7, 124.1, 125.6, 125.8, 127.3, 130.3, 131.3, 131.2, 135.4, 135.8, 145.4, 152.8; IR (KBr) ν: 3074, 1630, 1608, 1489, 834, 729 cm-1; HRMS (ESI-TOF) calcd for C15H10Cl2N3[M+H]+ 302.0252, found 302.0259.
7-氟-2-(4-氟苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3j): 116 mg紫色固体, 产率86%. m.p. 227~229 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.60 (s, 1H, NH), 7.97~8.00 (m, 2H), 7.70 (dd, J=8.5, 2.3 Hz, 1H), 7.45 (dd, J=8.8, 4.4 Hz, 1H), 7.28 (d, J=8.8 Hz, 2H), 7.16 (td, J=9.6, 2.4 Hz, 1H), 6.36 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 77.9, 97.9 (2JC-F=28.7 Hz), 110.8 (2JC-F=24.8 Hz), 113.0 (3JC-F=8.9 Hz), 113.1, 115.9 (2JC-F=21.4 Hz), 125.8 (3JC-F=12.6 Hz), 128.0 (3JC-F=6.9 Hz), 131.1, 132.3, 146.8, 155.2, 157.3 (1JC-F=235.5 Hz), 162.4 (1JC-F=244.2 Hz); IR (KBr) ν: 3056, 1633, 1600, 1491, 838, 813, 746 cm-1; HRMS (ESI-TOF) calcd for C15H10F2-N3 [M+H]+ 270.0843, found 270.0856.
2-(4-氯苯基)-7-氟-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3k): 128 mg紫色固体, 产率90%. m.p. 256~258 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.62 (s, 1H, NH), 7.94~7.97 (m, 2H), 7.67 (dd, J=8.5, 2.5 Hz, 1H), 7.49~7.51 (m, 2H), 7.43~7.45 (m, 1H), 7.13~7.17 (m, 1H), 6.39 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 78.3, 98.1 (2JC-F=28.8 Hz), 111.1 (2JC-F=24.6 Hz), 113.2 (3JC-F=9.7 Hz), 113.3, 125.9 (3JC-F=13.0 Hz), 127.8, 129.2, 132.4, 132.9, 134.5, 146.8, 154.9, 157.4 (1JC-F=235.7 Hz); IR (KBr) ν: 3065, 1634, 1589, 1491, 835, 805, 742 cm-1; HRMS (ESI-TOF) calcd for C15H10ClFN3[M+H]+ 286.0547, found 286.0553.
2-(4-溴苯基)-7-氟-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3l): 153 mg棕色固体, 产率93%. m.p. 264~265 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.61 (s, 1H, NH), 7.96~7.97 (m, 1H), 7.94~7.95 (m, 1H), 7.69 (dd, J=8.5, 2.0 Hz, 1H), 7.48~7.51 (m, 2H), 7.44 (dd, J=8.9, 4.4 Hz, 1H), 7.13~7.17 (m, 1H), 6.38 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 82.9, 102.7 (2JC-F=28.5 Hz), 115.7 (2JC-F=24.8 Hz), 117.9 (3JC-F=9.5 Hz), 130.5 (3JC-F=7.8 Hz), 132.5, 133.9, 137.1, 137.7, 138.1, 151.5, 159.6, 162.2 (1JC-F=248.5 Hz); IR (KBr) ν: 3064, 1633, 1598, 1493, 830, 804, 748 cm-1; HRMS (ESI-TOF) calcd for C15H10BrFN3 [M+H]+ 330.0042, found 330.0051.
7-氟-2-(对甲苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3m): 128 mg红色固体, 产率96%. m.p. 263~265 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.51 (s, 1H, NH), 7.80 (d, J=7.8 Hz, 2H), 7.60~7.70 (m, 1H), 7.40 (dd, J=8.6, 4.3 Hz, 1H), 7.22 (d, J=7.7 Hz, 2H), 7.09~7.11 (m, 1H), 6.27 (s, 1H), 2.32 (s, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 21.3, 77.6, 97.8 (2JC-F=28.4 Hz), 110.6 (2JC-F=24.9 Hz), 112.9 (3JC-F=11.4 Hz), 125.9, 129.6, 131.8, 132.2, 137.7, 146.7, 156.2, 157.3 (1JC-F=236.7 Hz); IR (KBr) ν: 3066, 1632, 1597, 1489, 834, 824, 740 cm-1; HRMS (ESI-TOF) calcd for C16H13FN3 [M+H]+ 266.1094, found 266.1086.
2-(4-氟苯基)-7-甲基-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3n): 114 mg紫色固体, 产率86%. m.p. 225~227 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.51 (s, 1H, NH), 7.94~7.97 (m, J=4.8 Hz, 2H), 7.60 (s, 1H), 7.23~7.32 (m, 4H), 7.08~7.10 (d, J=8.0 Hz, 2H), 6.29 (s, 1H), 2.44~2.50 (s, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 21.5, 77.7, 111.3 (1JC-F=217.5 Hz), 115.9 (2JC-F=21.4 Hz), 124.7, 126.1, 127.9 (3JC-F=7.4 Hz), 130.1, 131.4, 133.8, 145.7, 154.4, 161.4, 163.3; IR (KBr) ν: 3065, 1632, 1587, 1482, 840, 802, 744 cm-1; HRMS (ESI-TOF) calcd for C16H13F-N3[M+H]+ 266.1094, found 266.1087.
2-(4-氯苯基)-7-甲基-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3o): 124 mg棕色固体, 产率88%. m.p. 248~250 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.42 (s, 1H, NH), 7.95~7.97 (m, 2H), 7.63 (s, 1H), 7.48~7.52 (m, 2H), 7.33 (d, J=8.2 Hz, 2H), 7.12 (d, J=8.3 Hz, 1H), 6.35 (s, 1H), 2.46 (s, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 21.5, 78.0, 110.5, 112.2, 124.9, 126.0, 127.6, 129.2, 160.2, 132.6, 133.7, 133.8, 145.7, 154.11; IR (KBr) ν: 3068, 1632, 1600, 1485, 1399, 853, 830, 739 cm-1; HRMS (ESI-TOF) calcd for C16H13ClN3[M+H]+ 282.0798, found 282.0786.
2-(4-溴苯基)-7-甲基-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3p): 140 mg红色固体, 产率86%. m.p. 247~249 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.39 (s, 1H, NH), 7.84~7.89 (m, 2H), 7.58~7.62 (m, 3H), 7.30 (d, J=8.1 Hz, 1H), 7.10 (d, J=8.1 Hz, 1H), 6.32 (s, 1H), 2.44 (s, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 21.4, 77.9, 110.5, 112.1, 121.2, 124.9, 126.0, 127.9, 130.2, 132.1, 133.9, 134.1, 145.7, 154.1; IR (KBr) ν: 3068, 1611, 1498, 1385, 844, 828, 748 cm-1; HRMS (ESI-TOF) calcd for C16H13Br-N3[M+H]+ 326.0293, found 326.0285.
7-甲基-2-(对甲苯基)-4H-苯并[4,5]咪唑[1, 2-b]吡唑(3q): 119 mg红色固体, 产率91%. m.p. 216~218 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.31 (s, 1H, NH), 7.80 (d, J=7.9 Hz, 2H), 7.58 (s, 1H), 7.29 (d, J=8.2 Hz, 1H), 7.22 (d, J=7.9 Hz, 2H), 7.07 (d, J=8.1 Hz, 1H), 6.23 (s, 1H), 2.43 (s, 3H), 2.32 (s, 3H); 13C NMR (DMSO-d6, 125 MHz) δ: 21.3, 21.5, 77.4, 110.3, 112.0, 124.5, 125.8, 126.2, 129.6, 132.1, 133.8, 137.4, 145.7, 155.4; IR (KBr) ν: 3031, 2918, 1608, 1476, 1408, 1385, 825, 800, 752 cm-1; HRMS (ESI-TOF) calcd for C17H16N3[M+H]+ 262.1344, found 262.1352.
辅助材料(Supporting Information) 所有新化合物2和3的1H NMR、13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Douglas, A. H.; Gregory, T. B.; Mark, L. S. Chem. Rev. 2003, 103, 893. doi: 10.1021/cr020033s
-
[2]
(a) Sadowski, S.; Ruf, T.; Wirth, K.; Schreuder, H.; Buning, C. WO 2014053533, 2014[Chem. Abstr. 2014, 160, 567598].
(b) Ruf, S.; Sadowski, T.; Horstick, G.; Schreuder, H.; Buning, C.; Olpp, T.; Wirth, K. WO 2012101199, 2012 [Chem. Abstr. 2012, 157, 295144]. -
[3]
Wardakhan, W. W. Phosphorus, Sulfur Silicon Relat. Elem. 2006, 181, 2051. doi: 10.1080/10426500600605749
-
[4]
Van Gelder, J. M.; Basel, Y.; Kraiz, B. O.; Mouallem, O.; Miron, D.; Gur-Arie, N.; Klein, J. WO 2005074375, 2005 [Chem. Abstr. 2005, 143, 229556].
-
[5]
(a) Shang, X. -J. ; Liu, Z. -Q. Chin. J. Org. Chem. 2015, 35, 522 (in Chinese).
(尚筱洁, 刘忠全, 有机化学, 2015, 35, 522. )
(b) Zhang, W. -M. ; Dai, J. -J. ; Xu, H. -J. Chin. J. Org. Chem. 2015, 35, 1820 (in Chinese).
(张文曼, 戴建军, 许华建, 有机化学, 2015, 35, 1820. ) -
[6]
(a) Ma, D. -W. ; Cai, Q. -A. Acc. Chem. Res. 2008, 41, 1450.
(b) Bi, H. -P. ; Zhao, L. ; Liang, Y. -M. ; Li, C. -J. Angew. Chem. , Int. Ed. 2009, 48, 792.
(c) Liao, Q. ; Xi, C. -J. Chin. J. Org. Chem. 2012, 32, 986 (in Chinese).
(廖骞, 席婵娟, 有机化学, 2012, 32, 986. )
(d) Zhang, J. -X. ; Yin, H. -Q. ; Han, S. -Q. Chin. J. Org. Chem. 2012, 32, 1429 (in Chinese).
(张敬先, 殷慧清, 韩世清, 有机化学, 2012, 32, 1429. )
(e) Huang, A. P. ; Chen, Y. M. ; Ma, C. Org. Lett. 2013, 21, 5480.
(f) Liu, Y. -Y. ; Wan, J. -P. Org. Biomol. Chem. 2011, 9, 6873. -
[7]
(a) Zheng, N.; Buchwald, S. L. Org. Lett. 2007, 9, 4749.
(b) Brasche, G.; Buchwald, S. L. Angew. Chem., Int. Ed. 2008, 47, 1932. -
[8]
(a) Zou, B.-L.; Yuan, Q.-L.; Ma, D.-W. Angew. Chem., Int. Ed. 2007, 46, 2598.
(b) Zhu, S.-L.; Yu, S.-Y.; Ma, D.-W. Angew. Chem., Int. Ed. 2008, 47, 545. -
[9]
Monnier, F.; Taillefer, M. Angew. Chem., Int. Ed. 2009, 48, 6954. doi: 10.1002/anie.v48:38
-
[10]
Verma, A. K.; Kesharwani, T.; Singh, J.; Tandon, V.; Larock, R. C. Angew. Chem., Int. Ed. 2009, 48, 1138. doi: 10.1002/anie.v48:6
-
[11]
(a) Rao, H.-H.; Fu, H.; Jiang, Y.-Y.; Zhao, Y.-F. Angew. Chem., Int. Ed. 2009, 48, 1114.
(b) Wang, F.; Liu, H.-X.; Fu, H.; Jiang, Y.-Y.; Zhao, Y.-F. Org. Lett. 2009, 11, 2469. -
[12]
(a) You, W.; Yan, X.-Y.; Liao, Q.; Xi, C.-J. Org. Lett. 2010, 12, 3930.
(b) Liao, Q.; Zhang, L.-Y.; Li, S.-T.; Xi, C.-J. Org. Lett. 2010, 13, 228. -
[13]
Liao, Q.; Wang, Y.-X.; Zhang, L.-Y.; Xi, C.-J. J. Org. Chem. 2009, 74, 6371. doi: 10.1021/jo901105r
-
[14]
Chen, Y.; Wang, Y.-J.; Sun, Z.-M.; Ma, D.-W. Org. Lett. 2008, 10, 625. doi: 10.1021/ol7029382
-
[15]
Yang, K.; Qiu, Y.-T.; Li, Z.; Wang, Z.-Y.; Jiang, S. J. Org. Chem. 2011, 76, 3151. doi: 10.1021/jo1026035
-
[16]
Xie, Y.-X.; Pi, S.-F.; Wang, J.; Yin, D.-L.; Li, J.-H. J. Org. Chem. 2006, 71, 8324. doi: 10.1021/jo061572q
-
[17]
Wang, D.-P.; Ding, K. Chem. Commun. 2009, 1891.
-
[18]
(a) Guo, W.-S.; Wen, L.-R.; Li, M. Org. Biomol. Chem. 2015, 13, 1942.
(b) Kumar, S.; Ila, H.; Junjappa, H. J. Org. Chem. 2009, 74, 7046.
(c) Zhao, Y.-L.; Zhang, W.; Wang, S.; Liu, Q. J. Org. Chem. 2007, 72, 4985.
(d) Wen, L.-R.; Sun, J.-H.; Li, M.; Sun, E.-T.; Zhang, S.-S. J. Org. Chem. 2008, 73, 1852. -
[19]
(a) Wang, K.-M.; Yan, S.-J.; Lin, J. Eur. J. Org. Chem. 2014, 1129.
(b) Yu, F.-C.; Yan, S.-J.; Hu, L.; Wang, Y.-C.; Lin, J. Org. Lett. 2011, 13, 4782.
(c) Wen, L.-R.; Li, Z.-R.; Li, M.; Cao, H. Green Chem. 2012, 14, 707. -
[20]
Wen, L.-R.; Jin, X.-J.; Niu, X.-D.; Li, M. J. Org. Chem. 2015, 80, 90. doi: 10.1021/jo5020323
-
[21]
Kumar, S.; Ila, H.; Junjappa, H. J. Org. Chem. 2009, 74, 7046. doi: 10.1021/jo901309t
-
[22]
(a) Li, M.; Cao, H.; Wang, Y.; Lv, X.-L.; Wen, L.-R. Org. Lett. 2012, 14, 3470.
(b) Wen, L.-R.; Men, L.-B.; He, T.; Ji, G.-J.; Li, M. Chem.-Eur. J. 2014, 20, 5028.
(c) Wen, L.-R.; Man, N.-N.; Yuan, W.-K.; Li. M. J. Org. Chem. 2016, 81, 5942.
(d) Li, M.; Kong, X.-J.; Wen, L.-R. J. Org. Chem. 2015, 80, 11999.
(e) Wen, L.-R.; Yuan, W.-K.; Li, M. J. Org. Chem. 2015, 80, 4942. -
[23]
Peruncheralathan, S.; Khan, T. A.; Ila, H.; Junjappa, H. J. Org. Chem. 2005, 70, 10030. doi: 10.1021/jo051771u
-
[24]
Kuz'menko, T. A.; Divaeva, L. N.; Morkovnik, A. S. Russ. Chem. Bull. Int. Ed. 2011, 60, 548. doi: 10.1007/s11172-011-0085-z
-
[25]
(a) Lou, Z.-B.; Zhang, S.; Chen, C.; Pang, X.-L.; Li, M.; Wen, L.-R. Adv. Synth. Catal. 2014, 356, 153.
(b) Hoover, J. M.; Ryland, B. L.; Stahl, S. S. J. Am. Chem. Soc. 2013, 135, 2357.
(c) Wang, Y.; Chen, C.; Peng, J.; Li, M. Angew. Chem., Int. Ed. 2013, 52, 5323.
(d) Zhu, S.-L.; Niljianskul, N.; Buchwald, S. L. J. Am. Chem. Soc. 2013, 135, 15746.
(e) Yao, C.-S.; Wang, D.-L.; Lu, J.; Li, T.-J.; Jiao, W.-H.; Yu, C.-X. Chem.-Eur. J. 2012, 18, 1914.
(f) Zeng, X.; Huang, W.-M.; Qiu, Y.-T.; Jiang, S. Org. Biomol. Chem. 2011, 9, 8224.
-
[1]
-
表 1 反应条件优化a
Table 1. Optimization of reaction conditions

表 2 取代基对反应的影响a
Table 2. Effect of the substituents on the reactions

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1973
- HTML全文浏览量: 763


 下载:
下载:



 下载:
下载:

