 图 1
具有增殖抑制活性的α, β不饱和δ内酯类天然产物
Figure 1.
α, β-Unsaturated δ-lactone natural compounds with antiproliferative activity
图 1
具有增殖抑制活性的α, β不饱和δ内酯类天然产物
Figure 1.
α, β-Unsaturated δ-lactone natural compounds with antiproliferative activity

Citation: Xu Haiwei, Jia Shilong, Xie Xiaoping, Luo Jiao, Wang Shu. Design, Synthesis and Anti-proliferative Activity of Novel 5, 6-Dihydro-6-alkyl-2-pyrone Analogues[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 902-907. doi: 10.6023/cjoc201612007

新型5, 6-二氢-6-烷基吡喃酮类衍生物的设计、合成及肿瘤细胞增殖抑制活性研究
-
关键词:
- α, β不饱和δ内酯
- / 合成
- / 肿瘤
- / 抑制活性
English
Design, Synthesis and Anti-proliferative Activity of Novel 5, 6-Dihydro-6-alkyl-2-pyrone Analogues
-
Key words:
- α, β-unsaturated δ-lactone
- / synthesis
- / cancer
- / antiproliferative activity
-
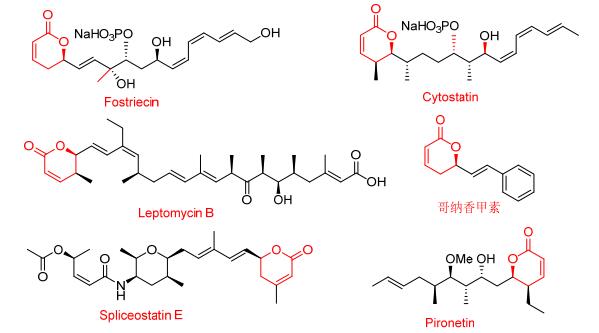
α, β-不饱和-δ-内酯是一类重要的天然产物, 如福司曲星 (Fostriecin)[1, 2]、哥纳香甲素 (Goniothalamin)[3]、Cytostatin[2]、Leptomicin B[4]、Anguinomycin[2]、Pironetin[5~10]等 (图 1).该类化合物具有广泛的生物活性, 包括细胞增殖抑制活性、免疫抑制活性、不同酶抑制活性、特殊磷酸蛋白的抑制活性.它们的共同特征是都具有一个α, β不饱和δ内酯结构, 在体内与氨基或者巯基发生Micheal加成, 形成共价键[4, 8], 在发挥作用的同时, 也表现出了很强的毒性.有研究表明, 包含有甲基取代的Spliceostatin E (图 1), 在体内不会发生Micheal加成反应, 但是其仍然保持着对N87(胃癌细胞)、BT474(乳腺癌细胞) 良好的细胞增殖抑制活性.但是, α, β-不饱和-δ-内酯双键上修饰的研究报道较少[11, 12].
 图 1
具有增殖抑制活性的α, β不饱和δ内酯类天然产物
Figure 1.
α, β-Unsaturated δ-lactone natural compounds with antiproliferative activity
图 1
具有增殖抑制活性的α, β不饱和δ内酯类天然产物
Figure 1.
α, β-Unsaturated δ-lactone natural compounds with antiproliferative activity
上述研究结果提示, 在吡喃环不饱和结构上引入取代基团, 有可能降低该类化合物的毒性, 而保持其原有生物活性.因此, 本文以哥纳香甲素基本骨架为基础, 首先参考文献设计合成了哥纳香甲素类似物1, 其具有与哥纳香甲素相当的肿瘤细胞增殖抑制活性.在此基础上, 设计合成一系列未见文献报道的5, 6-二氢-6-烷基吡喃酮类化合物5, 6和8 (Scheme 1), 利用噻唑蓝 (MTT) 法评价了目标化合物对人肝癌细胞 (7721)、人肺癌细胞 (A549)、人食管癌细胞 (EC-109)、人胃癌细胞 (MGC-803) 的细胞增殖抑制活性.研究吡喃酮结构中不饱和双键的修饰对该类化合物生物活性的影响.
1 结果与讨论
1.1 目标化合物的合成
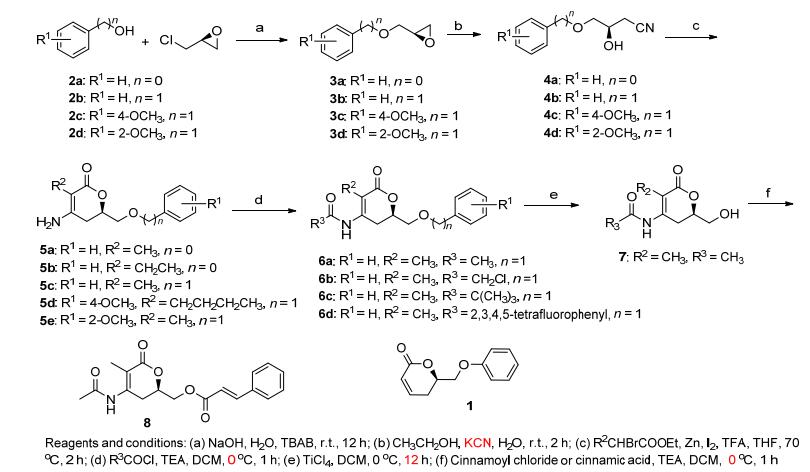
天然的吡喃环结构中, 手性碳的构型为R型[13], 因此, 我们选择了用S构型环氧氯丙烷合成R构型的目标化合物, 合成路线见Scheme 1.以化合物2为起始原料, 通过取代、开环、blaise关环反应、脱苄基、酰化合成10个新型5, 6-二氢-6-烷基-2-吡喃酮衍生物, 结构经过1 H NMR, 13C NMR和HRMS的确证.
在目标化合物合成过程中, Blaise关环和脱苄基是关键的两步反应.对于Blaise关环反应[14~16], 大部分文献报道, 在活化的锌粉作用下, 即能发生反应, 但是该条件不适于我们的底物, 未能获得目标化合物.通过大量实验探索发现, 碘粒可以活化α-溴丙酸乙酯, 使反应能顺利地进行获得目标化合物.通常情况下Blaise关环反应的产物为羟基产物, 但是在该条件下先得到的是氨基产物.以化合物6a为例, 其1H NMR中, 在δ 7.8有酰胺氢的宽信号峰, 同时其HRMS分析表明其分子量为290.1393, 分子式为C16H20NO4 [M+H]+.
脱苄基反应, 尝试了Pd/C加氢[17, 18], 发现化合物6双键易被还原, 且产率较低.于是分别筛选了无水三氯化铁[19]和四氯化钛等路易斯酸催化脱苄基.结果发现用四氯化钛[20, 21]催化搅拌过夜, 可以得到目标化合物.
哥纳香甲素类似物1的合成参照文献方法合成[2].
1.2 目标化合物的肿瘤细胞增殖抑制活性研究
以五氟尿嘧啶和化合物1为对照, 采用MTT法, 对所合成目标化合物的肿瘤细胞增殖抑制活性进行了评价.结果表明, 大部分化合物的活性明显降低, 甚至消失 (表 1).其中化合物6d对人肝癌细胞 (7721)、肺癌细胞 (A549)、食管癌细胞 (EC-109)、胃癌细胞 (MGC-803) 的IC50值分别达到11、19、37、13 μmol/L, 表现出了与阳性对照相当的活性.上述结果表明, α, β不饱和δ内酯双键对此类化合物的细胞增殖抑制活性起着至关重要的作用, 其不饱和双键的修饰能够明显影响目标化合物的活性.同时化合物6d表现出的肿瘤细胞增殖活性表明, 通过适当的修饰也可以保留对肿瘤细胞的增殖抑制活性, 而不形成共价键, 避免不可逆的毒性.
Compd. IC50/(μmol•L-1) 7721 A549 EC-109 MGC-803 5a >128 >128 >128 >128 5b >128 >128 >128 >128 5c >128 >128 >128 >128 5d >128 >128 >128 >128 5e >128 >128 >128 >128 6a >128 >128 >128 >128 6b >128 >128 >128 >128 6c >128 >128 >128 28±2 6d 11±1 19±1 37±2 13±1 8 >128 >128 >128 >128 1 14±1 3±1 20±1 2±1 5-Fu 14±1 4±1 2±1 7±1 a Do not calculate IC50 value which is bigger than 128 μmol•L-1. 表 1 目标化合物体外抗肿瘤活性a
Table 1. Antiproliferative activity of target compound2 结论
本文以哥纳香甲素为参照, 结合α, β不饱和δ内酯环与受体的作用机理, 设计并合成了10个新型的5, 6-二氢-6-烷基吡喃酮衍生物.通过体外细胞殖活性评价研究发现, 对α, β不饱和δ内酯双键适当地修饰, 可以保留对肿瘤细胞的增殖抑制活性, 而不形成共价键, 避免不可逆的毒性.上述结果为后期继续研究新型5, 6-二氢-6-烷基-吡喃酮类抗肿瘤药奠定了良好的基础.
3 实验部分
3.1 仪器与试剂
瑞典Bruker DPX-400超导核磁共振仪; Q-Tof Mico TM质谱仪 (Waters Micromass公司); Thermo Varioskan Flash全波长多功能酶标仪等主要仪器.
合成目标化合物所用原料均为市售分析纯, 必要时做常规处理; 用于分离纯化的试剂为重蒸的工业试剂.
3.2 化合物的合成
3.3 抗肿瘤活性实验
利用MTT法对10个目标化合物进行抗肿瘤活性评价, 评价细胞有人肺癌细胞A549、人胃癌细胞MGC-803、人肝癌细胞7721、人食管癌细胞EC-109.
利用酶消化液处理处于对数生长期的肿瘤细胞, 快速离心, 取出细胞, 加入定量的含有10%胎牛血清的RPM1 1640培养基配成细胞混悬液.置于96孔板中, 每孔200 μL, 含4×103~5×103个, 在37 ℃, 5% CO2恒温箱中培养24 h, 用9个梯度浓度的目标化合物处理, 在上述培养条件下培养72 h, 加入MTT溶液 (5.0 mg/mL) 20 μL, 在恒温箱中继续孵育4 h, 之后弃去上清, 每孔加入DMSO 150 μL, 充分溶解, 用酶联免疫检测仪于490 nm处测得吸光度值, 计算IC50值.
辅助材料 (Supporting Information) 所有化合物的1H NMR、13C NMR谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.2 中间体3的合成
将水 (50 mL) 和氢氧化钠 (8.5 g, 212.5 mmol) 置于250 mL圆底烧瓶中, 搅拌下加入苯酚 (10 g, 106.4 mmol) 和四丁基溴化铵 (TBAB) (1.7 g, 5.28 mmol), 冰浴条下用恒压滴液漏斗缓慢滴加环氧氯丙烷 (14.8 g, 159.1 mmol), 0.5 h之内滴加完毕.室温条件下反应约12 h, 反应完毕后, 加入200 mL水, 用乙酸乙酯萃取 (50 mL× 3), 有机相无水硫酸钠干燥, 抽滤, 减压蒸馏, 柱层析[V(石油醚):V(乙酸乙酯)=8:1]得到化合物3a 14.36 g, 产率90%.
3.2.6 中间体7的合成
将化合物6a (2 g, 7 mmol) 和二氯甲烷 (30 mL) 置于100 mL圆底烧瓶中, 在冰浴条件下向体系中快速加入四氯化钛 (5 mL), 反应约12 h.反应完毕后, 在500 mL锥形瓶中加入水 (200 mL), 将反应体系倒入该锥形瓶, 用二氯甲烷萃取 (50 mL×3), 有机相无水硫酸钠干燥, 抽滤, 减压浓缩, 柱层析[V(石油醚):V(乙酸乙酯)= 3:1], 得到4-乙酰氨基-3-甲基-6-羟甲基-5, 6-二氢-吡喃-2-酮 (7) 1.01 g, 产率73%.白色针晶, m.p. 147~ 148 ℃; [α]D29 +3.9 (c 0.005, CH3COCH3); 1H NMR (DMSO-d6, 400 MHz) δ: 9.40 (s, 1H), 5.04 (t, J=5.8 Hz, 1H), 4.26 (dt, J=12.7, 4.2 Hz, 1H), 3.70~3.45 (m, 2H), 3.05~2.61 (m, 2H), 2.07 (s, 3H), 1.75 (d, J=2.0 Hz, 3H); 13C NMR (DMSO-d6, 101 MHz) δ: 169.58, 167.16, 147.75, 108.14, 76.55, 62.76, 28.84, 24.27, 11.98. HRMS calcd for C9H13NNaO4 [M + Na] + 222.0742, found 222.0745.
3.2.1 化合物1的合成
6-苯氧甲基-5, 6-二氢-吡喃-2-酮 (1) 参考文献[2]合成, 0.35 g白色针晶, 产率65%. m.p. 83~84 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.44~7.29 (m, 2H), 7.12~ 6.80 (m, 4H), 6.11 (ddd, J=9.7, 2.6, 1.1 Hz, 1H), 4.92~ 4.72 (m, 1H), 4.37~4.06 (m, 2H), 2.79~2.49 (m, 2H); 13C NMR (CDCl3, 101 MHz) δ: 163.32, 158.15, 144.66, 129.60, 121.50, 121.37, 114.58, 75.53, 68.46, 26.31. HRMS calcd for C12H12NaO3 [M+Na]+ 227.0684, found 227.0682.
3.2.5 目标化合物6的合成
将化合物5c (2 g, 8.1 mmol) 和二氯甲烷 (8 mL) 置于25 mL的圆底烧瓶中, 之后加入三乙胺 (1.22 g, 12 mmol), 在冰浴条件下缓慢滴加乙酰氯 (0.959 g, 12 mmol), 约0.5 h滴加完毕.反应约1 h, 将体系倒入100 mL的锥形瓶中, 加入50 mL水淬灭反应.用二氯甲烷萃取 (20 mL×3), 有机相无水硫酸钠干燥, 抽滤, 减压浓缩, 柱层析[V(石油醚):V(乙酸乙酯)=10:1]得到4-乙酰氨基-3-甲基-6-苄氧甲基-5, 6-二氢-吡喃-2-酮 (6a) 2.17 g, 产率93%.淡黄色油状物. [α]D29+0.4 (c 0.005, CH3COCH3); 1H NMR (CDCl3, 400 MHz) δ: 7.56 (td, J= 12.2, 6.2 Hz, 1H), 7.48~7.29 (m, 5H), 4.59 (s, 2H), 4.49 (dq, J=12.6, 4.4 Hz, 1H), 3.68 (d, J=4.6 Hz, 2H), 3.45~ 3.29 (m, 1H), 3.05~2.86 (m, 1H), 2.18 (s, 3H), 1.91~ 1.79 (m, 3H); 13C NMR (CDCl3, 101 MHz) δ: 169.03, 167.19, 147.16, 137.64, 128.46, 127.83, 127.75, 106.60, 74.81, 73.61, 70.90, 28.20, 24.70, 10.61. HRMS calcd for C16H20NO4 [M+H]+ 290.1392, found 290.1393.
4-氯乙酰氨基-3-甲基-6-苄氧甲基-5, 6-二氢-吡喃-2-酮 (6b): 2.49 g, 产率95%.淡黄色油状物. [α]D29 +1.9 (c 0.005, CH3COCH3); 1H NMR (CDCl3, 400 MHz) δ: 8.30 (s, 1H), 7.48~7.29 (m, 5H), 4.67~4.50 (m, 3H), 4.18 (s, 2H), 3.72 (d, J=4.6 Hz, 2H), 3.39 (ddd, J=18.3, 3.8, 1.3 Hz, 1H), 3.03 (ddq, J=18.7, 12.0, 2.4 Hz, 1H), 1.94 (dd, J=2.4, 1.1 Hz, 3H); 13C NMR (CDCl3, 101 MHz) δ: 166.26, 164.11, 145.18, 137.63, 128.47, 127.85, 127.77, 108.68, 74.71, 73.67, 70.75, 43.05, 27.60, 10.38. HRMS calcd for C16H18ClNNaO4 [M+Na] + 346.0822, found 346.0818.
4-(2, 2, 2-三甲基) 乙酰氨基-3-甲基-6-苄氧甲基-5, 6-二氢-吡喃-2-酮 (6c): 2.47 g, 产率92%.淡黄色油状物. [α]D29+2.4 (c 0.005, CH3COCH3); 1H NMR (CDCl3, 400 MHz) δ: 7.47~7.29 (m, 6H), 4.61 (s, 2H), 4.51 (dq, J= 12.7, 4.4 Hz, 1H), 3.70 (d, J=4.6 Hz, 2H), 3.41 (dd, J= 18.3, 3.7 Hz, 1H), 3.10~2.92 (m, 1H), 1.88 (t, J=1.5 Hz, 3H), 1.30 (s, 9H); 13C NMR (DMSO-d6, 101 MHz) δ: 176.31, 166.19, 146.74, 138.05, 128.24, 127.48, 112.59, 74.23, 72.36, 70.64, 39.17, 29.19, 26.92, 12.08. HRMS calcd for C19H25NNaO4 [M + Na] + 354.1681, found 354.1685.
4-(2, 3, 4, 5-四氟) 苯甲酰氨基-3-甲基-6-苄氧甲基-5, 6-二氢-吡喃-2-酮 (6d): 3.08 g, 产率90%.淡黄色油状物. [α]D30 +5.6 (c 0.005, CH3COCH3); 1H NMR (DMSOd6, 400 MHz) δ: 10.16 (s, 1H), 7.74 (dddd, J=10.7, 8.3, 5.8, 2.5 Hz, 1H), 7.46~7.28 (m, 5H), 4.70~4.51 (m, 3H), 3.68 (d, J=4.5 Hz, 2H), 3.01~2.80 (m, 2H), 1.78 (s, 3H); 13C NMR (DMSO-d6, 101 MHz) δ: 166.57, 160.31, 146.01, 138.52, 128.76, 127.98, 112.60, 74.76, 72.85, 71.03, 29.08, 12.49. HRMS calcd for C21H17F4NNaO4 [M+Na]+ 446.0991, found 446.0993.
3.2.7 目标化合物8的合成
将化合物7 (1 g, 5 mmol) 和无水二氯甲烷 (5 mL) 置于25 mL的圆底烧瓶中, 冰浴搅拌条件下加入三乙胺 (0.757 g, 7.5 mmol), 之后将用3 mL无水二氯甲烷稀释好的肉桂酰氯 (1.25 g, 7.5 mmol) 用恒压滴定漏斗缓慢加入体系, 约0.5 h滴加完毕.反应约1 h.反应完毕后, 将体系倒入100 mL的锥形瓶中, 加入50 mL水淬灭反应.然后用二氯甲烷萃取 (20 mL×3), 有机相无水硫酸钠干燥, 抽滤, 减压浓缩, 柱层析[V(石油醚):V(乙酸乙酯)=4:1]得到4-乙酰氨基-3-甲基-6-肉桂酰氧甲基-5, 6-二氢-吡喃-2-酮 (8), 1.54 g, 产率93%.白色针晶, m.p. 144~145 ℃; [α]D29 +0.7 (c 0.005, CH3COCH3); 1H NMR (CDCl3, 400 MHz) δ: 7.75 (d, J=16.1 Hz, 1H), 7.64~7.37 (m, 5H), 7.15 (s, 1H), 6.48 (d, J=16.1 Hz, 1H), 4.69~4.63 (m, 1H), 4.44 (qd, J=12.0, 4.8 Hz, 2H), 3.57~3.41 (m, 1H), 2.99 (dd, J=18.2, 12.4 Hz, 1H), 2.22 (s, 3H), 1.91 (s, 3H); 13C NMR (DMSO-d6, 101 MHz) δ: 169.15, 166.14, 165.87, 146.86, 145.15, 133.88, 130.57, 128.88, 128.44, 117.49, 107.76, 72.95, 64.49, 28.10, 23.78, 11.51. HRMS calcd for C18H19NNaO5 [M + Na] + 352.1161, found 352.1161.
3.2.3 中间体4的合成
将水 (20 mL) 和乙醇 (10 mL) 置于150 mL的圆底烧瓶中, 然后加入3a (10 g, 66.7 mmol) 搅拌混匀, 最后加入氰化钾 (6.5 g, 100 mmol), 反应约2 h.反应完毕, 加入100 mL水使体系澄清, 减压蒸馏除去乙醇, 乙酸乙酯萃取 (50 mL×3), 有机相无水硫酸钠干燥, 抽滤, 减压浓缩, 柱层析[V(石油醚):V(乙酸乙酯)=4:1]得到化合物4a 10.0 g, 产率85%.
3.2.4 目标化合物5的合成
将锌粉 (1.02 g, 15.7 mmol) 和无水四氢呋喃 (10 mL) 置于50 mL的圆底烧瓶中, 搅拌条件下快速加入三氟乙酸 (179 mg, 1.57 mmol), 室温搅拌10 min, 升高温度至70 ℃回流, 等体系稳定后, 向体系中加入化合物4a (2 g, 11 mmol) 和3粒碘单质, 最后将称好的2-溴丙酸乙酯 (2.17 g, 12 mmol) 用5 mL无水四氢呋喃稀释, 缓慢加入到体系中 (约4 h), 滴加完毕反应约2 h, 此时体系颜色呈暗绿色.反应完毕, 向体系倒入5%稀盐酸终止反应, 搅拌0.5 h抽滤, 滤液减压蒸馏除去四氢呋喃, 乙酸乙酯萃取 (20 mL×3), 有机相无水硫酸钠干燥, 抽滤, 减压浓缩, 柱层析[V(石油醚):V(乙酸乙酯)=8:1]得到4-氨基-3-甲基-6-苯氧甲基-5, 6-二氢-吡喃-2-酮 (5a) 2.16 g, 产率82%.白色针晶, m.p. 145~146 ℃; [α]D30+6.7 (c 0.005, CH3COCH3); 1H NMR (DMSO-d6, 400 MHz) δ: 7.46~7.18 (m, 2H), 7.06~6.87 (m, 3H), 6.45 (s, 2H), 4.53 (dq, J=12.7, 4.5 Hz, 1H), 4.12 (d, J=4.8 Hz, 2H), 2.61 (ddd, J=16.7, 12.3, 1.7 Hz, 1H), 2.41 (dd, J=16.5, 3.7 Hz, 1H), 1.62 (s, 3H); 13C NMR (DMSO-d6, 101 MHz) δ: 167.68, 158.67, 156.07, 130.01, 121.30, 114.93, 87.59, 72.36, 69.17, 29.56, 10.11.
4-氨基-3-乙基-6-苯氧甲基-5, 6-二氢-吡喃-2-酮 (5b): 2.35 g, 产率84%.白色针晶, m.p. 146~147 ℃; [α]D30 +7.7 (c 0.005, CH3COCH3); 1H NMR (DMSO-d6, 400 MHz) δ: 7.32 (t, J=7.7 Hz, 2H), 6.97 (t, J=9.1 Hz, 3H), 4.66 (dd, J=11.5, 5.5 Hz, 1H), 4.16 (s, 2H), 2.75 (dd, J= 17.1, 12.1 Hz, 2H), 2.21 (q, J=7.4 Hz, 2H), 0.93 (d, J= 7.5 Hz, 3H); 13C NMR (DMSO-d6, 101 MHz) δ: 167.67, 165.47, 158.60, 130.01, 121.37, 114.94, 104.13, 72.71, 68.90, 29.68, 16.82, 13.83.
4-氨基-3-甲基-6-苄氧甲基-5, 6-二氢-吡喃-2-酮 (5c): 2.21 g, 产率85%.淡黄色油状物. [α]D31+8.3 (c 0.005, CH3COCH3); 1H NMR (CDCl3, 400 MHz) δ: 7.48~7.30 (m, 5H), 4.70~4.43 (m, 3H), 4.35 (s, 2H), 3.70 (qd, J= 10.3, 5.1 Hz, 2H), 2.73 (ddd, J=16.5, 12.1, 1.7 Hz, 1H), 2.30 (ddd, J=16.5, 3.8, 1.0 Hz, 1H), 1.77 (dd, J=1.7, 0.8 Hz, 3H); 13C NMR (CDCl3, 101 MHz) δ: 168.05, 152.91, 137.77, 128.45, 127.84, 127.75, 92.23, 73.66, 73.14, 71.00, 30.26, 9.15. HRMS calcd for C14H17NNaO3 [M+Na]+ 270.1106, found 270.1102.
4-氨基-3-丁基-6-(4-甲氧基) 苄氧甲基-5, 6-二氢-吡喃-2-酮 (5d): 2.45 g, 产率85%.淡黄色油状物. [α]D31+ 7.9 (c 0.005, CH3COCH3); 1H NMR (CDCl3, 400 MHz) δ: 7.35~7.22 (m, 2H), 6.92~6.83 (m, 2H), 4.53~4.50 (m, 2H), 4.47~4.41 (m, 1H), 3.81 (s, 3H), 3.64 (qd, J=10.2, 5.0 Hz, 2H), 2.68 (dd, J=16.5, 12.1 Hz, 1H), 2.34~2.23 (m, 2H), 2.15 (ddd, J=14.5, 8.6, 6.0 Hz, 1H), 1.53~1.24 (m, 4H), 0.91 (t, J=7.0 Hz, 3H); 13C NMR (CDCl3, 101 MHz) δ: 167.92, 159.34, 153.01, 129.88, 129.43, 113.85, 97.19, 73.26, 73.13, 70.69, 55.30, 30.41, 30.23, 24.02, 22.77, 14.06.
4-氨基-3-甲基-6-(2-甲氧基) 苄氧甲基-5, 6-二氢-吡喃-2-酮 (5e): 2.13 g, 产率85%.淡黄色油状物. [α]D31+ 8.7 (c 0.005, CH3COCH3); 1H NMR (CDCl3, 400 MHz) δ: 7.44~7.21 (m, 2H), 7.01~6.84 (m, 2H), 4.63 (s, 2H), 4.55 (s, 2H), 4.51~4.44 (m, 1H), 3.83 (s, 3H), 3.79~3.62 (m, 2H), 2.80~2.60 (m, 1H), 2.32 (dd, J=16.5, 3.7 Hz, 1H), 1.75 (s, 3H); 13C NMR (CDCl3, 101 MHz) δ: 168.43, 157.10, 153.67, 129.05, 128.95, 126.10, 120.42, 110.25, 91.49, 73.20, 71.25, 68.40, 55.35, 30.20, 9.15.
-
-
[1]
Jong, R.; Mulder, N.; Uges, D. Brit. J. Cancer. 1999, 79, 882. doi: 10.1038/sj.bjc.6690141
-
[2]
Barros, M. E.; Freitas, J. C.; Oliveira, J. M. Eur. J. Med. Chem. 2014, 76, 291. doi: 10.1016/j.ejmech.2014.02.013
-
[3]
Seyed, M. A.; Jantan, I.; Bukhari, S. N. A. BioMed Res. Int. 2014, 2014, 536508.
-
[4]
Sun, Q. X.; Carrasco, Y. P.; Hu, Y. C. P. Natl. Acad. Sci. U. S. A. 2013, 110, 1303. doi: 10.1073/pnas.1217203110
-
[5]
Sandra, T. G.; Concepcion, V.; Santiago, D. O. Arch. Pharm. Chem. Life Sci. 2015, 348, 541. doi: 10.1002/ardp.v348.8
-
[6]
Raju, A.; Reddy, A. Y.; Sabitha, G. Tetrahedron Lett. 2015, 56, 5474. doi: 10.1016/j.tetlet.2015.08.029
-
[7]
Luiz, F. T. N.; Carolina, M. A.; Karin, J. P. R. Chem. Med. Chem. 2015, 10, 1687. doi: 10.1002/cmdc.201500246
-
[8]
Vilanova, C.; Diaz-Oltra, S.; Murga, J. J. Med. Chem. 2014, 57, 10391. doi: 10.1021/jm501112q
-
[9]
Marucci, C.; Christodoulou, M. S.; Pieraccini, S. Eur. J. Org. Chem. 2016, 11, 2029.
-
[10]
Benedekovic, G.; Kovacevic, I.; Popsavin, M. Bioorg. Med. Chem. Lett. 2016, 26, 3318. doi: 10.1016/j.bmcl.2016.05.044
-
[11]
Li, X. C.; Guo, Z. Y.; Deng, Z. S. Rec. Nat. Prod. 2015, 9, 503.
-
[12]
He, H. Y.; Ratnayake, A. S.; Janso, J. E. J. Nat. Prod. 2014, 77, 1864. doi: 10.1021/np500342m
-
[13]
Marco, J. A.; García-Pla, J.; Carda, M. Eur. J. Med. Chem. 2011, 46, 1630. doi: 10.1016/j.ejmech.2011.02.011
-
[14]
Kim, J. H.; Lee, S. J.; Org. Lett. 2011, 13, 1350. doi: 10.1021/ol200045q
-
[15]
Kim, J. H.; Shin, H.; Lee, S. G. J. Org. Chem. 2012, 77, 1560. doi: 10.1021/jo201964a
-
[16]
曹秀芳, 孙婷婷, 柯少勇, 有机化学, 2010, 30, 1113. http://sioc-journal.cn/Jwk_yjhx/CN/volumn/home.shtmlCao, X. F.; Sun, T. T.; Ke, S. Y. Chin. J. Org. Chem. 2010, 30, 1113 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/volumn/home.shtml
-
[17]
Koziol, A.; Lendzion-Paluch, A.; Manikowski, A. Org. Proc. Res. Dev. 2013, 17, 869. doi: 10.1021/op300367c
-
[18]
赵剑阳, 郑紫华, 黄晴菲, 邓金根, 朱槿, 王启卫, 有机化学, 2016, 36, 648. http://sioc-journal.cn/Jwk_yjhx/CN/volumn/home.shtmlZhao, J. Y.; Zheng, Z. H.; Huang, Q. F.; Deng, J. G.; Zhu, J.; Wang, Q. W. Chin. J. Org. Chem. 2016, 36, 648 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/volumn/home.shtml
-
[19]
Pospisil, J.; Marko, I. E. J. Am. Chem. Soc. 2007, 129, 3516. doi: 10.1021/ja0691728
-
[20]
Ramesh, D.; Rajaram, S.; Peddikotla, P. Helv. Chim. Acta 2011, 94, 1226. doi: 10.1002/hlca.v94.7
-
[21]
AnkiReddy, S.; AnkiReddy, P.; Sabitha, G. Org. Biomol. Chem. 2015, 13, 10487. doi: 10.1039/C5OB01598G
-
[1]
-
表 1 目标化合物体外抗肿瘤活性a
Table 1. Antiproliferative activity of target compound
Compd. IC50/(μmol•L-1) 7721 A549 EC-109 MGC-803 5a >128 >128 >128 >128 5b >128 >128 >128 >128 5c >128 >128 >128 >128 5d >128 >128 >128 >128 5e >128 >128 >128 >128 6a >128 >128 >128 >128 6b >128 >128 >128 >128 6c >128 >128 >128 28±2 6d 11±1 19±1 37±2 13±1 8 >128 >128 >128 >128 1 14±1 3±1 20±1 2±1 5-Fu 14±1 4±1 2±1 7±1 a Do not calculate IC50 value which is bigger than 128 μmol•L-1. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 1418
- HTML全文浏览量: 196


 下载:
下载:

 下载:
下载:

