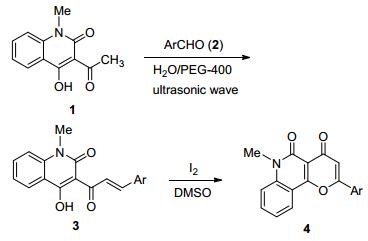
 图式1
合成路线
Scheme1.
Synthetic route
图式1
合成路线
Scheme1.
Synthetic route

Citation: Zhou Ting, Wang Daolin, Qian Jianhua, Zhao Wei. Iodine Promoted Synthesis of Pyrano[3, 2-c]quinoline-4, 5-diones[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1548-1555. doi: 10.6023/cjoc201612001

碘促进吡喃并[3,2-c]喹啉-4,5-二酮类衍生物的有效合成
English
Iodine Promoted Synthesis of Pyrano[3, 2-c]quinoline-4, 5-diones
-
Key words:
- quinoline
- / heterocycle
- / ultrasound irradiation
- / iodine
- / synthesis
-
吡喃并[3, 2-c]喹啉酮来源于Rutaceae植物家族中的生物碱, 它的许多衍生物具有广泛的生物活性, 如抗凝血、抗肿瘤、抗高血压、抗炎和抗疟活性[1].其中一些衍生物显示出对癌细胞生长的抑制活性, 被认为是潜在的抗癌药物[2].在有机合成上被用于制备其他天然产物, 如二聚喹啉生物碱和多环杂环化合物等[3].
吡喃并[3, 2-c]喹啉酮骨架结构由喹啉酮和吡喃酮拼接组成.喹啉酮衍生物已发现具有抗疟[4]、抗增殖[5]、抗乙型肝炎病毒[6]和抗HIV[7]活性.吡喃酮类化合物由于良好的抗菌[8]、抗肿瘤[9]等生物活性和药理活性, 在临床医学上得以应用.
在过去的几十年里, 由于分子碘的无毒、廉价和环境友好等特性, 使其成为一种应用广泛的有机催化剂[10], 用于有效促进化学反应[11], 如Michael加成[12]、催化氧化[13]等.分子碘在有机合成中的重要作用, 已经愈来愈受到人们的关注[14].
近年来, 我们以喹啉类杂环化合物为研究对象, 合成了具有潜在生物活性的含有呋喃[15a]、噻吩[15b]、嘧啶[15c]和香豆素[15d]等结构单元的喹啉类稠杂环化合物.为进一步开展此领域的研究工作, 本文以1-甲基-3-乙酰基-4-羟基-2-喹啉酮为反应底物, 在碘的促进下, 对吡喃并[3, 2-c]喹啉-4, 5-二酮类衍生物的合成方法进行探讨, 合成路线如Scheme 1所示.
1 结果与讨论
1.1 3-肉桂酰基-4-羟基-2-喹啉酮的合成
有关3-肉桂酰基-4-羟基-2-喹啉酮的制备, 文献报道了在L-脯氨酸催化下[16a], 通过1-甲基-3-乙酰基-4-羟基-2-喹啉酮(1)和芳香醛的Aldol缩合反应可以得到较好收率, 但反应时间长(3 d).超声波技术的应用使得该反应得以改进, 反应时间缩短为1.5 h[16b], 收率良好, 成为一种合成该类化合物的有效方法.
本实验方法以水代替有机溶剂, 在超声波辐射下, 通过哌啶与聚乙二醇(PEG-400) 的协同作用, 以较高收率制备了3-肉桂酰基-4-羟基-2-喹啉酮(3).在这一研究工作中, 我们考察了反应条件对该反应的影响(表 1), 发现10 mol%的哌啶与2.5%的PEG-400用量比较合适, 反应可以在2 h内完成(Entry 4), 产率较高; 与已有方法相比(Entries 1~3), 具有明显优势; 使用更多的催化剂(20 mol%的哌啶与5%的PEG-400) 时, 产物收率差别不大(Entry 5);当使用EtOH作为反应溶剂时, 2 h后, 3a的收率为53% (Entry 6);无PEG-400参与时3a收率显著下降(Entry 7).进一步证明PEG-400在Aldol缩合反应中的有效性[17].
 表 1
3-肉桂酰基-4-羟基-2-喹啉酮合成条件的优化
Table 1.
Optimization of reaction conditions on the synthesis of 1-methyl-3-cinnamoyl-4-hydroxyquinoline-2-one (3a) a
表 1
3-肉桂酰基-4-羟基-2-喹啉酮合成条件的优化
Table 1.
Optimization of reaction conditions on the synthesis of 1-methyl-3-cinnamoyl-4-hydroxyquinoline-2-one (3a) a

在此基础上, 我们选择以哌啶(10 mol%)与PEG-400 (2.5 mol%)作为该反应的协同催化剂, 在超声波辅助下, 于80 ℃合成3-肉桂酰基-4-羟基-2-喹啉酮, 实验结果列于表 2.
1.2 吡喃并[3, 2-c]喹啉-4, 5-二酮类衍生物的合成
在黄酮及其相关类似物的合成过程中利用I2/DMSO体系是一种重要的合成途径[18].我们曾经报道物的合成方法[17a].作为该方法的延续, 本工作旨在探讨I2对1-甲基-3-肉桂酰基-4-羟基-2-喹啉酮类化合物的环化反应性能.首先以1-甲基-3-肉桂酰基-4-羟基-2-喹啉酮(3a)为反应底物, 主要考察溶剂、催化剂用量和反应温度对反应的影响, 结果见表 3.实验发现在100 ℃下无任何催化剂参与时, 该反应无法进行(Entry 1);在I2存在下反应可以较为顺利地进行(Entries 2~6).其中, 碘的用量为15 mol%时(Entry 4), 目标产物收率可达到84%.增加催化剂的用量(20 mol%)或升高反应温度(110 ℃), 产物收率并没有得到改善(Entries 5, 6).其次, 通过与N, N-二甲基甲酰胺(DMF)和HOAc为反应溶剂的比较(Entries 7, 8), 发现二甲基亚砜(DMSO)作为溶剂效果较佳, 可能源于良好的溶解性能以及弱氧化性作用[19].因此选择以DMSO为反应溶剂、碘的用量为15 mol%作为该反应的优化条件.
 表 3
吡喃并[3, 2-c]喹啉-4, 5-二酮(4a)合成条件的优化a
Table 3.
Optimization of reaction conditions on the synthesis of pyrano[3, 2-c]quinoline-4, 5-dione (4a)
表 3
吡喃并[3, 2-c]喹啉-4, 5-二酮(4a)合成条件的优化a
Table 3.
Optimization of reaction conditions on the synthesis of pyrano[3, 2-c]quinoline-4, 5-dione (4a)

在以上优化反应条件下, 对吡喃并[3, 2-c]喹啉-4, 5-二酮类衍生物(4)的合成进行扩展实验(表 4).
从反应结果中可以看出, 1-甲基-3-肉桂酰基-4-羟基-2-喹啉酮类化合物在I2/DMSO体系中, 表现出较高的反应活性, 可以顺利实现环化:当苯环上含有供电子取代基(如Me, OMe, OH)时(Entries 2~8), 表现出良好的选择性和高的收率(82~88%); 含有吸电子取代基(如Cl, F)时(Entries 9, 10), 也得到良好收率(78%, 75%).另外, 杂环芳香醛、如糠醛和噻吩-2-甲醛(Entries 11, 12) 应用于该反应也得到较好收率(70%, 72%).
所制备产物结构经IR、1H NMR、13C NMR和元素分析数据得以确认.在IR谱图中, 目标化合物吡喃并[3, 2-c]喹啉-4, 5-二酮(4)的共同特征为在1756~1771 cm-1范围内表现出喹啉酮羰基的伸缩振动吸收峰, 在了在I2/DMSO体系中香豆素并[4, 3-b]吡喃-4-酮类衍生1632~1644 cm-1范围内出现的吸收峰为吡喃-4-酮羰基的伸缩振动吸收峰.在1H NMR谱图中, 目标产物4在δ 6.76~7.23处的单峰吸收, 为吡喃酮环3-位质子的特征吸收峰.在13C NMR谱图中, 目标产物4, 在δ 174~177处的吸收为喹啉酮羰基碳的特征吸收峰, δ 159~162为吡喃酮羰基碳的特征吸收峰.
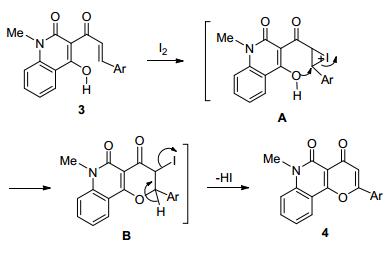
依据相关文献[11a]及实验结果, 推测该反应进行的可能机理如下(Scheme 2):首先1-甲基-3-肉桂酰基-4-羟基2-喹啉酮(3)在分子碘的作用下, 通过加成反应得到碘代鎓盐A, 接着通过分子内亲核取代得到环化产物B, 最后经过分子内脱除一分子HI得到最终产物:吡喃并[3, 2-c]喹啉-4, 5-二酮(4).
2 结论
通过1-甲基-3-乙酰基-4-羟基-2-喹啉酮与芳香醛的Aldol缩合及在碘促进下的环化反应, 成功地合成了一系列吡喃并[3, 2-c]喹啉-4, 5-二酮类化合物, 为新型吡喃并喹啉酮类衍生物提供了有效的合成策略.该方法反应条件温和、操作简便、收率良好, 有较好的实用价值及应用前景.
3 实验部分
3.1 仪器与试剂
熔点用WRS-1B数字熔点仪测定, 熔点未校正; NMR用Bruker DPX-400 MHz核磁共振仪测定, 四甲基硅烷为内标; IR用BIO-RAD FTS-40型傅立叶变换红外分光光度计测定, KBr压片; MS采用ZAB-HS型质谱仪测定; 元素分析用Vario EL元素分析仪测定; 超声波用频率为40 kHz和250 W输出功率的KQ-250B医用超声清洁器.所用试剂均为分析纯试剂, 1-甲基-3-乙酰基-4-羟基-2-喹啉酮(1)按照文献[20]方法制备.
3.2 实验方法
3.2.1 1-甲基-3-肉桂酰基-4-羟基-2-喹啉酮(3)的制备
合成的一般步骤:于超声波辐射下, 将1-甲基-3-乙酰基-4-羟基-2-喹啉酮(1) (2.17 g, 10.0 mmol)、哌啶(85 mg, 1.0 mmol)、芳香醛(2) (12.0 mmol)、水(20 mL)和PEG-400 (100 mg), 在80 ℃下反应1.5~3 h, 用硅胶层析板(TLC)监控反应.反应结束后, 冷却, 过滤, 无水乙醇重结晶, 得到产物3.产物3a~3l的物理分析数据与光谱数据如下:
1-甲基-3-肉桂酰基-4-羟基-2-喹啉酮(3a):黄色针状晶体. m.p. 155~157 ℃(文献值[16a] 148~150 ℃); 1H NMR (CDCl3, 400 MHz) δ: 3.65 (s, 3H, OCH3), 7.25~7.31 (m, 1H), 7.38~7.40 (m, 3H), 7.66~7.71 (m, 3H), 7.95 (d, J=8.0 Hz, 1H), 8.24 (d, J=8.0 Hz, 1H), 8.68 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.2, 114.2, 116.0, 122.1, 125.2, 126.2, 128.8, 129.4, 130.7, 134.9, 135.1, 141.6, 145.1, 161.6, 176.8, 176.9, 194.4; IR (KBr) ν: 3231 (OH), 1654 (C=O), 1577 (C=O) cm-1. Anal. calcd for C19H15NO3: C 74.74, H 4.95, N 4.59; found C 74.89, H 4.97, N 4.61.
1-甲基-3-(4-甲基肉桂酰基)-4-羟基-2-喹啉酮(3b):黄色针状晶体. m.p. 170~172 ℃(文献值[16a] 166~168 ℃); 1H NMR (CDCl3, 400 MHz) δ: 2.37 (s, 3H, CH3), 3.66 (s, 3H, NCH3), 7.18~7.30 (m, 4H), .60 (d, J=7.6 Hz, 2H), 7.67 (dd, J=7.6, 8.4 Hz, 1H), 8.14 (d, J=15.6 Hz, 1H), 8.23 (d, J=8.0 Hz, 1H), 8.82 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 19.3, 26.1, 103.2, 111.8, 113.8, 119.7, 121.7, 123.8, 126.7, 127.3, 130.1, 132.6, 138.9, 139.3, 143.0, 159.4, 173.9, 191.8; IR (KBr) ν: 3236 (OH), 1658 (C=O), 1594 (C=O) cm-1. Anal. calcd for C20H17NO3: C 75.22, H 5.37, N 4.39; found C 75.37, H 5.36, N 4.41.
1-甲基-3-(2-甲氧基肉桂酰基)-4-羟基-2-喹啉酮(3c):黄色针状晶体. m.p. 162~163 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.65 (s, 3H, NCH3), 3.90 (s, 3H, OCH3), 6.89~6.98 (m, 2H), 7.22~7.27 (m, 2H), 7.36 (t, J=7.6 Hz, 1H), 7.66 (dd, J=7.8, 8.0 Hz, 1H), 7.80 (d, J=8.0 Hz, 1H), 8.24 (d, J=8.0 Hz, 1H), 8.57 (d, J=15.6, Hz, 1H), 8.86 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ : 29.2, 55.5, 105.6, 111.4, 114.3, 116.2, 120.7, 122.0, 124.1, 124.9, 126.3, 128.7, 132.1, 134.8, 140.1. 141.6, 158.7, 161.8, 176.4, 194.5; IR (KBr) ν: 3230 (OH), 1652 (C=O), 1589 (C=O) cm-1. Anal. calcd for C20H17NO4: C 71.63, H 5.11, N 4.18; found C 71.78, H 5.10, N 4.19.
1-甲基-3-(3-甲氧基肉桂酰基)-4-羟基-2-喹啉酮(3d):黄色针状晶体. m.p. 139~141 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.66 (s, 3H, NCH3), 3.85 (s, 3H, OCH3), 6.94 (d, J=7.6 Hz, 1H), 7.20~7.31 (m, 5H), 7.68 (t, J=7.6 Hz, 1H), 7.92 (d, J=15.6 Hz, 1H), 8.24 (d, J=7.6 Hz, 1H), 8.65 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.2, 55.4, 105.6, 113.8, 114.3, 116.1, 116.7, 121.7, 122.1, 125.5, 126.3, 129.8, 134.9, 136.5, 141.7, 145.0, 159.8, 161.8, 176.2, 194.4; IR (KBr) ν: 3234 (OH), 1659 (C=O), 1582 (C=O) cm-1. Anal. calcd for C20H17-NO4: C 71.63, H 5.11, N 4.18; found C 71.75, H 5.12, N 4.20.
1-甲基-3-(4-甲氧基肉桂酰基)-4-羟基-2-喹啉酮(3e):黄色针状晶体. m.p. 171~173 ℃(文献值[16a] 170~172 ℃); 1H NMR (CDCl3, 400 MHz) δ: 3.71 (s, 3H, NCH3), 3.92 (s, 3H, OCH3), 7.05 (d, J=8.4 Hz, 1H), 7.14 (t, J=7.6, 8.0 Hz, 1H), 7.32~7.41 (m, 4H), 7.50 (d, J=7.6, 8.0 Hz, 1H), 7.72 (d, J=7.6, 8.0 Hz, 1H), 7.76 (d, J=15.6 Hz, 1H), 8.24 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.4, 53.6, 112.3, 112.5, 114.5, 120.2, 120.8, 124.4, 126.2, 127.5, 129.1, 132.9, 139.7, 143.5, 160.0, 160.1, 174.5, 192.2; IR (KBr) ν: 3235 (OH), 1659 (C=O), 1586 (C=O) cm-1. Anal. calcd for C20H17NO4: C 71.63, H 5.11, N 4.18; Found C 71.74, H 5.13, N 4.20.
1-甲基-3-(2, 4-二甲氧基肉桂酰基)-4-羟基-2-喹啉酮(3f):黄色针状晶体. m.p. 191~193 ℃(文献值[16a] 187~189 ℃); 1H NMR (CDCl3, 400 MHz) δ: 3.66 (s, 3H, NCH3), 3.84 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 6.43 (s, 1H), 6.50 (d, J=8.4 Hz, 1H), 7.22~7.29 (m, 2H), 7.65 (t, J=7.6 Hz, 1H), 7.76 (d, J=8.4 Hz, 1H), 8.23 (d, J=8.0 Hz, 1H), 8.37 (d, J=15.6 Hz, 1H), 8.61 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.3, 53.7, 96.2, 96.3, 103.7, 112.3, 114.6, 115.6, 120.1, 120.2, 124.4, 128.6, 132.7, 138.7, 139.2, 158.7, 160.1, 161.7, 174.7, 192.3; IR (KBr) ν: 3235 (OH), 1656 (C=O), 1594 (C=O) cm-1. Anal. calcd for C21H19NO5: C 69.03, H 5.24, N 3.83; found C 69.16, H 5.25, N 3.85.
1-甲基-3-(3, 4-二甲氧基肉桂酰基)-4-羟基-2-喹啉酮(3g):黄色针状晶体. m.p. 194~196 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.66 (s, 3H, NCH3), 3.91 (s, 3H, OCH3), 3.95 (s, 3H, OCH3), 6.86 (d, J=7.6 Hz, 1H), 7.22~7.30 (m, 4H), 7.67 (dd, J=7.6, 8.0 Hz, 1H), 7.94 (d, J=15.6 Hz, 1H), 8.23 (d, J=8.4 Hz, 1H), 8.56 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.2, 55.9, 105.4, 110.5, 110.9, 114.2, 116.3, 122.1, 122.7, 124.0, 126.2, 138.3, 134.8, 141.6, 145.7, 149.1, 151.6, 161.9, 176.4, 193.9; IR (KBr) ν: 3230 (OH), 1652 (C=O), 1589 (C=O) cm-1. Anal. calcd for C21H19NO5: C 69.03, H 5.24, N 3.83; found C 69.14, H 5.23, N 3.85.
1-甲基-3-(2, 4, 5-三甲氧基肉桂酰基)-4-羟基-2-喹啉酮(3h):黄色针状晶体. m.p. 223~224 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.65 (s, 3H, NCH3), 3.90 (s, 3H, OCH3), 3.91 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 6.48 (s, 1H), 7.22~7.29 (m, 3H), 7.66 (dd, J=7.2, 7.6 Hz, 1H), 8.23 (d, J=7.6 Hz, H), 8.42 (d, J=15.6 Hz, 1H), 8.56 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 26.9, 53.6, 54.1, 54.2, 94.1, 103.1, 108.3, 111.2, 113.6, 114.3, 119.5, 119.6, 123.8, 132.3, 138.6, 139.3, 140.9, 150.7, 152.6, 159.6, 174.2, 191.6; IR (KBr) ν: 3227 (OH), 1646 (C=O), 1589(C=O) cm-1. Anal. calcd for C22H21NO6: C 66.83, H 5.35, N 3.54; found C 66.96, H 5.36, N 3.53.
1-甲基-3-(4-氯肉桂酰基)-4-羟基-2-喹啉酮(3i):黄色针状晶体. m.p. 186~188 ℃ (文献值[16b] 182~184 ℃). 1H NMR (CDCl3, 400 MHz) δ: 3.64 (s, 3H, NCH3), 7.22~7.37 (m, 4H), 7.61 (d, J=8.4 Hz, 2H), 7.67 (dd, J=7.6, 8.0 Hz, 1H), 7.86 (d, J=15.6 Hz, 1H), 8.22 (d, J=7.6 Hz, 1H), 8.63 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.2, 105.6, 114.3, 115.9, 122.1, 125.7, 126.2, 129.7, 130.8, 133.7, 134.9, 136.5, 141.6, 143.3, 161.7, 176.7, 194.1; IR (KBr) ν: 3234 (OH), 1647 (C=O), 1583(C=O) cm-1. Anal. calcd for C19H14ClNO3: C 67.16, H 4.15, N 4.12; found C 67.23, H 4.16, N 4.10.
1-甲基-3-(2-氟肉桂酰基)-4-羟基-2-喹啉酮(3j):黄色针状晶体. m.p. 223~224 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.71 (3H, NCH3, s), 7.13~7.17 (m, 2H), 7.21~7.42 (m, 3H), 7.74 (t, J=7.6 Hz, 1H), 7.85 (t, J=6.8 Hz, 1H), 8.17 (d, J=8.0 Hz, 1H), 8.29 (d, J=7.6 Hz, 1H), 8.76 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.4, 112.4, 114.0, 114.4, 120.3, 121.4, 122.5, 124.4, 125.4, 127.2, 130.2, 133.2, 134.8, 139.9, 158.6, 159.9, 161.1, 174.3, 192.5; IR (KBr) ν: 3233 (OH), 1668 (C=O), 1580 (C=O) cm-1. Anal. calcd for C19H14FNO3: C 70.58, H 4.36, N 4.33; found C 70.75, H 4.38, N 4.34.
1-甲基-3-(3-(2-呋喃基)烯丙酰基)-4-羟基-2-喹啉酮(3k):黄色针状晶体. m.p. 168~170 ℃(文献值[16c] 160~162 ℃); 1H NMR (CDCl3, 400 MHz) δ: 3.65 (s, 3H, NCH3), 6.50 (s, 1H), 6.75 (d, J=2.8 Hz, 1H), 7.22~7.29 (m, 2H), 7.54~7.55 (m, 1H), 7.65~7.73 (m, 2H), 8.22 (d, J=8.0 Hz, 1H), 8.51 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.2, 112.3, 112.7, 114.2, 116.1, 116.6, 122.5, 122.7, 126.3, 130.9, 134.8, 141.3, 145.5, 152.1, 161.7, 176.1, 193.7; IR (KBr) ν: 3231 (OH), 1656 (C=O), 1582(C=O) cm-1. Anal. calcd for C17H13NO4: C 69.15, H 4.44, N 4.74; found C 69.26, H 4.45, N 4.73.
1-甲基-3-(3-(2-噻吩基)烯丙酰基)-4-羟基-2-喹啉酮(3l):黄色针状晶体. m.p. 211~212 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.66 (s, 3H, NCH3), 7.08 (d, J=7.6, 8.4 Hz, 1H), 7.27~7.40 (m, 2H), 7.44~7.45 (m, 2H), 7.68 (dd, J=7.6, 8.0 Hz, 1H), 8.10 (d, J=15.6 Hz, 1H), 8.23 (d, J=8.0 Hz, 1H), 8.51 (d, J=15.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.2, 105.4, 114.2, 116.2, 122.1, 123.8, 126.2, 128.3, 129.1, 132.3, 134.9, 137.7, 141.0, 141.7, 161.8, 176.2, 197.6; IR (KBr) ν: 3226 (OH), 1650 (C=O), 1584 (C=O) cm-1. Anal. calcd for C17H13NO3S: C 65.58, H 4.21, N 4.50; found C 65.74, H 4.22, N 4.52.
3.2.2 吡喃并[3, 2-c]喹啉-4, 5-二酮(4)的合成
合成的一般步骤:将碘(38.00 mg, 0.15 mmol)加入到1-甲基-3-肉桂酰基-4-羟基-2-喹啉酮(3) (1.00 mmol)的DMSO (10 mL)溶剂中, 100 ℃下反应5~12 h (TLC跟踪检测).反应完毕后, 将反应混合物转入水中(50 mL), 过滤, 水洗涤, 干燥, 用冰乙酸重结晶, 得到目标化合物4.产物4a~4l的物理分析数据与光谱数据如下:
1-甲基-2-苯基-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4a):黄色针状晶体. m.p. 239~241 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.71 (s, 3H, NCH3), 6.88 (s, 1H), 7.34~7.38 (m, 2H), 7.41~7.43 (m, 3H), 7.76 (t, J=6.6 Hz, 1H), 7.86~7.87 (m, 2H), 8.25 (d, J=6.8 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.6, 109.1, 110.9, 111.0, 111.3, 112.9, 120.0, 122.3, 124.1, 127.5, 128.8, 130.6, 132.4, 138.9, 159.1, 160.1, 174.2; IR (KBr) ν: 1756(C=O), 1639 (C=O) cm-1. Anal. calcd for C19H13NO3: C 75.24, H 4.32, N 4.62; found C 75.35, H 4.34, N 4.61.
1-甲基-2-(4-甲基苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4b):黄色针状晶体. m.p. 263~265 ℃; 1H NMR (CDCl3, 400 MHz) δ: 2.44 (s, 3H, CH3), 3.71 (s, 1H, NCH3), 6.84 (s, 1H), 7.32~7.40 (m, 4H), 7.71~7.76 (m, 3H), 8.24 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 19.2, 27.0, 107.6, 109.2, 109.6, 110.8, 112.4, 120.2, 121.8, 123.5, 125.4, 127.7, 131.8, 138.4, 140.3, 158.9, 159.5, 173.8; IR (KBr) ν: 1759 (C=O), 1632 (C=O) cm-1. Anal. calcd for C20H15NO3: C 75.70, H 4.76, N 4.41; found C 75.85, H 4.77, N 4.40.
1-甲基-2-(2-甲氧基苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4c):黄色针状晶体. m.p. 253~255 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.71 (s, 3H, NCH3), 3.92 (s, 1H, OCH3), 7.05 (d, J=8.4 Hz, 1H), 7.13 (t, J=7.6 Hz, 1H), 7.23 (s, 1H), 7.32~7.41 (m, 2H), 7.50 (t, J=7.6 Hz, 1H), 7.72 (dd, J=7.6, 7.8 Hz, 1H), 7.88 (d, J=7.6 Hz, 1H), 8.21 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.6, 53.9, 109.4, 110.1, 111.5, 112.9, 115.4, 117.5, 119.1, 120.7, 122.4, 126.9, 131.1, 132.3, 138.9, 156.3, 156.8, 156.9, 160.3, 174.9; IR (KBr) ν: 1762 (C=O), 1636 (C=O) cm-1. Anal. calcd for C20H15NO3: C 72.06, H 4.54, N 4.20; found C 72.17, H 4.56, N 4.21.
1-甲基-2-(3-甲氧基苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4d):黄色针状晶体. m.p. 240~242 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.72 (s, 3H, NCH3), 3.89 (s, 3H, OCH3), 6.89 (s, 1H), 7.09 (s, 1H), 7.35~7.47 (m, 4H), 7.45 (d, J=8.0 Hz, 2H), 8.25 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.6, 53.7, 109.7, 109.9, 111.1, 111.4, 112.9, 115.3, 116.5, 120.7, 122.3, 128.6, 130.2, 132.4, 139.0, 156.7, 158.3, 158.9, 160.1, 174.2; IR (KBr) ν: 1760 (C=O), 1633 (C=O) cm-1. Anal. calcd for C20H15NO3: C 72.06, H 4.54, N 4.20; found C 72.15, H 4.56, N 4.21.
1-甲基-2-(4-甲氧基苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4e):黄色针状晶体. m.p. 263~265 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.75 (s, 3H, CH3), 3.91 (s, 3H, OCH3), 6.80 (s, 1H), 7.05 (d, J=8.8 Hz, 2H), 7.30~7.42 (m, 2H), 7.75 (t, J=7.6 Hz, 1H), 7.83 (d, J=8.8 Hz, 2H), 8.26 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.3, 55.5, 111.0, 111.1, 111.5, 113.2, 114.6, 122.4, 122.8, 124.1, 127.5, 134.0, 140.7, 158.5, 160.9, 161.7, 162.4, 175.9; IR (KBr) ν: 1765 (C=O), 1639 (C=O) cm-1. Anal. calcd for C20H15NO3: C 72.06, H 4.54, N 4.20; found C 72.19, H 4.56, N 4.19.
1-甲基-2-(2, 4-二甲氧基苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4f):黄色针状晶体. m.p. 268~269 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.70 (s, 3H, NCH3), 3.88 (s, 3H, OCH3), 3.89 (s, 3H, OCH3), 6.52 (s, 1H), 6.64 (d, J=8.4 Hz, 1H), 7.16 (s, 1H), 7.30~7.38 (m, 2H), 7.70 (dd, J=7.4, 8.0 Hz, 1H), 7.83 (d, J=8.4 Hz, 1H), 8.18 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.4, 53.8, 97.1, 103.6, 109.6, 110.5, 111.7, 112.7, 114.2, 120.5, 122.3, 127.9, 131.9, 138.8, 156.5, 156.6, 157.8, 159.9, 161.5, 174.8; IR (KBr) ν: 1768(C=O), 1635 (C=O) cm-1. Anal. calcd for C21H17NO5: C 69.41, H 4.72, N 3.85; found C 69.56, H 4.73, N 3.84.
1-甲基-2-(3, 4-二甲氧基苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4g):黄色针状晶体. m.p.>300 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.72 (s, 3H, NCH3), 3.94 (s, 3H, OCH3), 3.96 (s, 3H, OCH3), 6.84 (s, 1H), 7.01 (d, J=8.4 Hz, 1H), 7.27 (s, 1H), 7.37~7.42 (m, 2H), 7.55 (d, J=7.6 Hz, 1H), 7.75 (d, J=7.6 Hz, 1H), 8.23 (d, J=7.2 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.4, 56.0, 56.1, 108.3, 109.9, 111.2, 111.4, 111.6, 113.2, 114.7, 119.5, 122.5, 122.9, 124.0, 134.6, 140.7, 149.4, 152.8, 160.8, 161.7, 176.6; IR (KBr) ν: 1767(C=O), 1634 (C=O) cm-1. Anal. calcd for C21H17NO5: C 69.41, H 4.72, N 3.85; found C 69.55, H 4.74, N 3.86.
1-甲基-2-(2, 4, 5-三甲氧基苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4h):黄色针状晶体. m.p.>300℃; 1H NMR (CDCl3, 400 MHz) δ: 3.72 (s, 3H, NCH3), 3.89 (s, 3H, OCH3), 3.94 (s, 3H, OCH3), 3.98 (s, 3H, OCH3), 6.59 (s, 1H), 7.23 (s, 1H), 7.35 (s, 1H), 7.37~7.43 (m, 2H), 7.73 (t, J=7.6 Hz, 1H), 8.18 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.5, 56.2, 56.4, 56.7, 96.9, 109.9, 110.5, 111.2, 113.2, 113.3, 114.9, 122.5, 122.7, 123.9, 134.3, 140.8, 143.1, 153.4, 154.5, 159.6, 161.8, 176.8; IR (KBr) ν: 1771(C=O), 1635 (C=O) cm-1. Anal. calcd for C22H19NO6: C 67.17, H 4.87, N 3.56; found C 67.25, H 4.88, N 3.55.
1-甲基-2-(4-氯苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4i):黄色针状晶体. m.p.>300 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.72 (s, 3H, NCH3), 6.86 (s, 1H), 7.36~7.43 (m, 2H), 7.53 (d, J=8.0 Hz, 2H), 7.74~7.77 (m, 1H), 7.81 (d, J=8.0 Hz, 2H), 8.24 (d, J=7.8 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.6, 109.9, 111.0, 111.2, 112.9, 120.7, 122.2, 125.4, 127.4, 127.8, 132.5, 136.4, 139.0, 156.5, 158.1, 160.1, 173.9; IR (KBr) ν: 1768(C=O), 1637 (C=O) cm-1. Anal. calcd for C19H12ClNO3: C 67.56, H 3.58, N 4.15; found C 67.68, H 3.60, N 4.16.
1-甲基-2-(2-氟苯基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4j):黄色针状晶体. m.p. 216~218 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.71 (s, 3H, NCH3), 6.98 (s, 1H), 7.23~7.340 (m, 4H), 7.51~7.54 (m, 1H), 7.73 (dd, J=7.6, 8.0 Hz, 1H), 7.86 (dd, J=7.2, 7.6 Hz, 1H), 8.21 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.4, 111.6, 113.7, 114.8, 117.1, 119.2, 122.6, 124.2, 124.9, 128.6, 133.3, 134.3, 140.7, 156.9, 158.5, 159.7, 161.6, 162.1, 175.8. IR (KBr) ν: 1764(C=O), 1644 (C=O) cm-1. Anal. calcd for C19H12FNO3: C 71.02, H 3.76, N 4.36; found C 71.17, H 3.75, N 4.37.
1-甲基-2-(呋喃-2-基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4k):黄色针状晶体. m.p.>300 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.71 (s, 3H, NCH3), 6.63~6.64 (m, 1H), 6.78 (s, 1H), 7.14~7.17 (m, 1H), 7.33~7.41 (m, 2H), 7.64~7.65 (m, 1H), 7.74 (t, J=7.6 Hz, 1H), 8.19 (d, J=7.6 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 29.5, 110.0, 110.2, 111.7, 112.5, 112.9, 113.0, 114.7, 122.5, 124.0, 134.3, 140.8, 145.1, 146.1, 153.0, 161.5, 175.4; IR (KBr) ν: 1761(C=O), 1635 (C=O) cm-1. Anal. calcd for C17H11NO4: C 69.62, H 3.78, N 4.78; found C 69.76, H 3.79, N 4.77.
1-甲基-2-(噻吩-2-基)-6-甲基吡喃并[3, 2-c]喹啉-4, 5-二酮(4l):黄色针状晶体. m.p.>300 ℃; 1H NMR (CDCl3, 400 MHz) δ: 3.71 (s, 3H, NCH3), 6.76 (s, 1H), 7.20~7.23 (m, 1H), 7.34~7.40 (m, 2H), 7.59 (d, J=7.6 Hz, 1H), 7.68~7.75 (m, 2H), 8.22 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 27.5, 109.1, 109.8, 111.1, 112.8, 120.7, 122.2, 126.3, 126.9, 128.5, 131.9, 132.4, 138.9, 154.8, 156.5, 159.6, 173.6; IR (KBr) ν: 1764(C=O), 1637 (C=O) cm-1. Anal. calcd for C17H11NO3S: C 66.01, H 3.58, N 4.53; found C 66.12, H 3.59, N 4.53.
辅助材料(Supporting Information) 合成产物的1H NMR和13C NMR图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Chen, J. J.; Chen, P. H.; Liao, C. H.; Huang S. Y.; Chen, I. S. J. Nat. Prod. 2007, 70, 1444.
(b) Hanawa, F.; Fokialakis N.; Skaltsounis, A. L. Planta Med. 2004, 70, 531.
(c) Madkour, H. M. F.; Mahmoud, M. R.; Sakr, A. M.; Habasy, M. M. Sci. Pharm. 2001, 69, 33. -
[2]
Chen, I. S.; Wu, S. J.; Tsai, I. L.; Wu, T. S.; Pezzuto, J. M.; Lu, M. C.; Chai, H.; Suh N.; Teng, C. M. J. Nat. Prod. 1994, 57, 1206. doi: 10.1021/np50111a003
-
[3]
(a) Barr, S. A.; Neville, C. F.; Grundon, M. F.; Boyd, D. R.; Malone, J. F.; Evans, T. A. J. Chem. Soc. Perkin Trans. 1 1995, 445.
(b) Ngadjui, B. T.; Ayafor, J. F.; Bilon, A. E. N.; Sondengam, B. L.; Connolly J. D.; Rycroft, D. S. Tetrahedron, 1992, 48, 8711.
(c) Grundon, M. F. Tetrahedron, 1978, 34, 143. -
[4]
Ghorab, M. M.; Heiba, H. I.; Amin, N. E. Pharmazie 1999, 54, 226.
-
[5]
Tavares, L. C.; Johann, S.; Alves, T. M. A.; Guerra, J. C.; Souza-Fagundes, E. M.; Cisalpino, P. Silva.; Bortoluzzi, A. J.; Caramori, G. F.; Piccoli. R. M.; Braibante, H. T. S.; Braibante, M. E. F.; Pizzolatti, M. G. Eur. J. Med. Chem. 2011, 46, 4448. doi: 10.1016/j.ejmech.2011.07.019
-
[6]
Guo, R. H.; Zhang, Q.; Ma, Y. B.; Luo, J.; Geng, C. A.; Wang, L. J.; Zhang, X. M.; Zhou, J.; Jiang, Z. Y.; Chen. J. J. Eur. J. Med. Chem. 2011, 46, 307. doi: 10.1016/j.ejmech.2010.11.019
-
[7]
Curreli, F.; Zhang, H.; Zhang, X.; Pyatkin, I.; Victor, Z.; Altieri, A.; Debnath, A. K. Bioorg. Med. Chem. 2011, 19, 77. doi: 10.1016/j.bmc.2010.11.045
-
[8]
(a) Rahman, M. M.; Gray, A. I.; Khondkar, P.; Sarker, S. D. Pharm. Biol. 2008, 46, 356.
(b) Meragelman, T. L.; Tucker, K. D.; McClord, T. G.; Cardel-lina, J. H.; Shoemker, R. H. J. Nat. Prod. 2005, 68, 1790. -
[9]
Hirpara, K. V.; Aggarwal, P.; Mukherjee, A. J.; Joshi, N.; Burman, A. C. Curr. Med. Chem. 2009, 9, 138.
-
[10]
(a) Mao, J.; Hua, Q.; Xie, G.; Guo, J.; Yao, Z.; Shi, D.; Ji, S. Adv. Synth. Catal. 2009, 351, 635.
(b) Naik, M. M.; Kamat, D. P.; Tilve, S. G.; Kamat, V. P. Tetrahedron 2014, 70, 5221. -
[11]
(a) Parvatkar, P. T. ; Parameswaran, P. S. ; Tilve, S. G. Chem. Eur. J. 2012, 18, 5460.
(b) Shen, S. S. ; Xu, X. P. ; Ji, S. J. Chin. J. Org. Chem. 2009, 29, 806 (in Chinese).
(沈舒苏, 徐小平, 纪顺俊, 有机化学, 2009, 29, 806. ) -
[12]
(a) Yin, G.; Fan, L.; Ren, T.; Zheng, C.; Tao, Q.; Wu, A.; She, N. Org. Biomol. Chem. 2012, 10, 8877.
(b) Ahmed, N.; Babu, B. V. Synth. Commun. 2013, 43, 3044. -
[13]
(a) Panarese, J. D.; Waters, S. P. Org. Biomol. Chem. 2013, 11, 3428.
(b) Wu, X.; Gao, Q.; Liu, S.; Wu, A. Org. Lett. 2014, 16, 2888. -
[14]
(a) Meng, D. J. ; Chen, R. X. ; Liu, L. T. ; Wang, T. ; Liu, X. M. ; Zhao, W. X. Chin. J. Org. Chem. 2015, 35, 2108 (in Chinese).
(孟团结, 陈荣祥, 刘澜涛, 王涛, 刘新明, 赵文献, 有机化学, 2015, 35, 2108. )
(b) Luo, Q. ; Xie, Y. X. ; Chen, C. Y. ; Yan, S. Y. ; Den, W. Y. Chin. J. Org. Chem. 2014, 34, 2537 (in Chinese).
(罗倩, 谢永新, 陈朝阳, 闫世友, 邓文叶, 有机化学, 2014, 34, 2537. )
(c) Hu, F. ; Gao, W. C. ; Chang, H. H. ; Li, X. ; Wei, W. L. Chin. J. Org. Chem. 2015, 35, 1848 (in Chinese).
(胡飞, 高文超, 常宏宏, 李兴, 魏文珑, 有机化学, 2015, 35, 1848. )
(d) Wang, D. Y. ; Zhang, R. X. ; Lin, S. ; Deng, R. H. ; Yan, Z. H. Chin. J. Org. Chem. 2016, 36, 2757 (in Chinese).
(王丁意, 张荣兴, 林森, 邓瑞红, 严兆华, 有机化学, 2016, 36, 2757. ) -
[15]
(a) Wang, D. L.; Wu, D.; Zhao, W.; Wang, Y. Y.; Wu, J. Y. Chin. Chem. Lett. 2015, 26, 251.
(b) Wang, D. L.; Zhou, T.; Xing, J. J.; Qiang, J. H.; Liu, L. Heterocycles, 2016, 92, 733.
(c) Wang, D. L.; Shi, X. C.; Wang, Y. Y.; Ma, J. Chin. Chem. Lett. 2016, 27, 261. -
[16]
(a) Ye, J. H. ; Wu, J. ; Huang, N. F. ; Zhang, W. C. ; Yu, S. Y. ; Qin, Z. C. ; Wang, Z. Y. ; Shang, Y. J. Chin. J. Org. Chem. 2010, 30, 1548 (in Chinese).
(叶家海, 吴俊, 黄年峰, 张文超, 余述燕, 秦志春, 王智勇, 商永嘉, 有机化学, 2010, 30, 1548. )
(b) Munawar, M. A. ; Azad, M. ; Siddiqui, H. L. ; Nasim, F. H. J. Chin. Chem. Soc. 2008, 55, 394.
(c) Azad, M. ; Munawar, M. A. ; Siddiqui, H. L. J. Applied Sci. 2007, 7, 2485. -
[17]
(a) Wang, D. L. ; Yang, F. F. ; Liu, Z. ; Dong, Z. ; Zhao, W. Chin. J. Org. Chem. 2014, 34, 204 (in Chinese).
(王道林, 杨菲菲, 刘忠, 董哲, 赵伟, 有机化学, 2014, 34, 204. )
(b) Gao, W. T. ; Cheng, X. P. ; Li, Y. Chin. J. Org. Chem. 2010, 30, 456 (in Chinese).
(高文涛, 程秀萍, 李阳, 有机化学, 2010, 30, 456. ) -
[18]
(a) Menezes, M. J.; Manjrekar, S.; Pai, V.; Patre, R. E.; Tilve, S. G. Indian J. Chem., Sect. B 2009, 48, 1311.
(b) Gao, W.; Li, Y.; Zhang, H.; Chang, M. Q.; Imafuku, K. J. Heterocyel. Chem. 2009, 46, 1107. -
[19]
Santosusso, T. M.; Swern, D. J. Org. Chem. 1975, 40, 2764. doi: 10.1021/jo00907a013
-
[20]
陈浩, 李杰, 陈国良, 周勋, 陆秀宏, 化学试剂, 2010, 32, 80. doi: 10.3969/j.issn.0258-3283.2010.01.021Chen, H.; Li, J.; Chen, G. L.; Zhou, X.; Lu, X. H. Chem. Reag. 2010, 32, 80 (in Chinese). doi: 10.3969/j.issn.0258-3283.2010.01.021
-
[1]
-
表 1 3-肉桂酰基-4-羟基-2-喹啉酮合成条件的优化
Table 1. Optimization of reaction conditions on the synthesis of 1-methyl-3-cinnamoyl-4-hydroxyquinoline-2-one (3a) a

表 2 化合物3的反应时间及产率
Table 2. Reaction times and yields of the products 3a

表 3 吡喃并[3, 2-c]喹啉-4, 5-二酮(4a)合成条件的优化a
Table 3. Optimization of reaction conditions on the synthesis of pyrano[3, 2-c]quinoline-4, 5-dione (4a)

表 4 化合物4的反应时间及产率
Table 4. Reaction times and yields of the products 4

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1400
- HTML全文浏览量: 64


 下载:
下载:

 下载:
下载:

