 图 图式 1
1-氮杂蒽在固态和溶液中的[4+4]光二聚反应
Figure 图式 1.
[4+4] photodimerization of 1-azaanthracene in the solid-state and in the solution
图 图式 1
1-氮杂蒽在固态和溶液中的[4+4]光二聚反应
Figure 图式 1.
[4+4] photodimerization of 1-azaanthracene in the solid-state and in the solution

Citation: Liu Weigang, Guo Lifeng, Fan Yangyang, Huang Zeao, Cong Huan. [4+4] Photodimerization of Anthracene Derivatives: Recent Synthetic Advances and Applications[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 543-554. doi: 10.6023/cjoc20161101

蒽衍生物的光化学[4+4]二聚反应:近期合成进展与应用
English
[4+4] Photodimerization of Anthracene Derivatives: Recent Synthetic Advances and Applications
-
Key words:
- anthracene
- / photochemistry
- / dimerization
- / [4+4] cycloaddition
- / synthetic applications
-
蒽及其衍生物是化学基础研究和工业应用中的重要稠环芳烃原料, 其在长波紫外光 (300~400 nm) 照射下发生[4+4]光二聚反应 (anthracene photodimerization) 是最早被人们发现的光化学反应之一, 相关文献报道可追溯至1867年[1, 2].蒽光二聚体的结构于1966年由Ehrenberg等通过单晶X射线衍射正式确定为对称的双桥环, 并且在中波紫外光 (250~290 nm) 或加热的条件下可以发生逆[4+4]反应 (cycloreversion) 分解重新生成蒽[3].经过一个多世纪的研究, 含杂原子的蒽衍生物[4]及其他稠环芳烃[5, 6]的[4+4]光二聚反应相继被发现; 关于蒽及其衍生物光二聚反应的性质及机理已较为清晰; 尤其是该反应具有底物多样、操作简便、过程可逆 (可控条件下) 等特点, 预示着反应的合成应用的巨大潜力.但是, 反应中生成的二聚体产物一般为难以分离且溶解性较差的立体异构体混合物, 因此很大程度上制约了蒽光二聚反应的广泛应用; 目前绝大多数已发表的相关文献中光二聚反应即为合成路线的终点, 而以光二聚物作为核心原料或中间体进行合成则鲜有报道[7~12].鉴于蒽光二聚体的结构具有独特的分子刚性、几何形状和潜手性, 针对其尚未被充分挖掘的合成用途开展进一步研究.为此, 一方面人们试图通过进一步调控、优化反应的选择性, 简化异构体的分离并实现精准分子结构的合成; 另一方面的研究着重设计新颖的分子结构与合成路线, 拓展反应的新用途.本文将重点关注近十余年来蒽光二聚反应的立体选择性与合成应用研究中的富于启发性的代表性进展, 围绕调控反应的区域选择性和对映选择性、功能有机分子和分子机器的合成应用等研究方向, 总结和分析这类经典光化学反应中所蕴含的创新点, 为该领域进一步研究提供思路.
2 蒽光二聚反应的区域选择性
对于因取代基而造成对称性降低的蒽衍生物, 其自身的光二聚体有多种可能的立体化学异构体.在不外加控制的条件下异构体比例为底物控制, 主要受取代基的电子和空间效应影响.近年来, 国内外若干课题组通过多种调控手段, 使蒽衍生物的极性取代基区域富集、反应底物定向排布, 从而展现出全新的反应活性, 甚至完全逆转底物的固有选择性, 成功实现了高区域选择性的光二聚反应[2, 13].
2.1 固相光反应
固相蒽光二聚反应利用晶体中分子密集有序的规则排布的特点, 通过成盐等方法调控晶体中特定底物的空间取向, 并对晶体直接光照发生反应.相比于液相条件下反应物分子杂乱随机的布朗运动, 在固相有序排布的底物之间发生的反应往往可以产生其他状态下无法得到的新反应活性和高区域选择性[14, 15].
9-取代蒽衍生物1在固态下不能发生自身光二聚反应, Ihmels等[16]发现三级胺化合物1与2-呋喃甲酸成盐结晶后在光照条件下可以高选择性地得到单一的头-尾 (h-t) 二聚体2 (Eq. 1). Ito等[17]进一步报道化合物1与共轭二羧酸成盐结晶后在光照条件下发生较为罕见的[1, 4]-[9', 10']位[4+4]二聚反应, 定量生成单一的h-t二聚体3 (Eq. 2).
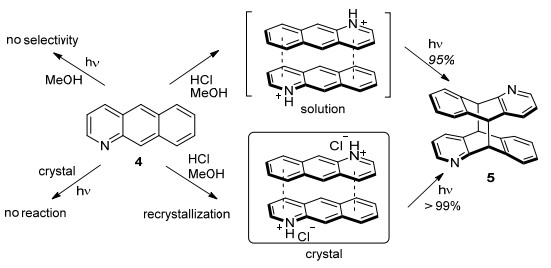
Yamada等[18]发现1-氮杂蒽4在甲醇溶液中的光二聚反应生成近似统计分布的异构体混合物, 而在固相形态下不能发生自身光二聚反应; 与上述结果形成鲜明对比, 化合物4在氯化氢甲醇溶液中或氯化氢成盐结晶状态下可几乎定量地进行[4+4]光反应, 且高区域选择性地得到单一的反式h-t二聚体5.其中, 酸性条件下化合物4中质子化的吡啶基团可通过π-阳离子作用和阳离子之间的排斥作用, 对反应底物的预取向至关重要, 从而影响反应的区域选择性 (Scheme 1).
 图 图式 1
1-氮杂蒽在固态和溶液中的[4+4]光二聚反应
Figure 图式 1.
[4+4] photodimerization of 1-azaanthracene in the solid-state and in the solution
图 图式 1
1-氮杂蒽在固态和溶液中的[4+4]光二聚反应
Figure 图式 1.
[4+4] photodimerization of 1-azaanthracene in the solid-state and in the solution
2.2 超分子微反应器
超分子主体作为微反应器, 能够提供特定结构的空腔或表面来定向结合并富集作为客体的底物分子, 促进化学反应快速且高选择性地发生, 从而显著降低背景反应的影响.尤其对于光化学反应, 超分子主-客体体系中的分子间相互作用, 甚至可以改变特定底物的光化学性质, 从而获得一般条件下难以得到的反应活性和选择性.
佟振合课题组[13, 19]报道以NaY型分子筛作为微反应器模板, 实现了含有双末端稠环类底物6的分子内萘-蒽光化学[4+4]反应.在分子筛提供的超分子笼中实现稠环基团的富集, 光反应以高产率和选择性得到h-t分子内环加成产物7, 而该反应产物在无分子筛的溶液条件下无法得到 (Eq. 3).
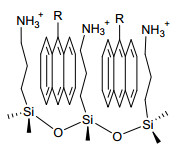
在进一步研究中, 佟振合、吴骊珠课题组相继以Nafion膜[20]、油包水微乳液[21]以及3-氨基丙基修饰的纳米硅胶颗粒[22]作为微反应器, 研究了一系列具有9位取代基的蒽衍生物的光二聚反应.实验结果表明:在这几类微反应器的促进下, 取代基中含有离子性或者极性官能团的蒽衍生物可高选择性地生成头-头 (h-h) 光二聚体.与此鲜明对比, 受取代基空间效应影响, 相同底物在不加调控下主要生成h-t光二聚体 (表 1).此外, 仅含有非极性取代基的蒽底物因无法与微反应器形成有效的主-客体体系, 在相同条件下未表现出明显区域选择性改变 (未在表 1中列出), 从侧面说明了极性基团之间的超分子非共价相互作用对反应区域选择性的强大调控能力.上述三种巧妙设计的微反应器克服了溶液中背景反应的影响, 完全逆转了蒽衍生物固有的区域选择性:其中在Nafion膜和油包水微乳液条件下, 蒽衍生物的极性端基在水/疏水相界面定向富集; 化学修饰的纳米硅胶构筑了类似胶束的结构, 使底物蒽环部分在亲脂的硅胶表面富集, 而极性取代基则向外指向溶剂相 (图 1), 上述因素均有利于h-h光二聚体的选择性生成.
 表 1
超分子微反应器调控9-取代蒽光二聚反应的区域选择性
Table 1.
Supermolecular microreactor-controlled regioselectivity for photodimerization of 9-substituted anthracenes
表 1
超分子微反应器调控9-取代蒽光二聚反应的区域选择性
Table 1.
Supermolecular microreactor-controlled regioselectivity for photodimerization of 9-substituted anthracenes

Compd. h-t/h-h Nafion membrane a Water-in-oil Mimicroemulsion b Modified silica nanoparticlec w/ w/o w/ w/o w/ w/o 8 92/8 0/100 65/35 0/100 83/17 8/92 9 100/0 7/93 83/17 8/92 80/20 0/100 10 90/10 6/94 68/32 10/90 86/14 33/67 a In CDCl3, with=w/, without=w/o; b in CH2Cl2; c in CH3OH. 表 1 超分子微反应器调控9-取代蒽光二聚反应的区域选择性
Table 1. Supermolecular microreactor-controlled regioselectivity for photodimerization of 9-substituted anthracenes相比于9-位取代, 2-位取代的蒽衍生物因其二聚反应产物异构体更复杂, 相关研究较少.利用超分子微反应器的调控策略, 杨成课题组[23]最近使用季铵盐阳离子修饰的柱[6]芳烃作为主体分子, 可显著促进2-蒽甲酸的光二聚反应h-h异构体的生成:相比于未加调控的条件, h-h/h-t的异构体比例可提高15倍以上.
2.3 金属离子络合
通过巧妙引入冠醚类结构单元, 含有双蒽官能团的底物在有无金属存在下借助强配位作用使得分子几何构型发生巨大改变, 蒽结构单元之间的相对空间位置与取向被固定, 从而实现调控分子内光二聚反应的区域选择性.
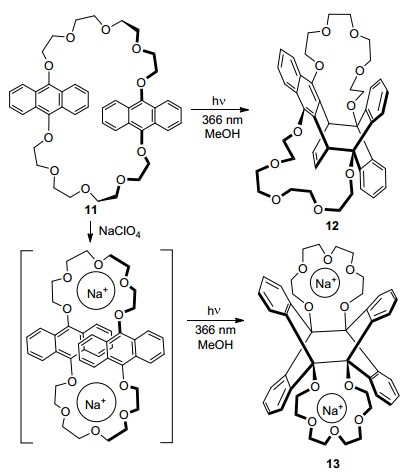
Desvergne等[24]报道金属钠离子显著影响含有双9, 10-取代蒽亚基单元的大环冠醚分子11的光反应结果.在无金属离子存在下, 由于取代基空间效应, 分子内[4+4]反应发生于[1, 4]-[9', 10']位得到产物12; 而当加入钠离子与底物形成稳定的2:1络合物时, 光二聚反应生成具有高度对称性的[9, 10]-[9', 10']位[4+4]环加成产物13 (Scheme 2).
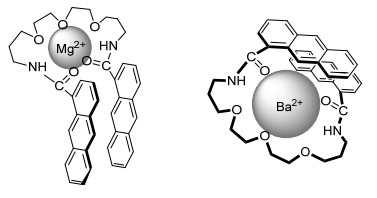
采用类似策略, Nakamura等[25]研究了醚类化合物14在不同ⅡA族元素离子存在下光二聚反应产物的三种异构体比例.实验结果表明, 半径较小的镁离子和钙离子显著促进cis-h-h产物16的生成, 而半径较大的锶离子和钡离子则可使trans-h-h产物15的相对比例上升.在金属离子存在下cis-h-t产物17的生成均受到明显抑制 (表 2).这种区域异构体比例的显著改变可能由于底物中的冠醚单元与不同半径金属离子配位后发生几何构像的改变 (图 2).
 表 2
Ⅱ族金属离子影响化合物14的光二聚产物比例
Table 2.
Isomer ratios for photodimers of 14 impacted by Group Ⅱ metal ions
表 2
Ⅱ族金属离子影响化合物14的光二聚产物比例
Table 2.
Isomer ratios for photodimers of 14 impacted by Group Ⅱ metal ions

Product No M2+ Mg2+ Ca2+ Sr2+ Ba2+ 15 31.9% 16.5% 24.7% 40.9% 45.7% 16 57.0% 81.3% 74.1% 59.0% 54.2% 17 11.1% 2.2% 1.2% 0.1% 0.1% 表 2 Ⅱ族金属离子影响化合物14的光二聚产物比例
Table 2. Isomer ratios for photodimers of 14 impacted by Group Ⅱ metal ions3 蒽光二聚反应的对映选择性
由于光反应普遍存在显著的背景反应以及分子在激发态下显现的高活性、短寿命和弱分子相互作用, 有机光反应的对映选择性控制具有很大挑战性, 是不对称合成领域的前沿科学难点问题[26~28].近年来, 在实现高区域选择性的基础上, 借助超分子手性诱导和手性辅基这两种主要策略, 蒽衍生物的不对称[4+4]光二聚反应的研究取得了重要进展.
Inoue等多年来针对2-蒽甲酸及其衍生物的不对称光二聚反应发表了一系列突破性工作, 结合多种手型诱导方法, 利用超分子主客体[29~31]、生物大分子[32~34]、手性小分子[35]、手性辅基[36~38]等体系相继实现了高对映选择性的[4+4]光二聚反应, 该课题组近期的代表性结果总结于表 3.尤其值得注意的是该课题组近期发展了六碳糖作为核心骨架的手型辅基, 将2-蒽甲酸以脂键方式连接于六碳糖2, 3-位的相邻平伏键羟基上, 同时促进了光二聚反应的区域选择性和对映选择性.相比于早期使用的复杂环形多糖辅基CNN[36], 最近的研究结果表明, 使用结构简单、制备快捷廉价的葡萄糖衍生物BnGlc即可得到>99%光学纯的anti-h-h异构体21, 且21与其他立体异构体的选择性均高于10:1[38].

Strategy Substrate+chiral sourcea Yield/% (ee/%) Ref. 19 20 21 22 Host-guest reactors AC-α-CD+γ-CD 30 68 (91) 1 (-2) 1 [29] AC2-α-CD+γ-CD <0.1 1 (7) 97 (98) 2 [30] AC2-α-CD+CB[8] <0.1 <0.1 98 (99) 2 [30] Biomacromolecules AC+HSA 5 6 (82) 6 (90) 0.6 [32] AC+wt-HSA 7 7 (79) 2 (92) 1 [33] AC+CSA 8 32 (97) 0.8 (18) 0.8 [34] Chiral small molecules AC+prolinol <0.1 <0.1 51 (-72) 49 [35] Chiral auxiliary AC2-CNN 0.9 0.5 96 (-99) 2.3 [36] AC2-BnGlc <0.1 <0.1 83 (-99) 6 [38] a HSA=human serum albumin; wt-HSA=wild-type HSA; CSA=Canine serum albumin. 表 3 2-蒽甲酸的不对称光二聚反应
Table 3. Asymmetric photodimerizations of 2-anthracenecarboxylic acid利用手性辅基策略, 人们分别实现了分子内和分子间的不对称蒽-萘[4+4]光环加成反应. Kohmoto等[39]设计并合成了含有手性酰亚胺连接单元的分子23, 该分子在固相或溶液中均可发生分子内[4+4]光环加成反应, 并高对映选择性地得到产物24 (Eq. 4). Sakamoto等[40, 41]报道带有脯氨酸衍生的手性辅基的萘酰胺25, 通过重结晶可以得到单一阻转异构体, 进而与9-氰基蒽进行分子间[4+4]反应, 以高区域选择性及对映选择性获得光环加成产物26 (Eq. 5).
4 蒽光二聚反应在功能有机分子合成中的应用
近年来, 借助蒽光二聚体的刚性几何形状和巧妙的合成设计, 人们尝试制备了若干具有独特结构的功能有机分子[42, 43].因前述溶解性和异构体分离的问题困扰, 尽管利用蒽光二聚反应的相关合成报道仍然较少, 最近的一些研究结果令人鼓舞.
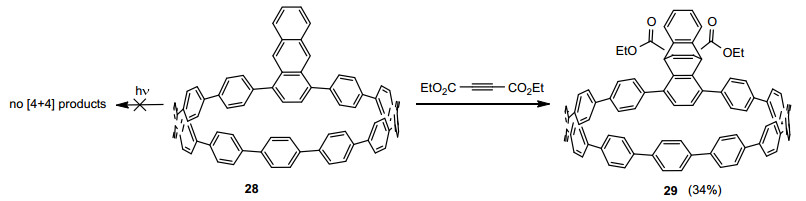
Sakamoto等[44~46]利用蒽光二聚体的刚性弯折结构, 以蒽的三叠烯衍生物27为原料, 通过[4+4]光二聚反应成功地构建了具有类六边形大孔结构的二维高分子 (Eq. 6), 并通过扫描隧道显微镜清晰观测到了二维高分子的规整形貌. Jasti等[12]在具有较大分子张力的[10]环对苯撑 (cycloparaphenylene) 中引入了1, 4-二取代蒽的结构单元合成化合物28, 并获得了该分子的单晶X射线衍射结构. 28在蒽的9, 10-位可与亲双烯体顺利得到[4+2]环加成产物29, 但在光照条件下没有得到期望的化合物28分子间[4+4]二聚产物 (Scheme 3). Jasti等认为环对苯撑体系的分子张力导致1, 4-二取代蒽结构发生扭曲, 从而影响了蒽基团的[4+4]光二聚反应活性.
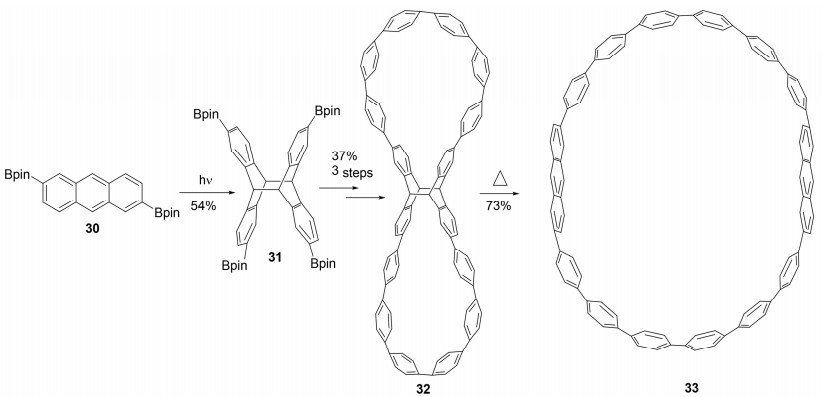
最近, 丛欢课题组[47]报道了应用蒽光二聚体的刚性弯折结构作为中心合成单元, 利用光二聚反应可逆的特性并借助过渡金属促进的偶联反应等方法构建高度扭曲的非平面芳香大环分子.合成路线以易得的2, 6-二取代的蒽衍生物30起始, 其[4+4]光二聚产物可通过重结晶纯化得到单一的h-t异构体31, 分子上修饰的频哪醇硼酸酯基团大幅提高了蒽二聚体的溶解性, 且为后续交叉偶联构建碳骨架提供反应位点.继而通过Suzuki偶联、Yamamoto偶联、萘自由基负离子还原三步合成高度扭曲的非平面共轭双环分子32, 并通过单晶X射线衍射确定其具有数字8形状的独特几何结构.在合成后期利用光二聚反应可逆的特性在加热条件下实现逆[4+4]反应并扩环, 精确合成碳纳米环分子33 (Scheme 4).上述两个共轭纳米分子均为首次合成, 并具有独特的光电性质, 为进一步合成以及优化材料性质奠定了基础, 并首次展现了蒽光二聚体作为核心合成子在快速、高产率、精确制备碳基纳米分子的应用.
5 蒽光二聚反应在分子机器合成中的应用
随着2016年诺贝尔化学奖的颁发, 分子机器的设计与合成作为近几十年来的热点研究领域更加受到关注和重视.蒽及其衍生物具有在可控条件下进行高效二聚和解聚的特性, 分子的几何构型和光电性质也随之发生巨大改变, 因此蒽衍生物的光化学反应性质长期以来被广泛应用于多种精巧设计的分子机器的合成.由于蒽光二聚和解聚的条件互不干扰, 这一突出优点在实现可控的可逆分子功能方面具有尤其重要的用途.
Mattay等[48]借助修饰有两个末端蒽单元的类杯芳烃分子34, 利用蒽在350 nm紫外光照下二聚生成笼状分子35, 35在加热的条件下可解聚重新生成化合物34, 从而发展了一种具有潜在主体分子性质的化学开关 (Eq. 7).
Houk等[49]利用蒽光二聚反应的可逆性, 在偶联的双杯芳烃上修饰两个蒽单元合成主体分子36. 36通过光二聚-解聚反应实现了对客体分子对二甲氧基苯的可逆包封与释放 (Eq. 8).
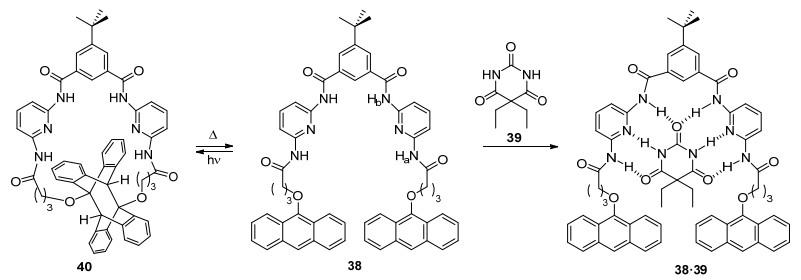
Bassani、Tucker和Desvergne等[50~52]设计并合成了由两个末端蒽单元、两个2, 6-二氨基吡啶单元和一个间苯二甲酸单元以酰胺键连接的主体分子38.借助分子间氢键的相互作用, 38可与客体分子环脲39发生较强的结合; 在光照作用下38发生分子内[4+4]环加成得到40, 使得主体分子结构和氢键给-受体相对位置发生显著改变, 从而高效控制主-客体分子之间结合 (Scheme 5).
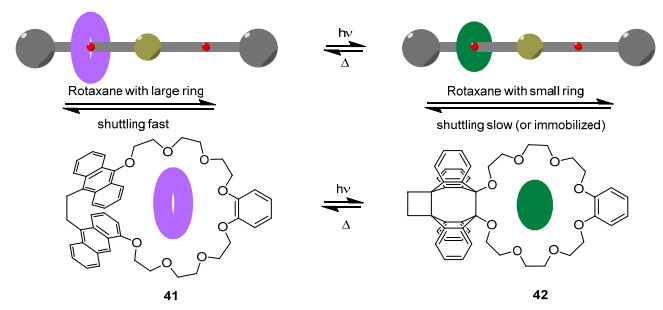
轮烷和锁烃是常见的两种机械互锁分子, 也是分子机器中常见且重要的组成单元, 蒽的光二聚反应在这两类分子的合成中也有巧妙设计的应用. Hirose等[53]合成了一种具有调控往复运动速率功能的轮烷体系, 其中的环状分子41在常用的类冠醚结构中修饰有两个邻近的蒽单元.利用蒽的光二聚及解聚反应, 大环41和小环42之间可随之发生可逆转化.当作者将分子41应用于轮烷结构中, 通过光/热控制环直径变化实现对轮烷往复运动的速率控制, 甚至在一定条件下使轮烷锁定位置, 不能随意移动 (Scheme 6).
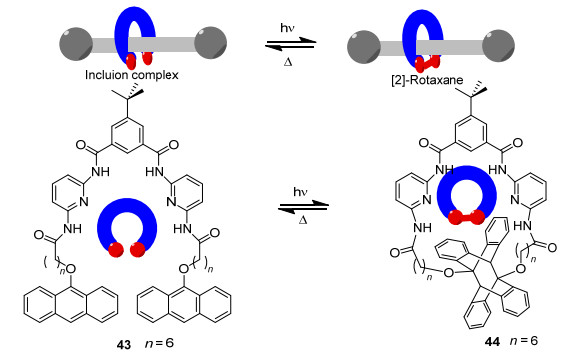
McClenaghan等[54]利用与前述分子38结构类似的双末端修饰有蒽单元的分子43, 通过43以氢键同另一个哑铃状的线型分子上特定的氢键结合位点形成稳定包合物.43发生光二聚反应并成环生成44的同时, 上述氢键包合物即形成轮烷体系, 该过程在加热的条件下随着蒽二聚体的解聚而可逆 (Scheme 7).该课题组[55]进一步合成了两端含有9-烷氧基蒽作为闭锁装置的哑铃状线型分子, 其中心含有二苯铵盐用以结合冠醚分子形成轮烷45.借助可逆的末端蒽基团的二聚与解聚反应, 巧妙实现了轮烷45和索烃46之间的互变 (Eq. 9).
Cano等[56]将蒽的[4+4]光二聚反应应用于金属络合物并实现了光/热控制的分子磁性开关.作者通过有针对性的巧妙设计, 合成了含有桥联蒽基团的双核的草酸铵铜络合物47, 并利用分子内蒽光二聚与解聚对分子几何形状和对称性的改变, 成功实现了反磁性络合物47与顺磁性络合物48之间的光磁转换 (Eq. 10).
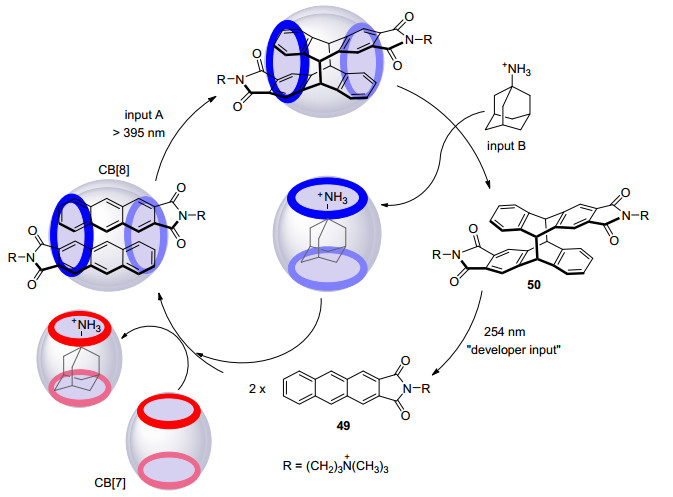
Pischel等[57]将蒽的[4+4]光二聚反应应用于分子逻辑体系, 合成了修饰季铵阳离子侧链的蒽衍生物49, 利用其与氨基金刚烷同葫芦脲 (CB[n]) 分子之间相互结合形成主-客体的竞争关系, 使得只有“输入”正确的信号顺序 (先input A后input B), 才能得到蒽光二聚体50的输出; 继而“输入”CB[7]可使逻辑循环重置.以上循环过程在试管中实现了“分子键盘锁”的功能 (Scheme 9).
6 总结与展望
有机合成光化学作为重要的合成方法来源和阐明化学键成断键规律的手段, 为探索高效高选择性的物质转化新途径提供了不可多得的经验积累和研究机遇, 值得进一步挖掘包含蒽[4+4]光二聚反应在内的经典光化学反应中蕴含的创新点, 创造更广泛的合成应用[58].
蒽[4+4]光二聚反应有着有超过百年研究历史, 其反应性质、机理等方面早已为人所知, 但该反应在合成中的应用与反应本身悠久深厚的研究历史并不相称, 目前仍然非常有限.结合本文总结的内容, 在今后的研究中蒽[4+4]光二聚反应面临的挑战可能包括以下两方面: (1) 进一步提高控制反应立体选择性的能力, 发展廉价普适的反应体系克服反应底物自身的区域选择性, 实现针对较广泛底物的催化不对称[4+4]方法; (2) 有针对性的设计并合成新型功能分子、有机框架和分子机器结构, 最大化利用蒽光二聚体的特性.尽管在反应的区域和对映选择性方面的研究已经取得了长足发展和进步, 加强对[4+4]反应立体选择性的调控将会对进一步拓展反应用途提供重要的方法学前提.值得注意的是, 蒽光二聚体具有独特的几何结构、分子刚性, 及其在可控条件下的优秀可逆性, 这些在其他分子中难以复制的特性决定了蒽[4+4]光二聚反应在有机功能分子和分子机器等领域的合成应用必将大有可为.
-
-
[1]
Becker, H.-D. Chem. Rev. 1993, 93, 145. doi: 10.1021/cr00017a008
-
[2]
Bouas-Laurent, H.; Castellan, A.; Desvergne, J.-P.; Lapouyade, R. Chem. Soc. Rev. 2000, 29, 43. doi: 10.1039/a801821i
-
[3]
Bouas-Laurent, H.; Castellan, A.; Desvergne, J.-P.; Lapouyade, R. Chem. Soc. Rev. 2001, 30, 248. doi: 10.1039/b006013p
-
[4]
For selected examples on photodimerizations of heteroaromatics:
(a) Zhang, Y.; Wang, L.; Zhang, M.; Fun, H.-K.; Xu, J.-H. Org. Lett. 2004, 6, 4893;
(b) Wang, R.; Yuan, L.; Macartney, D. H. J. Org. Chem. 2006, 71, 1237;
(c) Ihmels, H.; Luo, J. J. Photochem. Photobiol., A 2008, 200, 3. -
[5]
For selected examples on photodimerizations of naphthalene derivatives:
(a) Tung, C.-H.; Wang, Y.-M. J. Am. Chem. Soc. 1990, 112, 6322.
(b) Lei, L.; Wu, L.-Z.; Wu, X.-L.; Liao, G.-H.; Luo, L.; Zhang, L.-P.; Tung, C.-H.; Ding, K.-L. Tetrahedron Lett. 2006, 47, 4725.
(c) Luo, L.; Cheng, S.-F.; Chen, B.; Tung, C.-H.; Wu, L.-Z; Langmuir 2010, 26, 782.
(d) Xu, H.-X.; Cheng, S.-F.; Yang, X.-J.; Chen, B.; Chen, Y.; Zhang, L.-P.; Wu, L.-Z.; Fang, W.; Tung, C.-H.; Weiss, R. G. J. Org. Chem. 2012, 77, 1685. -
[6]
For selected examples on photodimerizations of tetracene and pentacene:
(a) Reichwagen, J.; Hopf, H.; Del Guerzo, A.; Desvergne, J.-P.; Bouas-Laurent, H. Org. Lett. 2004, 6, 1899.
(b) Benard, C. P.; 'Geng, Z.; Heuft, M. A.; VanCrey, K.; Fallis, A. G. J. Org. Chem. 2007, 72, 7229. -
[7]
Takaguchi, Y.; Tajima, T.; Ohta, K.; Motoyoshiya, J.; Aoyama, H. Chem. Lett. 2000, 29, 1388. doi: 10.1246/cl.2000.1388
-
[8]
Cao, D.; Meier, H. Angew. Chem., Int. Ed. 2001, 40, 186. doi: 10.1002/1521-3773(20010105)40:1<>1.0.CO;2-6
-
[9]
Benard, C. P.; Geng, Z.; Heuft, M. A.; VanCrey, K.; Fallis, A. G. J. Org. Chem. 2007, 72, 7229. doi: 10.1021/jo0709807
-
[10]
Liang, C.-K.; Desvergne, J.-P.; Bassani, D. M. Photochem. Photobiol. Sci. 2014, 13, 316. doi: 10.1039/C3PP50322D
-
[11]
Fukuhara, G.; Iida, K.; Kawanami, Y.; Tanaka, H.; Mori, T.; Inoue, Y. J. Am. Chem. Soc. 2015, 137, 15007. doi: 10.1021/jacs.5b09775
-
[12]
Li, P.; Wong, B. M.; Zakharov, L. N.; Jasti, R. Org. Lett. 2016, 18, 1574. doi: 10.1021/acs.orglett.6b00430
-
[13]
Tung, C.-H.; Wu, L.-Z.; Zhang, L.-P.; Chen, B. Acc. Chem. Res. 2003, 36, 39. doi: 10.1021/ar010141l
-
[14]
Schmidt, G. M. J. Pure Appl. Chem. 1971, 27, 647.
-
[15]
Ito, Y.; Fujita, H. J. Org. Chem. 1996, 61, 567.
-
[16]
Ihmels, H.; Leusser, D.; Pfeiffer, M.; Stalke, D. Tetrahedron 2000, 56, 6867. doi: 10.1016/S0040-4020(00)00508-1
-
[17]
Horiguchi, M.; Ito, Y. J. Org. Chem. 2006, 71, 3608. doi: 10.1021/jo060315i
-
[18]
Yamada, S.; Kawamura, C. Org. Lett. 2012, 14, 1572. doi: 10.1021/ol3003089
-
[19]
Tung, C. H.; Wu, L. Z.; Yuan, Z. Y.; Su, N. J. Am. Chem. Soc. 1998, 120, 11594. doi: 10.1021/ja9741178
-
[20]
Tung, C.-H., Guang, J.-Q. J. Org. Chem. 1998, 63, 5857. doi: 10.1021/jo980412e
-
[21]
Wu, D.-Y.; Zhang, L.-P.; Wu, L.-Z.; Wang, B.-J.; Tung, C.-H. Tetrahedron Lett. 2002, 43, 1281. doi: 10.1016/S0040-4039(01)02360-7
-
[22]
Wu, D.-Y.; Chen, B.; Fu, X.-G.; Wu, L.-Z.; Zhang, L.-P.; Tung, C.-H. Org. Lett. 2003, 5, 1075. doi: 10.1021/ol0341041
-
[23]
Gui, J.-C.; Yan, Z.-Q.; Peng, Y.; Yi, J.-G.; Zhou, D.-Y.; Su, D.; Zhong, Z.-H.; Gao, G.-W.; Wu, W.-H.; Yang, C. Chin. Chem. Lett. 2016, 27, 1017. doi: 10.1016/j.cclet.2016.04.021
-
[24]
Marquis, D.; Desvergne, J.-P.; Bouas-Laurent, H. J. Org. Chem. 1995, 60, 7984. doi: 10.1021/jo00129a045
-
[25]
Hiraga, H.; Morozumi, T.; Nakamura, H. Tetrahedron Lett. 2002, 43, 9093. doi: 10.1016/S0040-4039(02)02310-9
-
[26]
Rau, H. Chem. Rev. 1983, 83, 535. doi: 10.1021/cr00057a003
-
[27]
Inoue, Y. Chem. Rev. 1992, 92, 741. doi: 10.1021/cr00013a001
-
[28]
Yang, C.; Inoue, Y. Chem. Soc. Rev. 2014, 43, 4123. doi: 10.1039/C3CS60339C
-
[29]
Yang, C.; Mori, T.; Origane, Y.; Ko, H. Y.; Selvapalam, N.; Kim, K.; Inoue, Y. J. Am. Chem. Soc. 2008, 130, 8574. doi: 10.1021/ja8032923
-
[30]
Yang, C.; Ke, C.-F.; Liang, W.; Fukuhara, G.; Mori, T.; Liu, Y.; Inoue, Y. J. Am. Chem. Soc. 2011, 133, 13786. doi: 10.1021/ja202020x
-
[31]
Yao, J.; Yan, Z.; Ji, J.; Wu, W.; Yang, C.; Nishijima, M.; Fukuhara, G.; Mori, T.; Inoue, Y. J. Am. Chem. Soc. 2014, 136, 6916. doi: 10.1021/ja5032908
-
[32]
Nishijima, M.; Wada, T.; Mori, T.; Pace, T. C. S.; Bohne, C.; Inoue, Y. J. Am. Chem. Soc. 2007, 129, 3478. doi: 10.1021/ja068475z
-
[33]
Nishijima, M.; Kato, H.; Fukuhara, G.; Yang, C.; Mori, T.; Maruyama, T.; Otagiri, M.; Inoue, Y. Chem. Commun. 2013, 49, 7433. doi: 10.1039/c3cc42656d
-
[34]
Nishijima, M.; Goto, M.; Fujikawa, M.; Yang, C.; Mori, T.; Wada, T.; Inoue, Y. Chem. Commun. 2014, 50, 14082. doi: 10.1039/C4CC04818K
-
[35]
Kawanami, Y.; Katsumata, S.-Y.; Nishijima, M.; Fukuhara, G.; Asano, K.; Suzuki, T.; Yang, T.; Nakamura, A.; Mori, T.; Inoue, Y. J. Am. Chem. Soc. 2016, 138, 12187. doi: 10.1021/jacs.6b05598
-
[36]
Fukuhara, G.; Nakamura, T.; Kawanami, Y.; Yang, C.; Mori, T.; Hiramatsu, H.; Dan-oh, Y.; Tsujimoto, K.; Inoue, Y. Chem. Commun. 2012, 48, 9156. doi: 10.1039/c2cc34880b
-
[37]
Fukuhara, G.; Nakamura, T.; Kawanami, Y.; Yang, C.; Mori, T.; Hiramatsu, H.; Dan-oh, Y.; Nishimoto, T.; Tsujimoto, K.; Inoue, Y. J. Org. Chem. 2013, 78, 10996. doi: 10.1021/jo401977f
-
[38]
Fukuhara, G.; Iida, K.; Kawanami, Y.; Tanaka, H.; Mori, T.; Inoue, Y. J. Am. Chem. Soc. 2015, 137, 15007. doi: 10.1021/jacs.5b09775
-
[39]
Kohmoto, S.; Ono, Y.; Masu, H.; Yamaguchi, C.; Kishikaw, K.; Yamamoto, M. Org. Lett. 2001, 3, 4153. doi: 10.1021/ol010206k
-
[40]
Sakamoto, M.; Unosawa, A.; Kobaru, S.; Saito, A.; Mino, T.; Fujita, T. Angew. Chem., Int. Ed. 2005, 44, 5523. doi: 10.1002/(ISSN)1521-3773
-
[41]
Sakamoto, M.; Unosawa, A.; Kobaru, S.; Hasegawa, Y.; Mino, T.; Kasashima, Y.; Fujita, T.; Chem. Commun. 2007, 1632.
-
[42]
Barth, J. V.; Costantini, G.; Kern, K. Nature 2005, 437, 671. doi: 10.1038/nature04166
-
[43]
Kissel, P.; Heijst, J.; Enning, R.; Stemmer, A.; Schlüter, A. D.; Sakamoto, J. Org. Lett. 2010, 12, 2778. doi: 10.1021/ol100877g
-
[44]
Li, M.; Schlüter, A. D.; Sakamoto, J. J. Am. Chem. Soc. 2012, 134, 11721. doi: 10.1021/ja3038905
-
[45]
Kissel, P.; Erni, R.; Schweizer, W. B.; Rossell, M. D.; King, B. T.; Bauer, T.; Götzinger, S.; Schlüter, A. D.; Sakamoto, J. Nat. Chem. 2012, 4, 287. doi: 10.1038/nchem.1265
-
[46]
Murray, D. J.; Patterson, D. D.; Payamyar, P.; Bhola, R.; Song, W.; Lackinger, M.; Schlüter, A. D.; King, B. T. J. Am. Chem. Soc. 2015, 137, 3450. doi: 10.1021/ja512018j
-
[47]
Huang, Z.-A.; Chen, C.; Yang, X.-D.; Fan, X.-B.; Zhou, W.; Tung, C.-H.; Wu, L.-Z.; Cong, H. J. Am. Chem. Soc. 2016, 138, 11144. doi: 10.1021/jacs.6b07673
-
[48]
Schäfer, C.; Mattay, J. Photochem. Photobiol. Sci. 2004, 3, 331. doi: 10.1039/B400351A
-
[49]
Hao, W.; Fang, L.; Helgeson, R. C.; Houk, K. N. Angew. Chem., Int. Ed. 2013, 52, 655. doi: 10.1002/anie.201205376
-
[50]
Molard, Y.; Bassani, D. M.; Desvergne, J.-P.; Horton, P. N.; Hursthouse, M. B.; Tucker, J. H. R. Angew. Chem., Int. Ed. 2005, 44, 1072. doi: 10.1002/(ISSN)1521-3773
-
[51]
Molard, Y.; Bassani, D. M.; Desvergne, J.-P.; Moran, N.; Tucker, J. H. R. J. Org. Chem. 2006, 71, 8523. doi: 10.1021/jo061528a
-
[52]
Chih-Kai, L.; Dubacheva, G. V.; Buffeteau, T.; Cavagnat, D.; Hapiot, P.; Fabre, B.; Tucker, J. H. R.; Bassani, D. M. Chem. Eur. J. 2013, 19, 12748. doi: 10.1002/chem.201301613
-
[53]
Hirose, K.; Shiba, Y.; Ishibashi, K.; Doi, Y.; Tobe, Y. Chem. Eur. J. 2008, 14, 3427. doi: 10.1002/(ISSN)1521-3765
-
[54]
Tron, A.; Thornton, P. J.; Lincheneau, C.; Desvergne, J.-P.; Spencer, N.; Tucker, J. H. R.; McClenaghan, N. D. J. Org. Chem. 2015, 80, 988. doi: 10.1021/jo502452t
-
[55]
Tron, A.; Jacquot de Rouville, H.-P.; Ducrot, A.; Tucker, J. H. R.; Baroncini, M.; Credi, A.; McClenaghan, N. D. Chem. Commun. 2015, 51, 2810. doi: 10.1039/C4CC09472G
-
[56]
Castellano, M.; Ferrando-Soria, J.; Pardo, E.; Julve, M.; Lloret, F.; Mathoniere, C.; Pasan, J.; Ruiz-Perez, C.; Canadillas-Delgado, L.; Ruiz-Garcia, R.; Cano, J. Chem. Commun. 2011, 47, 11035. doi: 10.1039/c1cc15087a
-
[57]
Carvalho, C. P.; Dominguez, Z.; Silva, J. P. D.; Pischel, U. Chem. Commun. 2015, 51, 2698. doi: 10.1039/C4CC09336D
-
[58]
For selected reviews:
(a) Sieburth, S. M.; Cunard, N. T. Tetrahedron 1996, 52, 6251.
(b) Hoffmann, N. Chem. Rev. 2008, 108, 1052.
(c) Meier, H.; Cao, D. Chem. Soc. Rev. 2013, 42, 143.
-
[1]
-
表 1 超分子微反应器调控9-取代蒽光二聚反应的区域选择性
Table 1. Supermolecular microreactor-controlled regioselectivity for photodimerization of 9-substituted anthracenes

Compd. h-t/h-h Nafion membrane a Water-in-oil Mimicroemulsion b Modified silica nanoparticlec w/ w/o w/ w/o w/ w/o 8 92/8 0/100 65/35 0/100 83/17 8/92 9 100/0 7/93 83/17 8/92 80/20 0/100 10 90/10 6/94 68/32 10/90 86/14 33/67 a In CDCl3, with=w/, without=w/o; b in CH2Cl2; c in CH3OH. 表 2 Ⅱ族金属离子影响化合物14的光二聚产物比例
Table 2. Isomer ratios for photodimers of 14 impacted by Group Ⅱ metal ions

Product No M2+ Mg2+ Ca2+ Sr2+ Ba2+ 15 31.9% 16.5% 24.7% 40.9% 45.7% 16 57.0% 81.3% 74.1% 59.0% 54.2% 17 11.1% 2.2% 1.2% 0.1% 0.1% 表 3 2-蒽甲酸的不对称光二聚反应
Table 3. Asymmetric photodimerizations of 2-anthracenecarboxylic acid

Strategy Substrate+chiral sourcea Yield/% (ee/%) Ref. 19 20 21 22 Host-guest reactors AC-α-CD+γ-CD 30 68 (91) 1 (-2) 1 [29] AC2-α-CD+γ-CD <0.1 1 (7) 97 (98) 2 [30] AC2-α-CD+CB[8] <0.1 <0.1 98 (99) 2 [30] Biomacromolecules AC+HSA 5 6 (82) 6 (90) 0.6 [32] AC+wt-HSA 7 7 (79) 2 (92) 1 [33] AC+CSA 8 32 (97) 0.8 (18) 0.8 [34] Chiral small molecules AC+prolinol <0.1 <0.1 51 (-72) 49 [35] Chiral auxiliary AC2-CNN 0.9 0.5 96 (-99) 2.3 [36] AC2-BnGlc <0.1 <0.1 83 (-99) 6 [38] a HSA=human serum albumin; wt-HSA=wild-type HSA; CSA=Canine serum albumin. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 329
- 文章访问数: 11904
- HTML全文浏览量: 5051


 下载:
下载:









 下载:
下载:

