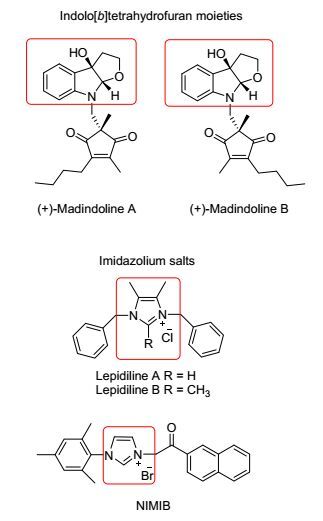
 图 1
含吲哚并四氢呋喃结构单元和咪唑盐的代表性化合物结构
Figure Figure1.
Representative structures of indolo[b]tetrahydrofuran moieties and imidazolium salts
图 1
含吲哚并四氢呋喃结构单元和咪唑盐的代表性化合物结构
Figure Figure1.
Representative structures of indolo[b]tetrahydrofuran moieties and imidazolium salts

Citation: Liu Zhengfen, Zhang Chaobo, Duan Shengzu, Liu Yang, Chen Wen, Li Yan, Zhang Hongbin, Yang Xiaodong. Synthesis and Cytotoxic Activity of Novel Hybrid Compounds between Indolo[b]tetrahydrofuran and Imidazolium Salts[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1506-1515. doi: 10.6023/cjoc201610043

吲哚并四氢呋喃-咪唑盐杂合物的合成及细胞毒活性研究
English
Synthesis and Cytotoxic Activity of Novel Hybrid Compounds between Indolo[b]tetrahydrofuran and Imidazolium Salts
-
Key words:
- indolo[b]tetrahydrofuran
- / imidazolium salts
- / hybrid compound
- / cytotoxic activity
-
迄今为止, 癌症仍然是人类死亡的主要原因之一, 开发新的抗癌药物和更有效的治疗癌症策略显得尤为重要.结构复杂多变的天然产物是现代药物的重要组成部分和新药发现的源泉.据统计, 超过50%的现代临床抗肿瘤药物直接或间接地来源于天然产物.基于活性天然产物分子结构, 设计并合成类天然产物库, 从中筛选并发现高效率、高选择性、低毒副作用的先导化合物进行药物临床前研究, 是新药研发的最重要途径之一[1-2].
吲哚并四氢呋喃结构单元广泛存在于天然产物及合成药物分子中, 具有广泛的药理活性[3].例如, 含吲哚并四氢呋喃骨架的(+)-Madindolines A和B (图 1)是由Ohmura课题组[4]从硝孢链霉菌K93-0711中分离得到的代谢产物, 对白细胞介素6 (IL-6) 具有显著的选择性抑制活性[5].由于IL-6细胞因子过量, 会导致恶性肿瘤、多发性骨髓瘤等病变, (+)-Madindolines A和B被认为是良好的抗肿瘤先导化合物[6, 7].
 图 1
含吲哚并四氢呋喃结构单元和咪唑盐的代表性化合物结构
Figure Figure1.
Representative structures of indolo[b]tetrahydrofuran moieties and imidazolium salts
图 1
含吲哚并四氢呋喃结构单元和咪唑盐的代表性化合物结构
Figure Figure1.
Representative structures of indolo[b]tetrahydrofuran moieties and imidazolium salts
咪唑类化合物在药物研究和发展过程中有着重要的地位, 其五元杂环结构广泛存在于天然产物分子中, 是许多活性天然产物的重要结构单元[8], 具有良好的药理活性, 如抗菌、抗炎、抗结核, 尤其是抗肿瘤活性等[9].在很多的已经上市或研发的药物中, 也经常以咪唑类化合物作为重要的药效团.特别是咪唑盐化合物, 由于具有广泛的生物和药理活性引起国内外广大药物化学家的兴趣.例如, 天然产物Lepidilines A和B(图 1)对肿瘤细胞株具有显著的细胞毒活性[10]; 本课题组设计合成的咪唑盐化合物NIMIB(图 1)具有显著地抗肿瘤细胞毒活性[11].
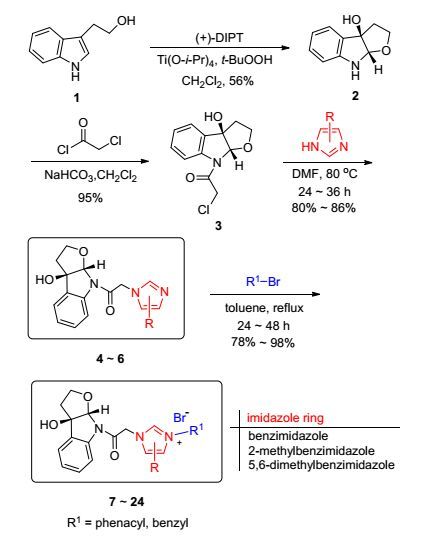
在过去的20多年里, 分子杂合手段广泛应用于新型药物分子的设计及合成[12].分子杂合(Molecular hybridization)是将不同天然产物的活性结构单元与活性分子或药物分子之间进行有机地结合来形成新化合物的设计方法, 能够有效地提高药物作用靶点的选择, 同时也能降低其毒副作用[13].很多药物化学工作者认为这一方法是寻找药物先导化合物和生物活性分子的一个极具潜力的新策略, 目前已取得了较好的成果[13, 14].在前期的工作中, 本课题组采用分子杂合设计合成了多种不同结构的咪唑盐组合物, 具有良好的生理活性[15].基于吲哚并四氢呋喃和咪唑杂环这两个药效团以及本课题组多年来对咪唑盐类化合物的研究, 本文设计合成了一系列吲哚并四氢呋喃—咪唑盐化合物, 以研究其生物活性, 从而发现具有良好抗肿瘤活性的新分子, 为进一步的药物化学研究提供物质基础和新的指导意义.具体合成路线见Scheme 1.
1 结果与讨论
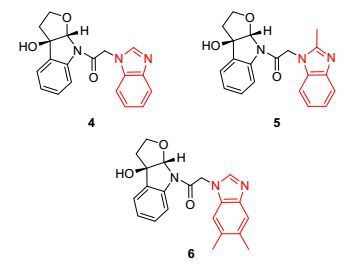
本文从商品化原料色醇出发, 在(+)-酒石酸二异丙酯、四异丙氧基钛、过氧叔丁醇的作用下, 发生Sharpless不对称环氧化反应得到化合物2 [收率56%, 99% ee, [α]D25-144 (c 0.84, CHCl3)][16]; 化合物2在碳酸氢钠的作用下与氯乙酰氯缩合, 以95%的收率制备得到酰胺化合物3; 化合物3在取代咪唑自身作碱的条件下与各类苯并咪唑偶联, 以80%~86%的收率制备得到3个新型的吲哚并四氢呋喃-咪唑化合物4~6, 结构见图 2.
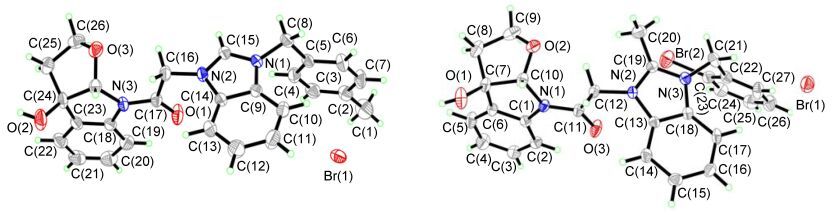
吲哚并四氢呋喃-咪唑化合物与溴代烷烃在丙酮中进一步回流反应, 以78%~98%的收率制备得到18个新型的氮杂吲哚并四氢呋喃-咪唑盐化合物7~24.该类化合物的结构经1H NMR, 13C NMR, HRMS进行确定, 见图 3.为了验证吲哚并四氢呋喃—咪唑盐化合物的结构是否正确, 本文选了化合物11和18作为代表, 将其放在二甲基亚砜(DMSO)中培养并通过X射线单晶衍射进行结构表征[17], 其单晶结构见图 4.
本文对所合成的新化合物4~24做了体外细胞毒活性测试.通过噻唑蓝(MTT)法, 选择了5种人体癌细胞株(白血病细胞(HL-60)、肝癌细胞(SMMC-7721)、肺癌细胞(A-549)、乳腺癌细胞(MCF-7) 和结肠癌细胞(SW480) 进行体外细胞毒活性测试, 其检测以顺铂(DDP)作为阳性对照物.通过浓度效应生长曲线计算了化合物的IC50值.测试结果表明, 化合物20、21、22和24均显示了一定的细胞毒活性, 其中化合物20和22具有较好的体外肿瘤生成抑制活性, 对SMMC-7721、MCF-7和SW-480这3种肿瘤细胞株的活性均优于顺铂, 化合物24对MCF-7和SW-480这2种肿瘤细胞株的活性优于顺铂, 特别是对MCF-7细胞株表现出较好的选择性细胞毒活性, 其IC50值为5.79 μmol•L-1, 约为顺铂的2.0倍, 测试结果见表 1.
 表 1
化合物4~24的体外细胞毒活性数据(IC50, μmol•L-1)a
Table 1.
In vitro cytotoxic activities of compounds 4~24 (IC50, mmol•L-1)
表 1
化合物4~24的体外细胞毒活性数据(IC50, μmol•L-1)a
Table 1.
In vitro cytotoxic activities of compounds 4~24 (IC50, mmol•L-1)

从表 1数据进行构效关系分析时, 可以从三个方面进行考虑.第一:咪唑盐类化合物优于咪唑类化合物; 第二:对于咪唑环的差异可知, 5, 6-二甲基苯并咪唑取代的盐类化合物优于苯并咪唑和2-甲基苯并咪唑取代的盐类化合物; 第三:对于溴代物的差异可知, 萘甲酰甲基取代的咪唑盐化合物20和萘甲基取代的咪唑盐化合物22活性相当, 它二者优于邻溴苄基取代的咪唑盐化合物24, 再优于对溴苄基取代的咪唑盐化合物21.
2 结论
本文从商品化的色醇出发, 通过Sharpless环氧化、酰胺化、偶联和成盐四步反应合成了一系列新型的吲哚并四氢呋喃-咪唑盐杂合物, 其结构经1H NMR, 13C NMR, HRMS以及X射线单晶衍射确定.对合成的新化合物进行了体外抗肿瘤活性的筛选, 结果表明, 化合物20、21、22和24均具有体外肿瘤生长抑制活性, 其中化合物20和22具有较好的体外肿瘤生成抑制活性, 对SMMC-7721、MCF-7和SW-480肿瘤细胞株的活性均优于顺铂; 化合物24对MCF-7和SW-480肿瘤细胞株的活性优于顺铂, 特别是对MCF-7细胞株表现出较好的选择性细胞毒活性, 其IC50值约为顺铂的2.0倍.今后在本研究的基础上, 可开展进一步的结构修饰, 作为此类化合物的活性及抗肿瘤机制的深入研究.
3 实验部分
3.1 仪器与试剂
核磁共振图谱用Bruker Avance 300核磁共振仪测定, TMS为内标; 熔点用X-6双目熔点测定仪进行测定, 温度计未校正; 所有样品红外谱图数据均使用Nicolet Avatar 360 FTIR红外光谱仪测定, KBr压片, 扫描的波速范围在4000至400 cm-1之间, 分辨率为4 cm-1; 高分辨质谱用QSTAR Pulsar质谱仪上测定; 柱层析用硅胶(200~300目和100~200目)和薄层色谱硅胶板(GF254) 均由青岛海洋化工厂生产; 显色剂为5%的磷钼酸乙醇溶液, 喷洒后加热显色; 商品化原料或试剂为Aldrich、探索平台、百灵威、韶远产品, 实验过程中未纯化; 对空气和水敏感的反应在氮气保护下进行; 无水二氯甲烷经钙氢重蒸后用活化的3Å分子筛干燥.
3.2 化合物2的合成
在500 mL的双口圆底烧瓶中加入300 mg已活化的4 Å分子筛, 在N2保护下, 用注射器加入170 mL的无水CH2Cl2, 采用低温装置冷却至-20 ℃.加入四异丙氧基钛(11.4 mL, 37.22 mmol)和(+)-酒石酸二异丙酯(9 mL, 40.942 mmol), 将反应体系冷却到-40 ℃搅拌1.5 h.缓慢地(0.5 h以上)逐滴加入过氧叔丁醇(5.0 mol•L-1 in decane, 10 mL, 50.247 mmol)后搅拌1.5 h.将溶于10 mL无水CH2Cl2的色醇(3 g, 18.61 mmol)逐滴加入反应体系中搅拌12 h, 此时反应体系中活化的分子筛已被消耗完全.用60 mL的四氢呋喃和25 mL饱和的Na2SO4淬灭反应, 再将反应体系转移到室温条件下搅拌6 h.所得的混合物用硅藻土在砂芯漏斗中过滤, 用CH2Cl2 (100 mL×3) 洗涤, 用CH2Cl2和H2O萃取, 合并有机相并用无水Na2SO4干燥, 过滤, 减压蒸去溶剂.柱色谱分离[V(石油醚, 60~90 ℃):V(乙酸乙酯)=8:1→5:1]得到(3aR, 8aS)-3, 3a, 8, 8a-四氢-2H-呋喃并[2, 3-b]吲哚-3a-醇(2) 1.85 g, 产率为56%.白色针状固体, m.p. 65~67 ℃[16]; [α]D25-144 (c 0.84, CHCl3), 1H NMR (300 MHz, CDCl3) δ: 7.17 (d, J=7.5 Hz, 1H), 7.04 (t, J=7.5 Hz, 1H), 6.70 (t, J=7.5 Hz, 1H), 6.45 (d, J=8.1 Hz, 1H), 5.14 (s, 1H), 3.87~3.81 (m, 1H), 3.51~3.42 (m, 2H), 2.29~2.11 (m, 2H); 13C NMR (75 MHz, CDCl3) δ: 149.5, 130.3, 130.1, 124.2, 119.4, 109.5, 99.4, 89.1, 67.1, 40.8.
3.3 化合物3的合成
称取底物2 (1.8 g, 10.16 mmol)溶于二氯甲烷25 mL, 0 ℃条件下加入饱和碳酸氢钠水溶液25 mL, 然后加入溴乙酰溴(4.32 mL, 40.63 mmol)反应6 h, 薄层色谱(TCL)检测反应完全, 加水淬灭反应, 二氯甲烷(30 mL×3) 萃取, 合并有机相, 用饱和食盐水洗, 无水NaSO4干燥, 过滤, 减压除去溶剂.柱色谱分离[V(石油醚, 60~90 ℃):V(乙酸乙酯)=5:1]得到2-氯-1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮(3), 产率为96%.白色粉末状固体. m.p. 97~99℃; 1H NMR (300 MHz, CDCl3) δ: 7.85 (d, J=8.1, Hz, 1H), 7.42 (d, J=6.9 Hz, 1H), 7.29~7.23 (m, 1H), 7.18~7.13 (m, 1H), 5.75 (s, 1H), 4.33 (d, J=13.8 Hz, 1H), 4.18 (d, J=13.8 Hz, 1H), 4.06 (t, J=8.1 Hz, 1H), 3.57~3.48 (s, 1H), 2.55~2.44 (m, 1H), 2.33 (dd, J=3.9, 3.9 Hz, 1H); 13C NMR (75 MHz, CDCl3)δ: 165.9, 142.2, 132.1, 130.5, 125.4, 124.1, 116.5, 98.4, 87.7, 68.3, 42.7, 41.1.
3.4 化合物4~6的合成
将化合物3 (1 mmol)和取代咪唑(3 mmol)溶于15 mL N, N-二甲基甲酰胺(DMF)中, 80 ℃下反应12~24 h, 薄层色谱(TLC)检测反应完全后, 冷却至室温, 减压蒸去溶剂, 乙酸乙酯(30 mL×3) 和水萃取, 合并有机相, 用饱和食盐水洗, 无水NaSO4干燥, 过滤, 减压除去溶剂.此时目标产物和取代咪唑的混合产物会析出, 不溶于乙酸乙酯, 过滤后滤饼用乙酸乙酯洗涤三次, 除去滤液, 再用热水洗涤滤饼, 除去混合产物中的取代咪唑, 所得滤饼放在真空干燥箱中干燥, 得到吲哚并四氢呋喃-咪唑化合物4~6, 产率70%~86%.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-1H-苯并[d]咪唑(4):产率86%, 白色粉末. m.p. 277~278 ℃; [α]D20-0.3 (c 0.65, MeCOMe); 1H NMR (300 MHz, DMSO-d6) δ: 8.26 (s, 1H), 7.94 (d, J=7.8 Hz, 1H), 7.68 (d, J=6.9 Hz, 1H), 7.52 (t, J=6.9 Hz, 2H), 7.33~7.16 (m, 4H), 6.36 (s, 1H), 6.21 (s, 1H), 5.69 (d, J=17.7 Hz, 1H), 5.37 (d, J=17.7 Hz, 1H), 4.18 (t, J=7.8 Hz, 1H), 3.58~3.49 (m, 1H), 2.46~2.35 (m, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 166.5, 145.2, 143.1, 142.2, 134.4, 133.5, 129.4, 124.6, 122.2, 121.4, 119.2, 115.1, 110.3, 97.7, 86.8, 67.7, 46.4, 41.3; IR (KBr) ν: 3103, 2872, 1686, 1599, 1480, 1444, 1402, 1341, 1284, 1265, 1126, 1051, 965, 891, 764, 747 cm-1; HRMS (ESI-TOF) calcd for C19H17N3O3K[M+K]+ 374.0901, found 374.0901.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-2-甲基-1H-苯并[d]咪唑(5):产率80%, 白色粉末. m.p. 254~255 ℃; [α]D20-17.4 (c 0.95, MeOH); 1H NMR (300 MHz, DMSO-d6) δ: 7.94 (d, J=8.1 Hz, 1H), 7.54 (t, J=8.7 Hz, 2H), 7.40 (t, J=3.9 Hz, 1H), 7.31 (t, J=7.5 Hz, 1H), 7.22~7.15 (m, 3H), 6.38 (s, 1H), 6.20 (s, 1H), 5.63 (d, J=18 Hz, 1H), 5.25 (d, J=18 Hz, 1H), 4.20 (t, J=7.8 Hz, 1H), 3.60~3.52 (m, 1H), 2.53 (s, 3H), 2.43~2.37 (m, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 166.3, 152.7, 142.1, 135.7, 133.5, 129.4, 124.7, 124.6, 121.5, 118.1, 115.2, 109.4, 97.6, 86.8, 67.8, 45.1, 41.3, 13.3; IR (KBr) ν: 3433, 1687, 1601, 1521, 1480, 1464, 1400, 1323, 1286, 1125, 1048, 964, 875, 742 cm-1; HRMS (ESI-TOF) calcd for C20H20N3O3[M+1]+ 350.1498, found 350.1499.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-5, 6-二甲基-1H-苯并[d]咪唑(6):产率85%, 白色粉末. m.p. 157~159 ℃; [α]D20-8.2 (c 0.15, MeOH); 1H NMR (300 MHz, DMSO-d6) δ: 8.10 (s, 1H), 7.94 (d, J=8.1 Hz, 1H), 7.52 (d, J=7.2 Hz, 1H), 7.44 (s, 1H), 7.28 (dd, J=8.4, 7.2 Hz, 2H), 7.21 (t, J=7.5 Hz, 1H), 6.36 (s, 1H), 6.19 (s, 1H), 5.61 (d, J=17.7 Hz, 1H), 5.29 (d, J=17.4 Hz, 1H), 4.18 (t, J=7.8 Hz, 1H), 3.57~3.51 (m, 1H), 2.41~2.30 (m, 2H), 2.27 (s, 6H); 13C NMR (75 MHz, DMSO-d6)δ: 166.6, 144.3, 142.2, 141.7, 133.5, 130.8, 129.7, 129.4, 124.6, 119.3, 115.16, 110.3, 97.6, 86.8, 67.7, 46.3, 41.3, 20.0, 19.8; IR (KBr) ν: 3096, 2972, 2882, 1735, 1690, 1502, 1480, 1403, 1327, 1269, 1193, 1047, 848, 758, 688 cm-1; HRMS (ESI-TOF) calcd for C21H22N3O3[M+1]+364.1656, found 364.1655.
3.5 化合物7~24的合成
称取吲哚并呋喃-咪唑化合物(1 mmol)和卤代物(1.2 mmol)于25 mL圆底烧瓶中, 加入丙酮10 mL, 搅拌回流24~48 h, 有白色固体析出, TLC检测反应完全后, 过滤, 固体用乙酸乙酯洗涤三次, 真空干燥得到咪唑盐化合物, 收率59%~96%.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-(4-溴苯基)-2-氧乙基)-1H-苯并[d]咪唑-3-溴盐(7):产率94%, 白色粉末. m.p. 163~164 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.76 (s, 1H), 8.09 (t, J=8.4 Hz, 4H), 7.93 (dd, J=12.6, 8.7 Hz, 3H), 7.71 (t, J=3.6 Hz, 2H), 7.56 (d, J=7.2 Hz, 1H), 7.34 (t, J=7.5 Hz, 1H), 7.25~7.18 (m, 1H), 6.48 (s, 3H), 6.26 (s, 1H), 6.13 (d, J=17.7 Hz, 1H), 5.83 (d, J=17.4 Hz, 1H), 4.21 (t, J=7.5 Hz, 1H), 3.61~3.52 (m, 1H), 2.47~2.36 (m, 2H); 13C NMR (75 MHz, DMSO-d6)δ: 190.4, 164.3, 144.8, 141.8, 133.7, 132.8, 132.1, 131.5, 131.4, 130.3, 129.5, 128.8, 128.6, 126.7, 125.1, 124.7, 115.1, 113.9, 113.8, 97.8, 87.0, 68.0, 53.3, 48.9, 41.5; IR (KBr) ν: 3425, 1686, 1586, 1483, 1405, 1345, 1222, 1194, 1070, 1045, 988, 753 cm-1; HRMS (ESI-TOF) calcd for C27H23N3O4Br[M-Br]+ 532.0863, found 532.0866.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-(萘-2-基)-2-氧乙基)-1H-苯并[d]咪唑-3-溴盐(8):产率80%, 白色粉末. m.p. 274~275 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.85 (s, 1H), 8.96 (s, 1H), 8.25 (d, J=7.5 Hz, 1H), 8.13 (dd, J=6.3, 7.8 Hz, 5H), 7.97 (d, J=8.1 Hz, 1H), 7.76 (dd, J=6.9, 6.3 Hz, 4H), 7.57 (d, J=7.2 Hz, 1H), 7.34 (t, J=7.5 Hz, 1H), 7.24 (t, J=7.5 Hz, 1H), 6.68 (s, 2H), 6.42 (s, 1H), 6.29 (s, 1H), 6.18 (d, J=17.7 Hz, 1H), 5.87 (d, J=17.4 Hz, 1H), 4.22 (t, J=7.5 Hz, 1H), 3.62~3.53 (m, 1H), 2.42 (dd, J=8.7, 7.5 Hz, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 190.9, 164.4, 144.9, 141.8, 135.5, 133.7, 132.0, 131.5, 131.4, 131.0, 130.8, 129.6, 129.5, 129.3, 128.7, 127.9, 127.4, 126.7, 125.1, 124.8, 123.3, 115.1, 114.0, 113.8, 97.8, 87.0, 68.0, 53.4, 48.9, 41.5; IR (KBr) ν: 3227, 2957, 1693, 1571, 1406, 1366, 1218, 1125, 1035, 940, 823, 752 cm-1; HRMS (ESI-TOF) calcd for C31H26N3O4[M-Br]+ 504.1918, found 504.1917.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(4-溴苄基))-1H-苯并[d]咪唑-3-溴盐(9):产率82%, 白色粉末. m.p. 191~192 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.94 (s, 1H), 8.05 (dd, J=1.8, 5.4 Hz, 2H), 7.92 (d, J=8.1 Hz, 1H), 7.67 (dd, J=6.0, 8.1 Hz, 4H), 7.54 (dd, J=7.8, 8.1 Hz, 3H), 7.33 (t, J=7.8 Hz, 1H), 7.22 (t, J=7.2 Hz, 1H), 6.41 (d, J=2.7 Hz, 1H), 6.24 (s, 1H), 6.07 (d, J=17.7 Hz, 1H), 5.87 (s, 2H), 6.72 (d, J=17.4 Hz, 1H), 4.20 (t, J=7.8 Hz, 1H), 3.57~3.50 (m, 1H), 3.40 (dd, J=8.4, 3.9 Hz, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 164.4, 144.0, 141.8, 133.6, 133.1, 132.0, 130.6, 130.3, 129.5, 126.9, 126.7, 125.1, 124.8, 122.2, 115.1, 114.0, 113.8, 97.8, 87.0, 67.9, 49.2, 48.8, 41.6; IR (KBr) ν: 3424, 1685, 1563, 1482, 1407, 1300, 1268, 1187, 1074, 1041, 827, 751 cm-1; HRMS (ESI-TOF) calcd for C26H23N3O3Br[M-Br]+ 504.0917, found 504.0917.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-萘甲基))-1H-苯并[d]咪唑-3-溴盐(10):产率87%, 白色粉末. m.p. 168~169 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 10.03 (s, 1H), 8.16~8.02 (m, 3H), 7.99~7.93 (m, 4H), 7.67 (dd, J=3.9, 6.6 Hz, 3H), 7.60~7.55 (m, 3H), 7.31 (d, J=7.2 Hz, 1H), 7.22 (t, J=7.2 Hz, 1H), 6.44 (s, 1H), 6.26 (s, 1H), 6.07 (s, 1H), 6.00 (s, 2H), 5.75 (d, J=17.4 Hz, 1H), 4.19 (t, J=7.8 Hz, 1H), 2.48~2.35 (m, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 164.4, 144.0, 141.8, 133.6, 132.7, 132.6, 132.0, 131.1, 130.5, 129.5, 128.9, 128.1, 127.8, 127.7, 126.8, 125.6, 125.1, 124.8, 115.1, 114.0, 97.8, 87.0, 67.9, 50.1, 48.8, 41.5; IR (KBr) ν: 3424, 1680, 1564, 1482, 1407, 1286, 1192, 1127, 1044, 823, 754 cm-1; HRMS (ESI-TOF) calcd for C30H26N3O3 [M-Br]+ 476.1969, found 476.1968.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(4-甲基苄基))-1H-苯并[d]咪唑-3-溴盐(11):产率92%, 白色粉末. m.p. 263~264 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.98 (s, 1H), 8.06 (t, J=4.5 Hz, 2H), 7.92 (d, J=8.1 Hz, 1H), 7.68 (d, J=3.9 Hz, 2H), 7.55 (d, J=6.9 Hz, 1H), 7.45 (d, J=7.5 Hz, 2H), 7.32~7.22 (m, 4H), 6.26 (s, 1H), 6.09 (d, J=17.4 Hz, 1H), 5.85 (s, 2H), 5.73 (d, J=17.4 Hz, 1H), 4.20 (t, J= 7.5 Hz, 1H), 3.54 (s, 1H), 2.44~2.37 (m, 2H), 2.30 (s, 3H); 13C NMR (75 MHz, DMSO-d6) δ: 164.5, 143.8, 141.8, 138.3, 133.7, 131.9, 130.7, 130.3, 129.5, 128.4, 126.8, 126.6, 125.0, 124.8, 115.0, 113.9, 97.8, 87.0, 67.9, 49.7, 48.8, 41.5; IR (KBr) ν: 3424, 1680, 1564, 1482, 1407, 1328, 1286, 1192, 1127, 1044, 823, 754 cm-1; HRMS (ESI-TOF) calcd for C27H26N3O3[M-Br]+ 440.1967, found 440.1966.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-溴苄基))-1H-苯并[d]咪唑-3-溴盐(12):产率93%, 白色粉末. m.p. 209~210 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.86 (s, 1H), 8.09 (d, J=5.1 Hz, 1H), 8.04 (t, J=5.4 Hz, 1H), 7.92 (d, J=8.1 Hz, 1H), 7.79 (d, J=7.8 Hz, 1H), 7.72 (t, J=3.9 Hz, 2H), 7.55 (d, J=7.2 Hz, 1H), 7.50 (d, J=4.2 Hz, 2H), 7.43 (t, J=4.5 Hz, 1H), 7.32 (t, J=7.5 Hz, 1H), 7.22 (t, J=7.5 Hz, 1H), 6.25 (s, 1H), 6.09 (d, J=17.7 Hz, 1H), 5.95 (s, 2H), 5.75 (d, J=17.4 Hz, 1H), 4.19 (t, J=7.5 Hz, 1H), 3.52 (t, J=5.7 Hz, 1H), 2.44~2.29 (m, 2H); 13C NMR (75 MHz, DMSO-d6)δ: 164.4, 144.3, 141.8, 133.7, 133.3, 132.3, 131.8, 131.2, 131.1, 130.6, 129.5, 128.5, 126, 9, 126.8, 125.0, 124.8, 123.4, 115.1, 114.1, 113.8, 97.8, 87.0, 67.9, 50.5, 48.9, 41, 5; IR (KBr) ν: 3396, 3230, 1685, 1568, 1483, 1410, 1300, 1220, 1189, 1046, 905, 820, 768, 754 cm-1; HRMS (ESI-TOF) C26H23N3O3Br[M- Br]+ 504.0917, found 504.0917.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-(4-溴苯基)-2-氧乙基)-2-甲基-1H-苯并[d]咪唑-3-溴盐(13):产率89%, 白色粉末. m.p. 314~315 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 8.11~8.00 (m, 4H), 7.94 (s, 3H), 7.66 (s, 2H), 7.56 (d, J=5.7 Hz, 1H), 7.33 (s, 1H), 7.23 (s, 1H), 6.54 (s, 2H), 6.43 (s, 1H), 6.31 (s, 1H), 6.16 (d, J=17.4 Hz, 1H), 5.70 (d, J=17.7 Hz, 1H), 4.22 (s, 1H), 3.61 (s, 1H), 2.86 (s, 3H), 2.42 (s, 2H); 13C NMR (75 MHz, DMSO-d6)δ: 190.2, 163.8, 154.4, 141.7, 133.7, 132.7, 132.0, 131.1, 130.6, 129.5, 128.7, 126.3, 125.1, 124.8, 115.2, 113.3, 112.8, 97.7, 87.0, 68.0, 52.1, 47.4, 41.5, 10.5; IR (KBr) ν: 3261, 2890, 1693, 1584, 1482, 1408, 1301, 1229, 1180, 1072, 986, 815, 755, 601 cm-1; HRMS (ESI-TOF) calcd for C28H25N3O4Br [M-Br]+ 546.1019, found 546.1022.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-(萘-2-基)-2-氧乙基)-2-甲基-1H-苯并[d]咪唑-3-溴盐(14):产率98%, 白色粉末. m.p. 211~212 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 8.99 (s, 1H), 8.23 (d, J=7.5 Hz, 1H), 8.17 (d, J=8.7 Hz, 1H), 8.10 (d, J=7.8 Hz, 3H), 8.03 (d, J=7.8 Hz, 1H), 7.97 (d, J=8.1 Hz, 1H), 7.77 (dd, J=6.3, 7.2 Hz, 2H), 7.66 (dd, J=6.3, 6.3 Hz, 2H), 7.57 (d, J=7.2 Hz, 1H), 7.35 (t, J=7.5 Hz, 1H), 7.24 (t, J=7.5 Hz, 1H), 6.70 (s, 2H), 6.43 (s, 1H), 6.32 (s, 1H), 6.18 (d, J=17.7 Hz, 1H), 5.72 (d, J=17.7 Hz, 1H), 4.24 (t, J=7.8 Hz, 1H), 3.65~3.58 (m, 1H), 2.93 (s, 3H), 2.46~2.40 (m, 2H); 13C NMR (75 MHz, DMSO-d6)δ: 190.7, 163.9, 154.4, 141.8, 135.6, 133.7, 131.9, 131.2, 131.0, 129.6, 129.5, 129.4, 128.5, 127.9, 127.4, 126.4, 125.2, 124.8, 123.5, 115.2, 113.3, 112.8, 97.8, 87.0, 68.0, 52.1, 47.4, 41.5, 10.6; IR (KBr) ν: 3413, 1685, 1601, 1534, 1482, 1408, 1359, 1286, 1221, 1125, 1045, 827, 753 cm-1; HRMS (ESI-TOF) calcd for C32H28N3O4[M-Br]+ 518.2072, found 518.2074.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(4-溴苄基))-2-甲基-1H-苯并[d]咪唑-3-溴盐(15):产率85%, 白色粉末. m.p. 275~276 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 8.02 (s, 2H), 7.92 (d, J=8.1 Hz, 1H), 7.65 (t, J=6.9 Hz, 4H), 7.56 (d, J=7.2 Hz, 1H), 7.35 (d, J=6.9 Hz, 3H), 7.22 (t, J=7.2 Hz, 1H), 6.42 (s, 1H), 6.32 (s, 1H), 6.13 (d, J=18.3 Hz, 1H), 5.95 (s, 2H), 5.63 (d, J=18.0 Hz, 1H), 4.22 (t, J=7.8 Hz, 1H), 3.61 (d, J=2.7 Hz, 1H), 2.96 (s, 3H), 2.41 (t, J=8.1 Hz, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 163.9, 153.6, 141.7, 133.7, 133.5, 131.9, 131.4, 130.5, 129.4, 126.6, 125.1, 124.7, 121.6, 115.2, 113.3, 112.9, 97.8, 87.0, 68.1, 47.6, 41.6, 10.9; IR (KBr) ν: 3224, 3031, 2871, 1679, 1600, 1530, 1478, 1405, 1320, 1285, 1114, 1048, 967, 859, 758 cm-1; HRMS (ESI-TOF) calcd for C27H25N3O3Br [M-Br]+ 518.1072, found 518.1073.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-萘甲基))-2-甲基-1H-苯并[d]咪唑-3-溴盐(16):产率90%, 白色粉末. m.p. 153~154 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 8.09 (d, J=7.2 Hz, 1H), 8.05 (t, J=7.2 Hz, 1H), 8.02~7.88 (m, 5H), 7.65 (dd, J=1.8, 3.0 Hz, 2H), 7.55 (t, J=4.5 Hz, 3H), 7.47 (d, J=8.7 Hz, 1H), 7.33 (t, J=7.5 Hz, 1H), 7.23 (t, J=7.5 Hz, 1H), 6.44 (s, 1H), 6.33 (s, 1H), 6.20 (s, 1H), 6.13 (s, 2H), 5.67 (d, J=17.7 Hz, 1H), 4.23 (t, J=7.8 Hz, 1H), 3.66~3.57 (m, 1H), 3.02 (s, 3H), 2.46~2.38 (m, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 164.0, 153.6, 141.7, 133.7, 132.6, 132.5, 131.6, 131.4, 130.7, 129.5, 128.8, 128.1, 127.7, 127.6, 126.7, 126.5, 126.0, 125.2, 124.8, 115.2, 113.4, 112.9, 97.7, 87.0, 68.0, 48.4, 47.5, 41.6, 11.0; IR (KBr) ν: 3238, 1681, 1602, 1529, 1482, 1409, 1301, 1285, 1128, 1046, 825, 757 cm-1; HRMS (ESI-TOF) calcd for C31H28N3O3[M-Br]+ 490.2126, found 490.2125.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(4-甲基苄基))-2-甲基-1H-苯并[d]咪唑-3-溴盐(17):产率89%, 白色粉末. m.p. 259~260 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 8.05~7.98 (m, 2H), 7.92 (d, J=8.1 Hz, 1H), 7.65 (t, J=4.8 Hz, 2H), 7.56 (d, J=7.2 Hz, 1H), 7.34~7.16 (m, 6H), 6.42 (s, 1H), 6.29 (d, J=6.3 Hz, 1H), 6.12 (d, J=18.0 Hz, 1H), 5.89 (s, 2H), 5.63 (d, J=18.0 Hz, 1H), 4.22 (t, J=8.1 Hz, 1H), 3.65~3.56 (m, 1H), 2.97 (s, 3H), 2.45~2.36 (m, 2H), 2.29 (s, 3H); 13C NMR (75 MHz, DMSO-d6) δ: 163.9, 153.3, 141.7, 137.8, 133.7, 131.4, 131.0, 130.5, 129.5, 128.8, 128.1, 127.2, 126.5, 125.1, 124.7, 115.2, 113.4, 112.9, 97.8, 87.0, 68.0, 48.0, 47.4, 41.5, 20.6, 10.9; IR (KBr) ν: 3426, 3221, 3032, 2940, 2874, 1674, 1529, 1480, 1301, 1285, 1114, 1048, 895, 759 cm-1; HRMS (ESI-TOF) calcd for C28H28N3O3[M-Br]+ 454.2121, found 454.2125.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-溴苄基))-2-甲基-1H-苯并[d]咪唑-3-溴盐(18):产率78%, 白色粉末. m.p. 314~315 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 8.03 (d, J=8.1 Hz, 1H), 7.94 (d, J=7.8 Hz, 1H), 7.80 (t, J=7.5 Hz, 2H), 7.78~7.55 (m, 3H), 7.40~7.31 (m, 3H), 7.23 (t, J=7.5 Hz, 1H), 6.84 (d, J=7.2 Hz, 1H), 6.43 (s, 1H), 6.31 (s, 1H), 6.14 (d, J=18.0 Hz, 1H), 5.95 (s, 2H), 5.68 (d, J=17.7 Hz, 1H), 4.23 (t, J=7.8 Hz, 1H), 3.66~3.57 (m, 1H), 2.90 (s, 3H), 2.45~2.37 (m, 2H); 13C NMR (75 MHz, DMSO-d6) δ: 163.9, 154.1, 141.7, 133.7, 133.3, 132.7, 131.4, 130.5, 130.3, 129.5, 128.4, 127.5, 126.6, 125.2, 124.8, 121.9, 115.2, 113.2, 113.0, 97.8, 87.0, 68.1, 48.8, 47.5, 41.6, 10.9; IR (KBr) ν: 3246, 1678, 1525, 1484, 1411, 1302, 1280, 1126, 1046, 768, 754 cm-1; HRMS (ESI-TOF) calcd for C27H25N3O3Br[M-Br]+ 518.1074, found 518.1073.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-(4-溴苯基)-2-氧乙基)-5, 6-二甲基-1H-苯并[d]咪唑-3-溴盐(19):产率89%, 白色粉末. m.p. 207~208 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 9.59 (s, 1H), 8.07 (d, J=8.4 Hz, 2H), 7.96~7.89 (m, 4H), 7.85 (s, 1H), 7.56 (d, J=6.9 Hz, 1H), 7.34 (t, J=7.2 Hz, 1H), 7.23 (t, J=7.5 Hz, 1H), 6.42 (s, 3H), 6.26 (s, 1H), 6.06 (d, J=17.1 Hz, 1H), 5.77 (d, J=17.4 Hz, 1H), 4.21 (t, J=8.1 Hz, 1H), 3.57~3.53 (m, 1H), 2.39 (d, J=7.5 Hz, 8H); 13C NMR (75 MHz, DMSO-d6) δ: 190.4, 164.4, 143.5, 141, 9, 136.4, 133.7, 132.8, 132.1, 130.3, 130.0, 129.9, 129.5, 128.6, 125.0, 124.8, 115.1, 113.4, 113.1, 97.8, 87.0, 67.9, 53.2, 48.7, 41.5, 19.9; IR (KBr) ν: 3406, 2976, 1682 1603, 1584, 1563, 1483, 11407, 1348, 1225, 1191, 1048, 966, 814, 755, 689 cm-1; HRMS (ESI-TOF) calcd for C29H27N3O4Br[M-Br]+ 560.1174, found 560.1179.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-(萘-2-基)-2-氧乙基)-5, 6-二甲基-1H-苯并[d]咪唑-3-溴盐(20):产率85%, 白色粉末. m.p. 232~233 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 9.69 (s, 1H), 8.96 (s, 1H), 8.25 (d, J=7.5 Hz, 1H), 8.16 (d, J=8.7 Hz, 1H), 8.09 (d, J=8.4 Hz, 2H), 7.97 (d, J=9.9 Hz, 2H), 7.88 (s, 1H), 7.79~7.70 (m, 2H), 7.57 (d, J=7.5 Hz, 1H), 7.35 (t, J=7.5 Hz, 1H), 7.23 (t, J=7.2 Hz, 1H), 6.61 (s, 2H), 6.43 (s, 1H), 6.29 (s, 1H), 6.10 (d, J=17.1 Hz, 1H), 5.80 (d, J=17.1 Hz, 1H), 4.22 (t, J=8.1 Hz, 1H), 3.62~3.53 (m, 1H), 2.42 (d, J=9.0 Hz, 8H); 13C NMR (75 MHz, DMSO-d6) δ: 190.9, 164.5, 143.6, 141.9, 136.4, 135.5, 133.7, 132.0, 131.0, 130.8, 130.0, 129.9, 129.6, 129.5, 129.3, 128.6, 127.8, 127.4, 125.0, 124.8, 123.3, 115.1, 113.4, 113.2, 97.8, 87.0, 67.9, 53.3, 48.8, 41.5, 19.9; IR (KBr) ν: 3189, 2978, 1695, 1569, 1482, 1407, 1347, 1289, 1220, 1190, 1125, 1035, 939, 903, 862, 751, 690 cm-1; HRMS (ESI-TOF) calcd for C33H30N3O4[M-Br]+ 532.2231, found 532.2230.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(4-溴苄基))-5, 6-二甲基-1H-苯并[d]咪唑-3-溴盐(21):产率79%, 白色粉末. m.p. 193~194 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 9.78 (s, 1H), 7.93 (d, J=7.5 Hz, 1H), 7.84 (s, 2H), 7.66 (d, J=8.4 Hz, 2H), 7.55 (d, J=6.9 Hz, 1H), 7.47 (d, J=8.4 Hz, 2H), 7.33 (t, J=7.2 Hz, 1H), 7.22 (t, J=7.5 Hz, 1H), 6.41 (s, 1H), 6.23 (s, 1H), 5.98 (d, J=17.1 Hz, 1H), 5.80 (s, 2H), 5.64 (d, J=17.4 Hz, 1H), 4.20 (t, J=7.5 Hz, 1H), 3.57 (t, J=4.8 Hz, 1H), 2.38 (d, J=5.1 Hz, 8H); 13C NMR (75 MHz, DMSO-d6) δ: 167.1, 145.5, 144.5, 139.4, 139.2, 136.4, 136.0, 134.6, 133.1, 132.2, 131.6, 127.7, 127.5, 124.8, 117.8, 116.1, 115.8, 100.5, 89.7, 70.6, 51.7, 51.4, 44.2, 22.6; IR (KBr) ν: 3394, 2978, 1681, 1563, 1483, 1465, 1407, 1326, 1287, 1189, 1046, 1024, 816, 759 cm-1; HRMS (ESI-TOF) calcd for C28H27N3O3Br[M-Br]+ 518.1071, found 518.1073.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-萘甲基))-5, 6-二甲基-1H-苯并[d]咪唑-3-溴盐(22):产率89%, 白色粉末. m.p. 188~190 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 9.87 (s, 1H), 8.10 (s, 1H), 8.10~7.92 (m, 5H), 7.86 (s, 1H), 7.57 (dd, J=11.1, 4.8 Hz, 4H), 7.33 (t, J=7.2 Hz, 1H), 7.22 (t, J=7.5 Hz, 1H), 6.42 (s, 1H), 6.25 (s, 1H), 5.92 (d, J=17.7 Hz, 3H), 5.68 (d, J=17.4 Hz, 1H), 4.19 (t, J=7.8 Hz, 1H), 3.51 (d, J=10.5 Hz, 1H), 2.44~2.32 (m, 8H); 13C NMR (75 MHz, DMSO-d6)δ: 164.5, 142.8, 141.8, 136.6, 136.4, 133.6, 132.7, 131.3, 130.5, 129.5, 129.0, 128.8, 127.8, 127.6, 127.5, 126.7, 125.5, 125.0, 124.8, 115.1, 113.4, 113.2, 97.8, 87.0, 67.9, 49.9, 48.7, 41.5, 19.9; IR (KBr) ν: 3404, 2979, 1674, 1602, 1560, 1482, 1407, 1301, 1287, 1191, 1046, 967, 899, 89, 758 cm-1; HRMS (ESI-TOF) calcd for C32H30N3O3[M-Br]+ 504.2282, found 504.2281.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(4-甲基苄基))-5, 6-二甲基-1H-苯并[d]咪唑-3-溴盐(23):产率84%, 白色粉末. m.p. 192~193 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 9.76 (s, 1H), 7.62 (d, J=7.8 Hz, 1H), 7.82 (d, J=5.4 Hz, 2H), 7.55 (d, J=7.2 Hz, 1H), 7.41 (d, J=12.3 Hz, 2H), 7.35 (t, J=6.6 Hz, 1H), 7.23 (d, J=4.2 Hz, 3H), 6.42 (s, 1H), 6.22 (s, 1H), 5.97 (d, J=17.4 Hz, 1H), 5.74 (s, 2H), 5.65 (d, J=17.1 Hz, 1H), 4.19 (t, J=7.5 Hz, 1H), 3.58 (s, 1H), 2.37 (t, J=6.0 Hz, 8H), 2.30 (s, 3H); 13C NMR (75 MHz, DMSO-d6) δ: 164.5, 142.5, 141.8, 138.2, 136.6, 136.4, 133.6, 130.8, 130.4, 129.5, 128.9, 128.2, 125.0, 124.7, 115.1, 113.2, 97.8, 87.0, 67.9, 49.5, 48.6, 40.2, 20.6, 19.9; IR (KBr) ν: 3404, 2977, 1683, 1562, 1483, 1407, 1300, 1287, 1117, 1045, 971, 899, 846, 758, 758, 686 cm-1; HRMS (ESI-TOF) calcd for C29H30N3O3[M-Br]+ 468.2277, found 468.2281.
1-((3aR, 8aS)-3, 3a-二氢-3a-羟基-2H-呋喃并[2, 3-b]吲哚-8(8aH)-基)乙酮-3-(2-溴苄基))-5, 6-二甲基-1H-苯并[d]咪唑-3-溴盐(24):产率81%, 白色粉末. m.p. 244~245 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 9.67 (s, 1H), 7.89 (dd, J=8.1, 9.6 Hz, 3H), 7.78 (d, J=7.8 Hz, 1H), 7.55 (d, J=7.2 Hz, 1H), 7.48 (d, J=7.2 Hz, 1H), 7.41 (t, J=6.0 Hz, 2H), 7.32 (t, J=7.2 Hz, 1H), 7.22 (t, J=7.5 Hz, 1H), 6.41 (s, 1H), 6.00 (d, J=17.1 Hz, 1H), 5.87 (s, 2H), 5.68 (d, J=17.4 Hz, 1H), 4.19 (t, J=8.1 Hz, 1H), 3.58~3.49 (m, 1H), 2.38 (d, J=9.0 Hz, 8H); 13C NMR (75 MHz, DMSO-d6) δ: 164.4, 143.0, 141.8, 136.7, 136.6, 133.7, 133.3, 132.5, 131.1, 130.7, 130.4, 129.5, 129.2, 128.5, 125.0, 124.7, 123.2, 115.1, 113.5, 113.1, 97.8, 87.0, 67.9, 50.3, 48.7, 41.5, 19.9; IR (KBr) ν: 3224, 2948, 1680, 1563, 1483, 1466, 1407, 1344, 1302, 1125, 1097, 1044, 899, 847, 753 cm-1; HRMS (ESI-TOF) calcd for C28H27N3O3Br[M-Br]+ 532.1235, found 532.1230.
3.6 生物活性筛选
吲哚并四氢呋喃-咪唑及咪唑盐化合物4~24经纯化及结构鉴定后, 进行了肿瘤细胞毒活性的筛选.采用MTT法进行测定:选取白血病(HL-60)、肝癌(SMMC-7721)、肺癌(A-549)、乳腺癌(MCF-7) 和结肠癌(SW480) 5种肿瘤细胞株, 采用含10%胎牛血清的培养液接种, 加入待测化合物溶液后, 37 ℃培养48 h.然后选择570 nm波长, 用酶联免疫检测仪(Bio-Rad 680) 读取光吸收值, 同一样品重复三次, 最后用两点法(Reed and Muench法)计算获得化合物的IC50值.
辅助材料(Supporting Information) 化合物4~24的核磁共振氢谱、碳谱以及化合物11和18的X单晶结构数据.这些材料可以免费从本刊网站(http://sioc-journal. cn/)上下载.
-
-
[1]
潘成学, 关一富, 张洪彬, 有机化学, 2012, 32, 1116. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341419.shtmlPan, C. X.; Guan, Y. F.; Zhang, H. B. Chin. J. Org. Chem. 2012, 32, 1116 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341419.shtml
-
[2]
汪学全, 李艳, 羊晓东, 张洪彬, 有机化学, 2015, 35, 1276. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344841.shtmlWang, X. Q.; Li, Y.; Yang, X. D.; Zhang, H. B. Chin. J. Org. Chem. 2015, 35, 1276 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344841.shtml
-
[3]
(a) Suzuki, T.; Choi, J. H.; Kawaguchi, T.; Yamashita, K.; Morita, A.; Hirai, H.; Nagai, K.; Hirose, T.; Omura, S.; Sunazuka, T.; Kawagishi, H. Bioorg. Med. Chem. Lett. 2012, 22, 4246.
(b) Chaudhaery, S. S.; Roy, K. K.; Shakya, N.; Saxena, G.; Sammi, S. R.; Nazir, A.; Nath, C.; Saxena, A. K. J. Med. Chem. 2010, 53, 6490.
(c) Luo, W.; Yu, Q. S.; Kulkarni, S. S.; Parrish, D. A.; Holloway, H. W.; Tweedie, D.; Shafferman, A.; Lahiri, D. K.; Brossi, A.; Greig, N. H. J. Med. Chem. 2006, 49, 2174.
(d) Gavuzzo, E.; Pomponi, M. J. Biochem. Mol. Toxicol. 2002, 16, 64. -
[4]
(a) Hayashi, M.; Kim, Y.-P.; Takamatsu, S.; Enomoto, A.: Shinose, M.; Takahashi, Y.; Tanaka, H.; Komiyama, K.; Ohmura, S. J. Antibiot. 1996, 49, 1091.
(b) Takamatsu, S.; Kim, Y.-P.; Enomoto, A.; Hayashi, M.; Tanaka, H.; Komiyama, K.; Ohmura, S. J. Antibiot. 1997, 50, 1069. -
[5]
Hayashi, M.; Rho, M.-C.; Enomoto, A.; Fukami, A.; Kim, Y.-P.; Kikuchi, Y.; Sunazuka, T.; Hirose, T.; Komiyama, K.; Ohmura, S. Proc. Natl. Acad. Sci. 2002, 99, 14728. doi: 10.1073/pnas.232562799
-
[6]
(a) Strassmann, G.; Masui, Y.; Chizzonite, R.; Fong, M. J. Immunol. 1993, 150, 2341.
(b) Zhang, X. G.; Bataille, R.; Jourdan, M.; Saeland, S.; Banchereau, J.; Mannoni, P.; Klein, B. Blood 1990, 76, 2599. -
[7]
Wan, L.; Tius, M. A. Org. Lett. 2007, 9, 647. doi: 10.1021/ol062919e
-
[8]
(a) Vlahakis, J. Z.; Lazar, C.; Crandall, I. E.; Szarek, W. A. Bioorg. Med. Chem. 2010, 18, 6184.
(b) Dominianni, S. J.; Yen, T. T. J. Med. Chem. 1989, 32, 2301.
(c) Pardin, C.; Schmitzer, A. R.; Leclercq, L. Chem. Eur. J. 2010, 16, 4686. -
[9]
(a) Fortuna, C. G.; Barresi, V.; Berellini, G..; Musumarra, G. Bioorg. Med. Chem. 2008, 16, 4150.
(b) Saberi, M. R.; Vinh, T. K.; Yee, S. W.; Griffiths, B. J. N.; Evan, P. J.; Simsons, C. J. Med. Chem. 2006, 49, 1016. -
[10]
Cui, B.; Zheng, B. L.; He, K.; Zheng, Q. Y. J. Nat. Prod. 2003, 66, 1101. doi: 10.1021/np030031i
-
[11]
(a) Zeng, X. H.; Yang, X. D.; Zhang, Y. L.; Qing, C.; Zhang, H. B. Bioorg. Med. Chem. Lett. 2010, 20, 1844.
(b) Yang, X. D.; Zeng, X. H.; Zhang, Y. L.; Qing, C.; Song, W. J.; Li, L.; Zhang, H. B. Bioorg. Med. Chem. Lett. 2009, 19, 1892. -
[12]
D'hooghe, M.; Mollet, K.; De Vreese, R.; Jonckers, T. H. M.; Dams, G.; De Kimpe, N. J. Med. Chem. 2012, 55(11), 5637.
-
[13]
Viegas-Junior, C.; Danuello, A.; Bolzani, V. S.; Barreiro, E. J.; Fraga, C. A. M. Curr. Med. Chem. 2007, 14(17), 1829.
-
[14]
(a) Walsh, J. J. ; Bell, A. Curr. Pharm. Des. 2009, 15, 2970.
(b) Zhu, P. F. ; Zhao, J. F. ; Yang, X. D. ; Zhang, H. B. Chin. J. Org. Chem. 2014, 34, 1167 (in Chinese).
(朱培芳, 赵静峰, 羊晓东, 张洪彬, 有机化学, 2014, 34, 1167. ) -
[15]
(a) Zhou, B.; Liu, Z. F.; Deng, G. G.; Chen, W.; Li, M. Y.; Yang, L. J.; Li, Y.; Yang, X. D., Zhang, H. B. Org. Biomol. Chem. 2016, 14, 9423.
(b) Zhou, Y. J.; Duan, K. Y.; Zhu, L.; Liu, Z. F.; Zhang, C. G.; Yang, L. J.; Li, M. Y.; Zhang, H. B., Yang, X. D. Bioorg. Med. Chem. Lett. 2016, 26, 460.
(c) Liu, L. X.; Wang, X. Q.; Zhou, B.; Yang, L. J.; Li, Y.; Zhang, H. B.; Yang, X. D. Sci. Rep. 2015, 5, 13101.
(d) Xu, X. L.; Yu, C. L.; Chen, W.; Li, Y. C.; Yang, L. J.; Li, Y.; Zhang, H. B.; Yang, X. D. Org. Biomol. Chem. 2015, 13, 1550.
(e) Xu, X. L.; Wang, J.; Yu, C. L.; Chen, W.; Li, Y. C.; Li, Y.; Zhang, H. B.; Yang, X. D. Bioorg. Med. Chem. Lett. 2014, 24, 4926.
(f) Sun, C. J.; Chen, W.; Li, Y.; Liu, L. X.; Wang, X. Q.; Li, L. J.; Zhang, H. B.; Yang, X. D. RSC Adv., 2014, 4, 16312.
(g) Liu, L. X.; Wang, X. Q.; Yan, J. M.; Li, Y.; Sun, C. J.; Chen, W.; Zhou, B.; Zhang, H. B.; Yang, X. D. Eur. J. Med. Chem. 2013, 66, 423.
(h) Wang, X. Q.; Liu, L. X.; Li, Y.; Sun, C. J.; Chen, W.; Li, L.; Zhang, H. B.; Yang, X. D. Eur. J. Med. Chem. 2013, 62, 111. -
[16]
Tomoyasu, H.; Toshiaki, S.; Daisuke, Y.; Naoto, K.; Tatsuya, S.; Yoshihiro, H.; Isao, K.; Satoshi, O. Tetrahedron 2005, 61, 6015. doi: 10.1016/j.tet.2005.04.056
-
[17]
CCDC 1509927 and 1509928 contain the supplementary crystallographic data for compounds 11 and 18. These data can be obtained free of charge from The Cambridge Crystallographic Data Center via www.ccdc.cam.ac.uk/data_request/cif.
-
[1]
-
表 1 化合物4~24的体外细胞毒活性数据(IC50, μmol•L-1)a
Table 1. In vitro cytotoxic activities of compounds 4~24 (IC50, mmol•L-1)

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 13
- 文章访问数: 1755
- HTML全文浏览量: 298



 下载:
下载:




 下载:
下载:

