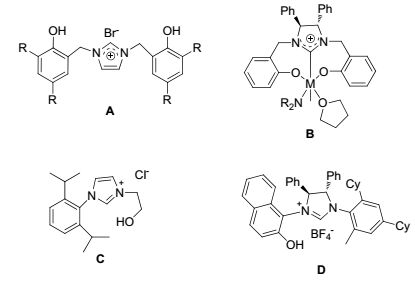
 图 1
部分已报道的侧臂含羟基官能团的NHC配体和配合物
Figure 1.
Selected examples of reported NHC ligands with hydroxyl-functionalized side arms or related metal complexes
图 1
部分已报道的侧臂含羟基官能团的NHC配体和配合物
Figure 1.
Selected examples of reported NHC ligands with hydroxyl-functionalized side arms or related metal complexes

Citation: Bai Yali, Li Xiaowei, Xiao Xuedong, Liu Jiaqi, Yang Junjuan, Wang Junwen. Synthesis of Imidazolium Precursors for the Hydroxyl-Group-Modified N-Heterocyclic Carbenes and Applications of the in situ Generated Carbene Ligands in Suzuki-Miyaura and Sonogashira Coupling Reactions[J]. Chinese Journal of Organic Chemistry, 2017, 37(5): 1258-1265. doi: 10.6023/cjoc201610039

含羟基氮杂环卡宾的咪唑盐前体的合成及其原位产生的卡宾配体在Suzuki-Miyaura和Sonogashira反应中的应用
-
关键词:
- 羟基官能团
- / 氮杂环卡宾
- / 钯
- / Suzuki偶联反应
- / Sonogashira偶联反应
English
Synthesis of Imidazolium Precursors for the Hydroxyl-Group-Modified N-Heterocyclic Carbenes and Applications of the in situ Generated Carbene Ligands in Suzuki-Miyaura and Sonogashira Coupling Reactions
-
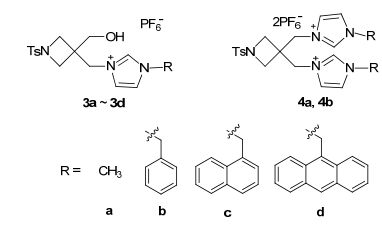
自1991年Auduengo等[1]首次分离出稳定的游离氮杂环卡宾后, 氮杂环卡宾的开发与应用在过去的20年里已经得到了迅猛的发展[2].由于这些化合物具有较强的σ-配位能力, 可以作为配体与几乎所有的金属配位, 尤其是与过渡金属形成的金属卡宾配合物在构造C—C键中表现出了良好的催化活性[3].近年来, 一些含有功能基团(N, O, N-O等)的氮杂环卡宾被相继报道, 在这些功能性侧臂的辅助下, 所形成的氮杂环卡宾配合物更为稳定, 其催化活性也更好[4]. Barroso等[5]于2014年报道了Zr和Hf与NHC配体A (图 1)的络合物可高效催化分子内烯烃的加氢胺化反应; Zhao等[6]以手性NHC的金属络合物B为引发剂, 研究了外消旋丙交酯的开环聚合反应, 在酚羟基的辅助配位下, 催化剂的稳定性和活性均得到了较大程度的提高; Hameury等[7]研究了N-杂环卡宾C在Pd(ⅱ)和Ni(ⅱ)的络合物中的羟基功能臂对其结构的影响, 研究表明羟基侧臂提高了Ni(ⅱ)络合物对乙烯低聚的催化性能. Ohmiya等[8]在2016年报道了萘酚羟基修饰的手性N-杂环卡宾配体D作为前催化剂催化烯丙基的烷基化反应, 该反应的选择性高达93%.为此, 本工作设计合成了一系列含羟基官能团的氮杂环卡宾的前体咪唑盐3a~3d(图 2), 并将其应用在钯催化的偶联反应中, 同时与不含羟基官能团的咪唑盐4a和4b(图 2)的反应活性进行了研究对比.
 图 1
部分已报道的侧臂含羟基官能团的NHC配体和配合物
Figure 1.
Selected examples of reported NHC ligands with hydroxyl-functionalized side arms or related metal complexes
图 1
部分已报道的侧臂含羟基官能团的NHC配体和配合物
Figure 1.
Selected examples of reported NHC ligands with hydroxyl-functionalized side arms or related metal complexes
N-杂环卡宾钯配合物作为一种高效的催化剂, 已经被成功应用于许多催化反应中[9].其中, Suzuki-Miyaura偶联反应是合成联芳类化合物最有效的合成方法[10], 并且, 近年来绿色化学的观念逐渐深入人心[11, 12].因此, 我们试图在低污染和低能耗下实现对Suzuki-Miyaura偶联反应的高效催化.另一方面, Sonogashira偶联反应的催化剂或前催化剂常用膦作为配体, 以氮杂环卡宾用作配体的报道相对较少[13](Caddick和Cloke等[14]首次将氮杂环卡宾作为配体应用于Sonogashira偶联反应中), 并且, 催化剂的用量也相对较大.在本工作中, 我们探讨了含有羟基官能团的四元杂环氮杂卡宾咪唑盐前体在Sonogashira偶联反应中的催化活性, 并筛选了混合催化剂PdCl2(CH3CN)2/咪唑盐/CuI的最小用量, 最大限度地提高了催化剂的利用率, 降低了反应的成本.
1 结果与讨论
1.1 咪唑盐的合成与表征
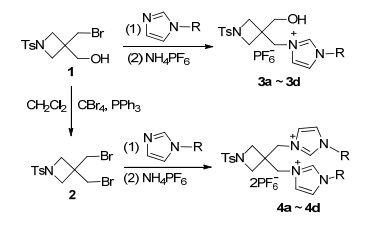
化合物1和2依据文献中的方法合成[15~19].咪唑盐3a~3d或4a, 4b是通过化合物1或2与过量的1-取代咪唑在四氢呋喃(THF)或1, 4-二氧六环溶剂中完全反应后, 再经过阴离子交换而制得(Scheme 1)[15].这些咪唑六氟磷酸盐(3a~3d, 4a, 4b)的结构已通过1H NMR, 13C NMR、红外光谱、元素分析和单晶X射线衍射进行了表征.在3a~3d和4a, 4b的1H NMR谱中, 咪唑2位氢质子归属为δ 9.07~9.50处的单峰, 在13C NMR谱中, 咪唑2位碳质子信号出现在δ 144附近, 这与文献中报道的相关咪唑盐的化学信号相一致.
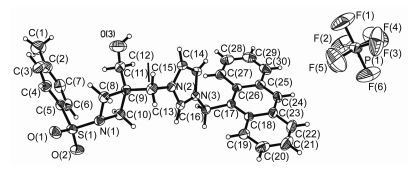
采用X射线衍射对化合物3d的单晶结构进行了解析, 单晶3d (CCDC 1476938) 是通过乙醚分散到饱和的乙腈溶液中得到的.其晶体结构如图 3所示, 选定的键长和键角列于表 1.结果显示咪唑盐3d属于三斜晶系, 空间群P-1. S原子有一个扭曲的四面体环境, O(1)—S(1)—O(2) 键角为119.99(18)°, C(5)—S(1)—N(1) 键角为106.34(17)°.晶体的堆积结构中包含有弱的C—H…X (X=N, O)氢键作用(表 1), 分子间通过这些氢键构筑成了一个网络结构.
D—H…A D—H H…A D…A ∠D—H…A O(3)—H(3)…F(4)ⅱ 0.82 2.49 3.091(9) 124 C(6)—H(6)…O(2) 0.93 2.59 2.935(5) 103 C(10)—H(10A)…F(2)ⅲ 0.97 2.53 3.431(7) 155 C(12)—H(12B)…O(1)ⅰ 0.97 2.56 3.429(5) 150 C(13)—H(13)…F(6)ⅳ 0.93 2.39 3.269(6) 158 C(15)—H(15)…F(1)ⅱ 0.93 2.31 3.236(7) 173 aSymmetry codes:(ⅰ) -x, 2-y, 2-z; (ⅱ) 1-x, 1-y, 1-z; (ⅲ) x, y, 1+z; (ⅳ) 1-x, 2-y, 1-z. 表 1 3d的氢键键长( )及键角(°)a
Table 1. Hydrogen bond distances ( ) and angles (°) for 3d1.2 氮杂环卡宾的前体咪唑盐与乙腈氯化钯组成的催化体系在Suzuki偶联反应中的催化活性
1.3 氮杂环卡宾的前体咪唑盐在钯与铜催化的Sonogashira偶联反应中的催化活性
1.2.1 Suzuki-Miyaura偶联反应反应条件的优化
以溴代芳烃与苯硼酸作为模板底物, 使用PdCl2-(CH3CN)2 (1.0 mmol%)和咪唑盐3b (1.0 mmol%)作为催化剂, 通过改变溶剂、碱和时间, 优化其反应条件.结果列于表 2中.
 表 2
不同的溶剂和碱对溴苯与苯硼酸偶联反应的影响a
Table 2.
Effect of different solvents and bases on the cross-coupling of bromobenzene and phenylboronic acid
表 2
不同的溶剂和碱对溴苯与苯硼酸偶联反应的影响a
Table 2.
Effect of different solvents and bases on the cross-coupling of bromobenzene and phenylboronic acid

Entry Solvent (V:V) Base Time/h Yieldb/% 1 DMSO KOH 1 43 2 Dioxane KOH 1 10 3 i-PrOH KOH 1 50 4 TBA KOH 1 89 5 H2O KOH 1 42 6 i-PrOH/H2O (1:1) KOH 1 85 7 TBA/H2O (1:1) KOH 0.5 99 8 TBA/H2O (1:1) KOBu-t 0.5 89 9 TBA/H2O (1:1) K2CO3 0.5 85 10 TBA/H2O (1:1) NaHCO3 0.5 70 aReaction conditions: PhB(OH)2 (0.6 mmol), bromobenzene (0.5 mmol), base (1.0 mmol), 3b (1.0 mol%), PdCl2(CH3CN)2 (1.0 mol%)and solvent (2.0 mL) at 25 ℃; bIsolated yields determined by chromatographic purification, and the products were characterized by 1H NMR and 13C NMR. 表 2 不同的溶剂和碱对溴苯与苯硼酸偶联反应的影响a
Table 2. Effect of different solvents and bases on the cross-coupling of bromobenzene and phenylboronic acid由表 2可知, 溶剂和碱对Suzuki-Miyaura偶联反应是至关重要的.当溶剂选用非质子型溶剂二甲基亚砜(DMSO)和1, 4-二氧六环(Dioxane)时, 产率分别为43%和10%, 效果不佳(表 2, Entries 1, 2).当溶剂换成质子型溶剂i-PrOH、叔丁醇(TBA)和H2O时, 产率有一定的提高, 分别为50%, 89%和42%(表 2, Entries 3~5).我们从经济、环保和高效的角度出发, 尝试使用了一种混合溶剂(有机溶剂与水按体积1:1的混合), 结果表明, 混合溶剂与纯溶剂相比取得了更好的催化效果(表 2, Entries 6, 7 vs. 3, 4).其中, 混合溶剂叔丁醇(TBA)/H2O (V:V=1:1) 的收率最高99% (表 2, Entry 7).因此, 选用TBA/H2O (V:V=1:1) 作为最佳反应溶剂, 同时在室温反应0.5 h条件下进行碱的筛选.由实验数据可以看出, KOH是最有效的碱(表 2, Entry 7), 其它无机碱和有机碱(如KOBu-t, K2CO3, NaHCO3等)得到的产率都较低(表 2, Entries 8~10).
1.2.2 反应底物及咪唑盐对Suzuki偶联反应的影响
在优化的反应条件下, 我们测试了不同的反应底物对Suzuki-Miyaura偶联反应的影响, 所有的反应均在室温下进行0.5 h, 结果列于表 3中.
 表 3
不同的溴代芳烃和芳基硼酸对Suzuki-Miyaura偶联反应的影响a
Table 3.
Suzuki-Miyaura reaction of various arylhalides with different arylboronic acids
表 3
不同的溴代芳烃和芳基硼酸对Suzuki-Miyaura偶联反应的影响a
Table 3.
Suzuki-Miyaura reaction of various arylhalides with different arylboronic acids

Entry R1 R2 X Yieldb/% 1 H H Br 99 2 H OC2H5 Br 94 3 H Cl Br 87 4 OCH3 H Br 92 5 OCH3 OC2H5 Br 90 6 OCH3 Cl Br 82 7 CH3 H Br 95 8 CH3 OC2H5 Br 91 9 CH3 Cl Br 85 10 NO2 H Br 99 11 NO2 OC2H5 Br 99 12 NO2 Cl Br 99 13 CN H Br 99 14 CN OC2H5 Br 99 15 CN Cl Br 99 16 H H Cl 15 a Reaction conditions: arylboronic acids (0.6 mmol), arylhalides (0.5 mmol), KOH (1.0 mmol), 3b (1.0 mol%), PdCl2(CH3CN)2 (1.0 mol%) and TBA/ H2O (V:V=1:1) (2.0 mL) at 25 ℃ for 0.5 h; b Isolated yields determined by chromatographic purification, and all products were characterized by 1H NMR and 13C NMR. 表 3 不同的溴代芳烃和芳基硼酸对Suzuki-Miyaura偶联反应的影响a
Table 3. Suzuki-Miyaura reaction of various arylhalides with different arylboronic acids如表 3所示, 所有的溴代芳烃和芳基硼酸转化为相应的联苯类化合物均取得了良好的收率(表 3, Entries 1~16).实验表明, 反应收率与反应底物取代基团的电子效应有关(表 3, Entries 1~15).带有吸电子基团的反应底物活性较高, 反应收率相对较好.相反, 带有给电子基团的底物则不利于Suzuki-Miyaura偶联反应的进行.此外, 溴代芳烃取代基团的电子效应对活性的影响比芳基硼酸取代基的影响作用明显.
为了考察咪唑盐取代基对催化性能的影响, 我们在优化的条件下, 测试了咪唑盐3a~3d和4a, 4b在钯催化的Suzuki-Miyaura偶联反应中的反应活性, 结果如表 4所示.
 表 4
不同的咪唑盐对溴苯和苯硼酸的Suzuki-Miyaura偶联反应的影响a
Table 4.
Suzuki-Miyaura reaction of bromobenzene and phenylboronic acid with different imidazolium salts
表 4
不同的咪唑盐对溴苯和苯硼酸的Suzuki-Miyaura偶联反应的影响a
Table 4.
Suzuki-Miyaura reaction of bromobenzene and phenylboronic acid with different imidazolium salts

Entry Imidazolium salt Yieldb/% 1 3a 85 2 3b 99 3 3c 89 4 3d 85 5 4a 30 6 4b 41 a Reaction conditions: PhB(OH)2 (0.6 mmol), bromobenzene (0.5 mmol), KOH (1.0 mmol), imidazolium salts (1.0 mol%), PdCl2(CH3CN)2 (1.0 mol%) and TBA/H2O (V:V=1:1) (2.0 mL) at 25 ℃ for 0.5 h; b Isolated yields determined by chromatographic purification, and all products were characterised by 1H NMR and 13C NMR. 表 4 不同的咪唑盐对溴苯和苯硼酸的Suzuki-Miyaura偶联反应的影响a
Table 4. Suzuki-Miyaura reaction of bromobenzene and phenylboronic acid with different imidazolium salts由表 4可知, 在相同的反应条件下, 与不含羟基官能团的咪唑盐相比, 含有羟基官能团的咪唑盐在钯催化的Suzuki-Miyaura偶联反应中表现出更好的反应活性(表 4, Entries 1~4 vs. 5, 6).其中, 使用催化剂PdCl2/咪唑盐3b得到的催化活性最高(表 4, Entry 2, 99%).
1.3.2 反应底物及咪唑盐对Sonogashira偶联反应的影响
在优化的反应条件下, 我们测试了不同底物和带有不同取代基的咪唑盐对Sonogashira偶联反应的影响, 结果如表 6所示.
 表 6
不同咪唑盐和碘代烃对Sonogashira偶联反应的影响a
Table 6.
Sonogashira reactions of various iodobenzenes with different imidazolium salts
表 6
不同咪唑盐和碘代烃对Sonogashira偶联反应的影响a
Table 6.
Sonogashira reactions of various iodobenzenes with different imidazolium salts

Entry R Imidazolium salt Yieldb/% 1 H 3a 77 2 H 3b 99 3 H 3c 98 4 H 3d 92 5 H 4a 61 6 H 4b 77 7 4-NO2 3b 99 8 4-OCH3 3b 95 9 2-NH2 3b 86 10 3-NH2 3b 71 11 4-NH2 3b 89 a Reaction conditions: phenylacetylene (0.6 mmol), iodobenzene (0.5 mmol), triethylamine (1.2 mmol), imidazolium salts (0.1 mmol%), PdCl2(CH3CN)2 (0.1 mmol%), CuI (1.0 mmol%) and DMSO (0.7 mL) at 80 ℃ for 5 h; b Isolated yields determined by chromatographic purification, and the products were characterized by 1H NMR, 13C NMR. 表 6 不同咪唑盐和碘代烃对Sonogashira偶联反应的影响a
Table 6. Sonogashira reactions of various iodobenzenes with different imidazolium salts由表 6可知, 与Suziki-Miyaura偶联反应相似, 在其他条件相同, 而加入的咪唑盐不同的情况下, 反应收率明显与咪唑盐的取代基团有关(表 6, Entries 1~6).与不含羟基官能团的咪唑盐相比, 含有羟基官能团的咪唑盐在钯与铜催化的Sonogashira偶联反应中表现出的反应活性更好(表 6, Entries 1~4 vs. 5, 6).其中, 催化剂PdCl2/咪唑盐3b表现出最高的催化活性99%(表 6, Entry 2).对于不同的反应底物, 带有吸电子基团的芳基碘代物得到较高的收率(表 6, Entries 7), 并且带有给电子基团的芳基碘代物得到的收率相对较低(表 6, Entries 8~11).同时, 间位取代的氨基碘化物与邻位取代和对位取代的氨基碘化物相比, 得到的收率相对较低(表 6, Entries 9~11).
1.3.1 Sonogashira偶联反应条件的优化
以碘苯和苯乙炔的偶联反应为模板反应, 以咪唑盐3b和PdCl2(CH3CN)2作为催化剂, CuI作为助催化剂, 通过改变溶剂、碱、温度、反应时间、催化剂用量等, 筛选Sonogashira偶联反应的最优反应条件.实验结果见表 5.
 表 5
不同的溶剂, 碱和催化剂用量对Sonogashira偶联反应的影响a
Table 5.
The effect of different solvents, bases and amounts of catalysts on the Sonogashira coupling reaction
表 5
不同的溶剂, 碱和催化剂用量对Sonogashira偶联反应的影响a
Table 5.
The effect of different solvents, bases and amounts of catalysts on the Sonogashira coupling reaction

Entry Base Solvent [Cu]/mmol% [Pd]/mmol% Temp./℃ Time/h Yieldb/% 1 KOH DMF 5 1 120 24 83 2 KOH DMSO 5 1 120 24 38 3 K2CO3 DMF 5 1 120 24 18 4 K2CO3 DMSO 5 1 120 24 5 5 Et3N DMF 5 1 80 24 66 6 Et3N DMSO 5 1 80 5 99 7 Et3N NMP 5 1 80 16 92 8 Et3N 1, 4-Dioxane 5 1 80 16 66 9 Et3N EtOH 5 1 80 16 38 10 Et3N DMSO 0 1 80 24 44 11 Et3N DMSO 5 1 80 5 99 12 Et3N DMSO 1 1 80 5 98 13 Et3N DMSO 1 0.1 80 5 98 14 Et3N DMSO 0.1 0.1 80 5 59 15 Et3N DMSO 0.1 0.01 80 5 38 16 Et3N DMSO 5 0 80 48 68 a Reaction conditions: phenylacetylene (0.6 mmol), iodobenzene (0.5 mmol), base (1.2 mmol), 3b, PdCl2(CH3CN)2, CuI and solvent (0.7 mL); b Isolated yields determined by chromatographic purification, and the products were characterised by 1H NMR and 13C NMR. 表 5 不同的溶剂, 碱和催化剂用量对Sonogashira偶联反应的影响a
Table 5. The effect of different solvents, bases and amounts of catalysts on the Sonogashira coupling reaction由表 5可知, 当我们选用两种非质子型溶剂N, N-二甲基甲酰胺(DMF)和DMSO作为反应溶剂时, 无机碱KOH和K2CO3在120 ℃下反应24 h的效果均较差(表 5, Entries 1~4), 而有机碱Et3N则在80 ℃, 5 h内获得了99%的收率(表 5, Entry 6), 所以, 选用Et3N作为反应碱.随后, 以1.2 mmol Et3N为碱, 在筛选的所有溶剂中, 极性溶剂均取得了较好的效果(表 5, Entries 5~7), 而非极性溶剂和质子型溶剂则分别给出了较低的收率(表 5, Entries 8~9).其中, 以DMSO为溶剂, Et3N为碱, 80 ℃下, 反应5 h, 可得到99%的收率(表 5, Entry 6).因此, 我们将此选为最佳反应条件.此外, 催化剂用量也直接影响反应的效果, 使用0.1 mmol% PdCl2(CH3CN)2和1 mmol% CuI的混合催化剂可获得最佳的收率98%(表 5, Entry 13).
2 结论
合成了四个含羟基官能团的四元杂环氮杂环卡宾前体咪唑盐, 研究了其在钯催化的Suzuki和Sonogashira反应中的催化活性.结果表明, 这些咪唑盐在碱KOH存在下原位产生的氮杂环卡宾配体与PdCl2(CH3CN)2在相对温和的条件下(叔丁醇/水, 室温, 0.5 h)可高效催化Suziki-Miyaura偶联反应.而在Sonogashira偶联反应中, 以DMSO为溶剂, Et3N为碱, 使用小剂量的咪唑盐与催化剂(0.1 mol% PdCl2(CH3CN)2和1 mol% CuI), 可使碘代苯与苯乙炔的偶联反应得到良好的收率.而对于不含羟基官能团的咪唑盐, 在此两类钯催化的偶联反应中表现出的反应活性较差.
3 实验部分
3.1 仪器与试剂
1H NMR和13C NMR在常温下Bruker AVANCE Ⅲ HD 600 MHz Spectrometer测定, TMS为内标, CDCl3或DMSO-d6为溶剂; 红外数据经Varian 660-IR FT-IR Spectrometer测得; 熔点经WRS-3 Melting Point Apparatus测得; 元素分析经Vario MACRO cube元素分析仪测定.实验过程中所用的试剂均为市售分析纯, 未经特别说明, 均通过标准方法除水.
3.2 催化剂的制备
3.3 Suziki-Miyaura偶联反应的一般实验方法
在氮气氛围下, 于反应管中加入卤代芳烃(0.5 mmol)、有机硼化物(0.6 mmol)、KOH (1.0 mmol), PdCl2(CH3CN)2 (1.0 mmol%)、咪唑盐(1.0 mmol%)和溶剂(2.0 mL), 在25 ℃下反应, TLC跟踪反应完成后.用水润洗, 萃取, 将二氯甲烷有机相用无水MgSO4干燥, 过滤后, 减压蒸去溶剂得粗产物, 经柱色谱分离得到目标产物.目标化合物结构经1H NMR确认.
3.3 Sonogashira偶联反应的一般实验方法
在氮气氛围下, 于反应管中加入卤代芳烃(0.5 mmol)、苯乙炔(0.6 mmol)、Et3N (1.2 mmol)、0.1% mmol (0.25 mg) PdCl2(CH3CN)2、1.0 mmol% (1.90 mg) CuI、0.1 mmol%咪唑盐和0.7 mL溶剂, 在80 ℃下反应, TLC跟踪反应完成后, 用水润洗, 二氯甲烷萃取, 有机相用无水MgSO4干燥, 过滤, 减压蒸去溶剂得粗产物, 经柱色谱分离得到目标产物.目标化合物结构经1H NMR确认.
3-(1-甲苯磺酰基氮杂环丁烷-3-羟甲基-3-亚甲基)-甲基咪唑六氟磷酸盐(3a):白色固体, 产率85%. m.p. 194.1~194.6 ℃; 1H NMR (DMSO-d6, 600 MHz) δ: 2.45 (s, 3H), 3.14 (d, J=4.7 Hz, 2H), 3.45 (d, J=8.7 Hz, 2H), 3.58 (d, J=8.7 Hz, 2H), 3.82 (s, 3H), 4.28 (s, 2H), 5.19 (t, J=4.7 Hz, 1H), 7.49 (d, J=7.8 Hz, 2H), 7.63~7.66 (m, 4H), 9.07 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 144.571 (CH), 137.836 (CAr), 131.235 (CAr), 130.396 (CHAr), 128.587 (CHAr), 123.960 (CH), 123.600 (CH), 63.090 (CH2), 54.885 (CH2), 51.019 (CH2), 38.918 (CH3), 36.306 (C), 21.5849 (CH3). Anal. calcd for C16H22F6N3-O3PS: C 39.92, H 4.61, N 8.73; found C 40.01, H 4.61, N 8.75.
3-(1-甲苯磺酰基氮杂环丁烷-3-羟甲基-3-亚甲基)-苄基咪唑六氟磷酸盐(3b):白色固体, 产率89%. m.p. 122.0~122.5 ℃; 1H NMR (DMSO-d6, 600 MHz) δ: 2.45 (s, 3H), 3.11 (d, J=4.5 Hz, 2H), 3.46 (d, J=8.7 Hz, 2H), 3.62 (d, J=8.7 Hz, 2H), 4.33 (s, 2H), 5.17 (t, J=4.5 Hz, 1H), 5.40 (s, 2H), 7.38~7.45 (m, 5H), 7.48 (d, J=8.0 Hz, 2H), 7.65 (d, J=8.0 Hz, 2H), 7.73 (d, J=14.6 Hz, 2H), 9.30 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 144.611 (CH), 137.621 (CAr), 135.195 (CAr), 131.237 (CAr), 130.424 (CHAr), 129.492 (CHAr), 129.214 (CHAr), 128.587 (CHAr), 124.278 (CHAr), 122.920 (CH), 63.177 (CH2), 54.967 (CH2), 52.482 (CH2), 51.427 (CH2), 38.851 (C), 21.583 (CH3). Anal. calcd for C22H26F6N3O3PS: C 47.40, H 4.70, N 7.54; found C 47.52, H 4.71, N 7.55.
3-(1-甲苯磺酰基氮杂环丁烷-3-羟甲基-3-亚甲基)-萘甲基咪唑六氟磷酸盐(3c):淡黄色固体, 产率86%. m.p. 186.0~186.3 ℃; 1H NMR (DMSO-d6, 600 MHz) δ: 2.44 (s, 3H), 3.11 (d, J=5.0 Hz, 2H), 3.45 (d, J=8.8 Hz, 2H), 3.61 (d, J=8.8 Hz, 2H), 4.33 (s, 2H), 5.17 (t, J=5.0 Hz, 1H), 5.95 (s, 2H), 7.45 (d, J=7.9 Hz, 2H), 7.50 (d, J=6.9 Hz, 1H), 7.57~7.66 (m, 5H), 7.76 (d, J=6.3 Hz, 2H), 8.03 (t, J=6.3 Hz, 2H), 8.13 (d, J=7.9 Hz, 1H), 9.38 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 144.571 (CH), 137.861 (CAr), 133.874 (CAr), 131.233 (CAr), 130.812 (CAr), 130.547 (CAr), 130.417 (CHAr), 130.071 (CHAr), 129.372 (CHAr), 128.595 (CHAr), 127.887 (CHAr), 127.662 (CHAr), 126.925 (CHAr), 126.162 (CHAr), 124.111 (CHAr), 123.336 (CH), 123.176 (CH), 63.194 (CH2), 54.955 (CH2), 51.403 (CH2), 50.463 (CH2), 38.909 (C), 21.587 (CH3). Anal. calcd for C26H28F6N3O3PS: C 51.40, H 4.65, N 6.92; found C 51.51, H 4.66, N 6.94.
3-(1-甲苯磺酰基氮杂环丁烷-3-羟甲基-3-亚甲基)-蒽甲基咪唑六氟磷酸盐(3d):黄色固体, 产率85%. m.p. 200.6~200.9 ℃; 1H NMR (DMSO-d6, 600 MHz) δ: 2.36 (s, 3H), 3.03 (d, J=5.2 Hz, 2H), 3.38 (d, J=8.5 Hz, 2H), 3.51 (d, J=8.5 Hz, 2H), 4.24 (s, 2H), 5.13 (t, J=5.2 Hz, 1H), 6.48 (s, 2H), 7.37 (d, J=7.4 Hz, 2H), 7.49 (s, 1H), 7.57~7.70 (m, 7H), 8.24 (d, J=8.4 Hz, 2H), 8.45 (d, J=8.4 Hz, 2H), 8.87 (s, 1H), 9.12 (s, 1H); 13C NMR (DMSO-d6, 125 MHz) δ: 144.509 (CH), 137.182 (CAr), 131.555 (CHAr), 131.335 (CAr), 131.111 (CAr), 131.024 (CAr), 130.647 (CAr), 130.373 (CHAr), 129.887 (CHAr), 128.515 (CHAr), 128.271 (CHAr), 128.187 (CHAr), 126.094 (CHAr), 123.826 (CH), 122.698 (CH), 63.013 (CH2), 54.868 (CH2), 51.181 (CH2), 45.479 (CH2), 38.856 (C), 21.473 (CH3). Anal. calcd for C30H30F6N3O3PS: C 54.79, H 4.60, N 6.39; found C 54.82, H 4.61, N 6.38.
3, 3-二(1-甲基咪唑-3-亚甲基)-1-甲苯磺酰基氮杂环丁烷六氟磷酸盐(4a):白黄色固体, 产率78%. m.p. 193.2~193.4 ℃; 1H NMR (DMSO-d6, 600 MHz) δ: 2.49 (s, 3H), 3.59 (s, 4H), 3.85 (s, 6H), 4.48 (s, 4H), 7.44 (d, J=8.3 Hz, 2H), 7.49 (d, J=8.3 Hz, 2H), 7.66 (s, 2H), 7.80 (s, 2H), 9.31 (s, 2H); 13C NMR (DMSO-d6, 125 MHz) δ: 144.774 (CH), 138.146 (CAr), 130.368 (CAr), 128.477 (CHAr), 124.103 (CHAr), 123.747 (CH), 54.135 (CH2), 51.200 (CH2), 38.290 (CH3), 36.481 (C), 21.646 (CH3). Anal. calcd for C20H27F12N5O2P2S: C 34.74, H 3.94, N 10.13; found C 34.82, H 3.93, N 10.11.
3, 3-二(1-苄基咪唑-3-亚甲基)-1-甲苯磺酰基氮杂环丁烷六氟磷酸盐(4b):白黄色固体, 产率82%. m.p. 106.2~106.5 ℃; 1H NMR (DMSO-d6, 600 MHz) δ: 2.49 (s, 3H), 3.62 (s, 4H), 4.47 (s, 4H), 5.46 (s, 4H), 7.44~7.49 (m, 12H), 7.49 (d, J=8.0 Hz, 2H), 7.79 (s, 2H), 7.84 (s, 2H), 9.50 (s, 2H); 13C NMR (DMSO-d6, 125 MHz) δ: 142.685 (CH), 135.721 (CAr), 132.922 (CAr), 128.269 (CAr), 127.308 (CHAr), 127.090 (CHAr), 126.649 (CHAr), 126.314 (CHAr), 122.140 (CHAr), 120.941 (CH), 52.029 (CH2), 50.398 (CH2), 49.361(CH2), 35.972 (C), 19.510 (CH3). Anal. calcd for C32H35F12N5O2P2S: C 45.56, H 4.18, N 8.30; found C 45.63, H 4.19, N 8.30.
联苯[20](表 3, Entry 1): 1H NMR (CDCl3, 600 MHz) δ: 7.34 (t, J=7.4 Hz, 2H), 7.44 (t, J=7.4 Hz, 4H), 7.59 (d, J=7.4 Hz, 4H).
4-乙氧基联苯[20](表 3, Entry 2): 1H NMR (CDCl3, 600 MHz) δ: 1.36 (t, J=6.9 Hz, 3H), 4.00 (q, J=6.9 Hz, 2H), 6.89 (d, J=8.4 Hz, 2H), 7.22 (t, J=7.5 Hz, 1H), 7.34 (t, J=7.5 Hz, 2H), 7.44 (t, J=8.4 Hz, 2H), 7.48 (t, J=7.5 Hz, 2H).
4-氯联苯[21](表 3, Entry 3): 1H NMR (DMSO-d6, 600 MHz) δ: 7.39 (t, J=7.6 Hz, 1H), 7.47 (t, J=8.4 Hz, 2H), 7.52 (d, J=7.6 Hz, 2H), 7.66 (d, J=8.4 Hz, 2H), 7.69 (d, J=8.4 Hz, 2H).
4-甲氧基联苯[20](表 3, Entry 4): 1H NMR (CDCl3, 600 MHz) δ: 3.78 (s, 3H), 6.91 (d, J=8.7 Hz, 2H), 7.23 (t, J=7.4 Hz, 1H), 7.34 (t, J=7.4 Hz, 2H), 7.48 (d, J=8.7 Hz, 2H), 7.46 (d, J=7.4 Hz, 2H).
4-乙氧基-4'-甲氧基联苯[22](表 3, Entry 5): 1H NMR (CDCl3, 600 MHz) δ: 1.36 (t, J=7.0 Hz, 3H), 3.77 (s, 3H), 4.00 (q, J=7.0 Hz, 2H), 6.88 (dd, J=8.4, 8.4 Hz, 4H), 7.40 (dd, J=8.4, 8.4 Hz, 4H).
4-氯-4'-甲氧基联苯[21](表 3, Entry 6): 1H NMR (CDCl3, 600 MHz) δ: 3.77 (s, 3H), 6.89 (d, J=8.7 Hz, 2H), 7.30 (d, J=8.6 Hz, 2H), 7.39 (d, J=8.6 Hz, 2H), 7.41 (d, J=8.7 Hz, 2H).
4-甲基联苯[20](表 3, Entry 7): 1H NMR (CDCl3, 600 MHz) δ: 2.27 (s, 3H), 7.13 (d, J=7.5 Hz, 2H), 7.21 (t, J=7.5 Hz, 1H), 7.30 (t, J=7.5 Hz, 2H), 7.38 (d, J=7.1 Hz, 2H), 7.47 (d, J=7.1 Hz, 2H).
4-乙氧基-4'-甲基联苯[23](表 3, Entry 8): 1H NMR (CDCl3, 600 MHz) δ: 1.36 (t, J=7.0 Hz, 3H), 2.30 (s, 3H), 3.99 (q, J=7.0 Hz, 2H), 6.87(d, J=8.7 Hz, 2H), 7.14 (d, J=8.1 Hz, 2H), 7.37 (d, J=8.1 Hz, 2H), 7.42 (d, J=8.7 Hz, 2H).
4-氯-4'-甲基联苯[21](表 3, Entry 9): 1H NMR (CDCl3, 600 MHz) δ: 2.39 (s, 3H), 7.25 (d, J=8.9 Hz, 2H), 7.38 (d, J=8.5 Hz, 2H), 7.45 (d, J=8.9 Hz, 2H), 7.49 (d, J=8.5 Hz, 2H).
4-硝基联苯[20](表 3, Entry 10): 1H NMR (CDCl3, 600 MHz) δ: 7.45 (t, J=7.1 Hz, 1H), 7.51 (t, J=7.1 Hz, 2H), 7.63 (d, J=7.1 Hz, 2H), 7.74 (d, J=8.9 Hz, 2H), 8.30 (d, J=8.9 Hz, 2H).
4-硝基-4'-乙氧基联苯[24](表 3, Entry 11): 1H NMR (CDCl3, 600 MHz) δ: 1.46 (t, J=7.0 Hz, 3H), 4.10 (q, J=7.0 Hz, 2H), 7.00 (d, J=8.6 Hz, 2H), 7.57 (d, J=8.6 Hz, 2H), 7.69 (d, J=8.6 Hz, 2H), 8.27 (d, J=8.6 Hz, 2H).
4-硝基-4'-氯联苯[21](表 3, Entry 12): 1H NMR (CDCl3, 600 MHz) δ: 7.47 (d, J=8.5 Hz, 2H), 7.56 (d, J=8.5 Hz, 2H), 7.71 (d, J=8.7 Hz, 2H), 8.30 (d, J=8.7 Hz, 2H).
4-氰基联苯[25](表 3, Entry 13): 1H NMR (CDCl3, 600 MHz) δ: 7.35 (t, J=7.4 Hz, 1H), 7.40 (t, J=7.4 Hz, 2H), 7.51 (d, J=7.4 Hz, 2H), 7.60 (d, J=8.4 Hz, 2H), 7.64 (d, J=8.4 Hz, 2H).
4-乙氧基-4'-氰基联苯[26](表 3, Entry 14): 1H NMR CDCl3, 600 MHz) δ: 1.37 (t, J=7.0 Hz, 3H), 4.01 (q, J=7.0 Hz, 2H), 6.91 (d, J=8.7 Hz, 2H), 7.45 (d, J=8.7 Hz, 2H), 7.56 (d, J=8.4 Hz, 2H), 7.61 (d, J=8.4 Hz, 2H).
4-氯-4'-氰基联苯[21](表 3, Entry 15): 1H NMR (CDCl3, 600 MHz) δ: 7.38 (d, J=8.6 Hz, 2H), 7.44 (d, J=8.6 Hz, 2H), 7.57 (d, J=8.5 Hz, 2H), 7.65 (d, J=8.5 Hz, 2H).
1, 2-二苯乙炔[27](表 6, Entries 1~6): m.p. 60.2~60.7 ℃ (lit.[28]: 60~61 ℃); 1H NMR (CDCl3, 600 MHz) δ: 7.17~7.28 (m, 6H), 7.45~7.47 (m, 4H).
4-硝基苯基苯乙炔[27](表 6, Entry 7): 1H NMR (CDCl3, 600 MHz) δ: 7.39~7.40 (m, 3H), 7.56~7.57 (m, 2H), 7.67 (m, J=8.9 Hz, 2H), 8.23(m, J=8.9 Hz, 2H).
4-甲氧基苯基苯乙炔[27](表 6, Entry 8): 1H NMR (CDCl3, 600 MHz) δ: 3.75 (s, 3H), 6.80 (d, J=8.6 Hz, 2H), 7.23~7.27 (m, 3H), 7.40 (d, J=8.6 Hz, 2H), 7.44 (d, J=6.8 Hz, 2H).
2-乙炔基苯基苯胺[29](表 6, Entry 9): 1H NMR (CDCl3, 600 MHz) δ: 4.13 (br, 2H), 6.63~6.66 (m, 2H), 7.07 (t, J=7.8 Hz, 1H), 7.25~7.30 (m, 4H), 7.45 (d, J=7.8 Hz, 2H).
3-乙炔基苯基苯胺[30](表 6, Entry 10): 1H NMR (CDCl3, 600 MHz) δ: 3.62 (br, 2H), 6.58 (d, J=7.8 Hz, 1H), 6.78 (s, 1H), 6.87 (d, J=7.8 Hz, 1H), 7.05 (t, J=7.8 Hz, 1H), 7.24~7.28 (m, 3H), 7.44 (d, J=7.9 Hz, 2H).
4-乙炔基苯基苯胺[31](表 6, Entry 11): 1H NMR (CDCl3, 600 MHz) δ: 3.71 (br, 2H), 6.53 (d, J=8.5 Hz, 2H), 7.19~7.26 (m, 5H), 7.41 (m, J=6.8 Hz, 2H).
辅助材料(Supporting Information) 所合成化合物的1H NMR, 13C NMR和IR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.2 咪唑盐3b~3d和4b的合成
在反应瓶中加入化合物1 (2.0 g, 6.0 mmol)或化合物2 (1.0 g, 2.5 mmol)和1-苄基咪唑(1.2 g, 7.6 mmol), 溶解于50.0 mL的四氢呋喃(THF)中, 于80 ℃下搅拌回流, TLC跟踪反应至无原料点.反应体系中有白色沉淀生成, 过滤, 并用10.0 mL THF洗涤, 得到白色粉末状固体, 然后在甲醇中与六氟磷酸铵进行阴离子交换后得到咪唑盐3b或4b, 咪唑盐3c~3d的制备方法类似.
3.2.1 咪唑盐3a和4a的合成
在反应瓶中加入化合物1 (2.0 g, 6.0 mmol)或化合物2 (2.0 g, 5.1 mmol)和1-甲基咪唑(9.5 mL, 119.0 mmol), 于80 ℃下搅拌回流5 h, 薄层色谱(TLC)跟踪反应至无原料点.在粗产物中加入100 mL乙醚, 有白色沉淀生成.过滤, 用乙醚洗涤, 得到白色粉末状固体, 然后在甲醇中与六氟磷酸铵进行阴离子交换后得到咪唑盐3a或4a.
-
-
[1]
Arduengo, A. J.; Harlow, R. L.; Kline, M. J. Am. Chem. Soc. 1991, 113, 361. doi: 10.1021/ja00001a054
-
[2]
屈孟男, 何金梅, 有机化学, 2011, 31, 1388. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340406.shtmlQu, M. N.; He, J. M. Chin. J. Org. Chem. 2011, 31, 1388 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340406.shtml
-
[3]
唐演, 杨飞飞, 聂士鹏, 王林, 罗治斌, 陆鸿飞, 有机化学, 2015, 35, 705. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344694.shtmlTang, Y.; Yang, F. F.; Nie, S. P.; Wang, L.; Luo, Z. B.; Lu, H. F. Chin. J. Org. Chem. 2015, 35, 705 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344694.shtml
-
[4]
Zhang, D.; Zi, G. F. Chem. Soc. Rev. 2015, 44, 1898. doi: 10.1039/C4CS00441H
-
[5]
Barroso, S.; de Aguiar, S. R. M. M.; Munhá, R. F.; Martins, A. M. J. Organomet. Chem. 2014, 760, 60. doi: 10.1016/j.jorganchem.2013.11.041
-
[6]
Zhao, N.; Hou, G. H.; Deng, X. B.; Zi, G. F.; Walter, M. D. Dalton Trans. 2014, 43, 8261. doi: 10.1039/C4DT00510D
-
[7]
Hameury, S.; de Frémont, P.; Breuil, P. A. R.; Olivier-Bourbigou, H.; Braunstein, P. Inorg. Chem., 2014, 53, 5189. doi: 10.1021/ic500349t
-
[8]
Ohmiya, H.; Zhang, H.; Shibata, S.; Harada, A.; Sawamura, M. Angew. Chem. 2016, 128, 4855. doi: 10.1002/ange.201600619
-
[9]
(a)Wang, N. X. Chin. J. Org. Chem. 2011, 31, 1319 (in Chinese). (王乃兴, 有机化学, 2011, 31, 1319.) (b)Maluenda, I.; Navarro, O. Molecules 2015, 20, 7528.
-
[10]
Fortman, G. C.; Nolan, S. P. Chem. Soc. Rev. 2011, 40, 5151. doi: 10.1039/c1cs15088j
-
[11]
Levin, E.; Ivry, E.; Diesendruck, C. E.; Lemcoff, N. G. Chem. Rev. 2015, 115, 4607. doi: 10.1021/cr400640e
-
[12]
Schmid, T. E.; Jones, D. C.; Songis, O.; Diebolt, O.; Furst, M. R. L.; Slawin, A. M. Z.; Cazin, C. S. J. Dalton Trans. 2013, 42, 7345. doi: 10.1039/c2dt32858e
-
[13]
Neumann, K. T.; Laursen, S. R.; Lindhardt, A. T.; Bang-Andersen, B.; Skrydstrup, T. Org. Lett. 2014, 16, 2216. doi: 10.1021/ol5007289
-
[14]
Caddick, S.; Cloke, F. G. N.; Clentsmith, G. K. B.; Hitchcock, P. B.; McKerrecher, D.; Titcomb, L. R.; Williams, M. R. V. J. Organomet. Chem. 2001, 617, 635.
-
[15]
Burkhard, J. A.; Wagner, B.; Fischer, H.; Schuler, F.; Müller, K.; Carreira, E. M. Angew. Chem., Int. Ed. 2010, 49, 3524. doi: 10.1002/anie.200907108
-
[16]
Burkhard, J. A.; Guérot, C.; Knust, H.; Rogers-Evans, M.; Carreira, E. M. Org. Lett. 2010, 12, 1944. doi: 10.1021/ol1003302
-
[17]
Burkhard, J.; Carreira, E. M. Org. Lett. 2008, 10, 3525. doi: 10.1021/ol801293f
-
[18]
Wuitschik, G.; Rogers-Evans, M.; Buckl, A.; Bernasconi, M.; Märki, M.; Godel, T.; Fischer, H.; Wagner, B.; Parrilla, I.; Schuler, F.; Schneider, J.; Alker, A.; Schweizer, W. B.; Müller, K.; Carreira, E. M. Angew. Chem. 2008, 120, 4588. doi: 10.1002/(ISSN)1521-3757
-
[19]
Wang, J. W.; Li, Q. S.; Xu, F. B.; Song, H. B.; Zhang, Z. Z. Eur. J. Org. Chem. 2006, 1310.
-
[20]
Yu, L.; Han, Z. Mater. Lett. 2016, 184, 312. doi: 10.1016/j.matlet.2016.08.056
-
[21]
Al-Amin, M.; Akimoto, M.; Tameno, T.; Ohki, Y.; Takahashi, N.; Hoshiya, N.; Shuto, S.; Arisawa, M. Green Chem. 2013, 15, 1142. doi: 10.1039/c3gc00063j
-
[22]
Ma, H. C.; Cao, W.; Bao, Z. K.; Lei, Z. Q. Catal. Sci. Technol. 2012, 2, 2291. doi: 10.1039/c2cy20126g
-
[23]
Zhao, X. H.; Zhao, Y. Y.; Zhang, J.; Li, X. Appl. Organomet. Chem. 2015, 29, 840. doi: 10.1002/aoc.3391
-
[24]
Yadav, R. R.; Vishwakarma, R. A.; Bharate, S. B. Tetrahedron Lett. 2012, 53, 5958. doi: 10.1016/j.tetlet.2012.08.121
-
[25]
Hassine, A.; Sebti, S.; Solhy, A.; Zahouily, M.; Len, C.; Hedhili, M. N.; Fihri, A. Appl. Catal., A 2013, 450, 13. doi: 10.1016/j.apcata.2012.09.046
-
[26]
Siamaki, A. R.; Lin, Y.; Woodberry, K.; Connell, J. W.; Gupton, B. F. J. Mater. Chem. A 2013, 1, 12909.
-
[27]
Iranpoor, N.; Firouzabadi, H.; Motevalli, S.; Rajabi, K. Aust. J. Chem. 2015, 68, 926. doi: 10.1071/CH14332
-
[28]
张国平, 李品华, 有机化学, 2010, 30, 117. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338444.shtmlZhang, G. P.; Li, P. H. Chin. J. Org. Chem. 2010, 30, 117 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338444.shtml
-
[29]
Elumalai, V.; Bjørsvik, H. R. Tetrahedron Lett. 2016, 57, 1224. doi: 10.1016/j.tetlet.2016.02.007
-
[30]
Wang, X.; Wang, Z. H.; Wu, Y.; Luo, Y. L.; Zhang, G. F.; Jian, Y. J.; Sun, H. M.; Zhang, W. Q.; Gao, Z. W. Appl. Organomet. Chem. 2016, 30, 831. doi: 10.1002/aoc.v30.10
-
[31]
Sagadevan, A.; Hwang, K. C. Adv. Synth. Catal. 2012, 354, 3421. doi: 10.1002/adsc.v354.18
-
[1]
-
表 1 3d的氢键键长( )及键角(°)a
Table 1. Hydrogen bond distances ( ) and angles (°) for 3d
D—H…A D—H H…A D…A ∠D—H…A O(3)—H(3)…F(4)ⅱ 0.82 2.49 3.091(9) 124 C(6)—H(6)…O(2) 0.93 2.59 2.935(5) 103 C(10)—H(10A)…F(2)ⅲ 0.97 2.53 3.431(7) 155 C(12)—H(12B)…O(1)ⅰ 0.97 2.56 3.429(5) 150 C(13)—H(13)…F(6)ⅳ 0.93 2.39 3.269(6) 158 C(15)—H(15)…F(1)ⅱ 0.93 2.31 3.236(7) 173 aSymmetry codes:(ⅰ) -x, 2-y, 2-z; (ⅱ) 1-x, 1-y, 1-z; (ⅲ) x, y, 1+z; (ⅳ) 1-x, 2-y, 1-z. 表 2 不同的溶剂和碱对溴苯与苯硼酸偶联反应的影响a
Table 2. Effect of different solvents and bases on the cross-coupling of bromobenzene and phenylboronic acid

Entry Solvent (V:V) Base Time/h Yieldb/% 1 DMSO KOH 1 43 2 Dioxane KOH 1 10 3 i-PrOH KOH 1 50 4 TBA KOH 1 89 5 H2O KOH 1 42 6 i-PrOH/H2O (1:1) KOH 1 85 7 TBA/H2O (1:1) KOH 0.5 99 8 TBA/H2O (1:1) KOBu-t 0.5 89 9 TBA/H2O (1:1) K2CO3 0.5 85 10 TBA/H2O (1:1) NaHCO3 0.5 70 aReaction conditions: PhB(OH)2 (0.6 mmol), bromobenzene (0.5 mmol), base (1.0 mmol), 3b (1.0 mol%), PdCl2(CH3CN)2 (1.0 mol%)and solvent (2.0 mL) at 25 ℃; bIsolated yields determined by chromatographic purification, and the products were characterized by 1H NMR and 13C NMR. 表 3 不同的溴代芳烃和芳基硼酸对Suzuki-Miyaura偶联反应的影响a
Table 3. Suzuki-Miyaura reaction of various arylhalides with different arylboronic acids

Entry R1 R2 X Yieldb/% 1 H H Br 99 2 H OC2H5 Br 94 3 H Cl Br 87 4 OCH3 H Br 92 5 OCH3 OC2H5 Br 90 6 OCH3 Cl Br 82 7 CH3 H Br 95 8 CH3 OC2H5 Br 91 9 CH3 Cl Br 85 10 NO2 H Br 99 11 NO2 OC2H5 Br 99 12 NO2 Cl Br 99 13 CN H Br 99 14 CN OC2H5 Br 99 15 CN Cl Br 99 16 H H Cl 15 a Reaction conditions: arylboronic acids (0.6 mmol), arylhalides (0.5 mmol), KOH (1.0 mmol), 3b (1.0 mol%), PdCl2(CH3CN)2 (1.0 mol%) and TBA/ H2O (V:V=1:1) (2.0 mL) at 25 ℃ for 0.5 h; b Isolated yields determined by chromatographic purification, and all products were characterized by 1H NMR and 13C NMR. 表 4 不同的咪唑盐对溴苯和苯硼酸的Suzuki-Miyaura偶联反应的影响a
Table 4. Suzuki-Miyaura reaction of bromobenzene and phenylboronic acid with different imidazolium salts

Entry Imidazolium salt Yieldb/% 1 3a 85 2 3b 99 3 3c 89 4 3d 85 5 4a 30 6 4b 41 a Reaction conditions: PhB(OH)2 (0.6 mmol), bromobenzene (0.5 mmol), KOH (1.0 mmol), imidazolium salts (1.0 mol%), PdCl2(CH3CN)2 (1.0 mol%) and TBA/H2O (V:V=1:1) (2.0 mL) at 25 ℃ for 0.5 h; b Isolated yields determined by chromatographic purification, and all products were characterised by 1H NMR and 13C NMR. 表 5 不同的溶剂, 碱和催化剂用量对Sonogashira偶联反应的影响a
Table 5. The effect of different solvents, bases and amounts of catalysts on the Sonogashira coupling reaction

Entry Base Solvent [Cu]/mmol% [Pd]/mmol% Temp./℃ Time/h Yieldb/% 1 KOH DMF 5 1 120 24 83 2 KOH DMSO 5 1 120 24 38 3 K2CO3 DMF 5 1 120 24 18 4 K2CO3 DMSO 5 1 120 24 5 5 Et3N DMF 5 1 80 24 66 6 Et3N DMSO 5 1 80 5 99 7 Et3N NMP 5 1 80 16 92 8 Et3N 1, 4-Dioxane 5 1 80 16 66 9 Et3N EtOH 5 1 80 16 38 10 Et3N DMSO 0 1 80 24 44 11 Et3N DMSO 5 1 80 5 99 12 Et3N DMSO 1 1 80 5 98 13 Et3N DMSO 1 0.1 80 5 98 14 Et3N DMSO 0.1 0.1 80 5 59 15 Et3N DMSO 0.1 0.01 80 5 38 16 Et3N DMSO 5 0 80 48 68 a Reaction conditions: phenylacetylene (0.6 mmol), iodobenzene (0.5 mmol), base (1.2 mmol), 3b, PdCl2(CH3CN)2, CuI and solvent (0.7 mL); b Isolated yields determined by chromatographic purification, and the products were characterised by 1H NMR and 13C NMR. 表 6 不同咪唑盐和碘代烃对Sonogashira偶联反应的影响a
Table 6. Sonogashira reactions of various iodobenzenes with different imidazolium salts

Entry R Imidazolium salt Yieldb/% 1 H 3a 77 2 H 3b 99 3 H 3c 98 4 H 3d 92 5 H 4a 61 6 H 4b 77 7 4-NO2 3b 99 8 4-OCH3 3b 95 9 2-NH2 3b 86 10 3-NH2 3b 71 11 4-NH2 3b 89 a Reaction conditions: phenylacetylene (0.6 mmol), iodobenzene (0.5 mmol), triethylamine (1.2 mmol), imidazolium salts (0.1 mmol%), PdCl2(CH3CN)2 (0.1 mmol%), CuI (1.0 mmol%) and DMSO (0.7 mL) at 80 ℃ for 5 h; b Isolated yields determined by chromatographic purification, and the products were characterized by 1H NMR, 13C NMR. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 1527
- HTML全文浏览量: 252


 下载:
下载:



 下载:
下载:

