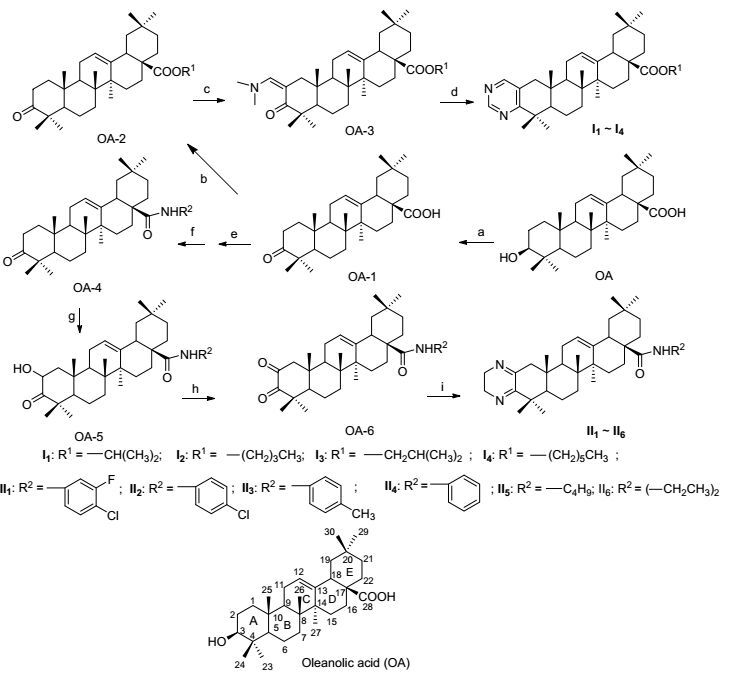
 图式 1
齐墩果酸类似物的合成
Scheme1.
Synthesis of derivatives of oleanolic acid
图式 1
齐墩果酸类似物的合成
Scheme1.
Synthesis of derivatives of oleanolic acid

Citation: Meng Yanqiu, Xing Wen, Kuai Zhenyu, Zhang Weichen, Li Wei. Synthesis and Anti-Tumor Activities of Ring A Derived Analogues of Oleanolic Acid[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1417-1425. doi: 10.6023/cjoc201610033

齐墩果酸A环衍生的类似物的合成及抗肿瘤活性研究
English
Synthesis and Anti-Tumor Activities of Ring A Derived Analogues of Oleanolic Acid
-
Key words:
- oleanolic acid analogues
- / synthesis
- / anti-tumor activity
- / molecular docking
-
齐墩果酸(Oleanolic acid, OA)属于五环三萜类化合物[1], 是从女贞子和青叶胆等植物中分离得到的有效成份[2]. OA具有多种生物活性[3], 包括抗肿瘤活性[4, 5].我们课题组自2000年以来, 开展了五环三萜类似物的抗肿瘤活性研究, 主要集中在乳香酸、熊果酸、积雪草酸广泛的结构修饰及体外抗肿瘤活性评价[6~9].近年来, 借助计算机辅助设计, 指导熊果酸、积雪草酸的结构改造取得一定的进展[10].
C-kit受体蛋白是Ⅲ型蛋白酪氨酸激酶家族中的一员, 又称干细胞因子受体(SCFR), 是由C-kit原癌基因编码的Ⅰ型跨膜糖蛋白受体, 其配体为干细胞因子[11] (SCF). C-kit受体在许多恶性肿瘤细胞表面包括前列腺癌、乳腺癌、小细胞肺癌等都存在着高表达的特点[12], 因此, C-kit的异常表达与肿瘤的发生密切相关. C-kit作为目前肿瘤靶向分子的热门靶标, 通过抑制C-kit与特定的生长因子特异性结合发挥作用, 从而介导细胞信息传递途径去寻找新型抗肿瘤药物[13].
2001年首个获得美国食品药品监督管理局批准上市的络氨酸激酶抑制剂Imatinib[14] (1), 具有嘧啶和酰胺类结构, 高效作用于C-kit等靶点, 通过与ATP竞争结合于BCR-ABL融合蛋白, 使之失去ATP提供的磷酸来源, 从而达到切断传导信号的目的. AKN-028[15] (2)是针对C-kit、FLK等靶点的络氨酸激酶抑制剂, 现已进入Ⅰ/Ⅱ期临床实验, 通过下调c-Myc癌基因的表达, 将细胞周期阻滞于G0/G1期. Amuvatinib[16] (MP-470, 3)是多靶点络氨酸激酶抑制剂, 通过结合干细胞因子受体, 增加DNA损伤诱导剂的活性, 对小细胞肺癌有特异的治疗作用, 并已进入Ⅱ期临床实验.
本文结合PDB数据库中C-kit受体的三维晶体结构(PDB:1T46), 经计算机模拟对接分析络氨酸激酶抑制剂与靶酶的相互作用, 解析蛋白质发挥活性作用的关键氨基酸残基片段, 并确定能够和关键位点结合的活性基团片段, 并将其创新性地引入齐墩果酸中, 在其A环上引入了含氮杂环, 同时C(28) 位羧基成酰胺或酯, 设计合成了10个新型齐墩果酸类似物, 并对新设计的结构进行分子对接预测结合方式和结合自由能, 对预测结果好的化合物第Ⅰ类和第Ⅱ类进行合成.并进行了体外抗肿瘤活性测试.
1 结果与讨论
1.1 化学合成
以OA为原料, 设计并合成了两类共10个化合物.首先采用Jones试剂将齐墩果酸3位羟基氧化成酮, 在此基础上, 进一步合成齐墩果酸A环骈合嘧啶环和氢化吡嗪环, 同时将C(28) 位羧基成酯或酰胺.通过A环引入嘧啶环, 形成2, 3-并嘧啶环-齐墩果烷型-12-烯-28-羧酸酯类化合物Ⅰ1~Ⅰ4; 以及A环引入氢化吡嗪环, 形成2, 3-并氢化吡嗪环-齐墩果烷型-12-烯-28-羧酸酰胺类化合物Ⅱ1~Ⅱ6.目标化合物路线见Scheme 1.
1.2 生物活性评价
OA能够促进肺癌A549细胞[17]、人口腔表皮样癌KB细胞[18]的凋亡来抑制它们的生长.以5-氟尿嘧啶(5-FU)和阿霉素(Adriamycin)为阳性对照物, 采用四甲基偶氮唑盐法(MTT比色法)测试目标化合物体外抗肿瘤活性, 活性数据见表 1.
 表 1
目标化合物对KB和A549细胞的活性抑制
Table 1.
Inhibitory activity of the target compounds on the KB and A549 cells
表 1
目标化合物对KB和A549细胞的活性抑制
Table 1.
Inhibitory activity of the target compounds on the KB and A549 cells

实验结果说明, 所测试的目标化合物对KB和A549细胞的生长均具有一定的抑制作用, 且优于母体OA.其中化合物Ⅰ4和Ⅱ3对两种肿瘤细胞表现出明显的抑制作用, 在10 μmol/L浓度下对KB细胞的抑制率分别为56%和65%, 其IC50值分别为10.27和9.79 μmol/L; 在10 μmol/L浓度下对A549细胞的抑制率分别为59%和64%, 其IC50值分别为2.67和1.03 μmol/L, 尤其是对A549细胞的IC50值分别是阳性对照物5-氟尿嘧啶的2.8和7.2倍, 是阿霉素的3.3和8.5倍.由此可见, 化合物Ⅰ4和Ⅱ3值得进一步研究.
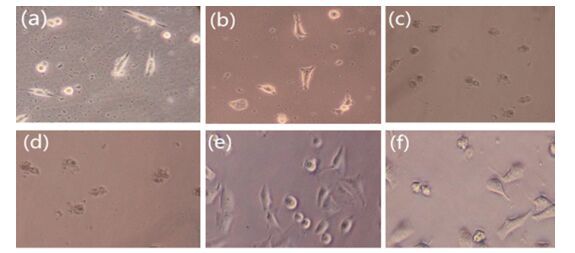
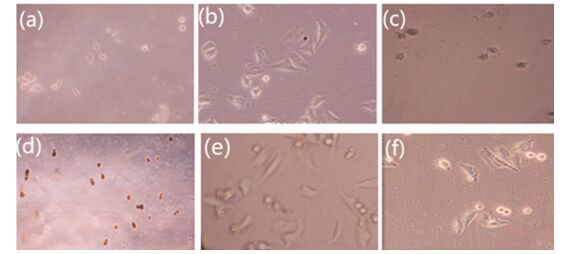
化合物Ⅰ4和Ⅱ3经处理72 h后, KB和A549细胞形态发生变化(图 1和图 2).
根据肿瘤细胞形态变化图可知, 持续用药蓄积72 h后, 由菱形片状分布的A549细胞逐步呈现出碎块状、空泡, 明显表现出现细胞凋亡的形态特征, 相反空白对照组的A549细胞仍具有完整细胞膜, 细胞株呈连片堆积的恶性增值状态.通过对比观察可以得出, 化合物Ⅰ4、Ⅱ3对其肿瘤细胞有显著的抑制作用.
1.3 分子对接
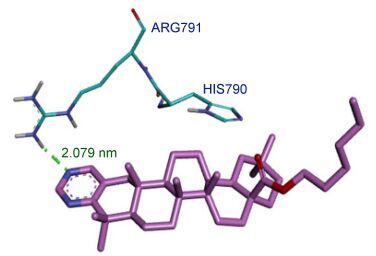
为了确定合适的成键方向和药物分子与受体相互作用构象, 本文将代表化合物用molegro virtual docker软件与之对接, 根据对接函数打分(MloDock Score, Escore=Einter+Eintra, Einter表示配体-蛋白质相互作用能量, Eintra表示配体内部能量), 结果显示Ⅰ4: -86.189 kcal/mol, Ⅱ3: -117.548 kcal/mol, 5-FU: -58.970 kcal/mol. (绝对值越大表示连接的亲和力越大), 并用Discovery Studio2.0直观分析化合物与靶点的结合情况.
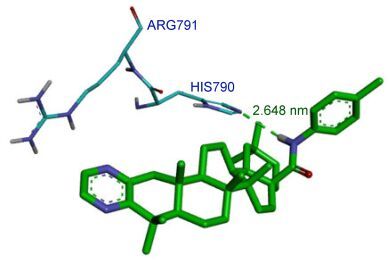
我们从蛋白质晶体数据库找到C-kit受体与ST157复合物蛋白(PDB:1T46), 发现所设计的齐墩果酸衍生物嵌入了靶点的活性口袋当中, 与周围的一些重要氨基酸紧密相连.从图 3和图 4中可以观察到Ⅰ4、Ⅱ3与氨基酸形成氢键, 使化合物分子在活性疏水口袋里结合得更加牢固.
2 结论
为了寻求抗肿瘤活性好的新候选化合物, 以齐墩果酸(OA)为先导化合物, 在其A环上引入含氮杂环, 同时将C-28位羧基成酯或酰胺, 最终设计合成的10个新型的齐墩果酸类似物, 其结构经1H NMR、13C NMR、MS所确证.对人口腔表皮样癌细胞(KB)和人肺癌细胞(A549) 均表现出较好的增殖抑制活性.尤其是化合物Ⅰ4和Ⅱ3对A549细胞的IC50值分别是阳性对照物5-氟尿嘧啶的2.8和7.2倍, 是阿霉素的3.3和8.5倍.在化合物Ⅰ1~Ⅰ4和Ⅱ1~Ⅱ6系列中, 对A549细胞的IC50值Ⅰ4>Ⅰ2>Ⅰ3>Ⅰ1和Ⅱ3>Ⅱ1>Ⅱ2>Ⅱ4>Ⅱ5>Ⅱ6说明支链上碳的减少和吸电子基团不利于抗肿瘤活性; Ⅱ1、Ⅱ2>Ⅰ2、Ⅰ3, 说明齐墩果酸A环引入氢化吡嗪环比嘧啶环抗肿瘤活性更好.这对齐墩果酸类似物的进一步结构设计、优化和药理活性研究具有一定的指导意义, 为今后研究和开发高效、低毒的抗肿瘤药物打下良好的基础.
3 实验部分
3.1 仪器与试剂
Büchi B-540熔点测定仪; BrukerARX-300型核磁共振分析仪, CDCl3为溶剂, TMS为内标; 热电-菲尼根LCQ型质谱仪; SPECTRA MAX plus型酶标仪; XDS-1B倒置显微镜; TGL-16B低速台式离心机.齐墩果酸(质量分数>98%)购于陕西森弗生物技术有限公司; 柱色谱用200~300目硅胶、薄层色谱硅胶GF254, 购于深圳市宇恒硅橡胶制品有限公司; 显色剂为质量分数10%硫酸乙醇溶液; 活性测试所用的RPMI-1640培养基(含质量分数10%胎牛血清, 100 U/mL青霉素, 100 μg/mL链霉素); 四甲基偶氮唑盐法(MTT)、胰蛋白酶(Trypsin)和标准胎牛血清(FBS), 购于上海图赫实业有限公司; Molegro virtual docker分子对接软件、活性测试所用KB细胞和A549细胞均由沈阳药科大学药理教研室提供.所有试剂均为分析纯或化学纯.阳性对照物5-氟尿嘧啶, 购于阿斯利康制药有限公司.所有试剂均为分析纯或化学纯.
3.2 目标化合物合成
3.3 活性测试
以5-氟尿嘧啶、阿霉素为阳性对照药, 采用MTT法对合成的齐墩果酸类化合物进行体外抗肿瘤活性测试, 所选用的肿瘤细胞为人胃癌细胞(KB)和人非小细胞肺癌细胞(A549).
用MTT比色法测定化合物的细胞毒活性, 以二甲基亚砜(1%DMSO)和培养基作为溶剂, 所有药品起始浓度为1000 μg/mL, 依次稀释成500, 50, 5, 0.5, 0.05 μg/mL, 对数生长期肿瘤细胞培养于96孔培养板内, 每100 μL (大约含4000个细胞), 置37 ℃、CO2全湿条件培养, 培养24 h后, 给药组加入含有不同浓度浓度的测试物, 至少3个平行孔, 阴性对照组加入与给药组等体积的溶剂, 并设只加RPMI-1640培养基的空白对照组, 置37 ℃, CO2温箱中培养, 72 h后弃培养液, 每孔加入50 μL MTT溶液, 37 ℃孵育4 h, 弃上清液, 每孔加入150 μL DMSO溶解甲臜颗粒, 轻度振荡溶解.在酶标仪波长490 nm条件下测定光密度值(OD), 计算所测化合物对细胞的抑制率和IC50值.实验重复3次, 结果取平均值.
抑制率(%)=[1-(A实验组-A空白组)/(A对照组-A空白组]×100%
辅助材料(Supporting Information) 中间体和目标产物的核磁共振氢谱和碳谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.11 5', 6'-二氢-齐墩果-2-烯并[2, 3-b]吡嗪-12-烯-28-酰-3''-氟-4''-氯苯胺(Ⅱ1)的制备
取上一步无需纯化的中间体OA-6 (0.168 g, 0.3 mmol)溶于10 mL无水乙醇中, 回流至加热.待中间体完全溶解后, 加入无水硫酸镁0.150 g, 再将过饱和的乙二胺-乙醇溶液(2滴乙二胺, 0.6 mmol)缓慢滴加于OA-4溶液中, TLC检测反应终点[展开剂: V(石油醚)/V(乙酸乙酯)=5/1], 5 h反应结束.过滤, 减压蒸出溶剂, 得黄白色固体.粗品用硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=15/1], 得0.096 g白色粉末状固体Ⅱ1, 产率35.78%. m.p. 163.1~165.2 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.99 (s, 1H, NH), 7.34 (t, J=9.1 Hz, 1H), 7.32 (s, 1H), 7.26 (s, 1H), 5.28 (s, 1H), 2.36 (t, J=7.5 Hz, 1H), 1.56~1.51, 1.49~1.42 (m, 4H, NCH2CH2N), 1.57~1.40 (m, 6H), 1.47 (t, J=7.0 Hz, 1H), 1.39~1.37, 1.36~1.34 (m, 4H, NCH2CH2N), 1.35~1.33 (m, 4H), 1.31~1.24 (m, 4H), 1.23 (s, 3H), 1.18 (s, 3H), 1.14 (s, 3H), 1.12 (s, 3H), 1.02 (s, 3H), 0.96 (s, 3H), 0.95 (s, 3H); 13C NMR (150 MHz, CDCl3)δ: 180.4, 165.9, 165.5, 163.2, 150.6, 141.3, 131.9, 123.4, 118.8, 117.2, 109.2, 51.9, 51.2, 50.2, 48.6, 45.3, 43.7, 40.1, 36.8, 35.7, 34.5, 34.3, 31.2, 30.5, 30.1, 29.8, 28.4, 28.1, 25.3, 24.6, 24.5, 24.2, 22.2, 20.1, 20.1, 18.9, 18.3, 18.1; ESI-MS m/z: 619.3 [M+H]+. Anal. calcd for C38H51ClFN3O: C 73.58, H 8.29, N 6.77; found C 73.50, H 8.18, N 6.65.
3.2.14 5', 6'-二氢-齐墩果-2-烯并[2, 3-b]吡嗪-12-烯-28-酰苯胺(Ⅱ4)的制备
按照Ⅱ1的制备方法, 由中间体OA-1 (0.22 mmol)与苯胺(0.44 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.082 g白色晶体Ⅱ4, 产率40.31%. m.p. 128~130 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.02 (s, 1H, NH), 7.62 (t, J=9.1 Hz, 1H), 7.59 (t, J=9.3 Hz, 1H), 7.27 (s, 1H), 7.23 (s, 1H), 7.05 (t, J=9.3 Hz, 1H), 5.27 (s, 1H), 2.37 (t, J=7.7 Hz, 1H), 1.88~1.46 (m, 4H), 1.45 (t, J=7.2 Hz, 1H, H-9), 1.44~1.42, 1.41~1.39 (m, 4H, NCH2CH2N), 1.38~1.36, 1.35~1.33 (m, 4H, NCH2CH2N), 1.32~1.29 (m, 6H), 1.28~1.23 (m, 4H), 1.21 (s, 3H), 1.16 (s, 3H), 1.15 (s, 3H), 1.07 (s, 3H), 1.05 (s, 3H), 0.97 (s, 3H), 0.95 (s, 3H); 13C NMR (150 MHz, CDCl3)δ: 180.5, 164.6, 164.7, 150.3, 139.9, 129.3, 129.3, 124.2, 123.7, 120.6, 120.6, 51.7, 51.5, 50.4, 48.5, 45.3, 45.1, 40.3, 37.5, 36.4, 35.6, 34.5, 31.4, 30.6, 30.2, 29.4, 27.5, 27, 5, 25.4, 24.8, 24.3, 22.2, 20.3, 20.3, 19.5, 18.5, 18.4, 17.2; ESI-MS m/z: 567.4 [M+H]+. Anal. calcd for C38H53N3O: C 80.37, H 9.41, N 7.40; found C 81.21, H 9.33, N 7.39.
3.2.6 齐墩果-2, 12-二烯并[3, 2-d]嘧啶-28-羧酸异丁酯(Ⅰ3)的制备
按照Ⅰ1的制备方法, 由中间体OA-1 (0.22mmol)与溴代异丁烷(0.88 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.087 g白色晶体Ⅰ3, 产率42.76%. m.p. 221.1~224.2 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.85 (s, 1H, C4N2Ha), 8.33 (s, 1H, C4N2Hb), 5.34 (s, 1H), 4.12~4.08 (m, 2H, COOCH-(CH3)2), 2.68 (t, J=7.1 Hz, 1H), 2.46 (d, J=11.4 Hz, 1H), 2.39~1.47 (m, 6H), 1.45 (t, J=7.0 Hz, 1H), 1.41 (s, 3H), 1.37~1.35 (m, 4H), 1.34~1.32 (m, 4H), 1.31 (s, 3H), 1.30 (s, 3H), 1.22 (s, 3H), 1.19 (s, 3H), 1.15 (s, 3H), 1.08 (s, 3H), 1.05 (s, 3H), 1.03 (d, J=8.5 Hz, 6H, COOCH-(CH3)2); 13C NMR (150 MHz, CDCl3) δ: 176.4, 171.6, 158.3, 156.4, 150.2, 123.8, 77.2, 58.1, 45.9, 44.3, 40.1, 39.2, 38.4, 37.2, 35.9, 34.2, 33.1, 32.0, 31.8, 31.6, 30.5, 30.3, 30.1, 29.2, 28.3, 28.1, 27.6, 26.5, 26.4, 25.2, 24.3, 19.6, 19.1, 17.4, 17.2, 16.5; ESI-MS m/z: 546.4 [M+H]-. Anal. calcd for C36H54N2O2: C 79.07, H 9.95, N 5.12; found C 79.12, H 9.79, N 5.03.
3.2.12 5'6'-二氢-齐墩果-2-烯并[2, 3-b]吡嗪-12-烯-28-酰-4''-氯苯胺(Ⅱ2)的制备
按照Ⅱ1的制备方法, 由中间体OA-1 (0.22 mmol)与4-氯代苯胺(0.44 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.089 g白色晶体Ⅱ2, 产率30.64%. m.p. 135~143 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.03 (s, 1H, NH), 7.61 (s, 1H), 7.58 (s, 1H), 7.28 (s, 1H), 7.26 (s, 1H), 5.27 (s, 1H), 2.34 (t, J=7.1 Hz, 1H), 1.91~1.42 (m, 6H), 1.41 (t, J=7.0 Hz, 1H), 1.40~1.38, 1.37~1.35 (m, 4H, NCH2CH2N), 1.36~1.35, 1.34~1.33 (m, 4H, NCH2CH2N), 1.32~1.31 (m, 4H), 1.29~1.23 (m, 4H), 1.22 (s, 3H), 1.16 (s, 3H), 1.14 (s, 3H), 1.05 (s, 3H), 1.02 (s, 3H), 0.97 (s, 3H), 0.95 (s, 3H); 13C NMR (150 MHz, CDCl3)δ: 180.2, 164.8, 164.7, 150.2, 139.1, 130.4, 130.2, 130.1, 123.5, 122.2, 122.1, 51.9, 51.2, 50.2, 48.9, 45.8, 45.3, 40.1, 37.8, 36.9, 35.2, 34.7, 31.5, 30.2, 30.1, 29.5, 27.8, 27, 8, 25.1, 24.9, 24.6, 22.4, 20.1, 20.1, 19.8, 18.6, 18.2, 17.6; ESI-MS m/z: 601.3 [M+H]+. Anal. calcd for C38H52ClN3O: C 75.78, H 8.70, N 6.98; found C 75.61, H 8.51, N 7.00.
3.2.2 3-羰基-齐墩果-12-烯-28-羧酸异丙酯(OA-2)的制备
在50 mL的茄形瓶中加入中间体OA-1 (0.100 g, 0.22 mmol)、无水碳酸钾(0.060 g, 0.44 mmol)、N, N-二甲基甲酰胺(DMF) 4 mL, 缓慢滴加溴代异丙烷0.06 mL (0.88 mmol), 室温反应5 h, TLC检测反应终点[展开剂: V(石油醚)/V(乙酸乙酯)=5/1].减压蒸出剩余的卤代烷后, 加入饱和食盐水、乙酸乙酯, 萃取3次, 合并有机相.用无水硫酸镁干燥过夜, 过滤, 减压蒸馏浓缩得0.110 g白色片状固体OA-2, 产率91.80%. m.p. 200.4~206.1 ℃.
3.2.7 齐墩果-2, 12-二烯并[3, 2-d]嘧啶-28-羧酸正己酯(Ⅰ4)的制备
按照Ⅰ1的制备方法, 由中间体OA-1 (0.22 mmol)与溴正己烷(0.88 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=8/1], 得0.067g白色晶体Ⅰ4, 产率46.70%. m.p. 229.1~233.2℃; 1H NMR (CDCl3, 500 MHz) δ: 8.80 (s, 1H, C4N2Ha), 8.32 (s, 1H, C4N2Hb), 5.31 (s, 1H), 4.08~4.01 (m, 2H, COOCH2-(CH2)4CH3), 2.75 (t, J=7.5 Hz, 1H), 2.52 (d, J=12.6 Hz, 1H), 1.61 (s, 2H, OCH2(CH2)4CH3), 1.43 (s, 3H), 1.38 (s, 3H), 1.35~1.29 (m, 8H, OCH2(CH2)4CH3), 1.28 (s, 3H), 1.18 (s, 3H), 1.15 (s, 3H), 1.07 (s, 3H), 1.04 (s, 3H), 1.02 (t, J=6.5 Hz, 3H, O(CH2)4CH3); 13CNMR (150 MHz, CDCl3) δ: 176.3, 171.4, 158.6, 157.9, 150.2, 136.5, 123.4, 68.3, 58.4, 49.6, 45.9, 44.2, 39.2, 38.5, 37.1, 36.5, 34.8, 32.5, 32.1, 31.6, 30.5, 30.1, 29.6, 29.1, 28.5, 28.2, 27.9, 27.8, 27.5, 26.4, 25.9, 24.3, 24.1, 23.9, 21.2, 19.3, 19.1, 18.6, 18.4, 18.1, 15.3; ESI-MS m/z: 574.4 [M+H]+. Anal. calcd for C38H58N2O2: C 79.39, H 10.17, N 4.87; found C 80.01, H 10.00, N 4.71.
3.2.3 2-[二甲胺基亚甲基]-3-羰基-齐墩果-12-烯-28-羧酸异丙酯(OA-3)的制备
取OA-2 (0.141 g, 0.3 mmol)溶于10 mL甲苯溶液中, 加热至110℃.待完全溶解后, 逐滴加入DMF-DMA (1.5 mmol, 0.2 mL), TLC检测反应终点[展开剂: V(石油醚)/V(乙酸乙酯)=8/1], 12 h反应结束.冷却至室温, 减压蒸出溶剂, 得淡黄色油状液体, 无需纯化直接进行下一步反应.
3.2.10 2, 3-二羰基-齐墩果-12-烯-28-酰-3'-氟-4'-氯苯胺(OA-6)的制备
取上一步无需纯化的中间体OA-5, 按照OA-1的合成方法制备, 最终得0.121 g浅黄色固体, 产率87.05%.直接用于下一步反应.
3.2.8 3-羰基-齐墩果-12-烯-28-酰-3'-氟-4'-氯苯胺(OA-4)的制备
取中间体OA-1 (0.100 g, 0.22 mmol), 加入5 mL干燥的二氯甲烷(DCM), 室温下搅拌, 待中间体完全溶解后, 加入草酰氯(0.24 mmol), 室温搅拌20 h, 生成3-氧代-12-烯-齐墩果烷-28-酰氯, 旋蒸除去反应溶剂和未反应的草酰氯, 残余物加入2 mL环己烷, 随后减压蒸除环己烷, 反复操作2次.酰氯中加入3 mL DCM, 加三乙胺调pH为9~10, 搅拌5 min后, 加入3-氟-4-氯-苯胺(0.44 mmol), 室温下反应6 h, 以TLC检测反应终点.反应结束后, 向反应液中加入3 mL食盐水, 以2 mol/L盐酸调pH至3~4, 静止分层, 分离有机相, 向水中再加入10 mL DCM, 萃取三次, 合并有机相, 加入无水硫酸钠干燥.减压蒸馏, 得白色固体.粗品经硅胶柱色谱分离纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=8/1], 得0.123 g白色晶体OA-4, 产率96.3%. m.p. 122.4~124.7 ℃.
3.2.5 齐墩果-2, 12-二烯并[3, 2-d]嘧啶-28-羧酸正丁酯(Ⅰ2)的制备
按照Ⅰ1的制备方法, 由中间体OA-1 (0.22 mmol)与溴正丁烷(0.88 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.081 g白色晶体Ⅰ2, 产率42.52%. m.p. 220.3~223.6 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.83 (s, 1H, C4N2Ha), 8.39 (s, 1H, C4N2Hb), 5.35 (s, 1H), 4.11~4.08 (m, 2H, COOCH2-(CH2)2CH3), 2.69 (t, J=7.5 Hz, 1H), 2.58 (d, J=15.1 Hz, 1H), 1.63~1.34 (m, 4H, OCH2(CH2)2CH3), 1.43 (s, 3H), 1.39 (s, 3H), 1.28 (s, 3H), 1.14 (s, 3H), 1.12 (s, 3H), 0.98 (s, 3H), 0.97 (s, 3H), 0.95 (t, J=6.5 Hz, 3H, O(CH2)3CH3); 13CNMR (150 MHz, CDCl3) δ: 176.4, 171.2, 158.6, 157.3, 151.3, 136.4, 123.8, 68.2, 58.5, 49.3, 46.5, 45.9, 40.1, 39.2, 37.9, 35.8, 32.8, 32.9, 32.5, 30.2, 30.1, 29.8, 28.6, 28.1, 26.2, 24.6, 24.3, 23.6, 20.5, 19.1, 17.9, 17.2, 14.1; ESI-MS m/z: 546.4 [M-H]-. Anal. calcd for C36H54N2O2: C 79.07, H 9.95, N 5.12; found C 78.79, H 9.65, N 5.11.
3.2.13 5', 6'-二氢-齐墩果-2-烯并[2, 3-b]吡嗪-12-烯-28-酰-4''-甲基苯胺(Ⅱ3)的制备
按照Ⅱ1的制备方法, 由中间体OA-1 (0.22 mmol)与4-甲基苯胺(0.44 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.058 g白色晶体Ⅱ3, 产率29.74%. m.p. 88~92 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.98 (s, 1H, NH), 7.51 (t, J=9.3 Hz, 1H), 7.49 (t, J=9.1 Hz, 1H), 7.08 (s, 1H), 7.05 (s, 1H), 5.25 (s, 1H), 2.36 (t, J=7.5 Hz, 1H), 2.39 (s, 3H, Ar-CH3), 1.91~1.47 (m, 4H), 1.46 (t, J=7.2 Hz, 1H), 1.45~1.43, 1.42~1.40 (m, 4H, NCH2CH2N), 1.39~1.37, 1.36~1.35 (m, 4H, NCH2CH2N), 1.34~1.31 (m, 6H), 1.29~1.24 (m, 4H), 1.23 (s, 3H), 1.20 (s, 3H), 1.18 (s, 3H), 1.16 (s, 3H), 1.14 (s, 3H), 1.03 (s, 3H), 0.96 (s, 3H); 13C NMR (150 MHz, CDCl3)δ: 180.3, 164.5, 164.7, 150.4, 138.2, 134.1, 130.3, 130.3, 123.3, 120.5, 120.4, 51.6, 51.4, 50.5, 48.3, 45.7, 45.2, 40.5, 37.6, 36.8, 35.4, 34.5, 31.7, 30.4, 30.3, 29.5, 27.6, 27, 625.4, 24.6, 24.5, 22.3, 20.5, 20.2, 20.2, 19.7, 18.5, 18.3, 17.4; ESI-MS m/z: 581.4 [M+H]+. Anal. calcd for C39H55N3O: C 80.50, H 9.53, N 7.22; found C 81.75, H 9.39, N 7.26.
3.2.1 3-羰基-齐墩果-12-烯-28-酸(OA-1)的制备
取OA (0.100 g, 0.22 mmol)溶于10 mL丙酮, 冰浴下缓慢滴加新配置的Jones试剂3滴(0.08 mL), 10 min后将温度升为室温反应1 h, 薄层色谱(TLC)监测反应终点[展开剂: V(石油醚)/V(乙酸乙酯)=3/1], 显色剂为10%硫酸乙醇溶液.待反应完毕, 加入异丙醇3 mL, 室温搅拌30 min, 淬灭其氧化性.加入饱和食盐水、乙酸乙酯, 萃取3次, 合并有机相.用无水硫酸镁干燥过夜, 过滤, 减压蒸馏浓缩得粗品, 粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=6/1], 得0.095 g白色粉末状固体OA-1, 产率95.42%. m.p. 220.3~222.1 ℃.
3.2.9 2-羟基-3-羰基-齐墩果-12-烯-28-酰-3'-氟-4'-氯苯胺(OA-5)的制备
取中间体OA-4 (0.164 g, 0.3 mmol)溶于5 mL DCM中, 加入10 mL 1.5%的硫酸-甲醇溶液, 再加入间氯过氧苯甲酸(m-CPBA) (0.06 g, 0.3 mmol), 冰浴下反应, TLC检测反应终点[展开剂: V(石油醚)/V(乙酸乙酯)=5/1], 24 h反应结束.将反应液中加入大量Na2SO3饱和溶液淬灭0.5 h, 再加入DCM稀释, 分离有机相, 分别用饱和K2CO3溶液、水和饱和食盐水萃取有机相3次, 有机相用无水硫酸镁干燥.过滤, 减压蒸馏浓缩得0.139 g黄色油状液体OA-5, 产率82.25%.直接用于下一步反应.
3.2.16 5', 6'-二氢-齐墩果-2-烯并[2, 3-b]吡嗪-12-烯-28-酰二乙胺(Ⅱ6)的制备
按照Ⅱ1的制备方法, 由中间体OA-1 (0.22 mmol)与二乙胺(0.44 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.053 g白色晶体Ⅱ6, 产率29.21%. m.p. 157~158 ℃; 1H NMR (CDCl3, 500 MHz) δ: 5.32 (s, 1H), 3.21 (brs, 1H, N-CH2), 3.20 (brs, 1H, N-CH2), 2.29 (t, J=6.3 Hz, 1H), 1.88~1.45 (m, 4H), 1.52~1.50, 1.48~1.46 (m, 4H, NCH2CH2N), 1.44 (t, J=7.1 Hz, 1H, H-9), 1.43~1.41, 1.38~1.36 (m, 4H, NCH2CH2N), 1.34~1.29 (m, 6H), 1.27~1.25 (m, 4H), 1.23 (d, 4H, CH2CH3), 1.22 (s, 3H), 1.18 (s, 3H), 1.14 (s, 3H), 1.12 (s, 3H), 1.06 (s, 3H), 1.03 (s, 3H), 0.98 (s, 3H); 13C NMR (150 MHz, CDCl3) δ: 181.2, 165.3, 165.3, 150.2, 122.6, 51.6, 51.2, 50.1, 48.6, 44.7, 44.1, 41.3, 41.3, 39.8, 38.1, 36.7, 35.2, 34.9, 31.5, 30.1, 29.6, 29.1, 28.2, 28.1, 25.6, 24.9, 24.5, 21.7, 20.3, 20.2, 18.9, 18.5, 18.1, 13.8, 13.7; ESI-MS m/z: 547.4 [M+H]+. Anal. calcd for C36H57N3O: C 78.92, H 10.49, N 7.67; found C 79.03, H 11.00, N 6.91.
3.2.4 齐墩果-2, 12-二烯并[3, 2-d]嘧啶-28-羧酸异丙酯(Ⅰ1)的制备
将OA-3溶解于10 mL无水乙醇, 依次加入醋酸甲脒(0.037 g, 1.5 mmol)、甲醇钠(0.016 g, 0.3 mmol), 加热至回流, TLC检测反应终点[展开剂: V(石油醚)/V(乙酸乙酯)=8/1], 12 h反应结束.后冷却至室温, 加入饱和食盐水、乙酸乙酯, 萃取3次, 合并有机相.过滤, 减压蒸出溶剂, 得深黄色半油状固体.粗品经硅胶柱色谱分离纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.079 g白色晶状固体Ⅰ1, 产率52.30%. m.p. 201.1~203.7 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.82 (s, 1H, C4N2Ha), 8.40 (s, 1H, C4N2Hb), 5.35 (s, 1H), 4.35~4.29 (m, 1H, COOCH(CH3)2), 2.75 (t, J=8.1 Hz, 1H), 2.61 (d, J=16.6 Hz, 1H), 2.03~1.59 (m, 6H, COOCH(CH3)2, 1.36 (s, 3H), 1.34 (s, 3H), 1.31 (s, 3H), 1.30 (s, 3H), 1.22 (s, 3H), 1.12 (s, 3H), 1.10 (s, 3H), 1.07 (s, H), 1.04 (s, H); 13C NMR (150 MHz, CDCl3) δ: 178.4, 171.3, 159.2, 157.5, 150.4, 134.7, 123.6, 70.1, 58.2, 49.6, 44.9, 44.8, 40.1, 38.7, 37.2, 36.4, 32.7, 32.5, 32.1, 30.1, 29.6, 28.1, 28.0, 27.9, 27.6, 26.3, 25.6, 24.1, 22.4, 22.1, 21.6, 19.3, 18.9, 18.2, 17.2; ESI-MS m/z: 532.4 [M+H]+. Anal. calcd for C35H52N2O2: C 78.90, H 9.84, N 5.26; found C 78.73, H 9.65, N 5.17.
3.2.15 5', 6'-二氢-齐墩果-2-烯并[2, 3-b]吡嗪-12-烯-28-酰正丁胺(Ⅱ5)的制备
按照Ⅱ1的制备方法, 由中间体OA-1 (0.22 mmol)与正丁胺(0.44 mmol)反应.最终粗品经硅胶柱色谱纯化[洗脱剂: V(石油醚)/V(乙酸乙酯)=20/1], 得0.042 g白色晶体Ⅱ5, 产率23.12%. m.p. 97~99 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.93 (s, 1H, NH), 5.31 (s, 1H), 3.24~3.20 (m, 2H, NHCH2), 2.35 (t, J=7.5 Hz, 1H), 1.89~1.48 (m, 4H), 1.59 (s, 2H, CH2CH2), 1.55~1.52, 1.46~1.42 (m, 4H, NCH2CH2N), 1.41 (t, J=6.9 Hz, 1H), 1.40~1.37, 1.36~1.35 (m, 4H, NCH2CH2N), 1.32 (s, 2H, CH2CH2), 1.31~1.28 (m, 6H), 1.26~1.23 (m, 4H), 1.18 (s, 3H), 1.16 (s, 3H), 1.14 (s, 3H), 1.13 (s, 3H), 1.05 (s, 3H), 1.03 (s, 3H), 0.93 (s, 3H); 13C NMR (150 MHz, CDCl3)δ: 183.1, 165.2, 165.2, 150.3, 122.6, 51.3, 51.2, 50.1, 49.2, 44.6, 43.9, 39.7, 37.1, 36.8, 35.2, 34.7, 33.6, 31.2, 30.3, 30.1, 29.9, 28.5, 28.5, 25.2, 25.1, 24.9, 24.6, 20.8, 20.3, 19.4, 19.4, 18.5, 17.8, 17.6, 14.5; ESI-MS m/z: 547.4 [M+H]+. Anal. calcd for C36H57N3O: C 78.92, H 10.49, N 7.67; found C 79.25, H 10.01, N 7.59.
-
-
[1]
Ovesna, Z.; Vachalkova, A.; Horvathova, K.; Tothova, D. Neoplasma 2004, 51, 327.
-
[2]
Sohn, K. H.; Lee, H. Y.; Chuang, H. Y.; Yong, H. S.; Yi, S. Y.; Kim, K. W. Cancer Lett. 1995, 94, 213. doi: 10.1016/0304-3835(95)03856-R
-
[3]
Petr, D.; Marian, H.; David, Vydra.; Alica, H.; Miroslav, K.; David, B.; Lenka, M.; Milan, U.; Jan, S. Nat. Prod. Rep. 2006, 23, 394. doi: 10.1039/b515312n
-
[4]
Huang, D.; Ding, Y.; Li, Y.; Zhang, W.; Fang, W. M.; Chen, X. G. Cancer Lett. 2006, 233, 289. doi: 10.1016/j.canlet.2005.03.019
-
[5]
田丽婷, 马龙, 堵年生, 中国中药杂志, 2002, 27, 884.Tian, L. T.; Ma, L.; Du, N. S. China J. Chin. Mater. Med. 2002, 27, 884 (in Chinese).
-
[6]
孟艳秋, 刘丹, 白中伟, 蔡伶俐, 艾宏儒, 药学学报, 2011, 46, 556.Meng, Y. Q.; Liu, D.; Bai, Z, W.; Cai, L. L.; Ai, H, R. Acta Pharm. Sin. 2011, 46, 556 (in Chinese).
-
[7]
孟艳秋, 聂慧慧, 王晓晨, 李丹, 葛崇勋, 赵娜, 陈虹, 曹波, 药学学报, 2011, 46, 1215.Meng, Y. Q.; Nie, H. H.; Wang, X. C.; Li, D.; Ge, C.T.; Zhao, N.; Chen, H.; Cao, B. Acta Pharm. Sin. 2011, 46, 1215 (in Chinese).
-
[8]
孟艳秋, 杨哲, 张萌, 丁一, 现代药物与临床, 2014, 29, 1674.Meng, Y. Q.; Yang, Z.; Zhang, M.; Ding, Y. Drug Clinic. 2014, 29, 1674 (in Chinese).
-
[9]
孟艳秋, 冯楚桥, 张良峰, 张萌, 赵娜, 药学学报, 2015, 50, 469.Meng, Y. Q.; Feng, C. Q.; Zhang, L. F.; Zhang, M.; Zhao, N. Acta Pharm. Sincia 2015, 50, 469 (in Chinese).
-
[10]
孟艳秋, 曹佳, 汤义, 鹿学宇, 刘立伟, 有机化学, 2016, 36, 1080. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345374.shtmlMeng, Y. Q.; Cao, J.; Tang, Y.; Lu, X. Y.; Liu, L. W. Chin. J. Org. Chem. 2016, 36, 1080 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345374.shtml
-
[11]
Hitoshi, K.; Tohru, T.; Itaru, M.; Kenji, O.; Hirokazu, I.; Jun, I.; Masaru, O.; Misao, S.; Ken-ichi, Y.; Matsuzawa, Y.; Kitamura, Y.; Kanakura, Y. Blood 1996, 88, 995.
-
[12]
Michele, B.; Michael W, D.; Gianantonio, R.; Andreas, H.; Simona, S.; Jane, F. A.; Francisco, C.; Richard, E. C.; Jorge, E. C.; Francois, C.; Henrik, H. H.; Timothy, P. H.; Hagop, M. K.; Dong-Wook, K.; Richard, A. L.; Jeffrey, H. L.; Francois-Xavier, M.; Giovanni, M.; Jiri, M.; Martin, C. M.; Dietge, N.; Fabrizio, P.; Jerald, P. R.; Philippe, R.; Giuseppe, S; Susanne, S.; Charles, S.; Richard, S.; Bengt, S.; Juan-Luis, S.; John, M. G.; Rudiger, H. Blood 2013, 122, 872. doi: 10.1182/blood-2013-05-501569
-
[13]
Leonie K, A.; Renate, G. Expert Opin. Drug 2013, 22, 103. doi: 10.1517/13543784.2013.740010
-
[14]
Lennartsson, J.; Rönnstrand, L. Physiol. Rev. 2012, 92, 1619. doi: 10.1152/physrev.00046.2011
-
[15]
Anna, E.; Antonia, K.; Malin, J.; Riet, H.; Linda, R.; Hanna G, K.; Rik, D. W.; Liesbeth, H.; Maarten, F.; Fredrik, O.; Rolf, L.; Vendela, P.; Martin, H. Biochem. Pharmacol. (Amsterdam. Neth.) 2014, 87, 284.
-
[16]
Zhao, H.; Luoto, K. R.; Meng, A. X.; Bristow, R. G. Radiother. Oncol. 2011, 101, 59. doi: 10.1016/j.radonc.2011.08.013
-
[17]
卫小红, 邵杰, 王军辉, Asmitan, Thankuf, 同济大学学报(医学版), 2009, 30, 19.Wei, X. H.; Shao, J.; Wang, J. H.; Asmitan; Thankuf J. Tongji Univ. (Med. Ed.) 2009, 30, 19 (in Chinese).
-
[18]
Chiang, Y. M.; Chang, J. Y.; Kuo, C. C.; Chang, C. Y.; Kuo, Y. H. Phytochemistry 2005, 66, 495. doi: 10.1016/j.phytochem.2004.12.026
-
[1]
-
图式 1 齐墩果酸类似物的合成
Scheme 1 Synthesis of derivatives of oleanolic acid
Reagent and conditions: (a) Jones, acetone, r.t., 1 h; (b) RBr, K2CO3, DMF; (c) DMF-DMA, toluene, 110 ℃, reflux, 8 h; (d) formamidine acetate, EtOH, reflux, 12 h; (e) DCM. (COCl)2, DMF, r.t., 4 h; (f) DCM, amine, Et3N; (g) m-CPBA, concd, H2SO4 (cat.), MeOH-DCM, r.t., 24 h; (h) Jones, acetone, r.t., 1 h; (i) H2NCH2CH2NH2, EtOH, reflux, 5 h
表 1 目标化合物对KB和A549细胞的活性抑制
Table 1. Inhibitory activity of the target compounds on the KB and A549 cells

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 1951
- HTML全文浏览量: 192


 下载:
下载:




 下载:
下载:

