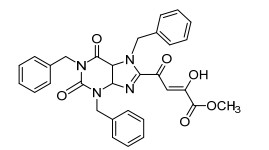
 图 1
具有生物活性的8-取代咖啡因衍生物
Figure 1.
8-Substituted caffeine derivative with biological activities
图 1
具有生物活性的8-取代咖啡因衍生物
Figure 1.
8-Substituted caffeine derivative with biological activities

Citation: Su Lü, Xiao Hanbing, Yuan Yumeng, Zhang Xiaofeng, Lin Shen, Huang Qiufeng. Palladium-Catalyzed C-H Alkoxycarbonylation of Caffeines: Synthesis of 8-Ester-substituted Caffeines[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 630-635. doi: 10.6023/cjoc201610028

钯催化咖啡因C-H键直接烷氧基羰基化反应生成8-酯基咖啡因衍生物
English
Palladium-Catalyzed C-H Alkoxycarbonylation of Caffeines: Synthesis of 8-Ester-substituted Caffeines
-
Key words:
- palladium
- / C-H bond acitivation
- / carbonylation
- / caffeine
- / carbon monoxide
-
过渡金属催化羰基化反应是构建C—C键的重要手段之一, 同时羰基化反应可以在有机分子中引入重要官能团羰基, 成为有机合成化学研究的前沿领域之一.一氧化碳 (CO) 是一种常见的C1化学资源, 对CO催化活化的羰基化反应研究有显著的经济效益及环境效益; 另一方面, CO作为碳基源的羰基化反应——插羰反应大多数属于高原子经济性反应, 符合现代绿色化学发展的要求.所以以CO为羰基源的羰基化反应一直以来都是C1资源高值化利用的重要研究方向及热点[1].自从Heck首次报道以C—X (X=卤素或拟卤素) 键出发的过渡金属催化的羰基化反应之后[2], 由C—X化合物出发的羰基化反应取得了重大的进展[3].但是C—X化合物制备成本高, 反应后会生成的HX酸副产物, 原子利用率低且对环境不友好.近年来, 直接从C—H键出发的羰基化反应受到更多化学工作者的重视[4].
8-取代咖啡因衍生物是一类重要的有机分子, 在医药方面表现出良好的药理性质[5], 如具有β-二酮酸 (DKA) 药效基团的8-取代咖啡因衍生物分子 (图 1) 具有抑制HIV-1整合酶活性的分子, 成为抗HIV药物[6]; 同时8-取代咖啡因衍生物在生物荧光方面也表现出优异的潜能.尽管科学家们已经发现了许多发光探针如生物发光蛋白、无机纳米颗粒、有机染料、稀土配合物等都可用于生物成像[7], 但咖啡因这类体积小的荧光标记分子具有低毒性和优良的生物相容性, 是生物成像方面重要的研究方向之一[8].本文将直接从咖啡因C—H键出发, 在CO气氛中, 以咖啡因与醇的羰基化反应作为研究对象, 探索出8-酯基取代咖啡因衍生物的新型简便合成方法.目前合成8-酯基取代咖啡因衍生物的方法是从咖啡因的卤代物出发得到目标产物, 此类合成路线缺点明显, 如路线繁琐、底物范围狭窄及对环境不友好[9].
1 结果与讨论
以咖啡因 (1a) 与正丁醇的氧化羰基化反应为模板反应, 以1, 4-二氧六环为溶剂, CO压力为一个大气压, 反应温度120 ℃下对催化剂、氧化剂和碱进行了筛选.过渡金属催化C—H活化并官能团反应中, 钯盐是最常见的催化剂[10], 首先用醋酸钯为催化剂对反应进行了多种尝试, 包括氧化剂、碱及各种添加剂的考察, 但反应都不能进行 (表 1, Entry 1). Pd (OPiv)2、Pd (TFA)2以及PdCl2同样也没有催化活性 (表 1, Entries 2~4).我们还尝试了其它过渡金属盐或配合物如[RuCl2(cod)]n、RhCl3和[Cp*RhCl2]2, 反应也基本不发生 (表 1, Entries 5~7).添加PPh3配体对反应有很大地促进作用, 使用PdCl2/PPh3/Cu (OAc)2催化剂体系时, 目标产物产率为30%(表 1, Entry 8), 将催化剂换成PdCl2(PPh3)2后, 可以高分离产率得到目标产物 (83.0%; 表 1, Entry 9).接着以PdCl2(PPh3)2为催化剂考察了几种常见的氧化剂发现醋酸铜Cu (OAc)2表现出较好的活性 (表 1, Entries 10~13).过渡金属催化C—H活化反应中, 碱通常可以作为酸的中和剂, 加速C—H键的断裂[11], 因此我们对几种碱进行了简单的考察 (表 1, Entries 14~16).结果表明碱的添加对反应没有帮助, 甚至是有害的.比如添加DBACO后反应产率降低至39%(表 1, Entry 14), 而添加K2CO3则使反应不能进行 (表 1, Entry 15).减少催化剂PdCl2(PPh3)2的用量及氧化剂Cu (OAc)2的用量, 都导致反应产率大幅度下降 (表 1, Entries 17~18).

Entry Catalyst Oxidant Base Yield b/% 1 Pd (OAc)2 Cu (OAc)2 0 2 Pd (OPiv)2 Cu (OAc)2 0 3 Pd (TFA)2 Cu (OAc)2 0 4 PdCl2 Cu (OAc)2 0 5 [RuCl2(cod)] n Cu (OAc)2 0 6 RhCl3 Cu (OAc)2 0 7 [Cp*RhCl2]2 Cu (OAc)2 0 8 c PdCl2/PPh3 Cu (OAc)2 30.0 9 PdCl2(PPh3)2 Cu (OAc)2 83.0 10 PdCl2(PPh3)2 AgOAc 0 11 PdCl2(PPh3)2 Ag2CO3 Trace 12 PdCl2(PPh3)2 Oxone 0 13 PdCl2(PPh3)2 Benzoquinone Trace 14 PdCl2(PPh3)2 Cu (OAc)2 DABCO 39.0 15 PdCl2(PPh3)2 Cu (OAc)2 K2CO3 Trace 16 PdCl2(PPh3)2 Cu (OAc)2 Et3N 18.9 17d PdCl2(PPh3)2 Cu (OAc)2 26.3 18e PdCl2(PPh3)2 Cu (OAc)2 15.7 a Reaction conditions: caffeine (1a, 0.2 mmol), n-BuOH (0.3 mL), catalyst (10 mol%), oxidant (2 equiv.), base (1 equiv.), CO (101 kPa) in 1, 4-dioxane (1 mL) at 120 ℃ for 24 h. b Isolated yield. c PPh3 (20 mol%). d PdCl2(PPh3)2(5 mol%). e Cu (OAc)2 (1 equiv.) 表 1 反应条件优化a
Table 1. Optimization of the reaction conditions在以PdCl2(PPh3)2为催化剂, Cu (OAc)2为氧化剂的反应条件下, 我们对反应溶剂对反应的影响进行了考察, 结果列于表 2.从表可以看出在极性溶剂N, N-二甲基甲酰胺 (DMF)、二甲基亚砜 (DMSO) 和N, N-二甲基乙酰胺 (DMA) 中反应很难进行, 其中DMSO为溶剂时产率只有9.0%, DMF和DMA为溶剂时反应都不能进行, 反应原料基本回收; 非极性溶剂作为反应溶剂时反应产率有明显改善, 其中1, 4-二氧六环中目标产物产率最高.

Entry Solvent Yieldb/% 1 1, 4-Dioxane 83.0 2 Toluene 34.6 3 Anisole 18.2 4 DMF 0 5 DMSO 9.0 6 DMA 0 a Reaction conditions: caffeine (0.2 mmol), n-BuOH (0.3 mL), catalyst (10 mol%), Cu (OAc)2 (2 equiv.), CO (1 atm) in solvent (1 mL) at 120 ℃ for 24 h. b Isolated yield. 表 2 反应溶剂筛选a
Table 2. Screening of the solvents综合以上反应条件结果, PdCl2(PPh3)2为催化剂对咖啡因与丁醇的羰基化反应的最佳反应条件是: 10 mol% PdCl2(PPh3)2, 2 equiv. Cu (OAc)2, 咖啡因与丁醇的物质的量比为1:16.4, 溶剂为1, 4-二氧六环, 反应温度120 ℃, CO压力为101 kPa, 反应时间24 h.
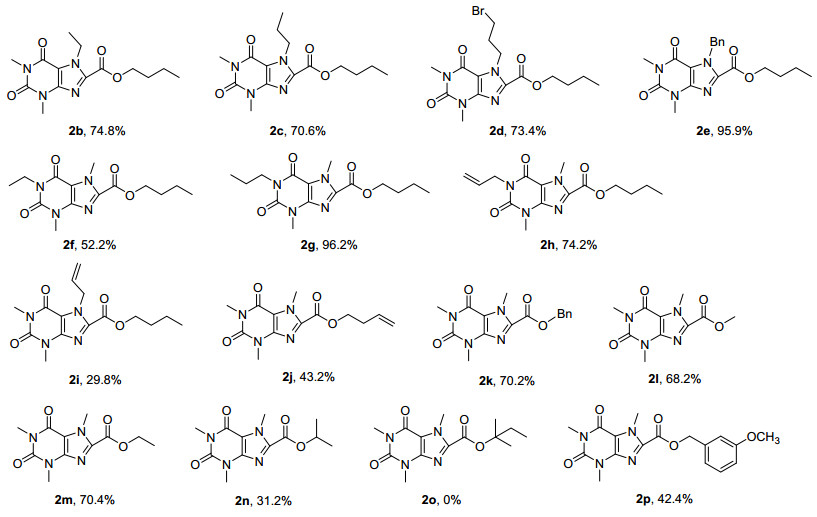
上述优化反应条件基础上, 首先对过渡金属催化的一系列咖啡因衍生物与正丁醇的氧化羰基化反应进行了考察 (图 2). 1位烷基取代咖啡因 (2b~2e) 和7位烷基取代的咖啡因 (2f~2h) 可以很好地进行烷氧基羰基化反应, 均以较高产率得到相应的咖啡因的酯化产物, 唯一例外的是7-烯丙基咖啡因, 目标产物产率仅29.8% (2i), 可能的原因是过渡金属钯配合物可以与靠近反应中心 (8位C—H键) 的烯丙基配位从而影响其催化羰基化反应活性, 而没有靠近反应中心的烯丙基则可以很好地在反应体系中兼容 (2h).从图中还可以看出7-位取代基的位阻对反应活性影响不大, 乙基、丙基甚至苄基取代咖啡因都可以较好地参与反应, 分别获得74.8%(2b)、70.6%(2c) 和95.9%(2e) 的产率.需要指出的是Br官能团在反应中不受影响, 可以为目标产物的进一步衍生化提供可能 (2d).
在考察了咖啡因的底物范围后, 研究了醇的底物适用范围.伯醇如甲醇、乙醇和苄醇都能与咖啡因反应得到较好产率的咖啡因酯化产物. m-甲氧基苄醇以及3-丁烯-1-醇在标准条件下反应产率不高, 分别为42.4% (2p) 和43.2% (2j).仲醇如异丙醇也能够与咖啡因进行羰基化反应, 但产率偏低 (31.2%, 2n), 而叔醇不能够与咖啡因进行反应, 原因可能是空间位阻效应 (2o).由于苯酚中羟基的亲核性比较弱, 在反应体系中不能作为反应物与咖啡因进行羰基化反应.
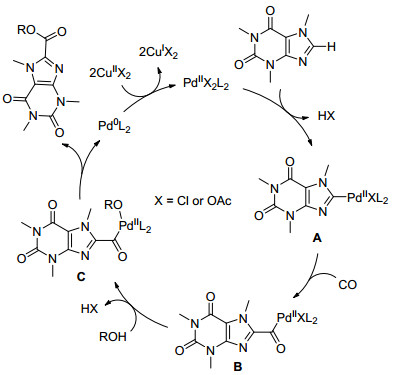
基于实验结果与文献报道[13], 以咖啡因与醇的羰基化反应为例子, 我们对反应机理进行了假设.如Scheme 1所示, 首先咖啡因与二价钯物种进行亲电钯化反应得到中间体A, 接着一氧化碳插入得到中间体B, 随后醇作为亲核试进攻钯中心并脱去一分子HX生成中间体C, 亲核性较弱的高位阻醇如叔醇会影响其反应活性导致羰基化反应不能进行, 中间体C可以经过还原消除得到目标产物并释放出零价钯, 产生的零价钯经过二价铜离子氧化后重新得到二价钯催化活性物种实现催化循环.
2 结论
本实验采用PdCl2(PPh3)2 (10 mol%) 为催化剂, 以Cu (OAc)2 (2.0 equiv.) 作为氧化剂, 1, 4-二氧六环 (1 mL) 作为反应溶剂, 在CO (101 kPa) 气氛下, 温度为120 ℃, 反应时间为24 h的反应体系下, 直接从咖啡因C—H键出发, 以CO作为C1源, 与醇类物质发生直接氧化羰基化反应合成8-酯基咖啡因衍生物.该反应具有以下优点: (1) 反应无需对咖啡因原料预先官能化如生成卤代化合物, 而是直接从咖啡因C—H键出发一步合成8-酯基咖啡因衍生物; (2) 反应以CO为碳源, 反应副产物为水, 具有高原子经济性, 符合现代绿色化学发展要求; (3) 反应无需高压操作, 所用CO为一个大气压, 操作简便; (4) 催化剂体系对底物的普适性强, 应用范围广, 可根据实际需要设计合成各种8-酯基咖啡因衍生物.
3 实验部分
3.1 仪器与试剂
1H NMR和13 C NMR用Bruker AM-400 (400 MHz) 型核磁共振仪器测定, TMS为内标; HRMS数据采用Waters GCT Premier (EI-TOF) 仪器测定.所有试剂分析纯, 均为商业购买, 直接用于实验, 溶剂经过严格除水干燥处理; 柱层析硅胶 (200~300目) 为青岛海洋化工有限公司生成, 购买后直接使用.咖啡因底物按文献方法合成[14].
3.2 8-酯基咖啡因衍生物的合成
通用实验过程以咖啡因1a与CO反应生成2a为例:室温下在连接有气球的Schlenk反应管中加入0.2 mmol咖啡因, 0.02 mmol [PdCl2(PPh3)2], 0.4 mmol Cu (OAc)2, 用CO气体抽换气三次.用注射器注射1 mL 1, 4-二氧六环和0.3 mL试剂正丁醇, 然后将反应管放于120 ℃的油浴锅中反应24 h, 反应结束后冷却至室温后在通风橱中缓慢释放CO气体.浓缩混合物, 所得粗产物用石油醚:乙酸乙酯的体积比为5:1的混合液体作为淋洗剂, 经柱层析得到最终产物1, 3, 7-三甲基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2a), 白色固体, 产率93%.1H NMR (400 MHz, CDCl3) δ: 4.42 (t, J=6.9 Hz, 2H), 4.35 (s, 3H), 3.61 (s, 3H), 3.41 (s, 3H), 1.85~1.76 (m, 2H), 1.46 (dd, J=15.1, 7.5 Hz, 2H), 0.97 (t, J=7.4 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.5, 155.6, 151.4, 146.8, 139.1, 110.4, 66.5, 34.8, 30.6, 30.0, 28.2, 19.1, 13.7; HRMS calcd for C13H18N4O4: 294.1328, found 294.1327.
1, 3-二甲基-7-乙基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2b): 1H NMR (400 MHz, CDCl3) δ: 4.87 (q, J=7.1 Hz, 2H), 4.42 (t, J=6.9 Hz, 2H), 3.61 (s, 3H), 3.42 (s, 3H), 1.80 (dd, J=8.6, 6.5 Hz, 2H), 1.45 (q, J=7.3 Hz, 5H), 0.97 (t, J=7.4 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.3, 155.2, 151.5, 147.0, 138.4, 109.7, 66.5, 43.1, 30.5, 30.0, 28.2, 19.1, 16.5, 13.7; HRMS calcd for C14H20N4O4: 308.1485, found 308.1487.
1, 3-二甲基-7-丙基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2c): 1H NMR (400 MHz, CDCl3) δ: 4.82~4.72 (m, 2H), 4.41 (t, J=7.0 Hz, 2H), 3.61 (s, 3H), 3.41 (s, 3H), 1.82 (dd, J=15.0, 11.4, 6.6 Hz, 4H), 1.45 (dd, J=15.1, 7.5 Hz, 2H), 0.96 (td, J=7.4, 6.4 Hz, 6H); 13C NMR (100 MHz, CDCl3) δ: 158.4, 155.3, 151.5, 147.0, 138.7, 110.0, 66.5, 48.9, 30.5, 30.0, 28.2, 24.7, 19.1, 13.7, 10.7; HRMS calcd for C15H22N4O4: 322.1641, found 322.1640.
1, 3-二甲基-7-(3-溴丙基)-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2d): 1H NMR (400 MHz, CDCl3) δ: 5.01~4.89 (m, 2H), 4.43 (t, J=7.0 Hz, 2H), 3.61 (s, 3H), 3.50~3.35 (m, 5H), 2.49~2.37 (m, 2H), 1.81 (dd, J=8.5, 6.5 Hz, 2H), 1.46 (dd, J=15.1, 7.5 Hz, 2H), 0.97 (t, J=7.4 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.4, 155.3, 151.4, 147.1, 138.8, 109.9, 66.7, 46.6, 33.7, 30.5, 30.1, 29.0, 28.3, 19.1, 13.7; HRMS calcd for C15H21BrN4O4: 400.0746, found 400.0746.
1, 3-二甲基-7-苄基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2e): 1H NMR (400 MHz, CDCl3) δ: 7.33~7.25 (m, 5H), 6.09 (s, 2H), 4.40 (t, J=6.9 Hz, 2H), 3.63 (s, 3H), 3.42 (s, 3H), 1.81~1.70 (m, 2H), 1.40 (dd, J=15.1, 7.5 Hz, 2H), 0.95 (t, J=7.4 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.5, 155.4, 151.4, 147.1, 138.8, 136.3, 128.7, 128.1, 127.5, 109.9, 66.5, 50.0, 30.5, 30.0, 28.3, 19.0, 13.7; HRMS calcd for C19H22N4O4: 370.1641, found 370.1640.
3, 7-二甲基-1-乙基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2f): 1H NMR (400 MHz, CDCl3) δ: 4.42 (t, J=6.9 Hz, 2H), 4.34 (s, 3H), 4.08 (q, J=7.1 Hz, 2H), 3.60 (s, 3H), 1.80 (dd, J=8.5, 6.5 Hz, 2H), 1.45 (dd, J=15.1, 7.5 Hz, 2H), 1.24 (t, J=7.1 Hz, 3H), 0.97 (t, J=7.4 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.5, 155.3, 151.0, 146.9, 139.0, 110.5, 66.4, 36.8, 34.7, 30.5, 29.9, 19.1, 13.7, 13.2; HRMS calcd for C14H20N4O4: 308.1485, found 308.1482.
3, 7-二甲基-1-丙基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2g): 1H NMR (400 MHz, CDCl3) δ: 4.42 (t, J=6.9 Hz, 2H), 4.34 (s, 3H), 4.02~3.90 (m, 2H), 3.60 (s, 3H), 1.86~1.74 (m, 2H), 1.68 (t, J=7.6 Hz, 3H), 1.45 (dd, J=15.1, 7.5 Hz, 2H), 0.97 (t, J=7.3 Hz, 5H); 13C NMR (100 MHz, CDCl3) δ: 158.5, 155.5, 151.2, 146.9, 139.1, 110.5, 66.4, 43.2, 34.7, 30.5, 29.9, 21.2, 19.1, 13.7, 11.3; HRMS calcd for C15H22N4O4: 322.1641, found 322.1640.
3, 7-二甲基-1-烯丙基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2h): 1H NMR (400 MHz, CDCl3) δ: 5.89 (dd, J=8.8, 8.3 Hz, 1H), 5.31~5.14 (m, 2H), 4.62 (d, J=5.8 Hz, 2H), 4.42 (t, J=6.9 Hz, 2H), 4.34 (s, 3H), 3.61 (s, 3H), 1.87~1.74 (m, 2H), 1.45 (dd, J=15.1, 7.5 Hz, 2H), 0.97 (t, J=7.4 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.5, 155.2, 151.0, 147.0, 139.2, 131.9, 117.9, 110.4, 66.5, 43.6, 34.8, 30.5, 30.0, 19.1, 13.7; HRMS calcd for C15H20N4O4: 320.1485, found 320.1486.
1, 3-二甲基-7-烯丙基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸丁酯 (2i): 1H NMR (400 MHz, CDCl3) δ: 7.03 (d, J=15.6 Hz, 1H), 5.65 (dd, J=5.3, 1.7 Hz, 2H), 4.41 (t, J=6.9 Hz, 2H), 4.10 (t, J=6.7 Hz, 2H), 3.63 (s, 3H), 3.41 (s, 3H), 1.79 (dd, J=8.6, 6.4 Hz, 2H), 1.64~1.56 (m, 2H), 1.00~0.94 (m, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.0, 151.5, 147.6, 141.7, 139.0, 132.9, 118.4, 108.4, 64.7, 49.2, 29.8, 28.2, 19.1, 13.7; HRMS calcd for C15H20N4O4: 320.1485, found 320.1483.
1, 3, 7-三甲基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸-3-丁烯酯 (2j): 1H NMR (400 MHz, CDCl3) δ: 5.83 (dd, J=17.1, 10.3 Hz, 1H), 5.23~5.07 (m, 2H), 4.47 (t, J=6.9 Hz, 2H), 4.34 (s, 3H), 3.60 (s, 3H), 3.40 (s, 3H), 2.57 (q, J=6.9 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 158.3, 133.1, 118.0, 65.4, 34.7, 32.9, 30.0, 28.2; HRMS calcd for C13H16N4O4: 292.1172, found 292.1170.
1, 3, 7-三甲基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸苄酯 (2k): 1H NMR (400 MHz, CDCl3) δ: 7.53~7.32 (m, 5H), 5.45 (s, 2H), 4.34 (s, 3H), 3.61 (s, 3H), 3.41 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.3, 155.6, 151.4, 146.8, 138.8, 134.8, 129.7~128.6, 110.5, 68.0, 34.8, 30.0, 28.2; HRMS calcd for C16H16N4O4: 328.1172, found 328.1170.
1, 3, 7-三甲基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸甲酯 (2l): 1H NMR (400 MHz, CDCl3) δ: 4.36 (s, 3H), 4.01 (s, 3H), 3.60 (s, 3H), 3.41 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.8, 155.5, 151.4, 146.8, 138.6, 110.6, 53.2, 34.7, 30.0, 28.2; HRMS calcd for C10H12N4O4: 252.0859, found 252.0860.
1, 3, 7-三甲基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸乙酯 (2m): 1H NMR (400 MHz, CDCl3) δ: 4.48 (q, J=7.1 Hz, 2H), 4.35 (s, 3H), 3.61 (s, 3H), 3.41 (s, 3H), 1.45 (t, J=7.1 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.3, 155.6, 151.4, 146.8, 139.0, 110.4, 65.8, 34.8, 33.0, 30.0, 28.2; HRMS calcd for C11H14N4O4: 266.1015, found 266.1015.
1, 3, 7-三甲基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸异丙酯 (2n): 1H NMR (400 MHz, CDCl3) δ: 5.36~5.24 (m, 1H), 4.33 (s, 3H), 3.60 (s, 3H), 3.46~3.35 (m, 3H), 1.43 (d, J=6.3 Hz, 6H); 13C NMR (100 MHz, CDCl3) δ: 158.0, 155.6, 151.4, 146.8, 139.5, 110.3, 70.9, 34.7, 30.0, 28.2, 21.7; HRMS calcd for C12H16N4O4: 280.1172, found 280.1175.
1, 3, 7-三甲基-2, 6-二氧代-2, 3, 6, 7-四氢-1H-嘌呤-8-甲酸-3-甲氧基苄酯 (2p): 1H NMR (400 MHz, CDCl3) δ: 7.29 (t, J=7.9 Hz, 1H), 7.06~7.02 (m, 1H), 7.00 (s, 1H), 6.90~6.86 (m, 1H), 5.41 (s, 2H), 4.33 (d, J=0.9 Hz, 3H), 3.80 (d, J=0.8 Hz, 3H), 3.59 (d, J=1.0 Hz, 3H), 3.40 (d, J=1.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 159.8, 158.3, 155.6, 151.4, 146.8, 138.8, 136.3, 129.8, 120.8, 114.2, 110.5, 67.8, 55.3, 34.8, 30.0, 28.2; HRMS calcd for C17H18N4O4: 358.1277, found 358.1277.
辅助材料(Supporting Information) 所有化合物的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
(a) Quintero-Duque, S.; Dyballa, K. M.; Fleischer, I. Tetrahedron Lett. 2015, 56, 2634.
(b) Wu, X.-F.; Fang, X.; Wu, L.; Jackstell, R.; Neumann, H.; Beller, M. Acc. Chem. Res. 2014, 47, 1041.
(c) Sumino, S.; Fusano, A.; Fukuyama, T.; Ryu, I. Acc. Chem. Res. 2014, 47, 1563.
(d) Barnard, C. F. J. Organometallics 2008, 27, 5402.
(e) Wu, X.-F.; Neumann, H.; Beller, M. Chem. Rev. 2013, 113, 1.
(f) Omae, I. Coordin. Chem. Rev. 2011, 255, 139. -
[2]
(a) Schoenberg, A.; Bartoletti, I.; Heck, R. F. J. Org. Chem. 1974, 39, 3318.
(b) Schoenberg, A.; Heck, R. F. J. Org. Chem. 1974, 39, 3327.
(c) Schoenberg, A.; Heck, R. F. J. Am. Chem. Soc. 1974, 96, 7761. -
[3]
(a) Wu, L.; Fang, X.; Liu, Q.; Jackstell, R.; Beller, M.; Wu, X.-F. ACS Catal. 2014, 4, 2977.
(b) Sumino, S.; Fusano, A.; Fukuyama, T.; Ryu, I. Acc. Chem. Res. 2014, 47, 1563.
(c) Wu, X.-F.; Neumann, H.; Beller, M. Chem. Soc. Rev. 2011, 40, 4986.
(d) Brennführer, A.; Neumann, H.; Beller, M. Angew. Chem., Int. Ed. 2009, 48, 4114.
(e) Sargent, B. T.; Alexanian, E. J. J. Am. Chem. Soc. 2016, 138, 7520. -
[4]
(a) Liu, B.; Hu, F.; Shi, B.-F. ACS Catal. 2015, 5, 1863.
(b) Wu, X.-F.; Neumann, H.; Beller, M. ChemSusChem 2013, 6, 229.
(c) Liu, Q.; Zhang, H.; Lei, A. Angew. Chem., Int. Ed. 2011, 50, 10788.
(d) Gadge, S. T.; Bhanage, B. M. RSC Adv. 2014, 4, 10367.
(e) Fenner, S.; Ackermann, L. Green Chem. 2016, 18, 3804.
(f) Boogaerts, I. I. F.; Nolan, S. P. J. Am. Chem. Soc. 2010, 132, 8858. -
[5]
(a) Müller, C. E.; Jacobson, K. A. Biochim. Biophys. Acta 2011, 1808, 1290.
(b) Stydom, B.; Bergh, J. J.; Petzer, J. P. Eur. J. Med. Chem. 2011, 46, 3474.
(c) Van der Walt, M. M.; Terre'Blanche, G.; Petzer, A.; Lourens, A. C. U.; Petzer, J. P. Bioorg. Chem. 2013, 49, 49.
(d) Rivara, S.; Piersanti, G.; Bartoccini, F.; Diamantini, G.; Pala, D.; Riccioni, T.; Stasi, M. A.; Cabri, W.; Borsini, F.; Mor, M.; Tarzia, G.; Minetti, P. J. Med. Chem. 2013, 56, 1247.
(e) Baraldi, P. G.; Baraldi, S.; Saponaro, G.; Preti, D.; Romagnoli, R.; Piccagli, L.; Cavalli, A.; Recanatini, M.; Moorman, A. R.; Zaid, A. N.; Varani, K.; Borea, P. A.; Tabrizi, M. J. J. Med. Chem. 2012, 55, 797. -
[6]
Uchil, V.; Seo, B.; Nair, V. J. Org. Chem. 2007, 72, 8577. doi: 10.1021/jo701336r
-
[7]
(a) Zhang, H.; Zhou, L.; Zhu, Z.; Yang, C. Chem. Eur. J. 2016, 22, 9886.
(b) Kocaoglu, O.; Carlson, E. E. Nat. Chem. Biol. 2016, 12, 472.
(c) Rice, D. R.; Clear, K. J.; Smith, B. D. Chem. Commun. 2016, 52, 8787. -
[8]
(a) Greco, N. J.; Tor, Y. Tetrahedron 2007, 63, 3515.
(b) Kim, D.; Lee, J. H.; Hong, S.-S.; Hong, S. Org. Lett. 2010, 12, 1212.
(c) Zhao, D.; Wang, W.; Yang, F.; Lan, J.; Yang, L.; Gao, G.; You, J. Angew. Chem., Int. Ed. 2009, 48, 3296.
(d) Huang, Y.; Song, F.; Wang, Z.; Xi, P.; Wu, N.; Wang, Z.; Lan, J.; You, J. Chem. Commun. 2012, 48, 2864. -
[9]
Heer, J. P.; Smith, I. E. D. WO 2007017265, 2007[Chem. Abstr. 2007, 146, 251660].
-
[10]
(a) Neufeldt, S. R.; Sanford, M. S. Acc. Chem. Res. 2012, 45, 936.
(b) Li, H.; Shi, Z. Prog. Chem. 2010, 22, 1414 (in Chinese).
(李湖, 施章杰, 化学进展, 2010, 22, 1414).
(c) Lyons, T. W.; Sanford, M. S. Chem. Rev. 2010, 110, 1147.
(d) Liu, C.; Yuan, J.; Gao, M.; Tang, S.; Li, W.; Shi, R.; Lei, A. Chem. Rev. 2015, 115, 12138.
(e) Chen, Z.; Wang, B.; Zhang, J.; Yu, W.; Liu, Z.; Zhang, Y. Org. Chem. Front. 2015, 2, 1107.
(f) Gang, F.; Xu, G.; Dong, T.; Yang, L.; Du, Z. Chin. J. Org. Chem. 2015, 35, 1428 (in Chinese).
(刚芳莉, 徐关利, 董涛生, 杨丽, 杜正银, 有机化学, 2015, 35, 1428.) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344872.shtml -
[11]
(a) Lang, R.; Shi, L.; Li, D.; Xia, C.; Li, F. Org. Lett. 2012, 14, 4130.
(b) Chen, M.; Ren, Z.-H.; Wang, Y.-Y.; Guan, Z.-H. J. Org. Chem. 2015, 80, 1258.
(c) Li, X.; Li, X.; Jiao, N. J. Am. Chem. Soc. 2015, 137, 9246.
(d) Yoo, E. J.; Wasa, M, Yu, J.-Q. J. Am. Chem. Soc. 2010, 132, 17378.
(e) Lian, Z.; Friis, S. D.; Skrydstrup, T. Chem. Commun. 2015, 51, 1870.
(f) Liu, B.; Hu, F.; Shi, B.-F. ACS Catal. 2015, 5, 1863. -
[12]
Chen, M.; Ren, Z.-H.; Wang, R.-Y.; Guan, Z.-H. Angew. Chem., Int. Ed. 2013, 52, 14196. doi: 10.1002/anie.201307942
-
[13]
Lang, R.; Wu, J.; Shi, L.; Xia, C.; Li, F. Chem. Commun. 2011, 47. 12553.
-
[14]
Zhang, H.; Liu, D.; Chen, C.; Liu, C.; Lei, A. Chem. Eur. J. 2011, 17, 9581. doi: 10.1002/chem.v17.35
-
[15]
(a) Malakar, C. C.; Schmidt, D.; Conrad, J.; Beifuss, U. Org. Lett. 2011, 13, 1378.
(b) Daly, J. W.; Padgett, W. L.; Shamim, M. T. J. Med. Chem. 1986, 29, 1305.
-
[1]
-
表 1 反应条件优化a
Table 1. Optimization of the reaction conditions

Entry Catalyst Oxidant Base Yield b/% 1 Pd (OAc)2 Cu (OAc)2 0 2 Pd (OPiv)2 Cu (OAc)2 0 3 Pd (TFA)2 Cu (OAc)2 0 4 PdCl2 Cu (OAc)2 0 5 [RuCl2(cod)] n Cu (OAc)2 0 6 RhCl3 Cu (OAc)2 0 7 [Cp*RhCl2]2 Cu (OAc)2 0 8 c PdCl2/PPh3 Cu (OAc)2 30.0 9 PdCl2(PPh3)2 Cu (OAc)2 83.0 10 PdCl2(PPh3)2 AgOAc 0 11 PdCl2(PPh3)2 Ag2CO3 Trace 12 PdCl2(PPh3)2 Oxone 0 13 PdCl2(PPh3)2 Benzoquinone Trace 14 PdCl2(PPh3)2 Cu (OAc)2 DABCO 39.0 15 PdCl2(PPh3)2 Cu (OAc)2 K2CO3 Trace 16 PdCl2(PPh3)2 Cu (OAc)2 Et3N 18.9 17d PdCl2(PPh3)2 Cu (OAc)2 26.3 18e PdCl2(PPh3)2 Cu (OAc)2 15.7 a Reaction conditions: caffeine (1a, 0.2 mmol), n-BuOH (0.3 mL), catalyst (10 mol%), oxidant (2 equiv.), base (1 equiv.), CO (101 kPa) in 1, 4-dioxane (1 mL) at 120 ℃ for 24 h. b Isolated yield. c PPh3 (20 mol%). d PdCl2(PPh3)2(5 mol%). e Cu (OAc)2 (1 equiv.) 表 2 反应溶剂筛选a
Table 2. Screening of the solvents

Entry Solvent Yieldb/% 1 1, 4-Dioxane 83.0 2 Toluene 34.6 3 Anisole 18.2 4 DMF 0 5 DMSO 9.0 6 DMA 0 a Reaction conditions: caffeine (0.2 mmol), n-BuOH (0.3 mL), catalyst (10 mol%), Cu (OAc)2 (2 equiv.), CO (1 atm) in solvent (1 mL) at 120 ℃ for 24 h. b Isolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 1185
- HTML全文浏览量: 135


 下载:
下载:


 下载:
下载:

