 图 1
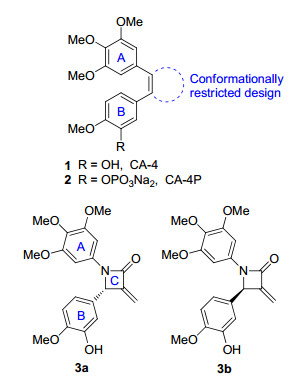
CA-4 (1)、CA-4P (2) 和二芳基-b-内酰胺类化合物 (3a~3b) 的结构
Figure 1.
The structures of CA-4 (1), CA-4P (2) and diaryl-β-lactams (3a~3b)
图 1
CA-4 (1)、CA-4P (2) 和二芳基-b-内酰胺类化合物 (3a~3b) 的结构
Figure 1.
The structures of CA-4 (1), CA-4P (2) and diaryl-β-lactams (3a~3b)

Citation: Feng Kechang, Liang Yuru, Zhou Pengfei, Liu Mingming, Wang Yang. Structural Modification and Inhibitory Activity on Tumor Cell Proliferation of Novel Diaryl-β-lactam Compounds as Tubulin Aggregation Inhibitors[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 683-690. doi: 10.6023/cjoc201610023

新型二芳基-β-内酰胺类微管蛋白聚集抑制剂的结构改造及肿瘤细胞增殖抑制活性研究
-
关键词:
- 二芳基-β-内酰胺类化合物
- / 微管蛋白聚集抑制剂
- / 抗肿瘤
English
Structural Modification and Inhibitory Activity on Tumor Cell Proliferation of Novel Diaryl-β-lactam Compounds as Tubulin Aggregation Inhibitors
-
Key words:
- diaryl-β-lactam
- / tubulin aggregation inhibitor
- / antitumor
-
微管蛋白存在于真核细胞中, 其重要功能是参与细胞有丝分裂中纺锤体的形成, 微管蛋白抑制剂可抑制快速增殖的肿瘤细胞有丝分裂, 是抗肿瘤药物研究领域的热点之一[1].康普立停 (Combretastatin A4, CA-4, 1, 图 1) 是一种从南非植物Combretum caffrum中分离得到的化合物, 它可以结合于秋水仙碱结合位点, 促进微管的解聚, 表现出很强的肿瘤细胞增殖抑制活性[2, 3].其磷酸酯二钠盐 (CA-4P, 2) 改善了水溶性, 在体内也表现出了较好的活性, 目前已进入临床Ⅲ期试验[4].但是, 由于CA-4在储藏或者体内过程中极易转变为反式构型而失去药效, 因此运用生物电子等排原理和骨架跃迁原理, 研究者的兴趣转向了构象限制的环状类似物[5~13].
 图 1
CA-4 (1)、CA-4P (2) 和二芳基-b-内酰胺类化合物 (3a~3b) 的结构
Figure 1.
The structures of CA-4 (1), CA-4P (2) and diaryl-β-lactams (3a~3b)
图 1
CA-4 (1)、CA-4P (2) 和二芳基-b-内酰胺类化合物 (3a~3b) 的结构
Figure 1.
The structures of CA-4 (1), CA-4P (2) and diaryl-β-lactams (3a~3b)
我们课题组[14, 15]前期利用文献报道的不对称烯丙基胺化反应, 高收率和高对映选择性地制备了手性α-亚甲基-β-取代氨基羧酸酯类化合物, 经过一步环化获得了一系列手性α-亚甲基-N, β-二芳基-β-内酰胺类化合物, 并进行了体外抗肿瘤活性测试, 发现与CA-4结构相似的 (S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-羟基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (3a) 对肿瘤细胞A2780、MDA-MB-231、SKOV3和Hela有显著的增殖抑制活性、而其对映异构体3b则没有抗肿瘤活性 (表 1), 首次确定了二芳基-β-内酰胺类化合物环上手性碳的绝对构型与抗肿瘤活性之间的构效关系, 并且阐明了其结合于微管蛋白的秋水仙碱结合位点、强效抑制微管蛋白聚集的抗肿瘤作用机制[16].为了进一步研究α-亚甲基-N, β-二芳基-β-内酰胺类化合物的B环酚羟基对抗肿瘤活性的影响, 考虑到酚羟基为药物易代谢位点[17], 参考CA-4的B环酚羟基已有结构改造基础[18~20], 本文以3a为先导化合物, 对其B环酚羟基进行了醚化、酰化及磺酰化改造, 以进一步明确构效关系、获得活性更好的目标化合物.
 表 1
化合物3a~3b对不同肿瘤细胞增殖的抑制活性
Table 1.
In vitro antiproliferative activities of compounds 3a~3b on different cell lines
表 1
化合物3a~3b对不同肿瘤细胞增殖的抑制活性
Table 1.
In vitro antiproliferative activities of compounds 3a~3b on different cell lines
Compound IC50a/(μmol•L-1) A2780b MDA-MB-231c SKOV-3b Helad 3a 0.115 0.308 0.114 0.243 3b 4.6 >10 3.5 5.5 CA-4 (1) 0.006 0.008 0.012 0.010 aThe anti-proliferation activities of individual compound to tumor cells were determined by the MTT assay. The data are the mean of triplicate determinations. bA2780 and SKOV-3 are human ovarian cancer cell lines. cMDA-MB-231 is a human breast cancer cell line. dHela is a human cervical carcinoma cell line. 表 1 化合物3a~3b对不同肿瘤细胞增殖的抑制活性
Table 1. In vitro antiproliferative activities of compounds 3a~3b on different cell lines1 结果与讨论
1.1 目标化合物的合成
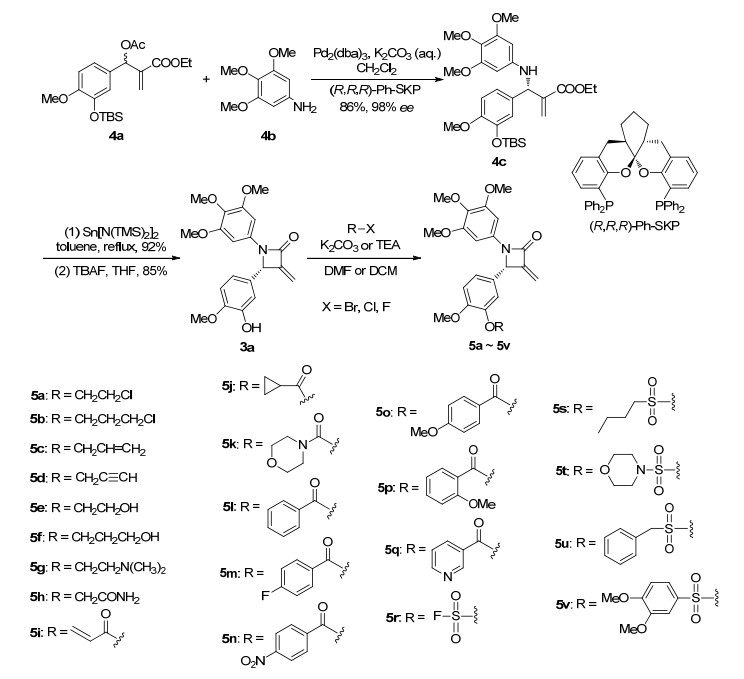
先导化合物3a的合成按照文献[16]方法, 以Morit-Baylis-Hillman (MBH) 反应产物4a为起始原料, 通过不对称烯丙基胺化、环合和脱保护基制备得到 (光学纯度99%).然后在碳酸钾或三乙胺碱性条件下, 化合物3a分别与卤代烷、酰卤和磺酰卤反应, 合成了其B环酚羟基分别被醚化、酰化及磺酰化的衍生物5a~5v, 共计22个 (Scheme 1), 结构均经1H NMR、13C NMR和ESI-HRMS确证.
1.2 体外抗肿瘤活性研究
以化合物1和3a为阳性对照, 采用噻唑蓝 (MTT) 法评价了目标化合物5a~5v对肿瘤细胞A2780、MDA-MB-231、SKOV-3和Hela的增殖抑制活性.目标化合物的半数抑制浓度IC50值如表 2所示.
 表 2
目标化合物5a~5v对不同肿瘤细胞增殖的抑制活性
Table 2.
In vitro antiproliferative activities of target compounds 5a~5v on different cell lines
表 2
目标化合物5a~5v对不同肿瘤细胞增殖的抑制活性
Table 2.
In vitro antiproliferative activities of target compounds 5a~5v on different cell lines
Compound IC50/(μmol•L-1) A2780 MDA-MB-231 SKOV3 Hela 5a 0.409 0.608 0.864 0.887 5b 2.177 4.148 4.066 6.035 5c 1.253 0.883 1.476 1.149 5d 0.429 1.196 0.841 1.046 5e 0.344 0.845 0.832 0.925 5f 1.542 1.921 3.031 7.469 5g >10 >10 >10 >10 5h 0.316 0.503 0.698 0.818 5i 0.328 0.565 0.522 0.49 5j 0.129 0.207` 0.108 0.142 5k >10 >10 >10 >10 5l 0.287 0.637 0.484 0.386 5m 0.169 0.223 0.114 0.075 5n 0.055 0.105 0.084 0.102 5o 0.125 0.284 0.258 0.139 5p 0.201 0.218 0.155 0.106 5q 0.112 0.151 0.075 0.115 5r 0.121 0.216 0.178 0.174 5s 5.322 7.293 10.202 14.023 5t 12.869 >20 15.597 19.324 5u 7.342 >20 8.656 >20 5v 12.321 13.422 15.234 12.343 3a 0.115 0.308 0.114 0.243 1 0.006 0.008 0.012 0.010 表 2 目标化合物5a~5v对不同肿瘤细胞增殖的抑制活性
Table 2. In vitro antiproliferative activities of target compounds 5a~5v on different cell lines体外抗肿瘤活性测试结果表明, 对于不同的肿瘤细胞, 大多数化合物表现出一定的抑制增殖活性.总的来说, 大部分酚羟基醚化产物活性优于磺酸酯类衍生物, 而羧酸酯类衍生物的活性又高于前两者.分析醚类衍生物发现, 5a、5d、5e活性基本保持, 其中5a活性优于5b、5e活性优于5f, 这说明酚羟基醚化的碳链以短为佳, 如果延长碳链活性下降; 分析磺酸酯类衍生物发现, 大体积的磺酸酯产物5s、5t、5u和5v均丧失活性, 只有小体积的氟磺酸酯产物5r活性保持; 羧酸酯类衍生物大都表现出与化合物3a相当的抑制活性, 比较5l、5m、5n和5o的活性可以看出, 苯环上电子云密度越低活性越好, 其中化合物5n的活性最好, 其抑制肿瘤细胞A2780、MDA-MB-231、SKOV-3和Hela的IC50值分别为0.055、0.105、0.084和0.102 μmol/L.
2 结论
本文合成了22个新型手性二芳基-β-内酰胺类化合物, 结构均经1H NMR、13C NMR和ESI-MS确证.采用MTT法测试了目标产物对肿瘤细胞A2780、MDA-MB-231、SKOV-3和Hela的增殖抑制活性, 结果表明, 大多数目标化合物显示了较好的抑制肿瘤细胞增殖活性, 其中化合物5n活性明显优于化合物3a, 对上述四种肿瘤细胞株均显示了较好的抑制活性, 相应IC50值分别为0.055、0.084、0.105和0.102 μmol/L, 下一步可考虑用其他基团替代该酚羟基进行更深入的构效关系研究.
3 实验部分
3.1 仪器与试剂
熔点用XT-4双目显微熔点测定仪测定, 温度计未校正.实验所用无水二氯甲烷是经CaH2回流干燥后蒸馏获得, 三乙胺经NaOH (或KOH) 干燥、蒸馏后使用. TLC用板为0.2 mm GF245高效薄层层析硅胶板, 显色条件为紫外灯.柱层析使用300~400目硅胶装柱. 1H NMR谱在Varian Mercury 400核磁共振仪上测定, 内标为TMS; 13C NMR谱在Varian Mercury 400或600核磁共振仪上测定, 内标为CDCl3; HRMS在Bruker Daltonics, Inc. APEXⅢ. 7.0 TESLA FTMS (ESI) 型仪器上测定.
3.2 实验方法
3.3 抗肿瘤活性测试
3.2.1 醚的合成
在20 mL茄形瓶中加入DMF (1 mL)、化合物3a (光学纯度99%, 20 mg, 0.054 mmol) 和碳酸钾 (15 mg, 0.108 mmol), 室温搅拌10 min后加入不同的溴代烷 (0.108 mmol), 室温过夜后, 加入10 mL乙酸乙酯, 分别以水 (10 mL×2) 和饱和食盐水 (10 mL) 洗涤, 无水硫酸钠干燥.过滤, 减压蒸除溶剂, 硅胶柱层析分离纯化, 收集对应的洗脱液, 蒸干溶剂得纯品5a~5h.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-[3-(2-氯乙氧基)-4-甲氧基苯基]-3-亚甲基氮杂环丁烷-2-酮 (5a):淡黄色固体, 收率73%. m.p. 91~92 ℃; [α]D20+36.4 (c 0.33, CHCl3); 1H NMR (CDCl3, 400 MHz) δ:7.05 (dd, J=8.2, 1.8 Hz, 1H), 6.90~6.88 (m, 2H), 6.59 (s, 2H), 5.84 (s, 1H), 5.30 (s, 1H), 5.16 (s, 1H), 4.22 (t, J=6.0 Hz, 2H), 3.87 (s, 3H), 3.80 (t, J=6.0 Hz, 2H), 3.76 (s, 3H), 3.73 (s, 6H); 13C NMR (CDCl3, 100 MHz) δ:161.2, 153.7, 150.6, 149.9, 148.5, 134.9, 134.0, 129.1, 121.4, 112.7, 112.3, 111.2, 95.0, 69.7, 64.0, 61.2, 56.3, 42.0; MS (ESI) m/z (%): 434.1 (M+H)+; HRMS (ESI) calcd for C22H25ClNO6 [M+H]+434.1365, found 434.1366.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-[3-(3-氯丙氧基)-4-甲氧基苯基]-3-亚甲基氮杂环丁烷-2-酮 (5b):白色固体, 收率77%. m.p. 72~73 ℃; [α]D20+20.1 (c 0.15, CHCl3); 1H NMR (CDCl3, 400 MHz) δ:7.01 (d, J=8.2 Hz, 1H), 6.88~6.86 (m, 2H), 6.60 (s, 2H), 5.84 (s, 1H), 5.30 (s, 1H), 5.17 (s, 1H), 4.18~4.01 (m, 2H), 3.85 (s, 3H), 3.76~3.73 (m, 11H), 2.27~2.22 (m, 2H); 13C NMR (CDCl3, 100 MHz) δ: 161.2, 153.7, 150.3, 150.0, 149.0, 134.8, 134.0, 129.0, 120.6, 112.0, 111.6, 111.1, 95.0, 65.9, 64.1, 61.2, 56.3, 56.2, 41.7, 32.4; MS (ESI) m/z (%): 448.1 (M+H)+; HRMS (ESI) calcd for C23H27ClNO6 [M+H]+ 448.1521, found 448.1523.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-烯丙氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5c):白色固体, 收率98%. m.p. 92~93 ℃; [α]D20+40.0 (c 0.39, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 6.99 (dd, J=8.2, 1.2 Hz, 1H), 6.87 (d, J=8.2 Hz, 1H), 6.85 (s, 1H), 6.59 (s, 2H), 6.00 (ddd, J=17.4, 10.5, 5.5 Hz, 1H), 5.83 (s, 1H), 5.33 (d, J=17.4 Hz, 1H), 5.29 (s, 1H), 5.22 (d, J=10.5 Hz, 1H), 5.16 (s, 1H), 4.55 (d, J=5.5 Hz, 2H), 3.87 (s, 3H), 3.76 (s, 3H), 3.73 (s, 6H); 13C NMR (CDCl3, 100 MHz) δ: 161.0, 153.5, 150.1, 149.8, 148.6, 134.7, 133.8, 132.8, 128.7, 120.1, 118.3, 111.7, 111.5, 110.7, 94.9, 69.9, 64.0, 61.0, 56.1, 56.0; MS (ESI) m/z (%): 412.1 (M+H)+; HRMS (ESI) calcd for C23H26NO6 [M+H]+412.1755, found 412.1756.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-炔丙氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5d):白色固体, 收率85%. m.p. 106~107 ℃. [α]D20+50.5 (c 0.33, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.04 (d, J=8.2 Hz, 1H), 7.02 (s, 1H), 6.90 (d, J=8.2 Hz, 1H), 6.60 (s, 2H), 5.84 (s, 1H), 5.33 (s, 1H), 5.17 (s, 1H), 4.73 (d, J=2.2 Hz, 2H), 3.87 (s, 3H), 3.76 (s, 3H), 3.73 (s, 6H), 2.34 (t, J=2.2 Hz, 1H); 13C NMR (CDCl3, 100 MHz) δ: 160.9, 153.5, 150.3, 149.8, 147.2, 134.7, 133.8, 128.7, 121.0, 112.9, 111.9, 110.8, 95.0, 78.0, 76.0, 63.8, 60.96, 56.9, 56.1, 56.0; MS (ESI) m/z (%): 410.2 (M+H)+; HRMS (ESI) calcd for C23H24NO6 [M+H]+ 410.1598, found 410.1600.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-羟乙氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5e):无色油状物, 收率54%. [α]D20+22.0 (c 0.25, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.03 (dd, J=4.0, 8.0 Hz, 1H), 6.87 (d, J=8.2 Hz, 2H), 6.58 (s, 2H), 5.83 (s, 1H), 5.29 (s, 1H), 5.15 (s, 1H), 4.05 (t, J=4.0 Hz, 2H), 3.92 (t, J=4.0 Hz, 2H), 3.85 (s, 3H), 3.75 (s, 3H), 3.72 (s, 6H), 2.81 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 160.3, 152.9, 149.7, 149.1, 148.2, 134.1, 133.2, 128.4, 120.2, 111.6, 111.1, 110.3, 94.2, 70.7, 63.2, 60.5, 60.3, 55.4, 55.3; MS (ESI) m/z (%): 416.2 (M+H)+; HRMS (ESI) calcd for C22H26NO7 [M+H]+ 416.1704, found 416.1704.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-羟丙氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5f):无色油状物, 收率95%. [α]D20+18.7 (c 0.27, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.01 (d, J=8.2 Hz, 1H), 6.91~6.79 (m, 2H), 6.61 (s, 2H), 5.85 (s, 1H), 5.31 (s, 1H), 5.18 (s, 1H), 4.14 (t, J=5.8 Hz, 2H), 3.86~3.84 (m, 5H), 3.77 (s, 3H), 3.74 (s, 6H), 2.59 (brd, 1H), 2.08~2.03 (m, 2H); 13C NMR (CDCl3, 100 MHz) δ:160.4, 152.9, 149.4, 149.2, 148.3, 134.1, 133.2, 128.2, 119.8, 110.7, 110.2, 110.1, 94.2, 67.7, 63.3, 60.7, 60.3, 55.5, 55.3, 31.0, 29.1; MS (ESI) m/z (%): 430.2 (M+H)+; HRMS (ESI) calcd for C23H28NO7 [M+H]+ 430.1860, found 430.1861.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-二甲氨基乙氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5g):白色固体, 收率88%. m.p. 87~88 ℃; [α]D20+45.8 (c 0.17, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 6.99 (d, J=8.1 Hz, 1H), 6.86~6.84 (m, 2H), 6.58 (s, 2H), 5.82 (s, 1H), 5.28 (s, 1H), 5.15 (s, 1H), 4.05 (t, J=5.6 Hz, 2H), 3.84 (s, 3H), 3.75 (s, 3H), 3.71 (s, 6H), 2.75 (t, J=5.6 Hz, 2H), 2.33 (s, 6H); 13C NMR (CDCl3, 150 MHz) δ: 160.9, 153.5, 150.2, 149.9, 148.9, 134.8, 133.8, 128.9, 120.4, 111.7, 111.6, 110.7, 94.9, 67.3, 63.9, 60.9, 58.0, 56.1, 55.9, 45.9; MS (ESI) m/z (%): 443.2 (M+H)+; HRMS (ESI) calcd for C24H31N2O6 [M+H]+ 443.2177, found 443.2178.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-氨甲酰甲氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5h):无色油状物, 收率95%. [α]D20+20.9 (c 0.29, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.08 (d, J=8.3 Hz, 1H), 6.92~6.90 (m, 3H), 6.57 (s, 2H), 6.02 (s, 1H), 5.84 (s, 1H), 5.30 (s, 1H), 5.15 (s, 1H), 4.48 (s, 2H), 3.87 (s, 3H), 3.76 (s, 3H), 3.74 (s, 6H); 13C NMR (CDCl3, 150 MHz) δ: 170.5, 160.1, 153.0, 149.7, 149.0, 147.1, 134.2, 133.0, 128.7, 121.2, 113.1, 111.6, 110.3, 94.3, 68.7, 62.8, 60.3, 55.5, 55.3; MS (ESI) m/z (%): 429.2 (M+H)+; HRMS (ESI) calcd for C22H24NaO7 [M+Na]+ 451.1476, found 451.1476.
3.2.2 酯的合成
化合物3a (光学纯度99%, 20 mg, 0.054 mmol) 溶于1.5 mL无水二氯甲烷中, 0 ℃搅拌条件下, 依次加入三乙胺 (11 mg, 0.108 mmol) 和酰氯 (0.081 mmol) (氟磺酰氟则过量), 后升至室温反应1 h.停止反应, 用1 mL水淬灭, 加入10 mL二氯甲烷, 分别以水 (10 mL×2)、饱和食盐水 (10 mL) 洗涤, 无水硫酸钠干燥.过滤, 减压蒸除溶剂, 拌硅胶柱层析分离纯化, 收集对应的洗脱液, 蒸干溶剂得纯品5i~5v.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-丙烯酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5i):白色固体, 收率74%. m.p. 109~110 ℃; [α]D20+52.1 (c 0.26, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.26 (dd, J=8.4, 2.0 Hz, 1H), 7.15 (d, J=2.0 Hz, 1H), 6.98 (d, J=8.4 Hz, 1H), 6.61~6.57 (m, 3H), 6.32 (dd, J=17.6, 10.4 Hz, 1H), 6.02 (d, J=10.4 Hz, 1H), 5.85 (s, 1H), 5.31 (s, 1H), 5.19 (s, 1H), 3.82 (s, 3H), 3.76 (s, 3H), 3.74 (s, 6H); 13C NMR (CDCl3, 100 MHz) δ: 163.8, 160.8, 153.6, 151.7, 149.6, 140.0, 134.8, 133.8, 132.9, 128.9, 127.4, 125.3, 121.8, 112.9, 111.1, 94.8, 63.3, 61.0, 56.1, 56.0; MS (ESI) m/z (%): 426.1 (M+H)+; HRMS (ESI) calcd for C23H23NNaO7 [M+Na]+ 448.1367, found 448.1369.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-环丙酰甲氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5j):白色固体, 收率84%. m.p. 68~69 ℃; [α]D20+12.4 (c 0.44, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.23 (dd, J=8.4, 2.1 Hz, 1H), 7.11 (d, J=2.1 Hz, 1H), 6.95 (d, J=8.5 Hz, 1H), 6.58 (s, 2H), 5.84 (s, 1H), 5.30 (s, 1H), 5.18 (s, 1H), 3.83 (s, 3H), 3.76 (s, 3H), 3.73 (s, 6H), 1.91~1.78 (m, 1H), 1.20~1.12 (m, 2H), 1.07~0.98 (m, 2H); 13C NMR (CDCl3, 100 MHz) δ: 161.0, 153.6, 150.0, 149.8, 148.9, 133.8, 128.9, 120.4, 111.4, 110.9, 110.8, 94.9, 68.3, 64.0, 61.3, 61.0, 56.1, 56.0, 31.7; MS (ESI) m/z (%): 440.2 (M+H)+; HRMS (ESI) calcd for C24H25NNaO7 [M+Na]+ 462.1523, found 462.1526.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-[3-(4-吗啉碳酰氧基)-4-甲氧基苯基]-3-亚甲基氮杂环丁烷-2-酮 (5k):白色固体, 收率84%. m.p. 82~83 ℃; [α]D20+30.0 (c 0.16, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.23 (dd, J=8.4, 2.1 Hz, 1H), 7.15 (d, J=2.1 Hz, 1H), 6.95 (d, J=8.4 Hz, 1H), 6.59 (s, 2H), 5.84 (s, 1H), 5.31 (s, 1H), 5.19 (s, 1H), 3.84 (s, 3H), 3.76 (s, 3H), 3.75~3.73 (m, 10H), 3.67 (s, 2H), 3.54 (s, 2H); 13C NMR (CDCl3, 150 MHz) δ: 160.2, 153.0, 152.5, 151.5, 149.0, 140.2, 134.1, 133.1, 128.2, 124.3, 121.3, 112.0, 110.5, 94.3, 66.0, 62.8, 60.3, 55.5, 55.4, 44.5, 43.7; MS (ESI) m/z (%): 485.2 (M+H)+; HRMS (ESI) calcd for C25H28N2NaO8 [M+Na]+ 507.1738, found 507.1739.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-苯甲酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5l):白色固体, 收率90%. m.p. 151~152 ℃; [α]D20+22.2 (c 0.34, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 8.18 (d, J=7.8 Hz, 2H), 7.66~7.62 (m, 1H), 7.53~7.49 (m, 2H), 7.30 (dd, J=8.4, 2.0 Hz, 1H), 7.24 (d, J=2.0 Hz, 1H), 7.02 (d, J=8.4 Hz, 1H), 6.61 (s, 2H), 5.86 (s, 1H), 5.34 (s, 1H), 5.22 (s, 1H), 3.82 (s, 3H), 3.78 (s, 3H), 3.76 (s, 6H); 13C NMR (CDCl3, 100 MHz) δ:164.5, 160.9, 153.6, 151.9, 149.6, 140.5, 134.8, 133.8, 133.7, 130.3, 129.1, 129.0, 128.6, 125.3, 121.9, 113.0, 111.1, 94.9, 63.4, 61.0, 56.1, 56.0; MS (ESI) m/z (%): 476.2 (M+H)+; HRMS (ESI) calcd for C27H26NO7 [M+H]+ 476.1704, found 476.1705.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-对氟苯甲酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5m):白色固体, 收率91%. m.p. 185~186 ℃; [α]D20+38.5 (c 0.15, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 8.22~8.14 (m, 2H), 7.30 (dd, J=8.5, 2.2 Hz, 1H), 7.22 (d, J=2.2 Hz, 1H), 7.19~7.15 (m, 2H), 7.02 (d, J=8.5 Hz, 1H), 6.60 (s, 2H), 5.86 (t, J=1.7 Hz, 1H), 5.34 (s, 1H), 5.21 (s, 1H), 3.81 (s, 3H), 3.77 (s, 3H), 3.75 (s, 6H); 13C NMR (CDCl3, 100 MHz) δ:166.4 (d, J=255 Hz), 163.6, 161.0, 153.7, 152.0, 149.7, 140.4, 134.8, 133.9, 133.1 (d, J=10.1 Hz), 129.1, 125.6, 125.5 (d, J=3.2 Hz), 122.0, 115.9 (d, J=22.2 Hz), 113.0, 111.4, 95.0, 63.5, 61.1, 56.3, 56.2; MS (ESI) m/z (%): 494.2 (M+H)+; HRMS (ESI) calcd for C27H25FNO8 [M+H]+ 494.1610, found 494.1611.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-对硝基苯甲酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5n):淡黄色固体, 收率96%. m.p. 88~89 ℃; [α]D20+45.2 (c 0.31, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 8.35 (s, 4H), 7.34 (dd, J=8.5, 2.1 Hz, 1H), 7.24 (d, J=2.1 Hz, 1H), 7.05 (d, J=8.5 Hz, 1H), 6.60 (s, 2H), 5.87 (s, 1H), 5.35 (s, 1H), 5.22 (s, 1H), 3.83 (s, 3H), 3.77 (s, 3H), 3.76 (s, 6H); 13C NMR (CDCl3, 100 MHz) δ:162.6, 160.7, 153.6, 151.6, 151.0, 149.6, 140.0, 134.9, 134.5, 133.7, 131.4, 129.2, 125.9, 123.7, 121.4, 113.0, 111.2, 94.9, 63.3, 61.0, 56.2, 56.1; MS (ESI) m/z (%): 521.1 (M+H)+; HRMS (ESI) calcd for C27H25N2O9 [M+H]+ 521.1555, found 521.1554.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-对甲氧基苯甲酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5o):无色油状物, 收率93%. [α]D20+31.7 (c 1.0, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.95 (d, J=8.7 Hz, 1H), 7.11~7.05 (m, 3H), 6.84~6.78 (m, 3H), 6.43 (s, 2H), 5.68 (s, 1H), 5.15 (s, 1H), 5.04 (s, 1H), 3.71 (s, 3H), 3.63 (s, 3H), 3.59~3.58 (m, 9H); 13C NMR (CDCl3, 150 MHz) δ: 163.5, 163.3, 160.2, 153.0, 151.3, 149.0, 139.9, 134.1, 133.1, 131.8, 128.3, 124.5, 121.4, 120.8, 113.2, 112.3, 110.4, 94.2, 62.8, 60.3, 55.5, 55.4, 54.9; MS (ESI) m/z (%): 506.1 [M+H]+. HRMS (ESI) calcd for C28H27NNaO8 [M+Na]+ 528.1629, found 528.1631.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-[3-(2-甲氧基) 苯甲酰氧基-4-甲氧基苯基]-3-亚甲基氮杂环丁烷-2-酮 (5p):无色油状物, 收率84%. [α]D20+22.2 (c 0.11, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 8.15~8.11 (m, 2H), 7.35~7.32 (m, 1H), 7.28 (dd, J=8.7, 2.0 Hz, 1H), 7.22 (d, J=2.0 Hz, 1H), 7.02~6.95 (m, 3H), 6.91~6.87 (m, 1H), 6.61 (s, 2H), 5.85 (s, 1H), 5.33 (s, 1H), 5.21 (s, 1H), 3.88 (s, 3H), 3.81 (s, 3H), 3.77 (s, 3H), 3.76 (s, 6H); 13C NMR (CDCl3, 150 MHz) δ: 171.3, 164.2, 164.0, 160.9, 160.3, 153.6, 152.0, 149.6, 140.6, 134.8, 133.8, 132.4, 129.5, 128.9, 128.2, 127.2, 125.2, 122.0, 121.4, 113.9, 113.7, 112.9, 111.1, 94.9, 92.8, 69.9, 66.9, 63.4, 60.9, 56.1, 56.1, 55.5, 55.3, 10.6; MS (ESI) m/z (%): 506.1 (M+H)+; HRMS (ESI) calcd for C28H27NNaO8 [M+Na]+ 528.1629, found 528.1630.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-[3-(3-吡啶甲酰氧基-4-甲氧基苯基)]-3-亚甲基氮杂环丁烷-2-酮 (5q):白色固体16 mg, 收率62%. m.p. 113~114 ℃; [α]D20+44.9 (c 0.35, CHCl3); 1H NMR (CDCl3, 400 MHz) δ:9.37 (s, 1H), 8.85 (d, J=4.4 Hz, 1H), 8.43 (d, J=8.0 Hz, 1H), 7.46 (dd, J=8.0, 4.4 Hz, 1H), 7.32 (dd, J=8.4, 1.7 Hz, 1H), 7.24 (d, J=1.7 Hz, 1H), 7.03 (d, J=8.5 Hz, 1H), 6.60 (s, 2H), 5.86 (s, 1H), 5.34 (s, 1H), 5.22 (s, 1H), 3.82 (s, 3H), 3.77 (s, 3H), 3.76 (s, 6H); 13C NMR (CDCl3, 150 MHz) δ: 163.2, 160.8, 154.0, 153.6, 151.7, 151.5, 149.6, 140.0, 137.7, 134.9, 133.7, 129.1, 125.7, 125.3, 123.5, 121.7, 113.0, 111.2, 94.9, 63.3, 61.0, 56.1; MS (ESI) m/z (%): 477.2 (M+H)+; HRMS (ESI) calcd for C26H25N2O7 [M+H]+ 477.1656, found 477.1659.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-氟磺酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5r):淡黄色油状液体, 收率86%. [α]D20+30.0 (c 0.34, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.39 (br s, 2H), 7.13~7.00 (m, 1H), 6.53 (s, 2H), 5.87 (s, 1H), 5.33 (s, 1H), 5.19 (s, 1H), 3.91 (s, 3H), 3.76 (s, 3H), 3.73 (s, 6H); 13C NMR (CDCl3, 150 MHz) δ: 159.9, 153.1, 151.0, 148.6, 138.3, 134.4, 132.7, 129.0, 127.2, 120.8, 113.6, 110.8, 94.2, 62.0, 60.3, 55.8, 55.4; MS (ESI) m/z (%): 454.1 (M+H)+; HRMS (ESI) calcd for C20H21FNO8S [M+H]+ 454.0966, found 454.0968.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-丁磺酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5s):白色固体, 收率82%. m.p. 99~100 ℃; [α]D20+18.6 (c 0.35, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.39 (d, J=2.1 Hz, 1H), 7.27 (dd, J=8.5, 2.1 Hz, 1H), 6.99 (d, J=8.5 Hz, 1H), 6.56 (s, 2H), 5.85 (s, 1H), 5.31 (s, 1H), 5.19 (s, 1H), 3.87 (s, 3H), 3.76 (s, 3H), 3.74 (s, 6H), 3.29 (td, J=6.9, 1.6 Hz, 2H), 2.00~1.92 (m, 2H), 1.54~1.45 (m, 2H), 0.97 (t, J=7.4 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ:160.7, 153.6, 151.9, 149.5, 138.2, 134.8, 133.6, 129.4, 126.0, 124.0, 113.6, 111.2, 94.8, 62.9, 61.0, 56.1, 51.6, 29.7, 25.5, 21.5, 13.5; MS (ESI) m/z (%): 492.2 (M+H)+; HRMS (ESI) calcd for C24H29NNaO8S [M+Na]+ 514.1506, found 514.1508.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-吗啉磺酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5t):白色固体, 收率71%. m.p. 134~135 ℃; [α]D20+24.7 (c 0.11, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.43 (d, J=2.0 Hz, 1H), 7.26 (dd, J=8.5, 2.0 Hz, 1H), 6.99 (d, J=8.5 Hz, 1H), 6.57 (s, 2H), 5.86 (t, J=1.6 Hz, 1H), 5.31 (s, 1H), 5.19 (s, 1H), 3.88 (s, 3H), 3.76~3.73 (m, 13H), 3.38 (t, J=4.8 Hz, 4H); 13C NMR (CDCl3, 150 MHz) δ: 160.0, 153.0, 151.3, 148.9, 138.5, 134.2, 132.9, 128.6, 125.1, 122.1, 113.0, 110.6, 94.2, 65.3, 62.4, 60.3, 55.6, 55.5, 46.3; MS (ESI) m/z (%): 521.2 (M+H)+; HRMS (ESI) calcd for C24H29N2O9S [M+H]+ 521.1588, found 521.1590.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-(3-苄基磺酰氧基-4-甲氧基苯基)-3-亚甲基氮杂环丁烷-2-酮 (5u):白色固体, 收率88%. m.p. 58~59 ℃; [α]D20-0.7 (c 0.14, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.46~7.36 (m, 5H), 7.26 (dd, J=8.4, 2.0 Hz, 1H), 7.05 (d, J=2.0 Hz, 1H), 6.99 (d, J=8.4 Hz, 1H), 6.54 (s, 2H), 5.84 (s, 1H), 5.23 (s, 1H), 5.15 (s, 1H), 4.58 (q, J=14.0 Hz, 2H), 3.89 (s, 3H), 3.76 (s, 3H), 3.74 (s, 6H); 13C NMR (CDCl3, 150 MHz) δ: 160.0, 153.0, 151.4, 148.8, 137.9, 134.2, 132.9, 130.3, 128.7, 128.3, 126.8, 125.5, 122.9, 112.9, 110.6, 94.2, 62.4, 60.3, 57.3, 55.6, 55.5; MS (ESI) m/z (%): 526.1 (M+H)+; HRMS (ESI) calcd for C27H31N2O8S [M+ NH4]+ 543.1796, found 543.1797.
(S)-1-(3, 4, 5-三甲氧基苯基)-4-[3-(3, 4-二甲氧基) 苯磺酰氧基-4-甲氧基苯基]-3-亚甲基氮杂环丁烷-2-酮 (5v):白色固体27 mg, 收率87%. m.p. 70~71 ℃; [α]D20+29.3 (c 0.14, CHCl3); 1H NMR (CDCl3, 400 MHz) δ: 7.30~7.26 (m, 2H), 7.24 (dd, J=8.5, 2.1 Hz, 1H), 7.18 (d, J=2.1 Hz, 1H), 6.87 (d, J=8.5 Hz, 1H), 6.81 (d, J=8.2 Hz, 1H), 6.55 (s, 2H), 5.83 (s, 1H), 5.29 (s, 1H), 5.15 (s, 1H), 3.94 (s, 3H), 3.83 (s, 3H), 3.77 (s, 3H), 3.76 (s, 6H), 3.63 (s, 3H); 13C NMR (CDCl3, 150 MHz) δ: 159.9, 153.3, 153.0, 151.8, 148.9, 148.4, 138.1, 134.2, 132.9, 128.4, 126.6, 125.5, 122.2, 122.2, 112.7, 110.4, 110.0, 109.5, 94.2, 62.3, 60.3, 55.7, 55.5, 55.3; MS (ESI) m/z (%): 572.2 (M+H)+; HRMS (ESI) calcd for C28H29NNaO10S [M+Na]+ 594.1404, found 594.1405.
3.3.2 体外抑制细胞增殖实验
取对数生长期的细胞, 弃去培养基, PBS洗涤2次, 0.25%胰酶消化, 终止消化, 重悬细胞, 计数.按5×103个细胞每孔接种于96孔板, 每孔100 μL培养基, 置于37 ℃、5% CO2的细胞培养箱中培养24 h, 待细胞贴壁后, 加入不同浓度的化合物, 处理细胞48 h.弃去培养基, 加入200 μL含0.5 mg/mL MTT的培养基, 细胞培养箱中孵育4 h.弃去培养基, 每孔加入150 μL DMSO, 低速震荡10 min.酶标仪上测定570 nm处的吸光度减去490 nm处的吸光度.每个受试化合物设置6个浓度梯度, 并设阴性对照组 (加入空白溶剂).抑制率按如下公式计算:
抑制率 (%)=(ODDMSO-ODCompd.)/(ODDMSO-ODBlank)×100%
根据不同浓度的抑制率, 使用Graphpad Prism软件计算系列化合物对4种肿瘤细胞株的半数抑制浓度 (IC50).
辅助材料 (Supporting Information)化合物5a~5v的1H NMR、13C NMR和HRMS谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.3.1 试剂耗材和仪器
实验中所用的肿瘤细胞A2780、MDA-MB-231、SKOV-3和Hela均购自美国模式培养物集存库 (ATCC); 细胞培养基RPMI-1640、DMEM和胎牛血清 (FBS) 购自美国Thermo Scientific公司; 细胞培养皿 (板) 购自上海NEST公司; MTT购自Sigma公司, 为分析纯.本研究所使用的主要仪器有CO2培养箱 (Thermo)、显微镜 (Olympus)、细胞计数仪 (Beckman) 和自动酶标仪 (Biotek-H4) 等.
-
-
[1]
Jordan, A.; Hadfield, J. A.; Lawrence, N. J.; McGown, A. T. Med. Res. Rev. 1998, 18, 259. doi: 10.1002/(ISSN)1098-1128
-
[2]
Pettit, G. R.; Singh, S. B.; Boyd, M. R.; Hamel, E.; Pettit, R. K.; Schmidt, J. M.; Hogan, F. J. Med. Chem. 1995, 38, 1666. doi: 10.1021/jm00010a011
-
[3]
Mikstacka, R.; Stefanski, T.; Rozanski, J. Cell. Mol. Biol. Lett. 2013, 18, 368-397.
-
[4]
Monk, B. J.; Minion, L. E.; Coleman, R. L. Ann. Oncol. 2016, 27, i33. doi: 10.1093/annonc/mdw093
-
[5]
Carr, M.; Greene, L. M.; Knox, A. J.; Lloyd, D. G.; Zisterer, D. M.; Meegan, M. J. Eur. J. Med. Chem. 2010, 45, 5752. doi: 10.1016/j.ejmech.2010.09.033
-
[6]
Lu, Y.; Chen, J.; Xiao, M.; Li, W.; Miller, D. D. Pharm. Res. 2012, 29, 2943. doi: 10.1007/s11095-012-0828-z
-
[7]
Kaur, R.; Kaur, G.; Gill, R. K.; Soni, R.; Bariwal, J. Eur. J. Med. Chem. 2014, 87, 89. doi: 10.1016/j.ejmech.2014.09.051
-
[8]
Zheng, S.; Zhong, Q.; Mottamal, M.; Zhang, Q.; Zhang, C.; Lemelle, E.; McFerrin, H.; Wang, G. J. Med. Chem. 2014, 57, 3369. doi: 10.1021/jm500002k
-
[9]
Chaudhary, V.; Venghateri, J. B.; Dhaked, H. P.; Bhoyar, A. S.; Guchhait, S. K.; Panda, D. J. Med. Chem. 2016, 59, 3439. doi: 10.1021/acs.jmedchem.6b00101
-
[10]
O'Boyle, N. M.; Carr, M.; Greene, L. M.; Bergin, O.; Nathwani, S. M.; McCabe, T.; Lloyd, D. G.; Zisterer, D. M.; Meegan, M. J. J. Med. Chem. 2010, 53, 8569. doi: 10.1021/jm101115u
-
[11]
Tripodi, F.; Pagliarin, R.; Fumagalli, G.; Bigi, A.; Fusi, P.; Orsini, F.; Frattini, M.; Coccetti, P. J. Med. Chem. 2012, 55, 2112. doi: 10.1021/jm201344a
-
[12]
Greene, T. F.; Wang, S.; Greene, L. M.; Nathwani, S. M.; Pollock, J. K.; Malebari, A. M.; McCabe, T.; Twamley, B.; O'Boyle, N. M.; Zisterer, D. M.; Meegan, M. J. J. Med. Chem. 2016, 59, 90. doi: 10.1021/acs.jmedchem.5b01086
-
[13]
Perez-Perez, M. J.; Priego, E. M.; Bueno, O.; Martins, M. S.; Canela, M. D.; Liekens, S. J. Med. Chem. 2016, 59, 8685. doi: 10.1021/acs.jmedchem.6b00463
-
[14]
Wang, X.; Meng, F.; Wang, Y.; Han, Z.; Chen, Y. J.; Liu, L.; Wang, Z.; Ding, K. Angew. Chem., Int. Ed. 2012, 51 (37), 9276. doi: 10.1002/anie.201204925
-
[15]
Wang, X.; Guo, P.; Han, Z.; Wang, X.; Wang, Z.; Ding, K. J. Am. Chem. Soc. 2014, 136 (1), 405. doi: 10.1021/ja410707q
-
[16]
Zhou, P.; Liu, Y.; Zhou, L.; Zhu, K.; Feng, K.; Zhang, H.; Liang, Y.; Jiang, H.; Luo, C.; Liu, M.; Wang, Y. J. Med. Chem. 2016, 59, 10329. doi: 10.1021/acs.jmedchem.6b01268
-
[17]
Franklin, T. J.; Jacobs, V.; Jones, G.; Plé, P.; Bruneau, P. Cancer Res. 1996, 56, 984.
-
[18]
Pettit, G. R.; Toki, B.; Herald, D. L.; Verdier-Pinard, P.; Boyd, M. R.; Hamel, E.; Pettit, R. K. J. Med. Chem. 1998, 41, 1688. doi: 10.1021/jm970644q
-
[19]
Coggiola, B.; Pagliai, F.; Allegrone, G.; Genazzani, A. A.; Tron, G. C. Bioorg. Med. Chem. Lett. 2005, 15, 3551. doi: 10.1016/j.bmcl.2005.05.052
-
[20]
Orsini, F.; Pelizzoni, F.; Bellini, B.; Miglierini, G. Carbohydr. Res. 1997, 301, 95. doi: 10.1016/S0008-6215(97)00087-6
-
[1]
-
表 1 化合物3a~3b对不同肿瘤细胞增殖的抑制活性
Table 1. In vitro antiproliferative activities of compounds 3a~3b on different cell lines
Compound IC50a/(μmol•L-1) A2780b MDA-MB-231c SKOV-3b Helad 3a 0.115 0.308 0.114 0.243 3b 4.6 >10 3.5 5.5 CA-4 (1) 0.006 0.008 0.012 0.010 aThe anti-proliferation activities of individual compound to tumor cells were determined by the MTT assay. The data are the mean of triplicate determinations. bA2780 and SKOV-3 are human ovarian cancer cell lines. cMDA-MB-231 is a human breast cancer cell line. dHela is a human cervical carcinoma cell line. 表 2 目标化合物5a~5v对不同肿瘤细胞增殖的抑制活性
Table 2. In vitro antiproliferative activities of target compounds 5a~5v on different cell lines
Compound IC50/(μmol•L-1) A2780 MDA-MB-231 SKOV3 Hela 5a 0.409 0.608 0.864 0.887 5b 2.177 4.148 4.066 6.035 5c 1.253 0.883 1.476 1.149 5d 0.429 1.196 0.841 1.046 5e 0.344 0.845 0.832 0.925 5f 1.542 1.921 3.031 7.469 5g >10 >10 >10 >10 5h 0.316 0.503 0.698 0.818 5i 0.328 0.565 0.522 0.49 5j 0.129 0.207` 0.108 0.142 5k >10 >10 >10 >10 5l 0.287 0.637 0.484 0.386 5m 0.169 0.223 0.114 0.075 5n 0.055 0.105 0.084 0.102 5o 0.125 0.284 0.258 0.139 5p 0.201 0.218 0.155 0.106 5q 0.112 0.151 0.075 0.115 5r 0.121 0.216 0.178 0.174 5s 5.322 7.293 10.202 14.023 5t 12.869 >20 15.597 19.324 5u 7.342 >20 8.656 >20 5v 12.321 13.422 15.234 12.343 3a 0.115 0.308 0.114 0.243 1 0.006 0.008 0.012 0.010 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1235
- HTML全文浏览量: 141


 下载:
下载:

 下载:
下载:

