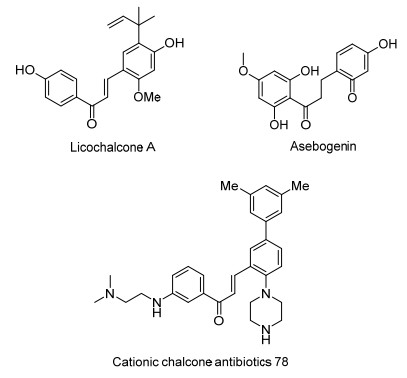
 图 1
具有抗菌活性的部分查尔酮化合物
Figure 1.
Some chalcone compounds with antibiotic activity
图 1
具有抗菌活性的部分查尔酮化合物
Figure 1.
Some chalcone compounds with antibiotic activity

Citation: Zhang En, Wang Mingming, Xu Shuaimin, Wang Shang, Zhao Di, Bai Pengyan, Cui Deyun, Hua Yonggang, Wang Ya'na, Qin Shangshang, Liu Hongmin. Synthesis and Antibiotic Activity Study of Pyridine Chalcone Derivatives against Methicillin-Resistant Staphylococcus aureus[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 959-966. doi: 10.6023/cjoc201610016

吡啶查尔酮衍生物的合成及抑制耐甲氧西林金黄色葡萄球菌活性评价
-
关键词:
- 吡啶查尔酮
- / 耐甲氧西林金黄色葡萄球菌
- / 抗菌活性
- / 红细胞溶血
English
Synthesis and Antibiotic Activity Study of Pyridine Chalcone Derivatives against Methicillin-Resistant Staphylococcus aureus
-
耐甲氧西林金黄色葡萄球菌 (MRSA) 自1961年首次报导以来[1], 在临床的分离率逐年升高, 并逐渐成为引起院内感染的重要病原菌[2, 3]. MRSA菌株耐药谱广, 感染患者病死率高, 临床治疗困难. MRSA多重耐药机制主要包括两方面:一是获得了相关的耐药基因; 二是细菌细胞膜上青霉素结合蛋白 (PBP) 的改变, 导致PBP蛋白与青霉素类药物结合能力下降[4]. MRSA的主要传播方式为皮肤和软组织直接接触传播, 导致病菌扩散[5]. MRSA院内感染的主要方式是肺炎, 在不合理的治疗方式下可能最终导致病患死亡. MRSA自报道发现之日起, 其在美国就以惊人的速度传播, 2003年美国医院重症监护室报导发现感染MRSA患者的比率高达64.4%[6].临床用于治疗MRSA的常用药物是糖肽类抗菌药物, 但是目前在美国已经有MRSA对糖肽类药物出现耐药的报道[7].同时对于幼儿和老年患者来说, 糖肽类化合物的毒副作用也较多[8].因此探索新型MRSA抑制药物的研发具有重要的意义.
黄酮和异黄酮是一类重要的天然产物, 广泛存在于可食用植物中[9].查尔酮作为黄酮和异黄酮的核心骨架单元, 广泛存在于天然产物中.该类化合物具有广泛的生物学活性, 如抗菌、抗癌、抗真菌、抗炎、抗疟疾等[10~14].由于查尔酮的结构中具有α, β-不饱和羰基, 可以与细菌内的亲核性基团 (如蛋白质中的巯基) 进行共轭加成而导致细菌死亡[13].同时, 由于查尔酮结构单元具有较好的柔性, 作为底物, 查尔酮就可与多种活性基团相结合.研究人员开始关注查尔酮的结构改造, 他们试图通过结构修饰来开发具有优异抗菌活性的查尔酮类衍生物[15~18]. Licochalcone A是从甘草里分离得到的查尔酮化合物, 活性结果表明甘草查尔酮A对MRSA和临床分离的万古霉素耐药的屎肠球菌的最小抑菌浓度 (MIC) 值约为13 μg/mL, 对屎肠球菌的MIC值是25 μg/ mL[17]; Cationic Chalcone Antibiotics 78是新型的脂肪基团取代的查尔酮衍生物, 其对MRSA的MIC值为1 μg/mL, 对大肠埃希菌 (ATCC 25922) 也有较好抑菌效果 (MIC为2 μg/mL)[17]; 二氢查尔酮类化合物Asebogenin对金黄色葡萄球菌和MRSA的MIC值分别为10和4.5 μg/mL[19](图 1).
1 结果与讨论
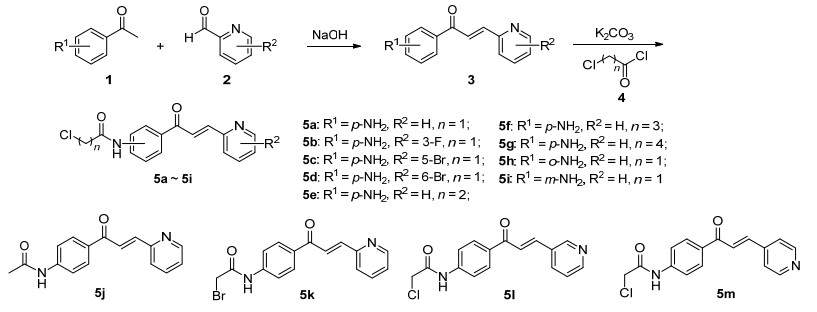
在前期抗菌活性化合物的合成[15, 16]和抗肿瘤活性的查尔酮衍生物合成[20, 21]的基础上, 我们合成了13个吡啶查尔酮衍生物, 力求发现具有良好抗MRSA活性的新型化合物.合成路线以取代苯乙酮和取代吡啶甲醛为底物经过羟醛缩合和亲核取代[12]两步反应, 得到最终产物5a~5m (Scheme 1).合成步骤操作步骤简单, 原料易得.化合物最终都通过1H NMR, 13C NMR和HRMS进行了结构确证.
首先对于化合物5a~5m进行了初步的抗菌活性评价, 参照美国临床和实验室标准协会 (CLSI) M07-A9标准, 选取标准菌株革兰氏阳性菌金黄色葡萄球菌 (ATCC 29213) 和革兰氏阴性菌大肠埃希菌 (ATCC 25922), 采用微量肉汤法测定化合物的MIC.利奈唑胺 (Line olid) 和美罗培南 (meropenem, MEM) 被选为实验组的阳性对照药物, 实验结果如表 1所示.结果表明化合物5a, 5i, 5j, 5k和5m对于革兰氏阳性菌金黄色葡萄球菌表现出良好的抑制活性, 对于革兰氏阴性菌大肠埃希菌 (ATCC 25922) 于64 μg/mL的浓度下没有抑制作用.间氨基吡啶苯乙酮化合物5i具有较高的抑制金黄色葡萄球菌的生物活性 (MIC为16 μg/mL), 对氨基吡啶苯乙酮衍生物5a, 5j, 5k和5m也显示出对于金黄色葡萄球菌 (ATCC 29213) 良好的抑菌效力 (MIC为32 μg/mL).然而, 化合物5b~5h和5l却显示对于金黄色葡萄球菌没有抑制活性 (其MIC值都>64 μg/mL).初步活性结果表明, 该系列吡啶查尔酮衍生物对革兰氏阳性菌比革兰氏阴性菌表现出更强的抑制效力.
化合物 临床敏感菌株 ATCC 29213 ATCC 25922 5a 32 >64 5b >64 >64 5c >64 >64 5d >64 >64 5e >64 >64 5f >64 >64 5g >64 >64 5h >64 >64 5i 16 >64 5j 32 >64 5k 32 >64 5l >64 >64 5m 32 >64 利奈唑胺b 2 —c 美罗培南b —c <0.125 a能抑制培养基内病原菌生长的最低药物浓度; b阳性对照药物; c未测. 表 1 化合物5a~5m的最小抑菌浓度 (μg/mL)a
Table 1. MIC data (μg/mL) of compounds 5a~5m在初筛的基础上, 又选取了11株无重复的耐甲氧西林金黄色葡萄球菌 (MRSA) 临床株, 对化合物5a, 5i, 5j, 5k和5m进行了进一步的药效学评价, 结果如表 2所示.化合物5a, 5i, 5j, 5k和5m都表现出较好的抑菌 (MRSA) 活性.令人兴奋的是, 相对于标准菌株金黄色葡萄球菌 (ATCC 29213), 这5个化合物对MRSA显示出更好的抑制活性, 这5个化合物的MIC50 (8~16 μg/mL) 和MIC90 (16~32 μg/mL) 都表明了对于MRSA的良好抑菌作用, 尤其是化合物5k.化合物5a, 5i, 5k和5m对于部分MRSA的抗菌的活性要优于临床常用的抗菌药物左氧氟沙星和红霉素, 但是弱于临床药物利奈唑胺.而化合物5k对于菌株 (MRSA) 的抑菌效果 (MIC50为8 μg/mL) 与利奈唑胺相当 (MIC50为4 μg/mL).
 表 2
化合物5a, 5i, 5j, 5k和5m最小抑菌浓度 (MIC) 的测定和MIC50, MIC90结果 (μg/mL)
Table 2.
MIC, MIC50, MIC90 data (μg/mL) of compounds 5a, 5i, 5j, 5k and 5m
表 2
化合物5a, 5i, 5j, 5k和5m最小抑菌浓度 (MIC) 的测定和MIC50, MIC90结果 (μg/mL)
Table 2.
MIC, MIC50, MIC90 data (μg/mL) of compounds 5a, 5i, 5j, 5k and 5m
化合物 MIC (MRSA) MIC50a MIC90b 1c 2c 3c 4c 5c 6c 7c 8c 9c 10c 11c 5a 16 16 16 16 16 16 16 16 16 16 32 16 16 5i 16 16 16 8 64 16 32 32 16 16 32 16 32 5j >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 5k 8 8 8 4 16 8 16 8 8 8 16 8 16 5m 16 16 16 8 32 16 16 8 8 16 16 16 16 左氧氟沙星d >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 0.25 >64 >64 红霉素d 4 2 0.5 >64 >64 >64 >64 >64 >64 >64 0.25 >64 >64 利奈唑胺d 4 4 1 2 4 4 4 4 4 4 2 4 4 a在一批实验中能抑制50%数目的菌株生长的MIC; b在一批实验中能抑制90%数目的菌株生长的MIC; c耐甲氧西林金黄色葡萄球菌临床分离株的编号; d阳性对照药物. 表 2 化合物5a, 5i, 5j, 5k和5m最小抑菌浓度 (MIC) 的测定和MIC50, MIC90结果 (μg/mL)
Table 2. MIC, MIC50, MIC90 data (μg/mL) of compounds 5a, 5i, 5j, 5k and 5m分析不同的化合物结构对金黄色葡萄球菌抑制活性的影响, 化合物5a, 5j, 5k, 5i和5m都是由对氨基吡啶苯乙酮为底物衍生得到, 相对邻位氨基和间位氨基取代的吡啶苯乙酮, 对位氨基吡啶苯乙酮衍生物具有更好的抑制MRSA的活性.从化合物5a对金黄色葡萄球菌的抑制活性优于化合物5b~5g中可以看出, 增加碳链长度和利用卤素原子取代的邻位吡啶甲醛对抗菌活性并没有任何改善.通过对化合物5a, 5l和5m的结构活性分析比较可以看出, 邻位吡啶甲醛衍生物较对位吡啶甲醛和间位吡啶甲醛衍生物具有更好的抑制金黄色葡萄球菌生物活性的潜力.对作用于MRSA的活性结果分析, 临床常用抗菌药物左氧氟沙星仅对编号为11的菌株有效, 红霉素仅对编号为1, 2, 3和11号菌株有效; 化合物5a和5i对于MRSA的抗菌结果表明, 芳环上氨基取代的位置对于其MIC几乎没有影响; 由化合物5j, 5k, 5m对于MRSA的抑菌结果分析可得, 当末端为甲基时, 化合物5j不存在抵抗MRSA的效力, 然而当末端为亚甲基溴存在的情况下, 化合物5k很大程度的提高了抵抗MRSA的抗菌效力, 并且MIC值最小可以达到4 μg/mL.
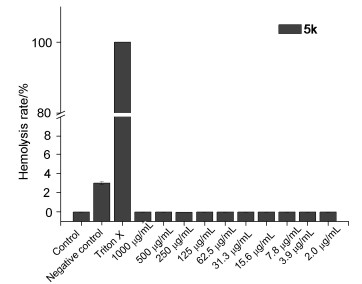
为了初步测试该类化合物的毒性, 我们对化合物5k用红细胞溶血法进行体外毒性评价, 溶血活性结果如图 2所示.当化合物5k的浓度在2 μg/mL到1000 μg/mL之间, 其对红细胞毒性很小.即使化合物5k在远大于其MIC的浓度1000 μg/mL时, 依然只能导致大约1%的红细胞发生溶血.实验结果证实, 化合物5k对血红细胞毒性很低, 表明化合物5k有一个广泛的安全范围.
2 结论
合成了一系列的吡啶查尔酮衍生物, 并对其体外生物活性进行了测定, 发现部分化合物具有抑制临床耐药菌株MRSA的药理学活性.活性实验结果表明化合物5a, 5i, 5j, 5k和5m对革兰氏阳性细菌具有较好的抑制活性, 该系列化合物在64 μg/mL浓度下对于革兰氏阴性细菌不存在抑菌活性.此外, 化合物5a, 5i, 5j, 5k和5m在对11株临床分离的耐药菌株MRSA的抑制活性数据显示, 它们中的大多数表现出具有比阳性对照药物 (左氧氟沙星和红霉素) 更好的抗菌活性.其中, 化合物5k对临床分离的11株MRSA的MIC50可以达到8 μg/mL, 比阳性对照利奈唑胺稍差.化合物5k的红细胞毒性数据显示, 该化合物即使在浓度为1000 μg/mL的条件下, 也几乎不存在红细胞毒性, 这就表明其安全窗口远大于其最低抑菌浓度 (MIC), 这使得其具备作为抗MRSA抑制剂进一步研究的潜力.
3 实验部分
3.1 仪器与试剂
核磁共振仪 (Bruker DPX400), 质谱仪 (Waters-Mi-cromass公司Q-Tof质谱仪), 旋转蒸发仪 (东京理化), 实验所用柱层析硅胶及薄层层析硅胶板购自青岛海洋化工厂.所用试剂均为国产或进口分析纯, 无水溶剂用常规方法干燥处理.
3.2 实验方法
3.3 生物活性评价
3.2.11 (E)-{4-[3-(5-溴-2-吡啶基) 丙烯酰基]-2-氯苯基}乙酰胺 (5c) 的合成
操作同5a的合成, 产物为淡黄色固体, 收率为75%. m.p. 226~227 ℃; 1H NMR (400 MH, DMSO-d6)δ: 10.70 (s, 1H), 8.81 (d, J=2.2 H, 1H), 8.22~8.10 (m, 4H), 7.92 (d, J=8.4 H, 1H), 7.80 (d, J=8.7 H, 2H), 7.69 (d, J=15.4 H, 1H), 4.33 (s, 2H); 13C NMR (101 MH, DMSO-d6)δ: 187.62, 165.24, 151.71, 150.72, 143.10, 141.25, 139.74, 132.40, 130.01, 126.28, 125.69, 121.21, 118.85, 43.59. HRMS (ESI) calcd for C16H13BrClN2O2 [M+H]+: 378.9849, found 378.9850.
3.2.18 (E)-N-{4-[3-(2-吡啶基) 丙烯酰基]苯基}乙酰胺 (5j) 的合成
操作同5a的合成, 产物为淡黄色固体, 收率为84%. m.p. 183~184 ℃; 1H NMR (400 MH, CDCl3)δ: 8.69 (s, 1H), 8.10 (t, J=11.2 H, 3H), 7.98 (s, 1H), 7.73 (dd, J=33.0, 11.1 H, 4H), 7.48 (d, J=7.3 H, 1H), 7.30 (d, J=6.0 H, 1H), 2.22 (s, 3H); 13C NMR (101 MH, CDCl3) δ: 189.02, 168.74, 153.22, 150.14, 142.54, 142.49, 136.99, 133.40, 130.24, 125.45, 125.40, 124.46, 118.98, 24.77.HRMS (ESI) calcd for C16H15N2O2[M+H]+: 267.1134, found 267.1132.
3.2.12 (E)-{4-[3-(6-溴-2-吡啶基) 丙烯酰基]-2-氯苯基}乙酰胺 (5d) 的合成
操作同5a的合成, 产物为淡黄色固体, 收率为73%. m.p. 225~226 ℃; 1H NMR (400 MH, DMSO-d6)δ: 10.73 (s, 1H), 8.13 (d, J=8.6 H, 2H), 8.08 (d, J=15.4 H, 1H), 7.96 (d, J=7.5 H, 1H), 7.87 (t, J=7.7 H, 1H), 7.81 (d, J=8.6 H, 2H), 7.69 (d, J=7.8 H, 1H), 7.64 (d, J=15.4 H, 1H), 4.33 (s, 2H); 13C NMR (101 MH, DMSO-d6) δ: 187.59, 165.27, 154.27, 143.18, 141.66, 140.62, 140.46, 132.31, 130.08, 128.96, 126.29, 124.33, 118.88, 43.62. HRMS (ESI) calcd for C16H13BrClN2O2 [M+H]+: 378.9849, found 378.9850.
3.2.3 (E)-2-氨基-(2-吡啶基) 苯丙烯酮 (3c) 的合成
操作同3a的合成, 产物为黄色固体, 收率为68%. 1H NMR (400 MH, DMSO-d6) δ: 8.68 (d, J=4.7 H, 1H), 8.20 (d, J=15.3 H, 1H), 7.97 (dd, J=8.2, 1.0 H, 1H), 7.89 (d, J=3.5 H, 2H), 7.63 (d, J=15.3 H, 1H), 7.51~7.36 (m, 3H), 7.36~7.24 (m, 1H), 6.83 (d, J=7.7 H, 1H), 6.64~6.55 (m, 1H); 13C NMR (101 MH, DMSO-d6) δ: 190.40, 153.18, 152.12, 149.90, 140.99, 137.09, 134.51, 131.19, 126.52, 124.42, 124.38, 117.22, 116.97, 114.56.
3.2.6 (E)-4-氨基-(3-氟-2-吡啶基) 苯丙烯酮 (3f) 的合成
操作同3a的合成, 产物为黄色固体, 收率为58%. 1H NMR (400 MH, DMSO-d6) δ: 8.55 (d, J=4.5 H, 1H), 8.16 (d, J=15.3 H, 1H), 7.90~7.71 (m, 4H), 7.55 (dt, J=8.6, 4.4 H, 1H), 6.66 (d, J=8.7 H, 2H), 6.29 (s, 2H); 13C NMR (101 MH, DMSO-d6) δ: 185.31, 157.85, 154.29, 146.12, 141.09, 131.64, 131.16, 126.91, 126.51, 124.81, 124.34, 112.90.
3.2.20 (E)-2-氯-N-{4-[3-(吡啶-3-基) 丙烯酰基]苯基}乙酰胺 (5l) 的合成
操作同5a的合成, 产物为黄色固体, 收率为85%. m.p. 242~243 ℃; 1H NMR (400 MH, DMSO-d6)δ: 10.71 (s, 1H), 9.03 (d, J=1.3 H, 1H), 8.62 (d, J=3.8 H, 1H), 8.36 (d, J=8.0 H, 1H), 8.21 (d, J=8.7 H, 2H), 8.10 (d, J=15.7 H, 1H), 7.78 (dd, J=14.9, 12.3 H, 3H), 7.51 (dd, J=7.9, 4.8 H, 1H), 4.34 (s, 2H); 13C NMR (101 MH, DMSO-d6) δ: 187.32, 165.25, 150.92, 150.30, 143.02, 140.06, 135.06, 132.53, 130.57, 130.09, 123.90, 123.78, 118.74, 43.61. HRMS (ESI) calcd for C16H14Cl-N2O2[M+H]+: 301.0744, found 301.0742.
3.2.5 (E)-3-氨基-(4-吡啶基) 苯丙烯酮 (3e) 的合成
操作同3a的合成, 产物为黄色固体, 收率为62%. 1H NMR (400 MH, DMSO-d6) δ: 8.65 (d, J=5.4 H, 2H), 8.09 (d, J=15.6 H, 1H), 7.96 (d, J=8.7 H, 2H), 7.80 (d, J=5.9 H, 2H), 7.56 (d, J=15.6 H, 1H), 6.65 (d, J=8.7 H, 2H), 6.26 (s, 2H); 13C NMR (101 MH, DMSO-d6) δ: 185.46, 154.24, 150.23, 142.31, 138.47, 131.40, 126.84, 124.87, 122.29, 112.75.
3.2.8 (E)-4-氨基-(6-溴-2-吡啶基) 苯丙烯酮 (3h) 的合成
操作同3a的合成, 产物为黄色固体, 收率为74%. 1H NMR (400 MH, CDCl3) δ: 8.11 (d, J=15.1 H, 1H), 7.99 (d, J=8.6 H, 2H), 7.67~7.52 (m, 2H), 7.45 (d, J=7.8 H, 1H), 7.37 (d, J=7.4 H, 1H), 6.70 (d, J=8.6 H, 2H), 4.24 (s, 2H); 13C NMR (101 MH, CDCl3) δ: 187.65, 154.91, 151.49, 142.58, 139.24, 139.02, 131.50, 128.41, 128.11, 127.15, 123.90, 113.94.
3.2.19 (E)-2-溴-N-{4-[3-(2-吡啶基) 丙烯酰基]苯基}乙酰胺 (5k) 的合成
操作同5a的合成, 产物为黄色固体, 收率为84%. m.p. 185~186 ℃; 1H NMR (400 MH, DMSO-d6)δ: 10.80 (s, 1H), 8.70 (d, J=3.6 H, 1H), 8.16 (t, J=11.4 H, 4H), 7.92 (d, J=3.2 H, 3H), 7.81 (d, J=8.2 H, 2H), 7.72 (d, J=15.4 H, 1H), 7.45 (d, J=4.1 H, 1H), 4.11 (s, 2H); 13C NMR (101 MH, DMSO-d6)δ: 187.79, 165.42, 152.77, 149.93, 143.14, 142.49, 137.26, 132.53, 129.98, 125.06, 124.92, 124.78, 118.78, 30.29. HRMS (ESI) calcd for C16H14BrN2O2[M+H]+: 345.0239, found 345.0239.
3.2.16 (E)-2-氯-N-{2-[3-(2-吡啶基) 丙烯酰基]苯基}乙酰胺 (5h) 的合成
操作同5a的合成, 产物为黄色固体, 收率为79%. m.p. 157~158 ℃; 1H NMR (400 MH, CDCl3)δ: 12.43 (s, 1H), 8.72 (dd, J=12.7, 6.3 H, 2H), 8.18 (dd, J=20.0, 11.3 H, 2H), 7.84~7.73 (m, 2H), 7.62 (t, J=7.9 H, 1H), 7.48 (d, J=7.7 H, 1H), 7.33 (dd, J=7.2, 4.9 H, 1H), 7.29~7.21 (m, 2H), 4.23 (s, 2H); 13C NMR (101 MH, CDCl3) δ: 193.32, 165.66, 152.76, 150.24, 143.62, 140.01, 137.05, 134.92, 131.24, 126.29, 125.85, 124.73, 123.87, 123.52, 121.09, 43.30. HRMS (ESI) calcd for C16H14Cl-N2O2[M+H]+: 301.0744, found 301.0746.
3.2.13 (E)-3-氯-N-{4-[3-(2-吡啶基) 丙烯酰基]苯基}丙酰胺 (5e) 的合成
操作同5a的合成, 产物为黄色固体, 收率为78%. m.p. 74~75 ℃; 1H NMR (400 MH, CDCl3)δ: 8.62 (d, J=3.9 H, 1H), 8.15 (s, 1H), 8.02 (dd, J=11.9, 10.7 H, 3H), 7.74~7.59 (m, 4H), 7.41 (d, J=7.7 H, 1H), 7.28~7.21 (m, 1H), 3.81 (t, J=6.4 H, 2H), 2.81 (t, J=6.4 H, 2H); 13C NMR (101 MH, CDCl3) δ: 189.08, 168.25, 153.13, 150.10, 142.56, 142.15, 137.07, 133.63, 130.25, 125.53, 125.39, 124.54, 119.26, 40.49, 39.64. HRMS (ESI) calcd for C17H16ClN2O2 [M+H]+: 315.0900, found 315.0898.
3.2.4 (E)-3-氨基-(3-吡啶基) 苯丙烯酮 (3d) 的合成
操作同3a的合成, 产物为黄色固体, 收率为72%. 1H NMR (400 MH, DMSO-d6) δ: 8.99 (d, J=1.8 H, 1H), 8.59 (dd, J=4.7, 1.4 H, 1H), 8.32 (d, J=8.0 H, 1H), 7.99 (dd, J=23.1, 12.0 H, 3H), 7.65 (d, J=15.6 H, 1H), 7.48 (dd, J=7.8, 4.9 H, 1H), 6.65 (d, J=8.4 H, 2H), 6.22 (s, 2H); 13C NMR (101 MH, DMSO-d6) δ: 130.95, 125.05, 124.35, 123.82, 112.72.
3.2.2 (E)-3-氨基-(2-吡啶基) 苯丙烯酮 (3b) 的合成
操作同3a的合成, 产物为黄色固体, 收率为64%. 1H NMR (400 MH, CDCl3) δ: 8.68 (d, J=4.0 H, 1H), 8.06 (d, J=15.3 H, 1H), 7.78~7.70 (m, 2H), 7.47 (dd, J=7.7, 4.1 H, 2H), 7.40~7.36 (m, 1H), 7.29 (t, J=3.4 H, 1H), 7.25 (s, 1H), 6.90 (dd, J=7.9, 2.3 H, 1H), 3.87 (s, 2H); 13C NMR (101 MH, CDCl3) δ: 190.58, 153.29, 150.13, 146.86, 142.45, 138.90, 136.86, 129.49, 125.81, 125.32, 124.33, 119.68, 119.13, 114.51.
3.2.10 (E)-2-氯-N-{4-[3-(3-氟吡啶-2-基) 丙烯酰基]苯基}乙酰胺 (5b) 的合成
操作同5a的合成, 产物为淡黄色固体, 收率为78%. m.p. 157~158 ℃; 1H NMR (400 MH, CDCl3)δ: 8.43 (d, J=4.4 H, 1H), 8.39 (s, 1H), 8.10 (dd, J=24.8, 12.0 H, 3H), 7.98 (dd, J=15.3, 1.1 H, 1H), 7.66 (d, J=8.7 H, 2H), 7.48~7.33 (m, 1H), 7.28 (dt, J=8.5, 4.3 H, 1H), 4.16 (s, 2H); 13C NMR (101 MH, CDCl3) δ: 188.57, 164.04, 158.58, 145.75, 141.89 141.04, 134.69, 134.30, 130.27, 126.46, 125.95, 123.93, 119.39, 42.89. HRMS (ESI) calcd for C16H13ClFN2O2[M+H]+: 319.0650, found 319.0648.
3.2.1 (E)-4-氨基-(2-吡啶基) 苯丙烯酮 (3a) 的合成
取氢氧化钠 (370 mg, 9.25 mmol) 于单口圆底烧瓶 (250 mL) 中, 加入水 (50 mL), 室温搅拌下溶解; 然后将对氨基苯乙酮 (1a) (1.00 g, 7.40 mmol) 和2-吡啶甲醛 (2a) (722 μL, 7.58 mmol) 加入100 mL锥形瓶内, 加入乙醇 (50 mL) 超声至该体系基本澄清, 然后将该澄清溶液恒压滴加 (1滴/s) 到上述氢氧化钠溶液的单口瓶内, 滴加完毕后室温下继续反应.约6 h后, 薄层色谱 (TLC) 检测[V(石油醚):V(乙酸乙酯)=1:1]显示反应完全.停止反应, 将反应体系倒入冰水 (50 mL) 中, 析出大量黄色固体, 抽滤, 滤饼水洗至中性, 真空干燥, 得到亮黄色固体化合物3a (1.48 g), 收率为89%. 1H NMR (400 MH, DMSO-d6) δ: 8.68 (d, J=4.7 H, 1H), 8.13 (d, J=15.4 H, 1H), 7.95~7.84 (m, 4H), 7.63 (d, J=15.4 H, 1H), 7.45~7.38 (m, 1H), 6.66 (d, J=8.6 H, 2H), 6.25 (s, 2H); 13C NMR (101 MH, DMSO-d6) δ: 185.79, 154.11, 153.32, 149.87, 140.59, 137.07, 131.13, 125.55, 125.05, 124.38, 124.29, 112.82.
3.2.17 (E)-2-氯-N-{3-[3-(2-吡啶基) 丙烯酰基]苯基}乙酰胺 (5i) 的合成
操作同5a的合成, 产物为黄色固体, 收率为65%. m.p. 117~118 ℃; 1H NMR (400 MH, CDCl3)δ: 8.63 (d, J=3.5 H, 1H), 8.36 (s, 1H), 7.99 (t, J=15.4 H, 3H), 7.83 (d, J=7.5 H, 1H), 7.70 (dd, J=20.0, 11.5 H, 2H), 7.44 (dd, J=13.8, 7.4 H, 2H), 7.28~7.21 (m, 1H), 4.16 (s, 2H); 13C NMR (101 MH, CDCl3) δ: 189.78, 164.21, 153.01, 150.19, 143.25, 138.64, 137.32, 137.01, 129.64, 125.58, 125.42, 125.27, 124.73, 124.61, 120.04, 42.88. HRMS (ESI) calcd for C16H14ClN2O2[M+H]+: 301.0744, found 301.0747.
3.2.21 (E)-2-氯-N-{4-[3-(吡啶基) 丙烯酰基]苯基}乙酰胺 (5m) 的合成
操作同5a的合成, 产物为黄色固体, 收率为87%. m.p. 224~225 ℃; 1H NMR (400 MH, DMSO-d6)δ: 10.76 (s, 1H), 10.76 (s, 1H), 8.67 (d, J=4.9 H, 2H), 8.20 (d, J=8.6 H, 2H), 8.16 (d, J=15.9 H, 1H), 7.84 (d, J=5.0 H, 2H), 7.80 (d, J=8.5 H, 2H), 7.66 (d, J=15.7 H, 1H), 4.33 (s, 2H); 13C NMR (101 MH, DMSO-d6) δ: 187.46, 165.28, 150.31, 143.20, 141.88, 140.54, 132.31, 130.21, 126.27, 122.48, 118.76, 43.61. HRMS (ESI) calcd for C16H14ClN2O2 [M+H]+: 301.0744, found 301.0743.
3.2.15 (E)-5-氯-N-{4-[3-(2-吡啶基) 丙烯酰基]苯基}戊酰胺 (5g) 的合成
操作同5a的合成, 产物为黄色固体, 收率为72%. m.p. 67~68 ℃; 1H NMR (400 MH, CDCl3)δ: 8.68 (d, J=4.0 H, 1H), 8.17~7.91 (m, 4H), 7.82~7.62 (m, 4H), 7.47 (d, J=7.7 H, 1H), 7.30 (dd, J=7.0, 5.1 H, 1H), 3.56 (d, J=5.3 H, 2H), 2.44 (t, J=6.6 H, 2H), 1.86 (s, 4H); 13C NMR (101 MH, CDCl3) δ: 188.00, 170.13, 152.14, 149.10, 141.48, 136.01, 132.33, 129.24, 124.46, 124.36, 123.48, 118.01, 43.54, 35.66, 30.81, 21.60. HRMS (ESI) calcd for C19H20ClN2O2[M+H]+: 343.1213, found 343.1216.
3.2.9 (E)-2-氯-N-{4-[3-(2-吡啶基) 丙烯酰基]苯基}乙酰胺 (5a) 的合成
取上述化合物3a (100 mg, 0.446 mmol) 和碳酸钾 (74 mg, 0.535 mmol) 于单口圆底烧瓶 (5 mL), 然后加入丙酮 (1.35 mL), 室温下搅拌; 然后用1mL注射器向反应体系注入化合物4 (40.3 μL, 0.535 mmol), 体系由原来的橙色浑浊变为黄色浑浊.约0.5 h后, TLC [V(石油醚):V(乙酸乙酯)=1:1]检测, 显示反应完全, 加入3 mL冰水淬灭反应, 搅拌10 min后, 将体系抽滤, 滤饼冰水洗至中性, 真空干燥得到化合物5a (119 mg), 5a为浅棕色固体, 收率为79%. m.p. 137~138 ℃; 1H NMR (400 MH, CDCl3)δ: 8.70 (d, J=3.9 H, 1H), 8.51 (s, 1H), 8.18~8.08 (m, 3H), 7.82~7.68 (m, 4H), 7.48 (d, J=7.7 H, 1H), 7.31 (ddd, J=7.6, 4.8, 0.9 H, 1H), 4.23 (s, 2H); 13C NMR (101 MH, CDCl3) δ: 188.86, 164.07, 153.11, 150.13, 142.66, 141.01, 136.98, 134.34, 130.22, 125.52, 125.23, 124.49, 119.37, 42.89. HRMS (ESI) calcd for C16H14ClN2O2 [M+H]+: 301.0744, found 301.0744.
3.2.7 (E)-4-氨基-(5-溴-2-吡啶基) 苯丙烯酮 (3g) 的合成
操作同3a的合成, 产物为黄色固体, 收率为78%. 1H NMR (400 MH, CDCl3) δ: 8.71 (d, J=2.3 H, 1H), 8.10 (d, J=15.2 H, 1H), 7.99 (d, J=8.7 H, 2H), 7.85 (dd, J=8.3, 2.4 H, 1H), 7.67 (d, J=15.2 H, 1H), 7.34 (d, J=8.3 H, 1H), 6.70 (d, J=8.7 H, 2H), 4.22 (s, 2H); 13C NMR (101 MH, CDCl3) δ: 187.74, 152.12, 151.45, 151.22, 139.81, 139.36, 131.42, 128.19, 126.33, 126.04, 121.14, 113.94.
3.2.14 (E)-4-氯-N-{4-[3-(2-吡啶基) 丙烯酰基]苯基}丁酰胺 (5f) 的合成
操作同5a的合成, 产物为黄色固体, 收率为78%. m.p. 155~156 ℃; 1H NMR (400 MH, CDCl3)δ: 8.69 (d, J=4.1 H, 1H), 8.11 (t, J=12.4 H, 3H), 7.99 (s, 1H), 7.82~7.66 (m, 4H), 7.48 (d, J=7.7 H, 1H), 7.31 (dd, J=7.1, 5.1 H, 1H), 3.66 (t, J=6.1 H, 2H), 2.62 (t, J=7.0 H, 2H), 2.25~2.15 (m, 2H); 13C NMR (101 MH, CDCl3) δ: 188.99, 170.44, 153.15, 150.10, 142.48, 142.40, 137.04, 133.44, 130.27, 125.50, 125.40, 124.49, 119.04, 44.37, 34.19, 27.70. HRMS (ESI) calcd for C18H18ClN2O2[M+H]+: 329.1057, found 329.1056.
3.3.2 微量肉汤法测定最小抑菌浓度
选择革兰氏阳性的金黄色葡萄球菌 (ATCC 29213) 革兰氏阴性的大肠埃希菌 (ATCC 25922) 为评价对象, 实验操作如下[22]:参照美国CLSI M07-A9标准中规定的微量肉汤稀释法测定化合物5a~5m的最小抑菌浓度 (MIC) 值, 分别以空白肉汤和待测菌液为阴性和阳性对照组.使细菌于37 ℃ 250 rpm恒温摇床中培养6 h使其生长至1×108 CFU/mL.用合适的培养基 (ATCC 29213, MRSA为MHB; ATCC 25922为LB) 稀释菌液至105 CFU/mL.所有的待测药物 (5a~5m) 用无菌水溶解为合适浓度的待测储备液于-80 ℃冰箱内储存备用.实验开始, 先将200 μL化合物待测储备液加入96孔板中, 用合适的培养基对其进行梯度稀释.最后, 将100 μL稀释好的105 CFU/mL菌液加入已经梯度稀释好的含药96孔板中. 37 ℃培养16~20 h.读取最小抑菌浓度 (MIC) 结果, 以肉眼观察所能完全抑制细菌生长的浓度判定为该待测化合物的MIC.
3.3.1 实验仪器与材料
超纯水仪 (Thermo); 生物安全柜HR40-HA2(青岛海耳公司); 恒温摇床ZMY-1102C (河南超继仪器设备公司); 微量可调节加样器 (德国Eeppendorf); 自动立式压力蒸汽灭菌器MJ-78A型 (河南超继仪器设备公司); 96孔细胞培养板 (NEST); -20 ℃冰箱BCD-232型 (伊莱克斯); -80 ℃超低温冰箱 (德国Thermo Scientific Inc.); 米勒-海顿 (MHA) 琼脂培养基, 米勒-海顿 (MHB) 肉汤培养基, 卢里亚-贝尔塔尼 (LB) 培养基均产自北京奥博星生物技术有限责任公司.
3.3.3 红细胞溶血率测定
采用新鲜脱纤维无菌羊血分离得到的红细胞 (Red blood cells, RBCs), 将无菌羊血用磷酸缓冲盐溶液 (PBS) 重悬后配置为红细胞悬液 (5%), 向96孔板中加入150 μL的5%的红细胞悬液, 随后加入50 μL稀释好的待测化合物, 阴性对照和阳性对照分别为50 μL PBS溶液和0.1%的曲拉通X-100.将96孔板放入37 ℃恒温培养箱孵育1 h.孵育结束后, 将96孔板3500 r/min离心5 min.吸出100 μL上清至另一干净的96孔板中, 于酶标仪540 nm波长处测其OD值.红细胞溶血率 (%)=(A-A0)/(Atotal-A0)×100%. A为待测药物的吸光度, A0为阴性对照组吸光度, Atotal为用曲拉通X-100处理后全溶血的阳性对照组的吸光度[23].
辅助材料 (Supporting Information)化合物3a~3h和5a~5m的核磁氢谱和核磁碳谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
Jevons, M. P. Br. Med. J. 1961, 1, 124.
-
[2]
Hamilton, G. L. A. Lab. Med. 2010, 41, 329. doi: 10.1309/LM7Z99UPDZSXFJUZ
-
[3]
Deurenberg, R. H.; Nulens, E.; Valvatne, H.; Sebastian, S.; Driessen, C.; Craeghs, J.; De Brauwer, E.; Heising, B.; Kraat, Y. J.; Riebe, J.; Stals, F. S.; Trienekens, T. A.; Scheres, J.; Friedrich, A. W.; van Tiel, F. H.; Beisser, P. S.; Stobberingh, E. E. Emerging Infect. Dis. 2009, 15, 727. doi: 10.3201/eid1505.071618
-
[4]
Kallen, A. J.; Mu, Y.; Bulens, S.; Reingold, A.; Petit, S.; Gershman, K.; Ray, S. M.; Harrison, L. H.; Lynfield, R.; Dumyati, G. JAMA, J. Am. Med. Assoc. 2010, 304, 641. doi: 10.1001/jama.2010.1115
-
[5]
Fridkin, S. K.; Hageman, J. C.; Morrison, M.; Sanza, L. T.; Como-Sabetti, K.; Jernigan, J. A.; Harriman, K.; Harrison, L. H.; Lynfield, R.; Farley, M. M. N. Engl. J. Med. 2005, 352, 1436. doi: 10.1056/NEJMoa043252
-
[6]
Cardo, D.; Horan, T.; Andrus, M.; Dembinski, M.; Edwards, J.; Peavy, G.; Tolson, J.; Wagner, D. Am. J. Infect. Control. 2004, 32, 470. doi: 10.1016/j.ajic.2004.10.001
-
[7]
Fridkin, S. K.; Yokoe, D. S.; Whitney, C. G.; Onderdonk, A.; Hooper, D. C. J. Clin. Microbiol. 1998, 36, 965.
-
[8]
Rybak, M. J.; Abate, B. J.; Kang, S. L.; Ruffing, M. J.; Lerner, S. A.; Drusano, G. L. Antimicrob. Agents Chemother. 1999, 43, 1549.
-
[9]
Nowakowska, Z. Eur. J. Med. Chem. 2007, 42, 125. doi: 10.1016/j.ejmech.2006.09.019
-
[10]
Magiorakos, A. P.; Srinivasan, A.; Carey, R. B.; Carmeli, Y.; Falagas, M. E.; Giske, C. G.; Harbarth, S.; Hindler, J. F.; Kahlmeter, G.; Olsson-Liljequist, B.; Paterson, D. L.; Rice, L. B.; Stelling, J.; Struelens, M. J.; Vatopoulos, A.; Weber, J. T.; Monnet, D. L. Clin. Microbiol. Infect. 2012, 18, 268. doi: 10.1111/j.1469-0691.2011.03570.x
-
[11]
Kluytmans, J.; Van Belkum, A.; Verbrugh, H. Clin. Microbiol. Rev. 1997, 10, 505.
-
[12]
Patel, R. V.; Patel, P. K.; Kumari, P.; Rajani, D. P.; Chikhalia, K. H. Eur. J. Med. Chem. 2012, 53, 41. doi: 10.1016/j.ejmech.2012.03.033
-
[13]
Chen, Z.-H.; Zheng, C.-J.; Sun, L.-P.; Piao, H.-R. Eur. J. Med. Chem. 2010, 45, 5739. doi: 10.1016/j.ejmech.2010.09.031
-
[14]
Klevens, R. M.; Morrison, M. A.; Nadle, J.; Petit, S.; Gershman, K.; Ray, S.; Harrison, L. H.; Lynfield, R.; Dumyati, G.; Townes, J. M. JAMA, J. Am. Med. Assoc. 2007, 298, 1763. doi: 10.1001/jama.298.15.1763
-
[15]
Zhang, Q.-R.; Xue, D.-Q.; He, P.; Shao, K.-P.; Chen, P.-J.; Gu, Y.-F.; Ren, J.-L.; Shan, L.-H.; Liu, H.-M. Bioorg. Med. Chem. Lett. 2014, 24, 1236. doi: 10.1016/j.bmcl.2013.12.010
-
[16]
Chen, P.-J.; Yang, A.; Gu, Y.-F.; Zhang, X.-S.; Shao, K.-P.; Xue, D.-Q.; He, P.; Jiang, T.-F.; Zhang, Q.-R.; Liu, H.-M. Bioorg. Med. Chem. Lett. 2014, 24, 2741. doi: 10.1016/j.bmcl.2014.04.037
-
[17]
Nielsen, S. F.; Larsen, M.; Boesen, T.; Schønning, K.; Kromann, H. J. Med. Chem. 2005, 48, 2667. doi: 10.1021/jm049424k
-
[18]
Stringer, J. R.; Bowman, M. D.; Weisblum, B.; Blackwell, H. E. ACS Comb. Sci. 2011, 13, 175. doi: 10.1021/co100053p
-
[19]
Joshi, A. S.; Li, X. C.; Nimrod, A. C.; ElSohly, H. N.; Walker, L. A.; Clark, A. M. Planta Med. 2001, 67, 186. doi: 10.1055/s-2001-11517
-
[20]
Fu, D.-J.; Zhang, S.-Y.; Liu, Y.-C.; Yue, X.-X.; Liu, J.-J.; Song, J.; Zhao, R.-H.; Li, F.; Sun, H.-H.; Zhang, Y.-B.; Liu, H.-M. Med. Chem. Commun. 2016, 7, 1664. doi: 10.1039/C6MD00169F
-
[21]
Fu, D.-J.; Zhang, S.-Y.; Liu, Y.-C.; Zhang, L.; Liu, J.-J.; Song, J.; Zhao, R.-H.; Li, F.; Sun, H.-H.; Liu, H.-M.; Zhang, Y.-B. Bioorg. Med. Chem. Lett. 2016, 26, 3918. doi: 10.1016/j.bmcl.2016.07.012
-
[22]
Ling, L. L.; Schneider, T.; Peoples, A. J.; Spoering, A. L.; Engels, I.; Conlon, B. P.; Mueller, A.; Schaberle, T. F.; Hughes, D. E.; Epstein, S.; Jones, M.; Lazarides, L.; Steadman, V. A.; Cohen, D. R.; Felix, C. R.; Fetterman, K. A.; Millett, W. P.; Nitti, A. G.; Zullo, A. M.; Chen, C.; Lewis, K. Nature 2015, 517, 455. doi: 10.1038/nature14098
-
[23]
Ghosh, C.; Manjunath, G. B.; Akkapeddi, P.; Yarlagadda, V.; Hoque, J.; Uppu, D. S.; Konai, M. M.; Haldar, J. J. Med. Chem. 2014, 57, 1428. doi: 10.1021/jm401680a
-
[1]
-
表 1 化合物5a~5m的最小抑菌浓度 (μg/mL)a
Table 1. MIC data (μg/mL) of compounds 5a~5m
化合物 临床敏感菌株 ATCC 29213 ATCC 25922 5a 32 >64 5b >64 >64 5c >64 >64 5d >64 >64 5e >64 >64 5f >64 >64 5g >64 >64 5h >64 >64 5i 16 >64 5j 32 >64 5k 32 >64 5l >64 >64 5m 32 >64 利奈唑胺b 2 —c 美罗培南b —c <0.125 a能抑制培养基内病原菌生长的最低药物浓度; b阳性对照药物; c未测. 表 2 化合物5a, 5i, 5j, 5k和5m最小抑菌浓度 (MIC) 的测定和MIC50, MIC90结果 (μg/mL)
Table 2. MIC, MIC50, MIC90 data (μg/mL) of compounds 5a, 5i, 5j, 5k and 5m
化合物 MIC (MRSA) MIC50a MIC90b 1c 2c 3c 4c 5c 6c 7c 8c 9c 10c 11c 5a 16 16 16 16 16 16 16 16 16 16 32 16 16 5i 16 16 16 8 64 16 32 32 16 16 32 16 32 5j >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 5k 8 8 8 4 16 8 16 8 8 8 16 8 16 5m 16 16 16 8 32 16 16 8 8 16 16 16 16 左氧氟沙星d >64 >64 >64 >64 >64 >64 >64 >64 >64 >64 0.25 >64 >64 红霉素d 4 2 0.5 >64 >64 >64 >64 >64 >64 >64 0.25 >64 >64 利奈唑胺d 4 4 1 2 4 4 4 4 4 4 2 4 4 a在一批实验中能抑制50%数目的菌株生长的MIC; b在一批实验中能抑制90%数目的菌株生长的MIC; c耐甲氧西林金黄色葡萄球菌临床分离株的编号; d阳性对照药物. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 9
- 文章访问数: 1774
- HTML全文浏览量: 196


 下载:
下载:


 下载:
下载:

