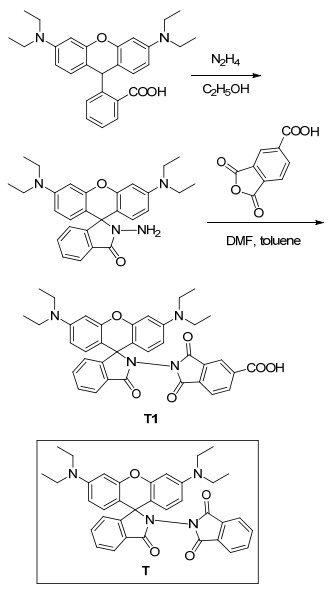
 图 图式 1
探针T1的合成路线和探针T的结构
Figure 图式 1.
Synthetic route of probe T1 and the structure of probe T
图 图式 1
探针T1的合成路线和探针T的结构
Figure 图式 1.
Synthetic route of probe T1 and the structure of probe T

Citation: Gao Yong, Wang Jun, Fu Mei, Chen Hongwei, Fang Mingzhang. A Water-Soluble Rhodamine-Based Fluorescent Probe for Fe3+ and Its Application in Live Cell Imaging[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 617-623. doi: 10.6023/cjoc201610014

水溶性罗丹明基Fe3+荧光探针及其在细胞成像中的应用
English
A Water-Soluble Rhodamine-Based Fluorescent Probe for Fe3+ and Its Application in Live Cell Imaging
-
Key words:
- rhodamine
- / water solubility
- / Fe3+
- / fluorescent probe
- / live cell imaging
-
铁是生命体中重要的微量元素, 广泛地参与多种生命过程, 如细胞代谢[1]、氧代谢、质子转移、酶催化[2~4]、DNA和RNA的合成等[5, 6].铁在人体细胞的生长和发育过程中起着至关重要的作用, 细胞内铁的缺失会导致贫血症、糖尿病、心脏病以及肾脏、大脑和肝脏的损伤[7].哺乳动物细胞中的铁是以二价和三价两种状态存在的[8], 鉴于细胞质属于还原性环境, Fe2+是主要存在形式, 占总铁量的80%~90%[9], Fe3+虽然在细胞中含量较低, 但是其生理功能与Fe2+同样重要.一方面Fe3+与Fe2+的氧化还原反应是多种生理过程的重要步骤[10], 另一方面, 研究表明许多神经变性疾病, 诸如帕金森氏症、阿兹海默病与Fe3+浓度异常直接相关[11, 12], 因此准确检测细胞内Fe3+的浓度和分布具有重要意义.
常用检测Fe3+的方法有原子吸收光谱法[13]、比色法[14]、分光光度法[15~17]和电感耦合等离子体原子发射光谱法 (ICP-AES)[18]等.虽然这些方法能够实现定量检测, 但所需装置昂贵, 检测过程复杂, 而且对生物样品具有破坏性, 无法实现生物活体检测.荧光探针法是Fe3+通过络合或化学反应与荧光探针发生作用, 诱导荧光基团发生结构变化, 进而产生荧光信号响应的分析方法.该方法具有灵敏度高、专一性强、无损伤、快速等优点, 在识别Fe3+, 进而反映生命体内部信息方面具有独特的优势, 与荧光显微镜配合还能实现被检测对象的可视化实时检测[19].因此近年来对于Fe3+荧光探针的研究引起的广泛的关注.
罗丹明具有优异的光物理性质和多种修饰途径[20~23], 在金属离子诱导下会出现内酰胺 (无荧光) 和开环酰胺结构 (荧光) 之间的转化, 这些特质使其成为构建off-on型金属离子荧光探针的理想平台[24].利用罗丹明衍生物设计荧光探针用于检测生命体中的Fe3+是一种简单、高效和经济的方法[25].尽管对Fe3+具有高灵敏性和选择性的罗丹明基荧光探针已被大量报道, 但大多数罗丹明基荧光探针的水溶性较差, 无法在水相或含水量大的体系中工作, 这已成为制约该类探针在生物领域应用的瓶颈[26].
本课题组在对罗丹明基荧光染料研究的基础上[27], 曾经设计合成了一个带有亲水性醚链的水溶性罗丹明基Fe3+荧光探针[28].该研究表明在探针结构中引入亲水性基团是改善探针水溶性的有效手段.但进一步研究显示, 应用该方法时有两个问题需要注意.其一, 细胞体系是含有质膜系统的水相体系, 探针要发挥作用不但要有良好的水溶性还要具备一定的脂溶性, 以便穿过细胞膜.探针的水溶性并不是越强越好, 若其极性太强而可能无法穿过细胞膜.探针的水溶性与脂溶性是辩证的统一, 必须要找到探针水溶性与脂溶性之间的平衡点.其二, 亲水性基团一般都含有N、O、S等可以与金属离子配位的原子, 如何巧妙地引入亲水基团而不干扰探针识别基团的工作, 保证探针的选择性和灵敏度, 是一个必须要解决的问题.
本文在文献报道的一种性能良好的罗丹明基Fe3+荧光探针T[29]的基础上, 在恰当的位置引入亲水性基团羧基, 设计了一个脂溶性与水溶性平衡的且不影响离子选择性的新型探针T1.该探针通过罗丹明B酰肼与1, 2, 4-苯三酸酐反应合成.探针T1通过引入一个亲水性羧基, 使其可以在DMF/Tris-HCl (V:V=1:9, pH=7.4) 的缓冲体系中, 实现对Fe3+的选择性识别.与探针T相比, 其合成步骤并未增加, 但是水溶性有了明显的提高.探针T1的合成路线及探针T的结构如Scheme 1所示.
1 结果与讨论
1.1 pH对探针T1荧光光谱的影响
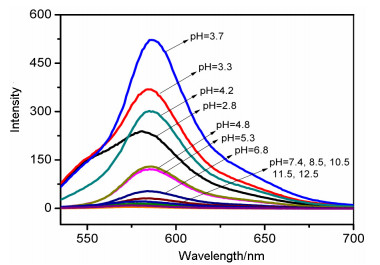
罗丹明基荧光探针对于环境的pH值比较敏感, 因此探究探针在不同pH值下的荧光发射光谱, 可以确定探针适用的pH范围. 图 1是探针T1在pH=2.8~12.4范围内的荧光发射光谱.如图所示, 探针T1在pH≤5.3的酸性环境下, 583 nm处出现荧光, 溶液由无色变为红色, 这说明该探针处于开环状态.探针T1在pH=3.7时荧光强度达到了最大.当pH≥5.3时, 探针T1在500~600 nm间无明显的荧光.考虑到探针最终将用于细胞体系的测试, 以下实验均选择在pH=7.4的DMF/Tris-HCl (V:V=1:9) 中进行.
1.2 探针T1对Fe3+的选择性
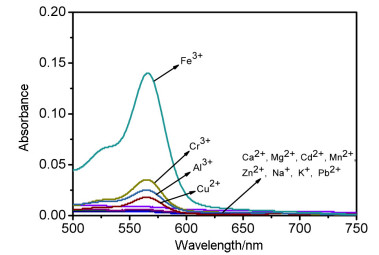
选择性是探针性能的一个重要参数, 在实际应用中能够对识别对象进行高选择性识别对探针至关重要.在T1浓度为50 μmol/L的DMF/Tris-HCl (V:V=1:9, pH=7.4) 体系中, 分别加入K+、Na+、Ca2+、Mg2+、Zn2+、Cd2+、Mn2+、Pb2+、Fe3+、Cu2+、Al3+、Cr3+等阳离子.紫外-可见光谱测试如图 2所示, 探针T1在Fe3+存在时产生明显的可见光谱吸收, 同时Cu2+、Al3+、Cr3+有一定的干扰.
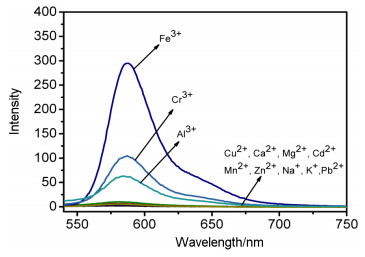
荧光光谱测试如图 3所示, 探针T1中加入铁离子溶液以后, 在586 nm处出现一个强烈的荧光发射带.探针T1仅对Al3+、Cr3+有一定响应, 而对Cu2+则没有明显的响应.此结果表明, 探针T1在上述缓冲体系对Fe3+有良好的选择性, 可以通过荧光光谱的变化来实现对Fe3+的检测.
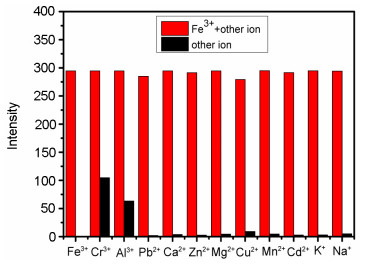
为了进一步探究探针T1对Fe3+的选择的抗干扰性, 在50 μmol/L的T1的DMF/Tris-HCl (V:V=1:9, pH=7.4) 溶液中, 分别加入一定量的K+、Na+、Ca2+、Mg2+、Zn2+、Cd2+、Mn2+、Pb2+、Fe3+、Cu2+、Al3+、Cr3+. 0.5 h之后进行荧光检测, 仅Al3+、Cr3+两样品溶液呈现弱荧光.在各个溶液中加入Fe3+后, 溶液产生强烈的荧光.如图 4所示, 共存离子对T1识别Fe3+未产生明显的干扰, 这表明在干扰离子存在下, 探针T1对Fe3+有良好的选择性.
1.3 紫外和荧光滴定
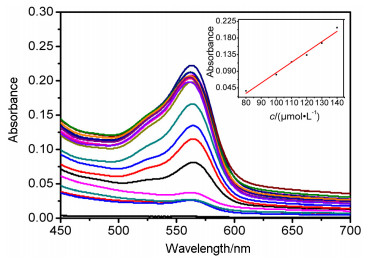
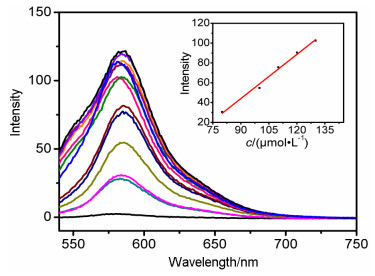
紫外光谱滴定如图 5所示, 随着Fe3+浓度的增加, 在562 nm处出现了一个新的吸收带, 其吸光度达到最大时强度大约增大了250倍.荧光光谱滴定如图 6所示, 当加入Fe3+之后在586 nm处出现了荧光发射带, 随着Fe3+浓度的增加, 荧光强度逐渐增大.当Fe3+超过200 μmol/L, 荧光强度基本不再增加, 紫外滴定实验也是类似情况, 此现象与Li的研究一致[30].如T1的荧光强度随Fe3+浓度变化的线性关系图 (图 6内插图) 所示, Fe3+浓度与荧光强度在80~130 μmol/L区间呈现良好的线性关系 (R2=0.98886).由公式DL=(3Sb1-I)/S求得[31], Fe3+的检测限为2.4 μmol/L, 这表明在此工作条件下探针T1对Fe3+有较高的灵敏度.
1.4 探针与Fe3+的络合方式
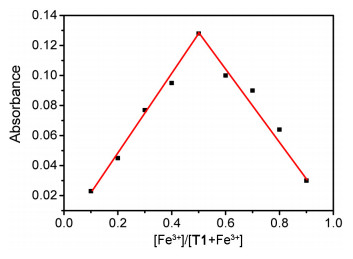
为了确定探针化合物T1和Fe3+之间的络合比, 绘制了探针T1与Fe3+的Job-plot工作曲线.固定探针T1与Fe3+的总浓度为100 μmol/L, 依次调节探针与Fe3+离子的浓度比分别为10:0、9:1、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9, 测试探针T1在不同的比例中, 562 nm处的吸光度值.如图 7所示, 当探针T1的摩尔分数达0.5时, 出现了最大吸光度值, 这表明T1与Fe3+之间的络和比为1:1.
1.5 探针对Fe3+的可逆性测试
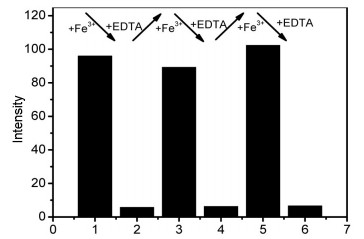
乙二胺四乙酸 (EDTA) 作为掩蔽剂常被用于研究探针与金属离子配位过程的可逆性.如图 8所示, 固定探针的浓度为50 μmol/L, 加入100 μmol/L的Fe3+溶液, 荧光强度增加, 显示探针对Fe3+响应.继续加入100 μmol/L EDTA溶液, 荧光强度减弱, 此现象表明EDTA会引起探针T1的on-off响应, 这是由于EDTA夺走了T1-Fe3+络合物中的Fe3+所致.再加入了100 μmol/L的Fe3+溶液后, 荧光强度又恢复, 这表明探针T1有良好的可逆性.
1.6 探针T1对Fe3+识别机理初探
通过可逆性的实验证实探针与Fe3+是属于可逆型识别, 其识别机理可能为配位型.由Job-plot曲线可知, 探针T1与Fe3+的络合比为1:1.对T1与Fe3+形成的络合物进行高分辨质谱检测发现m/z: 757.4334 [calcd 757.4396], 对应的结构可能为[T1+Fe3++2Cl-]+, 进一步证明T1与Fe3+形成了1:1络合物.根据文献[29]其可能的反应机理如Eq. 1所示.
1.7 细胞显微成像实验
在MCF-7的培养皿中加入20 μmol/L的探针, 在37 ℃及5% CO2条件下, 孵育30 min.用磷酸盐缓冲液 (PBS) 冲洗培养皿3遍后, 加入10 μmol/L Fe3+, 再孵育30 min, 在共聚焦荧光显微镜下观察 (图 9a~c).对照组为未加Fe3+的细胞 (图 9d, e, f).
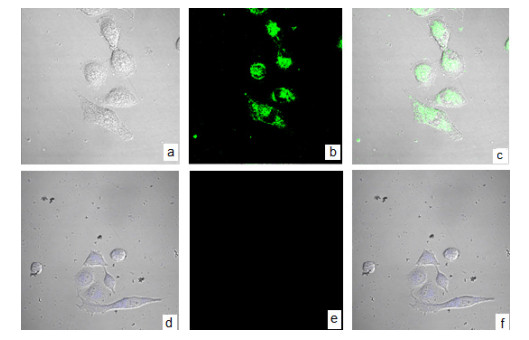 图 9
探针T1在MCF-7细胞中对Fe3+的识别成像
Figure 9.
Fluorescence images of Fe3+ in MCF-7 cells Bright-field transmission image (a, d) and fluorescence image (b, e) of MCF-7 cells incubated with 20 μmol/LT1and then 10 or 0 μmol/L Fe3+ for 30 min, respectively. Image c is the overlay image of (a) and (b). Image f is the overlay image of (d) and (e) (λex=559 nm)
图 9
探针T1在MCF-7细胞中对Fe3+的识别成像
Figure 9.
Fluorescence images of Fe3+ in MCF-7 cells Bright-field transmission image (a, d) and fluorescence image (b, e) of MCF-7 cells incubated with 20 μmol/LT1and then 10 or 0 μmol/L Fe3+ for 30 min, respectively. Image c is the overlay image of (a) and (b). Image f is the overlay image of (d) and (e) (λex=559 nm)
当T1和Fe3+共同孵育细胞时, 细胞内有明显的荧光出现 (图 9b), 仅有T1存在时细胞内无荧光 (图 9e), 表明在细胞中探针T1对Fe3+有选择性响应.从亮场与荧光的叠加图 (图 9c) 可见荧光信号处于细胞质区域, 说明该探针具有良好的细胞膜渗透能力.细胞显微成像实验显示该探针有可能用于生物细胞内Fe3+的检测.
2 结论
设计合成了一种亲水性罗丹明基荧光探针T1, 其结构通过氢谱、碳谱、质谱等方法进行了表征.利用紫外-可见光谱和荧光光谱研究了探针的识别性能, 研究结果表明, 探针T1可以通过显著的荧光增强来识别Fe3+, 并且有良好的选择性和抗干扰能力.特别需要说明的是, 由于在探针中引入了亲水性羧基, 该探针可以在DMF/Tris-HCl (V:V=1:9, pH=7.4) 的体系中进行测试, 而对照探针T是在CH3CN/Tris-HCl (V:V=1:9, pH=7.4) 体系中测试[29], 可见T1的水溶性比T有了很大的提高.细胞影像研究显示探针T1对细胞膜具有良好的透过性, 有可能用于细胞内Fe3+的检测.
3 实验部分
3.1 仪器与试剂
核磁共振仪: UNITYINOVA 400 (CDCl3为溶剂, TMS为内标); 高分辨质谱: Bruker microTOF-QII ESI-MS; 荧光分光光度计: Shimadzu RF-5310PC; 紫外可见分光光度计: Shimadzu UV-1750;共聚焦荧光显微镜: Olympus FV1000-IX81.所用试剂均为分析纯, 实验用水为二次蒸馏水.探针T1储备液:准确称取一定量的探针溶于DMF中, 配成浓度成5×10-4 mol/L的50 mL的储备液.金属阳离子储备液:准确地称取一定量的金属离子盐, 用二次蒸馏水溶解, 配成1×10-3 mol/L的100 mL金属离子储备液, 使用时根据需要适当稀释.实验中用到的阳离子为它们的硝酸盐或氯化盐.
3.2 实验方法
3.2.1 探针T1的合成和结构表征
罗丹明水合肼参考文献[32]合成.在100 mL三口瓶中加入0.1175 g (0.26 mmol) 罗丹明水合肼和20 mL的甲苯, 加热至回流, 再加入用10 mL N, N-二甲基甲酰胺 (DMF) 溶解的0.0641 g (0.33 mmol) 1, 2, 4-苯三酸酐, 反应12 h.待产物冷却至室温后, 减压除去溶剂, 残余物用中性氧化铝柱层析 (V甲醇:V二氯甲烷=1:100) 得到产品0.0798 g, 产率为49.17%. 1H NMR (400 MHz, MeOD) δ: 8.39 (d, J=7.6 Hz, 1H), 8.26 (s, 1H), 7.98 (d, J=7.3 Hz, 1H), 7.81 (d, J=7.8 Hz, 1H), 7.74~7.67 (m, 2H), 7.25 (d, J=5.9 Hz, 1H), 6.63 (d, J=8.7 Hz, 2H), 6.39 (s, 2H), 6.26 (s, 2H), 3.33~3.31 (m, 8H), 1.11 (t, J=6.0 Hz, 12H); 13C NMR (100 MHz, MeOD) δ: 166.2, 165.2, 163.1, 154.1, 150.8, 149.1, 137.8, 135.7, 134.06, 132.4, 130.2, 129.7, 128.4, 127.9, 124.6, 124.0, 123.5, 122.9, 108.0, 104.1, 97.2, 44.0, 11.4. HRMS-ESI calcd for C37H35N4O6 [M+H+] 631.6972, found 631.6961.
3.2.2 探针光谱测定
向一系列10 mL容量瓶中, 加适量探针T1储备液和一定体积的金属离子储备液, 用DMF/Tris-HCl (V:V=1:9, pH=7.4) 缓冲溶液稀释定容, 摇匀并放置3 min, 取3 mL样品液于比色皿中 (石英比色皿厚度为1 cm), 测定紫外-可见吸收光谱和荧光光谱.荧光光谱以λex=520 nm为激发波长, 扫描波长范围为535~750 nm, 狭缝宽度为2.5 nm.
3.2.3 细胞影像测试
向盛有2 mL培养基的细胞培养皿中加入40 μL的T1储备液, 保持在37 ℃及5% CO2条件下孵育30 min, 用磷酸缓冲溶液 (PBS) 冲洗3遍后, 加入10 μL Fe3+储备液再孵育30 min, 用PBS冲洗3遍后在共聚焦显微镜下进行成像.共聚焦显微镜用100倍油镜, λex=559 nm, 收集575~620 nm波段, 分别采集亮场、荧光, 并合成叠加图.
辅助材料 (Supporting Information) 探针T1的核磁共振谱和高分辨质谱, T1与Fe3+形成的络合物的高分辨质谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
Meneghini, R. Free Radical Biol. Med. 1997, 23, 783. doi: 10.1016/S0891-5849(97)00016-6
-
[2]
Aisen, P.; Wessling, R. M.; Leibold, E. A. Curr. Opin. Chem. Biol. 1999, 3, 200. doi: 10.1016/S1367-5931(99)80033-7
-
[3]
Eisenstein, R. S. Annu. Rev. Nutr. 2000, 20, 627. doi: 10.1146/annurev.nutr.20.1.627
-
[4]
Rouault, T. A. Nat. Chem. Biol. 2006, 2, 406. doi: 10.1038/nchembio807
-
[5]
Sumner, J. P.; Kopelman, R. Analyst 2005, 130, 528. doi: 10.1039/b414189j
-
[6]
Weizman, H.; Ardon, O.; Mester, B.; Libman, J.; Dwir, O.; Hadar, Y.; Chen, Y.; Shanzer, A. J. Am. Chem. Soc. 1996, 118, 12368. doi: 10.1021/ja9610646
-
[7]
Brugnara, C. Clin. Chem. 2003, 49, 1573. doi: 10.1373/49.10.1573
-
[8]
Eid, C.; Hémadi, M.; Ha-Duong, N.; Chahine, J. E. H. Biochim. Biophys. Acta 2014, 1840, 1771. doi: 10.1016/j.bbagen.2014.01.011
-
[9]
Breuer, W.; Epsztejn, S.; Cabantchik, Z. I. J. Biol. Chem. 1995, 270, 24209. doi: 10.1074/jbc.270.41.24209
-
[10]
Petrat, F.; Paluch, S.; Dogruöz, E.; Dörfler, P.; Kirsch, M.; Korth, H.-G.; Sustmann, R.; Groot, H. D. J. Biol. Chem. 2003, 278, 46403. doi: 10.1074/jbc.M305291200
-
[11]
Crichton, R. R.; Dexter, D. T.; Ward, R. J. Coord. Chem. Rev. 2008, 252, 1189. doi: 10.1016/j.ccr.2007.10.019
-
[12]
Dornelles, A. S.; Garcia, V. A.; Lima, M N. M. d.; Vedana, G.; Alcalde, L. A.; Bogo, M. R.; Schröder, N. Neurochem. Res. 2010, 35, 564. doi: 10.1007/s11064-009-0100-z
-
[13]
Ohashi, A.; Ito, H.; Kanai, C.; Imura, H.; Ohashi, K. Talanta 2005, 65, 525. doi: 10.1016/j.talanta.2004.07.018
-
[14]
Liang, Z.-Q.; Wang, C.-X.; Yang, J.-X.; Gao, H.-W.; Tang, Y.-P.; Tao, X.-T. Jiang, M.-H. New J. Chem. 2007, 31, 906. doi: 10.1039/b701201m
-
[15]
Lunvongsa, S.; Oshima, M.; Motomizu, S. Talanta 2006, 68, 969. doi: 10.1016/j.talanta.2005.06.067
-
[16]
Tesfaldet, Z. O.; Stefan, R. I. Talanta 2004, 64, 1189. doi: 10.1016/j.talanta.2004.02.044
-
[17]
Gomes, D. M.C.; Segundo, M. A.; Limaa, J. L. F. C.; Rangelb, A. O. S. S. Talanta 2005, 66, 703. doi: 10.1016/j.talanta.2004.12.011
-
[18]
陈浩, 梁沛, 胡斌, 赵丽, 孙大海, 王小如, 光谱学与光谱分析, 2002, 22, 1019.Chen, H.; Liang, P.; Hu, B.; Zhao, L.; Sun, D.-H.; Wang, X.-R. Spectrosc. Spectral Anal. 2002, 22, 1019 (in Chinese)
-
[19]
(a) Carter, K. P. ; Young, A. M. ; Palmer, A. E. Chem. Rev. 2014, 114, 4564.
(b) Li, D. -X. ; Sun, X. ; Huang, J. -M. ; Wang, Q. ; Feng, Y. ; Chen, M. ; Meng, X. -M. ; Zhu, M. -Z. ; Wang, X. Dyes Pigm. 2016, 125, 185.
(c) Feng, Y. ; Li, D. -X. ; Wang, Q. ; Wang, S. -X. ; Meng, X. -M. ; Shao, Z. -L. ; Zhu, M. -Z. ; Wang, X. Sens. Actuators, B 2016, 225, 572.
(d) Wang, Q. ; Feng, Y. ; Jiang, J. ; Wang, W. -J. ; Chen, J. -Y. ; Sheng, H. -T. ; Meng, X. -M. ; Zhu, M. -Z. Chin. Chem. Lett. 2016, 27, 1563. -
[20]
Kim, H. N.; Lee, M. H.; Kim, H. J.; Yoon, J. Chem. Soc. Rev. 2008, 37, 1465. doi: 10.1039/b802497a
-
[21]
Zhao, M.; Yang, X.-F.; He, S.; Wang, L. Sens. Actuators, B 2009, 135, 625. doi: 10.1016/j.snb.2008.10.044
-
[22]
Shang, G.-Q.; Gao, X.; Chen, M.-X.; Zheng, H.; Xu, J.-G. J. Fluoresc. 2008, 18, 1187. doi: 10.1007/s10895-008-0365-7
-
[23]
Wu, J.-S.; Hwang, I.-C.; Kim, K. S.; Kim, J. S. Org. Lett. 2007, 9, 907. doi: 10.1021/ol070109c
-
[24]
(a) Li, N.; Liu, M.; Yin, W.-T.; Yang, Z.; Li, J.-L.; Shi, Z. Chin. J. Org. Chem. 2011, 31, 39 (in Chinese).
(李娜, 刘美玲, 尹文婷, 杨征, 李剑利, 史真, 有机化学, 2011, 31, 39.)
(b) Sun, W.; Hu, D.-Y.; Wu, Z.-B.; Song, B.-A.; Yang, S. Chin. J. Org. Chem. 2011, 31, 997 (in Chinese).
(孙伟, 胡德禹, 吴志兵, 宋宝安, 杨松, 有机化学, 2011, 31, 997.)
(c) Guo, Z.-Q.; Park, S.; Yoon, J.; Shin, I. Chem. Soc. Rev. 2014, 43, 16.
(d) Zhu, L.; Yuan, Z.; Simmons, J. T.; Sreenath, K. RSC Adv. 2014, 4, 20398.
(e) Carter, K. P.; Young, A. M.; Palmer, A. E. Chem. Rev. 2014, 114, 4564.
(f) Ding, Y.-B.; Tang, Y.-Y.; Zhu, W.-H.; Xie, Y.-S. Chem. Soc. Rev. 2015, 44, 1101.
(g) Sun, J.-F.; Qian, Y. Chin. J. Org. Chem. 2016, 36, 151 (in Chinese).
(孙京府, 钱鹰, 有机化学, 2016, 36, 151.) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345228.shtml -
[25]
(a) Eggeling, C.; Volkmer, A.; Claus, A. M. Chem. Phys. Chem. 2005, 6, 791.
(b) Su, N.; Yang, M.-P.; Meng, W.-F.; Yang, B.-Q. Chin. J. Org. Chem. 2015, 35, 175 (in Chinese).
(苏娜, 杨美盼, 孟文斐, 杨秉勤, 有机化学, 2015, 35, 175.)
(c) Zhu, L.; Younes, A. H.; Yuan, Z.; Clark, R. J. J. Photochem. Photobiol. A 2015, 311, 1.
(d) Hou, H.-H.; Qu, Z.-G.; Zhong, K.-L.; Bian, Y.-J.; Tang, L.-J. Chin. J. Org. Chem. 2016, 36, 768 (in Chinese).
(侯淑华, 曲忠国, 钟克利, 边延江, 汤立军, 有机化学, 2016, 36, 768.) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345444.shtml -
[26]
Chen, X. Q.; Pradhan, T.; Wang, F.; Kim, J. S.; Yoon, J. Chem. Rev. 2012, 112, 1910. doi: 10.1021/cr200201z
-
[27]
(a) Gao, Y.; Tian, M.; Zhang, B.; Zhang, M.; Li, J.-L.; Shi, Z. Chin. J. Org. Chem. 2007, 27, 269 (in Chinese).
(高勇, 田敏, 张斌, 张敏, 李剑利, 史真, 有机化学, 2007, 27, 269.)
(b) Gao, Y.; Tian, M.; Guo, B. Chem. Bull. 2009, 72, 15 (in Chinese).
(高勇, 张敏, 郭斌, 化学通报, 2009, 72, 15.)
(c) Gao, Y.; Yang, X.-H.; You, C.-C.; OuYang, H.; Yuan, Y.-F. J. Chem. Ind. Eng. 2011, 62, 374 (in Chinese).
(高勇, 杨晓航, 游楚楚, 欧阳翰, 袁耀锋, 化工学报, 2011, 62, 374.)
(d) Fu, Mei.; Zhang, X.-W.; Wang, J.; Chen, H.-W.; Gao, Y. Curr. Org. Chem. 2016, 20, 1584. -
[28]
Yang, X.-H.; Li, S.; Tang, Z.-S.; Yu, X.-D.; Huang, T.; Gao, Y. Chin. Chem. Lett. 2015, 26, 129. doi: 10.1016/j.cclet.2014.09.025
-
[29]
Wan, X.-J.; Liu, T.-Q.; Liu, H.-Y.; Gu, L.-Q.; Yao, Y.-W. RSC Adv. 2014, 4, 29479. doi: 10.1039/C4RA03339F
-
[30]
Yang, H.; Zhou, Z.-G.; Huang, K.-W.; Yu, M.-X.; Li, F.-Y.; Yi, T.; Huang, C.-H. Org. Lett. 2007, 9, 4729. doi: 10.1021/ol7020143
-
[31]
Zhu, H.; Fan, J.-L.; Lu, J.; Hu, M.-M.; Cao. J.-F.; Wang. J.; Li, H.-L.; Liu, X.-J.; Peng, X.-J. Talanta 2012, 5, 55.
-
[32]
Yang, X.-F., Guo, X.-Q., Zhao, Y.-B. Talanta 2002, 57, 883.
-
[1]
-
图 9 探针T1在MCF-7细胞中对Fe3+的识别成像
Figure 9 Fluorescence images of Fe3+ in MCF-7 cells Bright-field transmission image (a, d) and fluorescence image (b, e) of MCF-7 cells incubated with 20 μmol/LT1and then 10 or 0 μmol/L Fe3+ for 30 min, respectively. Image c is the overlay image of (a) and (b). Image f is the overlay image of (d) and (e) (λex=559 nm)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 15
- 文章访问数: 2431
- HTML全文浏览量: 409


 下载:
下载:









 下载:
下载:

