 图 图式 1
Ru催化1, 2-环己二醇生成己二酸
Figure 图式 1.
Ru catalyzed synthesis of adipic acid from 1, 2-cyclo-hexanediol
图 图式 1
Ru催化1, 2-环己二醇生成己二酸
Figure 图式 1.
Ru catalyzed synthesis of adipic acid from 1, 2-cyclo-hexanediol

Citation: Wu Kong, Song Chan, Cui Dongmei. Advances of Unstrained Carbon-Carbon Single Bond Cleavage with Oxygen[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 586-602. doi: 10.6023/cjoc201609030

氧气参与的无张力碳-碳单键断裂反应研究进展
English
Advances of Unstrained Carbon-Carbon Single Bond Cleavage with Oxygen
-
Key words:
- oxygen
- / unstrained carbon-carbon single bond
- / cleavage
-
无张力的碳-碳单键是有机化合物中最基础、最广泛的一类化学键, 这一类型键的断裂反应已被广泛应用于天然产物的合成[1]、新能源开发[2]以及生物降解[3]等领域, 因而备受关注.过渡金属催化的无张力碳-碳单键氧化断裂是该类反应发展的大趋势, 与此同时, 非金属催化的碳-碳单键氧化断裂反应也有了一定的进展[4].碳-碳单键氧化断裂一般需要氧化剂参与, 传统的氧化剂 (如KMnO4、过氧化物等) 往往投料大、反应剧烈不容易控制, 还生成大量无机废料, 给环境增加了一定的负担.氧气作为最廉价易得、环境友好的氧化剂, 已经广泛应用于各种有机化学反应.目前还没有从氧气参与该类反应的角度对无张力碳-碳单键断裂反应进行综述, 本文根据是否使用过渡金属催化分类综述了氧气参与该类反应的研究进展, 着重探究氧气在该类反应中所起的作用以及碳-碳单键是如何断裂的.通过综述总结, 希望对氧气应用于该类型反应机理有更深的理解或有所启发.
1 氧气参与过渡金属催化的无张力碳-碳单键断裂反应
近年来, 过渡金属 (如Cu、Fe、V、Mn、Pd等) 催化的有机反应取得了重大进展, 特别是过渡金属催化碳-碳单键形成偶联反应 (如Suzuki[5]、Heck[6]以及Sonogashi[7]等反应) 的发现和发展, 为有机合成提供了更多新的合成途径.相比之下, 无张力碳-碳单键断裂反应研究进展要缓慢得多, 但过渡金属在该类反应中同样发挥着极其重要的作用, 过渡金属催化也是该类反应研究主要方向.氧气作为最廉价、环保的试剂, 在无张力碳-碳单键断裂反应中主要作为氧化剂将催化金属氧化或与底物生成不稳定的过氧化物或过氧化自由基而发挥作用.根据碳-碳单键杂化不同类型, 将氧气参与的过渡金属催化无张力碳-碳单键断裂反应分为以下三大类进行综述: C (sp3)—C (sp3) 单键断裂反应, C (sp2)(CO)—C (sp3) 单键断裂反应, C (sp2)(CO)—C (sp2) 和C (sp2)-(CO)—C (sp) 单键断裂反应.
1.1 C (sp3)—C (sp3) 单键断裂反应
由于热力学稳定性和动力学惰性, 无张力的C (sp3)—C (sp3) 单键的断裂比较困难, 但当碳-碳单键一端或两端的碳上连有杂原子 (如N, O, P等) 时, 该类键在一定程度上被活化, 促进了该类型碳-碳单键的断裂.
2009年, Baker和Thorn课题组[8]首次在空气下使用Ⅴ(Ⅴ)/吡啶二甲酸复合物催化频哪醇C (sp3)—C (sp3) 单键氧化断裂, 生成两分子丙酮 (Eq. 1).该反应有望应用于自然界中广泛存在的木质素和纤维素的氧化水解, 以解决当前的能源问题.
2010年, Kirihara课题组[9]报道了Ⅴ(Ⅴ)[如VO-(OEt) Cl2, VOCl3]催化多取代的乙二醇类化合物发生C (sp3)—C (sp3) 单键氧化断裂, 高效率地生成两分子酮的方法 (Eq. 2).该反应在氧气中室温即可反应, 条件相对温和, 而且适用于多种不同的底物.
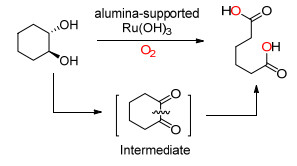
2013年, Cavani课题组[10]报道了Ru (OH)3作为催化剂, 氧气作为氧化剂, 将反式1, 2-环己二醇氧化成己二酸的方法 (Scheme 1). Cavani等认为Ru (Ⅲ) 先将反式1, 2-环己二醇催化氧化成1, 2-环己二酮, 再进一步氧化为目标化合物.反应中Ru (OH)3是附着在矾石的固体催化剂, 故可以回收再利用.
 图 图式 1
Ru催化1, 2-环己二醇生成己二酸
Figure 图式 1.
Ru catalyzed synthesis of adipic acid from 1, 2-cyclo-hexanediol
图 图式 1
Ru催化1, 2-环己二醇生成己二酸
Figure 图式 1.
Ru catalyzed synthesis of adipic acid from 1, 2-cyclo-hexanediol
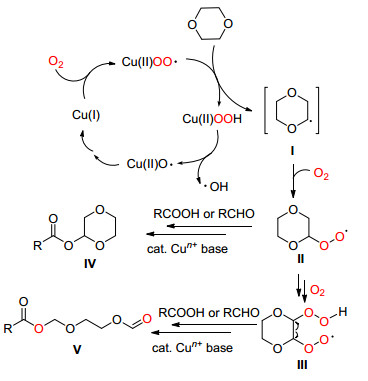
2012年, Liu课题组[11]意外地发现在氧气或空气下, 一价Cu盐催化二氧六环其中一个C (sp3)—C (sp3) 单键发生氧化断裂, 然后与羧酸或醛偶联分别生成α-酰氧基醚或1, 2-乙二醇甲酸酯类化合物.该反应是首次报道的Cu催化的醚中饱和C (sp3)—C (sp3) 单键的断裂, 通过该方法他们合成了42个收率在43%~99%的目标化合物 (Eq. 3).
Liu等认为该反应可能经由Scheme 2中的机理进行:首先Cu (Ⅰ) 被氧气氧化生成Cu (Ⅱ) 过氧化自由基, 该自由基夺去二氧六环其中一个亚甲基上的氢原子生成自由基中间体Ⅰ, 此步是反应的关键步骤.自由基Ⅰ捕获一分子氧生成过氧化自由基Ⅱ, Ⅱ继续与氧气反应得到自由基Ⅲ或直接与醛、羧酸生成化合物Ⅳ, 自由基Ⅲ再通过电子转移和由Cu催化的碳-氢均裂反应, 最终生成C (sp3)—C (sp3) 单键氧化断裂产物Ⅴ.氧气在该反应中不仅作为氧化剂将Cu (Ⅰ) 氧化, 还参与过氧化自由基的生成, 促使碳-碳单键发生断裂.
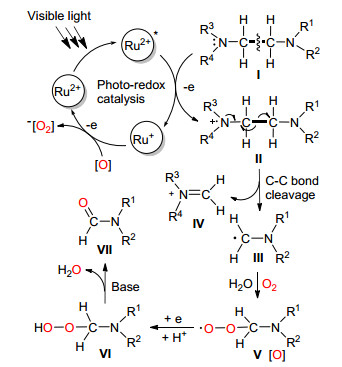
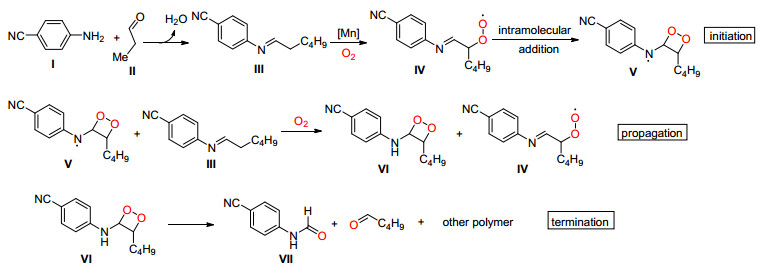
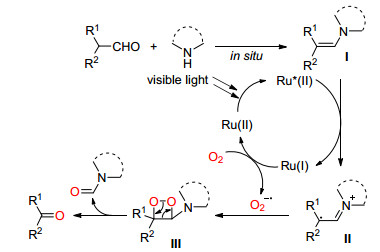
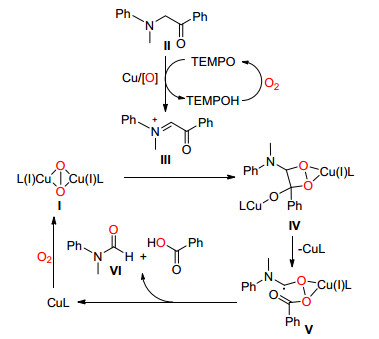
2013年, Wang课题组[12]在可见光和Ru协同催化下, 成功地将一系列乙二胺类化合物通过C (sp3)—C (sp3) 单键断裂转化为了甲酰胺, 该反应在氧气中室温即可进行, 条件温和 (Eq. 4).
他们认为该反应可能按Scheme 3中的机理进行, 首先在可见光照射下Ru (Ⅱ) 被激活, 与底物Ⅰ反应生成不稳定的中间体Ⅱ, Ⅱ通过电子转移使C (sp3)—C (sp3) 单键断裂并生成一个氨基自由基Ⅲ和一个亚胺正离子Ⅳ, Ⅲ可能被氧气捕获生成过氧化自由基Ⅴ, Ⅴ可以作为氧化剂将Ru (Ⅰ) 氧化为Ru (Ⅱ) 实现催化剂循环, 同时生成中间体Ⅵ, Ⅵ在碱作用下最终生成了甲酰胺.
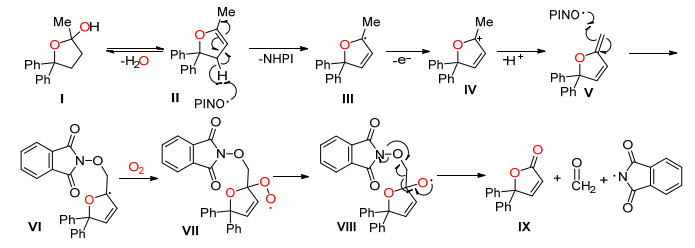
2015年, Chiba课题组[13]以CuCl为催化剂, 在氧气和N-羟基邻苯二甲酰胺 (NHPI) 存在条件下, 以1, 1-二苯基戊烷为原料一锅法合成了烯内酯.他们认为原料在反应条件下先生成半缩醛中间体, 然后再在该反应条件下通过断裂C (sp3)—C (sp3) 单键生成内酯 (Scheme 4).
Chiba等认为半缩醛中间体Ⅰ生成后, 反应按照Scheme 5的机理进行: Ⅰ脱水生成烯醚Ⅱ, 自由基PINO·夺去Ⅱ烯丙位上的氢生成α-氧自由基Ⅲ, Ⅲ失去一个电子生成碳正离子Ⅳ, Ⅳ被PINO·自由基再夺去一个氢原子生成环外烯烃Ⅴ, Ⅴ与PINO·自由基结合生成α-氧自由基Ⅵ, Ⅵ再被氧气氧化生成过氧化自由基Ⅶ, 最后通过电子转移使C (sp3)—C (sp3) 单键发生断裂生成内酯Ⅸ.
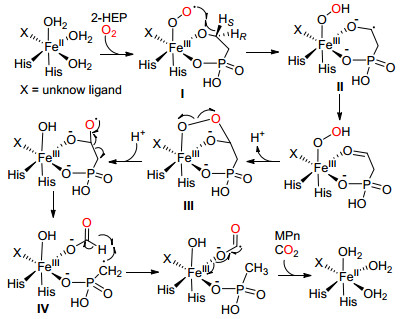
2012年, van der Donk课题组[14]在氧气下, 使用甲基磷酸酯酶 (MPnS) 催化2-羟基乙基磷酸酯 (2-HEP) C (sp3)—C (sp3) 单键氧化断裂生成甲基磷酸酯 (MPn) (Eq. 5).该反应是酶催化的反应, 酶中的金属Fe (Ⅱ) 在反应中起着关键作用.
Donk等认为2-羟基乙基磷酸酯 (2-HEP) 与甲基磷酸酯酶 (MPn) 结合后在氧气下得到Fe (Ⅲ) 过氧化自由基Ⅰ, Ⅰ选择性夺去2-HEP上连有羟基碳上的一个氢原子生成自由基负离子Ⅱ, Ⅱ将一个电子转移到Fe (Ⅲ) 上, 生成与Fe (Ⅲ) 相连的膦酰基乙醛, 然后脱去一个H+, 得到烷基过氧化物中间体Ⅲ, Ⅲ中氧-氧键发生均裂生成二元醇自由基, 再通过C (sp3)—C (sp3) 单键断裂, 生成中间体Ⅳ, 该中间体的铁上连有一个MPn自由基和一个甲酸盐, MPn自由基夺去甲酸盐上的氢原子并通过电子转移最终生成MPn和二氧化碳 (Scheme 6).
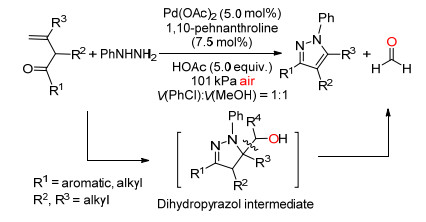
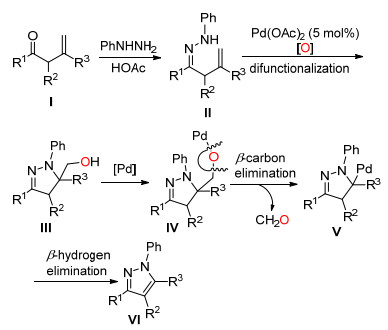
2015年, Loh课题组[15]报道了以空气中的氧气作为唯一的氧化剂, Pd (OAc)2催化烯酮与苯肼反应生成二氢吡唑中间体, 然后通过断裂C (sp3)—C (sp3) 单键一锅法合成吡唑 (Scheme 7).该法提出了一种一锅法合成多取代吡唑的新途径.
Loh等认为烯酮Ⅰ先与苯肼缩合生成苯腙Ⅱ, Ⅱ在氧气和Pd (OAc)2催化下生成中间体Ⅲ, Ⅲ再与Pd作用生成中间体Ⅳ, Ⅳ通过β-碳和β-氢两步消除得到目标化合物Ⅵ(Scheme 8).
1.2 C (sp2)(CO)—C (sp3) 单键断裂反应
由于羰基的吸电子作用, 使得C (sp2)(CO)—C (sp3) 单键的活性明显比无羰基C (sp3)—C (sp3) 单键要高, 近年来碳-碳单键的断裂反应研究也是主要针对该类型键, 并取得了较大的进展, 所以本文也只对含有羰基的C (sp2)—C (sp3) 单键的断裂反应进行了综述, 根据断裂反应生成不同的产物, 分为六类分别进行阐述.
1.3 C (sp2)(CO)—C (sp2) 和C (sp2)(CO)—C (sp) 单键断裂的反应
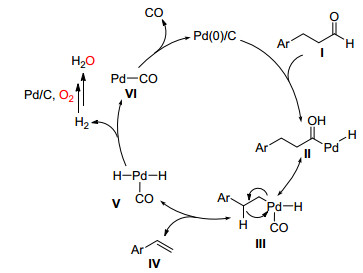
2016年, Monguchi和Sajiki课题组[40]首次报道了在氧气下Pd/C催化肉桂醛或苯丙醛类化合物 (前者为C (sp2)—C (sp3) 后者为C (sp2)—C (sp2)) 生成苯乙烯类化合物 (Eq. 28).
Sajiki等认为Pd (0)/C先插入到醛Ⅰ醛基的碳氢之间, 得到酰基Pd (Ⅱ)/H复合物Ⅱ, 接着Pd发生迁移生成乙烯基Pd (Ⅱ)/H复合物Ⅲ, Ⅲ通过还原消除得到苯乙烯类化合物并同时生成一氧化碳和Pd (0)/C (Scheme 33).
2016年, Song课题组[41]报道了氧气下, Cu/Fe混合盐催化剂催化α, β-不饱和羰基化合物的C (sp2)(CO)—C (sp2) 单键断裂, 并与氢亚磷酸二酯反应生成β-酮磷酸酯 (Eq. 29).
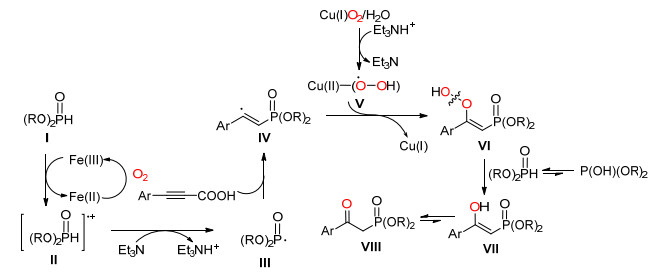
2015年, Song课题组[42]报道了苯炔酸在氧气和廉价的Cu/Fe催化系统下, 通过C (sp2)(CO)—C (sp) 单键断裂脱羧后与氢亚磷酸二酯反应生成β-酮磷酸酯类化合物的反应 (Eq. 30), 并通过该法得到19个收率在33%~78%目标化合物.
Song等认为, Ⅰ在Fe (Ⅲ) 和氧气作用下生成阳离子基Ⅱ, Ⅱ在三乙胺作用下脱质子生成磷酰基自由基Ⅲ, 其与炔烃反应生成自由基Ⅳ, Ⅳ过氧化自由基Ⅴ反应得到过氧化物Ⅵ, Ⅵ氢亚磷酸二酯作用下转化为目标化合物Ⅷ(Scheme 34).
1.2.6 C (sp2)(CO)—C (sp3) 单键断裂生成杂环
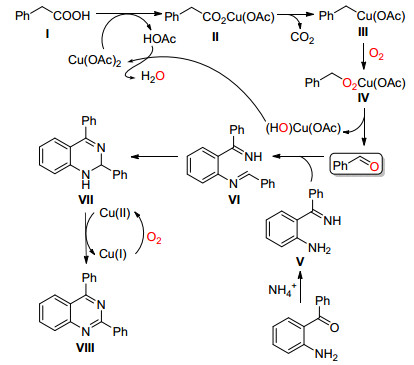
2016年, Yan和Liu课题组[39]报道了一种氧气下Cu (OAc)2催化芳乙酸氧化脱羧并与邻氨基芳酮反应高效地生成杂环2-芳基喹唑啉方法 (Eq. 27), 该方法通过一步生成多个碳-氮键.
Liu等认为底物Ⅰ先与Cu (Ⅱ) 反应通过配体交换生成Cu络合物Ⅱ, Ⅱ通过脱去一分二氧化碳生成Ⅲ, 氧气插入到Ⅲ生成中间体Ⅳ, Ⅳ转化为 (HO) Cu (OAc) 并通过β-H消除生成苯甲醛, (HO) Cu (OAc) 在醋酸作用下重新生成Cu (OAc)2, 苯甲醛与Ⅴ缩合生成Ⅵ, Ⅵ通过温和的分子内亲核加成和Cu催化的氧气氧化得到目标化合物Ⅷ(Scheme 32).
1.2.1 C (sp2)(CO)—C (sp3) 单键断裂生成醛
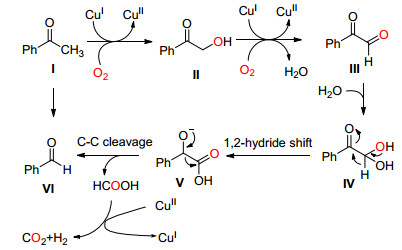
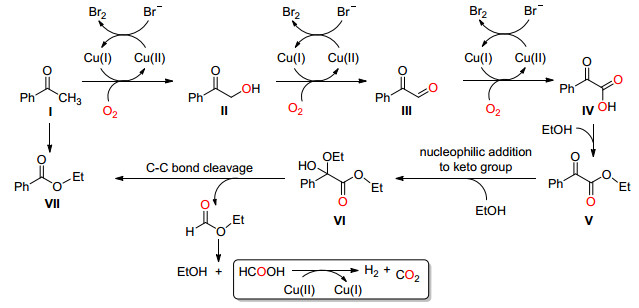
2013年, Bi和Liu课题组[16]首次报道了氧气下, CuI催化的芳香酮或脂肪酮选择性氧化断裂C (sp2)(CO)—C (methyl) 单键并成醛 (Eq. 6).当羰基酮的α位不是甲基而是其它脂肪链时反应也可以发生, 但需要适当延长反应时间.该反应的最大优点就是生成的氧化产物停留在醛的阶段而不会被过度氧化, 所以该反应提供了一种新颖的将甲基酮转化为醛的好方法.
Liu等认为该反应机理按照Scheme 9进行.首先底物Ⅰ在Cu (Ⅰ) 催化下被氧气氧化生成α-羟基苯乙酮Ⅱ, 然后进一步被氧化, 脱去一分子水生成苯甲酰甲醛中间体Ⅲ, Ⅲ被一分子水亲核进攻生成α, α-二羟基苯乙酮Ⅳ, 再通过类似于Cannizzaro反应进行1, 2-氢转移得到中间体Ⅴ, 最后通过电子转移使C (sp2)(CO)—C (sp3) 单键断裂生成目标化合物Ⅵ, 释放出一分子甲酸, 甲酸在Cu (Ⅱ) 催化下生成二氧化碳和氢气, 与此同时Cu (Ⅱ) 转变为Cu (Ⅰ) 实现催化剂循环.
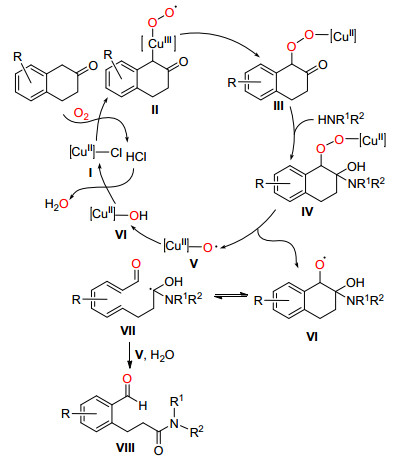
2015年, Zhou和Jiao课题组[17]使用CuCl2·2H2O作为催化剂, 在胺和空气存在下, 成功地将无张力环酮的C (sp2)(CO)—C (sp3) 单键氧化断裂生成分子内含有酰胺的醛 (Eq. 7).该反应能一步生成碳-氧双键和碳-氮单键, 他们使用该方法合成了36个收率最高达93%的目标化合物.
Jiao等认为Ⅰ先与酮在氧气下生成Cu (Ⅲ) 过氧化自由基Ⅱ, Ⅱ异构化生成过氧化合物Ⅲ, Ⅲ与胺发生亲核反应得到过氧化中间体Ⅳ, Ⅳ发生均裂得到Cu (Ⅱ) 化合物Ⅴ和中间体Ⅵ, Ⅵ发生可逆的β裂解得到中间体Ⅶ, Ⅶ进一步被中间体Ⅴ氧化得到目标化合物Ⅷ同时释放Ⅵ, Ⅵ在HCl的辅助下实现催化剂循环 (Scheme 10).
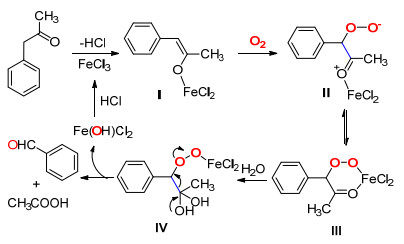
2016年, Li课题组[18]使用更廉价的FeCl3作为催化剂, 在空气中催化的1-芳基-丙-2-酮类化合物的C (sp2)-(CO)—C (sp3) 单键发生氧化断裂生成碳链缩短的醛、酮或1, 2-二羰基化合物的反应 (Eq. 8), 该反应可用于合成2-乙酰氨基-苯甲醛类化合物, 这类化合物是合成喹啉-2(1H)-酮原料.
Li等认为该反应的机理是底物酮首先与Fe (Ⅲ) 结合生成铁-烯醇化合物Ⅰ, Ⅰ捕获一分子氧气生成过氧化物Ⅱ, 其共振式Ⅲ与水分子亲核反应得到过氧化物中间体Ⅳ, Ⅳ通过电子转移, 断裂C (sp2)(CO)—C (sp3) 单键, 得到目标化合物醛同时释放出一分子酸, 脱下的Fe (OH) Cl2与HCl结合脱水后得到FeCl3, 实现催化剂循环 (Scheme 11).
1.2.5 C (sp2)(CO)—C (sp3) 单键断裂生成酰胺
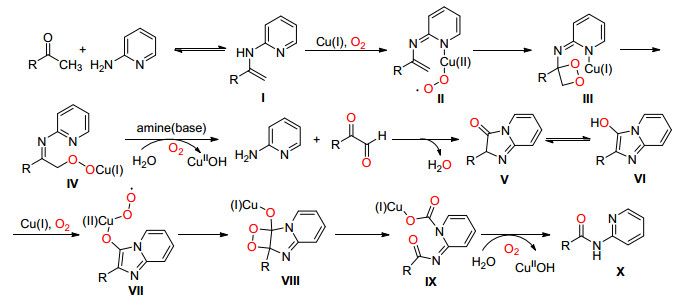
2014年, Kaliappan课题组[33]使用CuCl2催化酮与N-杂环芳伯胺一锅法合成了酰胺 (Eq. 21), 该反应条件温和、对酸碱敏感的底物同样适用.
Kaliappan等认为该反应可能经由酮和2-氨基吡啶先进行可逆的缩合反应生成烯胺Ⅰ, Ⅰ在Cu (Ⅰ) 催化下氧化生成过氧自由基Ⅱ, Ⅱ与双键加成生成1, 2-二氧杂环丁烷类中间体Ⅲ, Ⅲ开环在碱和Cu (Ⅱ) OH/O2作用下分解为不稳定酮醛和2-氨基吡啶, 接着脱水缩合生成咪唑并吡啶酮Ⅴ, Ⅴ通过互变生成Ⅵ后, 在Cu (Ⅰ)/O2催化氧化下生成过氧化自由基Ⅶ, 然后与双键生成1, 2-二氧杂环丁烷类中间体Ⅷ, 最后通过开环并脱羧生成目标化合物X (Scheme 27).
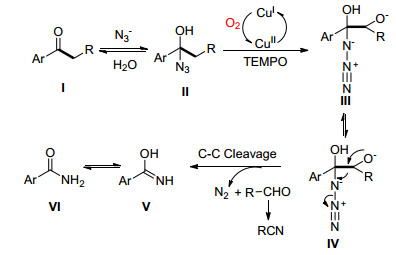
2014年, Jiao课题组[34]报道了在氧气下, CuCl2催化的芳酮与叠氮化钠反应生成酰胺的反应 (Eq. 22).该反应不仅可以用于芳乙酮同时也适用于长链的芳香酮的C (sp2)(CO)—C (sp3) 单键氧化断裂, 提供了一种新的合成酰胺的方法.
Jiao等认为底物酮Ⅰ先与叠氮化钠进行可逆亲核加成反应得到不稳定的中间体Ⅱ, 该中间体在Cu/O2催化系统下被氧化羟基化得到中间体Ⅲ, 中间体Ⅲ的共振式Ⅳ通过电子转移使C (sp2)(CO)—C (sp3) 单键断裂生成Ⅴ, 同时释放一分子醛和氮气, Ⅴ共振即得目标化合物Ⅵ(Scheme 28).
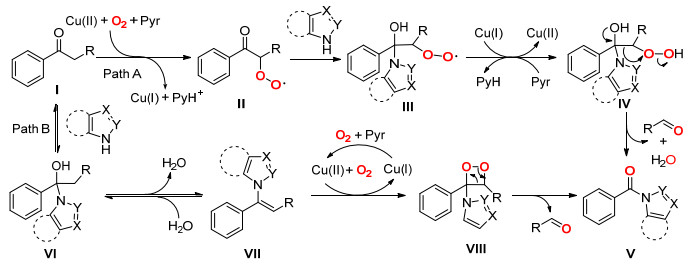
2015年, Song课题组[35]使用CuBr作为催化剂, 在吡啶和氧气下, 催化酮的C (sp2)(CO)—C (sp3) 单键断裂与唑类芳杂环反应生成三级酰胺 (Eq. 23).
Song等认为该反应通过两种可能路线进行 (Scheme 29). Path A:在Cu (Ⅱ) 和氧气下, 底物Ⅰ中的亚甲基首先通过单电子转移被氧化为过氧化自由基中间体Ⅱ, 然后被芳杂环亲核进攻生成中间体Ⅲ, Ⅲ质子化生成中间体Ⅳ, Ⅳ通过电子转移, 使C (sp2)(CO)—C (sp3) 单键发生断裂生成目标化合物Ⅴ, 同时释放出一分子醛和水. Path B: Ⅰ先与芳杂环发生亲核加成反应生成中间体Ⅵ, 然后脱去一分子水得到中间体Ⅶ, Ⅶ再在Cu (Ⅱ)/O2催化氧化系统作用下生成1, 2-二氧杂环丁烷中间体Ⅷ, Ⅷ通过C (sp2)(CO)—C (sp3) 单键和氧-氧键发生断裂生成目标化合物Ⅴ, 同时释放出一分子醛和水.
2014年, Yin课题组[36]报道了氧气下, CuCl催化不同分子的C (sp2)(CO)—C (sp3) 单键和碳-氮单键断裂一锅法生成叔酰胺的方法 (Eq. 24), 该反应不需要碱和配体.
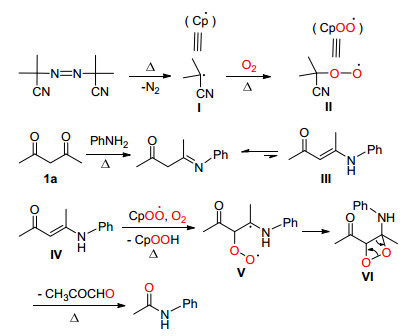
2012年, Jiao课题组[37]在氧气下, 使用Mn (OAc)3催化醛的C (sp2)(CO)—C (sp3) 单键断裂与胺生成了甲酰胺 (Eq. 25), 他们认为该反应是一个自由基反应, 并使用该方法合成了27个收率最高可达96%的目标化合物.
Jiao等认为胺Ⅰ先与醛Ⅱ进行脱水反应生成亚胺Ⅲ, 在Mn (OAc)3催化下Ⅲ被氧化生成过氧游离基Ⅳ, 接着进行分子内加成生成1, 2-二氧杂环丁烷自由基Ⅴ, Ⅴ在氧气下可以与亚胺Ⅲ反应生成中间体Ⅵ并释放Ⅳ, 使得反应继续发生.最后Ⅵ发生裂解反应得到目标化合物Ⅶ以及醛和一些未知的聚合物 (Scheme 30).
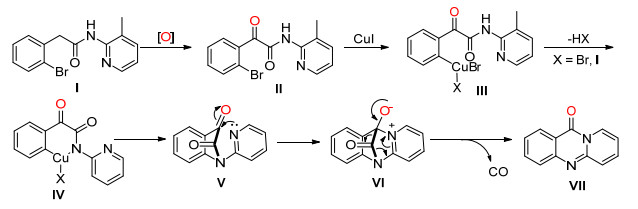
2014年, Xu课题组[38]报道了CuI催化的邻位溴代的芳基乙酰胺, 通过断裂C (sp2)(CO)—C (sp3) 单键和碳-氮单键脱去一分子一氧化碳, 然后关环生成环喹唑啉酮 (Eq. 26).
Xu等认为该反应经由Scheme 31的机理进行:首先底物Ⅰ被氧化生成α-酮酰胺Ⅱ, 该化合物再在Cu (Ⅰ) 的催化下生成中间体Ⅲ, Ⅲ脱去一分子卤化氢后发生分子内反应生成中间体Ⅳ, 然后吡啶环上的氮原子亲核进攻酮羰基得到一个两性离子中间体Ⅵ, Ⅵ通过电子转移脱去一分子一氧化碳得到目标化合物Ⅶ.
1.2.2 C (sp2)(CO)—C (sp3) 单键断裂生成酮
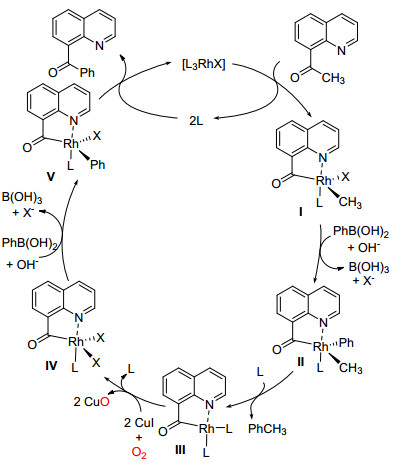
2012年, Wang课题组[19]利用Rh的螯合作用, 在空气中成功将酮的甲基或芳基直接置换成另外一个芳基 (Eq. 9), 新的芳基来源于芳基硼酸, 该反应中导向基团在反应中起着关键作用.
Wang等认为该反应可能经由Scheme 12的机理过程:首先Rh (Ⅰ) 在定位基团的辅助下螯合到底物芳乙酮乙酰基的碳-碳单键上, 形成Rh (Ⅲ) 的五元环中间体Ⅰ, Ⅰ与芳基硼酸发生转金属化得到Rh上连有甲基和芳基中间体Ⅱ, Ⅱ插入一个磷配体, 接着芳基和甲基发生消除得到Rh (Ⅰ) 中间体Ⅲ, 在氧气下, Cu (Ⅰ) 将Ⅲ中的Rh (Ⅰ) 氧化到Rh (Ⅲ) 生成中间体Ⅳ, 中间体Ⅳ再一次与芳基硼酸发生转金属化得到中间体Ⅴ, Ⅴ通过还原消除得到目标产物和Rh (Ⅰ), 从而实现催化剂循环.
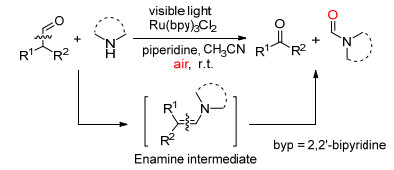
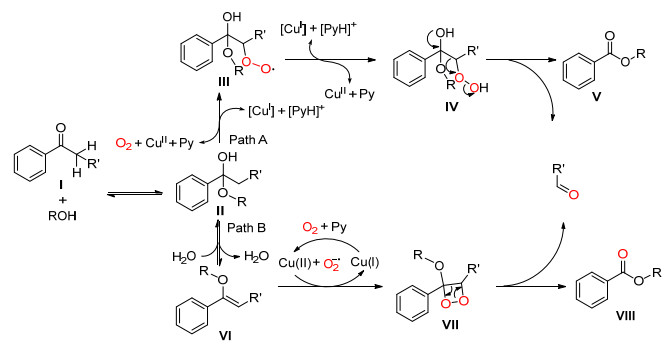
2013年, Xia课题组[20]使用Ru (bpy)3Cl2作为光催化剂, 在光照、胺和空气存在下将醛C (sp2)(CO)—C (sp3) 单键氧化断裂, 以较高的收率得到酮和甲酰胺 (Scheme 13).该反应在空气中室温就可以进行, 反应条件比较温和.
Xia等认为醛首先和胺反应生成烯胺Ⅰ, 接着烯胺Ⅰ被光激活的Ru (Ⅱ) 氧化为阳离子自由基Ⅱ和Ru (Ⅰ), Ru (Ⅰ) 被氧气氧化为Ru (Ⅱ), 使催化剂循环, 自由基Ⅱ与[O2]·‑作用生成1, 2-二氧杂环丁烷中间体, 最后通过电子转移使C (sp2)(CO)—C (sp3) 单键断裂, 生成目标产物酮和甲酰胺 (Scheme 14).
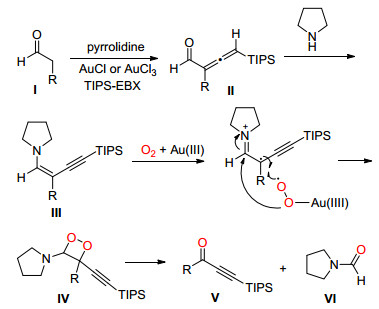
2014年, Huang课题组[21]报道了在氧气和四氢吡咯存在条件下, Au催化醛C (sp2)(CO)—C (sp3) 单键断裂并与高碘化合物TIPS-EBX反应生成炔酮 (Eq. 10).
Huang等认为醛Ⅰ在Au (Ⅰ) 或Au (Ⅲ) 催化下与TIPS-EBX反应得到连烯醛Ⅱ, Ⅱ与四氢吡咯反应生成炔烯胺中间体Ⅲ, Ⅲ在Au (Ⅲ) 催化下进一步与氧气发生自由基反应生成1, 2-二氧杂环丁烷中间体Ⅳ, Ⅳ通过C (sp2)(CO)—C (sp3) 单键断裂生成目标化合物Ⅴ同时释放副产物Ⅵ(Scheme 15).
2014年, Jiao课题组[22]使用CuBr作为催化剂, 在氧气下催化1, 3-二芳基二酮C (sp2)(CO)—C (sp3) 单键断裂生成1, 2-二酮 (Eq. 11), 反应的结果是将1, 3-二芳基二酮类化合物中的亚甲基碳切除, 生成直接将两个羰基碳用碳-碳单键相连的产物.
Jiao等提出如Scheme 16所示的机理: Cu (Ⅰ) 在氧气下氧化成Cu (Ⅱ), Cu (Ⅱ) 与底物Ⅰ发生催化氧化反应生成关键中间体Ⅱ, Ⅱ在Cu (Ⅱ) 催化下发生类似于1, 2-Wagner-Meerwein重排反应得到中间体Ⅲ, Ⅲ通过电子转移使C (sp2)(CO)—C (sp3) 单键断裂生成目标产物, 并释放出一氧化碳.
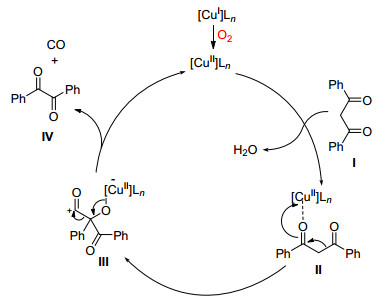
2014年, Maiti课题组[23]报道了氧气下Cu (OAc)2催化将二芳基乙酮苄位碳切除生成二芳基甲酮的方法 (Eq. 12).该反应除了一个苄基碳被切除之外, 其它结构保持不变.
对于该反应, Maiti等提出如Scheme 17的机理, 他们认为底物Ⅰ首先与胺生成亚胺Ⅱ, 接着在Cu/O2催化系统下苄基碳被氧化生成对应的酮Ⅲ, Ⅲ在Cu (Ⅱ) 辅助下通过二苯乙醇酸重排得到目标化合物Ⅸ.
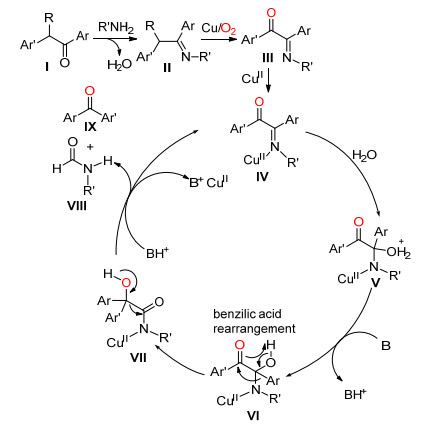
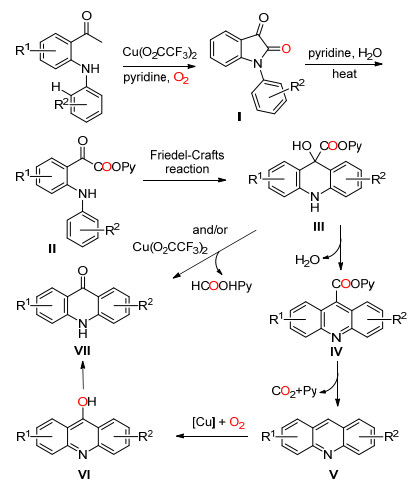
2013年, Fu课题组[24]以Cu (O2CCF3)2为催化剂, 氧气下催化2-芳胺基苯乙酮发生分子内的C (sp2)(CO)—C (sp3) 单键和碳-氢键活化断裂生成吖啶酮 (Eq. 13).该方法可较好收率地合成带有多种官能团的吖啶酮类化合物.
Fu等认为首先底物在Cu (Ⅱ) 催化下被氧气氧化成1-芳基二氢吲哚-2, 3-二酮Ⅰ, 加热条件下Ⅰ在吡啶和水中生成中间体Ⅱ, Ⅱ通过傅-克酰基化反应关环得到中间体Ⅲ, Ⅲ脱水得到中间体Ⅳ, 中间体Ⅳ脱去二氧化碳和吡啶得到中间体Ⅴ, Ⅴ在Subramanian Cu的催化下被氧化生成Ⅵ, Ⅵ共振后得到目标化合物Ⅶ.化合物Ⅲ在Cu (Ⅱ) 的催化下脱去吡啶得到目标化合物Ⅶ是另外一种可能的途径 (Scheme 18).
1.2.3 C (sp2)(CO)—C (sp3) 单键断裂生成酸或酸酐
2011年, Li课题组[25]以Cu盐为催化剂, 在氧气下催化α-氨基羰基化合物C (sp2)(CO)—C (sp3) 单键断裂生成相应的酸和甲酰胺 (Eq. 14).该反应使用附着在Fe上Cu作为固相催化剂, 反应后只需过滤就可以将催化剂回收.
Li等认为由Cu和氧气反应得到中间体Ⅰ, Ⅰ与亚胺中间体Ⅲ发生加成反应得到中间体Ⅳ, Ⅳ发生C (sp2)(CO)—C (sp3) 键断裂和还原消除反应得到中间体Ⅴ, Ⅴ通过氧-氧键断裂以及还原消除得到目标化合物Ⅵ和苯甲酸 (Scheme 19).
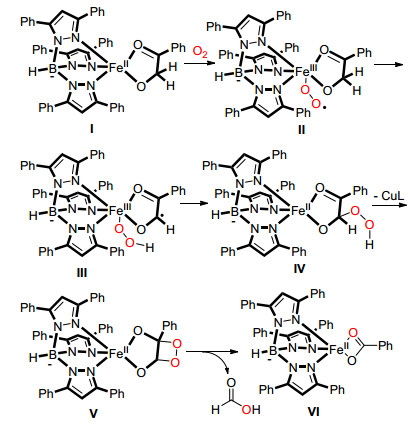
2012年, Paine课题组[26]报道了使用2, 4'-二羟基苯乙酮双加氧酶 (DAD), 在氧气下, 将2, 4'-二羟基苯乙酮中的C (sp2)(CO)—C (sp3) 单键氧化断裂生成对羟基苯甲酸和甲酸, 氧气分子中的两个氧原子分别转化到两个产物中 (Eq. 15).
Paine等认为DAD与2, 4'-二羟基苯乙酮的复合物Ⅰ与分子氧生成Fe (Ⅲ) 过氧化自由基Ⅱ, Ⅱ从羟基酮的α位夺取一个氢原子, 生成中间体Ⅲ, Ⅲ中Fe (Ⅲ) 上的过氧化氢迁移得到过氧化氢中间体Ⅳ, Ⅳ再生成1, 2-二氧杂环丁烷中间体, 并最终断裂C (sp2)(CO)—C (sp3) 单键和氧-氧单键生成产物 (Scheme 20).
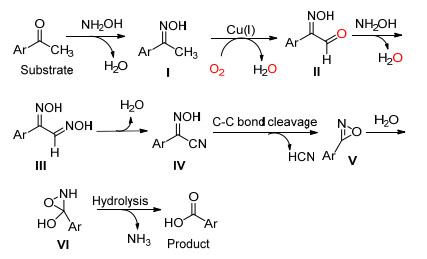
2015年, Bathula课题组[27]使用Cu/O2催化系统在羟胺存在条件下成功地将酮转化成了酸 (Eq. 16).该反应的底物可以是芳基酮、芳烷基酮或乙烯酮, R基团可以是甲基, 也可以是其它脂肪链, 但碳-碳单键断裂的位置相同, 即该反应具有一定的化学选择性.
Bathula等认为该反应可能经由下Scheme 21机理:酮先与羟胺反应生成肟Ⅰ, 接着在Cu (Ⅰ) 催化下被氧化成α-醛基肟Ⅱ, Ⅱ再与羟胺反应形成二肟化合物Ⅲ, Ⅲ脱水生成氰基苯甲酰肟Ⅳ, Ⅳ再通过C (sp2)(CO)—C (sp3) 单键断裂, 脱去一分子氢氰酸, 得到中间体Ⅴ, Ⅴ与水加成反应得到Ⅵ, Ⅵ最后脱去一分子氨气得到目标化合物酸.
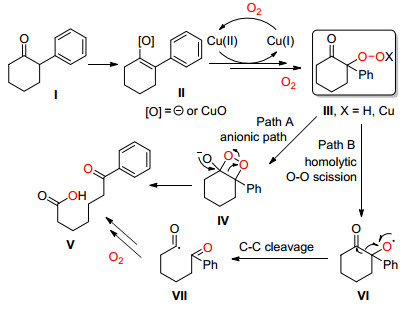
2016年, Schoenebeck课题组[28]使用Cu2O在碱hppH和氧气下, 催化环酮发生分子内C (sp2)(CO)—C (sp3) 单键氧化断裂生成酮和羧酸 (Eq. 17), 该反应中碱hppH发挥着重要作用而且不可取代.
Schoenebeck等认为, 底物酮Ⅰ通过互变生成烯醇式Ⅱ, Ⅱ与Cu (Ⅱ) 在氧气下形成Cu (Ⅱ) 过氧化合物Ⅲ, 该化合物通过两种可能路径生成碳-碳单键断裂产物, 一种是阴离子路径 (Path A), 通过电子转移, 开环生成目标化合物Ⅴ; 另外一种是 (Path B) 通过自由基均裂, 再与氧气作用生成C (sp2)(CO)—C (sp3) 单键断裂产物Ⅴ(Scheme 22).
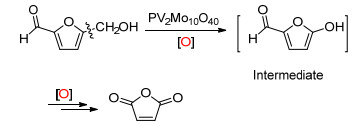
2015年, Yin课题组[29]使用杂多酸在氧气下将5-羟甲基糠醛氧化成马来酸酐 (Scheme 23), 他们认为该反应分两步进行, 先进行C (sp3)—C (sp3) 单键氧化断裂成5-羟基-2-呋喃甲醛, 然后再进一步氧化为目标产物.他们认为该反应是通过电子转移和氧转移 (ET-OT) 机理进行, 在该过程中杂多酸中Ⅴ由五价还原为四价.
1.2.4 C (sp2)(CO)—C (sp3) 单键断裂生成酯
2013年, Jiao课题组[30]以CuBr为催化剂, 在吡啶和一个大气压氧气下, 催化1, 3-二酮化合物氧化酯化生成α-酮酸酯的反应 (Eq. 18).该法高效地将C (sp2)-(CO)—C (sp3) 单键氧化断裂再与醇反应生成α-酮酸酯.
Jiao等认为, 在Cu催化条件下, 底物Ⅰ和Ⅱ先经过脱氢偶联生成中间体Ⅳ, 中间体Ⅳ在Cu/O2催化下被氧化为过氧化中间体Ⅴ, Ⅴ通过单电子转移得到阴离子中间体Ⅵ和羟基自由基, Ⅵ和Ⅱ反应生成半缩醛中间体Ⅶ, 最后再通过氧化使C (sp2)(CO)—C (sp3) 单键裂解得到目标化合物Ⅲ和副产物Ⅷ(Scheme 24).
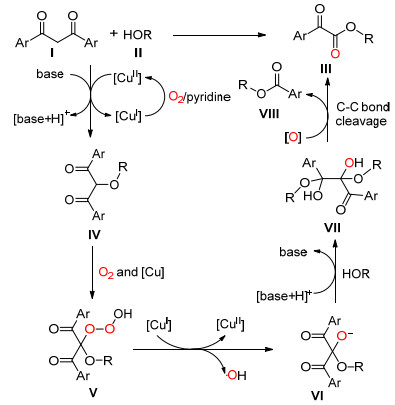
2014年, Jiao课题组[31]又报道了芳香酮或脂肪酮在空气中被CuBr-Py催化发生C (sp2)(CO)—C (sp3) 单键氧化断裂并与醇酯反应生成酯 (Eq. 19), 他们使用该方法合成了65个最高收率达90%的目标产物.该反应适用于多种不同种类的酮, 甚至长脂肪链的酮, 醇的种类也可以有多种, 包括伯醇、仲醇等, 并且含有手性的醇构型能得到保持.
Jiao等认为首先酮Ⅰ与醇发生可逆的亲核加成反应得到半缩酮Ⅱ, 然后反应通过两种可能路径进行 (Scheme 25). Path A:半缩酮Ⅱ发生单电子转移与Cu (Ⅱ) 生成以碳为中心的自由基中间体, 该中间体与分子氧生成过氧自由基Ⅲ, Ⅲ质子化后生成Ⅳ, Ⅳ最后通过电子化转移使碳-碳单键断裂生成目标化合物Ⅴ, 同时脱去一分子醛; Path B:半缩酮Ⅱ脱水生成乙烯醚Ⅵ, Ⅵ与Cu (Ⅱ) 和超氧游离基反应得到1, 2-二氧杂环丁烷中间体Ⅶ, Ⅶ最后通过碳-碳单键和氧-氧键的断裂生成目标化合物Ⅷ, 同时脱去一分子醛.
2016年, He课题组[32]报道了类似的反应 (Eq. 20), 该反应使用CuCl2·H2O作为催化剂, 在氧气下进行, 不需要吡啶参与, 条件相对温和, 对多种官能团耐受.该反应中使用LiBr, 将Cu (Ⅱ) 还原为Cu (Ⅰ), Cu (Ⅰ) 在氧气下生成Cu (Ⅱ), 实现催化剂的循环.
He等提出了不同的反应机理, 他们认为底物芳基乙酮Ⅰ通过三次连续的催化氧化, 形成丙酮酸结构的中间体Ⅳ, Ⅳ再与醇发生酯化反应和亲核加成反应得到中间体Ⅵ, Ⅵ最后脱去一分子甲酸乙酯生成目标产物Ⅶ(Scheme 26).
2 氧气参与的非金属催化的无张力碳-碳单键断裂
金属催化的碳-碳单键断裂反应往往能取得较好的效果, 但有些金属 (如Pd等) 价格昂贵, 回收成本高, 所以近年来非金属 (或无金属) 催化的无张力碳-碳单键断裂反应也引起了人们的关注.
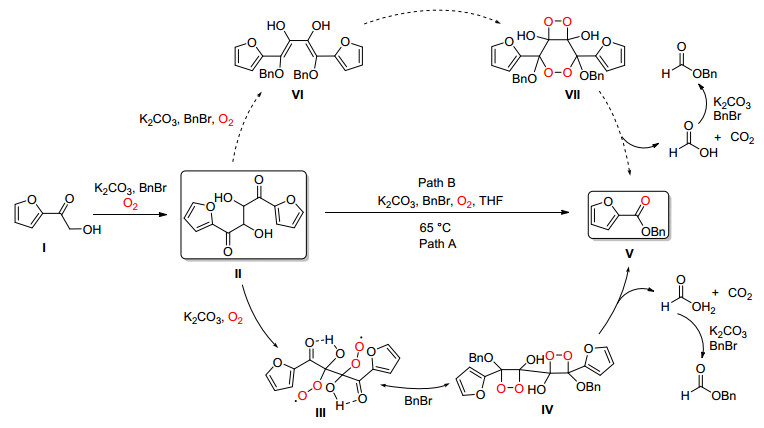
2012年, Jiang课题组[43]报道了氧气参与的非金属催化的α-羟基芳基酮发生C (sp2)(CO)—C (sp3) 单键断裂并与苄溴发生酯化的反应 (Eq. 31).
Jiang等认为 (Path A) 底物Ⅰ在碱、溴化苄和氧气下通过自由基中间体生成二聚体Ⅱ, Ⅱ在碱和氧气下生成双过氧化自由基Ⅲ, Ⅲ在BnBr作用下生成1, 2-二氧杂环丁烷结构的中间体Ⅳ, Ⅳ通过电子重排断裂, 释放一分子甲酸和二氧化碳并生成目标化合物Ⅴ(Scheme 35).
2013年, Jiang等[44]又提出了另外一条路径 (Path B), 二聚体Ⅱ与K2CO3, BnBr在氧气下生成中间体Ⅵ, Ⅵ通过[4+2]和[2+2]加成得到Ⅶ, Ⅶ最后通过断裂C (sp2)(CO)—C (sp3) 单键成为目标产物Ⅴ(Scheme 35).
2015年, Chu课题组[45]使用便宜的磺化硅胶作为催化剂, 在空气中催化苯胺类化合物与1, 3-二酮类化合物反应, 通过C (sp2)(CO)—C (sp3) 单键氧化断裂生成酰胺 (Eq. 32).
2016年, Adimurthy课题组[46]报道了在氧气下, AIBN促进1, 3-二酮C (sp2)(CO)—C (sp3) 单键断裂并与苯胺反应生成酰胺 (Eq. 33).该反应是一个自由基反应.
Adimurthy等认为偶氮二异丁腈 (AIBN) 在加热条件下通过失去氮气生成自由基Ⅰ, Ⅰ在氧气下生成过氧化自由基Ⅱ, 1, 3-二酮与苯胺缩合生成的中间体Ⅲ与过氧化自由基Ⅱ反应生成中间体Ⅴ, Ⅴ通过电子转移形成不稳定的1, 2-二氧杂环丁烷结构并通过断裂C (sp2)(CO)—C (sp3) 单键生成目标化合物 (Scheme 36).
3 结论与展望
综上所述, 氧气参与无张力碳-碳单键的断裂反应近年来取得了较大的进展, 但该类方法仍有一定的局限性, 比如还是以金属催化为主, 并且需与羟基、羰基等基团相连接.氧气在该类反应中主要作为氧化剂氧化催化金属或使底物生成不稳定的过氧化物而发挥作用.通过对该类反应的综述, 希望对氧气在该类反应中的作用机理有更加深刻的理解, 相信在不久的将来, 更加廉价、环保、选择性高、并可持续的碳-碳单键断裂新方法会不断被开发出来, 这些新的方法最终会广泛应用于有机合成、环境保护、工业生产等各个领域.
-
-
[1]
(a) Padwa, A.; Zhang, H. J. Org. Chem. 2007, 72, 2570.
(b) Ikeda, S.; Shibuya, M.; Iwabuchi, Y. Chem. Commun. 2007, 38, 504. -
[2]
(a) Huber, G. W.; Iborra, S.; Corma, A. Chem. Rev. 2006, 106, 4044.
(b) Hu, S.; Shima, T.; Hou, Z. Nature 2014, 512, 413. -
[3]
Seo, J.-H.; Lee, S.-M.; Lee, J.; Park, J.-B. J. Biotechnol. 2015, 216, 158.
-
[4]
(a) Chen, F.; Wang, T.; Jiao, N. Chem. Rev. 2014, 114, 8613.
(b) Ruhland, K. Eur. J. Org. Chem. 2012, 2012, 2683.
(c) Jun, C. H. Chem. Soc. Rev. 2004, 33, 610.
(d) Liu, H.; Feng, M.; Jiang, X. Chem.-Asian J. 2014, 9, 3360.
(e) Dermenci, A.; Coe, J. W.; Dong, G. Org. Chem. Front. 2014, 1, 567.
(f) Amadio, E.; Di Lorenzo, R.; Zonta, C.; Licini, G. Coord. Chem. Rev. 2015, 301-302, 147.
(g) Murakami, M.; Ito, Y. Top. Organomet. Chem. 1999, 3, 97. -
[5]
Miyaura, N.; Suzuki, A.; Miyaura, N.; Suzuki, A. J. Chem. Soc., Chem. Commun. 1979, 19, 866.
-
[6]
Heck, R. F. J. Am. Chem. Soc. 1968, 90, 5518.
-
[7]
Sonogashira, K.; Tohda, Y.; Hagihara, N. Tetrahedron Lett. 1975, 16, 4467. doi: 10.1016/S0040-4039(00)91094-3
-
[8]
Hanson, S. K.; Baker, R. T.; Gordon, J. C.; Scott, B. L.; Sutton, A. D.; Thorn, D. L. J. Am. Chem. Soc. 2009, 131, 428. doi: 10.1021/ja807522n
-
[9]
Kirihara, M.; Yoshida, K.; Noguchi, T.; Naito, S.; Matsumoto, N.; Ema, Y.; Torii, M.; Ishizuka, Y.; Souta, I. Tetrahedron Lett. 2010, 51, 3619. doi: 10.1016/j.tetlet.2010.04.134
-
[10]
Rozhko, E.; Raabova, K.; Macchia, F.; Malmusi, A.; Righi, P.; Accorinti, P.; Alini, S.; Babini, P.; Cerrato, G.; Manzoli, M.; Cavani, F. ChemCatChem 2013, 5, 1998. doi: 10.1002/cctc.v5.7
-
[11]
Liu, Z.-Q.; Zhao, L.; Shang, X.; Cui, Z. Org. Lett. 2012, 14, 3218. doi: 10.1021/ol301220s
-
[12]
Zhao, Y.; Cai, S.; Li, J.; Wang, D. Z. Tetrahedron 2013, 69, 8129.
-
[13]
Tnay, Y. L.; Chiba, S. Chem.-Asian J. 2015, 10, 873.
-
[14]
Cooke, H. A.; Peck, S. C.; Evans, B. S.; van der Donk, W. A. J. Am. Chem. Soc. 2012, 134, 15660. doi: 10.1021/ja306777w
-
[15]
Chen, Y. C.; Zhu, M. K.; Loh, T. P. Org. Lett. 2015, 17, 2712. doi: 10.1021/acs.orglett.5b01127
-
[16]
Zhang, L; Bi, X. H.; Guan, X. X.; Li, Q.; Barry, B. D.; Liao, P. Q. Angew. Chem., Int. Ed. 2013, 52, 11303.
-
[17]
Zhou, W.; Fan, W.; Jiang, Q.; Liang, Y.-F.; Jiao, N. Org. Lett. 2015, 17, 2542. doi: 10.1021/acs.orglett.5b01114
-
[18]
Xing, Q.; Lv, H.; Xia, C.; Li, F. Chem. Commun. 2016, 52, 489. doi: 10.1039/C5CC07390A
-
[19]
Wang, J.; Chen, W.; Zuo, S.; Liu, L.; Zhang, X.; Wang, J. Angew. Chem., Int. Ed. 2012, 51, 12334. doi: 10.1002/anie.v51.49
-
[20]
Sun, H.; Yang, C.; Gao, F.; Li, Z.; Xia, W. Org. Lett. 2013, 15, 624.
-
[21]
Wang, Z.; Li, L.; Huang, Y. J. Am. Chem. Soc. 2014, 136, 12233. doi: 10.1021/ja506352b
-
[22]
Zhang, C.; Wang, X.; Jiao, N. Synlett 2014, 45, 1458.
-
[23]
Maji, A.; Rana, S.; Akanksha; Maiti, D. Angew. Chem., Int. Ed. 2014, 53, 2428. doi: 10.1002/anie.201308785
-
[24]
Yu, J.; Yang, H.; Jiang, Y.; Fu, H. Chem.-Eur. J. 2013, 19, 4271. doi: 10.1002/chem.201204169
-
[25]
Song, R. J.; Liu, Y.; Hu, R. X.; Liu, Y. Y.; Wu, J. C.; Yang, X. H.; Li, J. H. Adv. Synth. Catal. 2011, 353, 1467. doi: 10.1002/adsc.201100225
-
[26]
Paria, S.; Halder, P.; Paine, T. K. Angew. Chem., Int. Ed. 2012, 51, 6299.
-
[27]
Sathyanarayana, P.; Ravi, O.; Muktapuram, P. R.; Bathula, S. R. Org. Biomol. Chem. 2015, 13, 9681. doi: 10.1039/C5OB01569C
-
[28]
Tsang, A. S. K.; Kapat, A.; Schoenebeck, F. J. Am. Chem. Soc. 2016, 138, 518. doi: 10.1021/jacs.5b08347
-
[29]
Lan, J.; Lin, J.; Chen, Z.; Yin, G. ACS Catal. 2015, 5, 2035. doi: 10.1021/cs501776n
-
[30]
Zhang, C.; Feng, P.; Jiao, N. J. Am. Chem. Soc. 2013, 135, 15257. doi: 10.1021/ja4085463
-
[31]
Xiaoqiang, H.; Xinyao, L.; Miancheng, Z.; Song, S.; Conghui, T.; Yizhi, Y.; Ning, J. J. Am. Chem. Soc. 2014, 136, 14858. doi: 10.1021/ja5073004
-
[32]
Ma, R.; He, L.-N.; Liu, A.-H.; Song, Q.-W. Chem. Commun. 2016, 52, 2145. doi: 10.1039/C5CC09146B
-
[33]
Parthasarathi, S.; Satrajit, I.; Kaliappan, K. P. Org. Lett. 2014, 16, 6212. doi: 10.1021/ol5031266
-
[34]
Tang, C.; Jiao, N. Angew. Chem., Int. Ed. 2014, 53, 6528. doi: 10.1002/anie.201403528
-
[35]
Ding, W.; Song, Q. Org. Chem. Front. 2015, 2, 765. doi: 10.1039/C5QO00101C
-
[36]
Chen, X.; Chen, T.; Li, Q.; Zhou, Y.; Han, L.-B.; Yin, S.-F. Chem.-Eur. J. 2014, 20, 12234. doi: 10.1002/chem.v20.38
-
[37]
Zhang, C.; Xu, Z.; Shen, T.; Wu, G.; Zhang, L.; Jiao, N. Org. Lett. 2012, 14, 2362. doi: 10.1021/ol300781s
-
[38]
Sun, J.; Tan, Q.; Yang, W.; Liu, B.; Xu, B. Adv. Synth. Catal. 2014, 356, 388.
-
[39]
Yan, Y.; Shi, M.; Niu, B.; Meng, X.; Zhu, C.; Liu, G.; Chen, T.; Liu, Y. RSC Adv. 2016, 6, 36192. doi: 10.1039/C6RA04195G
-
[40]
Hattori, T.; Takakura, R.; Ichikawa, T.; Sawama, Y.; Monguchi, Y.; Sajiki, H. J. Org. Chem. 2016, 81, 2737. doi: 10.1021/acs.joc.5b02632
-
[41]
Zhou, Y.; Rao, C.; Mai, S.; Song, Q. J. Org. Chem. 2016, 81, 2027. doi: 10.1021/acs.joc.5b02887
-
[42]
Zhou, M.; Chen, M.; Zhou, Y.; Yang, K.; Su, J.; Du, J.; Song, Q. Org. Lett. 2015, 17, 1786. doi: 10.1021/acs.orglett.5b00574
-
[43]
Liu, H.; Dong, C.; Zhang, Z.; Wu, P.; Jiang, X. Angew. Chem., Int. Ed. 2012, 51, 12570. doi: 10.1002/anie.201207206
-
[44]
Liu, H.; Jiang, X. Synlett 2013, 24, 1311.
-
[45]
Guo, R.; Zhu, C.; Sheng, Z.; Li, Y.; Yin, W.; Chu, C. Tetrahedron Lett. 2015, 56, 6223. doi: 10.1016/j.tetlet.2015.09.094
-
[46]
Rao, S. N.; Mohan, D. C.; Adimurthy, S. Tetrahedron 2016, 72, 4889.
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 32
- 文章访问数: 2324
- HTML全文浏览量: 546



 下载:
下载:



































 下载:
下载:

