 图 图式 1
原位制备联烯酯中间体参与的[2+2]环加成反应以及亲电螺环化反应
Figure 图式 1.
[2+2] cycloadditions and electrophilic spirocyclization of the in situ generated allenylic esters
图 图式 1
原位制备联烯酯中间体参与的[2+2]环加成反应以及亲电螺环化反应
Figure 图式 1.
[2+2] cycloadditions and electrophilic spirocyclization of the in situ generated allenylic esters

Citation: Zhao Lifang, Tong Xiaojuan, Zhu Haitao, Yang Desuo, Fan Mingjin. Intermolecular[2+2] Cycloaddition of in-situ Generated Allenylic Esters[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 646-651. doi: 10.6023/cjoc201609014

原位制备联烯酯的分子间[2+2]环加成反应研究
English
Intermolecular[2+2] Cycloaddition of in-situ Generated Allenylic Esters
-
Key words:
- allenylic esters
- / propargyl alcohols
- / [2+2]-cycloaddition
- / cyclobutanes
-
环丁烷类化合物广泛存在于细菌、真菌、陆地植物以及海洋无脊椎动植物中[1], 还作为中间体存在于初级代谢产物和次级代谢产物中[2], 而且许多该类化合物都具有重要的药理活性, 如抗菌、抗癌活性等[3].此外, 它们也是一类重要的有机合成中间体, 可以发生开环、扩环、缩环反应[4].因此, 研究其合成方法具有重要的科学意义和应用前景.
[2+2]环加成反应是合成环丁烷类化合物最直接有效的方法, 近年来人们对其相关的反应进行了较深入的研究.早期, 光或热条件下简单烯烃与烯烃的[2+2]环加成反应得到了广泛的研究[5], 随后, 发展了过渡金属 (如金、镍、铑等) 催化烯烃与共轭二烯、联烯或者炔的[2+2]环加成反应[6].最近, 高度立体选择性的烯烃参与的[2+2]环加成反应也被实现[7].此外, 应用重排[8]以及串联环化[9]等反应也能制备环丁烷类化合物.尽管这些方法可以有效地合成环丁烷类衍生物, 但仍存在一些不足, 例如, 反应条件苛刻, 昂贵金属催化剂的使用以及区域和立体选择性差等.因此, 寻找反应条件温和, 操作更加简单的方法仍然是一个挑战.
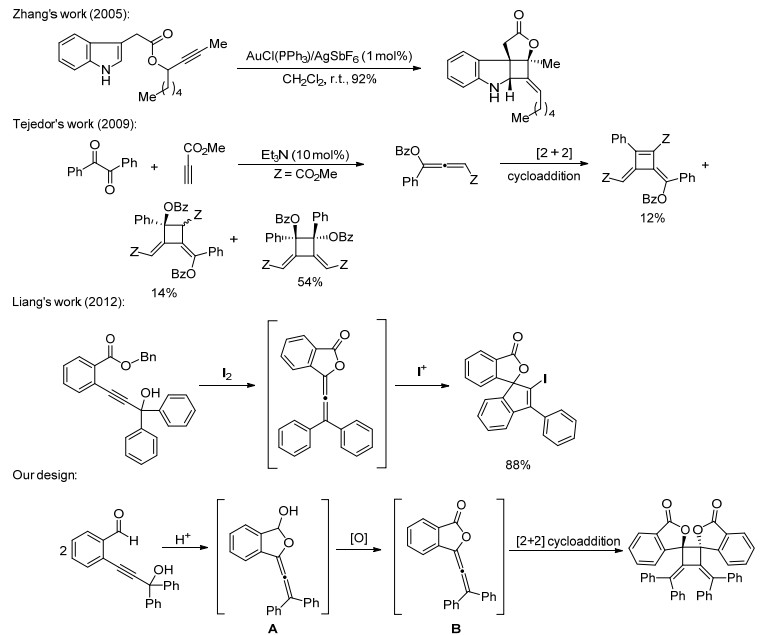
2005年, Zhang[10]以炔丙基酯为原料利用复合物AuCl (PPh3)/AgSbF6为催化剂实现了分步的3, 3-迁移、[2+2]环加成串联反应.据推测, 该反应过程中涉及联烯酯中间体.该反应条件温和, 选择性好, 但其使用的金/银复合物催化剂昂贵且操作要求高 (Scheme 1). 2009年, Tejedor等[11]利用丙炔酸甲酯与二芳基-1, 2-乙二酮在三乙胺的条件下形成1, 3-双官能团的联烯酯中间体, 随后发生分子间联烯酯的[2+2]环加成反应得到了环丁烷类化合物.但该反应的区域选择性不高, 使进一步的应用受到限制 (Scheme 1). 2012年Liang小组[12]报道了路易斯酸性碘活化炔丙醇的羟基, 随后邻位酯羰基的氧原子亲核进攻炔基原位得到了联烯酯中间体, 最后联烯酯中间体在碘鎓离子的活化作用下发生亲电环化反应 (Scheme 1).在以上反应的启发下, 我们设想以2-(3-羟基-3, 3-二芳基丙炔基) 苯甲醛为研究对象, 利用布朗斯特酸作为催化剂活化炔丙醇的羟基, 接着邻位醛羰基上的氧原子亲核进攻炔基产生半缩醛联烯中间体A, 进一步在氧化剂的作用下形成联烯酯中间体B, 从而实现联烯酯分子间的[2+2]环加成反应 (Scheme 1).经过反应的尝试, 成功地发展了以TsOH·H2O和三氧化铬吡啶盐酸盐 (PCC) 共同作用下的2-(3-羟基-3, 3-二芳基丙炔基) 苯甲醛原位制备联烯酯分子间[2+2]环加成反应, 构建了一系列高度取代的环丁烷类化合物.合成路线见Scheme 2.
 图 图式 1
原位制备联烯酯中间体参与的[2+2]环加成反应以及亲电螺环化反应
Figure 图式 1.
[2+2] cycloadditions and electrophilic spirocyclization of the in situ generated allenylic esters
图 图式 1
原位制备联烯酯中间体参与的[2+2]环加成反应以及亲电螺环化反应
Figure 图式 1.
[2+2] cycloadditions and electrophilic spirocyclization of the in situ generated allenylic esters
1 结果与讨论
1.1 反应条件优化
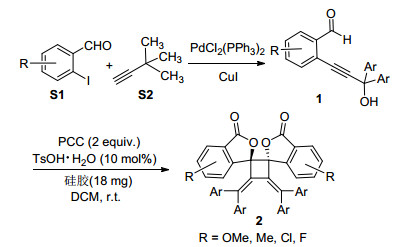
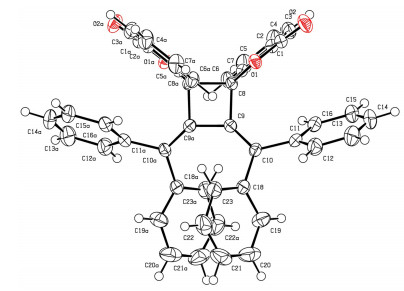
最初, 以2-(3-羟基-3, 3-二苯基丙炔基) 苯甲醛 (1a) 为原料, 在TsOH·H2O (10 mol%) 为催化剂, PCC (2 equiv.) 为氧化剂的条件下实现了原位制备联烯酯的[2+2]环加成反应, 以56%的产率生成环丁烷类化合物2a (Entry 2), 其结构通过X射线单晶衍射实验得到确证 (图 1), CCDC号为1422313.随后, 评估了氧化剂、催化剂、溶剂、温度以及催化剂和氧化剂的用量对反应产率的影响 (表 1).当分别使用氯铬酸吡啶 (PCC)、重铬酸吡啶盐 (PDC), 2, 3-二氯-5, 6-二氰基-1, 4-苯醌 (DDQ)、K2S2O8作为氧化剂时, 结果表明只有PCC有效, 而其它氧化剂均不能得到联烯酯中间体 (表 1, Entries 1~4).随后, 考察了不同的酸对反应体系的影响, 当加入Lewis酸CuSO4·5H2O和AgOAc时, 有2a产物生成, 但产率较低, 而加入Brfnsted酸HCl时, 该反应不能发生 (Entries 5~7).同时, 我们发现仅加入氧化剂PCC, 不加酸时, 没有生成2a产物 (Entry 8).这说明催化量的酸对反应体系起着至关重要的作用.此外, 对溶剂进行了筛选, 并没有得到好的结果.对反应温度进行了考察.当温度降低至0 ℃时, 产率反而降低.最后, 我们想通过改变对氧化剂和酸的用量来提高产率.当降低氧化剂的用量至1 equiv.时, 反应产率降低.当分别使用5, 15 mol%的对甲苯磺酸时, 未得到理想的结果.综上所述, 我们获得的最佳反应条件为:氧化剂PCC (2 equiv.), TsOH·H2O (10 mol%), silica gel (18 mg), DCM (2 mL), 反应温度为室温, 反应时间为10 h.
 表 1
原位制备联烯酯[2+2]环加成反应条件优化a
Table 1.
Optimization of reaction conditions for the [2+2] cycloaddition of allenylic esters
表 1
原位制备联烯酯[2+2]环加成反应条件优化a
Table 1.
Optimization of reaction conditions for the [2+2] cycloaddition of allenylic esters

Entry Oxidant (equiv.) Acid (mol%) Solventb Yieldc/% 1 PDC (2) TsOH·H2O (10) DCM 0 2 PCC (2) TsOH·H2O (10) DCM 56 3 DDQ (2) TsOH·H2O (10) DCM 0 4 K2S2O8(2) TsOH·H2O (10) DCM 0 5 PCC (2) CuSO4·5H2O (10) DCM 15 6 PCC (2) AgOAc (10) DCM <5 7 PCC (2) HCl (10) DCM 0 8 PCC (2) — DCM 0 9 PCC (2) TsOH·H2O (10) DCE Trace 10 PCC (2) TsOH·H2O (10) AcOH 36 11d PCC (2) TsOH·H2O (10) DCM 20 12 PCC (1) TsOH·H2O (10) DCM 39 13 PCC (2) TsOH·H2O (5) DCM 40 14 PCC (2) TsOH·H2O (15) DCM 45 a All reactions were run under the following conditions, unless otherwise indicated: 0.2 mmol of 1a with catalyst, oxidant and 18 mg of silica gel in 2 mL solvent at room temperature. b DCM: CH2Cl2, DCE: ClCH2CH2Cl. c Isolated yield. d At 0 ℃. 表 1 原位制备联烯酯[2+2]环加成反应条件优化a
Table 1. Optimization of reaction conditions for the [2+2] cycloaddition of allenylic esters1.2 底物的拓展
为了探究该方法的适用范围, 在最佳反应条件下, 我们对各种邻位二芳基炔丙醇苯甲醛底物进行了测试 (表 2).首先, 考察了炔丙醇芳基上不同取代基的电子效应对反应的影响.从表中可以看出当芳基上存在给电子基团 (OMe, Me) 时, 相应产物的产率比较低.造成这种结果的原因可能是:芳基上给电子基团具有稳定炔基正离子的作用, 不利于羰基上的氧亲核进攻炔键, 从而阻碍了联烯中间体的形成.当芳基上带有吸电子基团 (Cl, F) 时, 反应可以顺利进行, 能以正常的收率得到相应的四元环衍生物.接着, 尝试了苯甲醛芳基上的4-位和5-位含有卤素取代基的底物.以4-位为F和Cl原子取代的邻炔丙醇苯甲醛作为底物时, 分别以56%和51%的收率得到了2f和2g.底物的5-位带有F和Cl原子时, 分别以42%和37%的收率获得了相应的环丁烷衍生物2h和2i.结果显示, 芳基4-位含卤素取代的底物有利于形成联烯酯中间体, 进而发生分子间[2+2]环加成反应.当以9-芴炔醇苯甲醛作为底物, 在最佳反应条件下, 也能顺利地分离得到环丁烷化合物2j, 然而同2a相比较产率有所下降.
 表 2
氧化剂促进酸催化的邻位芳基炔丙醇苯甲醛[2+2]环加成反应a
Table 2.
PCC-promoted and TsOH·H2O-catalyzed [2+2] cyclo-addition reaction of o-arylpropynol benzaldehydes
表 2
氧化剂促进酸催化的邻位芳基炔丙醇苯甲醛[2+2]环加成反应a
Table 2.
PCC-promoted and TsOH·H2O-catalyzed [2+2] cyclo-addition reaction of o-arylpropynol benzaldehydes
 表 2 氧化剂促进酸催化的邻位芳基炔丙醇苯甲醛[2+2]环加成反应a
表 2 氧化剂促进酸催化的邻位芳基炔丙醇苯甲醛[2+2]环加成反应a
Table 2. PCC-promoted and TsOH·H2O-catalyzed [2+2] cyclo-addition reaction of o-arylpropynol benzaldehydes1.3 机理探究
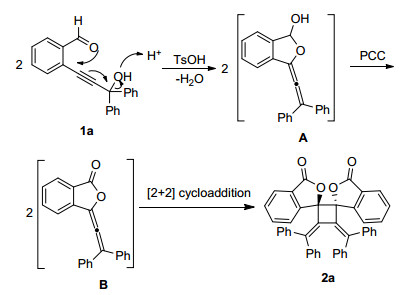
为了探究PCC在该反应中的作用机理.以1a为底物, 在最优反应条件下, 仅加入10 mol%的一水合对甲苯磺酸而不加氧化剂PCC, 并没有观测到四元环化合物3的生成 (Eq. 1).根据以上实验事实, 推测了该反应的可能机理.首先, 底物1a的醇羟基在质子酸活化下失去一份子水.随后, 醛羰基上的氧亲核进攻炔键形成半缩醛联烯中间体A.中间体A进一步在PCC的氧化作用下生成联烯酯中间体B.最后, 两分子联烯酯中间体B发生分子间[2+2]环加成反应生成四元环产物2a (Scheme 3).
2 结论
以PCC为氧化剂, TsOH·H2O为催化剂, 在室温条件下发展了一种2-(3-羟基-3, 3-二芳基丙炔基) 苯甲醛作为底物的原位制备联烯酯分子间的[2+2]环加成反应.该方法具有条件温和, 操作简单, 催化剂廉价易得, 区域选择性高等优点.这将为环丁烷类化合物的合成提供一种可行的方法.
3 实验部分
3.1 仪器与试剂
核磁共振氢谱1H NMR (400 MHz) 和13C NMR (100 MHz) 采用Agilent Technologies 400核磁共振仪测定, 所用溶剂为CDCl3, TMS为内标; 熔点测定仪采用北京泰克仪器有限公司生产的XT-4型熔点测定仪 (温度未经校正); 高分辨质谱使用AB SCIEX 4600型仪器测定; 红外光谱用PrekinElmer公司LR 64912C型光谱仪测定; 柱层析使用200~300目硅胶, 展开剂为石油醚 (60~90 ℃) 和乙酸乙酯.实验所用试剂均为市售分析纯试剂.
3.2 实验方法
3.3 产物数据表征
1, 1:2, 2-二 (3-异苯并呋喃酮)-3, 4-二 (二苯基甲叉基) 环丁烷 (2a):黄色固体, 35 mg, 产率56%. m.p. 323~324 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.86 (d, J=7.6 Hz, 2H), 7.62 (t, J=7.6 Hz, 2H), 7.55 (d, J=7.6 Hz, 2H), 7.43~7.39 (m, 2H), 7.10 (t, J=7.6 Hz, 2H), 7.01~6.96 (m, 10H), 6.84~6.78 (m, 8H); 13C NMR (100 MHz, CDCl3) δ: 168.6, 147.1, 141.7, 140.0, 138.8, 134.2, 132.7, 129.6, 129.1, 128.4, 128.4, 127.9, 127.5, 126.4, 125.1, 124.4, 92.4; IR (KBr) ν: 3060, 1771, 1583, 1451, 1059, 970 cm-1. HRMS (ESI) calcd for C44H28NaO4 (M+Na)+ 643.1880, found 643.1862.
1, 1:2, 2-二 (3-异苯并呋喃酮)-3, 4-二[二 (4'-甲氧基) 苯基甲叉基]环丁烷 (2b):黄色固体, 17 mg, 产率23%. m.p. 286~287 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.80 (d, J=7.8 Hz, 2H), 7.56~7.51 (m, 4H), 7.36 (d, J=7.6 Hz, 2H), 6.84 (d, J=9.2 Hz, 4H), 6.74 (d, J=7.2 Hz, 4H), 6.48 (d, J=8.8 Hz, 4H), 6.33 (d, J=9.2 Hz, 4H), 3.67 (s, 6H), 3.66 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 168.8, 160.2, 159.5, 146.9, 140.0, 134.0, 133.0, 131.5, 131.1, 130.7, 129.4, 126.6, 124.8, 124.7, 113.3, 112.6, 93.1, 55.4, 55.2; IR (KBr) ν: 3023, 1767, 1589, 1462, 1238, 973 cm-1. HRMS (ESI) calcd for C48H36NaO8 (M+Na)+763.2302, found 763.2298.
1, 1:2, 2-二 (3-异苯并呋喃酮)-3, 4-二[二 (4'-甲基) 苯基甲叉基]环丁烷 (2c):黄色固体, 24 mg, 产率35%. m.p. 304~305 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.04~8.02 (m, 3H), 7.93~7.90 (m, 3H), 7.83 (d, J=8.0 Hz, 1H), 7.59~7.52 (m, 4H), 7.38 (t, J=7.6 Hz, 1H), 6.81~6.76 (m, 4H), 6.67 (d, J=7.6 Hz, 3H), 6.57 (d, J=8.0 Hz, 3H), 2.18 (s, 6H), 2.14 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 168.8, 147.5, 141.0, 138.2, 138.1, 137.5, 136.2, 134.1, 131.7, 129.6, 129.4, 129.1, 128.5, 127.9, 126.4, 124.9, 124.5, 92.6, 21.2, 21.1; IR (KBr) ν: 3021, 1776, 1623, 1503, 1067, 972. HRMS (ESI) calcd for C48H36NaO4 (M+Na)+699.2506, found 699.2496.
1, 1:2, 2-二 (3-异苯并呋喃酮)-3, 4-二[二 (4'-氯) 苯基甲叉基]环丁烷 (2d):黄色固体, 42 mg, 产率55%. m.p. 295~296 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.72 (d, J=8.0 Hz, 2H), 7.59~7.54 (m, 4H), 7.40 (t, J=7.6 Hz, 2H), 6.94~6.84 (m, 12H), 6.72 (d, J=7.6 Hz, 4H); 13C NMR (100 MHz, CDCl3) δ: 168.2, 145.0, 140.2, 137.9, 136.5, 135.2, 135.0, 134.4, 130.8, 130.5, 130.0, 128.3, 128.1, 126.6, 125.3, 124.8, 92.7; IR (KBr) ν: 3059, 1776, 1595, 1489, 1281, 969 cm-1. HRMS (ESI) calcd for C44H24Cl4-NaO4 (M+Na)+779.0321, found 779.0329.
1, 1:2, 2-二 (3-异苯并呋喃酮)-3, 4-二[二 (4'-氟) 苯基甲叉基]环丁烷 (2e):黄色固体, 40 mg, 产率57%. m.p. 290~291 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.74 (d, J=8.0 Hz, 2H), 7.58~7.54 (m, 4H), 7.38 (t, J=7.6 Hz, 2H), 6.98~6.95 (m, 4H), 6.79~6.76 (m, 4H), 6.67~6.59 (m, 8H); 13C NMR (100 MHz, CDCl3) δ: 168.3, 164.3, 164.1, 161.8, 161.6, 140.0, 135.8, 135.7, 134.5, 134.4, 134.3, 131.4, 131.3, 131.1, 131.0, 129.9, 126.7, 125.2, 124.8, 115.2, 115.0, 114.9, 114.7, 92.8; IR (KBr) ν: 2953, 1771, 1589, 1492, 1223, 749 cm-1. HRMS (ESI) calcd for C44H24F4NaO4 (M+Na)+715.1503, found 715.1516.
1, 1:2, 2-二[3-(4-氟) 异苯并呋喃酮]-3, 4-二 (二苯甲叉基) 环丁烷 (2f):黄色固体, 37 mg, 产率56%. m.p. 292~293 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.54~7.50 (m, 2H), 7.47 (dd, J=7.8, 2.4 Hz, 2H), 7.14~7.06 (m, 4H), 7.03 (t, J=8.0 Hz, 4H), 6.99~6.93 (m, 6H), 6.86~6.79 (m, 8H); 13C NMR (100 MHz, CDCl3) δ: 167.6, 167.2, 165.1, 149.3, 149.2, 142.6, 139.7, 138.6, 129.7, 129.1, 128.7, 128.6, 128.0, 127.6, 127.5, 127.4, 112.0, 111.8, 91.9; IR (KBr) ν: 3052, 1774, 1600, 1478, 1271, 990 cm-1. HRMS (ESI) calcd for C44H26F2NaO4 (M+Na)+679.1691, found 679.1695.
1, 1:2, 2-二[3-(4-氯) 异苯并呋喃酮]-3, 4-二 (二苯甲叉基) 环丁烷 (2g):黄色固体, 35 mg, 产率51%. m.p. 305~306 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.75 (d, J=2.4 Hz, 2H), 7.43 (d, J=8.4 Hz, 2H), 7.34 (dd, J=8.0, 2.2 Hz, 2H), 7.12~7.08 (m, 2H), 7.05~6.97 (m, 7H), 6.94 (d, J=7.2 Hz, 3H), 6.87~6.79 (m, 8H); 13C NMR (100 MHz, CDCl3) δ: 167.3, 147.8, 142.7, 140.9, 139.6, 138.5, 132.1, 130.5, 129.8, 129.1, 128.7, 128.6, 128.0, 127.5, 126.2, 125.0, 124.9, 92.1; IR (KBr) ν: 3056, 1770, 1597, 1448, 1238, 989 cm-1. HRMS (ESI) calcd for C44H26Cl2NaO4 (M+Na)+711.1100, found 711.1110.
1, 1:2, 2-二[3-(5-氟) 异苯并呋喃酮]-3, 4-二 (二苯甲叉基) 环丁烷 (2h):黄色固体, 27 mg, 产率42%. m.p. 261~262 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.74 (dd, J=8.6, 4.4 Hz, 2H), 7.28~7.22 (m, 2H), 7.15 (dd, J=7.2, 2.4 Hz, 2H), 7.12~7.08 (m, 2H), 7.03~6.94 (m, 10H), 6.85~6.80 (m, 8H); 13C NMR (100 MHz, CDCl3) δ: 167.2, 167.2, 164.6, 162.2, 142.7, 141.4, 139.8, 138.7, 129.7, 129.2, 128.6, 128.6, 128.0, 127.6, 122.2, 121.9, 111.4, 111.2, 92.8; IR (KBr) ν: 3075, 1763, 1483, 1262, 1090, 910 cm-1. HRMS (ESI) calcd for C44H26F2NaO4 (M+ Na)+679.1691, found 679.1688.
1, 1:2, 2-二[3-(5-氯) 异苯并呋喃酮]-3, 4-二 (二苯甲叉基) 环丁烷 (2i):黄色固体, 25 mg, 产率37%. m.p. 281~282 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.71 (d, J=8.2 Hz, 2H), 7.52 (dd, J=8.2, 2.0 Hz, 2H), 7.47 (dd, J=2.0, 0.4 Hz, 2H), 7.12 (t, J=7.6 Hz, 2H), 7.04~6.93 (m, 10H), 6.83~6.79 (m, 8H); 13C NMR (100 MHz, CDCl3) δ: 166.9, 144.2, 142.7, 139.7, 138.6, 136.1, 134.4, 132.3, 129.7, 129.2, 128.7, 128.7, 128.3, 128.1, 127.6, 125.9, 124.9, 92.7; IR (KBr) ν: 3055, 1773, 1590, 1441, 1243, 981 cm-1. HRMS (ESI) calcd for C44H26Cl2NaO4 (M+ Na)+711.1100, found 711.1085.
1, 1:2, 2-二 (3-异苯并呋喃酮)-3, 4-二[(9-芴) 甲叉基]环丁烷 (2j):黄色固体, 30 mg, 产率48%. m.p. 299~300 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.00 (d, J=7.2 Hz, 2H), 7.69 (t, J=7.2 Hz, 4H), 7.64~7.56 (m, 6H), 7.40 (d, J=8.0 Hz, 2H), 7.32 (dd, J=13.2, 7.2 Hz, 4H), 7.04 (t, J=7.6 Hz, 2H), 6.94 (t, J=7.6 Hz, 2H), 6.63 (d, J=8.0 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 168.7, 147.4, 141.4, 141.3, 138.7, 136.7, 136.6, 135.3, 132.7, 130.8, 130.6, 130.2, 128.0, 127.8, 126.0, 125.9, 125.6, 125.2, 123.9, 120.4, 120.1, 91.6; IR (KBr) ν: 3060, 1777, 1589, 1465, 1285, 979 cm-1. HRMS (ESI) calcd for C44H24NaO4 (M+Na)+639.1567, found 639.1575.
辅助材料 (Supporting Information) 产物的核磁氢谱和碳谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.1 底物的合成
将邻碘苯甲醛S1 (10 mmol) 溶于三乙胺 (5 mL) 中, 室温下通入氩气边搅拌边加入PdCl2(PPh3)2 (4 mol%, 0.4 mmol) 和CuI (2 mol%, 0.2 mmol), 继续搅拌5 min后, 向反应混合物中逐滴加入芳基炔丙醇S2 (10.5 mmol) 的三乙胺溶液, 滴加完毕后, 室温下搅拌过夜.薄层色谱检测反应完全后加入10 mL饱和NH4Cl溶液淬灭反应, 再用乙酸乙酯萃取 (15 mL×3), 合并萃取液, 水洗, 饱和NaCl溶液洗, 用无水NaSO4干燥.减压旋蒸, 经柱层析色谱纯化[V(石油醚):V(乙酸乙酯)=10:1]得1.
3.2.2 产物2a~2j的合成
在15 mL反应管中, 将底物1 (0.2 mmol) 溶于二氯甲烷 (2 mL) 中, 再依次加入硅胶 (18 mg), TsOH·H2O (10 mol%, 0.02 mmol), PCC (2 equiv, 0.4 mmol), 然后在室温下搅拌10 h.薄层色谱检测反应完全后加入5 mL水, 再用乙酸乙酯萃取 (15 mL×3), 合并萃取液, 水洗, 饱和NaCl溶液洗, 用无水NaSO4干燥.减压旋蒸, 经柱层析色谱纯化[V(石油醚):V(乙酸乙酯)=5:1]得目标产物2.
-
-
[1]
(a) Misonou, T.; Saitoh, J.; Oshiba, S.; Tokitomo, Y.; Maegawa, M.; Inoue, Y.; Hori, H.; Sakurai, T. Mar. Biotechnol. 2003, 5, 194.
(b) Vikram, A.; Hamzehzarghani, H.; Kushalappa, A. C. Can. J. Plant. Pathol. 2005, 27, 194.
(c) Xu, X. X.; Wei, Z. L.; Bai, X. Chin. J. Org. Chem. 2006, 26, 354 (in chinese).
(徐显秀, 魏忠林, 柏旭, 有机化学, 2006, 26, 354.) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract337146.shtml -
[2]
(a) Dembitsky, V. M. Russ. J. Bioorg. Chem. 2002, 28, 196.
(b) Dembitsky, V. M.; Gloriozova, T.; Poroikov, V. V. Mini-Rev. Med. Chem. 2005, 5, 319.
(c) Dembitsky, V. M. Lipids 2005, 40, 1081. -
[3]
(a) Bernan, V. S.; Roll, D. M.; Ireland, C. M.; Greenstein, M.; Maiese, W. M.; Steinberg, D. A. J. Antimicrob. Chemother. 1993, 32, 539.
(b) Jordan, M. A.; Wilson, L. Nat. Rev. Cancer 2004, 4, 253. -
[4]
(a) Dai, J. Q.; Jiménez, J. I.; Kelly, M.; Williams, P. G. J. Org. Chem. 2010, 75, 2399.
(b) Murakami, M.; Miyamoto, Y.; Ito, Y. Angew. Chem., Int. Ed. 2001, 40, 189.
(c) Chen, B. C.; Ngu, K.; Guo, P.; Liu, W.; Sundeen, J. E.; Weinstein, D. S.; Atwal, K. S.; Ahmad, S. Tetrahedron Lett. 2001, 42, 6227.
(d) Miyata, J.; Nemoto, H.; Ihara, M. J. Org. Chem. 2000, 65, 504. -
[5]
(a) Wu, B.-Q.; Wu, G.-S. Chin. J. Org. Chem. 1990, 10, 106 (in chinese).
(吴碧奇, 吴国生, 有机化学, 1990, 10, 106.)
(b) Blomquist, A. T.; Verdol, J. A. J. Am. Chem. Soc. 1956, 78, 109.
(c) Maverick, O. J.; Muscio, J.; Jacobs, T. L. J. Org. Chem. 1992, 57, 7346.
(d) Schuster, D. I.; Lem, G.; Kaprinidis, N. A. Chem. Rev. 1993, 93, 3.
(e) Iriondo-Alberdi, J.; Greaney, M. F. Eur. J. Org. Chem. 2007, 4801.
(f) Hoffmann, N. Chem. Rev. 2008, 108, 1052.
(g) Ischay, M. A.; Lu, Z.; Yoon, T. P. J. Am. Chem. Soc. 2010, 132, 8572. (h) Duan, G.-J.; Ling, J.-B.; Wang, W.-P.; Luo, Y.-C.; Xu, P.-F. Chem. Commun. 2013, 49, 4625. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract330674.shtml -
[6]
(a) Saito, S.; Hirayama, K.; Kabuto, C.; Yamamoto, Y. J. Am. Chem. Soc. 2000, 122, 10776.
(b) Oh, C. H.; Park, D. I.; Jung, S. H.; Reddy, V. R.; Gupta, A. K.; Kim, Y. M. Synlett 2005, 2092.
(c) Jiang, X.; Cheng, X.; Ma, S. Angew. Chem., Int. Ed. 2006, 45, 8009.
(d) Luzung, M. R; Mauleón, P.; Toste, F. D. J. Am. Chem. Soc. 2007, 129, 12402.
(e) Lu, P.; Ma, S. Chin. J. Chem. 2010, 28, 1600.
(f) Ebisawa, M.; Kusama, H.; Iwasawa, N. Chem. Lett. 2012, 41, 786.
(g) William, T.; Kelsey, J.; Jordan, G.; Neil, C. Adv. Org. Synth. 2013, 6, 59. -
[7]
(a) Brimioulle, R.; Bauer, A.; Bach, T. J. Am. Chem. Soc. 2015, 137, 8131.
(b) Conner, M. L.; Xu, Y.; Brown, M. K. J. Am. Chem. Soc. 2015, 137, 3482. -
[8]
Tsao, K. W.; Isobe, M. Org. Lett. 2010, 12, 5338. doi: 10.1021/ol102383g
-
[9]
Barluenga, J.; Álvarez-Pérez, M.; Wuerth, K.; Rodríguez, F.; Fańanás, F. J. Org. Lett. 2003, 5, 905.
-
[10]
Zhang, L. J. Am. Chem. Soc. 2005, 127, 16804. doi: 10.1021/ja056419c
-
[11]
Tejedor, D.; Méndez-Abt, G.; González-Platas, J.; Ramírez, M. A.; García-Tellado, F. Chem. Commun. 2009, 2368.
-
[12]
Zhu, H.-T.; Dong, X.; Wang, L.-J.; Zhong, M.-J.; Liu, X.-Y.; Liang, Y.-M. Chem. Commun. 2012, 48, 10748. doi: 10.1039/c2cc36127b
-
[1]
-
表 1 原位制备联烯酯[2+2]环加成反应条件优化a
Table 1. Optimization of reaction conditions for the [2+2] cycloaddition of allenylic esters

Entry Oxidant (equiv.) Acid (mol%) Solventb Yieldc/% 1 PDC (2) TsOH·H2O (10) DCM 0 2 PCC (2) TsOH·H2O (10) DCM 56 3 DDQ (2) TsOH·H2O (10) DCM 0 4 K2S2O8(2) TsOH·H2O (10) DCM 0 5 PCC (2) CuSO4·5H2O (10) DCM 15 6 PCC (2) AgOAc (10) DCM <5 7 PCC (2) HCl (10) DCM 0 8 PCC (2) — DCM 0 9 PCC (2) TsOH·H2O (10) DCE Trace 10 PCC (2) TsOH·H2O (10) AcOH 36 11d PCC (2) TsOH·H2O (10) DCM 20 12 PCC (1) TsOH·H2O (10) DCM 39 13 PCC (2) TsOH·H2O (5) DCM 40 14 PCC (2) TsOH·H2O (15) DCM 45 a All reactions were run under the following conditions, unless otherwise indicated: 0.2 mmol of 1a with catalyst, oxidant and 18 mg of silica gel in 2 mL solvent at room temperature. b DCM: CH2Cl2, DCE: ClCH2CH2Cl. c Isolated yield. d At 0 ℃. 表 2 氧化剂促进酸催化的邻位芳基炔丙醇苯甲醛[2+2]环加成反应a
Table 2. PCC-promoted and TsOH·H2O-catalyzed [2+2] cyclo-addition reaction of o-arylpropynol benzaldehydes

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 1894
- HTML全文浏览量: 272


 下载:
下载:



 下载:
下载:

