 图 1
含吡啶、呋喃或喹喔啉药物分子的结构
Figure Figure1.
Medicinal structures containing pyridine, furan or quinoxaline
图 1
含吡啶、呋喃或喹喔啉药物分子的结构
Figure Figure1.
Medicinal structures containing pyridine, furan or quinoxaline

Citation: Zhang Meimei, Wang Jie, Liu Jianquan, Wang Xiangshan. One-Pot and Three-Component Synthesis of Furopyridoquinoxaline Derivatives under Catalyst-Free Conditions[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1565-1570. doi: 10.6023/cjoc201608020

无催化条件下三组分一锅法合成呋喃并吡啶并喹喔啉衍生物
English
One-Pot and Three-Component Synthesis of Furopyridoquinoxaline Derivatives under Catalyst-Free Conditions
-
Key words:
- furopyridoquinoxaline
- / 6-aminoquinoxaline
- / three-component reaction
- / crystal structure
- / synthesis
-
Hantzsch反应是合成1, 4-二氢吡啶的重要方法[1].该方法最初是利用1分子醛与2分子活性亚甲基化合物, 在氨催化下进行的反应.其中氨既是反应物(氨首先与一分子的活性亚甲基化合物反应, 形成活性较高的烯胺), 又是催化剂促进Knoevenagel缩合反应的进行.该方法目前仍然被经常用来合成结构多样化的1, 4-二氢化吡啶或多氢化喹啉衍生物[2].最近, 随着有机合成化学的突飞猛进, 采用活性较高的芳胺类化合物, 例如2-萘胺、6-氨基喹啉、6-氨基吲唑、5-氨基吲哚、5-氨基吲唑等, 代替Hantzsch反应过程中形成的烯胺, 参与芳醛和活性亚甲基化合物的反应, 同样可以高产率地获得多氢化喹啉或其它含1, 4-二氢化吡啶类化合物[3].
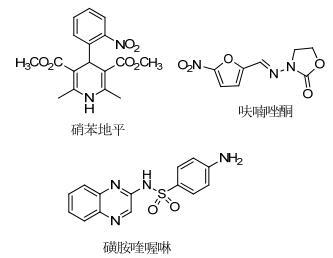
众所周知, 1, 4-二氢吡啶是重要的具有药用价值的杂环分子, 也是钙离子通道调节剂类药物的重要母核[4].例如硝苯地平[5], 化学名为2, 6-二甲基-4-(2-硝基苯基)-1, 4-二氢吡啶-3, 5-二羧酸二甲酯(图 1), 在临床主要用于预防和治疗冠心病心绞痛, 特别是变异型心绞痛和冠状动脉痉挛所致心绞痛.还适用于各种类型的高血压, 对顽固性、重度高血压也有较好疗效.呋喃唑酮[6]是一种硝基呋喃类抗生素(图 1), 可用于治疗细菌和原虫引起的痢疾、肠炎、胃溃疡等胃肠道疾患, 该药物的生理药理作用是基于呋喃杂环的骨架.而磺胺喹喔啉[7]是基于喹喔啉骨架的杂环(图 1), 在市场上广泛用于抗球虫病.此外, 采用季酮酸作为活性亚甲基, 参与芳醛和胺的反应, 例如苯胺[8]、2-萘胺[9]、1-萘胺[10]、胡椒胺[11]、2-蒽胺[12]、6-氨基喹啉[13]、5-氨基吡唑[14]、6-氨基吲唑或5-氨基吲哚[15]、5-氨基吲唑[16]和2-氨基吡唑[17], 目前尚没有关于6-氨基喹喔啉参与该类反应的报道, 通过此反应可以成功构筑分子内同时含有吡啶、呋喃和喹喔啉稠合杂环骨架.我们依据结构组合和活性叠加原理, 将活性较好的吡啶、呋喃和喹喔啉母环结合起来, 期望可以获得生物和药理活性更好、毒副作用更小的先导性化合物.本文使用6-氨基喹喔啉作为活性的烯胺、与芳醛、季酮酸(活性亚甲基化合物), 通过Hantzsch反应构建1, 4-二氢吡啶环, 三组分一步合成稠合四环呋喃并吡啶并喹喔啉衍生物, 并同时报道化合物4g的晶体结构.
 图 1
含吡啶、呋喃或喹喔啉药物分子的结构
Figure Figure1.
Medicinal structures containing pyridine, furan or quinoxaline
图 1
含吡啶、呋喃或喹喔啉药物分子的结构
Figure Figure1.
Medicinal structures containing pyridine, furan or quinoxaline
1 结果与讨论
将等物质的量芳醛(1)、6-氨基喹喔啉(2)和季酮酸(3)混合于无水乙醇中, 回流反应0.5 h, 无需加入任何催化剂, 即可较高产率地得到11-芳基-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮衍生物4 (Eq. 1).
该反应无需加入额外的催化剂, 例如酸或碱, 在乙醇回流的条件下, 即可获得很好的收率.我们最初使用4-氯苯甲醛(1a)与2、3的反应, 尝试使用其他的溶剂希望能进一步提高4a的收率(表 1), 例如甲醇、N, N-二甲基甲酰胺(DMF)和四氢呋喃(THF), 发现还是乙醇给出最高的收率(89%).使用DMF为溶剂先需要减压回收溶剂, 再用乙醇重结晶, 处理相对复杂.使用乙醇为溶剂, 通过薄层色谱(TLC)检测反应的进程[底物2反应完全, 展开剂为V(乙酸乙酯):V(石油醚)=1:3].反应结束后, 冷却到室温, 析出大量固体, 过滤即可得到化合物4a.在乙醇中, 如果降低反应温度到50 ℃, 反应产率只有62%;在室温下, 反应不能发生, 没有分离到预期的产物.此外, 根据反应的历程, 无论是Knoevenagel缩合反应还是Michael加成反应, 都需要碱的参与.但是向体系中额外加入碱, 例如三乙胺、DBU或哌啶, 4a的产率还不如无催化条件下高, 只有中等的产率(68~75%).
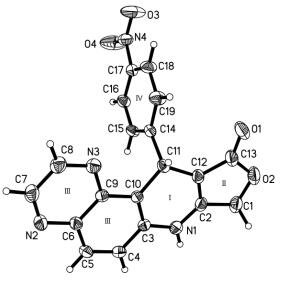
在无催化的条件下, 使用乙醇作为反应的溶剂, 改变不同的苯甲醛, 例如吸电子的卤代苯甲醛, 4-氰基苯甲醛和4-硝基苯甲醛, 还是供电子含甲氧基的苯甲醛; 无论单取代、二取代, 还是三取代的3, 4, 5-三甲氧基苯甲醛, 产物4均可以获得很好的收率(86%~95%)(表 2).产物4的结构都通过氢谱、红外和高分辨质谱加以表征.为了进一步确证产物的结构, 我们以DMF为溶剂, 培养和测定了产物4g的单晶, 结构图见图 2.
X衍射分析表明1, 4-二氢吡啶[C(2)—C(3)/N(1)/C(10)—C(12)]环采用半椅式构象:其中原子C(2)、C(3)、N(1)、C(10) 和C(12) 共平面[平面Ⅰ, 平面的原子平均偏差为0.014(2) Å], 但是原子C(11) 偏离该平面的距离为0.127(2) Å.相邻呋喃环(平面Ⅱ)上的原子C(1) 尽管采用sp3杂化, 但是环上所有原子的平均偏差只有0.008(1) Å, 表明该平面上所有的原子均处于同一个平面上.喹喔啉环[平面Ⅲ, C(3)—C(10)/N(2)/N(3)]和苯环[平面Ⅳ, C(14)—C(19)]均为平面结构.中心的1, 4-二氢吡啶(平面Ⅰ)几乎平行于呋喃环(平面Ⅱ)和喹喔啉环(平面Ⅲ), 形成的二面角分别为3.4(1)°和2.7(1)°.该平面还几乎垂直于苯环(平面Ⅳ), 形成的二面角为84.2(1)°.
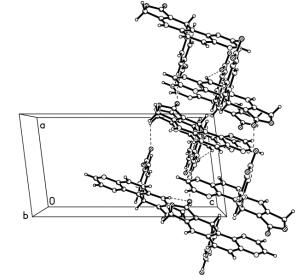
分子中尽管只有一个N—H键, 但是分子存在4个分子间氢键(表 3), 分别为C(16)—H(16A)…O(1), C(1)—H(1B)…O(4), C(5)—H(5A)…O(3) 和N(1)—H(1)…O(1).其中只有第四个N(1)—H(1)…O(1) 为经典的分子间氢键, 其他三个都是利用碳-氢(C—H)作为氢键的给予体, 这种又被称作非常规的氢键.由于这4个氢键的给予体和接受体均非相邻, 分子内相距较远, 使相邻的分子首尾相连形成多聚体, 为三维的空间网状结构(图 3).
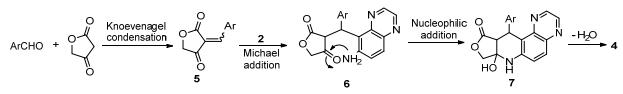
根据产物4的结构, 我们认为该反应可能经过醛与季酮酸的Knoevenagel缩合反应生成α, β-不饱和酮5; 再是活性的6-氨基喹喔啉2与5的Michael加成反应, 形成中间产物6; 6发生分子内的亲核加成, 7最后失去一分子水得到最终的目标产物4.具体可能如Scheme 1.
2 结论
以乙醇为溶剂, 三组分的醛、6-氨基喹喔啉和季酮酸为原料, 无需加入任何额外的催化剂, 可以一步合成稠合四环的呋喃并吡啶并喹喔啉衍生物.该过程具有反应条件温和、产率高和后处理操作简单等优点. X衍射分析表明新形成的1, 4-二氢吡啶环采用半椅式构象.
3 实验部分
3.1 仪器与试剂
熔点测定使用XT-5型数字熔点仪; 红外光谱采用TENSOR 27型红外光谱仪测定(KBr压片); 核磁共振氢谱采用Bruker AVANCE DPX-400型核磁共振仪测定, DMSO-d6为溶剂, TMS为内标; 高分辨质谱在Bruker-micro-TOF-Q-MS质谱仪上测定.
3.2 产物4的实验方法
将芳醛1 (1.0 mmol)、6-氨基喹喔啉(2) (145 mg, 1.0 mmol)、季酮酸(3) (100 mg, 1.0 mmol)依次加入到50 mL干燥的圆底烧瓶中, 最后加入无水乙醇(10 mL).搅拌加热轻微回流反应保持3~8 h, 通过薄层色谱(TLC)检测反应的进程到底物2反应完全[展开剂为V(乙酸乙酯):V(石油醚)=1:3].反应结束后, 冷却到室温, 析出大量固体, 过滤即可得到产物4.
11-(4-氯苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4a): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.68 (s, 1H, NH), 8.77 (d, J=1.6 Hz, 1H, ArH), 8.72 (d, J=1.6 Hz, 1H, ArH), 8.01 (d, J=8.8 Hz, 1H, ArH), 7.61 (d, J=8.8 Hz, 1H, ArH), 7.23 (d, J=8.8 Hz, 2H, ArH), 7.19 (d, J=8.8 Hz, 2H, ArH), 5.88 (s, 1H, CH), 5.07 (d, J=16.0 Hz, 1H, CH), 4.97 (d, J=16.0 Hz, 1H, CH); IR (KBr) ν: 3256, 3123, 3061, 1717, 1663, 1603, 1494, 1464, 1405, 1348, 1298, 1196, 1107, 1086, 1013, 869, 841, 812, 741, 697 cm-1. HRMS (ESI) calcd for C19H11ClN3O2 [M-H]- 348.0540, found 348.0542.
11-(2-氯苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4b): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.69 (s, 1H, NH), 8.69 (d, J=2.0 Hz, 1H, ArH), 8.66 (d, J=2.0 Hz, 1H, ArH), 7.98 (d, J=8.8 Hz, 1H, ArH), 7.58 (d, J=8.8 Hz, 1H, ArH), 7.28 (dd, J=7.6, 1.2 Hz, 1H, ArH), 7.16 (d, J=7.6 Hz, 1H, ArH), 7.12~7.03 (m, 2H, ArH), 6.22 (s, 1H, CH), 5.03 (d, J=16.0 Hz, 1H, CH), 4.97 (d, J=16.0 Hz, 1H, CH); IR (KBr) ν: 3273, 3176, 1735, 1651, 1601, 1464, 1442, 1414, 1373, 1345, 1201, 1067, 1047, 1015, 865, 834, 798, 758, 702 cm-1. HRMS (ESI) calcd for C19H11ClN3O2 [M-H]- 348.0540, found 348.0543.
11-(3-溴苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4c): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.69 (s, 1H, NH), 8.77 (d, J=2.0 Hz, 1H, ArH), 8.72 (d, J=2.0 Hz, 1H, ArH), 8.01 (d, J=8.8 Hz, 1H, ArH), 7.61 (d, J=8.8 Hz, 1H, ArH), 7.33 (s, 1H, ArH), 7.28~7.23 (m, 1H, ArH), 7.16~7.13 (m, 2H, ArH), 5.86 (s, 1H, CH), 5.08 (d, J=16.0 Hz, 1H, CH), 4.96 (d, J=16.0 Hz, 1H, CH); IR (KBr) ν: 3256, 3172, 3093, 3028, 2928, 1720, 1647, 1604, 1517, 1497, 1466, 1413, 1346, 1304, 1198, 1069, 1040, 1017, 867, 838, 819, 750, 695 cm-1. HRMS (ESI) calcd for C19H11BrN3O2 [M-H]- 392.0035, found 392.0026.
11-(4-溴苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4d): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.70 (s, 1H, NH), 8.77 (d, J=1.2 Hz, 1H, ArH), 8.73 (d, J=1.3 Hz, 1H, ArH), 8.02 (d, J=9.2 Hz, 1H, ArH), 7.62 (d, J=9.2 Hz, 1H, ArH), 7.37 (d, J=8.4 Hz, 2H, ArH), 7.14 (d, J=8.4 Hz, 2H, ArH), 5.87 (s, 1H, CH), 5.07 (d, J=16.0 Hz, 1H, CH), 4.97 (d, J=16.0 Hz, 1H, CH); 13C NMR (DMSO-d6, 400 MHz) δ: 172.2, 158.2, 145.8, 145.4, 143.5, 141.5, 140.4, 138.5, 131.3, 130.3, 130.1, 122.3, 119.5, 116.8, 98.2, 65.7, 35.5; IR (KBr) ν: 3236, 3173, 3056, 2895, 1716, 1648, 1603, 1578, 1493, 1463, 1402, 1347, 1296, 1017, 1009, 981, 850, 831, 811, 758, 689 cm-1. HRMS (ESI) calcd for C19H11Br-N3O2 [M-H]- 392.0035, found 392.0049.
11-(4-氟苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4e): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.67 (s, 1H, NH), 8.78 (d, J=2.0 Hz, 1H, ArH), 8.72 (d, J=2.0 Hz, 1H, ArH), 8.00 (d, J=9.2 Hz, 1H, ArH), 7.61 (d, J=9.2 Hz, 1H, ArH), 7.22~7.19 (m, 2H, ArH), 7.02~7.97 (m, 2H, ArH), 5.89 (s, 1H, CH), 5.08 (d, J=15.6 Hz, 1H, CH), 4.97 (d, J=15.6 Hz, 1H, CH); IR (KBr) ν: 3260, 3154, 3071, 1719, 1666, 1651, 1598, 1517, 1464, 1417, 1381, 1347, 1197, 1153, 1020, 867, 839, 802, 755, 694 cm-1. HRMS (ESI) calcd for C19H11FN3O2 [M-H]- 332.0835, found 332.0854.
11-(4-氰基苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4f): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.74 (s, 1H, NH), 8.72 (d, J=2.0 Hz, 1H, ArH), 8.70 (d, J=2.0 Hz, 1H, ArH), 8.01 (d, J=9.2 Hz, 1H, ArH), 7.64 (d, J=8.4 Hz, 2H, ArH), 7.60 (d, J=9.2 Hz, 1H, ArH), 7.36 (d, J=8.8 Hz, 2H, ArH), 5.91 (s, 1H, CH), 5.06 (d, J=16.0 Hz, 1H, CH), 4.97 (d, J=16.0 Hz, 1H, CH); 13C NMR (DMSO-d6, 400 MHz) δ: 172.2, 158.5, 151.5, 145.4, 143.5, 141.4, 140.4, 138.6, 132.6, 130.3, 129.2, 122.3, 119.2, 116.1, 109.3, 97.6, 65.8, 36.4; IR (KBr) ν: 3263, 3060, 3002, 2220, 1661, 1622, 1602, 1510, 1479, 1463, 1379, 1333, 1206, 1149, 1040, 1011, 1013, 861, 843, 834, 786, 688 cm-1. HRMS (ESI) calcd for C20H13N4O2 [M+H]+ 341.1039, found 341.1058.
11-(4-硝基苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4g): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.76 (s, 1H, NH), 8.71 (d, J=1.6 Hz, 1H, ArH), 8.69 (d, J=1.6 Hz, 1H, ArH), 8.04 (d, J=8.8 Hz, 2H, ArH), 8.01 (d, J=9.2 Hz, 1H, ArH), 7.60 (d, J=9.2 Hz, 1H, ArH), 7.43 (d, J=8.8 Hz, 2H, ArH), 5.95 (s, 1H, CH), 5.06 (d, J=16.0 Hz, 1H, CH), 4.98 (d, J=16.0 Hz, 1H, CH); 13C NMR (DMSO-d6, 400 MHz) δ: 172.1, 158.5, 153.5, 146.2, 145.5, 143.6, 141.5, 140.5, 138.6, 130.5, 129.4, 123.8, 122.3, 116.0, 97.5, 65.8, 36.4; IR (KBr) ν: 3230, 3167, 3098, 3063, 1716, 1648, 1602, 1521, 1464, 1441, 1386, 1347, 1199, 1153, 1024, 861, 840, 816, 752, 698 cm-1. HRMS (ESI) calcd for C19H11N4O4 [M-H]- 359.0780, found 359.0798.
11-(2, 3-二氯苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4h): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.73 (s, 1H, NH), 8.66 (d, J=1.6 Hz, 1H, ArH), 8.64 (d, J=1.6 Hz, 1H, ArH), 7.97 (d, J=9.2 Hz, 1H, ArH), 7.56 (d, J=9.2 Hz, 1H, ArH), 7.33~7.31 (m, 1H, ArH), 7.13~7.10 (m, 2H, ArH), 6.26 (s, 1H, CH), 5.03 (d, J=16.0 Hz, 1H, CH), 4.97 (d, J=16.0 Hz, 1H, CH); IR (KBr) ν: 3234, 3177, 3078, 1728, 1648, 1638, 1617, 1497, 1464, 1420, 1346, 1200, 1123, 1039, 1019, 865, 837, 809, 769, 751, 696 cm-1. HRMS (ESI) calcd for C19H10Cl2N3O2 [M-H]- 382.0150, found 382.0167.
11-(2, 6-二氯苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4i): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.71 (s, 1H, NH), 8.58 (d, J=2.0 Hz, 1H, ArH), 8.54 (d, J=2.0 Hz, 1H, ArH), 7.90 (d, J=8.8 Hz, 1H, ArH), 7.44~7.42 (m, 2H, ArH), 7.12~7.09 (m, 2H, ArH), 6.58 (s, 1H, CH), 4.95 (s, 2H, CH2); 13C NMR (DMSO-d6, 400 MHz) δ: 171.6, 159.4, 145.0, 143.0, 141.8, 140.1, 139.7, 138.6, 137.0, 135.3, 130.2, 130.0, 128.6, 128.4, 121.6, 115.8, 94.9, 65.5, 36.2; IR (KBr) ν: 3238, 3179, 3101, 3048, 2919, 1722, 1675, 1651, 1609 1536, 1495, 1393, 1363, 1348, 1207, 1083, 1072, 1014, 868, 840, 786, 766, 671 cm-1. HRMS (ESI) calcd for C19H10Cl2N3O2 [M-H]- 382.0150, found 382.0131.
11-(3, 4-二氯苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4j): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.73 (s, 1H, NH), 8.78 (d, J=2.0 Hz, 1H, ArH), 8.74 (d, J=2.0 Hz, 1H, ArH), 8.03 (d, J=9.2 Hz, 1H, ArH), 7.62 (d, J=9.2 Hz, 1H, ArH), 7.44 (d, J=8.4 Hz, 1H, ArH), 7.40 (d, J=2.0 Hz, 1H, ArH), 7.13 (dd, J=8.4, 2.0 Hz, 1H, ArH), 5.89 (s, 1H, CH), 5.09 (d, J=16.0 Hz, 1H, CH), 4.98 (d, J=16.0 Hz, 1H, CH); 13C NMR (DMSO-d6, 400 MHz) δ: 172.2, 158.4, 147.3, 145.5, 143.6, 141.4, 140.4, 138.5, 131.0, 130.7, 130.4, 129.9, 129.1, 128.5, 122.3, 116.1, 97.6, 65.8, 35.6; IR (KBr) ν: 3231, 3173, 3094, 3030, 1718, 1651, 1638, 1605, 1520, 1493, 1464, 1346, 1199, 1131, 1040, 1026, 865, 840, 815, 752, 674 cm-1. HRMS (ESI) calcd for C19H10Cl2N3O2 [M-H]- 382.0150, found 382.0169.
11-(2, 3-二甲氧基苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4k): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.55 (s, 1H, NH), 8.71 (d, J=2.0 Hz, 1H, ArH), 8.66 (d, J=2.0 Hz, 1H, ArH), 7.94 (d, J=8.8 Hz, 1H, ArH), 7.56 (d, J=8.8 Hz, 1H, ArH), 6.83~6.79 (m, 1H, ArH), 6.73~6.71 (m, 2H, ArH), 6.08 (s, 1H, CH), 4.99 (d, J=16.0 Hz, 1H, CH), 4.93 (d, J=16.0 Hz, 1H, CH), 3.72 (s, 3H, OCH3), 3.71 (s, 3H, OCH3); 13C NMR (DMSO-d6, 400 MHz) δ: 172.1, 158.1, 152.5, 146.4, 145.1, 143.0, 141.7, 140.2, 139.9, 138.7, 129.5, 123.4, 122.6, 122.1, 118.3, 111.0, 98.5, 65.4, 60.1, 55.8, 31.6; IR (KBr) ν: 3210, 3181, 3101, 3046, 2951, 2926, 2830, 1722, 1652, 1608, 1582, 1463, 1432, 1412, 1389, 1344, 1205, 1066, 1042, 1021, 866, 840, 810, 751, 688 cm-1. HRMS (ESI) calcd for C21H16N3O4 [M-H]- 374.1141, found 374.1174.
11-(3, 4, 5-三甲氧基苯基)-8, 11-二氢化呋喃并[3', 4':5, 6]吡啶并[3, 2-f]喹喔啉-10(7H)-酮(4l): m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.60 (s, 1H, NH), 8.82 (d, J=2.0 Hz, 1H, ArH), 8.73 (d, J=2.0 Hz, 1H, ArH), 7.98 (d, J=8.8 Hz, 1H, ArH), 7.59 (d, J=8.8 Hz, 1H, ArH), 6.46 (s, 2H, ArH), 5.87 (s, 1H, CH), 5.11 (d, J=15.6 Hz, 1H, CH), 4.96 (d, J=15.6 Hz, 1H, CH), 3.60 (s, 6H, 2OCH3), 3.53 (s, 3H, OCH3); IR (KBr) ν: 3283, 3125, 3030, 3001, 2976, 2941, 2832, 1716, 1659, 1588, 1520, 1460, 1415, 1364, 1346, 1188, 1124, 1027, 1011, 861, 836, 806, 754, 697 cm-1. HRMS (ESI) calcd for C22H18N3O5 [M-H]- 404.1246, found 404.1254.
3.3 产物4g单晶的实验方法
晶体学数据和衍射强度数据的收集在Bruker型四圆衍射仪上进行.将0.193 mm×0.122 mm×0.100 mm的浅黄色长方形单晶置于装有单色器的四圆衍射仪上, 用Mo Kα (λ=0.71073 Å)幅射和φ-ω扫描方式收集衍射数据, 在4.28°<2θ<50.02°范围内共收集2815个独立衍射点, 可观测衍射点2391个[I>2σ(I)], 数据经Lp校正.晶体结构由直接法(SHELXTL程序)解出, 经多轮Fourier合成获得全部非氢原子, 全部氢原子由理论后直接加氢而得到.全部非氢原子的坐标及各向异性热参数, 采用w=1/[σ2(Fo2)+(0.0475P)2+0.5451P], P= (Fo2+2Fc2)/3, 经全矩阵最小二乘法修正及收敛.最终的偏离因子为R=0.0394, wR=0.0956.最终差值电子密度的最高峰为0.252 e•Å-3, 最低峰为-0.269 e•Å-3. (Δ/σ)max=0.000, S=1.029.
辅助材料(Supporting Information) 化合物4的NMR图谱, 以及化合物4g的cif文件.这些材料可以免费从本刊网站(http://sioc-journal.cn)上下载.
-
-
[1]
Hantzsch, A. Ann. 1882, 215, 72.
-
[2]
(a) Quinonero, O.; Jean, M.; Vanthuyne, N.; Roussel, C.; Bonne, D.; Constantieux, T.; Bressy, C.; Bugaut, X.; Rodriguez, J. Angew. Chem., Int. Ed. 2016, 55, 1401.
(b) Heravi, M. M.; Hosseini, M.; Oskooie, H. A.; Baghernejad, B.; Farzaneh, F. Chin. J. Chem. 2010, 28, 2045.
(c) Wu, J.; Wang, W. Z.; Sun, W. Chin. J. Chem. 2007, 25, 1072.
(d) Guo, S. R.; Yuan, Y. Q.; Zhang, C. N.; Wu, X. M.; Sun, C. Chin. J. Chem. 2010, 28, 811.
(e) Yoo, J. S.; Laughlin, T. J.; Krob, J. J.; Mohan, R. S. Tetrahedron Lett. 2015, 56, 4060.
(f) Yadav, D. K.; Patel, R.; Srivastava, V. P.; Watal, G.; Yadav, L. D. S. Chin. J. Chem. 2011, 29, 118. -
[3]
(a) Wang, X. S.; Zhang, M. M.; Zeng, Z. S.; Shi, D. Q.; Tu, S. J.; Wei, X. Y.; Zong, Z. M. Tetrahedron Lett. 2005, 46, 7169.
(b) Peng, J. H.; Hao, W. J.; Wang, X. S.; Tu, S. J.; Ma, N.; Zhang, G. Chin. J. Chem. 2009, 27, 1707.
(c) Zhou, Y. J.; Chen, D. S.; Li, Y. L.; Liu, Y.; Wang, X. S. ACS Comb. Sci. 2013, 15, 498.
(d) Shi, F.; Yan, S.; Zhou, D. X.; Tu, S. J.; Zou, X.; Hao, W. J.; Zhang, X. H.; Han, Z. G.; Wu, S. S.; Cao, X. D. J. Heterocycl. Chem. 2009, 46, 563.
(e) Chen, D. S.; Zhou, Y. J.; Li, Y. L.; Yao, C. S.; Wang X. S. Comb. Chem. High Throughput. Screening 2013, 16, 550.
(f) Xun, Z.; Feng, X.; Wang, J.; Shi, D.; Huang, Z. Chin. J. Chem. 2016, 34, 696. -
[4]
Walker, M. J. A. Biochem. Pharmacol. 2015, 98, 335. doi: 10.1016/j.bcp.2015.07.021
-
[5]
Cifuentes, F.; Paredes, A.; Palacios, J.; Munoz, F.; Carvajal, L.; Nwokocha, C. R.; Morales, G. J. Ethnopharmacol. 2016, 179, 367. doi: 10.1016/j.jep.2015.12.048
-
[6]
Kargbo, R; Takahashi, Y; Bhor, S; Cook, G. R.; Lloyd-Jones, G. C.; Shepperson, I. R. J. Am. Chem. Soc. 2007, 129, 3846. doi: 10.1021/ja070742t
-
[7]
Stasiak, J.; Koba, M.; Baczek, T.; Bucinski, A. Med. Chem. 2015, 11, 432. doi: 10.2174/1573406411666150114102926
-
[8]
Tu, S.; Zhang, Y.; Zhang, J.; Jiang, B.; Jia, R.; Zhang, J.; Ji, S. Synlett 2006, 2785.
-
[9]
Kozlov, N. G.; Bondarev, S. L.; Kadutskii, A. P.; Basalaeva, L. I.; Pashkovskii, F. S. Russ. J. Org. Chem. 2008, 44, 1031. doi: 10.1134/S1070428008070142
-
[10]
Shi, C.; Wang, J.; Chen, H.; Shi, D. J. Comb. Chem. 2010, 12, 430. doi: 10.1021/cc100003c
-
[11]
Aillerie, A.; de Talancé, V. L.; Moncomble, A.; Bousquet, T.; Pélinski, L. Org. Lett. 2014, 16, 2982. doi: 10.1021/ol5011196
-
[12]
Tu, S.; Wu, S.; Yan, S.; Hao, W.; Zhang, X.; Cao, X.; Han, Z.; Jiang, B.; Shi, F.; Xia, M.; Zhou, J. J. Comb. Chem. 2009, 11, 239. doi: 10.1021/cc800094m
-
[13]
Shi, F.; Zhou, D.; Tu, S.; Shao, Q.; Li, C.; Cao, L. J. Heterocycl. Chem. 2008, 45, 1065. doi: 10.1002/jhet.v45:4
-
[14]
Shi, D.; Li, Y.; Shi, C.; Wang, H. Acta Chim. Sinica 2009, 67, 645.
-
[15]
Kamal, A.; Tamboli, J. R.; Nayak, V. L.; Adil, S. F.; Vishnuvardhan, M. V. P. S.; Ramakrishna, S. Bioorg. Med. Chem. 2014, 22, 2714. doi: 10.1016/j.bmc.2014.03.021
-
[16]
Sandaroos, R.; Damavandi, S.; Molaei, H. R. Res. Chem. Intermed. 2015, 41, 1517. doi: 10.1007/s11164-013-1289-7
-
[17]
Vilches-HerreraIngo, M.; de SouzaAlexander, K.; Vyacheslav, V.; Sosnovskikh, Y.; Iaroshenko, V. O. ACS Comb. Sci. 2012, 14, 434. doi: 10.1021/co300042v
-
[1]
-
表 1 产物4a的最佳条件筛选a
Table 1. Screen of optimal conditions for 4a

表 2 产物4的反应时间和产率
Table 2. Reaction time and yields of 4a

表 3 晶体结构4g中的氢键数据
Table 3. Hydrogen bond data in the crystal structure of 4g

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1351
- HTML全文浏览量: 136


 下载:
下载:



 下载:
下载:

