
Citation: Lin Wei, Zheng Yongxiang, Huang Zhibin, Shi Daqing. Rapid and Efficient Ultrasound-Assisted Method for the Synthesis of 2-Thioxo-2H-thiopyran and 2-Amino-6-thioxodihydropyridine Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(2): 508-513. doi: 10.6023/cjoc201608017

超声辐射下2-硫代羰基-2H-噻喃和2-氨基-6-硫代羰基二氢吡啶衍生物的高效合成
-
关键词:
- 2-硫代羰基-2H-噻喃
- / 2-氨基-6-硫代羰基二氢吡啶
- / 超声辐射
- / 合成
English
Rapid and Efficient Ultrasound-Assisted Method for the Synthesis of 2-Thioxo-2H-thiopyran and 2-Amino-6-thioxodihydropyridine Derivatives
-
Key words:
- 2-thioxo-2H-thiopyran
- / 2-amino-6-thioxodihydropyridine
- / ultrasound-assisted
- / synthesis
-
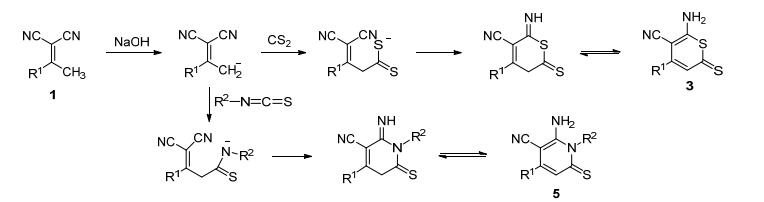
含硫杂环化合物广泛存在于天然产物和药物分子中, 具有重要的生物和药理活性, 在医药卫生领域有着广泛的应用[1].噻喃作为重要的含硫化合物已被证实具有很好的生物活性.例如苯并噻喃化合物广泛应用于抗真菌药、抗增生药和抗癌药[2].另外, 一些螺噻喃也是有机光致变色的主要母体组成部分[3].吡啶类化合物是具有良好生物活性, 在医药和农药工业有着广泛的应用.一些吡啶类衍生物可以用来治疗与糖尿病及衰老相关的心血管并发症[4].这类化合物也展现出一定的软体动物杀灭活性, 可以被当作一种屏蔽剂用于抗Chk1激酶抑制剂[5].由于含硫杂环化合物的重要生物活性, 引起了学者对该类杂环化合物的兴趣, 一些具有噻喃结构和含硫吡啶衍生物被合成出来[6].但是这些方法存在反应条件比较苛刻、产率低、反应时间长等缺点, 因此急需寻找简单、有效的快速合成方法.
20世纪80年代以来, 随着声化学的发展, 超声波技术在有机合成中的应用研究呈现蓬勃发展之势, 已经成为有机合成的主要技术之一[7].许多有机反应, 例如:氧化反应[8]、还原反应[9]、取代反应[10]、加成反应[11]、缩合反应[12]、偶联反应[13]、多组分反应[14]等都可以在超声波促进下进行.与传统的有机合成方法相比, 超声辐射可以缩短反应时间、提高反应产率, 甚至还可以使某些在传统条件下难以发生或不能发生的反应得以进行.最近我们利用超声波促进的多组分反应合成了一系列新型杂环化合物[15], 作为该工作的延续, 本论文将报道超声波促进下2-硫代羰基-2H-噻喃和2-氨基-6-硫代羰基二氢吡啶衍生物的快速合成法.
1 结果与讨论
我们以2-[1-(对甲苯基) 亚乙基]丙二腈 (1a) 与二硫化碳 (2) 反应生成化合物3a (Eq. 1) 为例, 探讨了溶剂、催化剂对反应的影响.结果见表 1.
Entry Solvent Catalyst (10 mol%) Time/min Yieldb/% 1 EtOH No 60 87 2 MeOH No 60 72 3 THF No 60 62 4 CH3CN No 60 65 5 Dioxane No 60 58 6 Toluene No 60 54 7 DMF No 60 82 8 H2O No 60 Trace 9 EtOH NaOH 60 92 10 EtOH EtONa 60 89 11 EtOH NaHCO3 60 80 12 EtOH K2CO3 60 72 13 EtOH Cs2CO3 60 76 14 EtOH Piperidine 60 69 15 EtOH Et3N 60 65 16 EtOH NaOH 20 80 17 EtOH NaOH 30 92 18 EtOH NaOH 40 91 19 EtOH NaOH 50 92 aReaction conditions: 2-(1-(p-tolyl) ethylidene) malononitrile (1 mmol), carbon disulfide (1 mmol), solvent (10 mL) and the ultrasonic power 250 W, irradiation frequency 40 kHz. bYield was determined by HPLC-MS. 表 1 反应条件的筛选a
Table 1. Optimization of reaction conditions我们首先考察了溶剂对反应的影响, 由表 1的数据 (表 1, Entries 1~8) 可以看出, 除了用水作溶剂不能得到产物外, 其它有机溶剂 (包括乙醇、甲醇、四氢呋喃、乙腈、1, 4-二氧六环、甲苯和N, N-二甲基甲酰胺) 都能得到目标产物, 但是, 用乙醇作溶剂时得到的收率最高 (87%).乙醇中反应的产率比甲醇中高的原因可能是二硫化碳在乙醇中的溶解度较大, 所以选择乙醇作为该反应的溶剂.随后考察了催化剂对该反应的影响 (表 1, Entries 9~15), 发现当用10 mol%的氢氧化钠为催化剂时, 产率可以高达92%.而用其它碱作为催化剂时, 无论是强碱 (例如:乙醇钠) 还是弱碱 (例如:碳酸氢钠、碳酸钾、碳酸铯) 甚至有机碱 (例如:哌啶、三乙胺), 得到的产率都没有氢氧化钠的高.所以, 最终确定该反应的催化剂为氢氧化钠.还考察了反应时间对反应的影响, 结果表明, 反应在30 min即可完成.
鉴于以上对反应条件的筛选, 我们选择的反应条件为:芳亚乙基丙二腈 (1 mmol)、二硫化碳 (1 mmol)、氢氧化钠 (0.1 mmol)、乙醇 (10 mL)、超声辐射的功率为250 W、频率为40 kHz、室温反应.
在最优反应条件下, 我们利用取代芳亚乙基丙二腈 (1) 与二硫化碳 (2) 的反应 (Eq. 2) 合成了一系列2-硫代羰基-2H-噻喃衍生物 (3), 其结果见表 2.从表 2可以看出, 取代芳亚乙基丙二腈的芳环上无论是吸电子的取代基还是供电子的取代基, 都能得到满意的结果.所有反应都可以在30 min内完成, 反应的收率都在88%以上.与仅有搅拌无超声辐射条件下的反应相比, 反应时间明显缩短, 收率也有所提高.如3a的合成, 在超声辐射下仅反应30 min产率可达到90%, 若仅用搅拌, 反应120 min产率才达到78%.显然, 超声辐射能够加速此类反应, 缩短反应时间, 使收率进一步提高.
 表 2
在超声辐射和常规条件下3a~3h的合成
Table 2.
Synthesis of 3a~3h under both ultrasonic irradiation and conventional method
表 2
在超声辐射和常规条件下3a~3h的合成
Table 2.
Synthesis of 3a~3h under both ultrasonic irradiation and conventional method
Entry Product R Ultrasonic
irradiationConventional t/min Yield/% t/min Yield/% 1 3a 4-CH3C6H4 30 90 30 90 2 3b C6H5 30 88 30 88 3 3c 4-CH3OC6H4 30 92 30 92 4 3d 3-BrC6H4 30 90 30 90 5 3e 4-FC6H4 40 91 40 91 6 3f 4-BrC6H5 30 95 30 95 7 3g 4-ClC6H4 30 90 30 90 8 3h Naphthalen-2-yl 45 89 45 89 表 2 在超声辐射和常规条件下3a~3h的合成
Table 2. Synthesis of 3a~3h under both ultrasonic irradiation and conventional method为了进一步拓展该类反应的适应范围, 我们以异硫氰酸酯 (4) 代替二硫化碳与芳亚乙基丙二腈进行反应, 得到了预期的产物2-氨基-6-硫代羰基二氢吡啶衍生物 (5) (Eq. 3).实验结果见表 3.从表 3可以看出, 该反应能够在超声波促进下进行, 而且在较短的反应时间内得到满意的产率.
 表 3
在超声辐射和常规条件下5a~5f的合成
Table 3.
Synthesis of 5a~5f under both ultrasonic irradiation and conventional method
表 3
在超声辐射和常规条件下5a~5f的合成
Table 3.
Synthesis of 5a~5f under both ultrasonic irradiation and conventional method
Entry Product R1 R2 Ultrasonic irradiation Conventional Time/min Yield/% Time/min Yield/% 1 5a 4-BrC6H4 4-ClC6H4 25 91 120 80 2 5b Naphthalen-2-yl C6H5 30 85 120 61 3 5c 3-BrC6H4 C6H5 30 88 120 65 4 5d C6H5 C6H5 30 92 120 65 5 5e 4-MeC6H4 C6H5 30 89 120 70 6 5f Naphthalen-2-yl 4-ClC6H4 30 93 120 71 表 3 在超声辐射和常规条件下5a~5f的合成
Table 3. Synthesis of 5a~5f under both ultrasonic irradiation and conventional method我们推测该反应的可能机理为 (Scheme 1):芳亚甲基丙二腈在碱作用下形成亚甲基碳负离子, 然后与二硫化碳或异硫氰酸酯发生亲核加成, 再经过环化、互变异构化成目标产物.
2 结论
在超声辐射和氢氧化钠催化下, 芳亚乙基丙二腈与二硫化碳或异硫氰酸酯的串联反应可以快速进行, 为2-硫代羰基-2H-噻喃和2-氨基-6-硫代羰基二氢吡啶衍生物的合成提供了一种简便有效的方法.该方法具有操作简单、反应时间短、产率高、后处理简单、环境友好等优点.
3 实验部分
3.1 试剂与仪器
熔点使用北京科仪电光仪器厂生厂的TX5显微熔点仪测定 (温度未校正); 红外光谱采用Varian F-1000型红外光谱仪测定 (KBr压片); 核磁共振氢谱和核磁共振碳谱在Agilent Inova-400 MHz或Agilent Vnmrs-300 MHz型核磁共振仪测定, DMSO-d6为溶剂, TMS为内标; 质谱在Agilent 6410三重串联四级杆质谱器测定, 采用电喷雾离子源 (ESI) 形式, 选择正离子模式, 扫描范围m/z 100~700;超声实验在昆山KQ-250E型医用超声波清洗器中进行, 超声波频率40 kHz, 功率250 W.所用试剂均为分析纯或化学纯, 使用前未经纯化.
3.2 2-硫代羰基-2H-噻喃衍生物3的合成
在100 mL干燥的锥形瓶中加入芳亚乙基丙二腈 (1) (1 mmol)、二硫化碳 (2)(1 mmol)、氢氧化钠 (0.1 mmol) 及10 mL乙醇, 将锥形瓶置于超声波清洗器中, 使反应瓶中液面略低于超声波清洗器中水面, 用薄层色谱 (TLC) 跟踪反应, 反应完毕后抽滤, 得到沉淀, 用乙醇重结晶得到纯净的产物3.
6-氨基-2-硫代羰基-4-对甲苯基-2H-噻喃-5-甲腈 (3a):黄色固体, 产率90%. m.p. 227~229 ℃ (Lit.[6a]m.p. 226 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.20 (s, 2H, NH2), 7.44 (d, J=8.0 Hz, 2H, ArH), 7.31 (d, J=8.4 Hz, 2H, ArH), 6.72 (s, 1H, CH), 2.37 (s, 3H, CH3); 13C NMR (100 MHz, DMSO-d6) δ: 198.6, 177.2, 158.8, 145.7, 140.8, 134.9, 133.5, 131.4, 121.5, 89.9, 26.6; IR (KBr) v: 3100, 2949, 2189, 1605, 1521, 1461, 1107, 837 cm-1; LC-MS m/z (%): 259.0 [M+H]+.
6-氨基-4-苯基-2-硫代羰基-2H-噻喃-5-甲腈 (3b):黄色固体, 产率88%. m.p. 271~273 ℃ (Lit.[6a] m.p. 268 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.24 (s, 2H, NH2), 7.52 (s, 5H, ArH), 6.71 (s, 1H, CH); 13C NMR (100 MHz, DMSO-d6) δ: 198.9, 177.2, 158.8, 143.6, 135.8, 134.4, 133.5, 131.5, 121.5, 89.9; IR (KBr) v: 3289, 3101, 2210, 1643, 1541, 1428, 1293, 1007, 909 cm-1; LC-MS m/z (%): 245.0 [M+H]+.
6-氨基-4-对甲氧基苯基-2-硫代羰基-2H-噻喃-5-甲腈 (3c):黄色固体, 产率92%. m.p. 254~256 ℃ (Lit.[6a] m.p. 272 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.16 (s, 2H, NH2), 7.51 (d, J=8.8 Hz, 2H, ArH), 7.03 (d, J=8.8 Hz, 2H, ArH), 6.73 (s, 1H, CH), 3.81 (s, 3H, CH3O); 13C NMR (100 MHz, DMSO-d6) δ: 198.1, 177.3, 166.5, 158.4, 135.6, 135.4, 131.4, 121.7, 119.7, 89.8, 61.0; IR (KBr) v: 3300, 3116, 2216, 1718, 1647, 1451, 1225, 1023, 825 cm-1; LC-MS m/z (%): 275.0 [M+H]+.
6-氨基-4-间溴苯基-2-硫代羰基-2H-噻喃-5-甲腈 (3d):黄色固体, 产率90%. m.p. 238~240 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 9.27 (s, 2H, NH2), 7.75~7.70 (m, 2H, ArH), 7.54 (d, J=7.2 Hz, 1H, ArH), 7.47~7.44 (m, 1H, ArH), 6.71 (s, 1H, CH); 13C NMR (100 MHz, DMSO-d6) δ: 194.3, 172.1, 151.9, 140.8, 133.4, 131.0, 127.7, 126.3, 122.3, 116.2, 84.7; IR (KBr) v: 3245, 3104, 2203, 1615, 1541, 1460, 1285, 1001, 917, 862, 692 cm-1; LC-MS m/z (%): 322.9 [M+H]+. Anal. calcd for C12H7BrN2S2: C 44.59, H 2.18, N 8.67; found C 44.76, H 2.12, N 8.76.
6-氨基-4-对氟苯基-2-硫代羰基-2H-噻喃-5-甲腈 (3e):黄色固体, 产率91%. m.p. 273~275 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 9.25 (s, 2H, NH2), 7.63~7.60 (m, 2H, ArH), 7.36~7.32 (m, 2H, ArH), 6.72 (s, 1H, CH); 13C NMR (100 MHz, DMSO-d6) δ: 194.0, 172.1, 163.6 (JCF=246.4 Hz), 152.6, 135.0, 131.1, 131.0, 126.5, 11 6.3 (d, JCF=21.7 Hz), 84.9; IR (KBr) v: 3350, 3200, 2178, 1640, 1528, 1446, 1270, 1200, 1135, 837 cm-1; LC-MS m/z (%): 263.0 [M+H]+. Anal. calcd for C12H7FN2S2: C 54.94, H 2.69, N 10.68; found C 54.71, H 2.76, N 10.51.
6-氨基-4-对溴苯基-2-硫代羰基-2H-噻喃-5-甲腈 (3f):黄色固体, 产率95%. m.p. 278~280 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 9.29 (s, 2H, NH2), 7.70 (d, J=8.8 Hz, 2H, ArH), 7.50 (d, J=8.4 Hz, 2H, ArH), 6.71 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 193.9, 171.9, 152.2, 137.6, 132.0, 130.5, 126.0, 124.0, 116.0, 84.4; IR (KBr) v: 3384, 3120, 2198, 1629, 1539, 1284, 1137, 824 cm-1; LC-MS m/z (%): 322.9 [M+H]+. Anal. calcd for C12H7BrN2S2: C 44.59, H 2.18, N 8.67; found C 44.73, H 2.24, N 8.59.
6-氨基-4-对氯苯基-2-硫代羰基-2H-噻喃-5-甲腈 (3g):黄色固体, 产率90%. m.p. 262~264 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 9.29 (s, 2H, NH2), 7.58 (s, 4H, ArH), 6.72 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 193.9, 171.9, 152.2, 137.2, 135.3, 130.3, 129.1, 126.0, 116.0, 84.4; IR (KBr) v: 3285, 3008, 2214, 1689, 1540, 1441, 1189, 836 cm-1; LC-MS m/z (%): 278.1 [M+H]+. Anal. calcd for C12H7ClN2S2: C 51.70, H 2.53, N 10.05; found C 51.91, H 2.48, N 9.97.
6-氨基-4-(2-萘基)-2-硫代羰基-2H-噻喃-5-甲腈 (3h):黄色固体, 产率89%. m.p. 264~266 ℃ (Lit.[6a] m.p. 276 ℃); ; 1H NMR (400 MHz, DMSO-d6) δ: 9.24 (s, 2H, NH2), 8.15 (s, 1H, ArH), 8.03~8.00 (m, 3H, ArH), 7.62~7.60 (m, 3H, ArH), 6.80 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 194.4, 172.8, 154.4, 136.7, 134.5, 133.6, 129.8, 129.4, 128.9, 128.8, 128.2, 127.3, 126.4, 117.0, 85.7; IR (KBr) v: 3249, 2982, 2204, 1616, 1542, 1505, 1458, 1431, 1323, 1293, 951, 917, 857, 739 cm-1; LC-MS m/z (%): 295.01 [M+H]+.
3.3 2-氨基-6-硫代羰基二氢吡啶衍生物5的合成
在100 mL干燥的锥形瓶中加入芳亚乙基丙二腈 (1) (1 mmol)、异硫氰酸酯 (4) (1 mmol)、氢氧化钠 (0.1 mmol) 及10 mL乙醇, 将锥形瓶置于超声波清洗器中, 使反应瓶中液面略低于超声波清洗器中水面, 用TLC跟踪反应, 反应完毕后抽滤, 得到沉淀, 用乙醇重结晶得到纯净的产物5.
2-氨基-4-对溴苯基-1-对氯苯基-6-硫代羰基-1, 6-二氢化吡啶-3-甲腈 (5a):黄色固体, 产率91%. m.p. 238~240 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 8.33 (s, 2H, NH2), 7.66 (d, J=8.4 Hz, 2H, ArH), 7.43~7.40 (m, 4H, ArH), 6.91 (d, J=8.4 Hz, 2H ArH), 5.98 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 163.6, 153.1, 149.0, 148.5, 138.6, 131.9, 130.4, 130.3, 128.8, 123.0, 122.1, 122.5, 75.7; IR (KBr) v: 3441, 3284, 2193, 1624, 1597, 1568, 1486, 1141, 1009, 821 cm-1; LC-MS m/z (%): [M+H]+415.9. Anal. calcd for C18H11BrClN3S: C 51.88, H 2.66, N 10.08; found C 51.76, H 2.62, N 10.15.
2-氨基-4-(2-萘基)-1-苯基-6-硫代羰基-1, 6-二氢化吡啶-3-甲腈 (5b):黄色固体, 产率85%. m.p. 228~230 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 7.69~7.51 (m, 5H, ArH), 7.39~7.35 (m, 3H, ArH), 7.27 (d, J=7.6 Hz, 2H, ArH), 7.14 (s, 2H, NH2), 6.84 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 182.5, 165.0, 161.8, 156.9, 147.5, 138.8, 132.9, 131.0, 130.8, 130.7, 130.1, 128.7, 128.0, 121.1, 117.2, 116.4, 116.1, 78.2; IR (KBr) v: 3458, 3212, 2209, 1611, 1583, 1526, 1481, 1286, 1234, 1020, 935, 821, 692 cm-1; LC-MS m/z (%): 354.1 [M+H]+. Anal. calcd for C22H15N3S: C 74.76, H 4.28, N 11.89; found C 74.91, H 4.23, N 11.82.
2-氨基-4-间溴苯基-1-苯基-6-硫代羰基-1, 6-二氢化吡啶-3-甲腈 (5c):黄色固体, 产率88%. m.p.>300 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 7.78~7.73 (m, 2H, ArH), 7.62~7.58 (m, 3H, ArH), 7.53~7.49 (m, 2H, ArH), 7.27 (d, J=7.6 Hz, 2H, ArH), 7.18 (s, 2H, NH2), 6.85 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 182.7, 156.9, 146.8, 138.7, 133.0, 131.4, 131.1, 130.8, 128.6, 127.5, 122.3, 121.1, 117.0, 78.0; IR (KBr) v: 3448, 3366, 2212, 1653, 1617, 1544, 1485, 1313, 1181, 1009, 825, 695 cm-1; LC-MS m/z (%): 382.0 [M+H]+. Anal. calcd for C18H12-Br2N3S: C 56.55, H 3.16, N 10.99; found C 56.63, H 3.20, N 11.04.
2-氨基-1, 4-二苯基-6-硫代羰基-1, 6-二氢化吡啶-3-甲腈 (5d):黄色固体, 产率92%. m.p.>300 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 7.61~7.53 (m, 8H, ArH), 7.29 (d, J=7.2 Hz, 2H ArH), 7.12 (s, 2H, NH2), 6.85 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 182.5, 157.0, 148.6, 138.8, 136.5, 131.0, 130.3, 130.0, 129.2, 128.7, 128.2, 121.1, 117.2, 78.2; IR (KBr) v: 3469, 3315, 2214, 1656, 1558, 1479, 1230, 1149, 1063, 836, 699 cm-1; LC-MS m/z (%): 304.1 [M+H]+. Anal. calcd for C18H13-N3S: C 71.26, H 4.32, N 13.85; found C 71.18, H 4.27, N 13.79.
2-氨基-1-苯基-4-对甲苯基-6-硫代羰基-1, 6-二氢化吡啶-3-甲腈 (5e):黄色固体, 产率89%. m.p. 215~217 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 7.61~7.49 (m, 5H, ArH), 7.35~7.28 (m, 4H, ArH), 7.07 (s, 2H, NH2), 6.84 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 182.4, 157.0, 148.5, 140.2, 138.8, 133.6, 131.0, 130.0, 129.8, 128.7, 128.5, 128.2, 120.9, 117.3, 78.2; IR (KBr) v: 3429, 3265, 2218, 1689, 1598, 1429, 1290, 1099, 1043, 826 cm-1; LC-MS m/z (%): 318.1 [M+H]+. Anal. calcd for C19H15N3S: C 71.90, H 4.76, N 13.24; found C 72.04, H 4.81, N 13.16.
2-氨基-1-对氯苯基-4-(2-萘基)-6-硫代羰基-1, 6-二氢化吡啶-3-甲腈 (5f):黄色固体, 产率93%. m.p.>300 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 8.20 (s, 1H, ArH), 8.07~8.00 (m, 3H ArH), 7.71~7.64 (m, 5H, ArH), 7.42~7.35 (m, 4H, ArH+NH2), 6.98 (s, 1H, CH); 13C NMR (75 MHz, DMSO-d6) δ: 182.3, 157.1, 148.9, 137.8, 134.7, 133.7, 132.9, 131.1, 130.9, 129.0, 128.8, 128.1, 127.8, 127.3, 125.6, 121.1, 117.3, 78.5; IR (KBr) v: 3468, 3275, 2208, 1639, 1568, 1479, 1256, 1020, 945, 820, 743 cm-1; LC-MS m/z (%): 388.1 [M+H]+. Anal. calcd for C22H14-ClN3S: C 68.12, H 3.64, N 10.83; found C 68.25, H 3.59, N 10.76.
辅助材料 (Supporting Information)产物的核磁共振氢谱和碳谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
Krauze, A.; Germane, S.; Eberlins, O. Eur. J. Med. Chem. 1999, 34, 301. doi: 10.1016/S0223-5234(99)80081-6
-
[2]
(a) Brown, M. J.; Carter, P. S.; Fenwick, A. E.; Fosberry, A. P.; Hamprecht, D. W.; Hibbs, M. J.; Jarvest, R. L.; Mensah, L.; Milner, P. H.; O'Hanlon, P. J.; Pope, A. J.; Richardson, C. M.; West, A.; Witty, D. R. Bioorg. Med. Chem. Lett. 2002, 12, 3171.
(b) Quaglia, W.; Pigini, M.; Piergentili, A.; Giannella, M.; Gentili, F.; Marucci, G.; Carrieri, A.; Carotti, A.; Poggesi, E.; Leonardi, A.; Melchiorre, C. J. Med. Chem. 2002, 45, 1633.
(c) Sugita, Y.; Hosoya, H.; Terasawa, K.; Yokoe, I.; Fujisawa, S.; Sakagami, H. Anticancer Res. 2001, 21, 2629. -
[3]
Freifeld, L.; Shojael, H.; Langer, P. J. Org. Chem. 2006, 71, 4965. doi: 10.1021/jo060593h
-
[4]
Eynde, J. J.; Defosse, F.; Mayence, A.; Haverbeke, Y. V. Tetrahedron 1995, 51, 6511. doi: 10.1016/0040-4020(95)00318-3
-
[5]
Sabitha, G.; Reddy, G. S. K. K.; Reddy, C. S.; Yadav, J. S. Tetrahedron Lett. 2003, 44, 4129. doi: 10.1016/S0040-4039(03)00813-X
-
[6]
(a) Abbas, A. E.; Rahele, H. Phosphorus, Sulfur Silicon Relat. Elem. 2011, 186, 2267.
(b) Wang, W.; Li, H.; Wang, J.; Zu, L. J. Am. Chem. Soc. 2006, 128, 10354.
(c) Jagodziński, T. S.; Sośnicki, J. G.; Wesolowska, A. Tetrahedron 2003, 59, 4183.
(d) Rios, R.; Sundén, H.; Ibrahem, L.; Zhao, G. L.; Eriksson, L.; Córdova, A. Tetrahedron Lett. 2006, 47, 8547.
(e) Krystyna, B. S.; Malgorzata, K. Monatsh. Chem. 2006, 137, 347. -
[7]
(a) Luche, J. L. Synthetic Organic Sonochemistry, Plenum Press, New York, 1998.
(b) Ji, S. J.; Shi, D. Q. New Technology of Modern Organic Synthesis, Chemical Industry Press, Bejing, 2009 (in Chinese).(纪顺俊, 史达清, 现代有机合成新技术, 化学工业出版社, 北京, 2009.)
(c) Li, J. T.; Wang, S. X.; Chen, G. F.; Li, T. S. Curr. Org. Synth. 2005, 2, 425. -
[8]
(a) Wolfe, S.; Ingold, C. F. J. Am. Chem. Soc. 1983, 105, 7755.
(b) Peng, K.; Chen, F. X.; She, X. G.; Yang, C. H.; Cui, Y. X.; Pan, X. F. Tetrahedron Lett. 2005, 46, 1217. -
[9]
(a) Suslick, K. S.; Casadonate, D. J. Am. Chem. Soc. 1987, 109, 3459.
(b) Pasha, M. A.; Jayashankara, V. P. Ultrason. Sonochem. 2005, 12, 433. -
[10]
(a) Hofmann, J.; Freier, U.; Weeks, M. Ultrason. Sonochem. 2003, 10, 271.
(b) Meciarova, M.; Kiripolsky, M.; Toma, S. Ultrason. Sonochem. 2005, 12, 401.
(c) Martins, M. A. P.; Rossatto, M.; Prola, L. D. T.; Pizzuti, L.; Moreira, D. N.; Campos, P. T.; Frizzo, C. P.; Zanatta, N.; Bonacorso, H. G. Ultrason. Sonochem. 2012, 19, 227. -
[11]
Li, J. T.; Chen, G. F.; Xu, W. Z.; Li, T. S. Ultrason. Sonochem. 2003, 10, 115. doi: 10.1016/S1350-4177(02)00134-7
-
[12]
(a) Li, J. T.; Yang, W. Z.; Wang, S. X.; Li, S. H.; Li, T. S. Ultrason. Sonochem. 2001, 4, 55.
(b) Zhang, Z. H.; Li, J. T.; Li, T. S. Ultrason. Sonochem. 2008, 15, 673. -
[13]
(a) Zhang, J.; Yang, F.; Ren, G.; Mark, T. C. W.; Song, M.; Wu, Y. Ultrason. Sonochem. 2008, 15, 115.
(b) Polackova, V.; Hutka, M.; Toma, S. Ultrason. Sonochem. 2005, 12, 99. -
[14]
(a) Tu, S. J.; Cao, L. J.; Zhang, Y.; Shao, Q. Q.; Zhou, D. X.; Li, C. M. Ultrason. Sonochem. 2008, 15, 217.
(b) Kumar, H.; Parmar, A. Ultrason. Sonochem. 2008, 15, 129.
(c) Zhou, G.; Liang, G. C.; Zhong, Y. F.; Han, X. Y.; Chen, G. F.; Song, Y. L. Chin. J. Org. Chem. 2016, 36, 143 (in Chinese).(周冠, 梁国超, 钟一凡, 韩晓燕, 陈国锋, 宋亚丽, 有机化学, 2016, 36, 143.) -
[15]
(a) Zou, Y.; Wu, H.; Hu, Y.; Liu, H.; Zhao, X.; Ji, H. L.; Shi, D. Q. Ultrason. Sonochem. 2011, 18, 708.
(b) Zou, Y.; Hu, Y.; Liu, H.; Shi, D. Q. ACS Comb. Sci. 2012, 14, 38.
(c) Hu, Y.; Zou, Y.; Wu, H.; Shi, D. Q. Ultrason. Sonochem. 2012, 19, 264.
(d) Yang, J. M.; Li, Q.; Zhang, J. J.; Lin, W.; Wang, J. X.; Wang, Y. C.; Huang, Z. B.; Shi, D. Q. Molecules 2013, 18, 14519.
(e) Liu, H.; Zou, Y.; Hu, Y.; Shi, D. Q. J. Heterocycl. Chem. 2011, 48, 877.
(f) Shi, D. Q.; Zou, Y.; Hu, Y.; Wu, H. J. Heterocycl. Chem. 2011, 48, 896.
-
[1]
-
表 1 反应条件的筛选a
Table 1. Optimization of reaction conditions
Entry Solvent Catalyst (10 mol%) Time/min Yieldb/% 1 EtOH No 60 87 2 MeOH No 60 72 3 THF No 60 62 4 CH3CN No 60 65 5 Dioxane No 60 58 6 Toluene No 60 54 7 DMF No 60 82 8 H2O No 60 Trace 9 EtOH NaOH 60 92 10 EtOH EtONa 60 89 11 EtOH NaHCO3 60 80 12 EtOH K2CO3 60 72 13 EtOH Cs2CO3 60 76 14 EtOH Piperidine 60 69 15 EtOH Et3N 60 65 16 EtOH NaOH 20 80 17 EtOH NaOH 30 92 18 EtOH NaOH 40 91 19 EtOH NaOH 50 92 aReaction conditions: 2-(1-(p-tolyl) ethylidene) malononitrile (1 mmol), carbon disulfide (1 mmol), solvent (10 mL) and the ultrasonic power 250 W, irradiation frequency 40 kHz. bYield was determined by HPLC-MS. 表 2 在超声辐射和常规条件下3a~3h的合成
Table 2. Synthesis of 3a~3h under both ultrasonic irradiation and conventional method
Entry Product R Ultrasonic
irradiationConventional t/min Yield/% t/min Yield/% 1 3a 4-CH3C6H4 30 90 30 90 2 3b C6H5 30 88 30 88 3 3c 4-CH3OC6H4 30 92 30 92 4 3d 3-BrC6H4 30 90 30 90 5 3e 4-FC6H4 40 91 40 91 6 3f 4-BrC6H5 30 95 30 95 7 3g 4-ClC6H4 30 90 30 90 8 3h Naphthalen-2-yl 45 89 45 89 表 3 在超声辐射和常规条件下5a~5f的合成
Table 3. Synthesis of 5a~5f under both ultrasonic irradiation and conventional method
Entry Product R1 R2 Ultrasonic irradiation Conventional Time/min Yield/% Time/min Yield/% 1 5a 4-BrC6H4 4-ClC6H4 25 91 120 80 2 5b Naphthalen-2-yl C6H5 30 85 120 61 3 5c 3-BrC6H4 C6H5 30 88 120 65 4 5d C6H5 C6H5 30 92 120 65 5 5e 4-MeC6H4 C6H5 30 89 120 70 6 5f Naphthalen-2-yl 4-ClC6H4 30 93 120 71 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 1011
- HTML全文浏览量: 127


 下载:
下载:
 下载:
下载:

