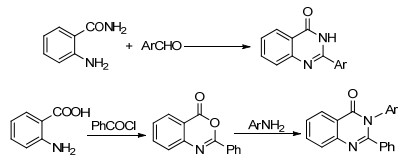
 图 图式1
喹唑啉-4-酮的合成方法
Figure 图式1.
Synthetic protocols for quinazolin-4(3H)-one
图 图式1
喹唑啉-4-酮的合成方法
Figure 图式1.
Synthetic protocols for quinazolin-4(3H)-one

Citation: Sun Jiajing, Zhou Likai, Tan Guanhai, Li Shuai, Wang Shuxia, Chen Hua, Li Xiaoliu. Synthesis and Anti-tumor Activity of Novel Quinazolin-4-one Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(2): 455-461. doi: 10.6023/cjoc201607045

喹唑啉-4-酮衍生物的合成及抗肿瘤活性
English
Synthesis and Anti-tumor Activity of Novel Quinazolin-4-one Derivatives
-
Key words:
- quinazolin-4-one
- / anti-tumor activity
- / iminoketene
- / amino side chain
- / elimination of carboxymethyl
- / coumarin
-
喹唑啉-4-酮是一类广谱的药效基团, 其衍生物多具有抗菌、抗炎、抗疟疾、抗结核、抗肿瘤和抗病毒等作用[1].其中C-2和N-3取代基的结构各异, 赋予了喹唑啉-4-酮衍生物多样的生物活性[2].因此, 喹唑啉-4-酮的合成及生物活性研究备受关注[3, 4].目前, 喹唑啉-4-酮衍生物的合成主要有两种 (Scheme 1):其一是以邻氨基苯甲酰胺与醛反应, 以C-2位单取代产物为主, 收率较高[5, 6]; 其二是以邻氨基苯甲酸为起始原料, 先制备其苯并噁嗪-4-酮衍生物, 进而胺解得到C-2和N-3位双取代产物[7, 8].此路线分两步进行, 易于制备N-3位取代基改变的产物, 但在获得结构更加多样的产物时, 略显繁琐.
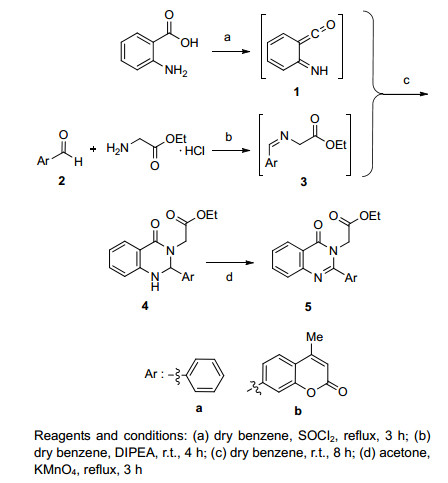
近年来, 文献报道通过邻氨基苯甲酸与亚胺 (Schiff base) 的一锅法反应, 可以简便合成C-2和N-3双取代喹唑啉-4-酮衍生物[9].由于邻氨基苯甲酸中氨基的亲核性较弱, 使得氨基直接对亚胺的亲核加成难以发生.因此, 该法首先将邻氨基苯甲酸转化成其相应的亚胺烯酮中间体, 进而与亚胺加成缩合得到目标产物[10, 11].此法原料易得且多样, 为喹唑啉-4-酮C-2、N-3双取代产物的制备提供了一个有效的便利方法.本文利用此法, 以邻氨基苯甲酸、苯甲醛 (或香豆素醛) 和甘氨酸乙酯为原料, 简便地合成了含氨基酸链的二氢喹唑啉-4-酮衍生物4(Scheme 2).
1 结果与讨论
1.1 喹唑啉-4-酮环的构建
如Scheme 2所示, 邻氨基苯甲酸在氯化亚砜作用下得到亚胺烯酮中间体1.以苯甲醛 (2a) 和甘氨酸乙酯盐酸盐为原料, 碱性条件下合成相应的亚胺中间体3a, 催化量的冰醋酸有利于亚胺的生成.不经分离, 亚胺中间体3a直接与亚胺烯酮中间体1反应, 得到二氢喹唑啉-4-酮衍生物4a.我们对亚胺与亚胺烯酮的加成反应条件进行了简单探讨, 改变投料比例、升高温度、延长反应时间对产率影响并不明显 (表 1).最终确定最佳反应条件是以苯为溶剂, 室温反应8 h, 以72%的收率得到了含氨基酸链的二氢喹唑啉-4-酮衍生物4a.需要指出的是, 反应过程中会有少量氧化产物5a的生成, 而且混合体系下4a不分离直接芳构也可以得到5a.但考虑到后续实验中5a难以分离, 故在此步快速柱分离并重结晶得到4a.在高锰酸钾的作用下, 4a以几乎定量的收率得到5a, 反应操作更为简便.利用同样的方法, 以7-香豆素醛2b[12]为原料, 得到了化合物5b.此方法将可用于更多C-2和N-3双取代喹唑啉-4-酮衍生物的合成.
Entry 投料比a 温度/℃ 时间/h 收率/% 1 1:1 r.t 8 45 2 1:1 40 8 47 3 1:1 80 8 40 4 1:1 r.t 10 48 5 1:1 r.t 12 47 6 1:2 r.t 8 48 7 1:5 r.t 8 52 8b 1:1 r.t 8 72 a邻氨基苯甲酸与苯甲醛的物质的量比; b生成亚胺时, 加催化量的冰醋酸. 表 1 二氢喹唑啉-4-酮 (4a) 的合成
Table 1. Synthesis of dihydroquinazolin-4-one (4a)1.2 化合物抗肿瘤活性评价
对所合成的化合物进行了体外抑制人乳腺癌 (MCF-7)、白血病 (K562)、肺癌 (A549)、宫颈癌 (hela) 细胞活性测试, 顺铂为阳性对照, 结果见表 2.总体而言, 大部分含香豆素的系列化合物具有较含苯环的系列化合物更好的抗肿瘤细胞增殖活性, 这表明C-2为具有较苯环更强抗肿瘤活性的香豆素[19], 或增加此处芳环的共轭平面体系, 可能有助于提高化合物抗肿瘤活性.氨基侧链的不同使得化合物表现出一定的抗肿瘤细胞的选择性, 其中化合物9ba和9bc具有较好的抗Hela细胞增殖活性, 而化合物9bc和9bd具有较好的抗A549细胞增殖活性, 它们的IC50值均低于10 μmol/L, 且高于阳性对照顺铂.不含氨基侧链的化合物8a和8b, 以及含吗啉侧链的化合物9ae和9be均没有活性, 进一步表明氨基侧链有利于化合物的抗肿瘤细胞增殖活性.而链的长短以及吗啉环对活性的影响还有待进一步研究.以上构效关系分析将有助于指导喹唑啉-4-酮类抗肿瘤化合物的结构修饰.
Compd. 抗肿瘤活性[IC50/(μmol•L-1)] MCF-7 K562 A549 Hela 8a >50 >50 >50 >50 9aa >50 >50 >50 >50 9ab >50 >50 >50 >50 9ac >50 >50 >50 >50 9ad >50 >50 >50 >50 9ae >50 >50 >50 >50 8b >50 >50 >50 >50 9ba >50 24.59±5.21 >50 8.16±0.78 9bb >50 43.25±7.60 >50 38.33±1.77 9bc 17.04±1.62 12.49±1.58 5.62±0.54 7.47±0.17 9bd 29.87±5.74 17.59±4.83 9.54±1.83 29.77±5.88 9be >50 >50 >50 >50 顺铂 7.93±0.67 3.00±0.71 11.88±1.21 12.07±1.28 表 2 化合物8和9的抗肿瘤活性
Table 2. Antitumor activities of compounds 8 and 91.2 连有氨基侧链的喹唑啉酮衍生物的合成
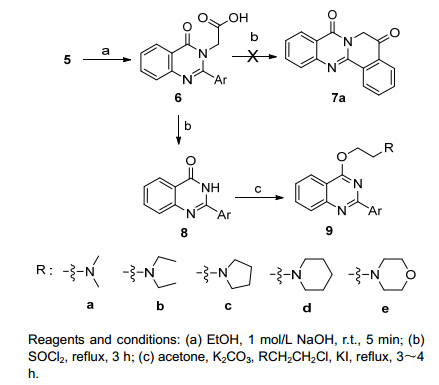
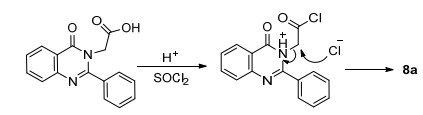
稠杂喹唑啉酮衍生物因其具有较大的共轭体系, 易于与DNA结合, 表现出显著的抗肿瘤活性, 如色胺酮[13]、骆驼宁碱[14]等天然喹唑啉酮化合物.因此, 在获得含氨基酸酯链的喹唑啉-4-酮衍生物5a后, 我们将其水解成酸, 拟用分子内傅-克 (Friedel-Crafts) 酰基化, 以制备稠杂喹唑啉酮7a(Scheme 3).尝试了不同的强质子酸如多聚磷酸 (PPA)、浓硫酸、三氟醋酸等, 酸性条件下脱水关环; 或将5a在二氯亚砜作用下制备成酰氯, 在路易斯酸 (Lewis acid) 如四氯化钛、氯化锌等作用下傅-克酰基化关环, 没有得到预期的目标化合物7a.部分反应, 如PPA、四氯化钛催化或二氯亚砜直接为溶剂 (不加催化剂), 生成了羧甲基脱除的产物8a, 收率28%~30%.反应机理可能是:羧基在氯化亚砜 (或酸性条件) 作用下形成酰氯, 羧甲基上的亚甲基更为活泼, 易受到Cl-的进攻, 进而脱除氯乙酰基得到8a(Scheme 4).这与文献[15]报道一致.同样条件下, 以5b为原料得到化合物8b.该方法可作为一个制备C-2位取代的喹唑啉-4-酮衍生物的补充反应.
考虑到氨乙基侧链可以改善化合物的溶解性, 并增强化合物与DNA的结合, 提高化合物的抗肿瘤活性[16, 17], 化合物8与氯乙基胺盐酸盐反应, 以60%~90%的产率制备了连有氨基侧链的喹唑啉衍生物9(Scheme 3).反应伴随有少量N-取代产物生成[18], 但难以分离得到.
2 结论
本文利用亚胺和亚胺烯酮的加成反应, 以邻氨基苯甲酸、芳醛和甘氨酸乙酯为原料, 一锅法构建了系列含氨基酸链的C-2和N-3双取代的二氢喹唑啉-4-酮衍生物4, 并芳构化得到喹唑啉-4-酮衍生物5.酸性条件下脱除羧甲基, 设计合成了连有氨基侧链的喹唑啉酮衍生物9, 并评价了化合物的抗肿瘤细胞增殖性.其中化合物9ba、9bc和9bd具有良好的抗肿瘤活性, 并表现出一定的选择性.构效关系分析表明, C-2位香豆素 (较大共轭平面体系) 取代以及氨基柔性侧链的引入将有利于化合物的抗肿瘤细胞增殖活性.
3 实验部分
3.1 仪器与试剂
微波合成仪为美国CEM公司的DISCOVER S-Class; 熔点由SGW® X-4显微熔点仪 (温度计未校正) 测定; 核磁共振谱用BRUKER AC-P600 (600 MHz) 型核磁共振仪测定, TMS为内标; 质谱 (ESI) 用Agilent G6300离子阱液相质谱联用仪; 元素分析用HERAEUS (CHNO, rapid) 型元素分析仪; 光密度用BioRad 3550型酶标仪测定; 层析用硅胶 (200~300目) 为青岛海洋化工厂产品.本文所用其他试剂均为分析纯, 无水试剂均按常规方法处理, 水为二次蒸馏水.
3.2 实验方法
3.2.6 抗肿瘤细胞毒性测试
抗肿瘤细胞毒性采用改进的Mosmann’s MTT (噻唑蓝) 染色法测定[23].具体操作如下:于96孔板接种细胞悬液, 90 μL/孔, 细胞密度2×104个/mL, 37℃; 5% CO2浓度的培养箱中过夜, 加10 μL/孔相应浓度药物 (100 μmol/L), 继续培44 h, 加MTT 10 μL/孔培养4 h, 从培养箱中取出, 倒板, 加DMSO 100 μL/孔溶解MTT, 测量570 nm波长下肿瘤细胞OD值, 代入公式: (ODcontrol-ODtreated)/ ODcontrol×100%计算抑制率, 顺铂为阳性对照[20].
辅助材料 (Supporting Information) 化合物9的核磁共振氢谱和碳谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.2 化合物5a和5b的合成
50 mL圆底烧瓶中加入310 mg (1.0 mmol) 化合物4a、395 mg (2.5 mmol) 高锰酸钾、5 mL无水丙酮, 加热回流, TLC监测反应. 3 h后反应完全, 反应液冷却至室温后, 抽滤除去不溶物, 母液减压除去溶剂, 得到的粗产品经乙酸乙酯重结晶得到295 mg化合物5a.按相同的方法, 以化合物4b为原料, 得到化合物5b.
2-[4-氧亚基-2-苯基喹唑啉-3(4H)-基]乙酸乙酯 (5a):白色固体, 产率96.0%. m.p. 125~129 ℃; 1H NMR (600 MHz, CDCl3) δ: 8.35 (d, J=8.4 Hz, 1H, Ar-H), 7.79~7.83 (m, 2H, Ar-H), 7.51~7.59 (m, 6H, Ar-H), 4.67 (s, 2H, CH2), 4.24 (q, J=7.2 Hz, 2H, CH2), 1.27 (t, J=7.2 Hz, 3H, CH3); MS (ESI) m/z: 309.2 ([M+H]+). Anal. calcd for C18H16N2O3: C 70.12, H 5.23, N 9.09; found C 70.21, H 5.26, N 9.03.
2-[2-(4-甲基-2-氧亚基-2H-苯并二氢吡喃-7-基)-4-氧亚基喹唑啉-3(4H)-基]乙酸乙酯 (5b):白色固体, 产率96.0%. m.p. 189~191 ℃; 1H NMR (600 MHz, CDCl3) δ: 8.35 (t, J=6.6 Hz, 1H, Ar-H), 7.85~7.83 (m, 1H, Ar-H), 7.79~7.75 (m, 2H, Ar-H), 7.59~7.54 (m, 3H, Ar-H), 6.42 (s, 1H, NH), 4.66 (s, 2H, CH2), 4.37 (dd, J=7.2 Hz, 2H, CH2), 2.52 (s, 3H, CH3), 1.29 (t, J=7.2 Hz, 3H, CH3); MS (ESI) m/z: 413.4 ([M+Na]+). Anal. calcd for C22H18N2O5: C 67.69, H 4.65, N 7.18; found C 67.78, H 4.72, N 7.20.
3.2.1 化合物4a和4b的合成
以化合物4a的合成为例, 参照文献[9]方法.将邻氨基苯甲酸137 mg (1.0 mmol) 溶于3 mL无水苯中, 再加入氯化亚砜595 mg (5.0 mmol), 氮气保护下, 回流反应3 h.反应结束后, 冷却至室温.蒸除过量的氯化亚砜和溶剂苯, 得到黄色油状物亚胺烯酮中间体1, 干燥备用.
在50 mL的圆底烧瓶中, 加入106 mg (1.0 mmol) 苯甲醛 (2a)、210 mg (1.5 mmol) 甘氨酸乙酯盐酸盐、5 mL无水苯以及2 mL (2.0 mmol) N, N'-二异丙基乙胺 (DIPEA), 氮气保护下室温搅拌.以一滴冰醋酸为催化剂, TLC监测反应结束后, 得到中间体亚胺3a, 备用.
将上述3a的反应液倒入亚胺烯酮中间体1中, 室温下剧烈搅拌8 h, 簿层色谱 (TLC) 监测反应结束后, 加水 (5 mL×2) 洗涤反应液.有机相用无水硫酸镁干燥, 抽滤浓缩, 所得粗产品用硅胶柱快速分离 (石油醚/乙酸乙酯, V:V=1:1), 再重结晶 (石油醚/乙酸乙酯, V:V=3:1) 得到170 mg化合物4a.按相同的方法, 以7-香豆素醛2b为原料, 得到化合物4b.
2-[4-氧亚基-2-苯基-1, 2-二氢喹唑啉-3(4H)-基]乙酸乙酯 (4a):白色固体, 产率72.0%. m.p. 155~159 ℃; 1H NMR (600 MHz, CDCl3) δ: 7.98 (d, J=7.8 Hz, 1H, Ar-H), 7.52 (t, J=6.0 Hz, 2H, Ar-H), 7.41~7.44 (m, 3H, Ar-H), 7.29~7.32 (m, 1H, Ar-H), 6.89 (t, J=7.6 Hz, 1H, Ar-H), 6.62 (d, J=7.8 Hz, 1H, Ar-H), 6.08 (s, 1H, CH), 4.65 (d, J=18.0 Hz, 1H, CH2), 4.13 (t, J=7.2 Hz, 2H, CH2), 3.27 (d, J=17.4 Hz, 1H, CH2), 1.21 (t, J=7.2 Hz, 3H, CH3); MS (ESI) m/z: 311.2 ([M+H]+). Anal. calcd for C18H18N2O3: C 69.66, H 5.85, N 9.03; found C 69.74, H 5.82, N 9.96.
2-[2-(4-甲基-2-氧亚基-2H-苯并二氢吡喃-7-基)-4-氧亚基-1, 2-二氢喹唑啉-3(4H)-基]乙酸乙酯 (4b):白色固体, 产率50.0%. m.p. 232~233 ℃; 1H NMR (600 MHz, CDCl3) δ: 7.93 (d, J=7.8 Hz, 1H, Ar-H), 7.61 (d, J=8.2 Hz, 1H, Ar-H), 7.45 (d, J=8.2 Hz, 1H, Ar-H), 7.40 (s, 1H, Ar-H), 7.29 (t, J=7.7 Hz, 1H, Ar-H), 6.88 (t, J=7.6 Hz, 1H, Ar-H), 6.62 (d, J=8.0 Hz, 1H, Ar-H), 6.31 (s, 1H, Ar-H), 6.09 (s, 1H, Ar-H), 4.74 (d, J=17.6 Hz, 1H, CH2), 4.58 (s, 1H, NH), 4.13 (dd, J=9.8, 7.1 Hz, 2H, CH2), 3.29 (d, J=17.6 Hz, 1H, CH2), 2.42 (s, 3H, CH3), 1.21 (t, J=7.1 Hz, 3H, CH3); MS (ESI) m/z: 415.4 ([M+Na]+). Anal. calcd for C22H20N2O5: C 67.34, H 5.14, N 7.14; found C 67.36, H 5.21, N 7.10.
3.2.5 化合物9aa~9ae和9ba~9be的合成
以化合物9aa的合成为例: 50 mL圆底烧瓶中加入200 mg (0.76 mmol) 化合物8a、210 mg (1.5 mmol) 无水碳酸钾, 再加入10 mL新处理的丙酮, 回流反应30 min后加入164 mg (1.1 mmol) 2-氯-N, N-二甲基乙胺盐酸盐和催化量碘化钾, 继续回流反应4 h, 反应结束后抽滤除去碳酸钾, 母液浓缩后经柱色谱分离 (石油醚/乙酸乙酯, V:V=3:1) 得到193 mg化合物9aa.按相同的方法, 以不同的氯代乙胺盐酸盐为原料, 得到化合物9ab~9ae和9ba~9be(8b为原料).
N, N-二甲基-2-[(2-苯基喹唑啉-4-基) 氧基]乙胺 (9aa):黄色油状物, 产率46.9%. 1H NMR (600 MHz, CDCl3) δ: 8.62~8.59 (m, 2H, Ar-H), 8.20 (d, J=8.1 Hz, 1H, Ar-H), 8.01 (d, J=8.3 Hz, 1H, Ar-H), 7.83 (dd, J=11.1, 4.2 Hz, 1H, Ar-H), 7.55~7.51 (m, 4H, Ar-H), 4.89 (t, J=5.8 Hz, 2H, CH2), 2.98 (t, J=5.8 Hz, 2H, CH2), 2.47 (s, 6H, CH3); MS (ESI) m/z: 316.4 ([M+Na]+). Anal. calcd for C18H19N3O: C 73.69, H 6.53, N 14.32; found C 73.72, H 6.58, N 14.33.
N, N-二乙基-2-[(2-苯基喹唑啉-4-基) 氧基]乙胺 (9ab):黄色油状物, 产率45.3%. 1H NMR (600 MHz, CDCl3) δ: 8.61 (d, J=7.2 Hz, 2H, Ar-H), 8.18 (d, J=7.8 Hz, 1H, Ar-H), 8.01 (d, J=8.4 Hz, 1H, Ar-H), 7.83 (t, J=7.2 Hz, 1H, Ar-H), 7.54~7.51 (m, 4H, Ar-H), 4.84 (t, J=6.0 Hz, 2H, CH2), 3.09 (t, J=6.0 Hz, 2H, CH2), 2.76 (q, J=7.2 Hz, 2H, CH2), 1.15 (t, J=7.2 Hz, 6H, CH3); MS (ESI) m/z: 344.2 ([M+Na]+). Anal. calcd for C20H23N3O: C 74.74, H 7.21, N 13.07; found C 74.78, H 7.19, N 13.06.
2-苯基-4-[2-(四氢吡咯-1-基) 乙氧基]喹唑啉 (9ac):黄色油状物, 产率56.7%. 1H NMR (600 MHz, CD3OD) δ: 8.55~8.53 (m, 2H, Ar-H), 8.27 (d, J=8.4 Hz, 1H, Ar-H), 7.89 (d, J=8.4 Hz, 1H, Ar-H), 7.91 (t, J=8.4 Hz, 1H, Ar-H), 7.63~7.61 (m, 1H, Ar-H), 7.53~7.52 (m, 3H, Ar-H), 4.93 (t, J=5.4 Hz, 2H, CH2), 3.18 (t, J=5.4 Hz, 2H, CH2), 2.83 (brs, 4H, CH2), 1.89 (brs, 4H, CH2); MS (ESI) m/z: 320.3 ([M+H]+). Anal. calcd for C20H23N3O: C 75.21, H 6.63, N 13.16; found C 75.24, H 6.65, N 13.09.
2-苯基-4-[2-(哌啶-1-基) 乙氧基]喹唑啉 (9ad):黄色油状物, 产率90.2%. 1H NMR (600 MHz, CDCl3) δ: 8.61 (d, J=6.6 Hz, 2H, Ar-H), 8.18 (d, J=7.2 Hz, 1H, Ar-H), 8.01 (d, J=8.4 Hz, 1H, Ar-H), 7.84 (t, J=7.2 Hz, 1H, Ar-H), 7.54~7.52 (m, 4H, Ar-H), 4.89 (t, J=6.0 Hz, 2H, CH2), 2.98 (t, J=6.0 Hz, 2H, CH2), 2.64 (brs, 4H, CH2), 1.68~1.64 (m, 4H, CH2), 1.49 (brs, 2H, CH2); MS (ESI) m/z: 356.2 ([M+Na]+). Anal. calcd for C21H23N3O: C 75.65, H 6.95, N 12.60; found C 75.71, H 6.88, N 13.69.
4-{2-[(2-苯基喹唑啉-4-基) 氧基]乙基}吗啉 (9ae):黄色油状物, 产率92.4%. 1H NMR (600 MHz, CDCl3) δ: 8.59 (dd, J=2.4, 6.6 Hz, 2H, Ar-H), 8.18 (d, J=6.6 Hz, 1H, Ar-H), 8.02 (d, J=8.4 Hz, 1H, Ar-H), 7.85 (dt, J=1.2, 5.4 Hz, 1H, Ar-H), 7.56~7.51 (m, 4H, Ar-H), 4.90 (t, J=6.0 Hz, 2H, CH2), 3.77 (t, J=4.8 Hz, 4H, CH2), 3.00 (t, J=6.0 Hz, 2H, CH2), 2.69 (brs, 4H, CH2); MS (ESI) m/z: 336.4 ([M+H]+). Anal. calcd for C20H21N3O2: C 71.62, H 6.31, N 12.53; found C 71.65, H 6.34, N 12.58.
7-{4-[2-(二甲基氨基) 乙氧基]喹唑啉-2-基}-4-甲基-2H-苯并二氢吡喃-2-酮 (9ba):白色固体, 产率54.3%. m.p. 128~129 ℃; 1H NMR (600 MHz, CDCl3) δ: 8.52 (d, J=6.6 Hz, 2H, Ar-H), 8.19 (d, J=8.4 Hz, 1H, Ar-H), 7.99 (d, J=8.4 Hz, 1H, Ar-H), 7.84 (t, J=7.2 Hz, 1H, Ar-H), 7.69 (d, J=8.4 Hz, 1H, Ar-H), 7.55 (t, J=7.2 Hz, 1H, Ar-H), 6.33 (s, 1H, CH), 4.84 (t, J=5.4 Hz, 2H, CH2), 2.94 (t, J=5.4 Hz, 2H, CH2), 2.49 (s, 3H, CH3), 2.43 (s, 6H, CH3); 13C NMR (150 MHz, CDCl3) δ:166.8, 160.9, 158.1, 153.7, 152.1, 151.71, 141.7, 133.8, 128.1, 127.1, 124.5, 123.9, 123.7, 121.4, 116.9, 115.6, 115.5, 65.2, 57.8, 46.0, 18.7; MS (ESI) m/z: 398.4 ([M+Na]+). Anal. calcd for C22H21N3O3: C 70.38, H 5.64, N 11.19; found C 70.45, H 5.60, N 11.28.
7-{4-[2-(二乙基氨基) 乙氧基]喹唑啉-2-基}-4-甲基-2H-苯并二氢吡喃-2-酮 (9bb):白色固体, 产率78.4%. m.p. 126~127 ℃; 1H NMR (600 MHz, CDCl3)δ: 8.55 (d, J=6.6 Hz, 2H, Ar-H), 8.19 (d, J=7.8 Hz, 1H, Ar-H), 8.02 (d, J=8.4 Hz, 1H, Ar-H), 7.87 (t, J=7.2 Hz, 1H, Ar-H), 7.72 (d, J=8.4 Hz, 1H, Ar-H), 7.58 (t, J=7.8 Hz, 1H, Ar-H), 6.36 (s, 1H, CH), 4.88 (t, J=6.0 Hz, 2H, CH2), 3.16 (t, J=6.6 Hz, 2H, CH2), 2.82 (d, J=7.2 Hz, 4H, CH2), 2.51 (s, 3H, CH3), 1.19 (s, 6H, CH3); 13C NMR (150 MHz, CDCl3) δ:166.8, 160.8, 158.2, 153.8, 151.9, 151.8, 141.7, 133.8, 128.2, 127.1, 124.4, 123.9, 123.5, 121.4, 116.9, 115.7, 115.5, 51.0, 47.9, 18.6, 11.7; MS (ESI) m/z: 426.2 ([M+Na]+). Anal. calcd for C24H25N3O3: C 71.44, H 6.25, N 10.41; found C 71.46, H 6.24, N 10.42.
4-甲基-7-{4-[2-(四氢吡咯-1-基) 乙氧基]喹唑啉-2-基}-2H-苯并二氢吡喃-2-酮 (9bc):白色固体, 产率80.2%. m.p. 121~122 ℃; 1H NMR (600 MHz, CDCl3) δ: 8.52 (dd, J=3.6, 1.2 Hz, 2H, Ar-H), 8.19 (d, J=8.4 Hz, 1H, Ar-H), 8.01 (d, J=8.4 Hz, 1H, Ar-H), 7.85 (t, J=7.2 Hz, 1H, Ar-H), 7.68 (d, J=8.4 Hz, 1H, Ar-H), 7.56 (t, J=7.2 Hz, 1H, Ar-H), 6.33 (s, 1H, CH), 4.89 (t, J=6.0 Hz, 2H, CH2), 3.13 (t, J=6.0 Hz, 2H, CH2), 2.77 (s, 4H, CH2), 2.49 (s, 3H, CH3), 1.87 (s, 4H, CH2); 13C NMR (150 MHz, CDCl3) δ: 166.6, 160.8, 153.6, 152.0, 151.7, 141.6, 133.7, 128.1, 127.0, 124.4, 123.9, 123.6, 121.3, 116.8, 115.6, 115.5, 66.1, 54.8, 54.4, 23.6, 18.6; MS (ESI) m/z: 464.5 ([M+Na]+). Anal. calcd for C24H23N3O3: C 71.80, H 5.77, N 10.47; found C 71.77, H 5.81, N 10.49.
4-甲基-7-{4-[2-(哌啶-1-基) 乙氧基]喹唑啉-2-基}-2H-苯并二氢吡喃-2-酮 (9bd):白色固体, 产率81.8%. m.p. 133~134 ℃; 1H NMR (600 MHz, CDCl3) δ: 8.57 (d, J=10.2 Hz, 2H, Ar-H), 8.21 (d, J=8.4 Hz, 1H, Ar-H), 8.03 (d, J=8.4 Hz, 1H, Ar-H), 7.87 (t, J=7.2 Hz, 1H, Ar-H), 7.73 (d, J=7.8 Hz, 1H, Ar-H), 7.58 (t, J=7.2 Hz, 1H, Ar-H), 6.37 (s, 1H, CH), 4.90 (t, J=6.0 Hz, 2H, CH2), 3.02 (t, J=6.0 Hz, 2H, CH2), 2.67 (brs, 4H, CH2), 2.52 (s, 3H, CH3), 1.68 (m, 4H, CH2), 1.51 (brs, 2H, CH2); 13C NMR (150 MHz, CDCl3) δ: 166.7, 160.8, 158.1, 153.7, 152.0, 151.7, 141.7, 133.7, 128.1, 127.0, 124.4, 123.9, 123.6, 121.3, 116.9, 115.6, 115.5, 64.9, 57.4, 54.9, 25.88, 24.1, 18.7; MS (ESI) m/z: 438.5 ([M+Na]+). Anal. calcd for C25H25N3O3: C 72.27, H 6.06, N 10.11; found C 72.20, H 5.98, N 10.03.
4-甲基-7-[4-(2-吗啉乙氧基) 喹唑啉-2-基]-2H-苯并二氢吡喃-2-酮 (9be):白色固体, 产率61.9%. m.p. 143~144 ℃; 1H NMR (600 MHz, CDCl3) δ: 8.54 (d, J=7.2 Hz, 2H, Ar-H), 8.18 (d, J=8.4 Hz, 1H, Ar-H), 8.03 (d, J=7.8 Hz, 1H, Ar-H), 7.87 (t, J=7.2 Hz, 1H, Ar-H), 7.72 (d, J=7.8 Hz, 1H, Ar-H), 7.58 (t, J=7.2 Hz, 1H, Ar-H), 6.36 (s, 1H, CH), 4.88 (t, J=6.0 Hz, 2H, CH2), 3.77 (t, J=5.4 Hz, 4H, CH2), 3.01 (t, J=6.0 Hz, 2H, CH2), 2.69 (s, 4H, CH2), 2.51 (s, 3H, CH3); 13C NMR (150 MHz, CDCl3) δ: 166.7, 160.8, 158.1, 153.7, 152.0, 151.7, 141.6, 133.8, 131.2, 128.2, 127.1, 124.4, 123.9, 123.5, 121.4, 116.9, 116.3, 115.7, 115.5, 67.0, 64.7, 57.2, 57.1, 54.1, 53.8, 18.6; MS (ESI) m/z: 440.1 ([M+Na]+). Anal. calcd for C24H23N3O4: C 69.05, H 5.55, N 10.07; found C 69.13, H 5.61, N 10.04.
3.2.4 化合物8a和8b的合成
50 mL圆底烧瓶中加入200 mg (0.7 mmol) 化合物6a, 加入5.0 mL氯化亚砜, 回流反应3 h, 反应结束后, 用氮气吹出氯化亚砜, 残留物用甲醇重结晶.所得粗品经硅胶柱 (石油醚/乙酸乙酯, V:V=3:1) 分离得到63 mg化合物8a.按相同的方法, 以化合物6b为原料, 得到化合物8b.
2-苯基喹唑啉-3(4H)-酮 (8a):白色固体, 产率28.0%. m.p. 252~253 ℃; 1H NMR (600 MHz, CDCl3): δ: 11.71 (s, 1H, OH), 8.33 (d, J=6.6 Hz, 1H, Ar-H), 8.27~8.25 (m, 2H, Ar-H), 7.85 (d, J=7.8 Hz, 1H, Ar-H), 7.81 (t, J=7.8 Hz, 1H, Ar-H), 7.59~7.58 (m, 3H, Ar-H), 7.51 (t, J=7.8 Hz, 1H, Ar-H); MS (ESI) m/z: 361.2 ([M+K]+). Anal. calcd for C14H10N2O: C 75.66, H 4.54, N 12.60; found C 75.73, H 4.57, N 12.56.
2-(4-甲基-2-氧亚基-2H-苯并二氢吡喃-7-基)-喹唑啉-3(4H)-酮 (8b):白色固体, 产率36.7%. m.p. 263~265 ℃; 1H NMR (600 MHz, Pyridine-d5) δ: 8.59 (d, J=7.8 Hz, 1H, Ar-H), 8.45 (s, 1H, Ar-H), 8.39 (t, J=7.2 Hz, 1H, Ar-H), 8.03 (d, J=7.8 Hz, 1H, Ar-H), 7.81 (d, J=8.4 Hz, 2H, Ar-H), 7.51 (t, J=7.8 Hz, 1H, Ar-H), 6.42 (s, 1H, CH), 2.26 (s, 3H, CH3); MS (ESI) m/z: 305.3 ([M+H]+). Anal. calcd for C18H12N2O3: C 71.05, H 3.97, N 9.21; found C 71.12, H 4.04, N 9.19.
3.2.3 化合物6a和6b的合成
50 mL圆底烧瓶中加入616 mg (2.0 mmol) 化合物5a, 加入5.0 mL无水乙醇, 室温搅拌下加入1 mol/L NaOH溶液1 mL, 继续搅拌5 min, 反应液变澄清, TLC监测反应完全.反应液用1 mol/L盐酸酸化至pH<1, 静置抽滤, 滤饼用乙酸乙酯重结晶得到550 mg化合物6a.按相同的方法, 以化合物5b为原料, 得到化合物6b.
2-[4-氧亚基-2-苯基喹唑啉-3(4H)-基]乙酸 (6a):白色固体, 产率98.0%. m.p. 233~237 ℃; 1H NMR (600 MHz, CD3OD) δ: 8.28 (d, J=7.2 Hz, 1H, Ar-H), 7.90 (t, J=7.2 Hz, 1H, Ar-H), 7.73 (t, J=8.4 Hz, 1H, Ar-H), 7.63~7.57 (m, 6H, Ar-H), 4.66 (s, 2H, CH2); MS (ESI) m/z: 281.2 ([M+H]+). Anal. calcd for C16H12N2O3: C 68.56, H 4.32, N 9.99; found C 68.54, H 4.36, N 10.02.
2-[2-(4-甲基-2-氧亚基-2H-苯并二氢吡喃-7-基)-4-氧亚基喹唑啉-3(4H)-基]乙酸 (6b):白色固体, 产率96.0%. m.p. 266~267 ℃; 1H NMR (600 MHz, CD3OD) δ: 8.30 (d, J=8.4 Hz, 1H, Ar-H), 7.99 (d, J=7.8 Hz, 1H, Ar-H), 7.91 (t, J=7.8 Hz, 1H, Ar-H), 7.76 (d, J=8.4 Hz, 1H, Ar-H), 7.66~7.61 (m, 3H, Ar-H), 6.48 (s, 1H, NH), 4.70 (s, 2H CH2), 2.56 (s, 3H, CH3); MS (ESI) m/z: 363.3 ([M+H]+). Anal. calcd for C20H14N2O5: C 66.30, H 3.89, N 7.73; found C 66.35, H 3.92, N 7.74.
-
-
[1]
Khan, I.; Zaib, S.; Batool, S.; Abbas, N.; Ashraf, Z.; Iqbal, J.; Saeed, A. Bioorg. Med. Chem. 2016, 24, 2361. doi: 10.1016/j.bmc.2016.03.031
-
[2]
Khan, I.; Ibrar, A.; Abbas, N.; Saeed, A. Eur. J. Med. Chem. 2014, 76, 193. doi: 10.1016/j.ejmech.2014.02.005
-
[3]
Khan, I.; Ibrar, A.; Ahmed, W.; Saeed, A. Eur. J. Med. Chem. 2015, 90, 124. doi: 10.1016/j.ejmech.2014.10.084
-
[4]
欧俊军, 刘克昌, 王毅, 张浩, 刘瑞全, 李奇博, 汪清民, 李永强, 芮昌辉, 刘尚钟, 有机化学, 2014, 34, 526. doi: 10.6023/cjoc201310022Ou, J. J.; Liu, K. C.; Wang, Y.; Zhang, H.; Liu, R. Q.; Li, Q. B.; Wang, Q. M.; Li, Y. Q.; Rui, C. H.; Liu S. Z. Chin. J. Org. Chem. 2014, 34, 526 (in Chinese). doi: 10.6023/cjoc201310022
-
[5]
Wang, Z.-Z.; Tang, Y. Tetrahedron 2016, 72, 1330. doi: 10.1016/j.tet.2016.01.027
-
[6]
Kim, N. Y.; Cheon, C.-H. Tetrahedron Lett. 2014, 55, 2340. doi: 10.1016/j.tetlet.2014.02.065
-
[7]
Yu, C. W.; Chang, P. T.; Hsin, L. W.; Chern, J. W. J. Med. Chem. 2013, 56, 6775. doi: 10.1021/jm400564j
-
[8]
Deepak, G.; Kumar, R.; Roy, R. K.; Sharma, A.; Ali, I. Med. Chem. Res. 2013, 22, 3282. doi: 10.1007/s00044-012-0293-6
-
[9]
Johannes, K.; Martens, J. Tetrahedron 2010, 66, 242. doi: 10.1016/j.tet.2009.10.107
-
[10]
Unsworth, W. P.; Coulthard, G.; Kitsiou, C.; Taylor, R. J. K. J. Org. Chem., 2014, 79, 1368. doi: 10.1021/jo402768r
-
[11]
Kametani, T.; Van LoC C.; Higa, T.; Koizumi, M.; Ihara, M.; Fukumoto, K. J. Am. Chem. Soc. 1977, 99, 2306. doi: 10.1021/ja00449a047
-
[12]
徐嵩, 徐世平, 李兰敏, 药学学报, 2002, 37, 113. http://www.cqvip.com/Main/Detail.aspx?id=6051675Xu, S.; Xu, S. P.; Li, L. M. Acta Pharm. Sin. 2002, 37, 113 (in Chinese). http://www.cqvip.com/Main/Detail.aspx?id=6051675
-
[13]
侯宝龙, 艾芸, 王翠玲, 张宁, 杨柳, 刘竹兰, 刘建利, 有机化学, 2016, 36, 121. doi: 10.6023/cjoc201507012Hou, B. L.; Ai, Y.; Wang, C. L.; Zhang, N.; Yang, L.; Liu, Z. L.; Liu, J. L. Chin. J. Org. Chem. 2016, 36, 121 (in Chinese). doi: 10.6023/cjoc201507012
-
[14]
Nacro, K.; Charles, Z.; Guzzo, P. R.; Herr, R. J.; Peace, D.; Friedrich, T. D. Bioorg. Med. Chem. 2007, 15, 4237. doi: 10.1016/j.bmc.2007.03.067
-
[15]
Mayer, J. P.; Lewis, G. S.; Curtis, M. J.; Zhang, J. W. Tetrahedron Lett. 1997, 38, 8445. doi: 10.1016/S0040-4039(97)10276-3
-
[16]
Chen, H.; Li, S.; Yao, Y. C.; Zhou, L. K.; Zhao, J. P.; Gu, Y. J.; Wang, K. R.; Li, X. L. Bioorg. Med. Chem. Lett. 2013, 23, 4785. doi: 10.1016/j.bmcl.2013.07.009
-
[17]
Gunaratnam, M.; Swank, S.; Haider, S. M.; Galesa, K.; Reszka, A. P.; Beltran, M.; Cuenca, F.; Fletcher, J. A.; Neidle, S. J. Med. Chem. 2009, 52, 3774. doi: 10.1021/jm900424a
-
[18]
Chen, G. S.; Kalchar, S.; Kuo, C.-W.; Chang, C.-S.; Usifoh, C. O.; Chern, J.-W. J. Org. Chem. 2003, 68, 2502. doi: 10.1021/jo0263420
-
[19]
Venkata Sairam, K.; Gurupadayya, B. M.; Chandan, R. S.; Nagesha, D. K.; Vishwanathan, B. Curr. Drug Delivery 2016, 13, 186. doi: 10.2174/1567201812666150702102800
-
[20]
Mosmann, T. J. Immunol. Methods 1983, 65, 55. doi: 10.1016/0022-1759(83)90303-4
-
[1]
-
表 1 二氢喹唑啉-4-酮 (4a) 的合成
Table 1. Synthesis of dihydroquinazolin-4-one (4a)
Entry 投料比a 温度/℃ 时间/h 收率/% 1 1:1 r.t 8 45 2 1:1 40 8 47 3 1:1 80 8 40 4 1:1 r.t 10 48 5 1:1 r.t 12 47 6 1:2 r.t 8 48 7 1:5 r.t 8 52 8b 1:1 r.t 8 72 a邻氨基苯甲酸与苯甲醛的物质的量比; b生成亚胺时, 加催化量的冰醋酸. 表 2 化合物8和9的抗肿瘤活性
Table 2. Antitumor activities of compounds 8 and 9
Compd. 抗肿瘤活性[IC50/(μmol•L-1)] MCF-7 K562 A549 Hela 8a >50 >50 >50 >50 9aa >50 >50 >50 >50 9ab >50 >50 >50 >50 9ac >50 >50 >50 >50 9ad >50 >50 >50 >50 9ae >50 >50 >50 >50 8b >50 >50 >50 >50 9ba >50 24.59±5.21 >50 8.16±0.78 9bb >50 43.25±7.60 >50 38.33±1.77 9bc 17.04±1.62 12.49±1.58 5.62±0.54 7.47±0.17 9bd 29.87±5.74 17.59±4.83 9.54±1.83 29.77±5.88 9be >50 >50 >50 >50 顺铂 7.93±0.67 3.00±0.71 11.88±1.21 12.07±1.28 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 26
- 文章访问数: 2283
- HTML全文浏览量: 409


 下载:
下载:



 下载:
下载:

