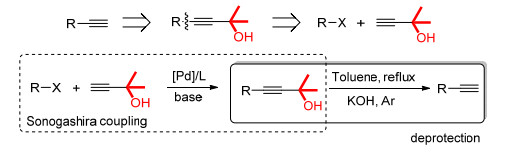
 图 1
Sonogashira偶联制备端炔的方法
Figure 1.
Sonogashira coupling to prepare terminal alkynes
图 1
Sonogashira偶联制备端炔的方法
Figure 1.
Sonogashira coupling to prepare terminal alkynes

Citation: Guan Zhipeng, Shi Yao, Shi Wei, Chen Hao. Synthesis of Terminal Alkynes/Diynes through Deprotection of Acetone Protected Alkynes under Mild Conditions[J]. Chinese Journal of Organic Chemistry, 2017, 37(2): 418-422. doi: 10.6023/cjoc201607032

温和条件下去丙酮保护制备末端单炔烃及末端二炔的方法
-
关键词:
- 1, 4-二氧六环
- / 去保护
- / 末端炔烃
- / 2-甲基-3-丁炔-2-醇
English
Synthesis of Terminal Alkynes/Diynes through Deprotection of Acetone Protected Alkynes under Mild Conditions
-
Key words:
- 1, 4-dioxane
- / deprotection
- / terminal alkyne
- / 2-methyl-3-butyn-2-ol
-
具有芳基末端炔烃结构的化合物, 不仅是有机合成中重要的原料或者中间体, 广泛应用于农药以及药物等合成过程中, 而且还是许多天然产物和具有生理活性的化合物的核心骨架[1~3], 还可以通过末端炔烃之间的二聚反应得到共轭多炔结构[4~7], 因此发展这类炔烃具有重要的意义和广阔的应用前景[8~10].目前, 合成端基炔化合物的过程, 一种重要的方法是通过卤代烃和2-甲基-3-丁炔-2-醇的Sonogashira偶联[11~13], 得到的产物可以看作是丙酮保护的末端炔烃[14].该产物在一定条件下脱去丙酮的保护, 即得炔烃, 如图 1所示.
如果将图 1中的2-甲基-3-丁炔-2-醇替换成乙炔或三甲基硅基乙炔[15], 反应也可以进行.但是, 乙炔难以操作、储存、运输, 且使用过程中有一定的危险性; 三甲基硅基乙炔虽然反应迅速、脱保护条件温和[16], 但是价格却非常昂贵[17].相比较而言, 2-甲基-3-丁炔-2-醇的价格低廉[17, 易于存储和运输, 反应简便而迅速, 具备更好的应用前景, 但是存在的问题是其脱保护操作较困难.根据已有报道, 2-甲基-3-丁炔-2-醇需要在KOH、NaOH或NaH等强碱存在下, 甲苯中110 ℃回流数小时才能脱去丙酮的保护[14, 18, 19], 部分文献曾报道在70 ℃下可以得到部分炔烃产物[20, 21], 但产率较低 (58%), 因此限制了其应用. Huang等[22]发现在甲醇-甲苯混合溶剂中, 75 ℃下四丁基氢氧化铵也可以得到炔烃, 但是四丁基氢氧化铵价格昂贵, 且对制备、运输、操作等环节都有较高的要求. Li等[23]则发现使用二乙二醇单乙基醚和甲苯作为混合溶剂, NaOH为碱, 75 ℃下可以得到末端炔烃, 但是需要5倍量以上的强碱, 且在报道的反应中, 产率均未超过90%.本研究针对这一问题, 对丙酮保护的末端炔烃的去保护进行了研究, 发现可以在更低的温度下, 在较短时间内 (0.5~2 h) 即可实现这一去保护过程, 且反应体系更简便, 实现了末端1, 3-二炔及末端炔烃的相对简便和廉价的合成, 具备一定的有机合成意义.
1 结果与讨论
1.1 合成丙酮保护的末端炔烃
按照Eq. 1所示, 合成丙酮保护的末端炔烃[18], 结果如表 1所示.
Entry R 3 Isolated yield/% 1 H 3a 91 2 4-F 3b 88 3 4-OEt 3c 92 4 4-Me 3d 86 表 1 合成丙酮保护的末端1, 3-二炔烃
Table 1. Synthesis of acetone protected 1, 3-butadiynes以3a的合成为例, 量取28 mL正丁胺于150 mL烧瓶中, 加入43.56 mg (0.44 mmol) CuCl, 再分2~4次加入过量的盐酸羟胺 (约0.5~0.8 mmol), 使体系保持为还原态.加入2.04 g (20 mmol) 苯乙炔, 0 ℃下, 边搅拌边向上述体系加入3.52 g (24 mmol) 2-甲基-4-溴-3-丁炔-2-醇 (2) 反应5 h, TLC检测反应结束后, 以乙醚萃取分离, 无水硫酸钠干燥后, 减压蒸发除去溶剂, 重结晶提纯得到3.33 g 3a, 产率91%.
1.2 合成末端炔烃标样
参考传统方法[14], 将233 mg (1.27 mmol) 原料3a溶于经金属钠回流处理过的干甲苯 (25 mL) 中, 加入80 mg NaOH, 氩气保护下回流, 薄层色谱 (TLC) 检测至反应完全.石油醚作流动相进行硅胶柱色谱分离提纯, 最终得到端基炔化合物4a(产率70%), 为浅黄色油状液体, 留作气相色谱 (GC) 标准样品, 如Eq. 2所示.
1.3 脱保护反应条件优化
分别取92 mg (0.5 mmol) 3a溶于2 mL甲苯、甲醇、乙醇、二氯甲烷、四氢呋喃、1, 4-二氧六环、甲基叔丁基醚七种溶剂中, 加入56 mg (1.0 mmol) KOH, 70 ℃氩气保护下反应2 h, 以联苯作为内标进行气相色谱分析. GC产率如表 2所示.可以看出1, 4-二氧六环条件下有较高的产率.
Entry 溶剂 t/℃ GC产率/% 1 甲苯 70 42 2 甲醇 70 7 3 乙醇 70 16 4 二氯甲烷 70 58 5 四氢呋喃 70 40 6 1, 4-二氧六环 70 74 7 甲基叔丁基醚 70 44 8 1, 4-二氧六环 50 53 9 1, 4-二氧六环 60 88 表 2 条件筛选
Table 2. Screening of reaction conditions随后以1, 4-二氧六环为溶剂, 对反应温度进行了探索, 发现60 ℃时反应的产率达到88%, 低于或高于此温度, 反应产率均有所下降.因此, 我们确定了最佳的反应条件: 2倍量的KOH存在条件下, 以1, 4-二氧六环为溶剂, 60 ℃下反应.
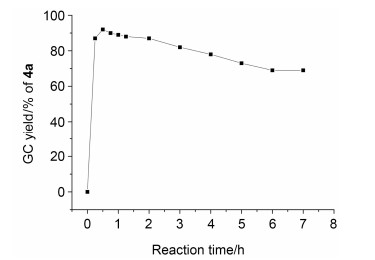
对反应时间也进行了研究, 结果如图 2所示.我们发现此反应在15 min内可基本完成, 30 min左右达到最大收率.随着反应时间的延长, 产率反而有下降的趋势.通过GC-MS及NMR等手段进行分析, 发现在数小时后, 有20%左右的产物转化为结构相对比较复杂的混合物, 其结构包含炔基、甲基等, 但是通过薄层层析对比, 并未发现有末端炔烃自身偶联的四炔产物.进一步的研究目前正在进行中.
1.4 底物的扩展
按照文献方法, 合成了包含不同取代基的底物3, 包括含二炔结构和含单炔结构的底物, 并对其进行脱保护试验, 结果如表 3所示.可以看到, 不论是富电子取代基还是贫电子取代基, 均可以满意的产率得到末端炔烃的产物.对于产物为共轭二炔的反应, 基本上可以在30 min之内完成 (Entries 1~5);而对于产物为单炔的反应, 反应时间需延长到2 h, 但温度保持不变 (Entries 6~9).对于Entry 6, GC显示反应物3f基本完全转化, 但由于产物苯乙炔沸点较低, 因此对其分离产率造成了影响.

Entry 3 4 Isolated
yield/%1 

90 2 

90 3 

81 4 

86 5 

99 6 

67 7 

87 8 

79 9 

93 10 

74 11 

94 12 

84 表 3 不同底物的产率
Table 3. Substrate scope2 结论
研究了丙酮保护的末端炔烃及二炔烃在温和条件下去保护的方法, 发现该方法可以实现较低的反应温度 (60 ℃)、较短的反应时间 (30 min~2 h)、较高的收率, 相比传统方法 (110 ℃甲苯回流) 具备明显的优点, 尤其是对末端二炔烃的制备, 反应可以在15~30 min内完成, 避免了高温下的副反应的发生, 从而完善了制备末端炔烃的成本相对低廉的方法.
3 实验部分
3.1 仪器与试剂
1H NMR和13C NMR用Bruker ADVANCE III 400 MHz测定, 以TMS为内标, CDCl3为溶剂; 气相色谱在Agilent 7820A GC System上测定.所用试剂均为分析纯, 甲苯、1, 4-二氧六环在氩气氛中金属钠存在下回流4 h后蒸出密封备用.其余溶剂均以分子筛干燥.
3.2 实验方法
取0.5 mmol 3于15 mL的Schlenk管中, 加入磁子、KOH (1.0 mmol), 用双排管将体系置换为氩气氛.保持氩气正压情况下, 向体系中加入2 mL干燥过的1, 4-二氧六环, 60 ℃油浴中反应30 min, 冷却至室温.向体系中加入4 mL水, 以乙酸甲酯进行萃取 (2 mL×2).有机相以无水硫酸钠干燥后, 浓缩, 柱层析.以正己烷为淋洗剂, 得到对应的产物4.
1-苯基-1, 3-丁二炔 (4a)[14]:淡黄色液体. 1H NMR (300 MHz, CDCl3) δ: 7.55 (d, J=6.8 Hz, 2H), 7.35~7.42 (m, 3H), 2.52 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 133.0, 129.6, 128.5, 121.0, 75.4, 73.5, 71.3, 68.2.
1-对氟苯基-1, 3-丁二炔 (4b)[14]:黄色固体. m.p. 69~70 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.49~7.52 (m, 2H), 7.03 (t, J=8.8 Hz, 2H), 2.48 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 164.5, 162.0, 134.9, 116.0, 74.3, 73.3, 71.3, 68.0.
1-对乙氧基苯基-1, 3-丁二炔 (4c)[14]:白色固体. m.p. 57~58 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.44 (d, J=8.8 Hz, 2H), 6.83 (d, J=9.2 Hz, 2H), 4.01~4.06 (m, 2H), 2.46 (s, 1H), 1.42 (t, J=7.2 Hz, 3H); 13C NMR (75 MHz, CDCl3) δ: 160.0, 134.4, 114.6, 112.6, 75.7, 72.3, 70.7, 68.4, 63.6, 14.7.
1-对甲苯基-1, 3-丁二炔 (4d)[14]:浅黄色液体. 1H NMR (300 MHz, CDCl3) δ: 7.40 (d, J=8.0 Hz, 2H), 7.13 (d, J=8.0 Hz, 2H), 2.46 (s, 1H), 2.35 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 139.2, 131.9, 128.5, 117.2, 74.7, 72.2, 70.2, 67.6, 20.8.
4-乙炔基苯乙酮 (4e):黄色固体. m.p. 69~70 ℃(文献值[24]: 68~70 ℃); 1H NMR (600 MHz, CDCl3) δ: 7.92 (d, J=8.0 Hz, 2H), 7.58 (d, J=8.0 Hz, 2H), 3.26 (s, 1H), 2.61 (s, 3H); 13C NMR (151 MHz, CDCl3) δ: 197.30, 136.76, 132.30, 128.19, 126.92, 82.75, 80.37, 26.66.
苯乙炔 (4f):浅黄色液体. 1H NMR (600 MHz, CDCl3) δ: 7.40~7.55 (m, 2H), 7.29~7.39 (m, 3H), 3.08 (s, 1H); 13C NMR (151 MHz, CDCl3) δ: 132.10, 128.78, 128.29, 122.04, 83.63, 77.15.
4-乙炔基甲苯 (4g):浅黄色液体. 1H NMR (600 MHz, CDCl3) δ: 7.38 (d, J=8.0 Hz, 2H), 7.12 (d, J=7.9 Hz, 2H), 3.03 (s, 1H), 2.35 (s, 3H); 13C NMR (151 MHz, CDCl3) δ: 138.94, 132.00, 129.05, 119.01, 83.83, 76.45, 21.49.
4-乙炔基苯甲醚 (4h):无色液体. 1H NMR (600 MHz, CDCl3) δ: 7.43 (d, J=8.8 Hz, 2H), 6.84 (d, J=8.9 Hz, 2H), 3.81 (s, 3H), 3.00 (s, 1H); 13C NMR (151 MHz, CDCl3) δ: 159.92, 133.58, 114.14, 113.92, 83.66, 75.77, 55.28.
1-溴-4-乙炔苯 (4i):黄色固体, m.p. 64~65 ℃(文献值[25]: 64℃). 1H NMR (400 MHz, CDCl3) δ: 7.45 (d, J=8.5 Hz, 2H), 7.34 (d, J=8.5 Hz, 2H), 3.12 (s, 1H); 13C NMR (101 MHz, CDCl3) δ: 133.52, 131.57, 123.12, 121.00, 82.55, 78.36.
1-溴-3-乙炔苯 (4j):浅黄色液体. 1H NMR (400 MHz, CDCl3) δ: 7.63 (t, J=1.8 Hz, 1H), 7.48 (ddd, J=8.0, 2.0, 1.1 Hz, 1H), 7.41 (dt, J=7.8Hz, 1.3 Hz, 1H), 7.18 (t, J=7.9 Hz, 1H), 3.12 (s, 1H); 13C NMR (101 MHz, CDCl3) δ: 134.83, 131.99, 130.66, 129.74, 124.05, 122.06, 82.01, 78.55.
1-氯-4-苯乙炔 (4k):黄色固体. m.p. 47~48 ℃(文献值[26]: 45.4~46.1 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.41 (d, J=8.5 Hz, 2H), 7.32~7.27 (m, 2H), 3.11 (s, 1H); 13C NMR (101 MHz, CDCl3) δ: 134.88, 133.34, 128.66, 120.55, 82.50, 78.18.
3-甲基苯乙炔 (4l):浅黄色液体. 1H NMR (400 MHz, CDCl3) δ: 7.36~7.26 (m, 2H), 7.23~7.12 (m, 2H), 3.04 (s, 1H), 2.32 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 138.00, 132.67, 129.66, 129.18, 128.19, 121.87, 83.82, 76.76, 21.18.
辅助材料 (Supporting Information) 所有产物的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
Siemsen, P.; Livingston, R. C.; Diederich, F. Angew. Chem., Int. Ed. 2000, 39, 2632. doi: 10.1002/(ISSN)1521-3773
-
[2]
Shun, A. L. K. S.; Tykwinski, R. R. Angew. Chem., Int. Ed. 2006, 45, 1034. doi: 10.1002/(ISSN)1521-3773
-
[3]
Ross, C.; Scherlach, K.; Kloss, F.; Hertweck, C. Angew. Chem., Int. Ed. 2014, 53, 7794. doi: 10.1002/anie.201403344
-
[4]
Tykwinski, R. R.; Chalifoux, W.; Eisler, S.; Lucotti, A.; Tommasini, M.; Fazzi, D.; Del, Z. M.; Zerbi, G. Pure Appl. Chem. 2010, 82, 891. doi: 10.1002/chin.201039255/full
-
[5]
Chalifoux, W. A.; Tykwinski, R. R. Nat. Chem. 2010, 2, 967. doi: 10.1038/nchem.828
-
[6]
Shi, W. Curr. Organocatal. 2015, 2, 2. doi: 10.2174/2213337201666140820225700
-
[7]
Tykwinski, R. R.; Chalifoux, W.; Eisler, S.; Lucotti, A.; Tommasini, M.; Fazzi, D.; Del Zoppo, M.; Zerbi, G. Pure Appl. Chem. 2010, 82, 891. doi: 10.1002/chin.201039255/full
-
[8]
Shi, W.; Lei, A. Tetrahedron Lett. 2014, 55, 2763. doi: 10.1016/j.tetlet.2014.03.022
-
[9]
Stefko, M.; Tzirakis, M. D.; Breiten, B.; Ebert, M.-O.; Dumele, O.; Schweizer, W. B.; Gisselbrecht, J.-P.; Boudon, C.; Beels, M. T.; Biaggio, I.; Diederich, F. Chem.-Eur. J. 2013, 19, 12693. doi: 10.1002/chem.201301642
-
[10]
Sahnoune, H.; Baranova, Z.; Bhuvanesh, N.; Gladysz, J. A.; Halet, J.-F. Organometallics 2013, 32, 6360. doi: 10.1021/om400709q
-
[11]
白东虎, 李春举, 李健, 贾学顺, 有机化学, 2012, 32, 994. doi: 10.6023/cjoc1202073Bai, D.; Li, C.; Li, J.; Jia, X. Chin. J. Org. Chem. 2012, 32, 994 (in Chinese). doi: 10.6023/cjoc1202073
-
[12]
王晔峰, 邓维, 刘磊, 郭庆祥, 有机化学, 2005, 25, 8. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338626.shtmlWang, Y.-F.; Deng, W.; Liu, L.; Guo, Q.-X. Chin. J. Org. Chem. 2005, 25, 8 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338626.shtml
-
[13]
Shi, W.; Luo, Y. D.; Luo, X. C.; Chao, L.; Zhang, H.; Wang, J.; Lei, A. W. J. Am. Chem. Soc. 2008, 130, 14713. doi: 10.1021/ja8049436
-
[14]
Zhang, F.-G.; Ma, H.; Zheng, Y.; Ma, J.-A. Tetrahedron 2012, 68, 7663. doi: 10.1016/j.tet.2012.05.086
-
[15]
Xue, Y.-X.; Zhu, Y.-Y.; Gao, L.-M.; He, X.-Y.; Liu, N.; Zhang, W.-Y.; Yin, J.; Ding, Y.; Zhou, H.; Wu, Z.-Q. J. Am. Chem. Soc. 2014, 136, 4706. doi: 10.1021/ja5004747
-
[16]
Carpita A., Mannocci L., Rossi R.. Eur. J. Org. Chem.[J]. , 2005, : 1859.
-
[17]
李硕, 毛凤, 师瑶, 王阳, 石炜, 福建师范大学学报 (自然科学版), 2015, 31, 120. http://www.cnki.com.cn/Article/CJFDTotal-FJSZ201505018.htmLi, S.; Mao, F.; Shi, Y.; Wang, Y.; Shi, W. J. Fujian Normal Univ. (Nat. Sci.) 2015, 31, 120 (in Chinese). http://www.cnki.com.cn/Article/CJFDTotal-FJSZ201505018.htm
-
[18]
Jiang, M. X.-W.; Rawat, M.; Wulff, W. D. J. Am. Chem. Soc. 2004, 126, 5970. doi: 10.1021/ja049836i
-
[19]
Havens, S. J.; Hergenrother, P. M. J. Org. Chem. 1985, 50, 1763. doi: 10.1021/jo00210a042
-
[20]
Danilkina, N. A.; Kulyashova, A. E.; Khlebnikov, A. F.; Bräse, S.; Balova, I. A. J. Org. Chem. 2014, 79, 9018. doi: 10.1021/jo501396s
-
[21]
West, K.; Wang, C.; Batsanov, A. S.; Bryce, M. R. J. Org. Chem. 2006, 71, 8541. doi: 10.1021/jo0615697
-
[22]
Li, J.; Huang, P. Beilstein J. Org. Chem. 2011, 7, 426. doi: 10.3762/bjoc.7.55
-
[23]
Li, J.; Guo, K.; Dong, Q.; Huang, P.; Wang, H.; Xu, B. CN 104177209, 2014 [Chem. Abstr. 2014, 2020360].
-
[24]
Kabalka, G. W.; Zhou, L.-L.; Wang, L.; Pagni, R. M. Tetrahedron 2006, 62, 857. doi: 10.1016/j.tet.2005.10.049
-
[25]
Ghaffarzadeh, M.; Bolourtchian, M.; Fard, Z. H.; Halvagar, M. R.; Mohsenzadeh, F. Synth. Commun. 2006, 36, 1973. doi: 10.1080/00397910600634100
-
[26]
Vaughn, T. H.; Nieuwland, J. A. J. Am. Chem. Soc. 1934, 56, 1207. doi: 10.1021/ja01320a065
-
[1]
-
表 1 合成丙酮保护的末端1, 3-二炔烃
Table 1. Synthesis of acetone protected 1, 3-butadiynes
Entry R 3 Isolated yield/% 1 H 3a 91 2 4-F 3b 88 3 4-OEt 3c 92 4 4-Me 3d 86 表 2 条件筛选
Table 2. Screening of reaction conditions
Entry 溶剂 t/℃ GC产率/% 1 甲苯 70 42 2 甲醇 70 7 3 乙醇 70 16 4 二氯甲烷 70 58 5 四氢呋喃 70 40 6 1, 4-二氧六环 70 74 7 甲基叔丁基醚 70 44 8 1, 4-二氧六环 50 53 9 1, 4-二氧六环 60 88 表 3 不同底物的产率
Table 3. Substrate scope

Entry 3 4 Isolated
yield/%1 

90 2 

90 3 

81 4 

86 5 

99 6 

67 7 

87 8 

79 9 

93 10 

74 11 

94 12 

84 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 36
- 文章访问数: 2830
- HTML全文浏览量: 591


 下载:
下载:

 下载:
下载:

