
Citation: Liu Zizhao, Xu Fan. Synthesis of Chromans via Domino Reaction of Phenols with Prenyl Bromide Catalyzed by Zinc Chloride[J]. Chinese Journal of Organic Chemistry, 2016, 36(10): 2499-2503. doi: 10.6023/cjoc201604021

氯化锌催化酚与异戊烯基溴的串联反应合成苯并吡喃化合物
English
Synthesis of Chromans via Domino Reaction of Phenols with Prenyl Bromide Catalyzed by Zinc Chloride
-
Key words:
- chroman
- / zinc chloride
- / catalysis
- / prenyl bromide
-
苯并吡喃结构单元广泛存在于多种天然化合物如维生素E及多种香豆素、黄酮衍生物中[1]. 合成的苯并吡喃及其衍生物更是具有非常丰富的生理活性[2]. 因此,高效合成苯并吡喃骨架的方法长期以来都受到合成化学家们的重视. 在文献中关于苯并吡喃的合成方法已有很多报道. 较为主要的路线涉及酚与烯类化合物的反 应[3],其中包括: 第一类,酚与共轭二烯烃的反应,采用的催化剂或促进剂包括酚铝[4]、AuCl3/AgOTf[5]、AgOTf[6]、AgOTf/t-BuCl[7]、Sc(OTf)3/离子液体[8]、Cu(OTf)2/PPh3[9]、阳离子交换树脂Amberlyst 15[10]等; 第二类,酚与烯丙醇或烯丙醇酯的反应,使用CpMoCl- (CO)3[11]、(acac)2Mo(SbF6)2[12]、BF3•Et2O[13]、I2[14]、In(OTf)3[15]等作为催化剂. 尽管如此,在这些体系中或使用了贵金属催化剂,或催化剂用量较大,或需要与特定的配体或溶剂结合使用才能显示效果,因此多数反应的条件仍显苛刻. 2004年,Dintzner等[16]报道了蒙脱土K10促进的酚与异戊烯基溴的反应,有效地合成了苯并吡喃,虽然条件较为温和,但蒙脱土用量较大. 因此,继续寻找温和条件下高效合成苯并吡喃化合物的方法仍具有十分积极的意义. 在此,我们考察了经济易得的氯化锌(ZnCl2)作为Lewis酸催化酚与异戊烯基溴反应合成苯并吡喃化合物的反应活性,获得了较好的结果,为苯并吡喃化合物的合成提供了一种经济、高效、实用的途径.
1 结果与讨论
1.1 反应条件的探索
首先,用6 mol%的ZnCl2催化2-萘酚(1a)与异戊烯基溴(2)的模板反应. 反应在正己烷溶剂里,45 ℃的条件下进行24 h后,以96%的气相收率(表 1,Entry 1)得到了目标产物3,3-二甲基-2,3-二氢苯并色烯(3a). 在通过常规的核磁共振、质谱、红外等测试手段确认了产物结构之后,将ZnCl2的催化活性与另外几个经典路易斯酸进行了对照. 从表 1中可以看出,CuCl2、FeCl3、AlCl3的催化活性均不及ZnCl2,甚至带有强吸电阴离子的Al(OTf)3在同样反应条件下也只给出了53%的产物收率(表 1,Entries 2~5). 在此结果的基础上,随之对包括催化剂用量、反应浓度、温度及溶剂在内的反应条件进行了优化,发现当把催化剂的用量从6 mol%降低至1 mol%(表 1,Entries 6~8),反应时间从24 h缩短到3 h(表 1,Entries 1,6),反应温度从45 ℃降至室温(表 1,Entries 9,16)时,反应仍旧以高达96%的收率生成目标产物,表明ZnCl2的确对2-萘酚与异戊烯基溴的反应显示极高的催化能力. 在所筛选的溶剂中,低极性的正己烷和甲苯有利于反应的顺利进行,其中又以正己烷的表现最佳. 2-萘酚的反应浓度在0.1~0.5 mol/L之间时反应活性没有大的改变. 因为ZnCl2易于吸水,作为对照,将原本在氩气保护条件下的反应置于空气中进行,发现反应虽可顺利发生但产物收率有所下降(表 1,Entry 16). 因此最终确定了该反应的最优条件是: 催化剂ZnCl2的用量为1 mol%,溶剂为正己烷,2-萘酚的反应浓度为0.2 mol/L,室温,氩气中3 h.
 表 1
2-萘酚与异戊烯基溴反应条件的优化a
Table 1.
Condition screening for the reaction of 2-naphthol with prenyl bromide
表 1
2-萘酚与异戊烯基溴反应条件的优化a
Table 1.
Condition screening for the reaction of 2-naphthol with prenyl bromide

Entry Catalyst (mol%) Solvent Conc.b/ (mol•L-1) Temp./ ℃ Time/ h Yieldc/ % 1 ZnCl2 (6) n-Hexane 0.1 45 24 96 2 CuCl2 (6) n-Hexane 0.1 45 24 66 3 FeCl3 (6) n-Hexane 0.1 45 24 81 4 AlCl3 (6) n-Hexane 0.1 45 24 89 5 Al(OTf)3 (6) n-Hexane 0.1 45 24 53 6 ZnCl2 (6) n-Hexane 0.1 45 3 98 7 ZnCl2 (3) n-Hexane 0.1 45 3 96 8 ZnCl2 (1) n-Hexane 0.1 45 3 96 9 ZnCl2 (1) n-Hexane 0.2 45 3 96 10 ZnCl2 (1) n-Hexane 0.5 45 3 94 11 ZnCl2 (1) DCE 0.2 45 3 66 12 ZnCl2 (1) Toluene 0.2 45 3 92 13 ZnCl2 (1) THF 0.2 45 3 ND 14 ZnCl2 (1) CH3NO2 0.2 45 3 72 15 ZnCl2 (1) n-Hexane 0.2 65 3 90 16 ZnCl2 (1) n-Hexane 0.2 r.t. 3 96 (84)d a Reactions conditions: 2-naphthol (1 mmol) and prenyl bromide (1.5 mmol) in Ar atmosphere. b 2-Naphthol in solvent. cGC yield using n-tetradecane as an internal standard. d The reaction was carried out in the air. 表 1 2-萘酚与异戊烯基溴反应条件的优化a
Table 1. Condition screening for the reaction of 2-naphthol with prenyl bromide1.2 反应底物范围的探索
在上述最佳条件下,对一系列酚与异戊烯基溴的反应进行了考察. 从表 2中可以看到,在1 mol% ZnCl2催化下,所有的酚均顺利发生反应,以中等到高的收率生成相应的苯并吡喃目标产物. 电子效应对反应活性有明显影响: 芳环对位被拉电子基团取代的酚产物收率较低,反之被推电子基团取代的则收率较高(表 2,Entries 1~3,6,7). 当酚羟基对位被强给电子基团如甲氧基取代时,反应收率反而有所下降(表 2,Entry 9),薄层色谱(TLC)表明反应生成较多副产物,原因很可能源于被强活化的芳环所带来的副反应增多. 间叔丁基苯酚的反应只得到了唯一产物2,2-二甲基-7-叔丁基苯并吡喃,说明该催化体系中的反应具有较好的区域选择性(表 2,Entry 8). 有意思的是,通常会与路易斯酸发生络合从而使其丧失活性的酯基在此反应中可以很好地被容忍,顺利生成酯基取代的苯并吡喃化合物(表 2,Entry 4). 2-萘酚类底物的活性要远高于苯酚类底物,在同样反应条件下产物收率均可达到90%(表 2,Entries 10,11).
1.3 反应机理的探索
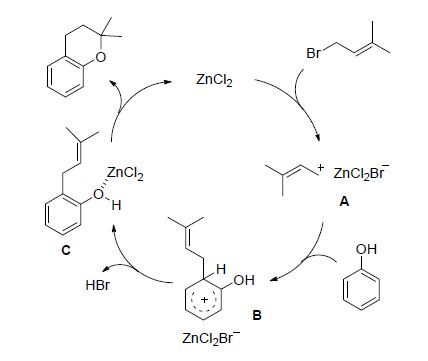
反应生成苯并吡喃的过程应该由一步傅克反应和一步氢烷氧化反应串联发生而成. 为了更深入地了解反应的实际过程,我们将2,6-二甲基苯酚(1k)与异戊烯基溴置于标准反应条件下(Eq. 1),3 h后终止反应. 体系经气相色谱-质谱联用仪检测,未见到化合物5的分子量,但经常规处理后柱层析分离得到61%收率的产物4. 很明显,产物4是1k与异戊烯基溴发生两次串联的傅克反应的结果. 这一实验结果证明,在ZnCl2催化条件下,酚与异戊烯基溴首先发生的是傅克反应. 基于此结论 ,我们提出如下反应机理(图 1): ZnCl2首先活化异戊烯基溴生成复合物A,A与酚发生傅克烷基化反应,生成s络合物B. B释放出一分子HBr后生成中间体C,ZnCl2再度活化酚羟基,继而引发分子内氢烷氧化反应,生成苯并吡喃产物的同时再生出ZnCl2.
由反应机理可见,反应过程中会释放当量的HBr. 为了验证反应的催化活性中心究竟是ZnCl2还是原位生成的HBr,我们仍以2-萘酚与异戊烯基溴的模板反应作为参照,在反应初期的体系里加入1 equiv.的碳酸钾,反应仍然顺利地生成了目标产物,证明该反应的确是由ZnCl2催化完成的.
 表 2 ZnCl2催化酚与异戊烯基溴的反应a
表 2 ZnCl2催化酚与异戊烯基溴的反应a
Table 2. ZnCl2 catalyzed reaction of phenols with prenyl bromide2 结论
该反应使用经典Lewis 酸ZnCl2催化酚与异戊烯基溴的傅克/氢烷氧化串联反应,高效地合成了一系列苯并吡喃化合物. 反应所用催化剂简单易得且用量较少,条件温和,为苯并吡喃化合物的合成提供了一个经济、实用、高效的途径.
3 实验部分
3.1 仪器与试剂
核磁测试用Bruker公司400 MHz核磁共振仪,氘代氯仿为溶剂,TMS为内标; 熔点测定采用XT-4型双目显微熔点测定仪; HRMS在Micromass GCT-TOF质谱仪上测定; 红外光谱在Magna-500红外光谱仪上测定. 溶剂均根据溶剂手册进行干燥处理之后蒸馏备用,异戊烯基溴经过分子筛干燥24 h之后蒸馏备用,酚均经油泵减压24 h后充氩气保存备用.
3.2 实验方法
所有的反应都在氩气保护条件下进行. 向反应瓶中依次加入1 mmol酚、1 mol%的ZnCl2和2.5 mL正己烷,待酚溶解后,向反应瓶中缓慢滴加2.5 mL溶有1.5 mmol异戊烯基溴的正己烷溶液,10 min内滴加完. 常温搅拌反应3 h后,将混合物转入分液漏斗中,加入10 mL水,充分振荡,分出有机层,水层用乙酸乙酯萃取3次,每次10 mL. 合并所有有机层,用无水硫酸钠干燥后旋干溶剂,进行柱层析分离(硅胶柱300~400目,洗脱剂为石油醚),得到苯并吡喃目标化合物.
2,2-二甲基-6-溴苯并吡喃(3b): 194 mg,黄色液体,收率81%. 1H NMR (400 MHz,CDCl3) δ: 7.11~7.07 (m,2H),6.58 (d,J=8.0 Hz,1H),2.67 (t,J=6.8 Hz,2H),1.70 (t,J=6.8 Hz,2H),1.24 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 153.3,132.0,130.2,123.2,119.2,111.7,74.6,32.5,26.9,22.5; IR ν: 2975,2930,1475,1410,1292,1259,1241,885,869 cm-1; HRMS (CI) calcd for C11H14BrO ([M+H]+) 241.0223,found 241.0225.
2,2-二甲基-6-氯苯并吡喃(3c)[11]: 147 mg,黄色液体,收率75%. 1H NMR (400 MHz,CDCl3) δ: 6.96~6.93 (m,2H),6.63~6.61 (m,1H),2.66 (t,J=6.8 Hz,2H),1.70 (t,J=6.8 Hz,2H),1.24 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 152.8,129.1,127.3,124.3,122.6,118.7,74.6,32.5,26.9,22.5; HRMS (CI) calcd for C11H14ClO ([M+ H]+) 197.0728,found 197.0731.
2,2-二甲基-6-氟苯并吡喃(3d): 126 mg,黄色液体,收率70%. 1H NMR (400 MHz,CDCl3) δ: 6.80~6.74 (m,2H),6.69 (dd,J=8.8,5.2 Hz,1H),2.75 (t,J=6.8 Hz,2H),1.78 (t,J=6.8 Hz,2H),1.31 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 156.5 (d,J=235.6 Hz),150.0 (d,J=1.9 Hz),122.1 (d,J=7.2 Hz),118.1 (d,J=8.0 Hz),115.2 (d,J=22.2 Hz),114.1 (d,J=22.8 Hz),74.3 ,32.6 ,26.8 ,22.8 (d,J=1.2 Hz); IR ν: 2980,2932,1490,1433,1302,1238,893,862 cm-1; HRMS (CI) calcd for C11H14FO ([M+H]+) 181.1023,found 181.1031.
2,2-二甲基苯并吡喃-6-羧酸乙酯(3e)[17]: 133 mg,白色固体,收率57%. m.p. 50~51 ℃; 1H NMR (400 MHz,CDCl3) δ: 7.71~7.69 (m,2H),6.70 (d,J=8.4 Hz,1H),4.25 (q,J=7.2 Hz,2H),2.73 (t,J=6.8 Hz,2H),1.74 (t,J=6.8 Hz,2H),1.29 (t,J=7.2 Hz,3H),1.26 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 166.8,158.3,131.7,129.2,121.9,120.7,117.2,75.4,60.6,32.6,27.0,22.4,14.5.
2,2-二甲基-6-苯基苯并吡喃(3f): 157 mg,白色固体,收率66%. m.p. 96~97 ℃; 1H NMR (400 MHz,CDCl3) δ: 7.55~7.52 (m,2H),7.41~7.37 (m,2H),7.33 (dd,J=8.4,2.4,1H),7.30~7.25 (m,2H),6.85 (d,J=8.4 Hz,1H),2.84 (t,J=6.8 Hz,2H),1.84 (t,J=6.8 Hz,2H),1.36 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 153.8,141.3,132.9,128.8,128.2,126.8,126.6,126.2,121.2,117.7,74.6,33.0,27.1,22.8; IR ν: 2985,2953,1478,1411,1365,1346,1332,879,858 cm-1; HRMS (ESI) calcd for C17H19O ([M+H]+) 239.1430,found 239.1422.
2,2,6-三甲基苯并吡喃(3g)[6]: 144 mg,无色液体,收率82%. 1H NMR (400 MHz,CDCl3) δ: 6.82~6.79 (m,2H),6.60 (d,J=8.4 Hz,1H),2.65 (t,J=6.8 Hz,2H),2.17 (s,3H),1.70 (t,J=6.8 Hz,2H),1.24 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 151.8,129.9,128.8,128.0,120.7,117.1,74.0,33.0,27.0,22.6,20.6; HRMS (ESI) calcd for C12H17O ([M+H]+) 177.1274,found 177.1276.
2,2-二甲基-6-叔丁基苯并吡喃(3h)[17]: 175 mg,无色液体,收率80%. 1H NMR (400 MHz,CDCl3) δ: 7.11 (dd,J=8.4,2.4 Hz,1H),7.04 (d,J=2.4 Hz,1H),6.71 (d,J=8.4 Hz,1H),2.76 (t,J=6.8 Hz,2H),1.79 (t,J=6.8 Hz,2H),1.32 (s,6H),1.28 (s,9H); 13C NMR (101 MHz,CDCl3) δ: 151.8,142.3,126.2,124.4,120.0,116.7,74.1,34.1,33.1,31.8,27.1,22.9; HRMS (ESI) calcd for C15H23O ([M+H]+) 219.1743,found 219.1737.
2,2-二甲基-7-叔丁基苯并吡喃(3i): 155 mg,无色液体,收率71%. 1H NMR (400 MHz,CDCl3) δ: 6.99 (d,J=8.0 Hz,1H),6.86 (dd,J=8.0,2.0 Hz,1H),6.81 (d,J=2.0 Hz,1H),2.73 (t,J=6.8 Hz,2H),1.79 (t,J=6.8 Hz,2H),1.34 (s,6H),1.28 (s,9H); 13C NMR (101 MHz,CDCl3) δ: 153.6,150.9,129.1,117.9,117.0,114.3,74.2,34.6,33.1,31.5,27.1,22.2; IR ν: 2961,2921,2869,2849,1382,1368,1277,1236,1046,987,730 cm-1; HRMS (ESI) calcd for C15H23O ([M+H]+) 219.1743,found 219.1746.
2,2-二甲基-6-甲氧基苯并吡喃(3j)[17]: 133 mg,无色液体,收率69%. 1H NMR (400 MHz,CDCl3) δ: 6.72~6.65 (m,2H),6.61 (d,J=2.2 Hz,1H),3.74 (s,3H),2.75 (t,J=6.8 Hz,2H),1.78 (t,J=6.8 Hz,2H),1.31 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 153.0,148.1,121.6,117.9,114.1,113.5,73.9,55.9,32.9,26.9,23.0; HRMS (ESI) calcd for C12H17O2 ([M+H]+)193.1223,found 193.1242.
3,3-二甲基-2,3-二氢-1H-苯并[f]色烯(3a)[11]: 191 mg,白色固体,收率90%. m.p. 109~110 ℃; 1H NMR (400 MHz,CDCl3) δ: 7.81 (d,J=8.4 Hz,1H),7.74 (d,J=8.0 Hz,1H),7.60 (d,J=8.8 Hz,1H),7.49~7.45 (m,1H),7.33~7.29 (m,1H),7.02 (d,J=8.8 Hz,1H),3.01 (t,J=6.8 Hz,2H),1.94 (t,J=6.8 Hz,2H),1.37 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 151.5,133.2,128.8,128.5,127.8,126.3,123.1,122.0,119.9,112.5,74.1,32.8,26.7,19.4; HRMS (ESI) calcd for C15H17O ([M+H]+) 213.1274,found 213.1270.
3,3-二甲基-6-溴-2,3-二氢-1H-苯并[f]色烯(3k): 261 mg,白色固体,收率90%. m.p. 120~121 ℃; 1H NMR (400 MHz,CDCl3) δ: 7.89 (d,J=2.0 Hz,1H),7.68 (d,J=8.8 Hz,1H),7.54~7.50 (m,2H),7.03 (d,J=8.8 Hz,1H),3.00 (t,J=6.8 Hz,2H),1.95 (t,J=6.8 Hz,2H),1.38 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 151.7,131.7,130.3,129.9,129.3,126.9,123.8,121.0,116.6,112.7,74.2,32.5,26.6,19.3; IR ν: 3072,2976,2925,1496,1427,1265,1249,1236,880,866 cm-1; HRMS (CI) calcd for C15H16BrO ([M+H]+) 291.0379,found: 291.0383.
3,3,4,6-四甲基-2,3-二氢-1H-茚-5-酚(4): 116 mg,黄色液体,收率61%. 1H NMR (400 MHz,CDCl3) δ: 6.78 (s,1H),4.55 (s,1H),2.72 (t,J=7.2 Hz,2H),2.25 (s,3H),2.18 (s,3H),1.87 (t,J=7.3 Hz,2H),1.33 (s,6H); 13C NMR (101 MHz,CDCl3) δ: 151.0,148.2,135.0,123.9,121.2,119.5,45.6,43.7,29.3,27.7,16.3,11.5; HRMS (ESI) calcd for C13H17O ([M-H])+ 189.1279,found 189.1280.
辅助材料(Supporting Information) 化合物3a~3k,4的1H NMR和 13C NMR图谱. 这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Pistelli, L.; Noccioli, C.; Appendino, G.; Bianchi, F.; Sterner, O.; Ballero, M. Phytochemistry 2003, 64, 595. (b) Shen, H. C. Tetrahedron 2009, 65, 3931. (c) Morito, K.; Hirose, T.; Kinjo, J.; Hirakawa, T.; Okawa, M.; Nohara, T.; Ogawa, S.; Inoue, S.; Muramatsu, M.; Masamune, Y. Biol. Pharm. Bull. 2001, 24, 351. (d) Grisar, J. M.; Petty, M. A.; Bolkenius, F. N.; Dow, J.; Wagner, J.; Wagner, E. R.; Haegele, K. D.; De Jong, W. J. Med. Chem. 1991, 34, 257. (e) Lambert, D. M.; Fowler, C. J. J. Med. Chem. 2005, 48, 5059.
-
[2]
Butsugan, Y.; Tsukamoto, H.; Morito, N.; Bito, T. Chem. Lett. 1976, 523. (b) Cichewicz, R. H.; Kenyon, V. A.; Whitman, S.; Morales, N. M.; Arguello, J. F.; Holman, T. R.; Crews, P. J. Am. Chem. Soc. 2004, 126, 14910. (c) Pelly, S. C.; Govender, S.; Fernandes, M. A.; Schmalz, H. G.; Koning, C. B. J. Org. Chem. 2007, 72, 2857. (d) Ren, W. Y.; Qiao, Z. H.; Wang, H. W.; Zhu, L.; Zhang, L. Med. Res. Rev. 2003, 23, 519. (e) Schneider, C. Mol. Nutr. Food Res. 2005, 49, 7.
-
[3]
For selected examples:(a) Kalena, G. P.; Jain, A.; Banerji, A. Molecules 1997, 2, 100. (b) Lee, J. H.; Bang, H. B.; Han, S. Y.; Jun, J. G. Bull. Korean Chem. Soc. 2006, 27, 2104. (c) Ishino, Y.; Mihara, M.; Hayakawa, N.; Miyata, T.; Kaneko, Y.; Miyata, T. Synth. Commun. 2001, 31, 439. (d) Bolzoni, V. L.; Casiraghi, G. Casnati, G.; Sartori, G. Angew. Chem. 1978, 90, 727. (e) Chiba, K.; Hirano, T.; Kitano, Y.; Tada, M. Chem. Commun. 1999, 691. (f) Murthy, Y. L. N.; Suhasini, K. P.; Jha, A. J. Serb. Chem. Soc. 2012, 77, 859. (g) Wang, Q.; She, X.; Ren, X.; Ma, J.; Pan, X. Tetrahedron:Asymmetry 2004, 15, 29. (h) Harel, D.; Khalid, S. A.; Kaiser, M.; Brun, R.; Wünsch, B.; Schmidt, T. J. J. Ethnopharmacol. 2011, 137, 620.
-
[4]
Dewhirst, K. C.; Rust, F. F. J. Org. Chem. 1963, 28, 798. doi: 10.1021/jo01038a051
-
[5]
Nguyen, R. V.; Yao, X.; Li, C. J. Org. Lett. 2006, 8, 2397. doi: 10.1021/ol0607692
-
[6]
Youn, S. W.; Eom, J. I. J. Org. Chem. 2006, 71, 6705. doi: 10.1021/jo061221b
-
[7]
Dang, T. T.; Boeck, F.; Hintermann, L. J. Org. Chem. 2011, 76, 9353. doi: 10.1021/jo201631x
-
[8]
Youn, S. W. Synlett 2007, 3050.
-
[9]
Adrio, L. A.; Hii, K. K. Chem. Commun. 2008, 2325.
-
[10]
Pongcharoen, W.; Rukachaisirikul, V.; Phongpaichit, S.; Sakayoraj, J. Chem. Pharm. Bull. 2007, 55, 1404. doi: 10.1248/cpb.55.1404
-
[11]
Yamamoto, Y.; Itonaga, K. Org. Lett. 2009, 11, 717.
-
[12]
Malkov, A. V.; Spoor, P. Vinader, V.; Kocǒvský, P. J. Org. Chem. 1999, 64, 5308. doi: 10.1021/jo990372u
-
[13]
Madabhushi, S.; Jillella, R.; Godala, K. R.; Mallu, K. K. R.; Beeram, C. R.; Chinthala, N. Tetrahedron Lett. 2012, 53, 5275. doi: 10.1016/j.tetlet.2012.07.077
-
[14]
Naik, M. M. Kamat, D. P.; Tilve, S. G.; Kamat, V. P. Tetrahedron 2014, 70, 5221. doi: 10.1016/j.tet.2014.05.093
-
[15]
Vece, V. Ricci, J. Poulain-Martini, S.; Nava, P.; Carissan, Y.; Humbel, S.; Duñach, E. Eur. J. Org. Chem. 2010, 6239.
-
[16]
Dintzner, M. R.; McClelland, K. M.; Morse, K. M.; Akroush, M. H. Synlett 2004, 2028.
-
[17]
Ollevier, T.; Topwe M.; Mwene-Mbeja, T. P. Synthesis 2006, 3963.
-
[1]
-
表 1 2-萘酚与异戊烯基溴反应条件的优化a
Table 1. Condition screening for the reaction of 2-naphthol with prenyl bromide

Entry Catalyst (mol%) Solvent Conc.b/ (mol•L-1) Temp./ ℃ Time/ h Yieldc/ % 1 ZnCl2 (6) n-Hexane 0.1 45 24 96 2 CuCl2 (6) n-Hexane 0.1 45 24 66 3 FeCl3 (6) n-Hexane 0.1 45 24 81 4 AlCl3 (6) n-Hexane 0.1 45 24 89 5 Al(OTf)3 (6) n-Hexane 0.1 45 24 53 6 ZnCl2 (6) n-Hexane 0.1 45 3 98 7 ZnCl2 (3) n-Hexane 0.1 45 3 96 8 ZnCl2 (1) n-Hexane 0.1 45 3 96 9 ZnCl2 (1) n-Hexane 0.2 45 3 96 10 ZnCl2 (1) n-Hexane 0.5 45 3 94 11 ZnCl2 (1) DCE 0.2 45 3 66 12 ZnCl2 (1) Toluene 0.2 45 3 92 13 ZnCl2 (1) THF 0.2 45 3 ND 14 ZnCl2 (1) CH3NO2 0.2 45 3 72 15 ZnCl2 (1) n-Hexane 0.2 65 3 90 16 ZnCl2 (1) n-Hexane 0.2 r.t. 3 96 (84)d a Reactions conditions: 2-naphthol (1 mmol) and prenyl bromide (1.5 mmol) in Ar atmosphere. b 2-Naphthol in solvent. cGC yield using n-tetradecane as an internal standard. d The reaction was carried out in the air. 表 2 ZnCl2催化酚与异戊烯基溴的反应a
Table 2. ZnCl2 catalyzed reaction of phenols with prenyl bromide

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 1776
- HTML全文浏览量: 377


 下载:
下载:
 下载:
下载:

