
Citation: Chen Cui, Xu Songsen, Liu Weibing. Selective Reduction of β-Keto Amides to α,β-Unsaturated Olefinic Amides and β-Hydroxy Amides by Using Sodium Borohydride as the Reductant[J]. Chinese Journal of Organic Chemistry, 2016, 36(8): 1890-1894. doi: 10.6023/cjoc201603020

硼氢化钠选择性还原乙酰乙酰苯胺至不饱和烯胺和β-羟基酰胺
-
关键词:
- 乙酰乙酰苯胺
- / α,β-不饱和烯酰胺类衍生物
- / 羰基还原
- / 硼氢化钠
English
Selective Reduction of β-Keto Amides to α,β-Unsaturated Olefinic Amides and β-Hydroxy Amides by Using Sodium Borohydride as the Reductant
-
Key words:
- β-keto amides
- / α,β-unsaturated olefinic amides
- / reduction of carbonyl
- / NaBH4
-
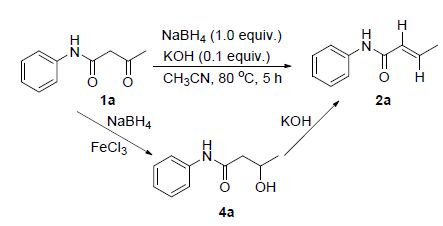
近年来,化学家对β-酮酰胺类化合物产生了浓厚的兴趣,这主要是由于这类化合物具有多个可参与反应的活性位点,它们为一些有机中间体、复杂有机化合物、天然产物和药物的合成指明了一个新的方向[1~5]. 尤其是在利用该类化合物来构建氮、氧杂环化合物这一领域,科学家已高度关注[6~9]. 到目前为止,本课题组已经对β-酮酰胺类化合物作了大量的研究工作[10~13]. 本文以乙酰乙酰苯胺类化合物为原料,在硼氢化钠与碱或三氯化铁存在的条件下,乙酰乙酰苯胺类化合物被还原之后所得到的产物分别为α,β-不饱和烯酰胺和3-羟基-N-苯基丁酰胺衍生物. α,β-不饱和烯酰胺和3-羟基-N-苯基丁酰胺衍生物是两类非常有用的有机原料,化学家利用它们通过氧化,成环等手段就可以构建出很多具有潜在生物活性的氮、氧杂环化合物.
1 结果与讨论
1.1 反应条件的优化
最初,以乙酰乙酰苯胺(1a)的反应为模版反应,利用硼氢化钠为还原剂,探索了反应时间、温度与溶剂以及碱对该反应的影响,实验结果见表 1. 在以1,4-二氧六环为溶剂和100 ℃的条件下,首先探索了反应时间对该反应体系的影响,经研究发现,该反应的最佳反应时间为5 h,能以68%的气相色谱(GC)收率得到α,β-不饱和烯酰胺2a (Entries 3~6). 而当反应温度降低到80 ℃时候,该反应反应5 h同样能以68%的GC收率得到2a,但是如果温度继续降到室温的时候,该反应基本不发生(Entries 4~5). 接下来考察了溶剂对该反应的影响(Entries 6~9),从实验结果可以发现,该反应体系对溶剂比较敏感,总的来说,非极性溶剂不利于此反应的发生,而极性溶剂有利于促进此反应的发生. 在筛选的溶剂中,乙腈为最佳溶剂,能以79%的GC收率得到目标化合物. 最后,考虑到碱可能有利于此反应的发生,因此,在该反应体系尝试加了0.1 equiv. KOH,实验结果证实该体系碱对该体系的影响非常大,加碱之后,能以93%的GC收率得到目标化合物.

Entry 溶剂 反应温度/℃ 反应时间/h 产率b/% 1 Dioxane 100 3 52 2 Dioxane 100 5 68 3 Dioxane 100 7 68 4 Dioxane 80 5 68 5 Dioxane r.t. 5 Trace 6 DMF 80 5 67 7 Cyclohexane 80 5 None 8 CH3CN 80 5 79 9 MeOH reflux 5 72 10[c] CH3CN 80 5 93 a Unless otherwise specified,all the reactions were carried out on 1a 0.25 mmol scale; b GC yield; c KOH: 0.1 equiv. 表 1 反应条件的优化a
Table 1. Optimization of reaction conditions1.2 底物的拓展
在上述优化反应条件下,对该反应体系的底物普适性进行了考察,如表 2所示. 由表 2可知,该反应体系对乙酰乙酰苯胺类化合物苯环上的取代基的电性,取代基的位置以及苯环上带有多少个取代基不是很敏感,所有这些被考察的底物都能以极好的分离收率得到相应的目标化合物. 例如: 乙酰乙酰苯胺是苯环上不带任何取代基的底物,该化合物能以89%的分离收率得到目标化合物2a. 通过相应的文献报道[14~18]和谱图所算出的烯碳上两个氢的偶合常数(J=15.2 Hz)[19~20],可以确定2a的结构为的(E)-N-苯基-2-丁烯酰胺. 苯环上不管是带有给电子基团的(如甲基、甲氧基、乙氧基),还是带有吸电子基团的(如氯),以及带有多个取代基的(如2,4-二甲氧基、2,4-二甲基、2,5-二甲氧基-4-氯)底物,都能以极好的收率得到对应的目标化合物.

Entry R 2 Yieldb/% 1 H 2a 89 2 o-Methyl 2b 82 3 p-Methyl 2c 84 4 2,4-Dimethyl 2d 88 5 o-Chloro 2e 85 6 p-Chloro 2f 87 7 o-Methoxy 2g 79 8 p-Methoxy 2h 84 9 p-Ethoxy 2i 82 10 2,4-Dimethoxy 2j 81 11 2,5-Dimethoxy-4-chloro 2k 86 12 Ethyl 3-oxo-3-phenylpropanoate 2l 83 a All the reactions are carried out using 1 (1.0 mmol),NaBH4 (1.0 mmol),KOH (0.1 mmol) in acetonitrile (2.0 mL) at 80 ℃ for 5 h; b Isolated yield. 表 2 底物拓展a
Table 2. Scope of the substrates为了控制该反应停留在还原阶段,以得到我们所期待得到的单一的还原产物,我们尝试在体系中加入路易斯酸. 通过尝试,我们发现,在反应体系中加入氯化锌、氧化锌、氯化铜、氯化铁都能导致羰基还原产物的出现,但是在这些被筛选的路易斯酸中,氯化铁的效果最佳,基本能以定量的收率得到对应的还原产物(表 3). 接下来,在此条件下,对该反应体系的底物普适性进行了考察,经研究发现,在此反应条件下,所有的被考察的底物都能应用于此反应体系,此反应体系对乙酰乙酰苯胺类化合物苯环上是否带有取代基,以及取代基的电性和取代基的位置都不是很敏感,所有这些被考察的底物基本都能以定量的收率得到相应的目标化合物.

Entry R 4 Yieldb/% 1 H 4a 94 2 2,4-Dimethoxy 4b 93 3 2,5-Dimethoxy-4-chloro 4c 95 4 2-Methyl 4d 92 5 4-Methyl 4e 90 6 4-Methoxy 4f 92 7 2,4-Dimethyl 4g 91 8 2,5-Dichloro 4h 93 9 2-Methyl-5-chloro 4i 95 10 2-Methoxy 4j 94 a All the reactions are carried out using 3 (1.0 mmol),NaBH4 (1.0 mmol),FeCl3 (0.1 mmol) in acetonitrile (2.0 mL) at 80 ℃ for 5 hour; b Isolated yield. 表 3 底物拓展a
Table 3. Scope of the substrates1.3 可能的催化反应机理
为了研究反应的机理,以4a为原料,在80 ℃和KOH存在的条件下,该反应基本能以定量的收率得到产物2a. 结合该实验结果和已有的文献报道,对该反应提出了如Scheme 1所示的可能机理. 以2a和4a的形成为反应模型对此机理进行阐述. 首先,在以硼氢化钠为还原剂和氯化铁为催化剂的条件下,乙酰乙酰苯胺的单羰基被还原为羟基,得到产物4a[16,17]. 另外,在碱性条件下,产物4a进一步脱水得到产物2a[18, 21].
2 结论
本文以乙酰乙酰苯胺类化合物为原料,报道了一种简便地构建α,β-不饱和烯酰胺和3-羟基-N-苯基丁酰胺衍生物的方法. 该反应经历两个连续的反应过程: 首先是硼氢化钠对羰基的还原; 其次是在碱性条件下,进一步脱水制得(E)-N-苯基-2-丁烯酰胺衍生物. 本方法利用乙酰乙酰苯胺类化合物为原料,通过官能团转换,构建出了两类有用的化工中间体,这些中间体在构建具有潜在生物活性的氮、氧杂环化合物方面具有广阔的应用空间.
3 实验部分
3.1 仪器与试剂
熔点采用RD-II型显微熔点仪测定; 核磁共振谱用Agilent400-MR型核磁共振仪(美国Agilent公司)测定,氘代氯仿作溶剂,TMS作内标; 质谱用Agilent1100型气质联用仪(美国Agilent公司) (GC/MSD VL ESI)测定; 高分辨质谱则由MicroTOF质谱仪测得; 紫外-可见吸收光谱用WFH-204B型手提式紫外分析仪测定; TLC用板为GF254(青岛海洋化工有限公司)高效薄层层析硅胶板. 实验所用试剂均购买于Aldrich Chemicals或J & K Scientific Ltd.
3.2 (E)-N-苯基-2-丁烯酰胺衍生物的合成
在10 mL的刻度试管中加入1.0 mmol乙酰乙酰苯胺类化合物1、1.0 mmol硼氢化钠(NaBH4)、0.1 mmol氢氧化钾(KOH),乙腈2.0 mL,在80 ℃的条件下搅拌反应5 h. 反应结束后,将反应体系冷却至室温,将所得反应液经过制备性薄层板纯化得到产物2. 得到的产品用熔点、1H NMR、13C NMR和高分辨质谱进行表征.
(E)-N-苯基-2-丁烯酰胺(2a)[22]: 无色晶体. m.p. 99~100 ℃; 1H NMR (CDCl3,400 MHz) δ: 7.67 (s,1H),7.45 (d,J=8.0 Hz,2H),7.27 (t,J=8.0 Hz,2H),7.06 (t,J=7.6 Hz,1H),6.99~6.90 (m,1H),5.54 (d,J=15.2 Hz,1H),1.84 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 164.3,141.5,138.1,128.9,125.5,124.3,120.1,17.8.
(E)-N-邻甲基苯基-2-丁烯酰胺(2b)[23]: 无色晶体. m.p. 134.3~136 ℃; 1H NMR (CDCl3,400 MHz) δ: 7.81 (s,1H),7.18 (d,J=8.0 Hz,1H),7.16 (d,J=8.0 Hz,1H),7.08~7.04 (m,2H),6.98~6.93 (m,1H),5.96 (d,J=14.8 Hz,1H),2.23 (s,3H),1.87 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 167.4,141.8,137.9,135.6,130.4,129.2,129.0,126.7,125.2,17.8,17.7.
(E)-N-对甲基苯基-2-丁烯酰胺(2c)[24]: 无色晶体. m.p. 127~129 ℃; 1H NMR (CDCl3,400 MHz) δ: 7.41 (d,J=7.6 Hz,2H),7.13 (d,J=8.0 Hz,2H),7.09 (d,J=8.0 Hz,2H),6.99~6.90 (m,1H),5.91 (d,J=15.2 Hz,1H),2.29 (s,3H),1.87 (d,J=8.0 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 165.9,142.4,141.2,135.4,131.3,129.4,125.7,119.9,20.8,17.8.
(E)-N-(2,4-二甲基苯基)-2-丁烯酰胺(2d)[25]: 无色晶体. m.p. 134.9~136.7 ℃; 1H NMR (CDCl3,400 MHz) δ: 7.49 (s,1H),7.20 (s,1H),6.93 (br,3H),5.96 (d,J=15.2 Hz,1H),2.24 (s,3H),2.14 (s,3H),1.81 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 164.3,140.6,134.9,133.1,131.0,130.2,127.0,125.5,124.0,20.8,17.7.
(E)-N-邻氯苯基-2-丁烯酰胺(2e)[26]: 无色晶体. m.p. 103~105 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.35 (d,J=8.4 Hz,1H),7.57 (s,1H),7.27 (d,J=8.0 Hz,1H),7.17 (T,J=8.0 Hz,1H),6.96~6.87 (m,2H),5.93 (d,J=15.2 Hz,1H),2.23 (s,3H),1.83 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 163.8,142.1,134.7,128.9,127.7,125.3,124.5,122.7,121.7,17.8.
(E)-N-对氯苯基-2-丁烯酰胺(2f)[27]: 无色晶体. m.p. 130~132 ℃; 1H NMR (CDCl3,400 MHz) δ: 7.43 (d,J=8.4 Hz,2H),7.23 (s,1H),7.20 (d,J=8.8 Hz,2H),6.96~6.87 (m,1H),5.86 (d,J=15.2 Hz,1H),1.83 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 164.0,142.1,136.5,133.2,129.1,129.0,125.0,121.2,118.4,17.8.
(E)-N-邻甲氧基苯基-2-丁烯酰胺(2g)[28]: 无色晶体. m.p. 127~129 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.42 (d,J=7.2 Hz,2H),7.74 (s,1H),7.01~6.91 (m,3H),6.84 (d,J=8.0 Hz,1H),5.97 (d,J=15.2 Hz,1H),3.85 (s,3H),1.88 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 163.7,147.6,140.9,127.8,125.8,123.5,121.1,119.9,109.8,55.6,17.7
(E)-N-对甲氧基苯基-2-丁烯酰胺(2h)[28]: 无色晶体. m.p. 118~120 ℃; 1H NMR (CDCl3,400 Hz) δ: 7.76 (s,1H),7.43 (d,J=8.4 Hz,2H),6.93~6.86 (m,1H),6.79 (d,J=8.8 Hz,2H),5.93 (d,J=15.2 Hz,1H),3.74 (s,3H),1.82 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 Hz) δ: 164.2,156.3,140.8,131.2,125.5,121.9,114.0,55.4,17.7.
(E)-N-对乙氧基苯基-2-丁烯酰胺(2i): 无色晶体. m.p. 132.4~133.7 ℃; 1H NMR (CDCl3,400 MHz) δ: 7.42 (d,J=8.0 Hz,2H),7.27 (s,1H),6.95~6.89 (m,1H),6.81 (d,J=8.0 Hz,2H),5.91 (d,J=15.2 Hz,1H),3.98 (q,J=7.6 Hz,3H),1.86 (d,J=7.6 Hz,3H),1.37 (t,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 166.8,162.8,154.7,139.9,130.0,124.4,120.7,113.7,62.7,16.7,13.8; HRMS (ESI) calcd for C12H15NNaO2 [M+Na]+ 228.0995,found 228.0978.
(E)-N-(2,4-二甲氧基苯基)-2-丁烯酰胺(2j): 无色晶体. m.p. 121.5~122.2 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.29 (d,J=9.2 Hz,1H),7.53 (s,1H),6.90 (m,1H),6.45 (m,2H),5.94 (d,J=15.2 Hz,1H),3.81 (s,3H),3.76 (s,3H),1.86 (d,J=7.6 Hz,3H);13C NMR (CDCl3,100 MHz) δ: 163.4,156.3,149.2,140.4,125.8,121.4,120.7,103.8,98.5,55.7,55.5,17.7; HRMS (ESI) calcd for C12H15NNaO3 [M+Na]+ 244.0944,found 244.0952.
(E)-N-(4-氯-2,5-二甲氧基苯基)-2-丁烯酰胺(2k): 无色粉末. m.p. 131.7~132.7 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.30 (s,1H),7.69 (s,1H),6.90 (m,1H),6.83 (s,1H),5.95 (d,J=15.2 Hz,1H),3.84 (s,3H),3.79 (s,3H),1.87 (d,J=7.6 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 163.8,149.1,141.9,141.6,127.2,125.5,115.5,112.1,105.0,56.6,56.3,17.8; HRMS (ESI) calcd for C12H14ClNNaO3 [M+Na]+ 278.0554,found 278.0561.
(E)-肉桂酸乙酯(2l)[29]: 浅灰色油状物. 1H NMR (CDCl3,400 MHz) δ: 7.65 (d,J=16.0 Hz,1H),7.50 (d,J=7.2 Hz,2H),7.36 (m,3H),6.42 (d,J=16.0 Hz,1H),4.25 (q,J=7.2 Hz,2H),1.32 (t,J=7.2 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 167.0,144.5,134.5,130.2,128.8,128.0,118.3,60.4,14.3.
3-羟基-N-苯基丁酰胺(2m)[30]: 无色晶体. m.p. 113.5~114.9 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.12 (s,1H),7.50 (d,J=8.0 Hz,2H),7.30 (t,J=8.4 Hz,2H),7.12 (t,J=7.6 Hz,2H),4.28 (m,1H),3.54 (s,1H),2.49 (m,2H),1.27 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.6,137.6,129.0,124.4,120.1,64.9,45.1,23.0.
3-羟基-N-(2,4-二甲氧基苯基)丁酰胺(2n): 无色晶体. m.p. 107.8~108.4 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.11 (d,J=8.4 Hz,1H),8.05 (s,1H),6.43 (s,1H),6.40 (d,J=8.4 Hz,1H),4.24 (m,1H),3.93 (s,1H),3.79 (s,3H),3.75 (s,3H),2.48 (m,2H),1.24 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.2,156.6,149.6,121.2,120.7,103.7,98.6,64.8,55.6,55.4,45.2,22.8; HRMS (ESI) calcd for C12H17NNaO4 [M+Na]+ 262.1050,found 262.1039.
3.3 3-羟基-N-苯基丁酰胺衍生物的合成
在10 mL的刻度试管中加入1.0 mmol乙酰乙酰苯胺类化合物3、1.0 mmol硼氢化钠(NaBH4)、0.1 mmol三氯化铁(FeCl3),乙腈2.0 mL,在80 ℃的条件下搅拌反应5 h. 反应结束后,将反应体系冷却至室温,将所得反应液经过制备性薄层板纯化得到产物4. 得到的产品用熔点、1H NMR、13C NMR和高分辨质谱进行表征.
N-(4-氯-2,5-二甲氧基苯基)-3-羟基丁酰胺(4a): 无色晶体. m.p. 122.6~124.4 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.11 (s,1H),8.19 (s,1H),6.86 (s,1H),4.31~4.27 (m,1H),3.86 (s,3H),3.81 (s,3H),3.40 (s,1H),2.54~2.51 (m,2H),1.27 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.4,149.0,141.9,126.7,115.8,112.3,105.1,64.8,56.7,56.4,45.6,22.9; HRMS (ESI) calcd for C12H16ClNNaO4 [M+Na]+ 296.0660,found 296.0645.
3-羟基-N-邻甲基苯基丁酰胺(4b)[31]: 无色晶体. m.p. 84.2~85.6 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.15 (s,1H),7.74 (d,J=8.0 Hz,2H),7.19~7.16 (m,2H),7.06 (t,J=8.0 Hz,1H),4.24~4.21 (m,1H),3.68 (s,1H),2.51~2.47 (m,2H),2.22 (s,3H),1.26 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.7,135.5,130.4,129.5,126.6,125.3,123.3,64.9,44.9,23.1,17.8.
3-羟基-N-对甲基苯基丁酰胺(4c)[32]: 无色晶体. m.p. 87.1~88.5 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.19 (s,1H),7.50 (d,J=8.4 Hz,2H),7.30 (d,J=8.4 Hz,2H),4.30~4.28 (m,1H),3.45 (s,1H),2.50~2.46 (m,2H),2.06 (s,3H),1.27 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.5,137.7,131.8,129.1,120.0,64.9,45.2,23.0,21.0.
3-羟基-N-对甲氧基苯基丁酰胺(4e)[28]: 无色晶体. m.p. 134.7~136.0 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.75 (s,1H),7.39 (d,J=8.8 Hz,2H),6.86 (d,J=8.8 Hz,2H),4.30~4.26 (m,1H),3.79 (s,1H),3.46 (s,1H),2.50~2.46 (m,2H),1.28 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.3,156.5,130.5,122.0,114.1,64.9,55.4,44.9,22.9.
3-羟基-N-(2,4-二甲基苯基)丁酰胺(4f): 无色晶体. m.p. 99.6~101.2.0 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.09 (s,1H),7.83 (d,J=8.0 Hz,1H),7.19 (d,J=8.0 Hz,1H),7.17 (s,1H),4.30~4.26 (m,1H),3.40 (s,1H),2.51~2.47 (m,2H),2.24 (s,3H),2.08 (s,2H),1.28 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.5,135.7,132.4,130.5,129.1,126.8,122.9,64.9,45.0,23.1,21.0,17.8; HRMS (ESI) calcd for C12H17NNaO2 [M+Na]+ 230.1151,found 230.1155.
N-(2,5-二氯苯基)-3-羟基丁酰胺(4g): 无色晶体. m.p. 96.9~97.7 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.59 (s,1H),8.47 (s,1H),7.28 (d,J=8.0 Hz,1H),7.01 (d,J=8.0 Hz,1H),4.34~4.31 (m,1H),3.05 (s,1H),2.57~2.54 (m,2H),1.32 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.4,135.4,133.4,129.6,124.5,121.6,120.8,64.8,45.9,23.2; HRMS (ESI) calcd for C10H11Cl2NNaO2 [M+Na]+ 270.0059,found 270.0066.
N-(4-氯-2-甲基苯基)-3-羟基丁酰胺(4h): 无色晶体. m.p. 89.8~91.4 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.08 (s,1H),7.76 (d,J=8.8 Hz,1H),7.15 (s,1H),7.14 (d,J=8.8 Hz,1H),4.31~4.27 (m,1H),3.29 (s,1H),2.55~2.51 (m,2H),2.20 (s,3H),1.30 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.4,134.2,130.9,130.2,130.0,126.6,124.1,65.0,45.0,23.2,17.7; HRMS (ESI) calcd for C11H14ClNNaO2 [M+Na]+ 250.0605,found 250.0622.
3-羟基-N-邻甲氧基苯基丁酰胺(4i): 无色晶体. m.p. 102.3~103.9 ℃; 1H NMR (CDCl3,400 MHz) δ: 8.29 (s,1H),7.27 (d,J=8.0 Hz,1H),7.01 (t,J=8.0 Hz,1H),7.14 (t,J=8.0 Hz,1H),6.85 (d,J=8.0 Hz,1H),4.29~4.25 (m,1H),3.91 (s,1H),3.83 (s,3H),2.52~2.48 (m,2H),1.25 (d,J=6.4 Hz,3H); 13C NMR (CDCl3,100 MHz) δ: 170.5,148.1,127.2,124.0,120.9,120.1,110.1,64.8,55.7,45.4,22.9; HRMS (ESI) calcd for C11H15NNaO3 [M+ Na]+ 232.0944,found 232.0938.
辅助材料(Supporting Information) 化合物原始核磁谱图. 这些材料可以免费从本刊网站(http://sioc-journal. cn/)上下载.
-
-
[1]
Clemens, R. J. Chem. Rev. 1986, 86, 241. doi: 10.1021/cr00072a001
-
[2]
Nishiwaki, N.; Nakaike, Y.; Ariga, M. J. Oleo Sci. 2008, 57, 53. doi: 10.5650/jos.57.53
-
[3]
Han, M.; Nam, K. D.; Hahn, H. G..; Shin, D. Tetrahedron Lett. 2008, 49, 5217. doi: 10.1016/j.tetlet.2008.05.132
-
[4]
Wang, Y.; Xin, X.; Liang, Y.; Lin, Y.; Duan, H.; Dong, D. Adv. Synth. Catal. 2009, 351, 2217. doi: 10.1002/adsc.v351:13
-
[5]
Tan, L. Q.; Zhou, P.; Chen, C.; Liu, W. B. Beilstein J. Org. Chem. 2013, 9, 2681. doi: 10.3762/bjoc.9.304
-
[6]
Wang, Z. K.; Bi, X. H.; Liao, P. Q.; Liu, X.; Dong, D. W. Chem. Commun. 2013, 49, 1309. doi: 10.1039/c2cc38473f
-
[7]
Hu, Y. Q.; Fu, X. L.; Barry, B. D.; Bi, X. H.; Dong, D. W. Chem. Commun. 2012, 48, 690. doi: 10.1039/C1CC15881C
-
[8]
Knapp, J. M.; Zhu, J. S.; Wood, A. B.; Kurth, M. J. ACS Comb. Sci. 2012, 14, 85. doi: 10.1021/co200199h
-
[9]
Zhang, Z. G..; Fang, S. L.; Liu, Q. F.; Zhang, G. S. J. Org. Chem. 2012, 77, 7665. doi: 10.1021/jo3010217
-
[10]
Liu, W. B.; Chen, C.; Zhang, Q.; Zhu, Z. B. Beilstein J. Org. Chem. 2011, 7, 1436. doi: 10.3762/bjoc.7.167
-
[11]
Liu, W. B.; Chen, C.; Zhang, Q.; Zhu, Z. B. Beilstein J. Org. Chem. 2012, 8, 344. doi: 10.3762/bjoc.8.38
-
[12]
Zhang, Q.; Liu, W. B.; Chen, C.; Tan, L. Q. Chin. J. Chem. 2013, 31, 453. doi: 10.1002/cjoc.201300007
-
[13]
Liu, W. B.; Zhou, P.; Chen, C.; Zhang, Q.; Zhu. Z. B. Org. Biomol. Chem. 2013, 11, 542.
-
[14]
Zhang, T. K.; Mo, D. L.; Dai, L. X.; Hou, X. L. Org. Lett. 2008, 10, 5337. doi: 10.1021/ol801946e
-
[15]
Bartoli, G..; Bellucci, M. C.; Petrini, M.; Marcantoni, E.; Sambri, L.; Torregiani, E. Org. Lett. 2000, 2, 1791.
-
[16]
Skoda, E. M.; Davis, G. C.; Wipf, P. Org. Process Res. Dev. 2012, 16, 26. doi: 10.1021/op2002613
-
[17]
Nishio, S.; Somete, T.; Sugie, A.; Kobayashi, T.; Yaita, T.; Mori, A. Org. Lett. 2012, 14, 2476.
-
[18]
Jang, Y. J.; Yan, M. C.; Lin, Y. F.; Yao, C. F. J. Org. Chem. 2004, 69, 3961. doi: 10.1021/jo049763l
-
[19]
Nishio, S.; Somete, T.; Sugie, A.; Kobayashi, T.; Yaita, T.; Mori, A. Org. Lett. 2012, 14, 2476.
-
[20]
Jang, Y. J.; Yan, M. C.; Lin, Y. F.; Yao, C. F. J. Org. Chem. 2004, 69, 3961. doi: 10.1021/jo049763l
-
[21]
Ma, Z. X.; Feltenberger, J. B.; Hsung, R. P. Org. Lett. 2012, 14, 2742. doi: 10.1021/ol300967a
-
[22]
Formentĺn, P.; Gimeno, N.; Steinke, I. H. G.; Vilar, R. J. Org. Chem. 2005, 70, 8235. doi: 10.1021/jo051120y
-
[23]
Eriksson, J.; Åberg, O.; Långström, B. Eur. J. Org. Chem. 2007, 455.
-
[24]
Xiong, T.; Li, Y.; Bi, H. X.; Lv, Y. H.; Zhang, Q. Angew. Chem., Int. Ed. 2011, 50, 7140. doi: 10.1002/anie.v50.31
-
[25]
Curran, D. P.; Liu, W. D.; Chen, C. H. T. J. Am. Chem. Soc. 1999, 121, 11012. doi: 10.1021/ja993329x
-
[26]
Merchant, J. R. Curr. Sci. 1979, 48, 13.
-
[27]
Couture, L.; Mathieu, J. P. Compt. Rend. 1948, 226, 1261.
-
[28]
Sandrock, D. L.; Jean-Gérard, L.; Chen, C. Y.; Dreher, S. D. L.; Molander G. A. J. Am. Chem. Soc. 2010, 132, 17108. doi: 10.1021/ja108949w
-
[29]
Faraji, L.; Jadidi, K.; Notash, B. Tetrahedron Lett. 2014, 55, 346.
-
[30]
Ryosuke, H.; Seijiro, M. Synthesis 2014, 46, 2272.
-
[31]
Yosuke, D.; Yuki, K.; Yoshihiro, M.; Osamu, O. Synlett 2008, 433.
-
[32]
Kawashima, E.; Takada, T.; Tabei, K. J. Heterocycl. Chem. 1985, 22, 1409. doi: 10.1002/jhet.v22:5
-
[1]
-
表 1 反应条件的优化a
Table 1. Optimization of reaction conditions

Entry 溶剂 反应温度/℃ 反应时间/h 产率b/% 1 Dioxane 100 3 52 2 Dioxane 100 5 68 3 Dioxane 100 7 68 4 Dioxane 80 5 68 5 Dioxane r.t. 5 Trace 6 DMF 80 5 67 7 Cyclohexane 80 5 None 8 CH3CN 80 5 79 9 MeOH reflux 5 72 10[c] CH3CN 80 5 93 a Unless otherwise specified,all the reactions were carried out on 1a 0.25 mmol scale; b GC yield; c KOH: 0.1 equiv. 表 2 底物拓展a
Table 2. Scope of the substrates

Entry R 2 Yieldb/% 1 H 2a 89 2 o-Methyl 2b 82 3 p-Methyl 2c 84 4 2,4-Dimethyl 2d 88 5 o-Chloro 2e 85 6 p-Chloro 2f 87 7 o-Methoxy 2g 79 8 p-Methoxy 2h 84 9 p-Ethoxy 2i 82 10 2,4-Dimethoxy 2j 81 11 2,5-Dimethoxy-4-chloro 2k 86 12 Ethyl 3-oxo-3-phenylpropanoate 2l 83 a All the reactions are carried out using 1 (1.0 mmol),NaBH4 (1.0 mmol),KOH (0.1 mmol) in acetonitrile (2.0 mL) at 80 ℃ for 5 h; b Isolated yield. 表 3 底物拓展a
Table 3. Scope of the substrates

Entry R 4 Yieldb/% 1 H 4a 94 2 2,4-Dimethoxy 4b 93 3 2,5-Dimethoxy-4-chloro 4c 95 4 2-Methyl 4d 92 5 4-Methyl 4e 90 6 4-Methoxy 4f 92 7 2,4-Dimethyl 4g 91 8 2,5-Dichloro 4h 93 9 2-Methyl-5-chloro 4i 95 10 2-Methoxy 4j 94 a All the reactions are carried out using 3 (1.0 mmol),NaBH4 (1.0 mmol),FeCl3 (0.1 mmol) in acetonitrile (2.0 mL) at 80 ℃ for 5 hour; b Isolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 1309
- HTML全文浏览量: 328


 下载:
下载:
 下载:
下载:

