 图 1
典型的具有AIE特征的分子体系结构示意图
Figure 1.
Chemical structures of typical AIE systems
图 1
典型的具有AIE特征的分子体系结构示意图
Figure 1.
Chemical structures of typical AIE systems

Citation: Pan Lingxiang, Luo Wenwen, Chen Ming, Liu Junkai, Xu Lu, Hu Rongrong, Zhao Zujin, Qin Anjun, Tang BenZhong. Tetraphenylpyrazine-Based Luminogens with Aggregation-Enhanced Emission Characteristics: Preparation and Property[J]. Chinese Journal of Organic Chemistry, 2016, 36(6): 1316-1324. doi: 10.6023/cjoc201602020

具有聚集荧光增强效应的四苯基吡嗪类衍生物的制备和性能研究
-
关键词:
- 四苯基吡嗪
- / 聚集荧光增强(AEE)
- / 构效关系
English
Tetraphenylpyrazine-Based Luminogens with Aggregation-Enhanced Emission Characteristics: Preparation and Property
-
近年来,有机发光材料由于具有较强的发光效率、可调的发光颜色和较好的生物相容性等优点,在光电和生物领域得到了广泛的关注和应用[1]. 传统的荧光分子一般具有大的π共轭刚性结构,使其在稀溶液中具有较高的发光效率,而在聚集态下由于π-π相互作用等使发光减弱甚至消失,这就是光物理领域中的聚集猝灭荧光(aggregation-caused quenching,ACQ)现象[2~4]. 然而,在实际应用中,有机发光材料通常要制成固态或薄膜形式,ACQ效应降低了其效率、限制了其应用空间.
2001年,唐本忠课题组[5]发现了多苯环取代的噻咯衍生物在良溶剂中不发光或发光微弱,而在聚集状态下荧光大大增强的这一与ACQ截然相反的现象,从而提出了“聚集诱导发光(aggregation-induced emission,AIE)”的概念. 在随后的研究中提出了“分子内运动(包括旋转和振动)受限(Restriction of intramolecular motion,RIM)”的机理,并得到了广泛采用和认可[6a]. AIE材料在聚集态或者固态下具有较高的发光效率,理论上可提高光电器件的效率和传感器件的灵敏度,从而受到了世界范围内科研人员的广泛关注和积极跟进[6].
AIE领域的研究基础是分子体系. 到目前为止,典型的AIE核心分子体系包括多苯基噻咯[7]、四苯基乙烯(TPE)[8]、二苯乙烯基蒽(DSA)[9]、三苯乙烯(triphenyl- ethylene)[10]以及四苯基-1,4-二丁烯(TPBD)[11]等(图 1). 然而,这些体系还不甚完美,例如,噻咯类化合物合成较繁琐,分离较困难; TPE类分子含有不稳定的双键,易发生光致异构化,光稳定性相对较差. 因此,综合上述分子的优点、规避其不足,开发新型的AIE分子体系是AIE研究领域进一步发展的必经之路.
基于早期提出的“分子内旋转受限(Restriction of intramolecular rotation,RIR)”的AIE机理,并综合上述典型AIE分子体系的优点,2015年,我们[12]报道了一类新型的AIE分子体系——四苯基吡嗪(TPP). TPP具有合成简单、易于衍生、光和热稳定性好等优点. 其全芳环结构也使其对氧、酸、碱等化学物质均具有较好的稳定性. 另外,TPP中心吡嗪环具有一定的吸电子性能,当其与给电子基团相连时,可以通过给、受体的分子内电荷转移效应对分子的发光波长进行调节. 基于上述特点,我们将TPP核分别与1、2、4个三苯胺(TPA)基团相连,制备了TPA修饰的TPP衍生物,其中连接一个TPA分子的TPP衍生物用于有机发光二极管(OLED)器件发光层显示了较好的性能[13].
受上述结果鼓舞,我们进一步将给电子基团与TPP核相连,以调控其发光波长和固态发光强度,从而发展新的基于TPP的AIE分子. 众所周知,噻吩基团也具有良好的给电子性能,但由于硫原子的作用,对发光具有一定的猝灭效应. 若将噻吩基团与TPP相连,所得分子是否还具有AIE特性? 基于这一疑问,我们开展了本文中的工作. 同时,为了研究构效关系,通过改变噻吩基团个数以及与TPP的连接位置,设计了如图 2所示的三个分子TPP-T,TPP-2T和T-TPP-T.
1 结果与讨论
1.1 TPP-T,TPP-2T和T-TPP-T的制备
TPP-T,TPP-2T和T-TPP-T均可通过简便快捷的方法得到,合成路线见Scheme 1. TPP-T可通过我们报道的单溴代TPP与噻吩硼酸的Suzuki偶联反应以73.9%的产率得到; TPP-2T可通过二溴代二苯基乙二酮与噻吩硼酸进行Suzuki偶联,接着与邻二氨基化合物进行环化和脱水反应而得; T-TPP-T可通过1-(4-溴)苯基-2-羟 基-2-苯乙酮的自环化反应生成的二溴代TPP与噻吩硼酸的Suzuki偶联而得. 上述反应的中间体易得,反应条件温和,适于其他功能化TPP衍生物的制备. 三个化合物均可溶于常用的有机溶剂,例如四氢呋喃(THF)、氯仿等,但不溶于水. 热重分析表明三个化合物均具有优异的稳定性,其5%的分解温度均高于330 ℃.
1.2 吸收和发射光谱测试
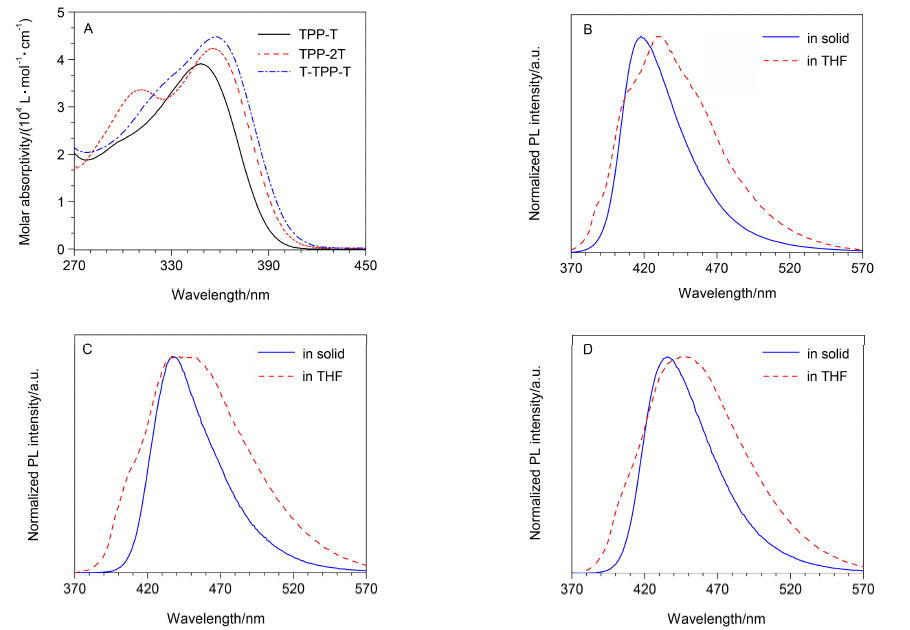
在三个化合物结构充分表征基础上,我们首先测试了它们在THF溶液中的紫外-可见吸收光谱. 从图 3中可知: TPP-T,TPP-2T和T-TPP-T的最大吸收峰分别位于348,356和358 nm处. 相较于TPP-T,TPP-2T和T-TPP-T吸收峰发生了红移,其中TPP-2T红移了8 nm,T-TPP-T红移了10 nm. 另外,三个化合物最大吸收峰位置的摩尔吸光系数分别为3.91×104,4.23×104和4.48×104 L•mol-1•cm-1. 上述现象是给电子基团数目增加及共轭延长效应共同作用的结果.
接着测试了TPP-T,TPP-2T和T-TPP-T的粉末以及THF溶液中的荧光光谱(图 3). 结果显示在THF溶液中,三者的发射峰分别位于429,442和448 nm处,也呈现逐渐红移的趋势,与紫外吸收光谱的结果一致. 另外,在粉末和溶液这两种状态下,TPP-T的最大荧光发射峰位置分别位于418和429 nm处,相对于粉末的发射,溶液状态下发射红移,其原因是TPP-T分子具有给、受体结构,在THF溶液中可以发生分子内电荷转移,从而使其发射红移. 同理,TPP-2T和T-TPP-T在THF溶液中的发射也较其粉末发生了红移,说明由于给、受体结构的存在,使其在THF中也存在分子内电荷转移.
1.3 聚集诱导发光(AIE)
TPP本身具有AIE的特性,当共价连接上噻吩基团后,所得的TPP-T,TPP-2T和T-TPP-T是否也具有AIE的特性? 为回答这一问题,我们通过向其THF溶液中加水的实验测试了其发光强度与聚集的关系. 测试结果如图 4所示,TPP-T,TPP-2T和T-TPP-T在THF溶液中已有一定的发光,但随着水含量的增加,荧光发射强度逐渐增强,表现出聚集荧光增强(aggregation-enhanced emission,AEE)的特性.
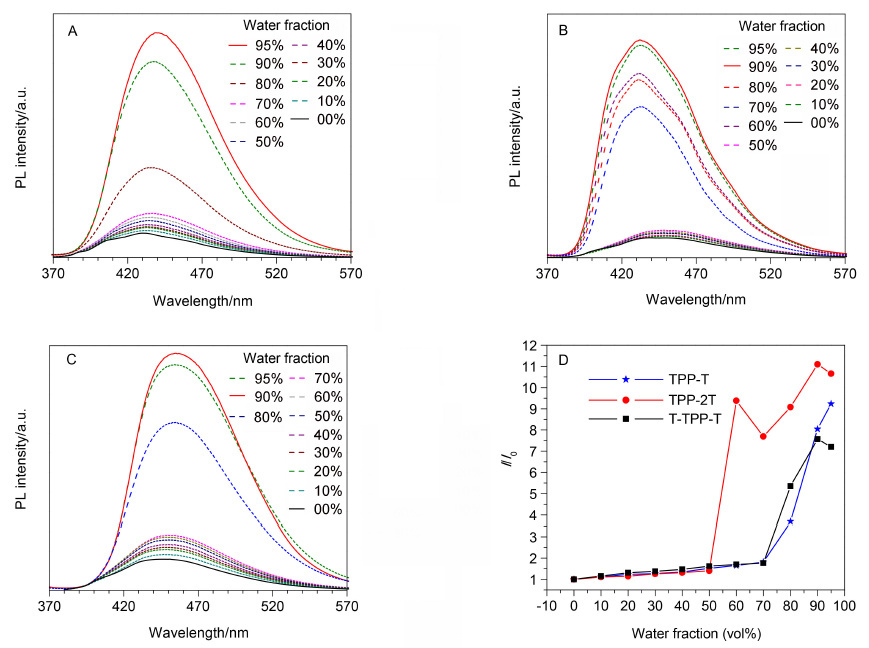 图 4
TPP-T (A),TPP-2T (B)和T-TPP-T (C)在不同水含量的THF和水混合溶剂中的PL光谱以及(D) TPP-T,TPP-2T和T-TPP-T在不同水含量的THF和水混合溶剂中的荧光强度变化示意图
Figure 4.
PL spectra of TPP-T (A),TPP-2T (B) and T-TPP-T (C) in THF/water mixtures with different water fraction,and (D) variation in the PL intensity of TPP-T,TPP-2T and T-TPP-T in THF/water mixtures with different water fraction
图 4
TPP-T (A),TPP-2T (B)和T-TPP-T (C)在不同水含量的THF和水混合溶剂中的PL光谱以及(D) TPP-T,TPP-2T和T-TPP-T在不同水含量的THF和水混合溶剂中的荧光强度变化示意图
Figure 4.
PL spectra of TPP-T (A),TPP-2T (B) and T-TPP-T (C) in THF/water mixtures with different water fraction,and (D) variation in the PL intensity of TPP-T,TPP-2T and T-TPP-T in THF/water mixtures with different water fraction
对于TPP-T而言,在水含量低于70%之前,随着水含量的增加,其荧光强度缓慢增加; 当水含量达到80%或之后,荧光强度显著增加; 当水含量为95%时,荧光强度达到最大,是THF溶液中强度的9.2倍. TPP-2T和T-TPP-T也表现出类似的发光行为. 其聚集体最大荧光强度分别是THF溶液中的11.1和7.6倍. 而在水含量为95%时两者的荧光有所减弱,其原因可能是此时聚集体的形态发生了改变[14]. 值得指出的是,TPP-2T呈现荧光显著增强现象时的水含量为60%,较TPP-T和T-TPP-T低,说明TPP-2T可能由于溶解性相对较差,在低水含量时即可形成聚集体.
另外,TPP-T和T-TPP-T的荧光随着THF和水混合溶剂中水含量的增加最大发射峰位置略有红移,而TPP-2T的荧光发射随着水含量的增加先红移再蓝移. 在THF和水的混合溶剂中,当水含量较低时,混合溶剂的极性对TPP-2T产生了较大的影响,使其分子内电荷转移增加,从而发光红移; 而进一步增加水的含量,由于溶解性较差,分子发生聚集. 而该聚集体受溶剂影响较小,从而表现为本征态的发光[15].
此外,TPP-T,TPP-2T和T-TPP-T的绝对荧光量子产率(QY)测试结果显示,在THF溶液中,TPP-T,TPP-2T,T-TPP-T的QY分别为1.4%、1.9%和2.5%,呈现微弱发光; 而粉末的QY分别为26.8%、29.0%和30.9%,均表现为AEE的特性. 该结果也与PL测试结果吻合.
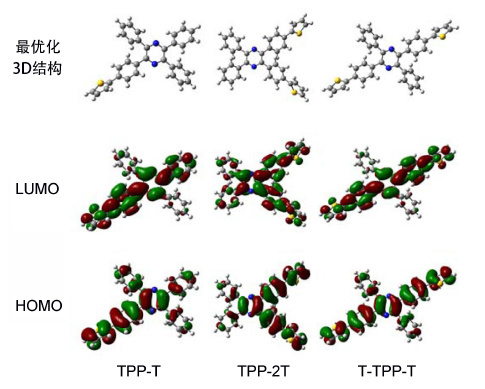
1.4 理论计算
为进一步理解实验中观察到的发光现象,我们通过理论计算进行了研究. 利用DFT/B3LYP/6-31G(d)对三个分子的构型进行了优化,并对其基态与激发态电子云分布进行了计算(图 5). 模拟结果显示,TPP-T,TPP-2T和T-TPP-T的最高占据轨道(HOMO)主要集中于中心吡嗪环以及连有噻吩的苯环及噻吩环上,还有少量位于中心吡嗪环上与苯基噻吩相应的邻位及对位苯环上; 而最低未占轨道(LUMO)主要集中于中心吡嗪环及苯基噻吩环上,还有少量位于中心吡嗪环上与苯基噻吩相应的对位苯环上. 且HOMO与LUMO相差不大,说明这三个分子均具有较好的共轭性.
从优化的结构中提取的分子二面角结果(表 1)显示: 噻吩环与其相连的苯环之间的二面角较小,均小于9°,说明两者平面较好(苯环与噻吩基团相连,两基团相邻氢原子距离较远,相互作用较弱[16]). 这一分子构型可用于解释AIE实验中观察到的TPP-T和T-TPP-T分子在THF和水的混合溶剂中红移的现象: 由于噻吩环和吡嗪环给受体的作用,在THF和水的混合溶剂中,当水含量较低时,溶剂的极性使分子发生分子内电荷转移,从而使发光红移; 而在水含量高时,由于分子的疏水作用,使分子彼此靠近,但由于噻吩环和与其相连的苯环之间平面性较好,使得分子间的π-π作用成为可能,所以,虽然溶剂极性的影响减小,但分子间的作用力增加,从而在THF和水的混合溶剂中发光还呈现红移状态.
化合物 二面角/(°) C(1)—C(2)—C(3)—C(4) C(5)—C(6)—C(7)-C(8) C(9)—C(10)—C(11)—C(12) TPP-T 4.46 14.57 38.16 TPP-2T 6.76 20.55 43.33 T-TPP-T 8.24 21.43 40.73  表 1 TPP-T,TPP-2T和T-TPP-T的理论计算的二面角
表 1 TPP-T,TPP-2T和T-TPP-T的理论计算的二面角
Table 1. Dihedral angles of TPP-T,TPP-2T and T-TPP-T另外,与噻吩相连的苯环与吡嗪环的二面角小于22°,说明苯基噻吩与吡嗪环共轭较好,分子刚性强,有利于其发光. 另外,未与噻吩环相连的苯环与吡嗪环间的扭转角相对较大,约为40°,刚性较差,旋转较容易. 溶液状态下,三个分子中以单键相连的基团均可以旋转消耗激发态能量,而较好的刚性又有利于其发光,两者共同作用,此消彼长,因而在溶液状态下呈现微弱发光; 而在粉末状态下,分子内这些旋转受到限制,非辐射跃迁途径受限,因此荧光大大增强.
2 结论
我们设计并以简便的方法合成了三个含不同噻吩数目和不同连接方式的TPP衍生物TPP-T,TPP-2T和T-TPP-T. 三个化合物均呈现AEE特性,证明了以TPP为核制备AIE分子的普适性. TPP-T,TPP-2T和T-TPP-T的发光波长位于418~437 nm之间,属于蓝紫光到深蓝光发射; 其荧光量子产率分别为26.8%,29.0%和30.9%,加之它们优异的热稳定性,可望应用于OLED制备时的发光层.
3 实验部分
3.1 仪器与试剂
紫外-可见吸收光谱在SHIMADZU UV-2600型紫外-可见吸收光谱仪上测得; 荧光发射光谱在HORIBA Fluoromax-4型荧光磷光光谱仪上测得; 荧光绝对量子产率在HAMAMATSU C11347-11 Quantaurus-QY型绝对光致发光量子产率测量系统中测得; 核磁共振氢谱和碳谱在Bruker AV 500 MHz核磁共振谱仪测得,以氘代氯仿(CDCl3)或氘代二甲基亚砜(DMSO-d6)为溶剂,四甲基硅烷为内标; 高分辨质谱(HRMS)在Agilent1290/ maXis impact上测得.
苯乙酰氯、含溴化氢30%的醋酸溶液、羟基(甲苯磺酰氧基)碘代苯、醋酸铵在梯希爱(上海)化成工业发展有限公司(TCI)购买; 溴苯在润捷化学购买; 1,2,-二苯基乙二胺在北京华威锐科化工购买; 2-硼酸噻吩在苏州苏凯路化学购买; 4,4'-二溴苯偶酰在北京伊诺凯科技购买; 七水氯化铯在安耐吉购买; 四三苯基膦钯在Aldrich购买.
3.2 2-(4-噻吩)苯基-3,5,6-三苯基吡嗪(TPP-T)的合成
3.3 2,3-(4-噻吩)二苯基-5,6-二苯基吡嗪(TPP-2T)的合成
3.4 2,5-(4-噻吩)二苯基-3,6-二苯基吡嗪(T-TPP-T)的合成
3.2.3 2-(4-溴苯基)-3,5,6-三苯基吡嗪(4)的合成
将3 (8.64 g,30 mmol)、1,2-二苯基乙二胺(7.65 g,36 mmol)加入250 mL的单口圆底烧瓶中,加入50 mL冰乙酸,加热至回流,反应12 h. 冷却到室温后,将反应液倒入水中,用DCM萃取3遍. DCM溶液用无水硫酸镁干燥,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=4:1],干燥后得到白色产物9.19 g,产率为 66.3%. 1H NMR (500 MHz,CDCl3) δ: 7.30~7.37 (m,9H),7.43~7.46 (m,2H),7.51~7.54 (m,2H),7.61~7.65 (m,6H); 13C NMR (125 MHz,CDCl3) δ: 148.70,148.50,148.31,147.09,138.27,138.15,137.38,131.46,131.44,129.86,129.82,128.82,128.72,128.42,128.27,128.25,123.12.
3.2.2 1-(4-溴苯基)-2-苯基乙二酮(3)的合成
参考文献[17]. 9.0 g 1-(4-溴苯基)-2-苯乙酮于500 mL单口圆底烧瓶中,加入60 mL DMSO使固体溶解. 用注射器吸取60 mL含30%溴化氢的醋酸溶液注入反应瓶中; 加入30 mL蒸馏水,加热至90 ℃,反应12 h. 冷却后将反应液倒入大量冰水中,并加入一定量的乙酸乙酯,搅拌至冰块融化,用乙酸乙脂萃取,合并的乙酸乙脂溶液用大量水洗涤,无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(乙酸乙酯)=20:1],干燥后得到淡黄色产物9.37 g,产率为 99.1%. 1H NMR (500 MHz,CDCl3) δ: 7.50~7.54 (m,2H),7.65~7.69 (m,3H),7.83~7.86 (m,2H),7.95~7.98 (m,2H); 13C NMR (125 MHz,CDCl3) δ: 193.84,193.28,135.08,132.79,132.45,131.75,131.25,130.51,129.96,129.09.
3.2.4 2-(4-噻吩)苯基-3,5,6-三苯基吡嗪(TPP-T)的合成
将4 (500 mg,1.08 mmol)、2-硼酸噻吩(170 mg,1.3 mmol)、四(三苯基膦)钯(70 mg,0.06 mmol)、无水碳酸钾(300 mg,2.20 mmol)放入250 mL的两口反应瓶中,抽真空换氮气三次; 将新蒸的THF (21 mL)和蒸馏水(9 mL)注入反应瓶中; 加热至回流,反应12 h. 冷却后将反应液倒入250 mL的单口烧瓶中,用旋转蒸发浓缩THF,加入大量DCM,用水洗后,DCM溶液用无水硫酸镁干燥,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=8:1],干燥后得到白色产物372 mg,产率为73.9%. 1H NMR (500 MHz,CDCl3) δ: 7.08~7.10 (dd,J=5.10,3.55 Hz,1H),7.29~7.30 (dd,J=5.05,1.05 Hz,1H),7.31~7.37 (m,10H),7.56~7.59 (m,2H),7.64~7.70 (m,8H); 13C NMR (125 MHz,CDCl3) δ: 148.36,148.33,148.27,147.64,143.86,138.48,138.43,138.41,137.41,134.56,130.41,129.88,129.86,128.71,128.65,128.63,128.41,128.37,128.25,128.24,128.12,125.60,125.20,123.46; HRMS (ESI) calcd for C32H22N2S [M+H+] 467.1576,found 467.1582.
3.2.1 1-(4-溴苯基)-2-苯基乙酮(2)的合成
参考文献[17]. 在500 mL的单口圆底烧瓶里加入苯乙酰氯(1) 7.0 mL (7.7 g,50 mmol)和二氯亚砜1.8 mL (2.75 g,25 mmol),加热回流2 h; 冷却至室温,将圆底烧瓶置于0 ℃环境中,加入10 mL干燥的二氯甲烷(DCM),使溶液稀释; 加入无水氯化铝(6.67 g,50 mmol)和溴苯(10 mL,100 mmol),反应1 h; 加热至80 ℃,反应2 h. 冷却后将反应液倒入大量冰水中,用DCM萃取. 萃取液用无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(乙酸乙酯)=20:1],干燥后得到白色产物10.3 g,产率为75.2%. 1H NMR (500 MHz,DMSO-d6) δ: 4.38 (s,2H),7.21~7.26 (m,3H),7.29~7.33 (m,2H),7.73~7.76 (m,2H),7.96~7.99 (m,2H); 13C NMR (125 MHz,DMSO-d6) δ: 197.39,135.81,135.30,132.29,130.87,130.18,128.79,127.85,127.02,45.14.
3.3.1 1,2-(4-噻吩)-二苯基乙二酮(6)的合成
将5 (3.7 g,10 mmol)、2-硼酸噻吩(3.07 g,24 mmol)、四(三苯基膦)钯(600 mg,0.5 mmol)、无水碳酸钾(5.5 g,40 mmol)放入250 mL的两口反应瓶中,抽真空换氮气3次; 将新蒸的THF (70 mL)和蒸馏水(30 mL)注入反应瓶中; 加热至回流,反应12 h. 冷却后将反应液倒入250 mL的单口烧瓶中,用旋转蒸发仪浓缩THF,之后加入大量的DCM,并用水洗. DCM溶液用无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=2:1],干燥后得到淡黄色固态产物2.46 g,产率为 65.8%. 1H NMR (500 MHz,CDCl3) δ: 7.13~7.15 (dd,J=5.1,3.65 Hz,2H),7.41~7.42 (dd,J=5.05,1.1 Hz,2H),7.47~7.48 (dd,J=3.7,1.1 Hz,2H),7.73~7.76 (m,4H),7.99~8.01 (m,4H); 13C NMR (125 MHz,CDCl3) δ: 193.54,142.53,140.52,131.57,130.75,128.54,127.24,125.9 7,125.32.
3.3.2 2,3-(4-噻吩)二苯基-5,6-二苯基吡嗪(TPP-2T)的合成
将6 (1.5 g,4 mmol)、1,2-二苯基乙二胺(1.1 g,5 mmol)放入250 mL的单口圆底烧瓶中,加入30 mL冰乙酸,加热至回流,反应12 h. 冷却后加入大量DCM,并用水洗. DCM溶液用无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=2:1],干燥后得到白色产物1.05 g,产率为 47.9%. 1H NMR (500 MHz,CDCl3) δ: 7.08~7.10 (dd,J=5.1,3.6 Hz,2H),7.29~7.31 (dd,J=5.1,1.1 Hz,2H),7.31~7.37 (m,8H),7.59~7.61 (m,4H),7.65~7.68 (m,4H),7.71~7.73 (m,4H); 13C NMR (125 MHz,CDCl3) δ: 148.28,147.50,143.83,138.39,137.41,134.67,130.40,129.89,128.68,128.27,128.14,125.72,125.25,123.51. HRMS (ESI) calcd for C36H24N2S2 [M+H+] 549.1454,found 549.1454.
3.4.2 2,5-(4-溴)二苯基-3,6-二苯基吡嗪(8)的合成
参考文献[18]. 将7 (2.45 g,8.5 mmol)、醋酸铵(2.62 g,34 mmol)、七水氯化铯(CeCl3•7H2O) (170 mg,0.45 mmol)放入250 mL的单口圆底烧瓶中,加入50 mL的乙醇,加热至回流,反应12 h. 将反应液浓缩,加入大量的DCM,之后用水洗. DCM溶液用无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=4:1],干燥后得到白色固体产物700 mg,产率为30.4%.
另外,还可参考文献[19]合成. 将7 (1.45 g,5.0 mmol)、醋酸铵(1.55 g,20 mmol)放入250 mL的单口圆底烧瓶中,加入冰乙酸(30 mL)和醋酸酐(0.8 mL,7.5 mmol),加热至回流,反应6 h. 在反应液中加入DCM,用水洗. DCM溶液用无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=4:1],干燥后得到白色固体产物370 mg,产率为27.3%. 1H NMR (500 MHz,CDCl3) δ: 7.33~7.39 (m,6H),7.43~7.46 (m,4H),7.49~7.53 (m,4H),7.60~7.63 (m,4H); 13C NMR (125 MHz,CDCl3) δ: 148.40,147.39,137.96,137.19,131.48,131.44,129.77,128.95,128.47,123.28.
3.4.3 2,5-(4-噻吩)二苯基-3,6-二苯基吡嗪(T-TPP-T)的合成
将8 (550 mg,1.0 mmol)、2-硼酸噻吩(400 mg,3.0 mmol)、四(三苯基膦)钯(120 mg,0.1 mmol)、无水碳酸钾(560 mg,4.0 mmol)放入250 mL的两口反应瓶中,抽真空换氮气三次; 将新蒸的THF (21 mL)和水(9 mL)注入反应瓶中; 加热至回流,反应12 h. 将反应液倒入250 mL的单口烧瓶中,用旋转蒸发仪蒸浓缩THF,之后加入大量的DCM,并用水洗. DCM溶液用无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=4:1],干燥后得到白色产物338 mg,产率为61.6%. 1H NMR (500 MHz,CDCl3) δ: 7.08~7.10 (ddd,J=5.0,3.6,1.2 Hz,2H),7.29~7.31 (dt,J=5.1,1.2 Hz,2H),7.33~7.38 (ddt,J=5.9,2.3,1.4 Hz,8H),7.56~7.61 (m,4H),7.67~7.71 (ddt,J=8.7,6.6,1.9 Hz,8H); 13C NMR (125 MHz,CDCl3) δ: 148.21,148.19,147.59,147.54,143.85,138.45,138.43,137.37,137.36,134.60,134.58,130.40,129.86,128.75,128.74,128.39,128.38,128.12,125.61,125.22,123.48. HRMS (ESI) calcd for C36H24N2S2 [M+H+]549.1454,found 549.1459.
辅助材料(Supporting Information) TPP-T、TPP-2T、T-TPP-T的热失重图、核磁谱图和的高分辨质谱图. 这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载
3.4.1 1-(4-溴)苯基-2-羟基-2苯乙酮(7)的合成
将2 (8.22 g,30 mmol)放入500 mL的单口烧瓶中,加入150 mL DMSO使固体溶解,并加入7.5 mL H2O; 分两次加入羟基(甲苯磺酰氧基)碘代苯(29.4 g,75 mmol),室温下搅拌24 h. 冷却后加入大量乙酸乙酯,并用水洗三次以除去DMSO. 乙酸乙酯溶液用无水硫酸镁干燥后,过滤. 滤液浓缩后用硅胶色谱柱分离提纯[淋洗液: V(石油醚):V(DCM)=4:1],干燥后得到白色固体产物3.84 g,产率为44.1%. 1H NMR (500 MHz,DMSO-d6) δ: 7.02~7.03 (d,J=5.0 Hz,1H),7.13~7.14 (d,J=5.0 Hz,1H),7.23~7.26 (m,1H),7.31~7.34 (m,2H),7.39~7.41 (m,2H),7.66~7.69 (m,2H),7.91~7.94 (m,2H); 13C NMR (125 MHz,DMSO-d6) δ: 198.88,139.87,134.19,132.16,131.31,128.98,128.25,127.81,127.64,76.32.
-
-
[1]
Chen, H. C.; Ching, K. C.; Fang, M. H.; Ching, F. S.; Pi, T. C.; Chin, H. L. Adv. Funct. Mater. 2009, 19, 560. (b) Lukas, Z.; Volker, E.; Ralph, R.; Klaus, M. Org. Lett. 2013, 15, 804. (c) Jon, P. A.; Bambi, L. R.; Kristin, B.; John, G. W. Nano. Lett. 2010, 10, 788. (d) You, S. S.; Cai, Q.; Zheng, Y.; He, B. C.; Shen, J.; Yang, W. T.; Yin, M. Z. ACS Appl. Mater. Interfaces 2014, 6, 16327. (e) Leung, C. W. T.; Hong, Y. N.; Chen, S. J.; Zhao, E. G.; Lam, J. W. Y.; Tang. B. Z. J. Am. Chem. Soc. 2013, 135, 62. (f) Chen, S. J.; Hong, Y. N.; Liu, Y.; Liu, J. Z.; Leung, C. W. T.; Li, M.; Kwok, R. T. K.; Zhao, E. G.; Lam, J. W. Y.; Yu, Y.; Tang, B. Z. J. Am. Chem. Soc. 2013, 135, 4926. (g) Wang, Z. K.; Chen, S. J.; Lam, J. W. Y.; Qin, W.; Kwok, R. T. K.; Xie, N.; Hu, Q. L.; Tang, B. Z. J. Am. Chem. Soc. 2013, 135 (22), 8238. (h) Ding, D.; Li, K.; Liu, B.; Tang, B. Z. Acc. Chem. Res. 2013, 46 (11), 2441. doi: 10.1002/adfm.v19:4
-
[2]
Jenekhe, S. A.; Osaheni, J. A. Science 1994, 265, 765. doi: 10.1126/science.265.5173.765
-
[3]
Friend, R. H.; Gymer, R. W.; Holmes, A. B.; Burroughes, J. H.; Marks, R. N.; Taliani, C.; Bradley, D. D. C.; Dos, S. D. A.; Brédas, J. L.; Lögdlund, M.; Salaneck, W. R. Nature 1999, 397, 121. doi: 10.1038/16393
-
[4]
Chen, C. T. Chem. Mater. 2004, 16, 4389. doi: 10.1021/cm049679m
-
[5]
Luo, J. D.; Xie, Z. L.; Lam, J. W. Y.; Cheng, L.; Chen, H. Y.; Qiu, C. F.; Kwok, H. S.; Zhan, X. W.; Liu, Y. Q.; Zhu, D. B.; Tang, B. Z. Chem. Commun. 2001, 1740.
-
[6]
Mei, J.; Leung, N. L. C.; Kwok, R. T. K.; Lam, J. W. Y.; Tang, B. Z. Chem. Rev. 2015, 115(21), 11718. (b) Hong, Y. N.; Lam, J. W. Y.; Tang, B. Z. Chem. Soc. Rev. 2011, 40, 5361. (c) Hong, Y. N.; Lam, J. W. Y.; Tang, B. Z. Chem. Commun. 2009, 4332. (d) Li, Q.; Li, Z. Sci. China Chem. 2015, 58, 1800. (e) Quan, C. Y.; Nie, H.; Hu, R. R.; Qin, A. J.; Zhao, Z. J.; Tang, B. Z. Chin. J. Chem. 2015, 33, 842. doi: 10.1021/acs.chemrev.5b00263
-
[7]
Chen, L.; Jiang, Y. B.; Nie, H.; Lu, P.; Sung, H. H. Y.; Williams, I. D.; Kwok, H. S.; Huang, F.; Qin, A. J.; Zhao, Z. J.; Tang, B. Z. Adv. Funct. Mater. 2014, 24, 3621. (b) Scalise, R. E.; Caradonna, P. A.; Tracy, H. J.; Mullin, J. L.; Keirstead, A. E. J. Inorg. Organomet. Polym. Mater. 2014, 24, 431. (c) Mei, J.; Wang, J.; Sun, J. Z.; Zhao, H.; Yuan, W. Z.; Deng, C. M.; Chen, S. M.; Sung, H. H. Y.; Lu, P.; Qin, A. J.; Kwok, H. S.; Ma, Y. G.; Williams, I. D.; Tang, B. Z. Chem. Sci. 2012, 3, 549. (d) Liu, J.; Lam, J. W. Y.; Tang, B. Z. J. Inorg. Organomet. Polym. Mater. 2009, 19, 249. doi: 10.1002/adfm.201303867
-
[8]
Zhao, Z.; Lam, J. W. Y.; Tang, B. Z. J. Mater. Chem. 2012, 22, 23726. (b) Huang, J.; Sun, N.; Dong, Y.; Tang, R.; Lu, P.; Cai, P.; Li, Q.; Ma, D.; Qin, J.; Li, Z. Adv. Funct. Mater. 2013, 23, 2329. (c) Gu, X. G.; Yao, J. J.; Zhang, G. X.; Zhang, C.; Yan, Y. L.; Zhao, Y. S.; Zhang, D. Q. Chem. Asian J. 2013, 8, 2362. (d) Zhang, X.; Chi, Z.; Zhou, X.; Liu, S.; Zhang, Y.; Xu, J. J. Phys. Chem. C 2012, 116, 23629. (e) Ma, J.; Lin, T. T.; Pan, X.; Wang, W. Z. Chem. Mater. 2014, 26, 4221. (f) Misra, R.; Jadhav, T.; Dhokale, B.; Mobin, S. M. Chem. Commun. 2014, 50, 9067. (g) Ghosh, K. R.; Saha, S. K.; Wang, Z. Y. Polym. Chem. 2014, 5, 5638. (h) Dong, W.; Fei, T.; Palma-Cando, A.; Scherf, U. Polym. Chem. 2014, 5, 4048. doi: 10.1039/c2jm31949g
-
[9]
Xu, B.; Zhang, J. B.; Ma, S. Q.; Chen, J. L.; Dong, Y. J.; Tian, W. J. Prog. Chem. 2013, 25, 1079. (b) Zhang, X. Q.; Chi, Z. G.; Xu, B. J.; Jiang, L.; Zhou, X.; Zhang, Y.; Liu, S. W.; Xu, J. R. Chem. Commun. 2012, 48, 10895. (c) He, J. T.; Xu, B.; Chen, F. P.; Xia, H. J.; Li, K. P.; Ye, L.; Tian, W. J. J. Phys. Chem. C 2009, 113, 9892.
-
[10]
Yang, Z.; Chi, Z,; Yu, T.; Zhang, X.; Chen, M.; Xu, B.; Liu, S.; Zhang, Y.; Xu, J. J. Mater. Chem. 2009, 19, 5541. (b) Zhang, X.; Yang, Z.; Chi, Z,.; Chen, M.; Xu, B.; Wang, C.; Liu, S.; Zhang, Y.; Xu, J. J. Mater. Chem. 2010, 20, 292. (c) Yang, Z.; Chi, Z.; Xu, B.; Li, H.; Zhang, X.; Li, X.; Liu, S.; Zhang, Y.; Xu, J. J. Mater. Chem. 2010, 20, 7352. (d) Zhang, X.; Chi, Z.; Li, H.; Xu, B.; Li, X.; Liu, S.; Zhang, Y.; Xu, J. J. Mater. Chem. 2011, 21, 1788. (e) Zhang, X.; Chi, Z.; Xu, B.; Chen, C.; Zhou, X.; Zhang, Y.; Liu, S.; Xu, J. J. Mater. Chem. 2012, 22, 18505. (f) Li, H.; Chi, Z.; Zhang, X.; Xu, B.; Liu, S.; Zhang, Y.; Xu, J. Chem. Commun. 2011, 47, 11273. (g) Li, H.; Zhang, X.; Chi, Z.; Xu, B.; Zhou, W.; Liu, S.; Zhang, Y.; Xu, J. Org. Lett. 2011, 4, 556. doi: 10.1039/b902802a
-
[11]
Chen, J. W.; Xu, B.; Ouyang, X. Y.; Tang, B. Z.; Cao, Y. J. Phys. Chem. A 2004, 108, 7522. (b) Han, T.; Zhang, Y. J.; Feng, X.; Lin, Z. G.; Tong, B.; Shi, J. B.; Zhi, J. G.; Dong, Y. P. Chem. Commun. 2013, 49, 7049. (c) Guo, Y. X.; Feng, X.; Han, T. Y.; Wang, S.; Lin, Z. G.; Dong, Y. P.; Wang, B. J. Am. Chem. Soc. 2014, 136, 15485. doi: 10.1021/jp048475q
-
[12]
Chen, M.; Li, L. Z.; Nie, H.; Tong, J. Q.; Yan, L. L.; Xu, B.; Sun, J. Z.; Tian, W. J.; Zhao, Z. J.; Qin, A. J.; Tang, B. Z. Chem. Sci. 2015, 6, 1932. doi: 10.1039/C4SC03365E
-
[13]
Chen, M.; Nie, H.; Song, B.; Li, L. Z.; Sun, J. Z.; Qin, A. J.; Tang, B. Z. J. Mater. Chem. C 2016, 4, 2901. doi: 10.1039/C5TC03299G
-
[14]
Dong, Y. Q.; Lam, J. W. Y.; Qin, A. J.; Sun, J. X.; Liu, J. Z.; Li, Z.; Sun, J. Z.; Sung, H. H. Y.; Williams, I. D.; Kwokc, H. S.; Tang, B. Z. Chem. Commun. 2007, 3255.
-
[15]
Qin, A. J.; Lam, J. W. Y.; Mahtab, F.; Jim, C. K. W.; Tang, L.; Sun J. Z.; Sung, H. H. Y.; Williams, I. D.; Tang, B. Z. Appl. Phys. Lett. 2009, 94, 253308. doi: 10.1063/1.3137166
-
[16]
Nie, H.; Chen, B.; Quan, C. Y.; Zhou, J.; Qiu, H. Y.; Hu, R. R.; Su, S. J.; Qin, A. J.; Zhao, Z. J.; Tang B. Z. Chem. Eur. J. 2015, 21, 8137.
-
[17]
Mohamad-Ali, T.; Freédeéric, D.; Bernadette, G.; Jean-Louis, C.; Didier, G.; Fabrice, M. S.; Jean-Pierre, F.; Jacques, L. Macromolecules 2013, 46, 736.
-
[18]
Marques, M. V.; Ruthner, M. M.; Fontoura, L. A. M.; Russowsky, D. J. Braz. Chem. Soc. 2012, 23, 171. doi: 10.1590/S0103-50532012000100024
-
[19]
Li, H.-Y.; Liang, J. H.; Liu, H. M.; Li, S. N.; Zhu. B. C. Chin. J. Synth. Chem. 2008, 16, 344 (in Chinese). (李红亚, 梁俊红, 刘卉闵, 李术娜, 朱宝成, 合成化学, 2008, 16, 344.)
-
[1]
-
图 3 (A) TPP-T、TPP-2T和T-TPP-T在THF中的紫外-可见吸收光谱以及TPP-T (B),TPP-2T (C)和TPP-T (D)分别在THF溶液中和粉末状态下的荧光光谱
Figure 3 (A) UV-Vis absorption spectra of TPP-T,TPP-2T and T-TPP-T in THF,and PL spectra of TPP-T (B),TPP-2T (C) and T-TPP-T (D) in THF and powder states
Concentration: 10-5mol•L-1; excitation wavelength: 348,356 and 358 nm
图 4 TPP-T (A),TPP-2T (B)和T-TPP-T (C)在不同水含量的THF和水混合溶剂中的PL光谱以及(D) TPP-T,TPP-2T和T-TPP-T在不同水含量的THF和水混合溶剂中的荧光强度变化示意图
Figure 4 PL spectra of TPP-T (A),TPP-2T (B) and T-TPP-T (C) in THF/water mixtures with different water fraction,and (D) variation in the PL intensity of TPP-T,TPP-2T and T-TPP-T in THF/water mixtures with different water fraction
Concentration of AIEgens: 10-5mol•L-1; excitation wavelengths: 348,356 and 358 nm,respectively
表 1 TPP-T,TPP-2T和T-TPP-T的理论计算的二面角
Table 1. Dihedral angles of TPP-T,TPP-2T and T-TPP-T
化合物 二面角/(°) C(1)—C(2)—C(3)—C(4) C(5)—C(6)—C(7)-C(8) C(9)—C(10)—C(11)—C(12) TPP-T 4.46 14.57 38.16 TPP-2T 6.76 20.55 43.33 T-TPP-T 8.24 21.43 40.73 
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 1794
- HTML全文浏览量: 483


 下载:
下载:





 下载:
下载:

