 图1
含四氢吡咯[1, 2-a]并吡嗪结构的天然产物和生物活性分子
Figure1.
Representative natural products and bioactive molecules with the tetrahydropyrrolo[1, 2-a]pyrazine skeleton
图1
含四氢吡咯[1, 2-a]并吡嗪结构的天然产物和生物活性分子
Figure1.
Representative natural products and bioactive molecules with the tetrahydropyrrolo[1, 2-a]pyrazine skeleton

Citation: Hu Shu-Bo, Chen Mu-Wang, Zhai Xiao-Yong, Zhou Yong-Gui. Synthesis of Tetrahydropyrrolo/indolo[1, 2-a]pyrazines by Enantioselective Hydrogenation of Heterocyclic Imines[J]. Acta Chimica Sinica, 2018, 76(2): 103-106. doi: 10.6023/A17110476

不对称氢化杂环亚胺合成四氢吡咯/吲哚[1, 2-a]并吡嗪
-
关键词:
- 不对称氢化
- / 杂环亚胺
- / 四氢吡咯/吲哚[1, 2-a]并吡嗪
English
Synthesis of Tetrahydropyrrolo/indolo[1, 2-a]pyrazines by Enantioselective Hydrogenation of Heterocyclic Imines
-
1 引言
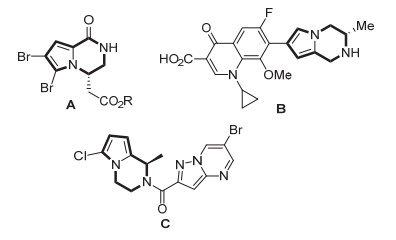
1, 2, 3, 4-四氢吡咯[1, 2-a]并吡嗪广泛存在于天然产物[1]和生物活性分子[2]中, 是一类重要的结构单元.诸如cyclooroidin, hanishin (图 1, A, R=Et), longamide B (A, R=H), phakellstatin, dibromophakellin等天然产物均含有该结构单元[1].另外, 四氢吡咯[1, 2-a]并吡嗪的衍生物表现出广泛的药理活性, 如抗衰老、抗过敏、抗心律不齐、抗病毒以及醛糖还原酶抑制活性等[2].需要特别指出的是, 活性分子B[2i]和C[2g]中四氢吡咯[1, 2-a]并吡嗪结构单元上的取代基和绝对构型对其药理活性有着非常重要的影响.因此, 手性四氢吡咯[1, 2-α]并吡嗪衍生物的合成引起了有机合成工作者的广泛兴趣.
 图1
含四氢吡咯[1, 2-a]并吡嗪结构的天然产物和生物活性分子
Figure1.
Representative natural products and bioactive molecules with the tetrahydropyrrolo[1, 2-a]pyrazine skeleton
图1
含四氢吡咯[1, 2-a]并吡嗪结构的天然产物和生物活性分子
Figure1.
Representative natural products and bioactive molecules with the tetrahydropyrrolo[1, 2-a]pyrazine skeleton
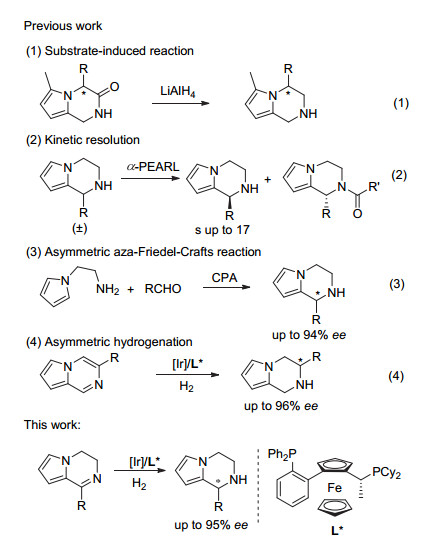
过去, 合成该分子的方法主要是通过底物诱导的策略[3], 比如通过对手性的二氢吡咯[1, 2-a]并吡嗪酮还原可以实现手性的四氢吡咯[1, 2-a]并吡嗪化合物的合成(图 2, Eq. 1)[3c].使用聚合物负载的手性酰基异羟肟酸拆分试剂进行动力学拆分提供了另外一种合成途径(Eq. 2)[4].直到2011年, 首例催化不对称合成四氢吡咯[1, 2-a]并吡嗪的方法才被Li和Antilla报道, 该反应利用手性磷酸催化2-(1H-吡咯-1-基)乙胺与醛发生分子内氮杂傅克反应, 取得了优异的反应活性和对映选择性(Eq. 3)[5].最近, Kobayashi小组[6]发展了一种非均相手性双功能催化剂, 由金属纳米粒子和手性磷酸组成, 实现了苄醇的有氧氧化-氮杂傅克反应合成四氢吡咯[1, 2-a]并吡嗪的串联一锅反应, 对映选择性最高为95%.不对称氢化作为一种简单、直接、原子经济性的合成方法, 广泛应用于手性胺的合成[7]. 2014年, Zhou小组[8]采用底物活化的策略, 实现了对1-取代吡咯[1, 2-a]并吡嗪苄溴盐底物的不对称氢化, 得到一系列的四氢吡咯[1, 2-a]并吡嗪衍生物, 反应体系中需要加入当量的碱中和反应产生的酸来抑制产物的消旋化.随后, 该小组成功实现了3-取代吡咯[1, 2-a]并吡嗪的直接不对称氢化, 值得注意的是, 该体系不需要进行底物活化就能以最高96%的ee值得到目标分子(Eq. 4)[9].考虑到四氢吡咯[1, 2-α]并吡嗪结构单元在天然产物和生物活性分子中的重要性, 并受到我们小组在不对称氢化反应的研究启发, 发展一种简单、直接的不对称氢化合成四氢吡咯[1, 2-α]并吡嗪的方法仍非常具有意义.在这里, 我们报道了通过直接不对称氢化3, 4-二氢吡咯[1, 2-a]并吡嗪合成1, 2, 3, 4-四氢吡咯[1, 2-α]并吡嗪的新方法, 反应的对映选择性高达95%.该催化体系也适用于3, 4-二氢吲哚[1, 2-a]并吡嗪的不对称氢化, 最高取得94%的ee值.
2 结果与讨论
2.1 反应条件的优化
以1-苯基-3, 4-二氢吡咯[1, 2-a]并吡嗪(1a)为模型底物进行不对称氢化反应研究, 实验结果如表 1所示.首先, 以1 mol% [Ir(COD)Cl]2为催化剂, (R)-SegPhos为配体, 原位制备手性铱催化剂后, 在四氢呋喃溶剂中, 500 psi氢气, 40 ℃条件下反应24 h, 反应以74%的转化率得到1, 2, 3, 4-四氢吡咯[1, 2-a]并吡嗪2a, 但是产物的对映体过量值仅有13% (Entry 1).考虑到卤素添加剂对铱活化后可以有效提高其在不对称氢化反应中的活性和对映选择性[10], 随后, 我们尝试在反应中加入10 mol%的碘用来活化铱催化剂, 结果表明, 虽然反应活性明显提高, 但是反应的对映选择性降至7% (Entry 2).可能是由于碘的加入, 体系中生成少量的氢碘酸, 使产物消旋化, 导致产物的ee值下降[8].鉴于这一初步结果, 我们不加入卤素添加剂, 考察了不同的溶剂对反应的影响.在1, 4-二氧六环、甲苯、苯、二氯甲烷溶剂中, 氢化反应虽然都能获得中等偏上的转化率, 但是相应产物的ee值并不理想(Entries 3~6).而当使用甲醇作为溶剂时, 反应基本不能进行(Entry 7).综合考虑反应活性和对映选择性, 我们选取甲苯为最佳溶剂.随后, 继续对手性配体进行筛选(Entries 8~11).结果表明, 使用简单的轴手性富电子双膦配体(R)-BINAP和缺电子双膦配体(R)-DifluorPhos, 反应的转化率和对映选择性均有提高, 但是ee值仍保持在中等水平(Entries 8, 9).紧接着我们考察了面手性双膦配体对反应的影响.令我们高兴的是, 采用富电子面手性双膦配体Cy-WalPhos L4, 反应的ee值提高到89%, 但是反应未进行完全(Entry 10).随后增加催化剂用量以及延长反应时间至48 h, 反应就可以完全转化, 并且ee值能够保持在90% (Entry 13).因此, 反应最优条件为:以1.5 mol% [Ir(COD)Cl]2/3.3 mol% L4为催化剂, 在甲苯溶剂中, 500 psi氢气, 40 ℃条件下反应48 h.

Entry a Solvent L Conv.b/% eec/% 1 THF L1 74 13 2d THF L1 >95 7 3 Dioxane L1 82 30 4 Toluene L1 78 40 5 Benzene L1 77 39 6 DCM L1 67 3 7 MeOH L1 8 4 8 Toluene L2 78 47 9 Toluene L3 90 48 10 Toluene L4 91 89 11 Toluene L5 64 32 12e Toluene L4 92 91 13f Toluene L4 >95 90 a Reaction conditions: 1a (0.2 mmol), [Ir(COD)Cl]2 (1 mol%), L (2.2 mol%), H2 (500 psi), solvent (3.0 mL), 24 h, 40 ℃. b Determined by 1H NMR spectroscopy. c Determined by HPLC analysis. d I2 (10 mol%). e [Ir(COD)Cl]2 (1.5 mol%), L4 (3.3 mol%). f [Ir(COD)Cl]2 (1.5 mol%), L4 (3.3 mol%), 48 h. 2.2 氢化反应的底物范围
在确定了最佳反应条件之后, 我们对二氢吡咯[1, 2-a]并吡嗪的底物范围进行了拓展, 如表 2所示.将反应的规模从0.2 mmol提高达0.3 mmol, 反应的活性和对映选择性基本保持(表 1, Entry 13 vs表 2, Entry 1).首先, 我们考察了位阻效应对该氢化反应的影响.结果表明, 位阻越大其对映选择性越好(Entries 2~4).而取代基的电子效应对反应的活性和对映选择性影响不大:在苯基取代基的4-位引入卤素(F, Cl和Br)、三氟甲基以及甲基, 反应均能反应完全, 并且反应的对映选择性都比较好(88%~90% ee, Entries 4~8).特别地, 在底物中苯基的3, 5-位引入甲基(1j)相较于仅在3-位引入一个甲基(1i), 相应产物的ee值高出5个百分点(Entries 9, 10).除了对芳基取代的底物进行考察以外, 我们对烷基取代基底物, 如环己基, 也进行了考察, 反应可以取得较好的对映选择性(86% ee, Entry 11).在二氢吡咯[1, 2-a]并吡嗪的6-位引入溴或者芳基取代基, 随着引入基团位阻增加, 产物的ee值有所提高(Entries 12~14).同时在6-位和8-位引入溴, 该氢化反应仍能取得比较好的收率和对映选择性(Entry 15).值得一提的是, 卤素的引入, 为进一步的化学转化提供了可能的反应位点.

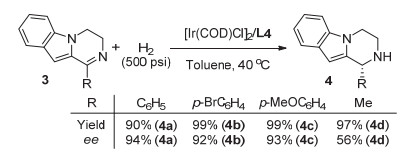
Entrya R1 R2 R3 Yieldb/% eec/% 1 Ph H H 98 (2a) 91 (+) 2 2-FC6H4 H H 95 (2b) 95 (+) 3 3-FC6H4 H H 97 (2c) 94 (+) 4 4-FC6H4 H H 93 (2d) 90 (+) 5d 4-ClC6H4 H H 92 (2e) 89 (R) 6 4-BrC6H4 H H 95 (2f) 89 (+) 7 4-F3CC6H4 H H 95 (2g) 88 (+) 8 4-MeC6H4 H H 92 (2h) 90 (+) 9 3-MeC6H4 H H 93 (2i) 90 (+) 10 3, 5-Me2C6H3 H H 98 (2j) 95 (+) 11 Cy H H 92 (2k) 86 (+) 12 Ph H Br 94 (2l) 89 (-) 13 Ph H Ph 91 (2m) 93 (-) 14 Ph H 4-MeC6H4 95 (2n) 94 (-) 15 Ph Br Br 97 (2o) 94 (-) a Reaction conditions: 1 (0.3 mmol), [Ir(COD)Cl]2 (1.5 mol%), L4 (3.3 mol%), H2 (500 psi), toluene (3.0 mL), 40 ℃, 48 h. b Isolated yields. c Determined by HPLC analysis. d The absolute configuration of the known compound 2e was assigned to be R by comparison of the specific rotation values with the reported data in Ref. 5 and the remaining configurations were assumed by analogy. 随后, 为了进一步考察该催化体系的普适性, 我们将该体系应用于三元并环亚胺3的不对称氢化反应中, 结果如图 3所示.二氢吲哚[1, 2-a]并吡嗪3的1-位为芳基取代基时, 反应的对映选择控制保持在较高的水平(92%~94%).然而, 当1-位取代基为甲基时, 可能是由于空间位阻的影响, 反应只能取得中等的ee值(56%).
3 结论
本文实现了二氢吡咯[1, 2-a]并吡嗪的直接不对称氢化方法合成手性1-取代四氢吡咯[1, 2-a]并吡嗪, 最高取得98%的收率和95%的ee值.该催化体系在三元并环亚胺3, 4-二氢吲哚[1, 2-a]并吡嗪的不对称氢化反应中仍具有较好的普适性, 对映体过量值高达94%.反应条件温和, 操作简单, 原子经济性好.但该催化体系在1-烷基取代的底物中, 对映选择性控制不太理想, 所以我们将在后续的研究中进一步改进.
4 实验部分
在手套箱中, 向含有[Ir(COD)Cl]2 (3.0 mg, 0.0045 mmol, 1.5 mol%)和Cy-WalPhos L4 (6.6 mg, 0.0099 mmol, 3.3 mol%)的反应瓶中加入1.0 mL甲苯.反应5 min后, 用2.0 mL甲苯将其转移至含有底物3, 4-二氢吡咯/吲哚[1, 2-a]并吡嗪底物(0.30 mmol)的反应瓶中.搅拌5 min使其混匀后, 将反应体系转移至高压反应釜中, 充入氢气(500 psi).在40 ℃条件下搅拌反应48 h.冷却反应釜至室温后, 缓慢释放氢气.随后减压除去甲苯后直接硅胶柱层析, 得到手性的四氢吡咯/吲哚[1, 2-a]并吡嗪化合物.
-
-
[1]
(a) Al-Mourabit, A. ; Zancanella, M. A. ; Tilvi, S. ; Romo, D. Nat. Prod. Rep. 2011, 28, 1229; (b) Papeo, G. ; Gómez-Zurita Frau, M. A. ; Borghi, D. ; Varasi, M. Tetrahedron Lett. 2005, 46, 8635.
-
[2]
(a) Peresada, V. P. ; Medvedev, O. S. ; Likhosherstov, A. M. ; Skoldinov, A. P. Khim. Farm. Zh. 1987, 21, 1054; (b) Seredenin, S. B. ; Voronina, T. A. ; Likhosherstov, A. M. ; Peresada, Y. P. ; Molodavkin, G. M. ; Halikas, J. A. US 5378846, 1995; (c) Seredenin, S. B. ; Voronina, T. A. ; Beshimov, A. ; Peresada, V. P. ; Likhosherstov, A. M. RU 2099055, 1997; (d) Negoro, T. ; Murata, M. ; Ueda, S. ; Fujitani, B. ; Ono, Y. ; Kuromiya, A. ; Komiya, M. ; Suzuki, K. ; Matsumoto, J. -I. J. Med. Chem. 1998, 41, 4118; (e) Likhosherstov, A. M. ; Filippova, O. V. ; Peresada, V. P. ; Kryzhanovskii, S. A. ; Vititnova, M. B. ; Kaverina, N. V. ; Reznikov, K. M. Pharm. Chem. J. 2003, 37, 6; (f) Merla, B. ; Christoph, T. ; Oberboersch, S. ; Schiene, K. ; Bahrenberg, G. ; Frank, R. ; Kuehnert, S. ; Schroeder, W. WO 2008046582, 2008[Chem. Abstr. 2008, 148, 472076]; (g) Henrich, M. ; Weil, T. ; Müller, S. ; Nagel, J. ; Gravius, A. ; Kauss, V. ; Zemribo, R. ; Erdmane, E. WO 2009095254, 2009[Chem. Abstr. 2009, 151, 221195]; (h) Gahman, T. C. ; Zhao, C. ; Lang, H. ; Massari, M. E. US 20090062253, 2009 [Chem. Abstr. 2009, 150, 283093]; (i) Zhu, B. ; Marinelli, B. A. ; Goldschmidt, R. ; Foleno, B. D. ; Hilliard, J. J. ; Bush, K. ; Macielag, M. Bioorg. Med. Chem. Lett. 2009, 19, 4933.
-
[3]
(a) Li, G. ; Rowland, G. B. ; Rowland, E. B. ; Antilla, J. C. Org. Lett. 2007, 9, 4065; (b) Gualandi, A. ; Cerisoli, L. ; Monari, M. ; Savoia, D. Synthesis 2011, 909; (c) Bhowmik, S. ; Kumar, A. K. S. ; Batra, S. Tetrahedron Lett. 2013, 54, 2251.
-
[4]
Kreituss, I.; Chen, K.-Y.; Eitel, S. H.; Adam, J.-M.; Wuitschik, G.; Fettes, A.; Bode, J. W. Angew. Chem., Int. Ed. 2016, 55, 1553. doi: 10.1002/anie.201509256
-
[5]
He, Y.; Lin, M.; Li, Z.; Liang, X.; Li, G.; Antilla, J. C. Org. Lett. 2011, 13, 4490. doi: 10.1021/ol2018328
-
[6]
Cheng, H.-G.; Miguélez, J.; Miyamura, H.; Yoo, W.-J.; Kobayashi, S. Chem. Sci. 2017, 8, 1356. doi: 10.1039/C6SC03849B
-
[7]
For some examples, see: (a) Glorius, F. Org. Biomol. Chem. 2005, 3, 4171; (b) Lu, S. -M. ; Han, X. -W. ; Zhou, Y. -G. Chin. J. Org. Chem. 2005, 25, 634 (in Chinese). (卢胜梅, 韩秀文, 周永贵, 有机化学, 2005, 25, 634. ) (c) Zhou, Y. -G. Acc. Chem. Res. 2007, 40, 1357; (d) Kuwano, R. Heterocycles 2008, 76, 909; (e) Xie, J. ; Zhou, Q. Acta Chim. Sinica 2012, 70, 1427 (in Chinese). (谢建华, 周其林, 化学学报, 2012, 70, 1427. ) (f) Yu, Z. ; Jin, W. ; Jiang, Q. Angew. Chem. Int. Ed. 2012, 51, 6060; (g) Wang, D. -S. ; Chen, Q. -A. ; Lu, S. -M. ; Zhou, Y. -G. Chem. Rev. 2012, 112, 2557; (h) He, Y. -M. ; Song, F. -T. ; Fan, Q. -H. Top. Curr. Chem. 2014, 343, 145; (i) Nagano, T. ; Iimuro, A. ; Yamaji, K. ; Kita, Y. ; Mashima, K. Heterocycles 2014, 88, 103; (j) Yuan, Q. ; Zhang, W. Chin. J. Org. Chem. 2016, 36, 274 (in Chinese). (袁乾家, 张万斌, 有机化学, 2016, 36, 274. ) (k) Chen, Z. -P. ; Zhou, Y. -G. Synthesis 2016, 48, 1769; (l) Zhang, Z. ; Butt, N. A. ; Zhang, W. Chem. Rev. 2016, 116, 14769; (m) Wang, H. ; Zheng, Y. ; Pan, Z. ; Fu, H. ; Ling, F. ; Zhong, W. Chin. J. Org. Chem. 2017, 37, 301 (in Chinese). (王辉, 郑亿, 潘振涛, 傅鸿樑, 凌飞, 钟为慧, 有机化学, 2017, 37, 301. ); (n) Liu, Y. ; Du, H. Acta Chim. Sinica 2014, 72, 771 (in Chinese). (刘勇兵, 杜海峰, 化学学报, 2014, 72, 771. ); (o) Wang, D. ; Hou, C. ; Chen, L. ; Liu, X. ; An, Q. ; Hu, X. Chin. J. Org. Chem. 2013, 33, 1355. (in Chinese). (王东, 侯传金, 陈丽凤, 刘小宁, 安庆大, 胡向平, 有机化学, 2013, 33, 1355. ) (p) Li, C. ; Xiao, J. J. Am. Chem. Soc. 2008, 130, 13208; (q) Ding, Z. -Y. ; Chen, F. ; Qin, J. ; He, Y. -M. ; Fan, Q. -H. Angew. Chem. , Int. Ed. 2012, 51, 5706; (r) Guo, C. ; Sun, D. -W. ; Yang, S. ; Mao, S. -J. ; Xu, X. -H. ; Zhu, S. -F. ; Zhou, Q. -L. J. Am. Chem. Soc. 2015, 137, 90; (s) Zhou, H. ; Liu, Y. ; Yang, S. Angew. Chem. , Int. Ed. 2017, 56, 2725.
-
[8]
Huang, W.-X.; Yu, C.-B.; Shi, L.; Zhou, Y.-G. Org. Lett. 2014, 16, 3324. doi: 10.1021/ol5013313
-
[9]
Hu, S.-B.; Chen, Z.-P.; Song, B.; Wang, J.; Zhou, Y.-G. Adv. Synth. Catal. 2017, 359, 2762. doi: 10.1002/adsc.v359.16
-
[10]
(a) Xiao, D. ; Zhang, X. Angew. Chem. , Int. Ed. 2001, 40, 3425; (b) Wang, D. -W. ; Wang, X. -B. ; Wang, D. -S. ; Lu, S. -M. ; Zhou, Y. -G. ; Li, Y. -X. J. Org. Chem. 2009, 74, 2780; (c) Ji, Y. ; Shi, L. ; Chen, M. -W. ; Feng, G. -S. ; Zhou, Y. -G. J. Am. Chem. Soc. 2015, 137, 10496.
-
[1]
-
表 1 反应条件的优化
Table 1. Optimization of reaction conditions

Entry a Solvent L Conv.b/% eec/% 1 THF L1 74 13 2d THF L1 >95 7 3 Dioxane L1 82 30 4 Toluene L1 78 40 5 Benzene L1 77 39 6 DCM L1 67 3 7 MeOH L1 8 4 8 Toluene L2 78 47 9 Toluene L3 90 48 10 Toluene L4 91 89 11 Toluene L5 64 32 12e Toluene L4 92 91 13f Toluene L4 >95 90 a Reaction conditions: 1a (0.2 mmol), [Ir(COD)Cl]2 (1 mol%), L (2.2 mol%), H2 (500 psi), solvent (3.0 mL), 24 h, 40 ℃. b Determined by 1H NMR spectroscopy. c Determined by HPLC analysis. d I2 (10 mol%). e [Ir(COD)Cl]2 (1.5 mol%), L4 (3.3 mol%). f [Ir(COD)Cl]2 (1.5 mol%), L4 (3.3 mol%), 48 h. 表 2 3, 4-二氢吡咯[1, 2-a]并吡嗪底物的拓展
Table 2. Substrate scope of 3, 4-dihydropyrrolo[1, 2-a]pyrazines

Entrya R1 R2 R3 Yieldb/% eec/% 1 Ph H H 98 (2a) 91 (+) 2 2-FC6H4 H H 95 (2b) 95 (+) 3 3-FC6H4 H H 97 (2c) 94 (+) 4 4-FC6H4 H H 93 (2d) 90 (+) 5d 4-ClC6H4 H H 92 (2e) 89 (R) 6 4-BrC6H4 H H 95 (2f) 89 (+) 7 4-F3CC6H4 H H 95 (2g) 88 (+) 8 4-MeC6H4 H H 92 (2h) 90 (+) 9 3-MeC6H4 H H 93 (2i) 90 (+) 10 3, 5-Me2C6H3 H H 98 (2j) 95 (+) 11 Cy H H 92 (2k) 86 (+) 12 Ph H Br 94 (2l) 89 (-) 13 Ph H Ph 91 (2m) 93 (-) 14 Ph H 4-MeC6H4 95 (2n) 94 (-) 15 Ph Br Br 97 (2o) 94 (-) a Reaction conditions: 1 (0.3 mmol), [Ir(COD)Cl]2 (1.5 mol%), L4 (3.3 mol%), H2 (500 psi), toluene (3.0 mL), 40 ℃, 48 h. b Isolated yields. c Determined by HPLC analysis. d The absolute configuration of the known compound 2e was assigned to be R by comparison of the specific rotation values with the reported data in Ref. 5 and the remaining configurations were assumed by analogy. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 14
- 文章访问数: 2548
- HTML全文浏览量: 433


 下载:
下载:


 下载:
下载:

