 图式1
靛红衍生物生成二烯醇类型物种及其转化
Scheme1.
Transformations of dienolate species from isatin derivatives
图式1
靛红衍生物生成二烯醇类型物种及其转化
Scheme1.
Transformations of dienolate species from isatin derivatives

Citation: Shi Minglin, Zhan Gu, Du Wei, Chen Yingchun. Direct Asymmetric Aza-Vinylogous Mannich Reaction of Nitrones from Isatins and Ketimines[J]. Acta Chimica Sinica, 2017, 75(10): 998-1002. doi: 10.6023/A17060277

靛红衍生的硝酮与酮亚胺的不对称直接氮杂插烯Mannich反应
-
关键词:
- 不对称催化
- / 有机催化
- / 插烯Mannich反应
- / 硝酮
- / 酮亚胺
English
Direct Asymmetric Aza-Vinylogous Mannich Reaction of Nitrones from Isatins and Ketimines
-
Key words:
- asymmetric catalysis
- / organocatalysis
- / vinylogous Mannich reaction
- / nitrones
- / ketimines
-
1 引言
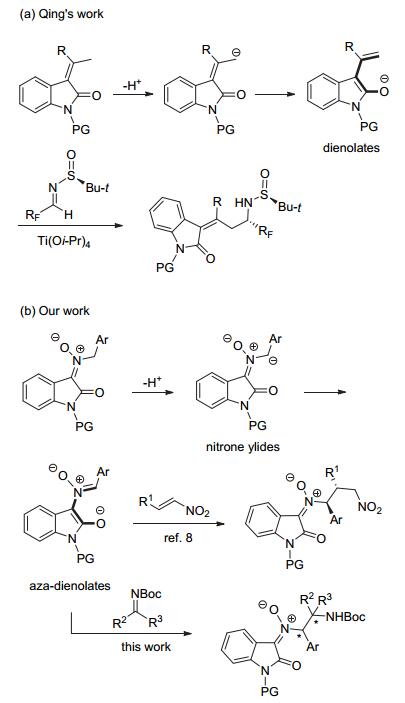
不对称插烯Mannich反应是一种高效构建碳碳键的方法, 通过二烯醇醚中间体的γ-位对亚胺进行加成, 从而生成手性δ-氨基-α, β-不饱和羰基化合物[1].由于直接插烯Mannich反应不需要预先制备二烯醇硅醚类化合物, 而是原位脱质子化生成活性二烯醇负离子参与反应, 因此具有便捷、原子经济性等优点更受化学家们的青睐.这类反应主要以γ-丁烯酸内酯及类似物[2]和α, α-二氰基烯烃[3]作为亲核试剂, 其γ-CH具有较强酸性能在金属或叔胺直接活化下进攻亚胺类化合物, 而其他类型的亲核试剂研究相对较少.因此探索新型插烯亲核试剂是该领域重要发展方向之一.
最近, 殷亮小组在线型二烯醇中引入吡唑基团, 在铜(I)配合物活化下与亚胺发生了高区域、高立体选择性的直接插烯甚至插二烯Mannich反应[4].另外, 靛红骨架也可作为强拉电子官能团, 其3-烯烃衍生物能在温和碱性条件下生成二烯醇负离子, 实现γ-位的官能团化[5].卿凤翎小组研究了Ti(Oi-Pr)4催化下3-烯基-2-氧化吲哚与手性二氟亚磺酰基亚胺的插烯Mannich反应[6] (Scheme 1a).但该方法是通过原料诱导生成手性产物, 与不对称催化策略相比不具优势.最近, 我们小组设计并合成了一类靛红衍生并含N-CH结构的硝酮化合物, 能在叔胺等温和碱性条件下生成硝酮叶立德中间体, 并与经手性亚胺盐机制活化的α, β-不饱和醛发生形式[3+2]环加成反应[7].更有意思的是, 该叶立德可转化为类似氮杂二烯醇中间体, 在新产生的硝酮部位与硝基烯烃发生极性反转的不对称直接氮杂插烯Michael加成反应, 生成手性硝酮衍生物而不发生上述的关环反应[8] (Scheme 1b).因此, 我们希望利用此类简单易得的硝酮化合物进一步发展不对称氮杂插烯Mannich反应.下面我们将系统报道该反应的结果.
2 不对称直接氮杂插烯Mannich反应的结果与讨论
2.1 不对称氮杂插烯Mannich反应条件的筛选
我们选择N-Boc保护的靛红衍生的硝酮1a和靛红酮亚胺[9]2a作为模板反应, 在奎尼丁衍生的叔胺硫脲双功能催化剂C1作用下[10], 于50 ℃在甲苯中反应36 h, 以较好的收率和立体控制得到了所期望的γ-选择性Mannich反应产物3a (表 1, Entry 1).以方酰胺为氢键供体的叔胺C2为催化剂也可以顺利得到产物, 但对映选择性有所下降(Entry 2).随后, 我们采用不同金鸡纳碱骨架的叔胺硫脲催化剂C3~C5 (Entries 3~5), 发现辛可宁衍生的催化剂C5可实现非常优异的立体选择性(>19:1 dr, 98% ee).通过进一步筛选, 我们发现该反应在多种溶剂中均有较高的活性(Entries 6~9), 当使用二甲苯作为溶剂时获得最好的收率和对映选择性, 且反应时间缩短为24 h (Entry 9).我们还尝试降低反应温度至40 ℃, 反应时间延长, 收率略微下降, 但是对立体控制并无影响(Entry 10).另一方面, 我们也尝试降低催化剂用量, 当降至10 mol%时, 对反应基本无影响, 甚至底物放大至1.0 mmol规模, 也能获得相当的结果(Entry 11);但降至5 mol%时, 收率明显下降(Entry 12).因此, 最终确定反应的最优条件为以二甲苯为溶剂, 以10 mol% C5为催化剂, 在50 ℃下反应.
 表 1
硝酮1a与亚胺2a的不对称氮杂插烯Mannich反应条件筛选
Table 1.
Screening studies on the asymmetric aza-vinylogous Mannich reaction of nitrone 1a and imine 2aa
表 1
硝酮1a与亚胺2a的不对称氮杂插烯Mannich反应条件筛选
Table 1.
Screening studies on the asymmetric aza-vinylogous Mannich reaction of nitrone 1a and imine 2aa

Entry C Solvent t/h Yieldb/% eec/% 1 C1 toluene 36 82 -79 2 C2 toluene 36 79 -66 3 C3 toluene 36 81 -27 4 C4 toluene 30 74 96 5 C5 toluene 30 89 98 6 C5 DCE 36 92 84 7 C5 THF 60 82 76 8 C5 PhCF3 24 93 92 9 C5 xylene 24 96 99 10d C5 xylene 48 93 99 11e C5 xylene 24 (24) 91 (86) 99 (98) 12f C5 xylene 48 77 95 aUnless noted otherwise, reactions were performed with 1a (0.1 mmol), 2a (0.11 mmol), catalyst C (20 mol%) in solvent (1.0 mL) at 50 ℃. bIsolated yield. cDetermined by HPLC analysis on a chiral stationary phase. d At 40 ℃. e With 10 mol% of C5. Data in parentheses were obtained with 1.0 mmol of 1a. f With 5 mol% of C5. 2.2 不对称直接氮杂插烯Mannich反应
在确定了优化的反应条件后, 我们对不对称直接氮杂插烯Mannich反应的底物普适性进行了考察, 总结数据见表 2.首先我们采用带有各种取代基的靛红亚胺类底物, 分别与N-苄基硝酮1a进行反应.我们发现当在亚胺的芳环骨架上引入吸电子基团时, 能以优异的收率和立体控制得到相应加成产物(表 2, Entries 2~6);而当其引入供电子基团时, 反应速率和对映选择性略微有所下降(Entries 7~8).随后我们考察了硝酮底物氧化吲哚骨架取代基对反应的影响:具有供电子和吸电子取代基的硝酮和靛红亚胺2a的反应均能以良好的收率和对映选择性得到相应产物(Entries 9~14).另外, 不同N-烷基羟胺与靛红缩合而得的硝酮也被应用于反应体系中.对于含吸电子苄基的硝酮化合物, 反应可以顺利进行(Entries 15~17), 其中2-溴苯环由于位阻因素导致反应收率降低(Entry 15).另一方面, 对于含给电子苄基和萘甲基的硝酮化合物, 反应活性降低, 需要增加催化剂用量至20 mol%才能取得良好收率以及良好到优异的对映选择性(Entries 18~20).另外, 含N-烯丙基类结构的硝酮化合物也能应用, 虽然反应活性和对映选择性都有所降低(Entries 21 and 22).遗憾的是含简单N-脂肪烷基的硝酮底物反应活性很低, 即使添加Lewis acid等添加剂也未能成功[8].
 表 2
不对称氮杂插烯Mannich反应的底物普适性
Table 2.
Substrate scope of asymmetric aza-vinylogous Mannich reactions between nitrones 1 and imines 2a
表 2
不对称氮杂插烯Mannich反应的底物普适性
Table 2.
Substrate scope of asymmetric aza-vinylogous Mannich reactions between nitrones 1 and imines 2a

Entry R, R1 R2 t/h Yieldb/% eec/% 1 H, Ph H 24 3a, 91 99 2 H, Ph 5-F 24 3b, 92 97 3 H, Ph 5-Cl 24 3c, 95 >99 4 H, Ph 5-Br 24 3d, 97 96 5 H, Ph 6-Br 24 3e, 96 98 6 H, Ph 7-F 24 3f, 95 98 7 H, Ph 5-Me 30 3g, 95 93 8 H, Ph 5-OMe 30 3h, 96 86 9 5-F, Ph H 24 3i, 93 88 10 5-Cl, Ph H 24 3j, 94 93 11 5-Br, Ph H 24 3k, 97 97 12 6-Br, Ph H 24 3l, 90 95 13 5-Me, Ph H 32 3m, 92 86 14 5-OMe, Ph H 32 3n, 91 95 15 H, 2-BrC6H4 H 24 3o, 77 87 16 H, 3-BrC6H4 H 24 3p, 96 97 17 H, 4-ClC6H4 H 24 3q, 92 93 18d H, 4-MeC6H4 H 30 3r, 89 97 19d H, 4-OMeC6H4 H 48 3s, 85 97 20 H, 1-naphthyl H 36 3t, 76 96 21d H, 2-styryl H 72 3u, 70 83 22d H, 
H 48 3v, 89 87 aUnless noted otherwise, reactions were performed with 1 (0.1 mmol), 2 (0.11 mmol), amine C5 (10 mol%) in solvent (1.0 mL) at 50 ℃. bIsolated yield. cDetermined by HPLC analysis on a chiral stationary phase. d With 20 mol% of C5. 2.3 产物衍生化
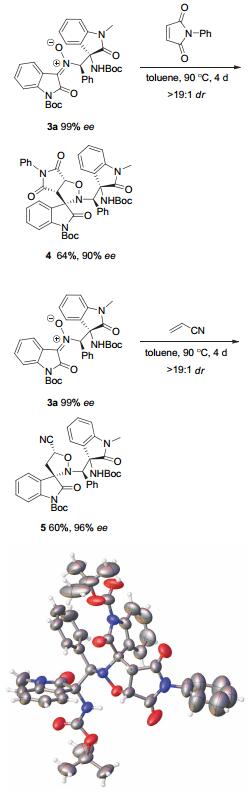
由于氮杂插烯Mannich反应的产物中仍然保留了硝酮官能团, 可以作为1, 3-偶极子分别与N-苯基马来酰亚胺以及丙烯腈发生传统的[3+2]偶极环加成反应, 分别生成含有氢化噁唑环的吲哚螺环骨架4和5.由于立体位阻等原因, 反应需要在高温条件下反应4天, 产物的对映选择性略微有所降低, 不过反应显示了非常优异的非对映选择性(Scheme 2).另外, 如下图所示, 手性产物4的结构经单晶衍射确定[11], 从而也可确定上述氮杂Mannich加成产物3的绝对构型.
3 结论
我们运用本小组发展的新型氮杂插烯亲核试剂——靛红衍生的硝酮化合物, 在金鸡纳碱衍生的叔胺硫脲催化剂作用下, 通过原位形成氮杂二烯醇负离子与靛红亚胺发生不对称直接插烯类型Mannich反应.该反应显示出良好的远端γ-位选择性, 以优秀的对映选择性(83%~99% ee)和非对映选择性(>19:1 dr)获得了氮杂插烯Mannich加成产物, 且能够进一步与缺电子烯烃发生[3+2]偶极环加成反应构建含有氢化噁唑环的螺环氧化吲哚复杂骨架.此工作展示了靛红衍生的硝酮作为氮杂插烯亲核试剂的新应用, 且这类化合物可能在不对称合成中有更加广阔的空间.
4 实验部分
下面为制备直接氮杂插烯Mannich反应与[3+2]环加成产物通用方法.底物和催化剂的制备方法参考文献, 见支持信息(Supporting Information).
4.1 氮杂Mannich加成产物的制备方法
硝酮1 (0.1 mmol)、亚胺2 (0.11 mmol)、催化剂C5 (0.01 or 0.02 mmol)混溶于二甲苯(1.0 mL)中, 于50 ℃下搅拌反应, 通过TLC监测直至原料1消失.柱层析(石油醚/乙酸乙酯=15:1 to 5:1) 得到加成产物3.
典型化合物的谱图数据如下:
3a, 黄色固体, 91% yield; >19:1 dr, [α]D20+16.6 (c 2.20 in CHCl3); 99% ee, 通过HPLC分析[Daicel chiralcel OD-H, 正己烷/异丙醇=90/10, 1.0 mL/min, λ=254 nm, t(major)=5.58 min, t(minor)=7.06 min]; 1H NMR (400 MHz, CDCl3) δ: 8.57 (d, J=7.6 Hz, 1H), 7.74 (d, J=8.0 Hz, 1H), 7.61 (d, J=7.6 Hz, 2H), 7.42~7.35 (m, 3H), 7.29 (t, J=7.6 Hz, 2H), 7.24~7.19 (m, 2H), 7.02 (brs, 1H), 6.82~6.76 (m, 3H), 3.19 (s, 3H), 1.65 (s, 9H), 1.23 (s, 9H); 13C NMR (100 MHz, CDCl3) δ: 174.4, 159.0, 154.3, 148.3, 143.4, 137.3, 134.6, 132.5, 131.8, 130.9, 129.6, 129.2, 128.0, 126.6, 125.6, 125.3, 124.8, 121.9, 118.1, 114.3, 108.1, 85.0, 80.3, 72.2, 64.6, 28.0, 27.9, 26.4; ESI-HRMS: calcd for C34H36N4O7+Na+635.2476, found 635.2470.
4.2 [3+2]环加成产物的制备方法
插烯Mannich加成产物3a (61.2 mg, 0.1 mmol)与N-苯基马来酰亚胺(26.0 mg, 0.15 mmol)或丙烯腈(0.15 mmol)混溶于甲苯(1.0 mL)中, 于90 ℃下搅拌96 h.柱层析(石油醚/乙酸乙酯=4:1) 得到环加成物4或5.
典型化合物的谱图数据如下:
4, 白色固体, 64% yield; >19:1 dr, [α]D20+19.8 (c 1.00 in CHCl3); 90% ee, 通过HPLC分析[Daicel chiralpak IF, 正己烷/异丙醇=60/40, 1.0 mL/min, λ=254 nm, t(major)=8.58 min, t(minor)=11.14 min]; 1H NMR (400 MHz, CDCl3) δ: 7.79 (brs, 2H), 7.52~7.49 (m, 4H), 7.29~7.26 (m, 5H), 7.19~7.08 (m, 3H), 6.92 (brs, 1H), 6.84 (brs, 1H), 6.46 (d, J=7.6 Hz, 1H), 6.33 (brs, 2H), 5.50 (d, J=7.6 Hz, 1H), 4.07 (brs, 2H), 2.56 (s, 3H), 1.45 (s, 9H), 1.25 (s, 9H); 13C NMR (100 MHz, CDCl3) δ: 174.4, 160.8, 158.8, 158.4, 154.3, 148.3, 143.5, 134.5, 134.4, 133.5, 133.5, 131.6, 131.0, 129.8, 129.4, 128.1, 126.6, 125.7, 122.1, 119.3, 119.2, 119.0, 118.8, 115.6, 115.6, 112.6, 112.3, 108.2, 85.3, 80.5, 72.7, 64.6, 28.1, 28.0, 26.9, 26.5; ESI-HRMS: calcd for C44H43N5O9+Na+808.2953, found 808.2957.
-
-
[1]
(a) Schneider, C.; Sickert, M. In Chiral Amine Synthesis, Ed.:Nugent, T. C., Wiley-VCH, Weinheim, 2010.
(b) Roselló, M. S.; del Pozo, C.; Fustero, S. Synthesis 2016, 48, 2553.
(c) Martin, S. F. Acc. Chem. Res. 2002, 35, 895. -
[2]
(a) Yamaguchi, A.; Matsunaga, S.; Shibasaki, M. Org. Lett. 2008, 10, 2319.
(b) Shepherd, N. E.; Tanabe, H.; Xu, Y.; Matsunaga, S.; Shibasaki, M. J. Am. Chem. Soc. 2010, 132, 3666.
(c) Zhou, L.; Lin, L.; Ji, J.; Xie, M.; Liu, X.; Feng, X. Org. Lett. 2011, 13, 3056.
(d) Guo, Y.-L.; Bai, J.-F.; Peng, L.; Wang, L.-L.; Jia, L.-N.; Luo, X.-Y.; Tian, F.; Xu, X.-Y.; Wang, L.-X. J. Org. Chem. 2012, 77, 8338.
(e) Yin, L.; Takada, H.; Kumagai, N.; Shibasaki, M. Angew. Chem. Int. Ed. 2013, 125, 7451.
(f) Guo, Y.; Zhang, Y.; Qi, L.; Tian, F.; Wang, L. RSC Adv. 2014, 4, 27286.
(g) Nakamura, S.; Yamaji, R.; Hayashi, M. Chem. Eur. J. 2015, 21, 9615. -
[3]
(a) Liu, T.-Y.; Cui, H.-L.; Long, J.; Li, B.-J.; Wu, Y.; Ding, L.-S.; Chen, Y.-C. J. Am. Chem. Soc. 2007, 129, 1878.
(b) Niess, B.; Jϕrgensen, K. A. Chem. Commun. 2007, 1620.
(c) Chen, Q.-A.; Zeng, W.; Wang, D.-W.; Zhou, Y.-G. Synlett 2009, 2009, 2236.
(d) Xiong, X.-F.; Jia, Z.-J.; Du, W.; Jiang, K.; Liu, T.-Y.; Chen, Y.-C. Chem. Commun. 2009, 6994.
(e) Cheng, C.; Lu, X.; Ge, L.; Chen, J.; Cao, W.; Wu, X.; Zhao, G. Org. Chem. Front. 2017, 4, 101. -
[4]
Zhang, H.-J.; Shi, C.-Y.; Zhong, F.; Yin, L. J. Am. Chem. Soc. 2017, 139, 2196. doi: 10.1021/jacs.6b13042
-
[5]
(a) Curti, C.; Rassu, G.; Zambrano, V.; Pinna, L.; Pelosi, G.; Sartori, A.; Battistini, L.; Zanardi, F.; Casiraghi, G. Angew. Chem. Int. Ed. 2012, 51, 6200.
(b) Rassu, G.; Zambrano, V.; Pinna, L.; Curti, C.; Battistini, L.; Sartori, A.; Pelosi, G.; Zanardi, F.; Casiraghi, G. Adv. Synth. Catal. 2013, 355, 1881.
(c) Chen, Q.; Wang, G.; Jiang, X.; Xu, Z.; Lin, L.; Wang, R. Org. Lett. 2014, 16, 1394.
(d) Ranieri, B.; Sartori, A.; Curti, C.; Battistini, L.; Rassu, G.; Pelosi, G.; Casiraghi, G.; Zanardi, F. Org. Lett. 2014, 16, 932.
(e) Di Iorio, N.; Righi, P.; Ranieri, S.; Mazzanti, A.; Margutta, R. G.; Bencivenni, G. J. Org. Chem. 2015, 80, 7158.
(f) Xiao, X.; Mei, H.; Chen, Q.; Zhao, X.; Lin, L.; Liu, X.; Feng, X. Chem. Commun. 2015, 51, 580.
(g) Zheng, C.; Chen, W.-X.; Chen, F.-E. Asian J. Org. Chem. 2015, 4, 1044.
(h) Han, J.-L.; Chang, C.-H. Chem. Commun. 2016, 52, 2322.
(i) Tian, L.; Hu, X.-Q.; Li, Y.-H.; Xu, P.-F. Chem. Commun. 2013, 49, 7213.
(j) Sun, Q.; Li, X.; Su, J.; Zhao, L.; Ma, M.; Zhu, Y.; Zhao, Y.; Zhu, R.; Yan, W.; Wang, K.; Wang, R. Adv. Synth. Catal. 2015, 357, 3187.
(k) Li, X.; Su, J.; Liu, Z.; Zhu, Y.; Dong, Z.; Qiu, S.; Wang, J.; Lin, L.; Shen, Z.; Yan, W.; Wang, K.; Wang, R. Org. Lett. 2016, 18, 956. -
[6]
Liu, Y.; Yang, Y.; Huang, Y.; Xu, X.-H.; Qing, F.-L. Synlett 2015, 26, 67.
-
[7]
(a) Chen, Y.-R.; Zhan, G.; Du, W.; Chen, Y.-C. Adv. Synth. Catal. 2016, 358, 3759. For other examples with nitrone ylides, see:
(b) Hanessian, S.; Bayrakdarian, M. Tetrahedron Lett. 2002, 43, 967.
(c) Hanessian, S.; Bayrakdarian, M. Tetrahedron Lett. 2002, 43, 9441.
(d) Merino, P.; Tejero, T.; Díez-Martínez, A.; Gültekin, Z. Eur. J. Org. Chem. 2011, 2011, 6567.
(e) Merino, P.; Tejero, T.; Díez-Martínez, A. J. Org. Chem. 2014, 79, 2189.
(f) Juste-Navarro, V.; Delso, L.; Tejero, T.; Merino, P. Chem. Eur. J. 2016, 22, 11527.
(g) Prieto, L.; Juste-Navarro, V.; Uria, U.; Delso, I.; Reyes, E.; Tejero, T.; Carrillo, L.; Merino, P.; Vicario, J. L. Chem. Eur. J. 2017, 23, 2764. -
[8]
Zhan, G.; Shi, M.-L.; Lin, W.-J.; Ouyang, Q.; Du, W.; Chen, Y.-C. Chem. Eur. J. 2017, 23, 6286. doi: 10.1002/chem.201701290
-
[9]
For selected examples, see:(a) Feng, J.; Yan, W.; Wang, D.; Li, P.; Sun, Q.; Wang, R. Chem. Commun. 2012, 48, 8003.
(b) Hara, N.; Nakamura, S.; Sano, M.; Tamura, R.; Funahashi, Y.; Shibata, N. Chem. Eur. J. 2012, 18, 9276.
(c) Yan, W.; Wang, D.; Feng, J.; Li, P.; Zhao, D.; Wang, R. Org. Lett. 2012, 14, 2512.
(d) Zhao, J.; Fang, B.; Luo, W.; Hao, X.; Liu, X.; Lin, L.; Feng, X. Angew. Chem. Int. Ed. 2015, 54, 241.
(e) Wang, Y.; Cao, Z.; Niu, Y.; Zhao, X.; Zhou, J. Acta Chim. Sinica 2014, 72, 867. (王雨卉, 曹中艳, 牛艳霏, 赵小莉, 周剑, 化学学报, 2014, 72, 867.)
(f) Liu, Y.-L.; Zhou, J. Chem. Commun. 2013, 49, 4421.
(g) Yin, X.; Xue, P.; Dong, K.; Liao, K.; Zhou, F.; Zhou, J. Acta Chim. Sinica 2015, 73, 685. (尹小平, 徐鹏巍, 董坤, 廖奎, 周锋, 周剑, 化学学报, 2015, 73, 685.) -
[10]
(a) Li, B.-J.; Jiang, L.; Liu, M.; Chen, Y.-C.; Ding, L.-S.; Wu, Y. Synlett 2005, 603.
(b) Connon, S. J. Chem. Commun. 2008, 2499.
(c) Takemoto, Y. Chem. Pharm. Bull. 2010, 58, 593.
(d) Taylor, M. S.; Jacobsen, E. N. Angew. Chem. Int. Ed. 2006, 45, 1520. -
[11]
CCDC-1558319(4) contains the supplementary crystallographic data for this paper. These data can be obtained free of charge from the Cambridge Crystallographic Data Centre via www.ccdc.cam.ac.uk/data_request/cif.
-
[1]
-
表 1 硝酮1a与亚胺2a的不对称氮杂插烯Mannich反应条件筛选
Table 1. Screening studies on the asymmetric aza-vinylogous Mannich reaction of nitrone 1a and imine 2aa

Entry C Solvent t/h Yieldb/% eec/% 1 C1 toluene 36 82 -79 2 C2 toluene 36 79 -66 3 C3 toluene 36 81 -27 4 C4 toluene 30 74 96 5 C5 toluene 30 89 98 6 C5 DCE 36 92 84 7 C5 THF 60 82 76 8 C5 PhCF3 24 93 92 9 C5 xylene 24 96 99 10d C5 xylene 48 93 99 11e C5 xylene 24 (24) 91 (86) 99 (98) 12f C5 xylene 48 77 95 aUnless noted otherwise, reactions were performed with 1a (0.1 mmol), 2a (0.11 mmol), catalyst C (20 mol%) in solvent (1.0 mL) at 50 ℃. bIsolated yield. cDetermined by HPLC analysis on a chiral stationary phase. d At 40 ℃. e With 10 mol% of C5. Data in parentheses were obtained with 1.0 mmol of 1a. f With 5 mol% of C5. 表 2 不对称氮杂插烯Mannich反应的底物普适性
Table 2. Substrate scope of asymmetric aza-vinylogous Mannich reactions between nitrones 1 and imines 2a

Entry R, R1 R2 t/h Yieldb/% eec/% 1 H, Ph H 24 3a, 91 99 2 H, Ph 5-F 24 3b, 92 97 3 H, Ph 5-Cl 24 3c, 95 >99 4 H, Ph 5-Br 24 3d, 97 96 5 H, Ph 6-Br 24 3e, 96 98 6 H, Ph 7-F 24 3f, 95 98 7 H, Ph 5-Me 30 3g, 95 93 8 H, Ph 5-OMe 30 3h, 96 86 9 5-F, Ph H 24 3i, 93 88 10 5-Cl, Ph H 24 3j, 94 93 11 5-Br, Ph H 24 3k, 97 97 12 6-Br, Ph H 24 3l, 90 95 13 5-Me, Ph H 32 3m, 92 86 14 5-OMe, Ph H 32 3n, 91 95 15 H, 2-BrC6H4 H 24 3o, 77 87 16 H, 3-BrC6H4 H 24 3p, 96 97 17 H, 4-ClC6H4 H 24 3q, 92 93 18d H, 4-MeC6H4 H 30 3r, 89 97 19d H, 4-OMeC6H4 H 48 3s, 85 97 20 H, 1-naphthyl H 36 3t, 76 96 21d H, 2-styryl H 72 3u, 70 83 22d H, 
H 48 3v, 89 87 aUnless noted otherwise, reactions were performed with 1 (0.1 mmol), 2 (0.11 mmol), amine C5 (10 mol%) in solvent (1.0 mL) at 50 ℃. bIsolated yield. cDetermined by HPLC analysis on a chiral stationary phase. d With 20 mol% of C5. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 1479
- HTML全文浏览量: 240


 下载:
下载:

 下载:
下载:

