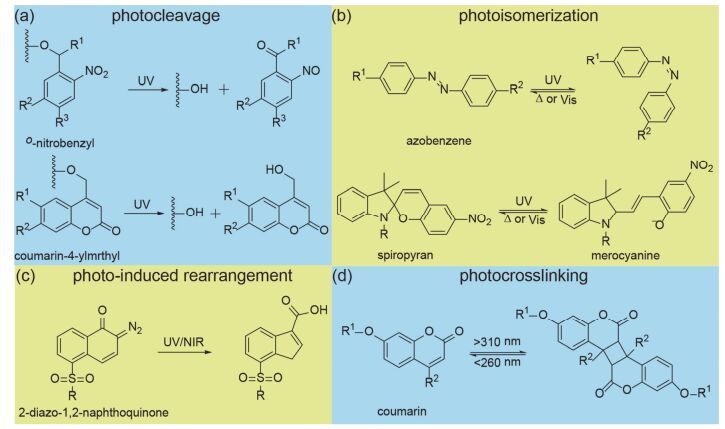
 图 1
光响应基团及其对光的响应机制
Figure 1.
Selected photo-responsive groups and their response mechanism
图 1
光响应基团及其对光的响应机制
Figure 1.
Selected photo-responsive groups and their response mechanism

Citation: Zhang Liuwei, Qian Ming, Wang Jingyun. Progress in Research of Photo-controlled Drug Delivery Systems[J]. Acta Chimica Sinica, 2017, 75(8): 770-782. doi: 10.6023/A17050194

光控释药型药物递送系统的研究进展
English
Progress in Research of Photo-controlled Drug Delivery Systems
-
Key words:
- photo-responsive
- / photo-controlled release
- / nanocarriers
- / drug delivery systems
- / cancer therapy
-
1 引言
肿瘤是威胁人类健康的杀手之一.目前, 化学药物治疗是最常用的癌症治疗手段之一, 但化疗药物缺乏肿瘤特异性, 患者常受到消化障碍、骨髓抑制、肝肾损伤及免疫功能下降等毒副作用的困扰.近年来, 纳米载体在肿瘤的靶向治疗及药物的可控释放等生物医学领域的应用日益受到人们的关注.理想的纳米载体应该具备高的载药量, 运输过程中低的药物泄露和有效的靶点药物可控释放.释药可控的药物递送系统(Controlled drug delivery systems)能够被人为控制实现治疗药物在病灶处(如肿瘤)可控快速释放, 克服了传统药物递送系统的诸多缺点(药物释放缓慢, 选择性差, 药物利用率低等).因此, 设计开发刺激响应触发的释药可控药物递送系统正受到科研工作者的广泛关注.构成可控释药递送系统的材料被称为“智能材料”, 他们可以对生物体的一些内部(pH、氧化还原、酶等)或外部(温度、电/磁、超声和光等)的刺激响应[1, 2], 响应前后, 材料发生组成或构象上的变化, 破坏递送系统原有的平衡, 从而使药物从递送系统中释放.而光是一种清洁, 无创和有效的刺激源.将特定波长的光用于肿瘤的精准治疗主要有光动力治疗[3, 4]、光热治疗[5, 6]、光声成像[7, 8]以及光控释放药物递送系统等, 在几种治疗系统中, 光控释药型药物递送体系通过调节光的波长和强度以及光照时间和空间, 实现药物在病灶部位的高浓度光控释放, 减少药物对正常部位的毒性, 因此光控释药的药物递送系统在生物医学领域有着巨大的应用价值和广阔的发展前景.本文介绍了四种光敏感基团的不同光响应机理, 对基于不同光响应机理的光控释药型药物递送系统的研究进展进行了综述, 指出现有光控释药型药物递送系统存在的问题及对未来的研究方向进行了展望.
2 具有光响应的光敏感基团
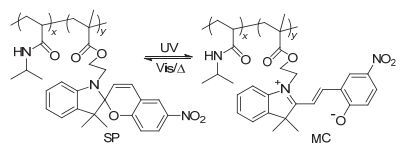
光控释药型药物递送系统(Photo-controlled drug delivery systems)由含有光敏感基团的材料制备而成.在特定波长光照条件下, 光敏感基团吸收光子能量引发光化学反应, 改变药物递送系统内部组成或构象从而达到控制药物释放的目的.目前, 根据光响应机理的不同, 光敏感基团有四种(图 1) [9~11]. (1) 光致断裂(photocleavage)的光敏感基团, 如邻硝基苄基氧(O-nitrobenzyl, ONB)和香豆素基团(coumarin-based groups)等(图 1a), 此类基团能够吸收光子的能量, 促使特定共价键的断裂. (2) 光致异构(photoisomerization)光敏感基团, 如偶氮苯(azobenzenes, Azo)和螺吡喃(spiropyran, SP)等.光照刺激能够使此类基团内部的双键进行顺反异构化反应或环闭合的反应(图 1b). (3) 光致重排(photo-induced rearrangement)光敏感基团, 如2-重氮-1, 2-萘醌(2-diazo-1, 2-naphthoquinone, DNQ)基团等(图 1c), DNQ吸收特定光子能量能够进行Wolff重排反应. (4) 光致交联(photocrosslinking)光敏感基团, 如香豆素(coumarin)、肉桂酰(cinnamoyl)和蒽(anthracene)等, 在光照刺激下, 香豆素(图 1d)或肉桂酰进行[2+2]环加成反应, 蒽进行[4+4]的环加成反应形成二聚体.
3 光控释药型药物递送系统
在传统的药物递送载体中合理地引入光敏感基团即可制备出光控释药的药物递送系统, 在特定光照下, 改变光照时间和位置, 光控释药系统结构的直接或间接改变实现药物在时空上的精确光控释放.根据引入的光敏基团对光响应机制不同, 光控释药型药物递送系统分为光致断裂型、光致异构型、光致重排型和光致交联型四种.下文分别对这四种光控释药型药物递送系统的设计制备、释药过程及在肿瘤治疗中的应用进行介绍.
3.1 光致断裂型药物递送系统
光致断裂型药物递送系统中含有光致断裂基团(如邻硝基苄基氧和香豆素基团等), 在紫外(UV)或近红外光(NIR)照射下发生化学键断裂反应, 引起药物递送系统结构改变而释放药物.根据引入光敏感基团位置的不同, 该类药物递送系统的设计策略主要有四种: (1) 光致断裂基团作为制备药物递送系统的两亲性分子的疏水部分, 通过光诱导共价键断裂来破坏药物递送系统内部亲疏水平衡, 释放药物[12~14]; (2) 光致断裂基团作为两亲性嵌段共聚物的连接臂, 光刺激嵌段共聚物主链断裂, 破坏药物递送系统释放药物[15~17]; (3) 光致断裂基团连接药物分子形成共聚物前药, 通过光诱导共价键断裂释放药物[18, 19]; (4) 光致断裂基团作为封堵药物的门控分子, 光触发“开门”释放药物[20, 21].
3.1.1 光致断裂基团作为疏水部分的药物递送系统
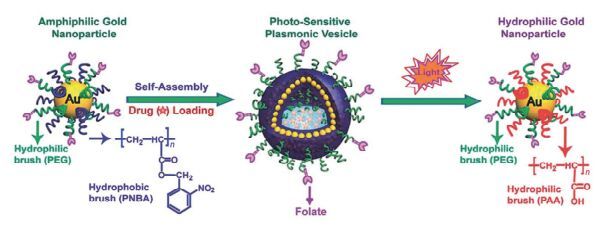
将疏水的光致断裂基团与亲水分子连接形成两亲性分子, 疏水的光致断裂基团成为自组装的药物递送系统的疏水核心, 在光照刺激, 疏水的光敏基团断裂, 破坏了递送系统的亲疏水平衡, 实现药物的光触发释放[22~30]. Hu等[31]将疏水的光致断裂ONB基团接枝到聚甲基丙烯酸酯的侧链上形成两亲性聚合物(图 2), 自组装形成纳米聚电解质复合物(polyelectrolyte complexes, PECs), 以疏水的尼罗红(Nile Red)作为药物模型, 在UV光(365 nm, 20 mW·cm-2, 5 min)的照射下实现了对Nile Red的光控制释放, 表明该递送系统可以实现对疏水药物的光触发释放. Fomina等[32]制备了侧链含有ONB基团的两亲性聚合物(图 3), 自组装包载疏水的Nile Red, 能够响应UV和NIR光的照射实现Nile Red快速的释放, 在UV光(350 nm)照射1 min后, Nile Red的荧光强度骤降了67%, 在4 h的NIR光(双光子, 750 nm, 照射20 min间歇10 min)照射期间观察到Nile Red的荧光强度逐渐降低, 而无光照时, Nile Red荧光强度没有变化, 证明通过调节光照参数可以实现对药物的精准释放. Song等[23]使用表面涂覆亲水性聚乙二醇(PEG)和疏水性聚丙烯酸酯(PNBA, 其中ONB为疏水侧链)的金纳米颗粒构建了光敏感的等离子体囊泡(Au@PEG/ PNBA)(图 4), 实验结果表明在UV光照15 min时, 装载阿霉素(DOX, 抗癌药物)的DOX/Au@PEG/PNBA载体实现了80%的阿霉素累积释放, 而对照组(DOX/ Au@PEG/PMMA和无光照处理的DOX/Au@PEG/ PNBA)没有明显的药物释放; 在DOX/Au@PEG/PNBA载体与MDA-MB-435细胞作用时, 光照组细胞存活率(<10%)显著小于无光照组(>80%), 表明Au@PEG/ PNBA药物递送系统具有很好的光触发释药的能力.
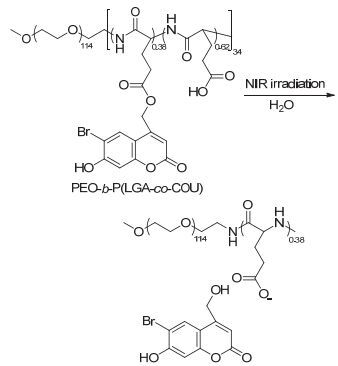
含有香豆素的光致断裂基团也可以作为两亲性聚合物的疏水侧链基团, 通过光照刺激触发药物递送系统的溶胀解体, 达到光控释药的目的. Kumar等[33]以溴羟基香豆素(Bromohydroxycoumarin, Bhc)为疏水基团, 接枝到聚谷氨酸ε-羧基上, 并与聚环氧乙烷(PEO)形成聚合物PEO-b-P (LGA-co-COU)(图 5), 自组装形成NIR光触发的药物递送载体, 在双光子激发光(794 nm)照射下, 装载利福平(Rifampicin, RIF)的载体在55 h后累积释放量大约75%, 远远高于无光照处理组(RIF累积释放量小于10%).装载紫杉醇(Paclitaxel, PTX)的载体在145 h后累计释放量达到了50%, 而无光照处理组PTX释放量可以忽略不计.这些结果表明以光致断裂基团为疏水核心纳米载体能够用于光触发药物递送系统, 并且能够获得很好的控制释放效果.
3.1.2 光致断裂基团作为连接臂的药物递送系统
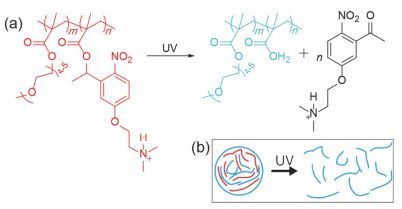
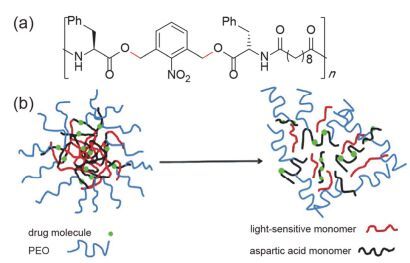
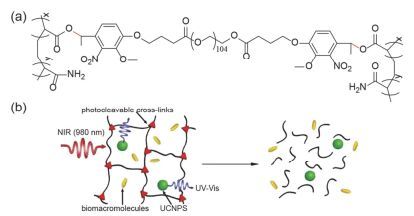
将光致断裂基团引入两亲性嵌段聚合物主链中, 在光照刺激下, 主链断裂破坏了两亲性嵌段聚合物自组装形成的递送系统, 实现药物的光控释放[34~42]. Lv等[43]将光不稳定的ONB基团引入聚合物主链, 制备了聚氨酯的纳米载体(图 6), 在UV光(365 nm, 11 mW·cm-2, 2 min)的照射下, 可以释放包载的模型药物(Tagalsin G).包载Tagalsin G (250 μg·mL-1)的纳米颗粒对RAW 264.7细胞几乎没有细胞毒性(9%), 而在光照情况下, 细胞死亡率达到了67%, 表明该纳米颗粒具有很好的光触发释药的效果. Soleimani等[44]制备了聚合物主链含有ONB的聚酯酰胺(PEA)纳米颗粒(图 7), 10 min的UV光照射获得了20%的药物释放(无光照组释放量小于3%). Yan等[45]用含有光响应基团ONB的聚丙烯酰胺-聚(乙二醇)交联剂制备了网格状的水凝胶分子(图 8a), 结合上转换纳米颗粒(upconversion nanoparticles UCNPs)实现了用NIR光作为刺激源控制药物释放的目的, 在NIR光的照射下, 水凝胶中的ONB基团断裂后, 通过凝胶-溶胶(gel-sol)转变破坏整个凝胶的结构, 释放所封装的生物大分子(图 8b), 实验结果显示在NIR光(980 nm, 5 W)照射57 min后装载的生物大分子(胰蛋白酶)累积释放量达到了72%, 这些结果说明掺杂UCNPs的光敏感水凝胶能够响应NIR光刺激, 释放装载的生物活性分子.
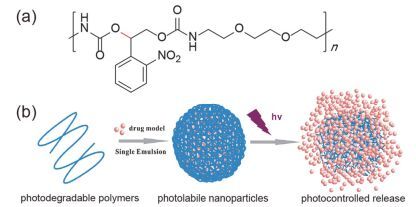 图 6
(a)光敏感聚氨酯分子结构; (b)疏水性模型药物和光敏感聚氨酯自组装成载药纳米颗粒, 在UV照射下, 聚合物主链降解释放药物[43]
Figure 6.
(a) The chemical structure of light-sensitive polyurethane molecules; (b) the drug-loaded nanoparticles are formed by the hydrophobic model drug and the light-sensitive polymer, which are degraded to release the drug under UV irradiation[43]
图 6
(a)光敏感聚氨酯分子结构; (b)疏水性模型药物和光敏感聚氨酯自组装成载药纳米颗粒, 在UV照射下, 聚合物主链降解释放药物[43]
Figure 6.
(a) The chemical structure of light-sensitive polyurethane molecules; (b) the drug-loaded nanoparticles are formed by the hydrophobic model drug and the light-sensitive polymer, which are degraded to release the drug under UV irradiation[43]
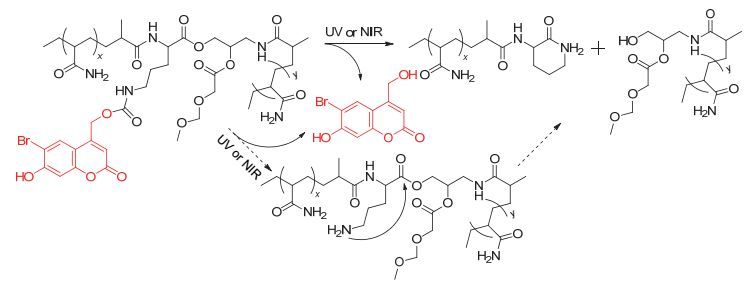
Lux等[16]将溴羟基香豆素(Bhc)连接在聚丙烯酰胺的侧链上形成聚丙烯酰胺凝胶, 在UV或NIR光的刺激下, 香豆素基团断裂并引发分子内自断裂反应, 移去香豆素基团的同时也破坏了聚合物主链结构(图 9), 从而使自组装形成的纳米载体解体, 释放亲水的包载物.以牛血清白蛋白(BSA)为模型包载药物的实验结果显示在UV光(365 nm, 15 min, 1 mW·cm-2)照射后, 10 h达到了100%药物释放, 而无光照组释放量小于20%.说明这一类含有光致断裂基团的嵌段共聚物自组装形成的纳米颗粒, 能够在光照的刺激下彻底破碎并完全释放包载物, 达到更好更快速的可控释药效果, 可将其用作光触发释药的药物递送系统.
3.1.3 光致断裂基团与药物形成前药的药物递送系统
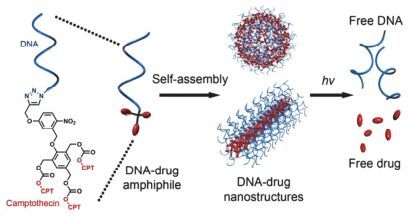
将抗癌药物分子通过光致断裂基团连接到纳米载体上形成聚合物前药, 可以有效地提高药物分子包封率, 避免药物分子提前释放, 大大降低药物的毒副作用[17, 18, 46, 47]. Wong等[48]将抗癌药物DOX和上转换纳米粒(UCN)通过ONB基团连接(图 10)形成UCN@(ONB-DOX)前药, 在NIR光(980 nm)的激发下, UCN发射的UV光(365 nm)触发ONB-DOX共价键断裂, 释放共价连接的DOX; 在UV光(365 nm)照射5 min时, DOX的累积释放量大于85%, 细胞毒性实验结果显示, 光照下的癌细胞存活力显著地降低. Tan等[49]将疏水性抗癌药物喜树碱(CPT)通过ONB与DNA共价连接, 形成的两亲性前药分子(DNA-CPT)自组装为DNA-药物的纳米结构(图 11), 用于光响应型药物递送系统的研究; 仅1 min的UV光(365 nm, 10 mW·cm-2)照射, 药物的累积释放量达到73%, 8 min照射时累积释放量超过了90%, 细胞毒性实验结果显示与游离CPT相比, 没有UV光处理时, DNA-CPT显示较低的毒性(IC50, 13 μmol/L vs 330 nmol/L), 用UV光处理时, DNA-CPT显示出与游离CPT相似的细胞毒性(IC50, 360 nmol/L).
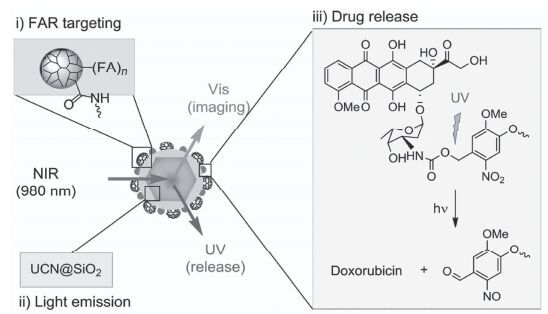
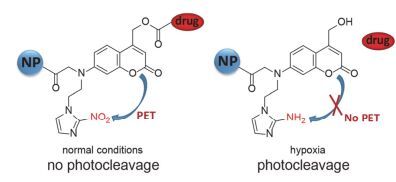
Lin等[50]设计了用于肿瘤中低氧微环境下光触发释放抗癌药物的递送系统, 壳聚糖与药物分子通过香豆素共价连接(图 12); 在正常组织中, 通过光诱导电子转移(PET)将光激发电子从香豆素基团转移到电子受体(硝基咪唑), 阻止了香豆素基团的光裂解反应, 只有在低氧条件下硝基咪唑被还原后, 香豆素基团才能发生光裂解反应释放连接的抗癌药物; 当暴露于可见光(λ>400 nm, 120 mW·cm-2, 20 min)时, 在低氧条件下纳米载体的药物释放量高达90%, 在NIR光(800 nm, 1 kHz, 12.7 mJ2 per pluse)照射20 min时, 药物释放量大约33%;细胞毒性结果显示在可见光(λ>400 nm, 120 mW·cm-2, 20 min)刺激下, 6 h孵育后, HeLa细胞的细胞存活率不到45%(而无光照组细胞存活率大约100%). Zhao等[51]设计合成了一种蛋黄-壳(yolk-shell)结构的NIR光调节药物释放的上转换纳米颗粒(YSUCNPs), 其中具有核-壳结构的上转换纳米粒(NaYF4:Yb, Tm@NaLuF4)作为蛋黄部分, 介孔二氧化硅作为壳包裹上转换纳米粒和前药分子(7-氨基-香豆素衍生物修饰的抗癌药物苯丁酸氮芥)(图 13).在980 nm光照射下, 上转换纳米粒发射365 nm的UV光触发前药分子中共价键断裂释放抗癌药物苯丁酸氮芥(ACCh), 光照处理15 h后药物释放量达68%, 细胞毒性显示有光照存在时细胞存活率小于50%, 而其他对照组细胞存活率均大于90%.该研究首次将光控释药递送系统成功的用于荷瘤小鼠的肿瘤治疗中, 结果显示:该递送体系能够减缓肿瘤的生长速率(图 13c), 并且延长荷瘤小鼠的存活时间.
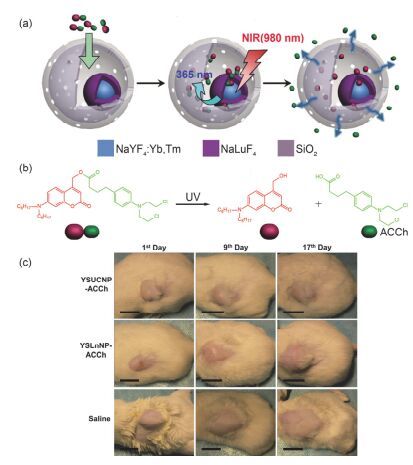 图 13
(a) YSUCNPs在NIR光触发下释放药物机理示意图; (b)前药分子UV光诱导断裂结构示意图; (c)荷瘤小鼠光触发治疗结果[51]
Figure 13.
(a) The exploited mechanisms for NIR-regulated release of drugs from YSUCNPs; (b) the photocleavage reaction of prodrugs under UV light; (c) photographs of tumor-bearing mice injected with YSUCNP-ACCh, YSLnNP-ACCh and saline on the 1st day, and after treatment on the 9th day and 17th day[51]
图 13
(a) YSUCNPs在NIR光触发下释放药物机理示意图; (b)前药分子UV光诱导断裂结构示意图; (c)荷瘤小鼠光触发治疗结果[51]
Figure 13.
(a) The exploited mechanisms for NIR-regulated release of drugs from YSUCNPs; (b) the photocleavage reaction of prodrugs under UV light; (c) photographs of tumor-bearing mice injected with YSUCNP-ACCh, YSLnNP-ACCh and saline on the 1st day, and after treatment on the 9th day and 17th day[51]
3.1.4 光致断裂基团作为门控分子的药物递送系统
利用光致断裂基团作为门控, 通过光照刺激实现门控释药也是光致断裂型药物递送系统的一种新的设计思路[20, 21]. Cui等[20]利用光致断裂基团ONB作为维持α-环糊精(α-CD)超分子纳米阀的塞子, 阻塞载药纳米颗粒的介孔来控制药物分子的释放(图 14), 当该纳米复合物用980 nm激光照射时, 通过上转换材料(吸收λ: 980 nm, 发射λ: 360 nm)转换发射的UV光可以断裂ONB基团, 使α-CD脱离并释放药物.体外释药实验结果显示, 在1.4 W·cm-2光照射时, 药物累积释放量高达81%(无光照组释药量小于4.5%), 细胞毒性实验结果显示, 在NIR照射时, HeLa细胞的存活率小于35%, 而对照组细胞存活率大于90%.此外在设计光致断裂型药物递送系统时, 除了常用的邻硝基苄基氧和香豆素基团之外, 其他的光致断裂基团也得到一些学者的关注, 例如: N-羟基邻苯二甲酰亚胺甲基丙烯酸酯(N-hydroxyphthalimide methacrylate)[52, 53], 1-乙酰基芘(1-Acetylpyrene)[54, 55], 苝(Perylene)[56, 57], 钌配合物(Ruthenium complex)[58]等.
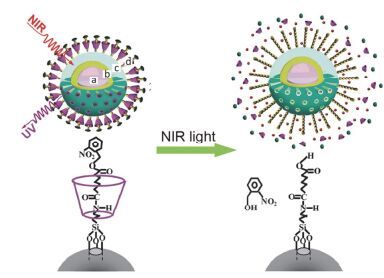 图 14
NIR光触发药物释放上转换纳米载药颗粒与光控释药过程[20]
Figure 14.
Near-infrared light-triggered drug release of up-conversion nanoparticles and the process of light-controlled drug release
图 14
NIR光触发药物释放上转换纳米载药颗粒与光控释药过程[20]
Figure 14.
Near-infrared light-triggered drug release of up-conversion nanoparticles and the process of light-controlled drug release
3.2 光致异构型药物递送系统
光致异构型药物递送系统是一类含有光致异构化基团的光响应性药物递送系统.偶氮苯(Azo)是光异构化分子的典型代表, 在UV光(300~400 nm)的刺激下, 偶氮苯可由反式(trans)构象转变为顺式(cis)构象, 而在可见光(>400 nm)的刺激下则可实现cis构象向trans构象的转变(图 1b).螺吡喃(SP)也是一种常见的光异构化分子, 在UV光的刺激下可实现cis构象向trans构象的转变, 并引起分子内断键开环形成开环体, 开环体在可见光的刺激下由trans构象转变为cis构象并闭环形成闭环体.这种光异构化分子的trans-cis构象转变能够引起相应载药纳米载体内部结构的改变, 达到光控释药的效果[59, 60].
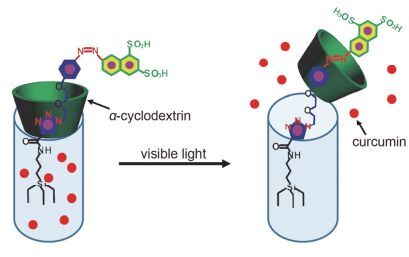
基于非共价键的超分子化学已经逐渐成为构建两亲性分子的一种常用的方法, 而偶氮苯和环糊精就是一个典型的超分子组装体系.通过偶氮苯与环糊精的结合实现光触发药物递送是偶氮苯最常用的方式之一[61~64], Zhao等[65]将合成的两亲性[4-丁基-4'-(氧-2, 3-环氧丙基)偶氮苯] (C4AG)与β-环糊精(β-CD)在水中自组装形成菌状囊泡C4AG@2β-CD, 在UV光照射下, C4AG@2β-CD囊泡会慢慢转变成C4AG@β-CD螺旋, 而在可见光的照射下, 又可以恢复原始的囊泡结构, 在体外释药阶段, 10 min UV光照射时, DOX累积释放量为32.5%, 并且通过改变施加刺激的时间实现了药物的逐步释放.利用偶氮苯与环糊精特殊结合能力设计其作为介孔的门控, 可实现对介孔的可逆开关[66, 67], Yan等[68]设计合成了以trans-偶氮苯为轴的α-CD功能化的介孔二氧化硅纳米颗粒(MSNPs), trans-偶氮苯时, α-CD环远离MSNPs的介孔使药物分子进入介孔中, 在365 nm光的照射时, 偶氮苯单元trans-cis异构化移动α-CD环封闭介孔, 而可见光可以诱导偶氮苯单元cis-trans异构化, 打开α-CD环的封堵并释放姜黄素药物(图 15).在斑马鱼幼虫中证明了用可见光照射(halogen 12 V, 100 W, 40%强度, 1 h) MSNP具有光触发药物释放的能力.单独的偶氮苯分子也可以用来作为门控, 控制药物分子的释放[69, 70], Wang等[71]将偶氮苯共价连接在介孔内表面, 反式偶氮苯时, 药物分子束缚在介孔内部不能扩散出来, 在可见光(450 nm)的刺激下, 偶氮苯发生trans-cis异构化反应, 打开了扩散通道, 药物从介孔中释放出来.以罗丹明(Rhodamine 6G)作为疏水药物模型包载到纳米载体中, 在光照刺激下累积释放量达到了90%, 实现“ON-OFF”开关式光控药物释放. Moorthy等[72]设计制备了含偶氮苯的介孔纳米载体(MSH@Azo-CA), 并在介孔内引入了静电作用基团(-COOH, -NH2, -NH-), 使药物分子只能在UV光(365 nm)和低pH条件下才能快速释放(图 16), 体外释药实验显示pH 5.0和UV (365 nm)光照组的药物释放高达84%, 而其他实验组(pH 7.4有/无UV和pH 5.0无UV)无明显释药.细胞毒性实验显示:有光组MCF-7细胞的死亡率为87%(无光组小于8%), 这些结果表明该载药纳米颗粒能够实现光和pH双重控制释药.
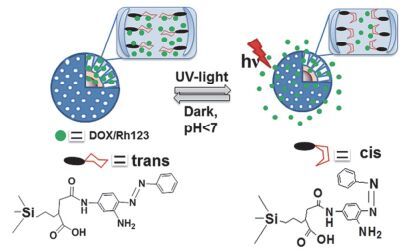
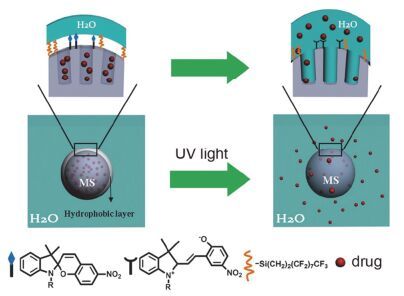
与偶氮苯trans-cis异构化相比, 螺吡喃(SP)的异构化改变了其本身的亲疏水性, 在UV光的照射下疏水的螺吡喃异构化为亲水的部花青(Merocyanine, MC)[73~76], 这种亲疏水性的转变能够破坏载体内部的亲疏水平衡并触发光控释药的过程.基于SP的光异构化, 研究者设计了多种两亲性的含有SP基团的嵌段共聚物自组装的纳米颗粒作为光响应性释药的药物递送载体[75, 77, 78], Chen等[79]合成了含有SP和热敏感聚N-异丙基丙烯酰胺(PNIPAM)的两亲性嵌段共聚物(NIPAM-co-SP)(图 17), 自组装形成具有光、pH和热三重响应的纳米药物载体, 包载香豆素-102的体外释药实验显示, UV光照射(365 nm, 20 mW·cm-2, 10 min)可以实现100%的药物释放, 而无光照组释放量小于20%.利用SP的光异构化亲疏水特性的改变, 把疏水的SP作为门控基团实现载体的光触发释药也是一种很好的设计策略[80, 81], Chen等[82]用SP和氟化硅烷修饰介孔二氧化硅(MS)的表面(图 18), 由于SP的疏水性使载体表面形成一个疏水层阻隔介孔中包载的药物, 当UV光照射时, SP异构化为亲水的MC, 导致MS表面湿润并通过渗透作用将药物分子从介孔中释放出来; 在UV光(365 nm, 2.4 mW· cm-2, 5 min)照射时, 载药载体对EA.hy926细胞的细胞毒性大大增强(无光照组细胞存活率大于90%, 而光照组细胞存活率小于30%).
3.3 光致重排型药物递送系统
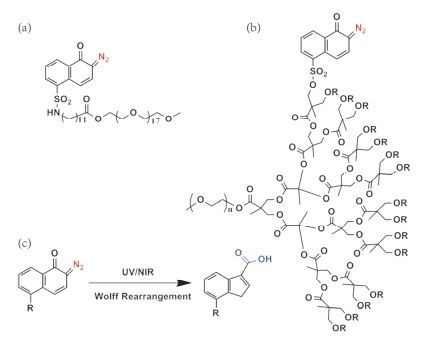
光致重排型药物递送系统是一类含有光致重排基团的光响应性药物递送系统.在光照刺激下, 光致重排分子的光化学反应改变药物递送系统的内部结构, 促使颗粒溶胀解体. DNQ是一种常见的光致重排分子, 具有较强的疏水特性, 在光的照射下发生Wolff重排反应变成亲水的3-茚羧酸(3-IC), 其光反应可以通过吸收高能UV光的一个光子或低能NIR光的双光子而发生[83], 所以含DNQ的聚合物也被广泛用作制备光响应型药物递送系统.
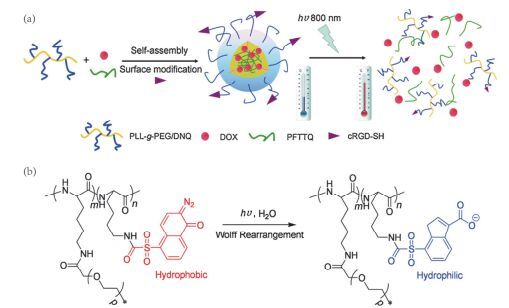
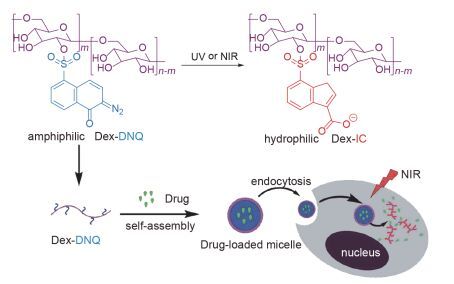
基于DNQ光致重排的性质, 将其作为疏水基团应用于合成两亲性的嵌段共聚物[84~86], 是一种比较常见的设计思路, Yuan等[86]将DNQ与聚合物(PLL-g-PEG)上PLL的残余氨基缀合形成两亲性嵌段共聚物, 加入光热剂(PFTTQ)和抗癌药物(DOX)自组装形NIR光响应的载药纳米胶束, 在NIR光刺激下, 疏水基团DNQ有效地转化为亲水基团(3-IC)导致胶束的破坏释放抗癌药物; 同时将靶向肽(cRGD)连接在该胶束表面, 实现了对肿瘤细胞的靶向化疗及光热联合治疗(图 19).体外细胞毒性分析显示:光照下, 该载药系统有非常好的抑制癌细胞增殖作用. Liu等[87]将DNQ偶联到葡聚糖分子上制备了两亲性共聚物(Dex-DNQ), 自组装形成NIR光响应的载药纳米胶束, 在NIR光的照射下, DNQ发生Wolff重排, 载药胶束解离释放包载的DOX药物(图 20), 对HepG2细胞有着显著的生长抑制, 表明该纳米胶束具有可以用于癌症化疗的潜力.
含有DNQ的树枝状分子也常用作光响应释药的纳米载体, Goodwin等[88]首次合成了含有DNQ-末端的PEO (Mn, PEO=800) 线性两亲性聚合物DNQ-PEO (图 21a), 其临界胶束浓度(CMC)为0.15 mg·mL-1 (PBS, pH=7.4), 并且以疏水的Nile Red作为药物模型实现了UV光触发的药物释放.由于线性两亲性聚合物一般有着较高的CMC和较低的稳定性, 所以该课题组Mynar等[89]设计合成了一种用16个DNQ基团修饰的树枝状聚合物PEO-b-G4-聚酯(图 21b), 其拥有更低的CMC (12 μg· mL-1), 在355 nm光照射3 min, 自组装的纳米胶束被破坏, 其粒径从40 nm减少至20 nm. 795 nm光照射胶束(负载0.5 mg·mL-1 Nile Red) 30 min, Nile Red的荧光发射降低至小于其初始强度的一半, 证明该纳米胶束能够很好的应用于光触发药物递送系统. Sun等[90]也合成了线性树枝状两亲性聚合物PEO-D3DNQ用于光控释药, 在808 nm光照射30 min时, DOX的累积释放量高达90%, 对HeLa细胞也展现出了NIR触发的细胞毒性(光照组细胞存活率约35%, 无光组细胞存活率约65%), 表明该纳米颗粒能够实现光触发的药物释放和光响应的肿瘤治疗.
3.4 光致交联型药物递送系统
交联也是制备稳定药物递送系统的简单有效的方法之一[91~93].可以进行光诱导交联的分子主要有香豆素(coumarin), 肉桂酰[94~96](cinnamoyl)和蒽(anthracene)等, 在不同的光照刺激下, 这些分子可进行可逆的光致二聚化反应, 因此含有这类分子的药物递送系统可以在合适的光照下进行光交联或光裂解反应, 破坏药物递送系统的稳定性达到光触发的药物释放.
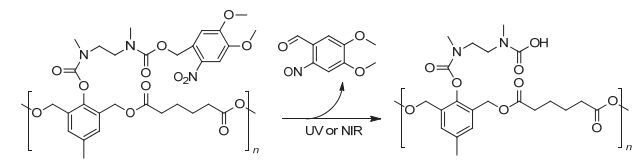
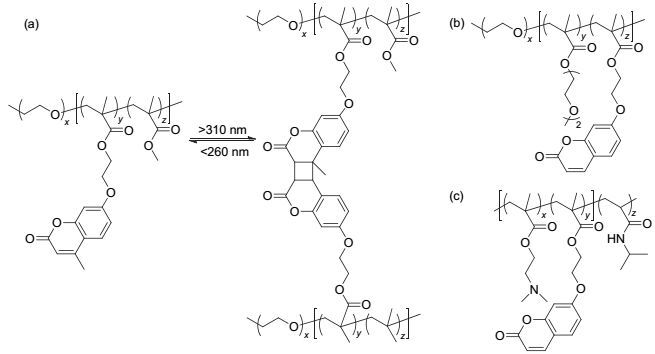
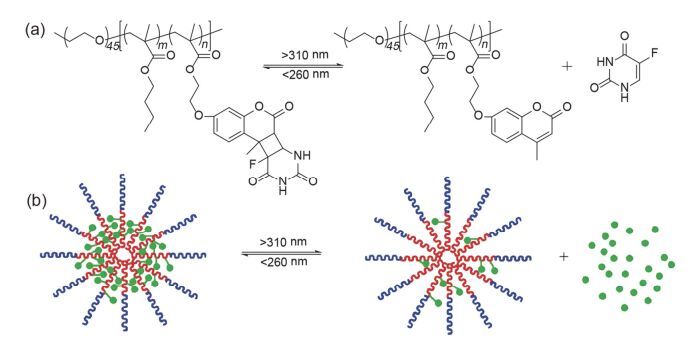
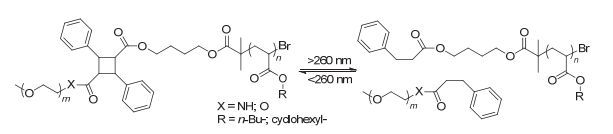
香豆素是比较常用的光交联分子, 当用波长大于310 nm的光刺激香豆素时, 香豆素会形成二聚体, 引起聚合物之间发生交联, 而在小于260 nm的光照刺激时二聚体结构断裂[97~100], 实现解交联. Zhao等[101~106]在将香豆素的光致二聚化应用于药物载体的设计方面开展了大量的工作, 通过将香豆素共价连接在嵌段聚合物的侧链上形成两亲性聚合物(图 22), 在波长大于310 nm的光照刺激下, 聚合物中香豆素基团能够发生二聚化形成交联体, 当波长小于260 nm的光照刺激时, 香豆素二聚体发生光解离破坏了胶束的结构.这种光致交联型的嵌段共聚物形成的胶束能够很好的用于光响应的药物递送. Jin等[107]将香豆素基团接枝到嵌段共聚物的侧链上形成两亲性的聚合物(PEO-b-P (BMA-co-CMA)), 在波长大于310 nm的光照刺激下, 将抗癌药物5-氟尿嘧啶(5-FU)与香豆素分子进行[2+2]环加成, 制备了胶束-药物共价偶联物(PEO-P (BMA-co-CMA)-FU), 在波长小于260 nm光照刺激下, 胶束-药物偶联物光解释放抗癌药物5-FU (图 23), 体外释药实验表明这种胶束-药物偶联物可以在254 nm光照射下释放5-FU, 该胶束具有很好的生物相容性, 是一种很好的光触发药物递送系统.但含香豆素二聚体结构的断裂必须在260 nm以下的光照刺激下才能实现, 该波长的光照对生物体的伤害较大, 所以限制了其在生物领域的应用.
利用肉桂酸酯的[2+2]光致环加成反应, Liu等[108~110]最早报道了将其用于胶束和囊泡的交联(图 24), 而这种光交联是不可逆的. Yang等[111]首次合成了用肉桂酸酯二聚体连接的两亲性二嵌段共聚物(PEO-b-PBA/PCHA), 并且实验证明UV光(波长小于260 nm)可以选择性的切断肉桂酸酯二聚体接头, 诱导自组装的纳米粒解体(图 25).由此可见, 肉桂酸酯的光交联(光裂解)特性也能够用于药物的光触发释放.与香豆素的光交联类似, 所用光源都是波长小于260 nm的UV光, 所以直接用于治疗肿瘤的药物递送系统受到一定的限制.
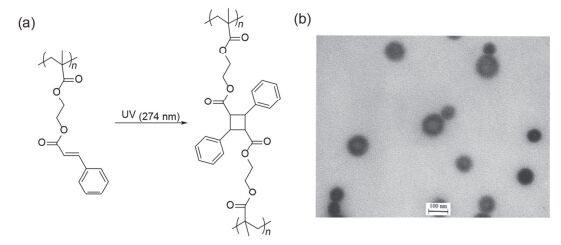 图 24
(a)含肉桂酸酯聚合物(PI-b-PCEMA)的化学结构及其在UV光刺激下发生光致二聚化反应; (b)由PI-b-PCEMA制备的纳米颗粒的TEM图[110]
Figure 24.
(a) The chemical structure of cinnamate-containing polymer (PI-b-PCEMA) and its photodimerization reaction under UV light stimulation; (b) transmission electron microscopy (TEM) image of nanoparticles prepared from PI-b-PCEMA[110]
图 24
(a)含肉桂酸酯聚合物(PI-b-PCEMA)的化学结构及其在UV光刺激下发生光致二聚化反应; (b)由PI-b-PCEMA制备的纳米颗粒的TEM图[110]
Figure 24.
(a) The chemical structure of cinnamate-containing polymer (PI-b-PCEMA) and its photodimerization reaction under UV light stimulation; (b) transmission electron microscopy (TEM) image of nanoparticles prepared from PI-b-PCEMA[110]
蒽也可以在光的刺激下引发二聚体化反应, 在光照波长小于300 nm时, 蒽可以进行[4+4]环加成反应形成二聚体, 而在波长大于300 nm时, 二聚体分子进行光解[112], 因此可以利用蒽的光反应特性设计光致交联型纳米载体用于光触发式药物递送系统.但是由于其需要的光照波长和香豆素等其他光二聚化分子类似, 也限制了其在生物方面的应用.
4 结论与展望
综上所述, 光作为易控的外部刺激用于药物递送系统的药物可控释放是非常有发展前景的.光控释药型药物递送系统释药的机制源于构成药物递送系统的材料中含有光敏基团(光致断裂, 光致异构, 光致重排或光致交联), 在特定光照下, 药物递送系统发生异构形态变化或降解, 从而实现光控释放药物.虽然目前相应的光控释药型药物递送系统取得了一定的进展, 但仍然有许多需要亟待解决的问题. (1) 目前, 有关光控释药的药物递送系统在体内对肿瘤治疗的研究报道很少, 原因在于大部分报道的光控药物递送系统所用的光源是UV, 而UV光组织穿透力弱, 具有一定的细胞毒性, 限制了光触发的药物递送系统的广泛应用.因此开发对组织穿透性深及损害小的NIR光响应的光控释药系统是释药载体研究的热点. (2) 目前多数报道的光控释药型药物递送系统没有靶向病灶(如肿瘤)的靶向性, 大多依赖纳米递送系统的EPR效应被动靶向肿瘤部位, 因此开发设计带有主动靶向基团的光控释药型药物递送系统也是未来的发展方向. (3) 光控释药型药物递送系统作为一种生物医药材料, 与生物体的相容性探讨是必须要研究的方向. (4) 在光控释药型药物递送系统上添加其他光控治疗法如光动力疗法及光热疗法, 实现对疾病(肿瘤)的联合治疗的研究将受到广泛的关注.
-
-
[1]
Liu, M.; Du, H.; Zhang, W.; Zhai, G. Mater. Sci. Eng., C 2017, 71, 1267. doi: 10.1016/j.msec.2016.11.030
-
[2]
Yin, J.; Chen, Y.; Zhang, Z. H.; Han, X. Polymers 2016, 8, 268. doi: 10.3390/polym8070268
-
[3]
Hou, Z. Y.; Deng, K. R.; Li, C. X.; Deng, X. R.; Lian, H. Z.; Cheng, Z. Y.; Jin, D. Y.; Lin, J. Biomaterials 2016, 101, 32. doi: 10.1016/j.biomaterials.2016.05.024
-
[4]
Xia, J.; Zhang, L. W.; Qian, M.; Bao, Y. M.; Wang, J. Y.; Li, Y. C. J. Colloid Interface Sci. 2017, 498, 170. doi: 10.1016/j.jcis.2017.03.059
-
[5]
Han, S. Y.; Samanta, A.; Xie, X. J.; Huang, L.; Peng, J. J.; Park, S. J.; The, D. B. L.; Choi, Y.; Chang, Y.; All, A. H.; Yang, Y. M.; Xing, B. G.; Liu, X. G. Adv. Mater. 2017, 29, 1700244. doi: 10.1002/adma.201700244
-
[6]
Qiu, W. X.; Liu, L. H.; Li, S. Y.; Lei, Q.; Luo, G. F.; Zhang, X. Z. Small 2017, 13, 1603956. doi: 10.1002/smll.v13.18
-
[7]
Li, Y. Y.; Jiang, C. H.; Zhang, D. W.; Wang, Y.; Ren, X. Y.; Ai, K. L.; Chen, X. S. Acta Biomater. 2017, 47, 124. doi: 10.1016/j.actbio.2016.10.010
-
[8]
Zhang, J. F.; Yang, C. X.; Zhang, R.; Chen, R.; Zhang, W. J.; Peng, X. Y.; Liu, G.; Hsu, C. S.; Lee, C. S. Adv. Funct. Mater. 2017, 27, 1605094. doi: 10.1002/adfm.v27.13
-
[9]
Rwei, A. Y.; Wang, W.; Kohane, D. S. Nano Today 2015, 10, 451. doi: 10.1016/j.nantod.2015.06.004
-
[10]
余丽丽, 姚琳, 杨黎燕, 化工进展, 2012, 31, 1065. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htmYu, L. L.; Yao, L.; Yang, L. Y. Chem. Ind. Eng. Prog. 2012, 31, 1065(in Chinese). http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm
-
[11]
Huang, Y.; Dong, R. J.; Zhu, X. Y.; Yan, D. Y. Soft Matter 2014, 10, 6121. doi: 10.1039/C4SM00871E
-
[12]
Du, X.; Jiang, Y.; Zhuo, R.; Jiang, X. J. Polym. Sci., Part A:Polym. Chem. 2016, 54, 2855. doi: 10.1002/pola.v54.18
-
[13]
Ye, Z.; Guo, J. J.; Wu, D. W.; Tan, M.; Xiong, X.; Yin, Y.; He, G. Carbohydr. Polym. 2015, 132, 520. doi: 10.1016/j.carbpol.2015.06.077
-
[14]
Ji, W.; Li, N.; Chen, D.; Qi, X.; Sha, W.; Jiao, Y.; Xu, Q.; Lu, J. J. Mater. Chem. B 2013, 1, 5942. doi: 10.1039/c3tb21206h
-
[15]
Li, H.; Tong, W.; Gao, C. J. Colloid Interface Sci. 2016, 463, 22. doi: 10.1016/j.jcis.2015.10.041
-
[16]
Lux, C.; Lux, J.; Collet, G.; He, S.; Chan, M.; Olejniczak, J.; Foucault-Collet, A.; Almutairi, A. Biomacromolecules 2015, 16, 3286. doi: 10.1021/acs.biomac.5b00950
-
[17]
Dispinar, T.; Colard, C. A. L.; Du Prez, F. E. Polym. Chem. 2013, 4, 763. doi: 10.1039/C2PY20735D
-
[18]
Wang, Q.; Coffinier, Y.; Li, M.; Boukherroub, R.; Szunerits, S. Langmuir 2016, 32, 6515. doi: 10.1021/acs.langmuir.6b00734
-
[19]
Chen, Z.; Li, N.; Chen, L.; Lee, J.; Gassensmith, J. J. Small 2016, 12, 4563. doi: 10.1002/smll.v12.33
-
[20]
Cui, L.; Zhang, F.; Wang, Q.; Lin, H.; Yang, C.; Zhang, T.; Tong, R.; An, N.; Qu, F. J. Mater. Chem. B 2015, 3, 7046. doi: 10.1039/C5TB00709G
-
[21]
Chen, G. J.; Jaskula-Sztul, R.; Esquibel, C. R.; Lou, I.; Zheng, Q. F.; Dammalapati, A.; Harrison, A.; Eliceiri, K. W.; Tang, W. P.; Chen, H.; Gong, S. Q. Adv. Funct. Mater. 2017, 27. 1604671 doi: 10.1002/adfm.v27.8
-
[22]
Olejniczak, J.; Nguyen Huu, V. A.; Lux, J.; Grossman, M.; He, S.; Almutairi, A. Chem. Commun. 2015, 51, 16980. doi: 10.1039/C5CC06143A
-
[23]
Song, J.; Fang, Z.; Wang, C.; Zhou, J.; Duan, B.; Pu, L.; Duan, H. Nanoscale 2013, 5, 5816. doi: 10.1039/C3NR01350B
-
[24]
Meng, L.; Huang, W.; Wang, D.; Huang, X.; Zhu, X.; Yan, D. Biomacromolecules 2013, 14, 2601. doi: 10.1021/bm400451v
-
[25]
Li, Y.; Qian, Y.; Liu, T.; Zhang, G.; Liu, S. Biomacromolecules 2012, 13, 3877. doi: 10.1021/bm301425j
-
[26]
Huang, Q.; Liu, T.; Bao, C.; Lin, Q.; Ma, M.; Zhu, L. J. Mater. Chem. B 2014, 2, 3333.
-
[27]
Cao, J.; Huang, S.; Chen, Y.; Li, S.; Li, X.; Deng, D.; Qian, Z.; Tang, L.; Gu, Y. Biomaterials 2013, 34, 6272. doi: 10.1016/j.biomaterials.2013.05.008
-
[28]
Zhang, R.; Yao, R.; Ding, B.; Shen, Y.; Shui, S.; Wang, L.; Li, Y.; Yang, X.; Tao, W. Adv. Mater. Sci. Eng. 2014, 2014, 1.
-
[29]
Liang, Y.; Gao, W. X.; Peng, X. Y.; Deng, X.; Sun, C. Z.; Xu, H. Y.; He, B. Biomaterials 2016, 100, 76. doi: 10.1016/j.biomaterials.2016.05.023
-
[30]
Huo, H. H.; Ma, X. Y.; Dong, Y. Q.; Qu, F. J. Eur. Polym. J. 2017, 87, 331. doi: 10.1016/j.eurpolymj.2016.12.038
-
[31]
Hu, X.; Feeney, M. J.; McIntosh, E.; Mullahoo, J.; Jia, F.; Xu, Q.; Thomas, S. W. ACS Appl. Mater. Inter. 2016, 8, 23517. doi: 10.1021/acsami.6b07366
-
[32]
Fomina, N.; McFearin, C.; Sermsakdi, M.; Edigin, O.; Almutairi, A. J. Am. Chem. Soc. 2010, 132, 9540. doi: 10.1021/ja102595j
-
[33]
Kumar, S.; Allard, J. F.; Morris, D.; Dory, Y. L.; Lepage, M.; Zhao, Y. J. Mater. Chem. 2012, 22, 7252. doi: 10.1039/c2jm16380b
-
[34]
Fatieiev, Y.; Croissant, J. G.; Alsaiari, S.; Moosa, B. A.; Anjum, D. H.; Khashab, N. M. ACS Appl. Mater. Inter. 2015, 7, 24993. doi: 10.1021/acsami.5b07365
-
[35]
Huynh, C. T.; Nguyen, M. K.; Tonga, G. Y.; Longe, L.; Rotello, V. M.; Alsberg, E. Adv. Healthc. Mater. 2016, 5, 305. doi: 10.1002/adhm.v5.3
-
[36]
Jiang, Z.; Li, H.; You, Y.; Wu, X.; Shao, S.; Gu, Q. J. Biomed. Mater. Res., Part A 2015, 103, 65. doi: 10.1002/jbm.a.v103.1
-
[37]
Kohman, R. E.; Cha, S. S.; Man, H. Y.; Han, X. Nano Lett. 2016, 16, 2781. doi: 10.1021/acs.nanolett.6b00530
-
[38]
Li, S.; Moosa, B. A.; Croissant, J. G.; Khashab, N. M. Angew. Chem., Int. Ed. 2015, 54, 6804. doi: 10.1002/anie.201501615
-
[39]
Liu, W.; Liang, L.; Lo, P. K.; Gou, X. J.; Sun, X. H. Tetrahedron Lett. 2016, 57, 959. doi: 10.1016/j.tetlet.2016.01.064
-
[40]
Lv, C.; Wang, Z.; Wang, P.; Tang, X. Int. J. Mol. Sci. 2012, 13, 16387. doi: 10.3390/ijms131216387
-
[41]
Olejniczak, J.; Sankaranarayanan, J.; Viger, M. L.; Almutairi, A. ACS Macro Lett. 2013, 2, 683. doi: 10.1021/mz400256x
-
[42]
Yu, L.; Ren, N.; Yang, K.; Zhang, M.; Su, L. J. Appl. Polym. Sci. 2016, 133, 1.
-
[43]
Lv, C.; Wang, Z.; Wang, P.; Tang, X. Langmuir 2012, 28, 9387. doi: 10.1021/la301534h
-
[44]
Soleimani, A.; Borecki, A.; Gillies, E. R. Polym. Chem. 2014, 5, 7062. doi: 10.1039/C4PY00996G
-
[45]
Yan, B.; Boyer, J. C.; Habault, D.; Branda, N. R.; Zhao, Y. J. Am. Chem. Soc. 2012, 134, 16558. doi: 10.1021/ja308876j
-
[46]
Dcona, M. M.; Sheldon, J. E.; Mitra, D.; Hartman, M. C.T. Bioorg. Med. Chem. Lett. 2017, 27, 466. doi: 10.1016/j.bmcl.2016.12.036
-
[47]
Li, J. M.; Lee, W. Y.; Wu, T. Y.; Xu, J. B.; Zhang, K. Y.; Wong, D. S. H.; Li, R.; Li, G.; Bian, L. M. Biomaterials 2016, 110, 1. doi: 10.1016/j.biomaterials.2016.09.011
-
[48]
Wong, P. T.; Chen, D.; Tang, S.; Yanik, S.; Payne, M.; Mukherjee, J.; Coulter, A.; Tang, K.; Tao, K.; Sun, K.; Baker, J. R., Jr.; Choi, S. K. Small 2015, 11, 6078. doi: 10.1002/smll.201501575
-
[49]
Tan, X.; Li, B. B.; Lu, X.; Jia, F.; Santori, C.; Menon, P.; Li, H.; Zhang, B.; Zhao, J. J.; Zhang, K. J. Am. Chem. Soc. 2015, 137, 6112. doi: 10.1021/jacs.5b00795
-
[50]
Lin, Q.; Bao, C.; Yang, Y.; Liang, Q.; Zhang, D.; Cheng, S.; Zhu, L. Adv. Mater. 2013, 25, 1981. doi: 10.1002/adma.201204455
-
[51]
Zhao, L.; Peng, J.; Huang, Q.; Li, C.; Chen, M.; Sun, Y.; Lin, Q.; Zhu, L.; Li, F. Adv. Funct. Mater. 2014, 24, 363. doi: 10.1002/adfm.v24.3
-
[52]
Tian, M.; Cheng, R. D.; Zhang, J.; Liu, Z. T.; Liu, Z. W.; Jiang, J. Q. Langmuir 2015, 32, 12.
-
[53]
Wang, Y. P.; Li, G.; Cheng, R. D.; Zhang, X.; Jiang, J. Q. Colloid Polym Sci. 2017, 295, 371. doi: 10.1007/s00396-017-4013-0
-
[54]
Dorresteijn, R.; Billecke, N.; Parekh, S. H.; Klapper, M.; Müllen, K. J. Polym. Sci., Part A:Polym. Chem. 2015, 53, 200. doi: 10.1002/pola.27363
-
[55]
Yu, G.; Yu, W.; Mao, Z.; Gao, C.; Huang, F. Small 2015, 11, 919. doi: 10.1002/smll.v11.8
-
[56]
Barman, S.; Mukhopadhyay, S. K.; Behara, K. K.; Dey, S.; Singh, N. D. ACS Appl. Mater. Inter. 2014, 6, 7045. doi: 10.1021/am500965n
-
[57]
Jana, A.; Devi, K. S.; Maiti, T. K.; Singh, N. D. J. Am. Chem. Soc. 2012, 134, 7656. doi: 10.1021/ja302482k
-
[58]
Jana, A.; Nguyen, K. T.; Li, X.; Zhu, P.; Tan, N. S.; Ågren, H.; Zhao, Y. ACS Nano 2014, 8, 5939. doi: 10.1021/nn501073x
-
[59]
Knežević, N. Ž.; Trewyn, B. G.; Lin, V. S. Chem. Commun. 2011, 47, 2817. doi: 10.1039/c0cc04424e
-
[60]
丁妍春, 俞燕蕾, 韦嘉, 化学学报, 2014, 72, 602. doi: 10.7503/cjcu20130795Ding, Y.; Yu, Y.; Wei, J. Acta Chim. Sinica 2014, 72, 602(in Chinese). doi: 10.7503/cjcu20130795
-
[61]
潘高翔, 冯泽, 韦嘉, 俞燕蕾, 化学学报, 2013, 71, 733. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract341993.shtmlPan, G.; Feng, Z.; Wei, J.; Yu, Y. Acta Chim. Sinica 2013, 71, 733(in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract341993.shtml
-
[62]
Aleandri, S.; Speziale, C.; Mezzenga, R.; Landau, E. M. Langmuir 2015, 31, 6981. doi: 10.1021/acs.langmuir.5b01945
-
[63]
Pianowski, Z. L.; Karcher, J.; Schneider, K. Chem. Commun. 2016, 52, 3143. doi: 10.1039/C5CC09633B
-
[64]
李惠梅, 王洁, 倪云洲, 周永丰, 颜德岳, 化学学报, 2016, 74, 415. doi: 10.3866/PKU.WHXB201511191Li, H.; Wang, J.; Ni, Y.; Zhou, Y.; Yan, D. Acta Chim. Sinica 2016, 74, 415(in Chinese). doi: 10.3866/PKU.WHXB201511191
-
[65]
Zhao, Q.; Wang, Y.; Yan, Y.; Huang, J. ACS Nano 2014, 8, 11341. doi: 10.1021/nn5042366
-
[66]
Shao, L.; Hua, B.; Sun, J. F.; Li, Q.; Yang, J.; Yu, G. C. Tetrahedron Lett. 2017, 58, 1863. doi: 10.1016/j.tetlet.2017.03.091
-
[67]
Croissant, J.; Chaix, A.; Mongin, O.; Wang, M.; Clement, S.; Raehm, L.; Durand, J. O.; Hugues, V.; Blanchard-Desce, M.; Maynadier, M.; Gallud, A.; Gary-Bobo, M.; Garcia, M.; Lu, J.; Tamanoi, F.; Ferris, D. P.; Tarn, D.; Zink, J. I. Small 2014, 10, 1752. doi: 10.1002/smll.v10.9
-
[68]
Yan, H.; Teh, C.; Sreejith, S.; Zhu, L.; Kwok, A.; Fang, W.; Ma, X.; Nguyen, K. T.; Korzh, V.; Zhao, Y. Angew. Chem., Int. Ed. 2012, 51, 8373. doi: 10.1002/anie.v51.33
-
[69]
Zhao, J. W.; He, Z. S.; Li, B.; Cheng, T. Y.; Liu, G. H. Mater. Sci. Eng. C 2017, 73, 1. doi: 10.1016/j.msec.2016.12.056
-
[70]
Cao, P. F.; Su, Z.; de Leon, A.; Advincula, R. C. ACS Macro Lett. 2015, 4, 58. doi: 10.1021/mz500632r
-
[71]
Wang, Y.; Li, B.; Zhang, L.; Song, H.; Zhang, L. ACS Appl. Mater. Inter. 2013, 5, 11. doi: 10.1021/am302492e
-
[72]
Moorthy, M. S.; Kim, H. B.; Bae, J. H.; Kim, S. H.; Ha, C. S. RSC Adv. 2016, 6, 29106. doi: 10.1039/C5RA28143A
-
[73]
Klajn, R. Chem. Soc. Rev. 2013, 43, 148.
-
[74]
Ma, L.; Li, J.; Han, D.; Geng, H.; Chen, G.; Li, Q. Macromol. Chem. Phys. 2013, 214, 716. doi: 10.1002/macp.v214.6
-
[75]
Wang, B.; Chen, K.; Yang, R.; Yang, F.; Liu, J. Carbohydr. Polym. 2014, 103, 510. doi: 10.1016/j.carbpol.2013.12.062
-
[76]
Schenderlein, H.; Voss, A.; Stark, R. W.; Biesalski, M. Langmuir 2013, 29, 4525. doi: 10.1021/la305073p
-
[77]
Khakzad, F.; Mahdavian, A. R.; Salehi, M. H.; Rezaee Shirin-Abadi, A.; Cunningham, M. Polymers 2016, 101, 274. doi: 10.1016/j.polymer.2016.08.073
-
[78]
Tong, R.; Hemmati, H. D.; Langer, R.; Kohane, D. S. J. Am. Chem. Soc. 2012, 134, 8848. doi: 10.1021/ja211888a
-
[79]
Chen, S.; Jiang, F.; Cao, Z.; Wang, G.; Dang, Z. M. Chem. Commun. 2015, 51, 12633. doi: 10.1039/C5CC04087F
-
[80]
Rosario, R.; Gust, D.; Hayes, M.; Jahnke, F.; Springer, J.; Garcia, A. A. Langmuir 2002, 18, 8062. doi: 10.1021/la025963l
-
[81]
Dattilo, D.; Armelao, L.; Fois, G.; Mistura, G.; Maggini, M. Langmuir 2008, 23, 12945.
-
[82]
Chen, L.; Wang, W.; Su, B.; Wen, Y.; Li, C.; Zhou, Y.; Li, M.; Shi, X.; Du, H.; Song, Y. ACS Nano 2014, 8, 744. doi: 10.1021/nn405398d
-
[83]
Goodwin, A. P.; Mynar, J. L.; Ma, Y.; And, G. R. F.; Fréchet, J. M. J. J. Am. Chem. Soc. 2005, 127, 9952. doi: 10.1021/ja0523035
-
[84]
Tian, F.; Yu, Y.; Wang, C.; Yang, S. Macromolecules 2008, 41, 3385. doi: 10.1021/ma800142j
-
[85]
Chen, C. J.; Liu, G. Y.; Shi, Y. T.; Zhu, C. S.; Pang, S. P.; Liu, X. S.; Ji, J. Macromol. Rapid Commun. 2011, 32, 1077. doi: 10.1002/marc.v32.14
-
[86]
Yuan, Y.; Wang, Z.; Cai, P.; Liu, J.; Liao, L. D.; Hong, M.; Chen, X.; Thakor, N.; Liu, B. Nanoscale 2015, 7, 3067. doi: 10.1039/C4NR06420H
-
[87]
Liu, G. Y.; Chen, C. J.; Li, D. D.; Wang, S. S.; Ji, J. J. Mater. Chem. 2012, 22, 16865. doi: 10.1039/c2jm00045h
-
[88]
Goodwin, A. P.; Mynar, J. L.; Ma, Y.; Fleming, G. R.; Fréchet, J. M. J. Am. Chem. Soc. 2005, 127, 9952. doi: 10.1021/ja0523035
-
[89]
Mynar, J. L.; Goodwin, A. P.; Cohen, J. A.; Ma, Y.; Fleming, G. R.; Fréchet, J. M. Chem. Commun. 2007, 20, 2081.
-
[90]
Sun, L.; Zhu, B.; Su, Y.; Dong, C. M. Polym. Chem. 2014, 5, 1605. doi: 10.1039/C3PY00533J
-
[91]
Li, Y.; Xiao, K.; Zhu, W.; Deng, W.; Lam, K. S. Adv. Drug Deliv. Rev. 2014, 66, 58. doi: 10.1016/j.addr.2013.09.008
-
[92]
O'Reilly, R. K.; Hawker, C. J.; Wooley, K. L. Chem. Soc. Rev. 2006, 35, 1068. doi: 10.1039/b514858h
-
[93]
Talelli, M.; Barz, M.; Rijcken, C. J.; Kiessling, F.; Hennink, W. E.; Lammers, T. Nano Today 2015, 10, 93. doi: 10.1016/j.nantod.2015.01.005
-
[94]
Chung, C. M.; Roh, Y. S.; Cho, S. Y.; Kim, J. G. Chem. Mater. 2004, 16, 3982. doi: 10.1021/cm049394+
-
[95]
Yusa, S.; Sugahara, M.; Endo, T.; Morishima, Y. Langmuir 2009, 25, 5258. doi: 10.1021/la803878s
-
[96]
Sandholzer, M.; Bichler, S.; Stelzer, F.; Slugovc, C. J. Polym. Sci., Part A:Polym. Chem. 2008, 46, 2402. doi: 10.1002/pola.v46:7
-
[97]
Trenor, S. R.; Shultz, A. R.; Love, B. J.; Long, T. E. Chem. Rev. 2004, 104, 3059. doi: 10.1021/cr030037c
-
[98]
Maddipatla, M.; Wehrung, D.; Tang, C.; Fan, W.; Oyewumi, M. O.; Miyoshi, T.; Joy, A. Macromolecules 2013, 46, 5133. doi: 10.1021/ma400584y
-
[99]
范溦, 李敏, 洪春雁, 潘才元, 化学学报, 2015, 73, 330. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract344824.shtmlFan, W.; Li, M.; Hong, C.; Pan, C. Acta Chim. Sinica 2015, 73, 330(in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract344824.shtml
-
[100]
Wang, Q.; Cheng, M.; Jiang, J. L.; Wang, L. Y. Chin. Chem. Lett. 2017, 28, 793. doi: 10.1016/j.cclet.2017.02.008
-
[101]
Zhao, Y.; Bertrand, J.; Tong, X.; Zhao, Y. Langmuir 2009, 25, 13151. doi: 10.1021/la901835z
-
[102]
Jiang, J.; Qi, B.; Lepage, M. A.; Zhao, Y. Macromolecules 2007, 40, 790. doi: 10.1021/ma062493j
-
[103]
He, J.; Yan, B.; Tremblay, L.; Zhao, Y. Langmuir 2011, 27, 436. doi: 10.1021/la1040322
-
[104]
He, J.; Xia, T.; Tremblay, L.; Zhao, Y. Macromolecules 2009, 42, 7267. doi: 10.1021/ma901817k
-
[105]
He, J.; Xia, T.; Zhao, Y. Macromolecules 2009, 42, 4845. doi: 10.1021/ma900665v
-
[106]
Babin, J.; Lepage, M.; Zhao, Y. Macromolecules 2008, 41, 1246. doi: 10.1021/ma702422y
-
[107]
Jin, Q.; Mitschang, F.; Agarwal, S. Biomacromolecules 2011, 12, 3684. doi: 10.1021/bm2009125
-
[108]
Guo, A.; Liu, G.; Tao, J. Macromolecules 1996, 29, 2487. doi: 10.1021/ma951354r
-
[109]
Ding, J.; Liu, G. Macromolecules 1998, 31, 6554. doi: 10.1021/ma980710d
-
[110]
Ding, J.; Liu, G. Chem. Mater. 1998, 10, 537. doi: 10.1021/cm970546t
-
[111]
Yang, H.; Lin, J.; Wang, Z.; Dicicco, A.; Lévy, D.; Keller, P. Macromolecules 2011, 44, 159. doi: 10.1021/ma1016264
-
[112]
Xie, H.; He, M. J.; Deng, X. Y.; Du, L.; Fan, C. J.; Yang, K. K.; Wang, Y. Z. ACS Appl. Mater. Inter. 2016, 8, 9431. doi: 10.1021/acsami.6b00704
-
[1]
-
图 6 (a)光敏感聚氨酯分子结构; (b)疏水性模型药物和光敏感聚氨酯自组装成载药纳米颗粒, 在UV照射下, 聚合物主链降解释放药物[43]
Figure 6 (a) The chemical structure of light-sensitive polyurethane molecules; (b) the drug-loaded nanoparticles are formed by the hydrophobic model drug and the light-sensitive polymer, which are degraded to release the drug under UV irradiation[43]
图 13 (a) YSUCNPs在NIR光触发下释放药物机理示意图; (b)前药分子UV光诱导断裂结构示意图; (c)荷瘤小鼠光触发治疗结果[51]
Figure 13 (a) The exploited mechanisms for NIR-regulated release of drugs from YSUCNPs; (b) the photocleavage reaction of prodrugs under UV light; (c) photographs of tumor-bearing mice injected with YSUCNP-ACCh, YSLnNP-ACCh and saline on the 1st day, and after treatment on the 9th day and 17th day[51]
(YSUCNP-ACCh: ACCh-loaded yolk–shell structured upconversion nanoparticles; YSLnNP-ACCh: ACCh-loaded yolk–shell structured non-upconversion nanoparticles; Scale bars represent 1 cm)
图 24 (a)含肉桂酸酯聚合物(PI-b-PCEMA)的化学结构及其在UV光刺激下发生光致二聚化反应; (b)由PI-b-PCEMA制备的纳米颗粒的TEM图[110]
Figure 24 (a) The chemical structure of cinnamate-containing polymer (PI-b-PCEMA) and its photodimerization reaction under UV light stimulation; (b) transmission electron microscopy (TEM) image of nanoparticles prepared from PI-b-PCEMA[110]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 290
- 文章访问数: 7975
- HTML全文浏览量: 2847


 下载:
下载:
























 下载:
下载:

