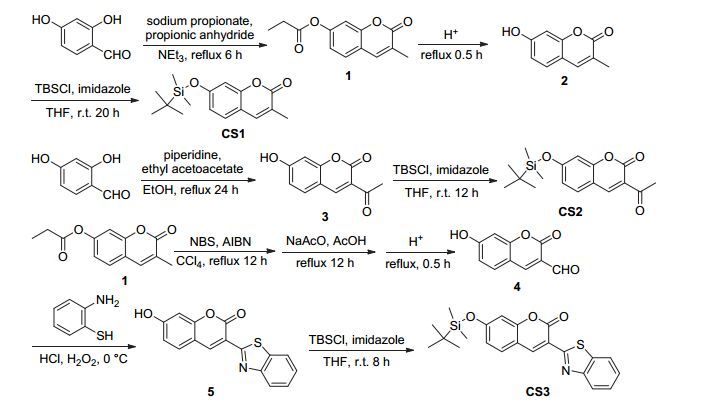
 图 图式1
探针CS1, CS2和CS3的合成路线
Figure 图式1.
The synthetic route of probe CS1, CS2 and CS3
图 图式1
探针CS1, CS2和CS3的合成路线
Figure 图式1.
The synthetic route of probe CS1, CS2 and CS3

Citation: Wang Shaojing, Li Changwei, Li Jin, Chen Bang, Guo Yuan. Novel Coumarin-Based Fluorescent Probes for Detecting Fluoride Ions in Living Cells[J]. Acta Chimica Sinica, 2017, 75(4): 383-390. doi: 10.6023/A17010029

新型香豆素类氟离子荧光探针的合成及细胞成像研究
English
Novel Coumarin-Based Fluorescent Probes for Detecting Fluoride Ions in Living Cells
-
Key words:
- coumarin
- / fluoride ions
- / fluorescent probe
- / intramolecular charge transfer
- / cell imaging
-
1 引言
氟是与生命相关的重要元素, 也是人体所必需的微量元素之一[1~6].人体缺氟容易导致牙齿松脆、骨质疏松[7, 8]等健康问题, 但是人体内氟离子 (F-) 浓度过高时会导致氟斑牙、氟骨症、尿石症以及癌症[9~14]等疾病.同时, 人类在生产、生活中又不可避免地排放含氟废弃物, 当今氟污染已相当严重.因此, 对环境和细胞内F-的准确、快速检测显得极其重要.
目前氟离子检测方法主要有离子色谱法[15]、离子选择电极法[16]、氟试剂比色法和荧光探针法[17~27].荧光探针分析法[28~32]具有选择性好、灵敏度高、检测限低等优点, 还可以进行生物荧光成像.用荧光探针分析法来检测F-通常基于以下三种原理:氢键类、氟硼络合物类和氟化物脱硅基类.由于氟离子是电负性最强、离子半径最小的阴离子, 致使其具有强烈的水化作用, 这严重制约着氢键类荧光探针对水体系中F-的检测[33, 34]; 又由于氟硼络合物自身的不稳定性及其较大的细胞毒性, 所以近年来新发展的基于氟化物脱硅基原理的F-荧光探针倍受科研工作者的青睐.此外, 香豆素类衍生物除具有抗细菌、抗病毒、抗真菌、抗癌、抗衰老等多方面的生物学和药学特性外, 其本身又具有荧光量子产率高、Stokes位移大、光稳定性好等优良的光学特性.因此, 近年来香豆素类荧光探针逐渐成为国内外科研人员的关注热点.鉴于此, 以具有优良生物学特性和光学特性的香豆素为母体, 本文设计合成了一类基于硅氧键断裂, 可用于细胞成像的高选择性氟离子荧光探针.
香豆素母环并没有显著的荧光特性, 通过在其3位引入吸电子基团以及7位引入给电子基团可形成推-拉电子体系, 基于分子内电荷转移机理 (ICT) 则能发出强烈的荧光.本文分别以3-甲基-7-羟基香豆素, 3-乙酰基-7-羟基香豆素和3-苯并噻唑基-7-羟基香豆素为母体, 合成了3-甲基-7-叔丁基二甲基硅氧基香豆素 (探针CS1), 3-乙酰基-7-叔丁基二甲基硅氧基香豆素 (探针CS2) 和3-苯并噻唑基-7-叔丁基二甲基硅氧基香豆素 (探针CS3).引入推拉电子体系的香豆素衍生物有很强的荧光, 但是7位羟基被叔丁基二甲基硅烷基保护后荧光强度减弱, 有时还会伴随着荧光波长的蓝移.以硅氧键为识别位点, 当探针与氟离子作用后, 硅氧键断裂产生酚氧负离子, 从而产生p-π共轭使整个分子共轭面积增大且富电子性增强, 光谱性质上表现为发射波长红移且荧光强度增强, 因此可以利用这个性质来识别F-.探针分子的合成路线如图式1所示.
2 结果与讨论
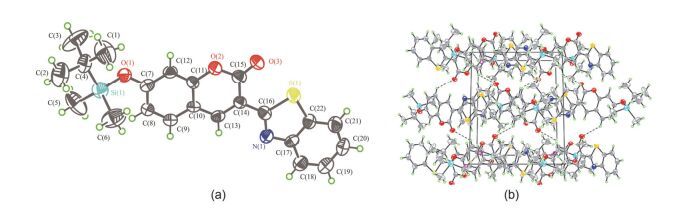
2.1 探针CS3的晶体结构分析
通过溶剂挥发法得到适合X射线单晶测试的晶体. CS3晶体的分子结构如图 1a所示, 其主要晶体学参数见表S2, 该分子属于单斜晶系, 空间群为P21/c.探针CS3分子之间存在着较强的氢键作用, 其晶胞堆积图 (图 1b) 表明CS3酯羰基上的O原子与另一分子5位的氢原子之间形成了氢键, 从而形成了一个三维超分子.
2.2 探针的光谱学性质
本文中探针CS1, CS2和CS3的最大特点就是能准确地检测水溶液体系中F-浓度, 这比大部分只能在有机相中检测以四丁基氟化铵为F-源的荧光探针更具有实用价值.通过紫外光谱实验研究了探针对F-的响应情况 (图S1).向含有探针CS1的乙醇-磷酸盐缓冲溶液 (4:6, V/V, 20 mmol/L, pH 7.4) 中加入F-后, 体系在396 nm处的荧光强度逐渐降低, 同时在465 nm处出现了新峰并且逐渐增强, 并在431 nm处出现了等强度点 (图 2a).加入F-后, 探针CS1的最大发射波长红移了69 nm, 而且其荧光强度比值 (F465/F396) 也是随着F-浓度的升高而增大的, 从空白时的0.44升至饱和后的22.04, 最终升高约50倍 (见图S2a).如此大的Stokes位移和显著的强度变化能使探针CS1作为比率型荧光探针检测F-.向含有探针CS2的乙腈-磷酸盐缓冲溶液 (7:3, V/V, 20 mmol/L, pH 7.4) 中逐渐加入F-后, 体系在460 nm处出现最大发射峰, 且荧光强度随着F-浓度的增大而增强 (图 2b), 荧光强度从空白时的600左右增长到饱和后的2100左右 (见图S2b), 如此明显的强度变化可作为开关型荧光探针检测F-.向含有探针CS3的乙腈-磷酸盐缓冲溶液 (5:5, V/V, 20 mmol/L, pH 7.4) 中逐渐加入F-后, 体系在450 nm处的荧光强度逐渐降低, 同时在500 nm处出现新峰并且逐渐增强, 并在480 nm处出现了等强度点 (图 2c).与加入F-前相比, 探针CS3的荧光发射波长红移了50 nm, 其荧光强度比值 (F500/F450) 也随着F-浓度的升高而增大, 并且有很好的线性关系, 从空白时的1.9升到饱和后的22.1, 最终升高约12倍 (见图S2c), 所以该探针也可用作检测F-的比率型荧光探针.
为了进一步研究探针CS1, CS2和CS3与F-浓度的线性关系, 我们又制作了其工作曲线 (图 2插图).在F-浓度为0~200 µmol/L的范围内, 探针CS1荧光强度比值 (F465/F396) 与F-浓度呈良好的线性关系, 线性相关系数为0.9953.根据这一良好的线性关系, 我们通过进一步的作图、计算得到了探针CS1对F-的最低检出限 (S/N=3) 为21.77 µmol/L.在F-浓度为0~20 µmol/L的范围内, 探针CS2在460 nm处的荧光强度与F-浓度呈良好的线性关系, 线性相关系数为0.9978, 最低检出限 (S/N=3) 为3.52 µmol/L.在F-浓度为0~12 µmol/L的范围内, 探针CS3荧光强度比值 (F500/F450) 与F-浓度有良好的线性关系, 线性相关系数为0.9957, 最低检出限 (S/N=3) 为1.99 µmol/L.通过以上实验数据可知, 与探针CS1相比, 探针CS2和CS3对F-有更低的检出限, 且探针CS3对F-最为敏感.
待测体系的pH对探针的荧光强度有显著影响, 同时也是衡量探针是否能应用于生物体系的重要指标.为此, 本文研究了体系pH对探针荧光强度的影响 (见图S3), 最终选择了pH 7.4作为实验条件.本文对探针检测F-的响应时间也进行了研究, 发现探针CS1、CS2、CS3与F-反应达到平衡分别需要90 min、25 min、50 min (见图S4).
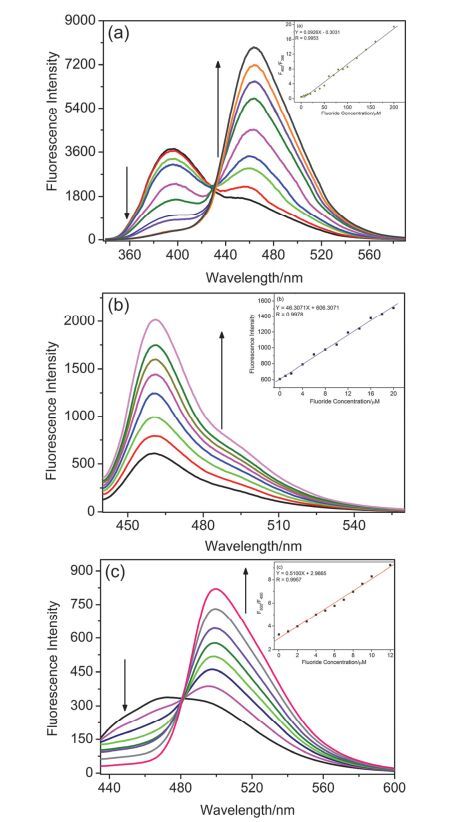 图 2
(a) 探针CS1 (10 μmol/L) 加入F- (0~200 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线. (b) 探针CS2 (10 μmol/L) 加入F- (0~200 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线. (c) 探针CS3 (10 μmol/L) 加入F- (0~150 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线
Figure 2.
(a) Fluorescence spectra of probe CS1 (10 μmol/L) in the presence of F- (0~200 μmol/L). Inset: A plot of F465/F396 vs. the concentration of F- in the range of 0~200 μmol/L. (b) Fluorescence spectra of probe CS2 (10 μmol/L) in the presence of F- (0~200 μmol/L). Inset: A plot of F460 vs. the concentration of F- in the range of 0~20 μmol/L. (c) Fluorescence spectra of probe CS3 (10 μmol/L) in the presence of F- (0~150 μmol/L). Inset: A plot of F500/F450 vs. the concentration of F- in the range of 0~12 μmol/L
图 2
(a) 探针CS1 (10 μmol/L) 加入F- (0~200 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线. (b) 探针CS2 (10 μmol/L) 加入F- (0~200 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线. (c) 探针CS3 (10 μmol/L) 加入F- (0~150 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线
Figure 2.
(a) Fluorescence spectra of probe CS1 (10 μmol/L) in the presence of F- (0~200 μmol/L). Inset: A plot of F465/F396 vs. the concentration of F- in the range of 0~200 μmol/L. (b) Fluorescence spectra of probe CS2 (10 μmol/L) in the presence of F- (0~200 μmol/L). Inset: A plot of F460 vs. the concentration of F- in the range of 0~20 μmol/L. (c) Fluorescence spectra of probe CS3 (10 μmol/L) in the presence of F- (0~150 μmol/L). Inset: A plot of F500/F450 vs. the concentration of F- in the range of 0~12 μmol/L
采用常见的阴离子作为干扰物, 研究了探针CS1, CS2和CS3对F-的选择性识别能力及抗干扰能力.如图 3所示:向含有探针CS1的乙醇-磷酸盐体系中加入各种阴离子, 只有F-能引起探针最大吸收峰的红移和荧光强度的增强, 其它离子则无明显的荧光响应.同样, 向含有探针CS2的乙腈-磷酸盐体系中分别加入各种阴离子, 只有F-能使探针体系在460 nm处的荧光强度显著增强.对于探针CS3, 仅有F-能引起体系最大吸收峰的红移和500 nm处荧光强度的显著增强, 其它离子则没有此效果.此外, 一些化学性质相似、极性相似以及电性相近的离子之间往往会相互产生干扰, 所以本文在其它阴离子存在的条件下分别对F-进行了荧光测定 (见图 4).干扰性实验表明, 其他离子几乎不对F-产生干扰作用, 探针能在其它离子存在的条件下很好地对F-进行识别.以上实验表明, 探针CS1, CS2和CS3对F-有很好的选择性, 同时也具有很好的抗干扰性, 这些性质为探针的实际应用提供了可能.
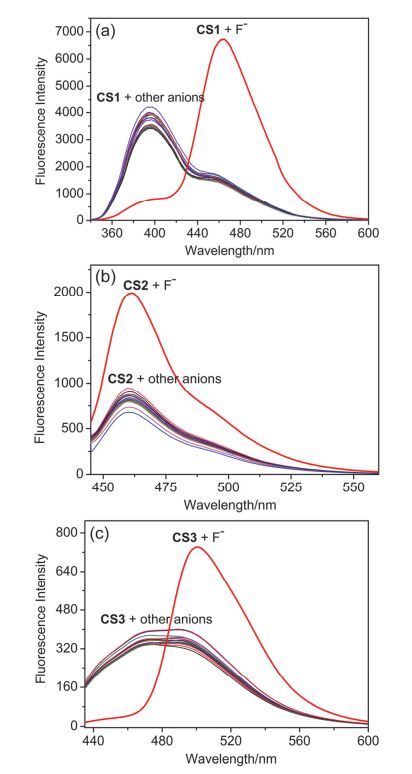 图 3
(a) 探针CS1 (10 μmol/L), (b) 探针CS2 (10 μmol/L) 和 (c) 探针CS3(10 μmol/L) 加入不同阴离子 (100 μmol/L) 的荧光光谱图
Figure 3.
The fluorescence spectra of (a) probe CS1 (10 μmol/L), (b) probe CS2 (10 μmol/L) and (c) probe CS3 (10 μmol/L) to various species (100 μmol/L for Cl-, Br-, I-, SO42-, NO3-, NO2-, SO32-, HSO3-, S2-, SCN-, ClO-, AcO-, S2O32-, CN-, CO32- and F-)
图 3
(a) 探针CS1 (10 μmol/L), (b) 探针CS2 (10 μmol/L) 和 (c) 探针CS3(10 μmol/L) 加入不同阴离子 (100 μmol/L) 的荧光光谱图
Figure 3.
The fluorescence spectra of (a) probe CS1 (10 μmol/L), (b) probe CS2 (10 μmol/L) and (c) probe CS3 (10 μmol/L) to various species (100 μmol/L for Cl-, Br-, I-, SO42-, NO3-, NO2-, SO32-, HSO3-, S2-, SCN-, ClO-, AcO-, S2O32-, CN-, CO32- and F-)
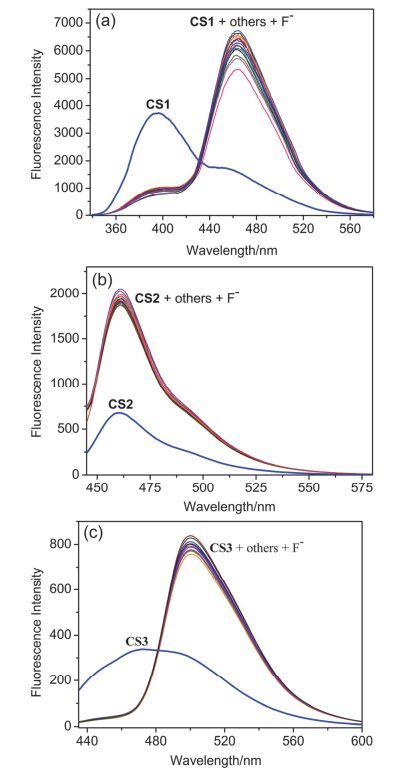 图 4
(a) 探针CS1(10 μmol/L), (b) 探针CS2 (10 μmol/L) 和 (c) 探针CS3 (10 μmol/L) 在F-(100 μmol/L) 存在下加入不同阴离子 (100 μmol/L) 的荧光光谱图
Figure 4.
The fluorescence spectra of (a) probe CS1 (10 μmol/L), (b) probe CS2 (10 μmol/L) and (c) probe CS3 (10 μmol/L) to various species (100 μmol/L Cl-, Br-, I-, SO42-, NO3-, NO2-, SO32-, HSO3-, S2-, SCN-, ClO-, AcO-, S2O32-, CN-, CO32-) in the presence of F- (100 μmol/L)
图 4
(a) 探针CS1(10 μmol/L), (b) 探针CS2 (10 μmol/L) 和 (c) 探针CS3 (10 μmol/L) 在F-(100 μmol/L) 存在下加入不同阴离子 (100 μmol/L) 的荧光光谱图
Figure 4.
The fluorescence spectra of (a) probe CS1 (10 μmol/L), (b) probe CS2 (10 μmol/L) and (c) probe CS3 (10 μmol/L) to various species (100 μmol/L Cl-, Br-, I-, SO42-, NO3-, NO2-, SO32-, HSO3-, S2-, SCN-, ClO-, AcO-, S2O32-, CN-, CO32-) in the presence of F- (100 μmol/L)
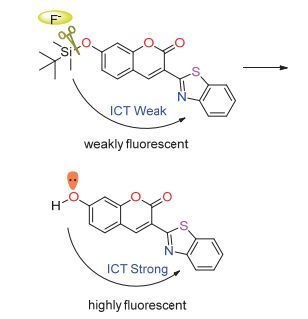
2.3 探针的检测机理及结构
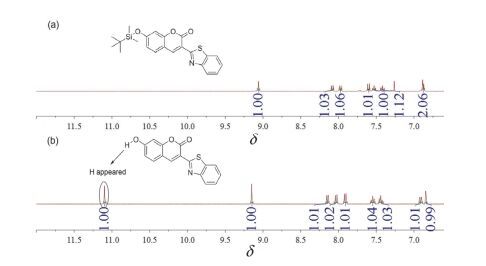
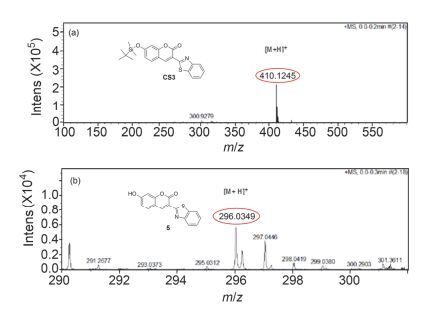
以探针CS3为例, 推测其检测机理如图 5.香豆素衍生物7位上的酚氧原子连有烷基硅时, 其对香豆素母环的供电子能力较弱, 使整个分子不能拥有很好的推-拉电子效应, 因而探针分子不能表现出很好的荧光特性.当探针分子与F-作用后, 氧硅键断裂, 形成的酚氧负离子有很强的供电子特性, 并且增大了整个分子的共轭体系 (p-π共轭), 于是探针分子便表现出荧光增强和波长红移.为进一步验证探针与F-的反应机理, 本文对探针CS3进行了1H NMR测定实验以及HRMS质谱测定实验.如图 6所示:探针CS3本来在δ 11.10处没有峰, 但将探针CS3与KF反应后的产物提取, 再次进行核磁测定时便在δ 11.10处出现了新峰, 此处的峰应归结为羟基上的质子峰.核磁实验表明, F-确实能使硅氧键断裂, 新产生的酚氧负离子从体系中得到了一个质子生成酚羟基.为了进一步证明该实验事实, 我们又分别对探针CS3在加F-前后进行了HRMS质谱测定如图 7:探针CS3 (C22H23O3NSSi[M+H]+: 410.1241, found 410.1245) 加入KF后出现新峰296.0349, 该峰可归属于化合物5 (C16H9O3NS[M+H]+: 296.0376).因此, 高分辨质谱实验进一步证明探针CS3可与F-作用并生成了化合物5.
2.4 细胞成像
为了进一步研究探针分子在生物体内的应用潜质, 本文测试了探针CS1, CS2和CS3对MCF-7细胞的毒性 (见图S6).由实验结果可知, 在探针浓度为10 μmol/L时细胞的成活率都在80%以上, 说明探针分子都具有较低的细胞毒性, 可以实现在活细胞内的应用.
基于以上实验结果, 本文又进行了探针CS1, CS2和CS3在MCF-7细胞中的成像研究 (分别见图S7、S8、8所示).结果表明, 三种探针均能很好的标记MCF-7细胞.在探针CS3的细胞成像中, 为了区别不同荧光接收波段, 在仪器设置中将400~450 nm荧光信号赋予蓝色, 将475~525 nm的荧光信号赋予绿色.由图 8可以看出, 当细胞内未加入F-时, 探针CS3的荧光信号主要集中在400~450 nm波段, 而475~525 nm的荧光信号相对较弱; 当外部的F-进入被探针标记的细胞以后, 探针CS3在400~450 nm波段的荧光信号减弱, 而475~525 nm波段的荧光信号增强, 说明探针加入F-以后能引起波长红移, 上述实验结果表明, 探针CS3可用于活细胞内不同信号波段的比率型荧光成像.
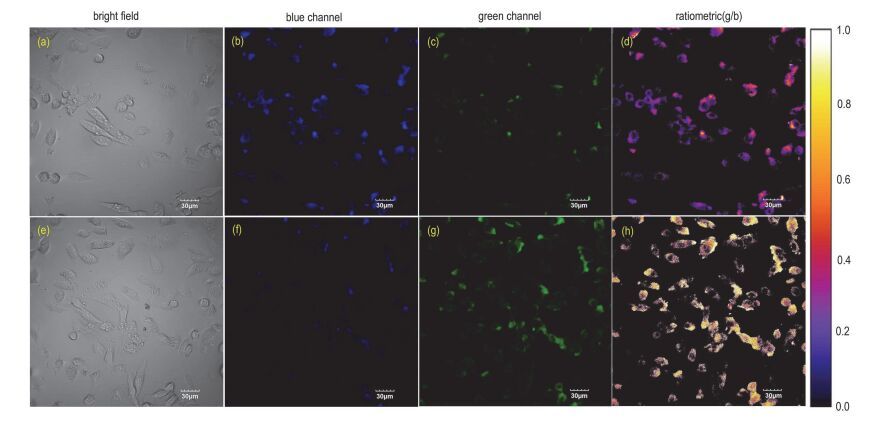 图 8
探针CS3在MCF-7细胞中成像实验, (a~d) 细胞经探针CS3 (5 μmol/L) 染色后的成像图, (e~h) 细胞经探针CS3 (5 μmol/L) 染色后, 加入F- (50 μmol/L) 培养后的成像图, 蓝色通道收集400~450 nm波段的信号, 绿色通道收集475~525 nm波段的信号, 比率成像图片通过绿色通道和蓝色通道荧光强度的比值合成, 标尺是30 μm
Figure 8.
Ratiometric imaging of F- in MCF-7 cells. (a~d) cells were incubated with 5 μmol/L probe CS3 only; (e~h) cells were treated with 50 μmol/L F- after incubation with probe CS3 (5 μmol/L). Blue channel obtained from 400 to 450 nm, green channel obtained from 475 to 525 nm, and ratiometric images generated from green and blue channel. Scale bar is 30 μm
图 8
探针CS3在MCF-7细胞中成像实验, (a~d) 细胞经探针CS3 (5 μmol/L) 染色后的成像图, (e~h) 细胞经探针CS3 (5 μmol/L) 染色后, 加入F- (50 μmol/L) 培养后的成像图, 蓝色通道收集400~450 nm波段的信号, 绿色通道收集475~525 nm波段的信号, 比率成像图片通过绿色通道和蓝色通道荧光强度的比值合成, 标尺是30 μm
Figure 8.
Ratiometric imaging of F- in MCF-7 cells. (a~d) cells were incubated with 5 μmol/L probe CS3 only; (e~h) cells were treated with 50 μmol/L F- after incubation with probe CS3 (5 μmol/L). Blue channel obtained from 400 to 450 nm, green channel obtained from 475 to 525 nm, and ratiometric images generated from green and blue channel. Scale bar is 30 μm
3 结论
本文设计合成了一类基于香豆素的新型F-荧光探针CS1, CS2和CS3, 该类探针基于氟化物脱硅基反应可实现对F-的识别.由于与F-反应后, 探针分子中香豆素环的7位形成的氧负离子具有较强的供电子能力, 使得ICT效应增强, 所以该类探针与F-反应后发射波长红移 (CS1和CS3) 且随F-浓度增加荧光强度逐渐增强 (CS1, CS2和CS3).光谱分析实验结果显示, CS1, CS2和CS3均具有较好的选择性和灵敏度, 且均能成功实现人乳腺癌细胞 (MCF-7) 中F-的检测.
4 实验部分
4.1 化合物的合成及表征
4.2 荧光探针在活体细胞中的成像研究
细胞毒性实验:选用融合度90%以上的MCF-7细胞, 使用0.25%的胰蛋白酶酶解, 转移酶解后的细胞到96孔板中, 在5% CO2、37 ℃环境中培养过夜.接着分别向96孔板中加入不同浓度的探针CS1, CS2和CS3, 同样的条件下再培养24 h.然后, 再向每一孔板滴加10 μL MTT, 并继续培养4 h.培养结束后使用PBS缓冲液冲洗细胞两次, 并向其中加入1 mL DMSO进行溶解, 最后使用酶标仪在490 nm光照下测定其吸收, 处理数据, 分析实验结果.
细胞成像实验:将MCF-7细胞经0.25%的胰蛋白酶消化5 min后置于培养皿中, 加入含10%胎牛血清的RPMI 1640培养基, 在5% CO2、37 ℃的培养箱中过夜培养.随后, 将细胞接种到激光共聚焦皿中, 在5% CO2、37 ℃条件下培养12 h, 待其贴壁后方可进行实验.另外分别配制探针CS1, CS2和CS3的溶液, 并用培养基稀释至5 μmol/L.将贴壁后的细胞分别用所配探针溶液培养30 min, 接着用PBS缓冲液洗涤细胞三次, 再用Olympus FV1000共聚焦荧光成像显微镜进行观察和实验.接着将上述细胞分别用F- (50 μmol/L) 培养30 min, PBS缓冲液洗涤后再次成像.
4.3 探针CS3的单晶培养与测定
本实验以乙醚为溶剂, 通过自然挥发法得到探针CS3的单晶.从中挑选出尺寸适合的单晶, 将其放置于Bruker Smart ApexⅡCCD X-ray单晶衍射仪上, 在296(2) K温度下, 用被石墨单色器单色化处理的Mo Kα射线 (λ=0.71073 Å) 收集衍射数据, 选用I>2σ(I) 的衍射点进行单晶结构分析.晶体结构解析用SHELXS-97和SHELXL-97程序进行.晶体初始模型中, 非氢原子可用差值Fourier合成找出, 再通过F2的全矩阵最小二乘法对原子的坐标及各向异性参数进行精修, 氢原子坐标通过理论加氢或电子密度函数找到, 并采用精修的命令结合其它原子同时来分析得到最终结果.这些数据在CCDC中的存储标号为1525667.探针CS3的晶体数据和结构精修参数列于表S2, 其相应的键长, 键角数据及非氢原子坐标和各项同性热参数分别见表S3、表S4和表S5.
4.1.3 3-苯并噻唑基-7-叔丁基二甲基硅氧基香豆素 (CS3) 的合成
将10.0 mmol (2.32 g) 化合物1和25.0 mmol (4.45 g) NBS加在300 mL四氯化碳中, 再向其加入痕量的AIBN, 然后加热回流12 h.冷至室温, 旋干溶剂后得到白色固体, 接着向其加入4.4 g醋酸钠和160 mL乙酸, 继续回流12 h.回流结束后得到米黄色澄清透明体系, 随后向此体系中加入160 mL 2.0 mol/L盐酸, 接着回流0.5 h.冷至室温, 并在室温下搅拌过夜.反应结束后得到棕色沉淀, 抽滤反应体系, 所得固体经水和甲醇洗涤, 最后得到棕色固体4.取2.0 mmol (0.38 g) 上述棕色固体4溶于20.0 mL无水乙醇中, 室温条件下向其加入2.0 mmol邻氨基苯硫酚, 然后再向其加入6.0 mmol盐酸和12.0 mmol过氧化氢.室温下搅拌2.0 h后将体系倒入20.0 mL冰水中, 过滤沉淀, 并用甲醇重结晶, 得到黄色固体5.氩气保护下, 将1.0 mmol上述黄色固体5和1.5 mmol咪唑溶于30.0 mL无水THF中, 室温下搅拌0.5 h后再向其加入1.2 mmol叔丁基二甲基氯硅烷, 室温下继续搅拌8 h.反应结束后向体系中加入50.0 mL冰水, 用CH2Cl2萃取三次, 有机相经水洗后再用无水硫酸钠干燥, 过滤体系后旋干溶剂.把所得粗品进行柱层析提纯 (洗脱剂:乙酸乙酯/石油醚15/1), 得到0.21 g黄绿色晶状固体CS3, 产率51.3%, m.p. 159~160 ℃, 1H NMR (400 MHz, CDCl3) δ: 9.06 (s, 1H), 8.08 (d, J=8.0 Hz, 1H), 7.98 (d, J=8.0 Hz, 1H), 7.60 (d, J=9.1 Hz, 1H), 7.53 (t, J=8.2 Hz, 1H), 7.42 (t, J=7.6 Hz, 1H), 6.89 (s, 1H), 6.87 (d, J=8.6 Hz, 1H), 1.01 (s, 9H), 0.30 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 161.01, 160.48, 160.20, 155.66, 152.37, 141.69, 136.58, 130.55, 126.39, 125.10, 122.63, 121.72, 118.59, 116.97, 113.31, 107.42, 25.54, 18.30, -4.33; IR (KBr) ν: 3415, 2971, 2859, 2696, 1722, 1598, 1515, 1438, 1346, 1255, 1126, 910, 746, 634 cm-1; HRMS calcd for C22H23O3NSSi [M+H]+ 410.1241, found 410.1245.
4.1.2 3-乙酰基-7-叔丁基二甲基硅氧基香豆素 (CS2) 的合成
将10.0 mmol (1.38 g) 2, 4-二羟基苯甲醛和11.0 mmol (14.0 mL) 乙酰乙酸乙酯溶于10.0 mL无水乙醇中, 并向其滴加0.1 mL哌啶, 然后加热回流24 h.回流结束后冷至室温, 过滤出沉淀并用少量乙醇洗涤, 再经乙醇重结晶后得到棕色晶体3.氩气保护下, 取1.0 mmol上述棕色晶体3和1.5 mmol咪唑溶于30.0 mL无水THF中, 室温下搅拌0.5 h后再向其加入1.2 mmol叔丁基二甲基氯硅烷, 在室温下继续搅拌12 h.反应结束后将体系倒入50.0 mL冰水中, 过滤沉淀, 晾干后进行柱层析提纯 (洗脱剂:二氯甲烷/甲醇40/1), 得到0.16 g黄色片状结晶CS2, 产率50.3%, m.p. 126~127 ℃, 1H NMR (400 MHz, CDCl3) δ: 8.49 (s, 1H), 7.52 (d, J=8.5 Hz, 1H), 7.27 (s, 1H), 6.82 (d, J=8.5Hz, 1H), 2.71 (s, 3H), 0.94 (s, 9H), 0.27 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 195.54, 162.12, 159.73, 157.38, 147.75, 131.59, 120.90, 118.45, 112.62, 107.16, 30.60, 25.50, 18.28, -4.36; IR (KBr) ν: 3394, 3276, 2925, 1693, 1613, 1556, 1442, 1317, 1214, 1130, 950, 84 750 cm-1; HRMS calcd for C17H22O4Si [M+H]+319.1321, found 319.1319.
4.1.1 3-甲基-7-叔丁基二甲基硅氧基香豆素 (CS1) 的合成
将10.0 mmol (1.38 g) 2, 4-二羟基苯甲醛以及22.0 mmol (2.10 g) 丙酸钠溶于29.0 mmol丙酸酐中搅拌均匀, 然后向体系滴加2~3滴三乙胺.加料完成后回流6 h, 然后冷至室温, 接着把体系倾倒入100.0 mL的冷水中, 过滤沉淀、并用冷水洗涤几次, 再把所得粗品用甲醇重结晶, 便得到无色晶体1.接着把所得晶体1投入到20.0 mL 2.0 mol/L的盐酸中, 回流4 h后得到白色沉淀, 把所得沉淀过滤、洗涤、晾干再用乙醇重结晶, 得到纯白色固体2.氩气保护下, 取1.0 mmol上述纯白色固体2和1.5 mmol咪唑溶于20.0 mL无水THF中, 室温下搅拌0.5 h后再向其加入1.2 mmol叔丁基二甲基氯硅烷, 在室温下继续搅拌20 h.反应结束后将体系倒入50.0 mL冰水中, 过滤沉淀, 柱层析提纯 (洗脱剂:乙酸乙酯/石油醚10/1) 后得到0.18 g白色晶体即探针CS1, 产率62.1%, m.p. 114~115 ℃, 1H NMR (400 MHz, CDCl3) δ: 7.45 (s, 1H), 7.27 (d, J=8.4 Hz, 1H), 6.78 (d, J=8.4 Hz, 1H), 6.75 (s, 1H), 2.17 (s, 3H), 0.99 (s, 9H), 0.24 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 162.55, 158.13, 154.56, 139.33, 127.74, 122.40, 117.30, 113.88, 107.39, 25.58, 18.26, 16.98, -4.41; IR (KBr) ν: 3276, 3075, 2881, 1691, 1617, 1446, 1380, 1251, 1164, 1124, 916, 842, 744, 632 cm-1; HRMS calcd for C16H22O3Si [M+H]+ 291.1411, found 291.1392.
支持信息 (Supporting Information)
实验中使用的试剂及仪器、部分光谱谱图、中间体及探针的结构表征及单晶数据等信息详见“支持信息”(Supporting Information) 中.
-
-
[1]
Gale, P. A. Chem. Soc. Rev. 2010, 39, 3746. doi: 10.1039/c001871f
-
[2]
Bowman-James, K. Acc. Chem. Res. 2005, 38, 671. doi: 10.1021/ar040071t
-
[3]
Gale, P. A. Acc. Chem. Res. 2006, 39, 465. doi: 10.1021/ar040237q
-
[4]
Zhou, Y.; Zhang, J. F.; Yoon, J. Chem. Rev. 2014, 114, 5511. doi: 10.1021/cr400352m
-
[5]
Suksai, C.; Tuntulani, T. Top. Curr. Chem. 2005, 255, 163.
-
[6]
Gale, P. A. Chem. Commun. 2011, 47, 82. doi: 10.1039/C0CC00656D
-
[7]
Featherstone, J. D. B. Community. Dent. Oral. Epidemiol. 1999, 27, 31. doi: 10.1111/com.1999.27.issue-1
-
[8]
Bassin, E. B.; Wypij, D.; Davis, R. B.; Mittleman, M. A. Cancer Causes Control 2006, 17, 421. doi: 10.1007/s10552-005-0500-6
-
[9]
Matsui, H.; Morimoto, M.; Horimoto, K.; Nishimura, Y. Toxicol. In Vitro 2007, 21, 1113. doi: 10.1016/j.tiv.2007.04.006
-
[10]
Basha, P. M.; Madhusudhan, N. Neurochem. Res. 2010, 35, 1017. doi: 10.1007/s11064-010-0150-2
-
[11]
Wade, C. R.; Broomsgrove, A. E. J.; Aldridge, S. Chem. Rev. 2010, 110, 3958. doi: 10.1021/cr900401a
-
[12]
Barbier, O.; Arreola-Mendoza, L.; DelRazo, L. M. Chem.-Biol. Interact. 2010, 188, 319. doi: 10.1016/j.cbi.2010.07.011
-
[13]
Singh, P.; Barjatiya, M.; Dhing, S.; Bhatnagar, R.; Kothari, S.; Dhar, V. Urol. Res. 2001, 29, 238. doi: 10.1007/s002400100192
-
[14]
Duke, R. M.; Veale, E. B.; Pfeffer, F. M.; Kruger, P. E.; Gunnlaugsson, T. Chem. Soc. Rev. 2010, 39, 3936. doi: 10.1039/b910560n
-
[15]
Hang, Y. P.; Wu, C. Y. Anal. Chim. Acta 2010, 661, 161. doi: 10.1016/j.aca.2009.12.018
-
[16]
Somer, G.; Kalayci, S.; Basak, I. Talanta 2010, 80, 1129. doi: 10.1016/j.talanta.2009.08.037
-
[17]
Tan, W. B.; Leng, T. H.; Lai, G. Q.; Li, Z. F.; Wu, J. F.; Shen, Y. J.; Wang, C. Y. Chin. J. Chem. 2016, 34, 809. doi: 10.1002/cjoc.v34.8
-
[18]
Zhang, L.; Wang, L. M.; Zhang, G. J.; Yu, J. J.; Cai, X. F.; Teng, M. S.; Wu, Y. Chin. J. Chem. 2012, 30, 2823. doi: 10.1002/cjoc.v30.12
-
[19]
Chen, Z. J.; Wang, L. M.; Zou, G. Zhang, L.; Zhang, J. L.; Cai, X. F.; Teng, M. S. Dyes Pigments 2012, 94, 410. doi: 10.1016/j.dyepig.2012.01.024
-
[20]
Chen, W.; Li, Z.; Shi, W.; Ma, H. M. Chem. Commun. 2012, 48, 2809. doi: 10.1039/c2cc17768d
-
[21]
卓继斌, 晏希泉, 王小雪, 谢莉莉, 袁耀锋, 有机化学, 2015, 35, 1090.Zhuo, J. B.; Yan, X. Q.; Wang, X. X.; Xie, L. L.; Yuan, Y. F. Chin. J. Org. Chem. 2015, 35, 1090(in Chinese).
-
[22]
Wang, F.; Wu, J. S.; Zhuang, X. Q.; Zhang, W. J.; Liu, W. M. Sens. Actuators, B 2010, 146, 260. doi: 10.1016/j.snb.2010.02.007
-
[23]
Qu, Y.; Hua, J.; Tian, H. Org. Lett. 2010, 12, 3320. doi: 10.1021/ol101081m
-
[24]
Wang, J. Q.; Yang, L. Y.; Hou, C.; Cao, H. S. Org. Biomol. Chem. 2012, 10, 6271. doi: 10.1039/c2ob25903f
-
[25]
Ke, I. S.; Myahkostupov, M.; Castellano, F. N. J. Am. Chem. Soc. 2012, 134, 15309. doi: 10.1021/ja308194w
-
[26]
Fu, L.; Jiang, F. L.; Fortin, D.; Harvey, P. D.; Liu, Y. Chem. Commun. 2011, 47, 5503. doi: 10.1039/c1cc10784d
-
[27]
Liu, X. M.; Zhao, Q.; Li, Y.; Song, W. C.; Li, Y. P.; Chang, Z.; Bu, X. H. Chin. Chem. Lett. 2013, 24, 962. doi: 10.1016/j.cclet.2013.06.032
-
[28]
Lv, H. M.; Yang, X. F.; Zhong, Y. G.; Guo, Y.; Li, Z.; Li, H. Anal. Chem. 2014, 86, 1800. doi: 10.1021/ac4038027
-
[29]
赵振盛, 郭旭东, 李沙瑜, 杨国强, 化学学报, 2016, 74, 593. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345646.shtmlZhao, Z. S.; Guo, X. D.; Li, S. Y.; Yang, G. Q. Acta Chim. Sinica 2016, 74, 593(in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345646.shtml
-
[30]
于海波, 李红玲, 张新富, 肖义, 方沛菊, 吕春娇, 侯伟, 化学学报, 2015, 73, 450. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345646.shtmlYu, H. B.; Li, H. L.; Zhang, X. F.; Xiao, Y.; Fang, P. J.; Lv, C. J.; Hou, W. Acta Chim. Sinica 2015, 73, 450(in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345646.shtml
-
[31]
Duan, Y. W.; Yang, X. F.; Zhong, Y. G.; Guo, Y.; Li, Z.; Li, H. Anal. Chim. Acta 2015, 859, 59. doi: 10.1016/j.aca.2014.12.054
-
[32]
杨阳, 黄嫣嫣, 张关心, 赵睿, 张德清, 化学学报, 2016, 74, 871. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345765.shtmlYang, Y.; Hang, Y. Y.; Zhang, G. X.; Zhao, R.; Zhang, D. Q. Acta Chim. Sinica 2016, 74, 871(in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345765.shtml
-
[33]
Wu, Z. S.; Tang, X. J. Anal. Chem. 2015, 87, 8613. doi: 10.1021/acs.analchem.5b02578
-
[34]
Li, L.; Ji, Y. Z.; Tang, X. J. Anal. Chem. 2014, 86, 10006. doi: 10.1021/ac503177n
-
[1]
-
图 2 (a) 探针CS1 (10 μmol/L) 加入F- (0~200 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线. (b) 探针CS2 (10 μmol/L) 加入F- (0~200 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线. (c) 探针CS3 (10 μmol/L) 加入F- (0~150 μmol/L) 的荧光光谱变化曲线, 插图:工作曲线
Figure 2 (a) Fluorescence spectra of probe CS1 (10 μmol/L) in the presence of F- (0~200 μmol/L). Inset: A plot of F465/F396 vs. the concentration of F- in the range of 0~200 μmol/L. (b) Fluorescence spectra of probe CS2 (10 μmol/L) in the presence of F- (0~200 μmol/L). Inset: A plot of F460 vs. the concentration of F- in the range of 0~20 μmol/L. (c) Fluorescence spectra of probe CS3 (10 μmol/L) in the presence of F- (0~150 μmol/L). Inset: A plot of F500/F450 vs. the concentration of F- in the range of 0~12 μmol/L
图 3 (a) 探针CS1 (10 μmol/L), (b) 探针CS2 (10 μmol/L) 和 (c) 探针CS3(10 μmol/L) 加入不同阴离子 (100 μmol/L) 的荧光光谱图
Figure 3 The fluorescence spectra of (a) probe CS1 (10 μmol/L), (b) probe CS2 (10 μmol/L) and (c) probe CS3 (10 μmol/L) to various species (100 μmol/L for Cl-, Br-, I-, SO42-, NO3-, NO2-, SO32-, HSO3-, S2-, SCN-, ClO-, AcO-, S2O32-, CN-, CO32- and F-)
图 4 (a) 探针CS1(10 μmol/L), (b) 探针CS2 (10 μmol/L) 和 (c) 探针CS3 (10 μmol/L) 在F-(100 μmol/L) 存在下加入不同阴离子 (100 μmol/L) 的荧光光谱图
Figure 4 The fluorescence spectra of (a) probe CS1 (10 μmol/L), (b) probe CS2 (10 μmol/L) and (c) probe CS3 (10 μmol/L) to various species (100 μmol/L Cl-, Br-, I-, SO42-, NO3-, NO2-, SO32-, HSO3-, S2-, SCN-, ClO-, AcO-, S2O32-, CN-, CO32-) in the presence of F- (100 μmol/L)
图 8 探针CS3在MCF-7细胞中成像实验, (a~d) 细胞经探针CS3 (5 μmol/L) 染色后的成像图, (e~h) 细胞经探针CS3 (5 μmol/L) 染色后, 加入F- (50 μmol/L) 培养后的成像图, 蓝色通道收集400~450 nm波段的信号, 绿色通道收集475~525 nm波段的信号, 比率成像图片通过绿色通道和蓝色通道荧光强度的比值合成, 标尺是30 μm
Figure 8 Ratiometric imaging of F- in MCF-7 cells. (a~d) cells were incubated with 5 μmol/L probe CS3 only; (e~h) cells were treated with 50 μmol/L F- after incubation with probe CS3 (5 μmol/L). Blue channel obtained from 400 to 450 nm, green channel obtained from 475 to 525 nm, and ratiometric images generated from green and blue channel. Scale bar is 30 μm
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 1093
- HTML全文浏览量: 186


 下载:
下载:








 下载:
下载:

