 图1
光催化产氢模拟图
Figure1.
The simulated diagram of photocatalytic hydrogen production
图1
光催化产氢模拟图
Figure1.
The simulated diagram of photocatalytic hydrogen production

Citation: LU Lingwei, SUN Xiaoqin, WANG Yawei, JIANG Lu, XU Xiaoxiang. Research Progress in Titanium Based Perovskite as Photocatalytic Materials[J]. Chinese Journal of Applied Chemistry, 2017, 34(11): 1221-1239. doi: 10.11944/j.issn.1000-0518.2017.11.170305

钛基钙钛矿型光催化材料的研究进展
English
Research Progress in Titanium Based Perovskite as Photocatalytic Materials
-
Key words:
- titanium based
- / perovskite
- / layered perovskite
- / crystal structure
- / photocatalysis
-
进入21世纪以来,能源危机与环境污染已逐渐成为了人类社会持续发展所面临的首要问题。以煤、石油、天然气为主的化石能源储量按照现在的消耗速度,分别只能维持53.3年、55.1年和113年[1-3]。更重要的是,化石能源在燃烧过程中会释放二氧化碳、二氧化硫等有害气体,这会进一步加重温室效应、酸雨等环境污染问题,进而危害人类的身体健康。所以,寻找新的、干净的能源体系迫在眉睫。值得注意的是,氢能作为清洁能源的代表得到了越来越多的关注。氢是一种高燃烧值和高效率的能源,它的循环使用不涉及任何污染,被誉为“终极清洁能源” [1]。但目前氢能的来源主要通过煤、天然气的重整获得,在这过程中,不仅化石燃料被消耗,同时还释放了二氧化碳,加剧了非可再生能源的消耗并带来了环境污染问题[2]。所以,寻找一种新的制氢方式势在必行。
1972年,日本东京大学Fujishima和Honda[3]发现了利用TiO2进行光催化反应可使水分解成氢和氧后,光催化制氢成为了全世界热门的研究方向。光催化反应如图 1所示,当太阳光照射在分散有光催化剂的水溶液中,水被分解为氢气和氧气,所以光催化反应实质上是将光能转化为化学能的过程,鉴于太阳能取之不尽用之不竭的特点,以水为原料,利用太阳能制氢是从根本上解决能源及环境污染问题的理想途径之一。早期光催化反应主要集中在TiO2上,包括其晶体结构[4-5]、元素掺杂改性[6-7]、形貌[8]等方面。继TiO2后,其它光催化材料也陆续被报道, 如1980年日本学者[9]首次报道了钙钛矿型SrTiO3,负载了助催化剂NiO后,可在紫外光下光解水;Kudo课题组发现[10] La掺杂的NaTaO3负载质量分数为0.2%的NiO后,其紫外光下分解水的量子效率高达56%;Reber和Meier[11]将金属硫化物ZnS在碱性Na2S和H3PO2溶液中进行光催化产氢测试,量子效率可达90%;Kudo课题组[12]报道的层状钙钛矿结构材料Ba5Nb4O15,在紫外光下可产氢2366 μmol/h和产氧1139 μmol/h。总的来说,在目前已发现的光催化材料中,钙钛矿材料以及它们的衍生物(层状钙钛矿材料)由于其结构、组分丰富,稳定性好以及光催化性能佳的优势成为了前景较好的半导体光催化材料。Tanaka和Misono[13]曾总结过钙钛矿的优点:第一,可由多种元素组成,晶体结构也很多样,便于合成和改性;第二,其块状结构非常具有特征性,可以从它们中较好结构的相关性质推测表面性质;第三,它们的化合价、化学计量数以及空位非常丰富,为实现性质的调控提供了多种手段;第四,关于它们的物理及固态化学性质已有较好的研究积累。本文主要总结了钛基钙钛矿材料及其衍生物在光催化分解水领域的研究进展。钛元素具有储量较大,化学性质比较稳定和环境友好等优点,有利于大规模应用。钛基钙钛矿材料及其衍生物表现出了许多优异的光催化活性,是太阳能光催化研究领域的研究热点。本文将从组分及结构的角度出发,探讨影响钛基钙钛矿材料光催化活性的因素。
1 半导体光催化反应
1.1 半导体光催化分解水的基本原理
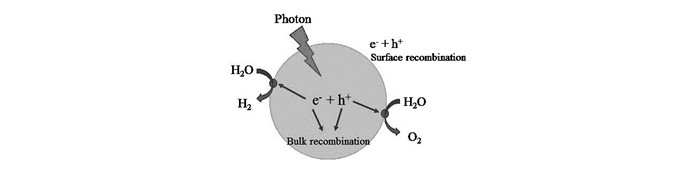
光催化指的是通过将光能转化为化学能,促进化合物的合成或使化合物(包括有机物)分解的过程。光催化反应可以分解为光催化氧化反应和光催化还原反应两步。从热力学角度分析,光催化将水分解为氢气和氧气是一个能量增大的非自发反应,属上坡反应,需要较大的吉布斯自由能(ΔG0=238 kJ/mol)。如图 2所示,当半导体材料受到能量等于或高于其禁带宽度的光子照射时,其价带上的电子(e-)受到激发发生跃迁,跃迁至导带,同时在价带上留下空穴(h+),形成了电子-空穴对。光生电子具有还原性,而光生空穴具有氧化性,在理想的光催化分解水的过程中,水分子被光生电子还原生成氢气(光催化还原反应),被光生空穴氧化生成氧气(光催化氧化反应)。
从动力学角度分析,光催化分解水的过程可分为3个步骤,如图 3所示,第一步是光照射后,半导体材料吸收光能产生电子-空穴对(光生载流子)。第二步是光生载流子从体相迁移到催化剂表面。第三步,到达表面的光生电子和空穴分别发生还原反应和氧化反应(载流子的表面转移)。
1.2 影响光催化反应的因素
根据光催化分解水的反应过程,可将影响光催化反应的因素归纳总结为材料本质光生载流子的跃迁能力、运输能力及分离能力。
首先,对于光催化剂的选择,为了有效实现光催化反应,要求其具有合适的带隙,其实也就是其导带底要负于H+/H2的氧化还原电位(0 V vs.NHE),价带顶要正于O2/H2O的氧化还原电位(1.23 eV),现有研究表明,通过掺杂、固溶体、形成异质结等复合物的方式可以调节宽带隙的半导体材料(如SrTiO3、TiO2和NaTaO3等)实现可见光下分解水或者降解有机物。
其次,光生载流子在运输过程中对于晶体的结晶度及微观形貌有较大的要求,一般情况下,结晶度越高,晶体的缺陷越少,在光催化反应中,晶体的缺陷易形成光生电子和空穴的复合中心,导致性能下降;颗粒尺寸越小,光生电子和空穴迁移至表面的活性位点的距离越短,从而复合的可能性就大大减少。
最后,对于光生载流子的分离,可以通过形成异质结或者负载助催化剂来有效地提高分离的效率,负载助催化剂可以通过提供活性位点同时抑制光生电子与空穴的复合以及逆反应的发生,促进光催化反应的进行,所以选择合适的助催化剂、适当的助催化剂量以及助催化剂在光催化材料表面的分布情况对光生载流子的分离起到了很强的作用。
2 钙钛矿型光催化材料
2.1 钛基钙钛矿型(ATiX3)材料及其结构
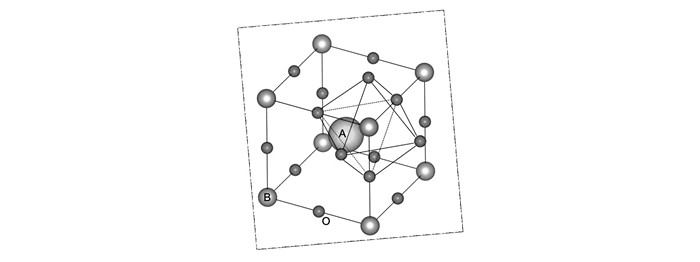
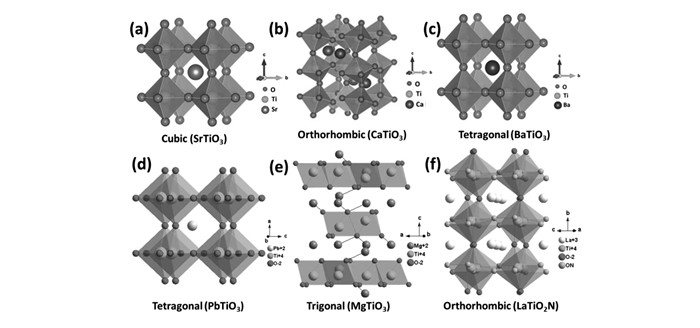
钙钛矿化合物的结构通式是ABX3,具有立方对称性,属Pm3m空间群,其中A位元素为半径较大的金属阳离子,如碱金属、碱土金属、稀土金属,B位元素为半径较小的金属阳离子,如过渡金属[14]。X为阴离子如O2-、N3-、F-和Cl-等。B位离子与邻近的6个X离子配位形成BX6八面体,配位数为6,A位离子与邻近12个X离子配位,配位数为12,整个结构可看作是BX6八面体顶点相连形成的钙钛矿结构,或者可以看成A与X的立方密堆积结构,而B填充在X的八面体空穴里面。结构图如图 4所示。
理想的钙钛矿化合物ATiO3结构中的离子半径满足关系式:RA+RO=
$ \sqrt 2 $ (RB+RO)·t, 其中,RA、RB、RO分别代表A、B、O的离子半径,t称为容忍因子(Tolerance factor)[15]。稳定的钙钛矿型材料的容忍因子满足0.75≤t≤1,当t=1时,晶体结构属简单立方堆积,是理想的立方钙钛矿结构,SrTiO3的容忍因子t=1.002,其中RO=0.140 nm, RSr=0.144 nm和RTi=0.0605 nm, 被称为“最理想的钙钛矿型光催化材料”;当t<1时,钙钛矿结构中以顶点相连的八面体发生协同扭曲,同时A位原子发生偏中心位移,例如由立方结构钙钛矿扭曲成正交结构的CaTiO3[16](t=0.843)、四方结构的PbTiO3[17](t=0.917)和BaTiO3[20](t=0.970)等;当t≤0.75时,呈钛铁矿型,例如MgTiO3[19](t=0.747)、FeTiO3[20](t=0.723)、NiTiO3[21](t=0.748)和ZnTiO3[22](t=0.755)等[23],钛铁矿结构中,氧离子按六方最紧密方式堆积,而A、B两类阳离子则有序地交替占据其中的八面体空隙。LaTiO2N是一种钙钛矿型氮氧化物,其结构同样符合钙钛矿型结构,其结构由La离子与周边12个阳离子填充于TiOxNy八面体(x+y=6)中心位置构成[24]。几种钛基钙钛矿型光催化材料结构如图 5所示。2.2 钛基钙钛矿材料的光催化性能及改性研究
钙钛矿是由俄罗斯矿物学家Count Lev Perovskite命名而来,随后地质学家Gustav Rose在1830年首次提到了CaTiO3[13], 1955年,美国国家李德公司用焰熔法制成了一种人工宝石,其成分为SrTiO3, 1980年日本学者Domen[9]对SrTiO3进行了研究, 同年加利福尼亚大学Wagner[25]在Nature上发表了关于SrTiO3的光催化研究。SrTiO3因其结构最接近ABO3型结构,被认为是最理想的钙钛矿材料,除此之外,SrTiO3具有环境友好、化学结构稳定、以及在无偏压下实现光催化分解水的优点,并且广泛应用于电子、机械与陶瓷工业,是一种具有发展潜力的半导体材料。SrTiO3虽然是一种比较传统的半导体光催化材料,并且具有良好的电子-空穴分离与运输特性,但其禁带宽度较宽(3.2 eV,导带位置在-0.2 V vs.NHE, pH=0, 价带位置在3.0 V vs.NHE, pH=0),只能在紫外下实现分解水[26]。所以,对SrTiO3进行改性从而拓展其光响应范围成为目前光催化研究的热点问题。
除了SrTiO3之外,其它钙钛矿材料ATiO3(如CaTiO3、BaTiO3、PbTiO3、CdTiO3、NiTiO3、ZnTiO3、LaTiO2N等)。其中BaTiO3是一种n型半导体材料,禁带宽度为3.0 eV, 由于结构也是钙钛矿型,所以BaTiO3表现出了良好的光催化分解水的性能[27]。原始型的钙钛矿是一种含有CaTiO3成分的矿物,而CaTiO3也是比较传统的光催化材料,其禁带宽度为3.15 eV, 由于其成本较低、合成方法简单以及较好的化学稳定性,被广泛用作光催化材料[16]。NiTiO3, 禁带宽度为2.18 eV,禁宽适宜,作为光催化材料在可见光下有独特的光响应[21]。LaTiO2N是一种钙钛矿型氮氧化物,在有合适的牺牲剂条件下、光照波长达600 nm下可实现光催化分解水[24, 28]。见表 1。
Perovskite Doping element Band gap/eV Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) O2/ (μmol·h-1) Pollutants* Ref. BaTiO3 Ag - water 350 W Hg MO [29] Fe 2.81 150 W Xe>420 nm photocurrent [30] Rh - Pt(0.25) 10%CH3OH 300 W Xe>420 nm 30.8 [27] CaTiO3 Ag,La - - 5%CH3OH 350 W Xe>400 nm 10.1 [31] Zr 3.592 Pt(1) 5%C2H5OH 500 W Hg 140 [32] Cu - NiOX 5%CH3OH 350 W Xe>400 nm 22.7 [33] NiTiO3 Ag - - water UV MB [21] PbTiO3 Cu - - 5%CH3OH 125 W Hg>400 nm 90 [17] ZnTiO3 La 2.92 - water sunlight RhB [34] LaTiO2N Ca 1.63 CoOX 0.05 mol/L AgNO3 400 W Xe>400 nm 63 [35] Catalyst:0.1 g, *MO:Methyl Orange, MB:Methyl Blue, RhB:Rhodamine B. 2.2.1 光学吸收改性
半导体材料的能带结构需满足水分解的氧化还原电势,理论上要实现在可见光下分解水为H2和O2,半导体的禁带宽度一般要大于水分解电势1.23 eV,根据公式:Eg=1240/λ, 对应的λ(光波长)约为1100 nm,若要使材料具有可见光吸收,即λ≥400 nm, 对应的带宽为3.1 eV,所以理论上具有可见光响应材料的带宽范围在1.23 ~3.1 eV[1],而典型的光催化材料(如SrTiO3、CaTiO3等)的禁带宽度较宽,只具有紫外光响应,所以,我们通过将新的元素引入原始材料的晶体结构中(掺杂改性),掺杂可在材料的CB和VB之间形成新的杂质能级,在可见光照射下,电子从新的能级上跃迁至导带,禁带宽度变窄,吸收光谱红移,从而实现可见光响应]36]。
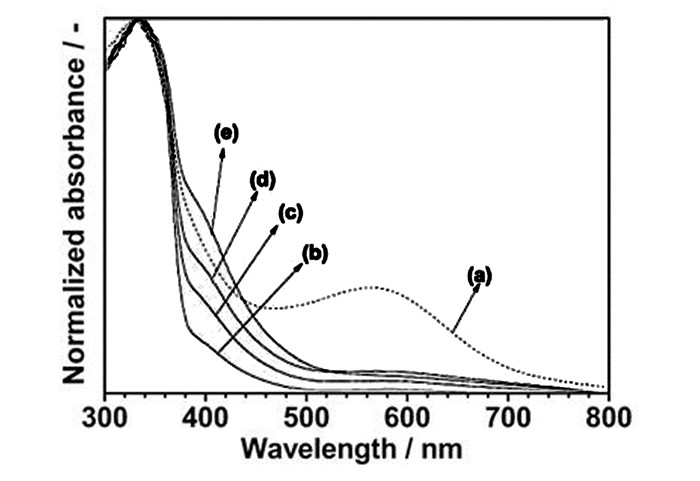
SrTiO3具有Sr、Ti两种阳离子替代位和一种O阴离子替代位,根据不同替代位,我们可以分为阳离子掺杂和阴离子掺杂,阳离子掺杂主要是金属离子掺杂,Chen课题组[37]通过将Cr掺杂到SrTiO3中, 掺杂后的材料吸收边发生红移,并且掺杂Cr后的SrTiO3能在甲醇溶液中实现可见光下分解水产氢, 根据紫外可见漫反射图谱以及密度泛函理论计算发现,掺杂Cr之后在CB和VB之间形成了一个新的杂质能级,即为Cr的3d轨道,同时CB是由Cr的3d轨道和Ti的3d轨道形成的杂化轨道,在光照下,电子从杂质能级向杂化的CB能级发生电子转移,从而缩短了SrTiO3的带宽,吸收边向可见光区移动。之后,Kudo课题组[38]又系统研究了贵金属(Mn、Ru、Rh、Ir)掺杂到SrTiO3中对光催化性能的影响,掺杂之后的SrTiO3禁带宽度变窄,分别为2.7、1.9、1.7和2.3 eV,能在甲醇溶液中、可见光下成功实现分解水产氢,并且也能在AgNO3溶液中实现分解水产生氧气。掺杂虽然可以降低材料的禁带宽度,但常伴随着形成电子与空穴的复合中心,从而降低了其光催化活性,所以通过双金属离子的共掺不仅可以补偿电荷平衡,还可以部分抑制复合中心的形成。2011年,Kudo课题组[39]曾报道Rh掺杂的SrTiO3中存在Rh4+, 导致电荷不平衡,2014年,Domen研究组[40]发表了一篇La和Rh共掺的SrTiO3,从紫外可见漫反射图谱中可发现,所有掺杂后的材料吸收边红移,并且La的引入削弱了550 nm附近的鼓包,即为Rh4+,如图 6所示,所以La的引入不仅抑制了氧空穴的形成,同时也抑制了Rh4+的形成,并且掺杂后的SrTiO3在可见光下分解水产氢量是Rh掺杂的SrTiO3的3.5倍,见表 2。我们[41]研究了Bi和Cr共掺杂的SrTiO3,与Cr掺杂SrTiO3不同的是,考虑到离子半径以及电荷平衡的因素,我们引入了Bi元素,从紫外漫反射光谱图可以看出,掺杂后的产物SrTiO3的可见光吸收从原来的400 nm红移至可见光区,在可见光照射下,甲醇作为空穴牺牲剂可放出氢气,理论计算与之前提到的Cr掺杂的SrTiO3相同,形成了新的杂质能级,而Bi在构建价带导带过程中没有太大贡献。在对Bi和Cr掺杂SrTiO3的研究基础上,我们[42]又进一步探究了Bi和Fe共掺SrTiO3对光催化性能的影响,采用水热法成功合成了一系列带宽可调的光催化材料,性能最佳的材料其可见光吸收红移最明显,在400 nm到600 nm之间有强烈的吸收可归因于金属至金属的价键转移(MMCT):Fe3+→Ti4+(Fe3++Ti4+→Fe4++Ti3+)或不同Fe3+之间的转移2Fe3+→Fe2++Fe4+,如图 7,密度泛函理论计算中,掺杂Fe后在CB和VB之间形成了Fe的3d杂质能级,带宽变窄,从而实现了对可见光的吸收。阴离子掺杂主要是非金属离子掺杂,相对于阳离子掺杂,对阴离子掺杂的研究相对较少,北京科技大学王金淑研究组[43]与日本东北大学合作研究了N掺杂的SrTiO3,做了光催化降解气态NO,并与纯的SrTiO3做了对比,在可见光下是SrTiO3的3.5倍,N掺杂后使得在CB和VB之间形成了N的2p和O的2p杂化能级,光照下,电子从杂化能级跃迁至导带,使得带宽变窄,有可见光吸收。日本学者Sayama[44]在2005年发表了一篇关于S和C共掺杂的SrTiO3, 掺杂之后的SrTiO3的吸收边明显从400 nm红移至700 nm,光催化性能方面通过对异丙醇的氧化进行了研究,其性能是SrTiO3的两倍。
 表 2
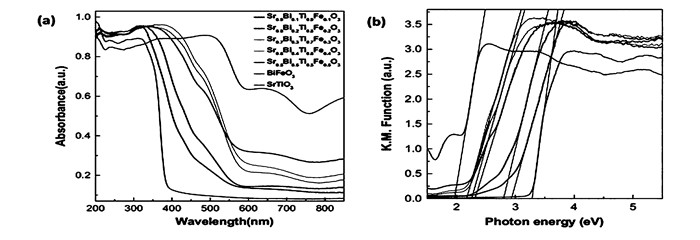
不同La掺杂量a的La/Rh共掺的SrTiO3的光催化性能[40]
Table 2.
Photocatalytic activities of SrTiO3:La/Rh with different La doping concentrations[40]
表 2
不同La掺杂量a的La/Rh共掺的SrTiO3的光催化性能[40]
Table 2.
Photocatalytic activities of SrTiO3:La/Rh with different La doping concentrations[40]

除了SrTiO3的掺杂改性研究之外,关于其它简单钙钛矿型材料也有相当多的研究。日本学者Maeda[27]探究了用PC法(聚合配合法)合成了Rh掺杂的BaTiO3,在可见光照射下光催化分解水产生了氢气,达到每小时26.67 μmol的产量,掺杂Rh后其光吸收从可见光红移至可见光下,并且Rh3+在CB和VB之间形成新的供电子能级,禁带宽度随之变窄,如图 8所示。哈尔滨工业大学张红杰和陈刚研究组[31]在2012年发表了关于Ag和La掺杂CaTiO3对光催化性能影响的研究,当Ag和La掺杂在Ca位后,其光吸收向长波长移动,可归因于电荷从Ag的4d5s轨道跃迁至O2p和Ti的3d杂化轨道,并发现通过溶胶凝胶法合成的材料无论在紫外光照条件下还是可见光照条件下,其性能均远远高于不掺杂的CaTiO3。关于SrTiO3改性及其光催化性能研究见表 3。
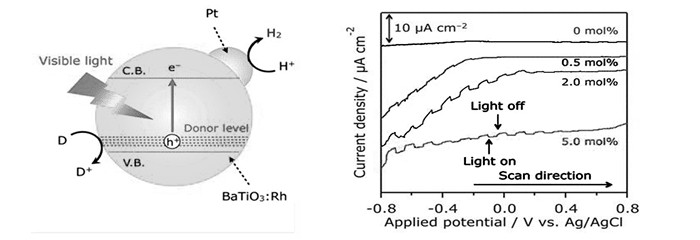 图8
(左)Rh掺杂BaTiO3光催化产氢示意图; (右)不同掺杂量Rh电极片在0.1 mol/L Na2SO4溶液中的线性扫描伏安图谱(λ>420 nm)[27]
Figure8.
(Left)The simulated diagram of photocatalytic hydrogen production by Rh doped BaTiO3; (Right)Current-voltage curves in aqueous 0.1 mol/L Na2SO4 solution(pH=5.9) under intermittent visible light(λ > 420 nm) for BaTiO3:Rh/FTO electrodes with different Rh doping amounts. Scan rate:20 mV/s[27]
图8
(左)Rh掺杂BaTiO3光催化产氢示意图; (右)不同掺杂量Rh电极片在0.1 mol/L Na2SO4溶液中的线性扫描伏安图谱(λ>420 nm)[27]
Figure8.
(Left)The simulated diagram of photocatalytic hydrogen production by Rh doped BaTiO3; (Right)Current-voltage curves in aqueous 0.1 mol/L Na2SO4 solution(pH=5.9) under intermittent visible light(λ > 420 nm) for BaTiO3:Rh/FTO electrodes with different Rh doping amounts. Scan rate:20 mV/s[27]
 表 3
SrTiO3的改性及其光催化性能研究
Table 3.
Summary of modification of SrTiO3 for water splitting and degradation of pollutants
表 3
SrTiO3的改性及其光催化性能研究
Table 3.
Summary of modification of SrTiO3 for water splitting and degradation of pollutants
Doping element BG/eV Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) O2/ (μmol·h-1) Pollutants Ref. Cr - - 5%CH3OH 350 W Xe>420 nm 27.92a [37] Mn 2.7 Pt(0.5) 10%CH3OH/ 300 W Xe>440 nm 0.2b 2.7b 0.05 mol/L AgNO3 Ru 1.9 1.7b 3.9b Ir 2.3 8.6b 0.4b [38] Rh - Pt(0.3) 300 W Xe>420 nm 141c [45] Zn 3.15 3%CH3OH 400 W Xe-Hg 732c [46] Er - Pt(1) Na2S/NaSO4 300 W Xe-Hg>420 nm 46.23b 0.185 mol/L AgNO3 44.23b [47] N - Gas 250 W Xe 410 nm<λ<500 nm 2-propanol [43] N 3.18 Gas 450 W Hg>400 nm NO [48] F 3 Gas 450 W Hg>400 nm NO [49] Sb, Cr 2.4 Pt(0.3) 8%CH3OH 400 W Xe>420 nm 78d 50 mmol/L AgNO3 0.9d [50] Cr, Ta - Pt(1) 6.5%CH3OH 300 W Xe>440 nm 70a [51] La, N - Gas 450 W Hg>400 nm NO [48] Ni, Ta 2.8 Pt(0.1) 10%CH3OH 300 W Xe>420 nm 2.4b 50 mmol/L AgNO3 0.5b [52] Ag, Pb 3.18 Gas Xe IPA [53] Cr, N 2.39 Pt(0.5) 18.5%CH3OH 300 W Xe>420 nm 106.7e [54] La, Rh - Ru(0.2) 10%CH3OH 300 W Xe>420 nm 84b [40] Bi, Cr - Pt(1) 10%CH3OH 300 W Xe>420 nm 3.7c [41] Bi, Fe - Pt(1) 0.05 mol/L Na2SO3 500 W Hg>400 nm 5c [42] S, C 2 Water 500 W Xe>400 nm 2-propanol [44] Catalyst:a.1 g; b.0.3 g; c.0.1 g; d.0.5 g; e.0.25 g, IPA:Isopropyl Alcohol. 2.2.2 电子传输改性
光催化反应过程中,电子与空穴分别从体相迁移至表相尤其关键,并伴随着电子与空穴的复合过程,有效抑制电子与空穴的复合是加强电子传输的根本途径。根据对光催化材料的报道,发现材料性能一般与材料的微观形貌有直接联系。许多研究者通过不同的合成方法,如溶胶凝胶法[55]、水热法[56-57]、聚合络合法[58]、固相法和熔融盐法[59-60]等对光催化材料进行改性。厦门大学匡勤研究组[61]通过水热法合成了多孔的SrTiO3纳米立方体,合成方法有两步,第一步是合成花状的层状钛酸盐层(LTHS)作为基底,第二步是将LTHSs溶于氢氧化钠溶液中,再加入溴化十六烷基三甲铵(CTAB)和SrCl2·6H2O, 最后将溶液转移至水热釜中,置于烘箱反应150 ℃(或180 ℃)10 h,此步骤也叫做奥斯瓦尔德熟化效应[62]下的定向附着生长过程。合成的纳米立方体颗粒大小为60~80 nm,比表面积为20.83 m2/g,与固相法合成的SrTiO3相比,水热法合成的样品尺寸小,比表面积大,其光催化性能也远超固相法合成的SrTiO3,光照下产氢达202.6 μmol/(h·g),如图 9所示,颗粒尺寸越小,光生电子和空穴迁移至表面距离越短,复合的几率减少,更加有利于光生电子和空穴的分离及传输。山东大学黄柏标研究组[56]同样通过水热法合成了中空微球状SrTiO3, 第一步合成了锐钛矿型的二氧化钛微球,第二步将合成的二氧化钛与SrCl2·6H2O溶于蒸馏水中,再加入NaOH,将溶液转移至水热釜中反应180 ℃、6 h,得到的样品用乙酸和乙醇洗涤并烘干,得到的中空型微球状SrTiO3从形貌上观察到随着反应时间的加长,颗粒尺寸变大,但依旧是纳米级,反应6 h得到70 nm左右的颗粒并且非常均匀,该研究组也对其光催化性能做了研究,对六价铬的光还原进行了测试,与P25及其它材料进行了对比,发现性能最佳的是通过水热法合成的中空型SrTiO3微球,在光照120 min后,90%的六价铬被还原。我们研究组[41]用水热法和固相法合成了Bi和Cr共掺杂的SrTiO3,发现水热法合成的材料性能优于固相法合成的材料,是固相法的5.5倍,原因在于水热法合成的样品结晶度更高,同样我们[42]用水热法合成了一系列Bi和Fe共掺杂的SrTiO3,性能最佳的材料其结晶度最高,而结晶度越高,晶体的缺陷越少,而晶体的缺陷易形成光生电子和空穴的复合中心,导致性能下降。所以,为减少电子与空穴的复合,可以从加强颗粒的结晶度及增大比表面积出发,提升其光催化性能。
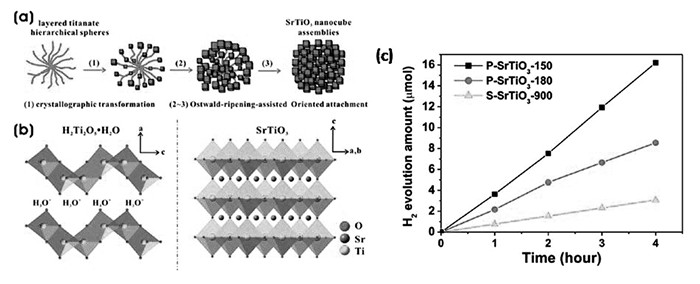 图9
(a) 由LTHSs形成单晶多孔SrTiO3纳米立方体团簇的机理示意图; (b)层状质子化钛酸盐的结构(左)和钙钛矿型SrTiO3的结构(右); (c)不同合成温度下SrTiO3的光催化性能图(300 W Xe灯, 320 nm<λ<780 nm)[61]
Figure9.
(a)Schematic illustration of the growth mechanism from LTHSs to single-crystalline porous SrTiO3 nanocube assemblies. (b)Crystal structures of layered protonated titanate(left) and perovskiteSrTiO3(right). (c)Hydrogen evolution curves of two porous SrTiO3 nanocube assemblies obtained at 150 and 180 ℃(i.e., P-SrTiO3-150 and P-SrTiO3-180) and solid SrTiO3 particles(S-SrTiO3-900) under irradiation of a 300 W xenon lamp(320 nm < λ < 780 nm)[61]
图9
(a) 由LTHSs形成单晶多孔SrTiO3纳米立方体团簇的机理示意图; (b)层状质子化钛酸盐的结构(左)和钙钛矿型SrTiO3的结构(右); (c)不同合成温度下SrTiO3的光催化性能图(300 W Xe灯, 320 nm<λ<780 nm)[61]
Figure9.
(a)Schematic illustration of the growth mechanism from LTHSs to single-crystalline porous SrTiO3 nanocube assemblies. (b)Crystal structures of layered protonated titanate(left) and perovskiteSrTiO3(right). (c)Hydrogen evolution curves of two porous SrTiO3 nanocube assemblies obtained at 150 and 180 ℃(i.e., P-SrTiO3-150 and P-SrTiO3-180) and solid SrTiO3 particles(S-SrTiO3-900) under irradiation of a 300 W xenon lamp(320 nm < λ < 780 nm)[61]
2.2.3 电子转移改性
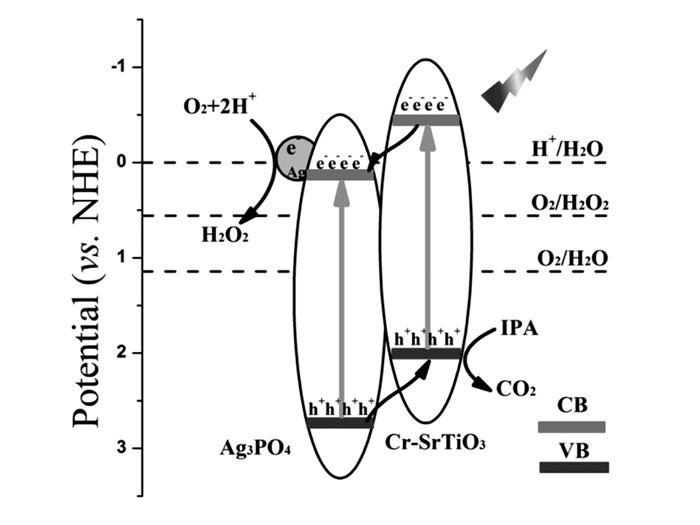
当光生电子与空穴传输至表相,为降低光生电子与空穴的复合几率以及逆反应的发生,常通过形成异质结或负载助催化剂的方式来降低复合率。叶金花组[63]研究了将Ag3PO4和Cr掺杂SrTiO3复合形成异质结,如图 10所示,Ag3PO4和Cr/SrTiO3在可见光照射下,产生电子-空穴对,由于Cr/SrTiO3的价带较高,Ag3PO4的空穴迁移至Cr/SrTiO3的价带上, 由于导带较低,Cr/SrTiO3的电子迁移至Ag3PO4的导带上,从而实现了电子与空穴的分离,并降低了它们的复合几率,并在可见光下进行了光降解IPA生成CO2,对比Ag3PO4和Cr/SrTiO3的降解效率,形成的异质结分别是它们的33倍和7倍。黄富强课题组[18]通过铣削退火法使Bi2O3和BaTiO3复合形成异质结,并测试了光催化降解甲基橙和甲基蓝,其性能均高于单独的Bi2O3和BaTiO3,该异质结的性能提高可归因于电场驱使下无论在表面还是体相都提高了光生电子与空穴的分离效率。Kudo组[64]报道了Rh和Sb掺杂的SrTiO3通过负载助催化剂IrO2后的光催化性能,发现负载IrO2的光催化剂产氢是未负载IrO2的约2倍,产氧则是约4倍,所以助催化剂在光催化反应中起着重要的角色,不仅提供了产氢的活性位点,还有产氧的活性位点。Kudo组[64]也曾探究过不同助催化剂对SrTiO3光催化性能的研究,通过负载Ni、Ag、Rh、Ru、Pt等助催化剂,发现负载Ru的材料光催化性能最佳,与Pt相比,Ru表现出更加稳定的产氢性能,如表 4所示。Domen组[24]曾研究了Ca掺杂的LaTiO2N,通过PC法合成了金属氧化物前驱体,再在氨气下进行氮化形成LaTiO2N,在AgNO3作为牺牲剂条件下,实现了可见光下光催化分解水产氧,并且后期用助催化剂IrO2进行修饰,其性能是原来的两倍左右,助催化剂通过提供活性位点同时抑制光生电子与空穴的复合以及逆反应的发生,促进光催化反应的进行。我们课题组[35]通过共沉淀法成功合成了一系列Ca掺杂的LaTiO2N,La0.3Ca0.7TiO2.7N0.3表现出最好的光催化性能,在可见光照射下,通过沉积助催化剂CoOx、牺牲剂AgNO3下产氧量达到了66.96 μmol/h,表观量子效率达3.13%。
 表 4
不同助催化剂对(SrTiO3:Rh)-(WO3)体系分解水的作用[65]
Table 4.
Effect of co-catalysts on water splitting by (SrTiO3:Rh)-(WO3) systems[65]
表 4
不同助催化剂对(SrTiO3:Rh)-(WO3)体系分解水的作用[65]
Table 4.
Effect of co-catalysts on water splitting by (SrTiO3:Rh)-(WO3) systems[65]
Co-catalyst Loading method Amounts of products for 22 h/μmola H2 O2 None - 21 51 Ni Photodeposition 60 42 Ru Photodeposition 416 197 Rh Photodeposition 92 67 Ag Photodeposition 7.1 39 Pt Photodeposition 322 153 Au Impregnation 140 71 Fe2O3 Impregnation 15 55 NiOX Impregnation 0.9 33 RuO2 Impregnation 4.4 38 Reaction conditions:catalyst, 50 mg each; reactant solution, 2 mmol/L of an aqueous FeCl3 solution; 120 mL; pH=2.4; light source, 300 W Xe-arc lamp(λ>420 nm); cell, top-irradiation cell with a Pyrex glass window. 3 钛基钙钛矿材料的衍生物—层状材料
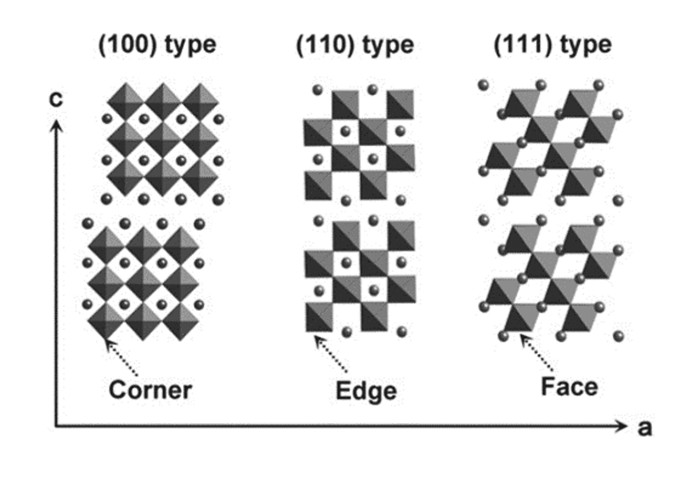
层状二维钙钛矿材料由于其优良的光催化性能、离子电导率、诱电性质、磁性性质、发光性质和插层性能,常应用于超导、巨磁阻、铁电、光催化等方面。层状钙钛矿可以看成简单钙钛矿按照不同晶面有序分层而来,根据晶体内分层情况,层状钙钛矿材料可分为{100}和{110}型,其中{110}型根据材料晶体结构的平面缺陷又可分为{110}和{111}型;另外这些结构可根据夹层的暴露面在拐角处、边缘处和表面处来区分[66],如图 11所示。
3.1 {100}型钛基层状材料、结构及改性研究
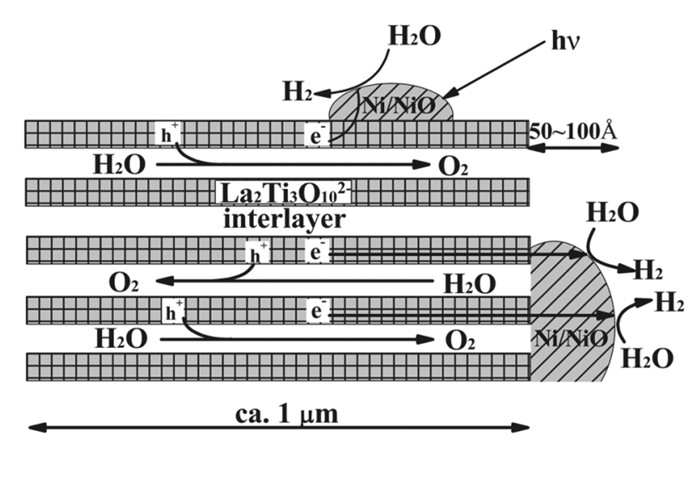
Domen组[67]曾报道了一系列A2La2Ti3O10层状材料,通过固相法合成K2La2Ti3O10、Rb2La2Ti3O10和Cs2La2Ti3O10,在450 W汞灯照射下并通过负载不同量的Ni/NiO,Rb2La2Ti3O10表现出光催化性能最佳,每克样品产氢量达每小时869 μmol,产氧量达每小时430 μmol,机理示意图如图 12所示,发现夹层中含有较多碱金属阳离子的层状钙钛矿更有利于水合反应,增加层的负电荷密度能够增加夹层中的碱金属阳离子的量,这对于层状钙钛矿材料有效分解水具有指导意义。Domen组[68]在2000年对K2La2Ti3O10再次进行了深入研究,发现在该材料上同时负载Ni和另一种金属,其光催化性能有非常大的突破,通过简单烧结过程合成层状材料K2La2Ti3O10,再通过浸渍法将其加入至含有适量硝酸镍和其他金属硝酸盐的溶液中,然后进行水浴烘干,在空气下573 K加热20 min,在将光催化剂置于氢气下773 K还原2 h,最后在氧气下473 K氧化1 h,得到产物MOx-NiOy-K2La2Ti3O10,发现负载Cr后光催化性能可达到产氢量3270 μmol/h、产氧量1650 μmol/h,优于原始的材料性能,对比只负载Cr的K2La2Ti3O10,其性能远远低于同时负载Ni和Cr的材料,推测Cr通过改变Ni的电子性质帮助提升Ni作为助催化剂产氢的能力,再者相比于其它单价元素如Ag、Li等,三价Cr的加入降低了产氧能力,所以推测Cr降低产氧能力从而提升产氢能力。
奥利维里斯(Aurivillius)结构材料,同样属于{100}型材料,通式可表示为(Bi2O2)2+(Bim-1TimO3m+1)2-, Kudo组[69]1999年报道了层状材料Bi4Ti3O12,其晶体结构式可表示成(Bi2O2)2+(Bi2Ti3O10)2-,其结构是由TiO6正八面体和沿c轴方向生长的单层(Bi2O2)2+叠加组成。在450 W汞灯照射下,通过光沉积法负载助催化剂Pt,并加入5%的甲醇作为牺牲剂,每小时可产0.6 μmol的氢气;加入0.05 mol/L的AgNO3溶液后,每小时可产3 μmol的氧气。陈刚组[70]通过掺杂改性的方式研究了Cr掺杂进Bi4Ti3O12材料中对光催化性能的影响,发现当Cr的掺杂量为40%时,在可见光照射下,无助催化剂,5%甲醇作为牺牲剂,产氢量达到了58.1 μmol/(h·g),远高于不掺杂样品的性能。除了掺杂改性的方式外,南京大学孙成组[71]通过形成异质结的方式进行了研究,形成异质结可有效提高电子与空穴的分离效率,该研究组通过球磨法将g-C3N4与Bi4Ti3O12复合,并在可见光下测试了材料对有机污染物acid orange-Ⅱ(AO-7)的光催化降解性能,并发现复合后的材料性能均优于单一的材料。有报道发现颗粒的暴露晶面对光催化性能的影响也非常大,李英宣组[72]研究发现,若单晶材料Bi4Ti3O12纳米片主要以{001}面生长,在可见光下,其光催化降解性能是通过固相法合成的Bi4Ti3O12的8.65倍,有效的暴露晶面,缩短表面电荷传输的距离,光诱导极化引起的内部电场均是光催化降解性能的关键所在。
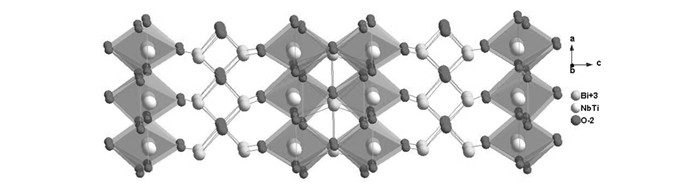
Bi3TiNbO9同样属于Aurivillius型材料, 结构由(Bi2O2)2+和(BiTiNbO7)2-组成,结构如图 13所示,最早Kudo课题组[73]曾报道过,该材料在紫外下负载适当的助催化剂和牺牲剂可产氢和氧,由于Bi3TiNbO9禁带宽度较宽(3.1 eV), 为了实现其在可见光下有响应,Hyo Jin Seo组[74]将Ni掺杂入Bi3TiNbO9,发现掺杂之后材料的带宽明显变小(2.61 eV), 并且在可见光下实现了光催化测试,可有效地降解甲基蓝。我们课题组[75]也通过掺杂Cr和Nb的方式(如图 14所示),对Bi3TiNbO9进行了光催化产氢研究,发现掺杂Cr和Nb可以扩大晶胞大小,不仅减小了带宽,更实现了在可见光下产氢,产氢量为41.11 μmol/h,对应的量子效率为0.52%。
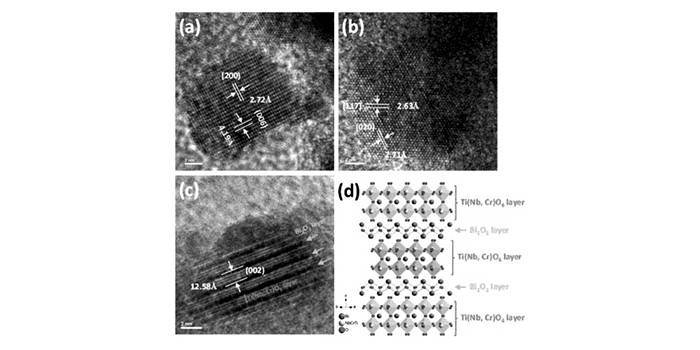 图14
Bi3Ti0.6Cr0.2Nb1.2O9的高分辨透射电子显微镜图: (a)沿{010}轴方向; (b)沿{70-1}轴方向; (c)(002)晶格条纹; (d)从[110]方向拟合的晶体结构图[75]
Figure14.
High resolution transmission electron microscopy images of Bi3Ti0.6Cr0.2Nb1.2O9(x=0.2): (a)along {010} zone axis, (b)along {70-1} zone axis, (c)showing the (002) lattice fringe and (d) a refined crystal structure projected from [110] direction[75]
图14
Bi3Ti0.6Cr0.2Nb1.2O9的高分辨透射电子显微镜图: (a)沿{010}轴方向; (b)沿{70-1}轴方向; (c)(002)晶格条纹; (d)从[110]方向拟合的晶体结构图[75]
Figure14.
High resolution transmission electron microscopy images of Bi3Ti0.6Cr0.2Nb1.2O9(x=0.2): (a)along {010} zone axis, (b)along {70-1} zone axis, (c)showing the (002) lattice fringe and (d) a refined crystal structure projected from [110] direction[75]
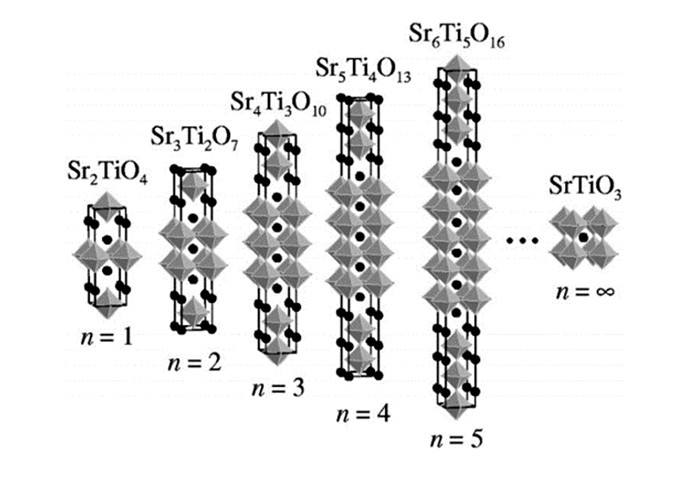
Srn+1TinO3n+1(n=1, 2, 3)是一系列典型{100}型层状材料,其化学式也可表示为SrO(SrTiO3)n(n=1, 2, 3)。他们的结构分别为:Sr2TiO4按照每单层TiO6八面体分层;Sr3Ti2O7按照每两层TiO6八面体分层;以此类推,Sr4Ti3O10按照每3层TiO6八面体分层[76],如图 15所示。李灿组[77]曾研究过Sr2TiO4和La、Cr共掺SrTiO3的复合材料,通过PC法合成La和Cr共掺SrTiO3、La和Cr通过PC法合成La和Cr共掺SrTiO3、La和Cr共掺Sr2TiO4以及Sr2TiO4和La、Cr共掺SrTiO3的复合物3种材料,并测试了它们的光催化产氢性能,发现复合材料的产氢量分别是La、Cr共掺SrTiO3和La、Cr共掺Sr2TiO4的6.4倍和3倍之多,并且从XPS和EPR测试中发现,对比3种材料,复合材料中的Cr6+含量最少,Cr6+的轨道能级低于Ti的3d导带能级,易形成电子捕获中心,不利于光催化反应,复合(形成异质结)是一种有效的改性方式之一,可提高电荷转移和分离效率。我们课题组[78]也深入研究了Sr2TiO4层状材料,并通过掺杂改性的方式对其进行了探究,通过固相法合成了一系列掺杂不同量Cr以及La、Cr共掺的Sr2TiO4, 发现,当Cr的掺杂量达5%时,该材料表现出最佳的光催化性能,在紫外下每小时可产氢为97.7 μmol,在可见光下每小时产氢为17 μmol,相比于原始的Sr2TiO4以及La、Cr共掺的Sr2TiO4,不仅实现了可见光下产氢,其性能也得到了很大的提高,如图 16所示。在此研究基础上,我们[79]又探究了La和Rh共掺的Sr2TiO4, 通过PC法合成了一系列掺杂量不同的材料,从光吸收图中可以看出,掺杂La和Rh之后,材料的光吸收边红移至550 nm可见光区,如图 17所示,我们进一步进行了光催化性能测试,在可见光照射下,沉积助催化剂Pt的光催化材料在亚硫酸钠溶液中产氢量可达40 μmol/h,其表观量子效率为1.18%,相比于Cr掺杂的以及La和Cr掺杂的材料,其性能得到很大的提高。其它{100}型层状材料的光催化性能见表 5。
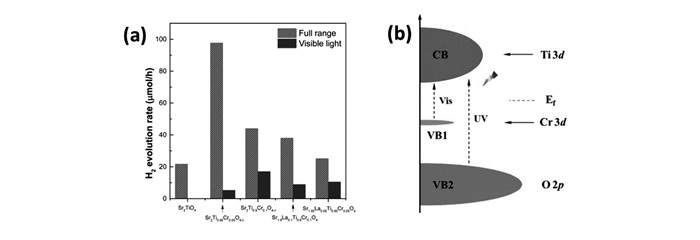 图16
不同掺杂量Cr和不同掺杂量La和Cr的光催化性能图(a); 能带结构示意图(b)[78]
Figure16.
Plotof photocatalytic hydrogen production rate by dividing the amount of hydrogen produced with irradiation time (a); Schematic representation of band structures of dopedsamples and possible charge generation procedures; the Fermi level ismarked by the dotted line (b)[78]
图16
不同掺杂量Cr和不同掺杂量La和Cr的光催化性能图(a); 能带结构示意图(b)[78]
Figure16.
Plotof photocatalytic hydrogen production rate by dividing the amount of hydrogen produced with irradiation time (a); Schematic representation of band structures of dopedsamples and possible charge generation procedures; the Fermi level ismarked by the dotted line (b)[78]
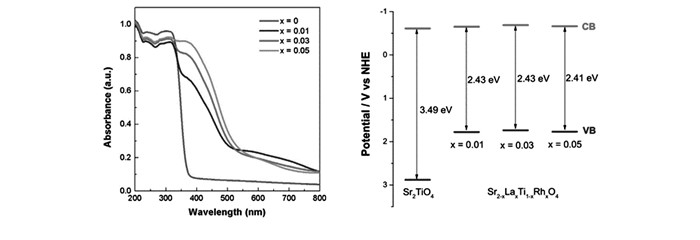 图17
Sr2-xLaxTi1-xRhxO4(x=0, 0.01, 0.03和0.05)的紫外可见漫反射图谱(左); 样品的能带边示意图(右)[79]
Figure17.
(left)UV-Vis light absorption spectra(converted from diffuse reflectance spectra) of as-prepared samples Sr2-xLaxTi1-xRhxO4(x=0, 0.01, 0.03 and 0.05); (right)schematic representation of band edge positions of all samples[79]
图17
Sr2-xLaxTi1-xRhxO4(x=0, 0.01, 0.03和0.05)的紫外可见漫反射图谱(左); 样品的能带边示意图(右)[79]
Figure17.
(left)UV-Vis light absorption spectra(converted from diffuse reflectance spectra) of as-prepared samples Sr2-xLaxTi1-xRhxO4(x=0, 0.01, 0.03 and 0.05); (right)schematic representation of band edge positions of all samples[79]
Perovskite Doping element Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) O2/ (μmol·h-1) Pollutants Ref. K2La2Ti3O10 Ni/NiO(3) 0.1 mol/L KOH 450 W Hg light 444a 221a [67] V aqueous aolution 250 W Xe light 42.2a [80] Zn aqueous aolution 250 W Xe light 55.5a [81] Rb2La2Ti3O10 Ni/NiO(4) 0.1 mol/L RbOH 450 W Hg light 869a 430a Nb Ni/NiO(5) 0.1 mol/L RbOH 450 W Hg light 725a 358a [67] Bi4Ti3O12 5%CH3OH 450 W Hg light 0.6a 0.05 mol/L AgNO3 450 W Hg light 3.0a [69] Cr None 5%CH3OH 350 W Xe light>400 nm 58.1a [70] Eu water 300 W Xe light>420 nm MO [82] g-C3N4/ Bi4Ti3O12 C3N4 water 500 W Xe light>420 nm acidorange-Ⅱ (AO-7) [71] TiO2/Bi4Ti3O12 water 300 W Xe light>400 nm phenol [83] Sr2TiO4 La Cr Pt(0.25) 20%CH3OH 300 W Xe light>420 nm 4b Sr2TiO4/SrTiO3 (La, Cr) Pt(0.25) 20%CH3OH 300 W Xe light>420 nm 12b [77] Cr Pt(1) 0.05 mol/L Na2SO3 500 W Hg light>400 nm 17b [78] La Rh Pt(1) 0.05 mol/L Na2SO3 500 W Hg light>400 nm 40b [79] Bi3TiNbO9 Pt(1) CH3OH 450 W Hg light 33a None AgNO3 450 W Hg light 31a [69] Ni water 500 W Xe light>400 nm MB [74] Cr Nb Pt(1) 0.05 mol/L Na2SO3 500 W Hg light>420 nm 41.11b [75] Catalyst:a.1 g; b.0.1 g,MO:Methyl Orange,MB:Methyl Blue,orange-Ⅱ(AO-7):C16H11N2NaO4S. 3.2 {110}型钛基层状材料、结构及改性研究
Lee课题组[83]曾报道过一系列{110}型层状材料AmTimO3m+2(m=2, 4和5,A= Ca, Sr和La), 其中,当m=2, A为La时为La2Ti2O7,La2Ti2O7被广泛用于光催化性能的测试以及对有毒物质的降解测试(如CH3Cl)研究,它表现出较好的光催化性能归因于其特有的电子结构,如La原子的超价构建了层状钙钛矿的结构,但是La2Ti2O7的禁带宽度为3.8 eV, 只能吸收紫外光,这就局限了材料的光催化性能。在紫外光下,沉积质量分数1%Ni的La2Ti2O7在无牺牲剂的条件下可产氢每小时441 μmol,量子效率为12%。许多报道通过不同的合成方法对La2Ti2O7进行了研究,如水热法[84]、聚合配合法[85]、熔融盐法[86]和固相法等,其中Lee课题组[85]报道了一篇通过聚合配合法合成的La2Ti2O7,在紫外光灯照射下,此法合成的材料通过负载质量分数1%NiOx,产氢量达960 μmol/(h·g cat),产氧为478 μmol/(h·g cat),相比于之前报道的La2Ti2O7以及其它方法合成的材料,其性能得到了很大的提高,原因可能在于聚合配合法合成的材料比表面积较大、结晶度较好以及助催化剂负载分布均匀等。他们[87]在此基础上又深入研究了通过掺杂金属元素来减小La2Ti2O7的带宽,使其能够吸收可见光,从而提升其光催化性能,他们选择了Cr、Fe和Sb 3种金属元素进行掺杂,发现掺杂Cr的La2Ti2O7在可见光下,以质量分数1%Pt作为助催化剂,甲醇作为牺牲剂的条件下,产氢量达到了每小时15 μmol;同样条件下,掺杂Fe的La2Ti2O7产氢量为每小时10 μmol,掺杂Cr和Sb的La2Ti2O7则每小时产氢为4 μmol。从XPS和理论计算可以证明掺杂三价Fe和Cr之后,形成了一个完全充满的3d轨道作为间带,使得La2Ti2O7的价带更负,电子从这个新间带中跃迁至导带,从而实现了对可见光的吸收。之前我们提到过形成复合材料(异质结)是一种改性的有效方法之一,近些年,许多学者将La2Ti2O7与其它材料进行复合来进行光催化性能的测试,例如Parida组[88]通过将n型的La2Ti2O7与p型的CuO进行复合形成p-n异质结,如图 18所示,CuO的导带低于氢的还原电势,复合后实现了在可见光下进行光催化反应,产氢量为234.15 μmol/h;还有La2Ti2O7与g-C3N4的复合[89],并进行了光催化降解测试,发现相比单个的La2Ti2O7和g-C3N4,复合后的性能更佳。其它{110}型钛基层状材料见表 6。
Perovskite Doping element Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) Pollutants Ref. La2Ti2O7 NiOx(1) water 450 W Hg light 441a [90] Cr Pt(1) 33%CH3OH 500 W Hg light>420 nm 15b Fe Pt(1) 33%CH3OH 500 W Hg light>420 nm 10b Cr, Sb Pt(1) 33%CH3OH 500 W Hg light>420 nm 4b [91] La2Ti2O7 nanosheet N - water Luzchem LZC-420 MO [92] La4CaTi5O17 NiOx(1) water 450 W Hg light 499a [90] Catalyst:a.1 g; b.0.5 g,MO:Methyl Orange. 3.3 {111}型钛基层状材料、结构及改性研究
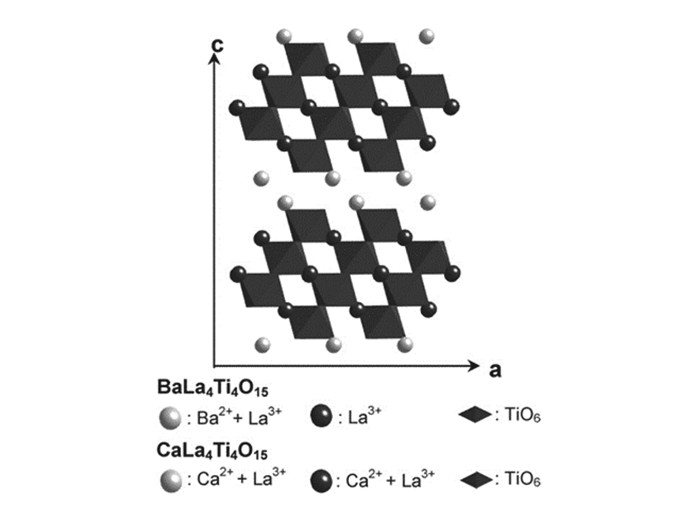
相比{100}型层状材料,{111}型材料偏少,最典型的钛基层状材料就是ALa4Ti4O15(A=Ca, Sr和Ba),CaLa4Ti4O15、SrLa4Ti4O15和BaLa4Ti4O15的带隙分别为3.77、3.82和3.85 eV。它们的结构如图 19所示,从La3+、Ca2+和Ba2+所处在晶体结构的位置可以为带隙的差异提供一些信息,对于BaLa4Ti4O15,夹层中Ba2+:La3+为1:1,并且在钙钛矿层中只存在La3+;而对于CaLa4Ti4O15,Ca2+和La3+无序的存在于夹层和钙钛矿层中,BaLa4Ti4O15的带隙大于CaLa4Ti4O15是因为Ba2+的离子半径大于Ca2+而引起的层间距增大以及极化能力不同[66]。Kudo课题组[66]也对该材料进行了光催化性能的研究,他通过聚合络合法合成了ALa4Ti4O15(A=Ca, Sr, Ba),在紫外光照射下,负载了质量分数0.5%NiO的BaLa4Ti4O15表现出最好的产氢和产氧性能,产氢量为每小时2300 μmol以及产氧量为1154 μmol。在此基础上,他们[93]又研究了该材料还原二氧化碳的能力,通过光沉积的方式将助催化剂Ag负载在ALa4Ti4O15(A=Ca, Sr, Ba)上,将光催化材料置于气流为15 mL/min的CO2水溶液反应器中进行气体检测,发现负载2%Ag的BaLa4Ti4O15不仅可以分解水同时也可以还原二氧化碳,优于CaLa4Ti4O15和SrLa4Ti4O15。随后又有研究报道将Au纳米簇负载在BaLa4Ti4O15,其光催化分解水性能是负载大颗粒Au的2.6倍[94]。La4Ti3O12也属于{111}型,Kudo[66]也曾对其进行了研究,通过PC法合成,在紫外光下,通过负载质量分数0.6%NiO,可产氢357 μmol/h以及产氧179 μmol/h,见表 7。
Perovskite Co-catalyst/ (mass%) Reactant solution Light source H2/ (μmol·h-1) O2/ (μmol·h-1) CO/ (μmol·h-1) HCOOH/ (μmol·h-1) Ref. La4Ti3O12 NiO(0.6) pure water 400 W Hg light 357a 179a CaLa4Ti4O15 NiO(0.2) pure water 400 W Hg light 593a 276a SrLa4Ti4O15 NiO(0.7) pure water 400 W Hg light 1 171a 546a BaLa4Ti4O15 NiO(0.5) pure water 400 W Hg light 2 300a 1 154a [66] Ag(2) CO2 flow system (15 mL/min) 400 W Hg light 10b 16b 22b 0.7b Au(2) pure water 400 W Hg light 400a 200a [95] Catalyst:a.0.5 g; b.0.3 g. 4 结论与展望
采用光催化将太阳能转化为氢能是解决能源和环境的根本途径之一,极具意义也极具挑战。虽然近30年来,国内外对于光催化课题的探究有了许多的积累,但在太阳光下实现光催化产氢的效率依旧很低,在可见光下最高的量子效率仅为6%,远远达不到工业化的水平。为促进光催化研究的发展,今后可从以下几个方面进行研究:第一,光催化材料开发方面,在典型光催化材料的基础上,首先总结性能较好的材料,找出其中的规律如理化性质、合成方法和条件、晶体结构变化等,其次是通过交叉学科交流,如与有机物形成复合材料等;第二,光催化机理方面,要加强基础研究,如光生电子与空穴的分离、传输的微观反应过程,材料缺陷的定量定性研究,为未来光催化研究提供理论基础;第三,光催化应用方面,光催化反应其中包括降解有毒污染物以及二氧化碳还原,可利用适当的光催化材料进行空气净化、水处理等,产氢方面可利用现有的光催化材料进行规模化的生产并进行制氢,向工业化迈进。
-
-
[1]
Kudo A, Miseki Y. Heterogeneous Photocatalyst Materials for Water Splitting[J]. Chem Soc Rev, 2009, 38(1): 253-278. doi: 10.1039/B800489G
-
[2]
温福宇, 杨金辉, 宗旭. 太阳能光催化制氢研究进展[J]. 化学进展, 2009,21,(11): 2285-2302. WEN Fuyu, YANG Jinhui, ONG Xu. Photocatalytic Hydrogen Production Utilizing Solar Energy[J]. Prog Chem, 2009, 21(11): 2285-2302.
-
[3]
Fujishima A, Honda K. Electrochemical Photolysis of Water at a Semiconductor Electrode[J]. Nature, 1972, 238(5358): 37-38. doi: 10.1038/238037a0
-
[4]
Shi J Y, Chen J, Feng Z C. Photoluminescence Characteristics of TiO2 and Their Relationship to the Photoassisted Reaction of Water/Methanol Mixture[J]. J Phys Chem C, 2007, 111(2): 693-699. doi: 10.1021/jp065744z
-
[5]
Fujishima A, Zhang X, Trky D A. TiO2 Photocatalysis and Related Surface Phenomena[J]. Surf Sci Rep, 2008, 63(12): 515-582. doi: 10.1016/j.surfrep.2008.10.001
-
[6]
Wang G M, Wang H Y, Ling Y C. Hydrogen-treated TiO2 Nanowire Arrays for Photoelectrochemical Water Splitting[J]. Nano Lett, 2011, 11(7): 3026-3033. doi: 10.1021/nl201766h
-
[7]
Chen X B, Liu L, Huang F Q. Black Titanium Dioxide(TiO2) Nanomaterials[J]. Chem Soc Rev, 2015, 44(7): 1861-1885. doi: 10.1039/C4CS00330F
-
[8]
Wang Z, Yang C Q, Lin T Q. Visible-light Photocatalytic, Solar Thermal and Photoelectrochemical Properties of Aluminium-reduced Black Titania[J]. Energ Environ Sci, 2013, 6(10): 3007-3014. doi: 10.1039/c3ee41817k
-
[9]
Domen K, Naito S, Soma M. Photocatalytic Decomposition of Water Vapour on an NiO-SrTiO3 Catalyst[J]. J Phys Chem, 1982, 86(18): 3657-3661. doi: 10.1021/j100215a032
-
[10]
Kato H, Asakura K, Kudo A. Highly Efficient Water Splitting into H2 and O2 over Lanthanum-Doped NaTaO3 Photocatalysts with High Crystallinity and Surface Nanostructure[J]. J Am Chem Soc, 2003, 125(10): 3082-3089. doi: 10.1021/ja027751g
-
[11]
Reber J F, Meier K. Photochemical Production of Hydrogen with Zinc Sulfide Suspensions[J]. J Phys Chem, 1984, 88(24): 5903-5913. doi: 10.1021/j150668a032
-
[12]
Miseki Y, Kato H, Kudo A. Water Splitting into H2 and O2 over Ba5Nb4O15 Photocatalysts with Layered Perovskite Structure Prepared by Polymerizable Complex Method[J]. Chem Lett, 2006, 35(9): 1052-1053. doi: 10.1246/cl.2006.1052
-
[13]
Tanaka H, Misono M. Advances in Designing Perovskite Catalysts[J]. Curr Opin Solid State Mater Sci, 2001, 5(5): 381-387. doi: 10.1016/S1359-0286(01)00035-3
-
[14]
Grabowska E. Selected Perovskite Oxides:Characterization, Preparation and Photocatalytic Properties-A Review[J]. Appl Catal B-Environ, 2016, 186: 97-126. doi: 10.1016/j.apcatb.2015.12.035
-
[15]
Pena M, Fierro J. Chemical Structures and Performance of Perovskite Oxides[J]. Chem Rev, 2001, 101(7): 1981-2018. doi: 10.1021/cr980129f
-
[16]
Mizoguchi H, Ueda K, Orita M. Decomposition of Water by a CaTiO3 Photocatalyst under UV Light Irradiation[J]. Mater Res Bull, 2002, 37(15): 2401-2406. doi: 10.1016/S0025-5408(02)00974-1
-
[17]
Reddy K H, Parida K. Fabrication, Characterization, and Photoelectrochemical Properties of Cu-Doped PbTiO3 and Its Hydrogen Production Activity[J]. ChemCatChem, 2013, 5(12): 3812-3820. doi: 10.1002/cctc.201300462
-
[18]
Lin X P, Xing J C, Wang W D. Photocatalytic Activities of Heterojunction Semiconductors Bi2O3/BaTiO3:A Strategy for the Design of Efficient Combined Photocatalysts[J]. J Phys Chem C, 2007, 111(49): 18288-18293. doi: 10.1021/jp073955d
-
[19]
Jin R C, Gao W L, Chen J X. Photocatalytic Reduction of Nitrate Ion in Drinking Water by Using Metal-Loaded MgTiO3-TiO2 Composite Semiconductor Catalyst[J]. J Photochem Photobiol A, 2004, 162(2): 585-590.
-
[20]
Kim Y J, Gao B F, Han S Y. Heterojunction of FeTiO3 Nanodisc and TiO2 Nanoparticle for a Novel Visible Light Photocatalyst[J]. J Phys Chem C, 2009, 113(44): 19179-19184. doi: 10.1021/jp908874k
-
[21]
Qu Y, Zhou W, Ren Z Y. Facile Preparation of Porous NiTiO3 Nanorods with Enhanced Visible-Light-Driven Photocatalytic Performance[J]. J Mater Chem, 2012, 22(32): 16471-16476. doi: 10.1039/c2jm32044d
-
[22]
Kong J Z, Li A D, Zhai H F. Preparation, Characterization and Photocatalytic Properties of ZnTiO3 Powders[J]. J Hazard Mater, 2009, 171(1): 918-923.
-
[23]
李娜. 钙钛矿晶体的结构与化学键[D]. 大连: 大连理工大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10141-2010111223.htmLI Na. Structure and Chemical Bonds of Perovskite Crystals[D]. Dalian:Dalian University of Technology, 2010(in Chinese). http://cdmd.cnki.com.cn/Article/CDMD-10141-2010111223.htm
-
[24]
Kasahara A, Nukumizu K, Hitoki G. Photoreactions on LaTiO2N under Visible Light Irradiation[J]. J Phys Chem A, 2002, 106(29): 6750-6753. doi: 10.1021/jp025961+
-
[25]
Wagner F, Ferrer S, Somorjai G. Photocatalytic Hydrogen Production from Water over SrTiO3 Crystal Surfaces, Electron Spectroscopy Studies of Adsorbed H2, O2 and H2O[J]. Surf Sci, 1980, 101(1/2/3): 462-474.
-
[26]
于鹤. SrTiO3光催化材料光吸收边调控及其光催化产氢性能研究[D]. 南京: 南京大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10284-1013359589.htmYU He. The Tuning of Optical Absorption Edge and Performance of Photocatalytic Hydrogen Evolution for SrTiO3[D]. Nanjing:Nanjing University, 2013(in Chinese). http://cdmd.cnki.com.cn/Article/CDMD-10284-1013359589.htm
-
[27]
Maeda K. Rhodium-Doped Barium Titanate Perovskite as a Stable p-Type Semiconductor Photocatalyst for Hydrogen Evolution under Visible Light[J]. ACS Appl Mater Interfaces, 2014, 6(3): 2167-2173. doi: 10.1021/am405293e
-
[28]
Kasahara A, Nukumizu K, Takata T. LaTiO2N as a Visible-Light(≤ 600 nm)-Driven Photocatalyst(2)[J]. J Phys Chem B, 2003, 107(3): 791-797. doi: 10.1021/jp026767q
-
[29]
Liu J W, Sun Y, Li Z H. Ag Loaded Flower-Like BaTiO3 Nanotube Arrays:Fabrication and Enhanced Photocatalytic Property[J]. Cryst Eng Comm, 2012, 14(4): 1473-1478. doi: 10.1039/C1CE05949A
-
[30]
Upadhyay S, Shrivastava J, Solanki A. Enhanced Photoelectrochemical Response of BaTiO3 with Fe Doping:Experiments and First-Principles Analysis[J]. J Phys Chem C, 2011, 115(49): 24373-24380. doi: 10.1021/jp202863a
-
[31]
Zhang H J, Chen G, He X D. Electronic Structure and Photocatalytic Properties of Ag-La Codoped CaTiO3[J]. J Alloy Compd, 2012, 516: 91-95. doi: 10.1016/j.jallcom.2011.11.142
-
[32]
Sun W, Zhang S Q, Wang C. Enhanced Photocatalytic Hydrogen Evolution over CaTi1-xZrxO3 Composites Synthesized by Polymerized Complex Method[J]. Catal Lett, 2007, 119(1/2): 148-153.
-
[33]
Zhang H J, Chen G, Li Y X. Electronic Structure and Photocatalytic Properties of Copper-Doped CaTiO3[J]. Int J Hydrogen Energy, 2010, 35(7): 2713-2716. doi: 10.1016/j.ijhydene.2009.04.050
-
[34]
Surendar T, Kumar S, Shanker V. Influence of La-Doping on Phase Transformation and Photocatalytic Properties of ZnTiO3 Nanoparticles Synthesized via Modified Sol-Gel Method[J]. Phys Chem Chem Phys, 2014, 16(2): 728-735. doi: 10.1039/C3CP53855A
-
[35]
Wu F F, Liu G, Xu X X. Efficient Photocatalytic Oxygen Production over Ca-Modified LaTiO2N[J]. J Catal, 2017, 346: 10-20. doi: 10.1016/j.jcat.2016.11.022
-
[36]
贾德伟, 卢艳丽, 胡婷婷. SrTiO3光催化材料的研究进展[J]. 材料导报, 2014,28,(3): 8-11. JIA Dewei, LU Yanli, HU Tingting. Research Progress of SrTiO3 Photocatalytic Materials[J]. Mater Rev, 2014, 28(3): 8-11.
-
[37]
Liu J, Chen G, Li Z. Electronic Structure and Visible Light Photocatalysis Water Splitting Property of Chromium-Doped SrTiO3[J]. J Solid State Chem, 2006, 179(12): 3704-3708. doi: 10.1016/j.jssc.2006.08.014
-
[38]
Konta R, Ishii T, Kato H. Photocatalytic Activities of Noble Metal Ion Doped SrTiO3 under Visible Light Irradiation[J]. J Phys Chem B, 2004, 108(26): 8992-8995. doi: 10.1021/jp049556p
-
[39]
Iwashina K, Kudo A. Rh-Doped SrTiO3 Photocatalyst Electrode Showing Cathodic Photocurrent for Water Splitting under Visible-Light Irradiation[J]. J Am Chem Soc, 2011, 133(34): 13272-13275. doi: 10.1021/ja2050315
-
[40]
Wang Q, Hisatomi T, Ma S S K. Core/shell Structured La-and Rh-Codoped SrTiO3 as a Hydrogen Evolution Photocatalyst in Z-scheme Overall Water Splitting under Visible Light Irradiation[J]. Chem Mater, 2014, 26(14): 4144-4150. doi: 10.1021/cm5011983
-
[41]
Lv M L, Xie Y H, Wang Y W. Bismuth and Chromium co-Doped Strontium Titanates and Their Photocatalytic Properties under Visible Light Irradiation[J]. Phys Chem Chem Phys, 2015, 17(39): 26320-26329. doi: 10.1039/C5CP03889H
-
[42]
Lu L W, Lv M L, Wang D. Efficient Photocatalytic Hydrogen Production over Solid Solutions Sr1-xBixTi1-xFexO3(0 ≤ x ≤ 0.5)[J]. Appl Catal B-Environ, 2017, 200: 412-419. doi: 10.1016/j.apcatb.2016.07.035
-
[43]
Wang J S, Yin S, Komatsu M. Preparation and Characterization of Nitrogen Doped SrTiO3 Photocatalyst[J]. J Photochem Photobiol A, 2004, 165(1): 149-156.
-
[44]
Ohno T, Tsubota T, Nakamura Y. Preparation of S, C Cation-Codoped SrTiO3 and Its Photocatalytic Activity under Visible Light[J]. Appl Catal A-Gen, 2005, 288(1): 74-79.
-
[45]
Kato H, Sasaki Y, Shirakura N. Synthesis of Highly Active Rhodium-Doped SrTiO3 Powders in Z-scheme Systems for Visible-Light-Driven Photocatalytic Overall Water Splitting[J]. J Mater Chem A, 2013, 1(39): 12327-12333. doi: 10.1039/c3ta12803b
-
[46]
Zou J P, Zhang L Z, Luo S L. Preparation and Photocatalytic Activities of Two New Zn-Doped SrTiO3 and BaTiO3 Photocatalysts for Hydrogen Production from Water Without Cocatalysts Loading[J]. Int J Hydrogen Energ, 2012, 37(22): 17068-17077. doi: 10.1016/j.ijhydene.2012.08.133
-
[47]
Shi J W, Ye J H, Ma L J. Site-Selected Doping of Upconversion Luminescent Er3+ into SrTiO3 for Visible-Light-Driven Photocatalytic H2 or O2 Evolution[J]. Chem-Eur J, 2012, 18(24): 7543-7551. doi: 10.1002/chem.201102807
-
[48]
Wang J S, Yin S, Komatsu M. Lanthanum and Nitrogen co-Doped SrTiO3 Powders as Visible Light Sensitive Photocatalyst[J]. J Eur Ceram Soc, 2005, 25(13): 3207-3212. doi: 10.1016/j.jeurceramsoc.2004.07.027
-
[49]
Wang J S, Yin S, Zhang Q W. Mechanochemical Synthesis of SrTiO3-xFx with High Visible Light Photocatalytic Activities for Nitrogen Monoxide Destruction[J]. J Mater Chem, 2003, 13(9): 2348-2352. doi: 10.1039/B303420H
-
[50]
Kato H, Kudo A. Visible-Light-Response and Photocatalytic Activities of TiO2 and SrTiO3 Photocatalysts Codoped with Antimony and Chromium[J]. J Phys Chem B, 2002, 106(19): 5029-5034. doi: 10.1021/jp0255482
-
[51]
Ishii T, Kato H, Kudo A. H2Evolution from an Aqueous Methanol Solution on SrTiO3 Photocatalysts Codoped with Chromium and Tantalum Ions under Visible Light Irradiation[J]. J Photochem Photobiol A, 2004, 163(1): 181-186.
-
[52]
Niishiro R, Kato H, Kudo A. Nickel and Either Tantalum or Niobium-Codoped TiO2 and SrTiO3 Photocatalysts with Visible-Light Response for H2 or O2 Evolution from Aqueous Solutions[J]. Phys Chem Chem Phys, 2005, 7(10): 2241-2245. doi: 10.1039/b502147b
-
[53]
Irie H, Maruyama Y, Hashimoto K. Ag+ and Pb2+ Doped SrTiO3Photocatalysts. A Correlation Between Band Structure and Photocatalytic Activity[J]. J Phys Chem C, 2007, 111(4): 1847-1852. doi: 10.1021/jp066591i
-
[54]
Yu H, Yan S C, Li Z S. Efficient Visible-Light-Driven Photocatalytic H2 Production over Cr/N-Codoped SrTiO3[J]. Int J Hydrogen Energy, 2012, 37(17): 12120-12127. doi: 10.1016/j.ijhydene.2012.05.097
-
[55]
Puangpetch T, Sreethawong T, Yoshikawa S. Synthesis and Photocatalytic Activity in Methyl Orange Degradation of Mesoporous-assembled SrTiO3 Nanocrystals Prepared by Sol-gel Method with the Aid of Structure-directing Surfactant[J]. J Mol Catal A-Chem, 2008, 287(1): 70-79.
-
[56]
Zheng Z K, Huang B B, Qin X Y. Facile Synthesis of SrTiO3 Hollow Microspheres Built as Assembly of Nanocubes and Their Associated Photocatalytic Activity[J]. J Colloid Interface Sci, 2011, 358(1): 68-72. doi: 10.1016/j.jcis.2011.02.032
-
[57]
Dong W J, Li X Y, Yu J. Porous SrTiO3 Spheres with Enhanced Photocatalytic Performance[J]. Mater Lett, 2012, 67(1): 131-134. doi: 10.1016/j.matlet.2011.09.045
-
[58]
Jia Y S, Shen S, Wang D E. Composite Sr2TiO4/SrTiO3(La, Cr) Heterojunction Based Photocatalyst for Hydrogen Production under Visible Light Irradiation[J]. J Mater Chem A, 2013, 1(27): 7905-7912. doi: 10.1039/c3ta11326d
-
[59]
刘韩星, 孙晓琴, 肖静. 熔盐法制备SrTiO3片状晶的研究[J]. 化学学报, 2004,62,(3): 324-327. LIU Hanxing, SUN Xiaoqin, XIAO Jing. Study on Tabular SrTiO3 Processed by Molten Salt Synthesis Method[J]. Acta Chim Sin, 2004, 62(3): 324-327.
-
[60]
辛钢, 郭威, 马廷丽. 熔盐法制备钛酸锶的光解水研究[J]. 大连理工大学学报, 2011,51,(1): 20-24. doi: 10.7511/dllgxb201101004XIN Gang, GUO Wei, MA Yanli. Study on the Photohydrolysis of Strontium Titanate by Molten Salt Method[J]. J Dalian Univ Technol, 2011, 51(1): 20-24. doi: 10.7511/dllgxb201101004
-
[61]
Kuang Q, Yang S H. Template Synthesis of Single-Crystal-Like Porous SrTiO3 Nanocube Assemblies and Their Enhanced Photocatalytic Hydrogen Evolution[J]. ACS Appl Mater Interfaces, 2013, 5(9): 3683-3690. doi: 10.1021/am400254n
-
[62]
陈超, 王智宇. 二氧化钛纳米棒的制备及其晶体生长机理分析[J]. 无机材料学报, 2011,27,(1): 45-48. CHEN Chao, WANG Zhiyu. Synthesis and Crystal Growth Mechanism of Titanium Dioxide Nanorods[J]. J Inorg Mater, 2011, 27(1): 45-48.
-
[63]
Guo J J, Ouyang S X, Li P. A New Heterojunction Ag3PO4/Cr-SrTiO3 Photocatalyst towards Efficient Elimination of Gaseous Organic Pollutants under Visible Light Irradiation[J]. Appl Catal B-Environ, 2013, 134: 286-292.
-
[64]
Niishiro R, Tanaka S, Kudo A. Hydrothermal-Synthesized SrTiO3 Photocatalyst Codoped with Rhodium and Antimony with Visible-Light Response for Sacrificial H2 and O2 Evolution and Application to Overall Water Splitting[J]. Appl Catal B-Environ, 2014, 150: 187-196.
-
[65]
Sasaki Y, Iwase A, Kato H. The Effect of Co-catalyst for Z-scheme Photocatalysis Systems with an Fe3+/Fe2+ Electron Mediator on Overall Water Splitting under Visible Light Irradiation[J]. J Catal, 2008, 259(1): 133-137. doi: 10.1016/j.jcat.2008.07.017
-
[66]
Miseki Y, Kato H, Kudo A. Water Splitting into H2 and O2 over Niobate and Titanate Photocatalysts with (111) Plane-type Layered Perovskite Structure[J]. Energy Environ Sci, 2009, 2(3): 306-314. doi: 10.1039/b818922f
-
[67]
Takata T, Furumi Y, Shinohara K. Photocatalytic Decomposition of Water on Spontaneously Hydrated Layered Perovskites[J]. Chem Mater, 1997, 9(5): 1063-1064. doi: 10.1021/cm960612b
-
[68]
Thaminimulla C, Takata T, Hara M. Effect of Chromium Addition for Photocatalytic Overall Water Splitting on Ni-K2La2Ti3O10[J]. J Catal, 2000, 196(2): 362-365. doi: 10.1006/jcat.2000.3049
-
[69]
Kudo A, Hijii S. H2 or O2 Evolution from Aqueous Solutions on Layered Oxide Photocatalysts Consisting of Bi3+ with 6s2 Configuration and d0 Transition Metal Ions[J]. Chem Lett, 1999, 28(10): 1103-1104. doi: 10.1246/cl.1999.1103
-
[70]
Zhang H J, Chen G, Li X. Synthesis and Visible Light Photocatalysis Water Splitting Property of Chromium-Doped Bi4Ti3O12[J]. Solid State Ionics, 2009, 180(36): 1599-1603.
-
[71]
Guo Y, Li J H, Gao Z Q. A Simple and Effective Method for Fabricating Novel p-n Heterojunction Photocatalyst g-C3N4/Bi4Ti3O12 and Its Photocatalytic Performances[J]. Appl Catal B-Environ, 2016, 192: 57-71. doi: 10.1016/j.apcatb.2016.03.054
-
[72]
He H Q, Yin J, Li Y X. Size Controllable Synthesis of Single-crystal Ferroelectric Bi4Ti3O12 Nanosheet Dominated with {001} Facets toward Enhanced Visible-Light-Driven Photocatalytic Activities[J]. Appl Catal B-Environ, 2014, 156: 35-43.
-
[73]
Kudo A. Development of Photocatalyst Materials for Water Splitting with the Aim at Photon Energy Conversion[J]. J Ceram Soc Jpn, 2001, 109(1270): S81-S88. doi: 10.2109/jcersj.109.1270_S81
-
[74]
Xu L, Wan Y P, Xie H D. On Structure, Optical Properties and Photodegradated Ability of Aurivillius-Type Bi3TiNbO9 Nanoparticles[J]. J Am Ceram Soc, 2016, 99(12): 3964-3972. doi: 10.1111/jace.14423
-
[75]
Jiang L, Ni S, Liu G. Photocatalytic Hydrogen Production over Aurivillius Compound Bi3TiNbO9 and Its Modifications by Cr/Nb Co-doping[J]. Appl Catal B-Environ, 2017, 217: 342-352. doi: 10.1016/j.apcatb.2017.06.012
-
[76]
Haeni J, Schlom D, Tian W, et al. Nanoenineering of Ruddlesden-Popper Phases Using Molecular Beam Epitaxy[D]. Pennsylvania State:The Pennsylvania State University, 2002. http://adsabs.harvard.edu/abs/2002PhDT.......108H
-
[77]
Jia Y S, Shen S, Wang D E. Composite Sr2TiO4/SrTiO3(La, Cr) Heterojunction Based Photocatalyst for Hydrogen Production under Visible Light Irradiation[J]. J Mater Chem A, 2013, 1(27): 7905-7912. doi: 10.1039/c3ta11326d
-
[78]
Sun X Q, Xie Y H, Wu F F. Photocatalytic Hydrogen Production over Chromium Doped Layered Perovskite Sr2TiO4[J]. Inorg Chem, 2015, 54(15): 7445-7453. doi: 10.1021/acs.inorgchem.5b01042
-
[79]
Sun X Q, Xu X X. Efficient Photocatalytic Hydrogen Production over La/Rh co-Doped Ruddlesden-Popper Compound Sr2TiO4[J]. Appl Catal B-Environ, 2017, 210: 149-159. doi: 10.1016/j.apcatb.2017.03.063
-
[80]
Yang Y H, Chen Q Y, Yin Z L. Study on the Photocatalytic Activity of K2La2Ti3O10 Doped with Vanadium(V)[J]. J Alloy Compd, 2009, 488(1): 364-369. doi: 10.1016/j.jallcom.2009.08.136
-
[81]
Yang Y H, Chen Q Y, Yin Z L. Study on the Photocatalytic Activity of K2La2Ti3O10 Doped with Zinc(Zn)[J]. Appl Surf Sci, 2009, 255(20): 8419-8424. doi: 10.1016/j.apsusc.2009.05.146
-
[82]
Lin X, Guan Q F, Zhang Y. Visible Light Photocatalytic Properties of Bi3.25Eu0.75Ti3O12 Nanowires[J]. J Phys Chem Solids, 2013, 74(9): 1254-1262. doi: 10.1016/j.jpcs.2013.04.001
-
[83]
Li Y Y, Dang L Y, Han L F. Iodine-sensitized Bi4Ti3O12/TiO2 Photocatalyst with Enhanced Photocatalytic Activity on Degradation of Phenol[J]. J Mol Catal A-Chem, 2013, 379: 146-151. doi: 10.1016/j.molcata.2013.08.001
-
[84]
Song H P, Peng T Y, Cai P. Hydrothermal Synthesis of Flaky Crystallized La2Ti2O7 for Producing Hydrogen from Photocatalytic Water Splitting[J]. Catal Lett, 2007, 113(1/2): 54-58.
-
[85]
Kim H G, Hwang D W, Bae S W. Photocatalytic Water Splitting over La2Ti2O7 Synthesized by the Polymerizable Complex Method[J]. Catal Lett, 2003, 91(3): 193-198.
-
[86]
Arney D, Porter B, Greve B. New Molten-salt Synthesis and Photocatalytic Properties of La2Ti2O7 Particles[J]. J Photochem Photobiol A, 2008, 199(2): 230-235.
-
[87]
Hwang D W, Kim H G, Jang J S. Photocatalytic Decomposition of Water-Methanol Solution over Metal-Doped Layered Perovskites under Visible Light Irradiation[J]. Catal Today, 2004, 93: 845-850.
-
[88]
Nashim A, Martha S, Parida K. Heterojunction Conception of n-La2Ti2O7/p-CuO in the Limelight of Photocatalytic Formation of Hydrogen under Visible Light[J]. RSC Adv, 2014, 4(28): 14633-14643. doi: 10.1039/c3ra47037g
-
[89]
Cai X Y, Zhang J Y, Fujitsuka M. Graphitic-C3N4 Hybridized N-Doped La2Ti2O7 Two-dimensional Layered Composites as Efficient Visible-Light-Driven Photocatalyst[J]. Appl Catal B-Environ, 2017, 202: 191-198. doi: 10.1016/j.apcatb.2016.09.021
-
[90]
Kim H, Hwang D, Kim Y. Highly Donor-Doped (110) Layered Perovskite Materials as Novel Photocatalysts for Overall Water Splitting[J]. Chem Commun, 1999, 12: 1077-1078.
-
[91]
Hwang D W, Kim H G, Lee J S. Photocatalytic Hydrogen Production from Water over M-doped La2Ti2O7(M=Cr, Fe) under Visible Light Irradiation(λ>420 nm)[J]. J Phys Chem B, 2005, 109(6): 2093-2102. doi: 10.1021/jp0493226
-
[92]
Meng F K, Hong Z L, Arndt J. Visible Light Photocatalytic Activity of Nitrogen-Doped La2Ti2O7 Nanosheets Originating from Band Gap Narrowing[J]. Nano Res, 2012, 5(3): 213-221. doi: 10.1007/s12274-012-0201-x
-
[93]
Iizuka K, Wato T, Miseki Y. Photocatalytic Reduction of Carbon Dioxide over Ag Cocatalyst-loaded ALa4Ti4O15(A=Ca, Sr, and Ba) Using Water as a Reducing Reagent[J]. J Am Chem Soc, 2011, 133(51): 20863-20868. doi: 10.1021/ja207586e
-
[94]
Negishi Y, Matsuura Y, Tomizawa R. Controlled Loading of Small Aun Clusters(n=10~39) onto BaLa4Ti4O15 Photocatalysts:Toward an Understanding of Size Effect of Cocatalyst on Water-Splitting Photocatalytic Activity[J]. J Phys Chem C, 2015, 119(20): 11224-11232. doi: 10.1021/jp5122432
-
[95]
Negishi Y, Mizuno M, Hirayama M. Enhanced Photocatalytic Water Splitting by BaLa4Ti4O15 Loaded with~1 nm Gold Nanoclusters Using Glutathione-protected Au 25 Clusters[J]. Nanoscale, 2013, 5(16): 7188-7192. doi: 10.1039/c3nr01888a
-
[1]
-
图 8 (左)Rh掺杂BaTiO3光催化产氢示意图; (右)不同掺杂量Rh电极片在0.1 mol/L Na2SO4溶液中的线性扫描伏安图谱(λ>420 nm)[27]
Figure 8 (Left)The simulated diagram of photocatalytic hydrogen production by Rh doped BaTiO3; (Right)Current-voltage curves in aqueous 0.1 mol/L Na2SO4 solution(pH=5.9) under intermittent visible light(λ > 420 nm) for BaTiO3:Rh/FTO electrodes with different Rh doping amounts. Scan rate:20 mV/s[27]
图 9 (a) 由LTHSs形成单晶多孔SrTiO3纳米立方体团簇的机理示意图; (b)层状质子化钛酸盐的结构(左)和钙钛矿型SrTiO3的结构(右); (c)不同合成温度下SrTiO3的光催化性能图(300 W Xe灯, 320 nm<λ<780 nm)[61]
Figure 9 (a)Schematic illustration of the growth mechanism from LTHSs to single-crystalline porous SrTiO3 nanocube assemblies. (b)Crystal structures of layered protonated titanate(left) and perovskiteSrTiO3(right). (c)Hydrogen evolution curves of two porous SrTiO3 nanocube assemblies obtained at 150 and 180 ℃(i.e., P-SrTiO3-150 and P-SrTiO3-180) and solid SrTiO3 particles(S-SrTiO3-900) under irradiation of a 300 W xenon lamp(320 nm < λ < 780 nm)[61]
图 14 Bi3Ti0.6Cr0.2Nb1.2O9的高分辨透射电子显微镜图: (a)沿{010}轴方向; (b)沿{70-1}轴方向; (c)(002)晶格条纹; (d)从[110]方向拟合的晶体结构图[75]
Figure 14 High resolution transmission electron microscopy images of Bi3Ti0.6Cr0.2Nb1.2O9(x=0.2): (a)along {010} zone axis, (b)along {70-1} zone axis, (c)showing the (002) lattice fringe and (d) a refined crystal structure projected from [110] direction[75]
图 16 不同掺杂量Cr和不同掺杂量La和Cr的光催化性能图(a); 能带结构示意图(b)[78]
Figure 16 Plotof photocatalytic hydrogen production rate by dividing the amount of hydrogen produced with irradiation time (a); Schematic representation of band structures of dopedsamples and possible charge generation procedures; the Fermi level ismarked by the dotted line (b)[78]
图 17 Sr2-xLaxTi1-xRhxO4(x=0, 0.01, 0.03和0.05)的紫外可见漫反射图谱(左); 样品的能带边示意图(右)[79]
Figure 17 (left)UV-Vis light absorption spectra(converted from diffuse reflectance spectra) of as-prepared samples Sr2-xLaxTi1-xRhxO4(x=0, 0.01, 0.03 and 0.05); (right)schematic representation of band edge positions of all samples[79]
表 1 几种钛基钙钛矿材料的光催化性能
Table 1. The photocatalytic properties of several titanium-based perovkites
Perovskite Doping element Band gap/eV Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) O2/ (μmol·h-1) Pollutants* Ref. BaTiO3 Ag - water 350 W Hg MO [29] Fe 2.81 150 W Xe>420 nm photocurrent [30] Rh - Pt(0.25) 10%CH3OH 300 W Xe>420 nm 30.8 [27] CaTiO3 Ag,La - - 5%CH3OH 350 W Xe>400 nm 10.1 [31] Zr 3.592 Pt(1) 5%C2H5OH 500 W Hg 140 [32] Cu - NiOX 5%CH3OH 350 W Xe>400 nm 22.7 [33] NiTiO3 Ag - - water UV MB [21] PbTiO3 Cu - - 5%CH3OH 125 W Hg>400 nm 90 [17] ZnTiO3 La 2.92 - water sunlight RhB [34] LaTiO2N Ca 1.63 CoOX 0.05 mol/L AgNO3 400 W Xe>400 nm 63 [35] Catalyst:0.1 g, *MO:Methyl Orange, MB:Methyl Blue, RhB:Rhodamine B. 表 2 不同La掺杂量a的La/Rh共掺的SrTiO3的光催化性能[40]
Table 2. Photocatalytic activities of SrTiO3:La/Rh with different La doping concentrations[40]

表 3 SrTiO3的改性及其光催化性能研究
Table 3. Summary of modification of SrTiO3 for water splitting and degradation of pollutants
Doping element BG/eV Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) O2/ (μmol·h-1) Pollutants Ref. Cr - - 5%CH3OH 350 W Xe>420 nm 27.92a [37] Mn 2.7 Pt(0.5) 10%CH3OH/ 300 W Xe>440 nm 0.2b 2.7b 0.05 mol/L AgNO3 Ru 1.9 1.7b 3.9b Ir 2.3 8.6b 0.4b [38] Rh - Pt(0.3) 300 W Xe>420 nm 141c [45] Zn 3.15 3%CH3OH 400 W Xe-Hg 732c [46] Er - Pt(1) Na2S/NaSO4 300 W Xe-Hg>420 nm 46.23b 0.185 mol/L AgNO3 44.23b [47] N - Gas 250 W Xe 410 nm<λ<500 nm 2-propanol [43] N 3.18 Gas 450 W Hg>400 nm NO [48] F 3 Gas 450 W Hg>400 nm NO [49] Sb, Cr 2.4 Pt(0.3) 8%CH3OH 400 W Xe>420 nm 78d 50 mmol/L AgNO3 0.9d [50] Cr, Ta - Pt(1) 6.5%CH3OH 300 W Xe>440 nm 70a [51] La, N - Gas 450 W Hg>400 nm NO [48] Ni, Ta 2.8 Pt(0.1) 10%CH3OH 300 W Xe>420 nm 2.4b 50 mmol/L AgNO3 0.5b [52] Ag, Pb 3.18 Gas Xe IPA [53] Cr, N 2.39 Pt(0.5) 18.5%CH3OH 300 W Xe>420 nm 106.7e [54] La, Rh - Ru(0.2) 10%CH3OH 300 W Xe>420 nm 84b [40] Bi, Cr - Pt(1) 10%CH3OH 300 W Xe>420 nm 3.7c [41] Bi, Fe - Pt(1) 0.05 mol/L Na2SO3 500 W Hg>400 nm 5c [42] S, C 2 Water 500 W Xe>400 nm 2-propanol [44] Catalyst:a.1 g; b.0.3 g; c.0.1 g; d.0.5 g; e.0.25 g, IPA:Isopropyl Alcohol. 表 4 不同助催化剂对(SrTiO3:Rh)-(WO3)体系分解水的作用[65]
Table 4. Effect of co-catalysts on water splitting by (SrTiO3:Rh)-(WO3) systems[65]
Co-catalyst Loading method Amounts of products for 22 h/μmola H2 O2 None - 21 51 Ni Photodeposition 60 42 Ru Photodeposition 416 197 Rh Photodeposition 92 67 Ag Photodeposition 7.1 39 Pt Photodeposition 322 153 Au Impregnation 140 71 Fe2O3 Impregnation 15 55 NiOX Impregnation 0.9 33 RuO2 Impregnation 4.4 38 Reaction conditions:catalyst, 50 mg each; reactant solution, 2 mmol/L of an aqueous FeCl3 solution; 120 mL; pH=2.4; light source, 300 W Xe-arc lamp(λ>420 nm); cell, top-irradiation cell with a Pyrex glass window. 表 5 {100}型层状钙钛矿光催化材料
Table 5. {100} layered perovskite photocatalyst
Perovskite Doping element Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) O2/ (μmol·h-1) Pollutants Ref. K2La2Ti3O10 Ni/NiO(3) 0.1 mol/L KOH 450 W Hg light 444a 221a [67] V aqueous aolution 250 W Xe light 42.2a [80] Zn aqueous aolution 250 W Xe light 55.5a [81] Rb2La2Ti3O10 Ni/NiO(4) 0.1 mol/L RbOH 450 W Hg light 869a 430a Nb Ni/NiO(5) 0.1 mol/L RbOH 450 W Hg light 725a 358a [67] Bi4Ti3O12 5%CH3OH 450 W Hg light 0.6a 0.05 mol/L AgNO3 450 W Hg light 3.0a [69] Cr None 5%CH3OH 350 W Xe light>400 nm 58.1a [70] Eu water 300 W Xe light>420 nm MO [82] g-C3N4/ Bi4Ti3O12 C3N4 water 500 W Xe light>420 nm acidorange-Ⅱ (AO-7) [71] TiO2/Bi4Ti3O12 water 300 W Xe light>400 nm phenol [83] Sr2TiO4 La Cr Pt(0.25) 20%CH3OH 300 W Xe light>420 nm 4b Sr2TiO4/SrTiO3 (La, Cr) Pt(0.25) 20%CH3OH 300 W Xe light>420 nm 12b [77] Cr Pt(1) 0.05 mol/L Na2SO3 500 W Hg light>400 nm 17b [78] La Rh Pt(1) 0.05 mol/L Na2SO3 500 W Hg light>400 nm 40b [79] Bi3TiNbO9 Pt(1) CH3OH 450 W Hg light 33a None AgNO3 450 W Hg light 31a [69] Ni water 500 W Xe light>400 nm MB [74] Cr Nb Pt(1) 0.05 mol/L Na2SO3 500 W Hg light>420 nm 41.11b [75] Catalyst:a.1 g; b.0.1 g,MO:Methyl Orange,MB:Methyl Blue,orange-Ⅱ(AO-7):C16H11N2NaO4S. 表 6 {110}型层状钙钛矿光催化材料
Table 6. {110} layered perovskite photocatalyst
Perovskite Doping element Co-catalyst/ (mass%) Reactant solution Lamp source H2/ (μmol·h-1) Pollutants Ref. La2Ti2O7 NiOx(1) water 450 W Hg light 441a [90] Cr Pt(1) 33%CH3OH 500 W Hg light>420 nm 15b Fe Pt(1) 33%CH3OH 500 W Hg light>420 nm 10b Cr, Sb Pt(1) 33%CH3OH 500 W Hg light>420 nm 4b [91] La2Ti2O7 nanosheet N - water Luzchem LZC-420 MO [92] La4CaTi5O17 NiOx(1) water 450 W Hg light 499a [90] Catalyst:a.1 g; b.0.5 g,MO:Methyl Orange. 表 7 {111}型层状钙钛矿光催化材料
Table 7. {111} layered perovskite photocatalyst
Perovskite Co-catalyst/ (mass%) Reactant solution Light source H2/ (μmol·h-1) O2/ (μmol·h-1) CO/ (μmol·h-1) HCOOH/ (μmol·h-1) Ref. La4Ti3O12 NiO(0.6) pure water 400 W Hg light 357a 179a CaLa4Ti4O15 NiO(0.2) pure water 400 W Hg light 593a 276a SrLa4Ti4O15 NiO(0.7) pure water 400 W Hg light 1 171a 546a BaLa4Ti4O15 NiO(0.5) pure water 400 W Hg light 2 300a 1 154a [66] Ag(2) CO2 flow system (15 mL/min) 400 W Hg light 10b 16b 22b 0.7b Au(2) pure water 400 W Hg light 400a 200a [95] Catalyst:a.0.5 g; b.0.3 g. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 29
- 文章访问数: 3238
- HTML全文浏览量: 917




 下载:
下载:


















 下载:
下载:

