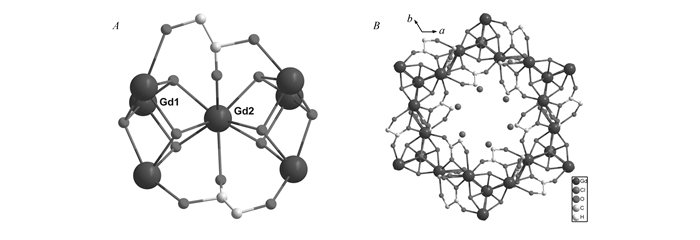
 图1
化合物1的七核稀土团簇结构单元(A)和沿着c轴的三维结构(B)
Figure1.
{Gd7(OH)8(HOCH2COO)2} unit(A) and 3D structure(B) of compound 1 along c-axis
图1
化合物1的七核稀土团簇结构单元(A)和沿着c轴的三维结构(B)
Figure1.
{Gd7(OH)8(HOCH2COO)2} unit(A) and 3D structure(B) of compound 1 along c-axis

Citation: ZHENG Xiuying, KONG Xiangjian, LONG Lasheng, ZHENG Lansun. Synthesis, Structure, Magnetic Properties of Lanthanide Cluster-Based Metal-Organic Frameworks[J]. Chinese Journal of Applied Chemistry, 2017, 34(9): 1086-1092. doi: 10.11944/j.issn.1000-0518.2017.09.170176

稀土簇基金属有机框架的合成、结构及磁学性质
English
Synthesis, Structure, Magnetic Properties of Lanthanide Cluster-Based Metal-Organic Frameworks
-
自从1881年Warburg发现磁热效应后[1],一种基于磁热效应基础上的磁制冷技术逐渐引起研究者们的注意。由于磁制冷技术具有高效节能,绿色无污染等优点,且在超低温区有可能取代现在昂贵的氦-3,因此如何制备出具有高效磁热效应的磁制冷材料越发的吸引着研究者们的兴趣。
通过文献调研发现,在众多不同类型的磁性材料中,稀土簇合物和稀土配位聚合物格外引人注目[2]。一方面是由于它们的结构丰富性和可调性,研究人员可以有效的调控金属离子之间磁相互作用,进而可以得到比镧系合金材料和磁纳米材料大的磁熵变[3-4]。另一方面由于它们的磁相变通常发生在超低温区,因此可以用作超低温区磁制冷剂。
在过去的近10年里,分子基磁制冷材料,如{Mn12}[5]、{Fe8}[6]、{Gd4Mn4}[7]、{Gd36Ni12}[8]、{Gd42Co10}[9]、{Gd104}[10]、[Gd(HCOO)3]n[3][Gd(OH)CO3]n[4]等,被相继报道。磁熵变研究发现多维结构的金属配合物或者金属框架与零维的簇合物相比通常具有更大的磁热效应。这可能与多维金属配合物磁密度大、长程磁有序的特点有关。另外,多维金属配合物通常比零维的簇合物更加稳定,更有利于实际应用。本文中,我们选择羟基乙酸配体与Gd3+离子反应制备了一个具有高磁热效应和化学稳定性的金属有机框架化合物。
1 实验部分
1.1 仪器和试剂
C、H的含量分析是用EA 1110型元素分析仪(意大利CE公司)。红外光谱在AVATAR 330型傅里叶变换红外光谱仪(FT-IR,美国Nicolet公司)上测试,波数范围400~4000cm-1,样品采用KBr压片。热重分析采用SDT-Q600型热重分析仪(美国TG仪器公司)测试。磁性是在MPMS (SQUID)型磁强计(美国Quantum Design公司)上测试。粉末衍射是在Ultima Ⅳ型X射线衍射仪(PXRD, 日本理学Rigaku)上进行测试,扫描角度5°~50°,扫描速率2°/min单晶结构通过Agilent Super Nova Diffractometer型单晶X射线衍射仪收集(日本理学,173 K)。采用石墨单色器单色化MoKα射线(λ=0.071073 nm)作为入射光源,以ω-2θ扫描方式收集衍射点。结构解析通过直接法得到初结构,并用Shelx-97提供的全矩阵最小二乘法精修。所有非氢原子都做各向异性精修,所有H原子均设定在相同的各向同性温度因子并包括在结构因子计算中。整个结构解析过程使用Olex2提供的图形化用户界面完成。化合物1和2的CCDC号分别为1551677和1551678。
六水合氯化钆(GdCl3·6H2O)、六水合氯化镝(DyCl3·6H2O)和羟基乙酸均从北京伊诺凯试剂公司购买;乙醇、乙腈、NaOH、37%的浓盐酸均从国药集团化学试剂有限公司购买。所有试剂均为市售分析纯,使用前均未进一步纯化。
1.2 实验方法
1.2.1 化合物的合成
化合物{[Gd7(OH)8(HOCH2COO)8(H2O)3]·Cl5·3H2O}n(1)的合成:将0.185 g GdCl3·6H2O(0.5 mmol)和0.038 g羟基乙酸(0.5 mmol)加入6 mL乙腈、4 mL乙醇和2 mL去离子水的混合溶剂中,常温搅拌30~60 min后,将混合物倒入25 mL聚四氟乙烯水热反应釜中,以65 ℃/h速率升温至160 ℃, 并恒温2880 min,之后以4.3 ℃/h速率降温至室温。将产物从溶液中过滤即可得到无色棒状晶体(1)。产率50%,以羟基乙酸计算。元素分析实验值(理论值)/%:C 9.01(9.05), H 2.03(2.09)。部分红外特征峰(KBr压片),σ/cm-1:3413(s), 1592(s), 1458(s), 1426(s), 1373(s), 1317(s), 1275(s), 1075(s), 1008(m), 927(s), 867(w), 837(m), 781(m), 709(w), 693(m), 584(m), 547(m)。
化合物{[Dy7(OH)8(HOCH2COO)8(H2O)6]·Cl5·3H2O}n(2)的合成:所有的合成步骤均和化合物1一致,仅仅是将GdCl3·6H2O替换为DyCl3·6H2O。产率5 %,以羟基乙酸计算。元素分析实验值(理论值)/%:C 8.92(8.90), H 2.04(2.05)。部分红外特征峰(KBr压片),σ/cm-1:3413(s), 1592(s), 1458(s), 1426(s), 1373(s), 1317(s), 1275(s), 1075(s), 1008(m), 927(s), 867(w), 837(m), 781(m), 709(w), 693(m), 584(m), 547(m)。
1.2.2 粉末衍射测定
取化合物1和2(各0.050 g)分别浸泡在pH=1的盐酸(3 mL)、pH=14的NaOH溶液(3 mL)中和100 ℃的去离子水(3 mL)中,12 h后,通过粉末衍射验证其稳定性。
2 结果与讨论
2.1 单晶结构解析
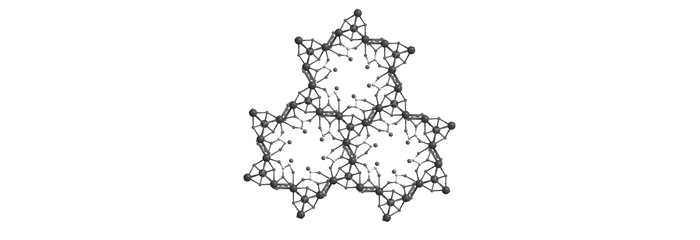
化合物1和2属同构体,现以化合物1为例对其进行结构解析。化合物1属于六方晶系,空间群P63/m,分子式为{[Gd7(OH)8(HOCH2COO)8(H2O)3]·Cl5·3H2O}n(n为周期数,取无穷大),晶胞参数为a=b=1.21189 nm, c=1.81058 nm, V=2.30290 nm3(a、b、c分别为晶胞的3个轴长,V为晶胞的体积)。结构分析显示,化合物1是由七核稀土团簇和羟基乙酸配体组成的。如图 1A所示,7个Gd3+和8个μ3-OH组成了一个共顶点的双立方烷结构单元[Gd7(OH)8]13+。另外,两个立方烷结构单元还通过两个无序的HOCH2COO-桥连接,形成[Gd7(HOCH2COO)2(OH)8]11+团簇单元。相邻的[Gd7(HOCH2COO)2(OH)8]11+团簇单元通过羟基乙酸相连形成三维结构, 如图 1B所示。5个Cl-作为平衡电荷存在于三维框架的孔道内。晶体中有两种晶体学独立的Gd3+。其中Gd1以八配位方式与3个羟基乙酸上的羧基、一个羟基乙酸上的羟基、1个碳酸根上的O和3个μ3-OH-配位形成十二面体构型,而Gd2则是以九配位的方式与3个碳酸根上的O和6个μ3-OH-配位形成十四面体构型。Gd—O的键长在0.2326~0.2528 nm范围内,Gd—O—Gd的键角为101.4~113.5°,Gd....Gd之间距离为0.3420~0.3859 nm。
 图1
化合物1的七核稀土团簇结构单元(A)和沿着c轴的三维结构(B)
Figure1.
{Gd7(OH)8(HOCH2COO)2} unit(A) and 3D structure(B) of compound 1 along c-axis
图1
化合物1的七核稀土团簇结构单元(A)和沿着c轴的三维结构(B)
Figure1.
{Gd7(OH)8(HOCH2COO)2} unit(A) and 3D structure(B) of compound 1 along c-axis
Complex Compound 1 Compound 2 Formula C16H44Cl5Gd7O38 C16H44Cl5Dy7O38 Formula mass 2 122.51 2 159.26 T/K 173 173 Crystal system hexagonal hexagonal Space group P63/m P63/m a/nm 1.211 89 (4) 1.203 92 (5) b/nm 1.211 89 (4) 12.039 2 (5) c/nm 1.810 58 (9) 1.790 34 (8) V/nm3 2.302 90 (16) 2.247 30 (16) Z 2 2 Dc/(g·cm-3) 3.061 3.191 μ/mm-1 10.329 64.800 Data/parameters 1 398/116 1 230/116 2θ/(°) 5.94~50.48 8.48~124.24 Observed reflections 1 257 1 106 F(000) 1 954 1 950.0 GOF 1.189 1.175 R1[I>2σ(I)]a 0.032 7 0.037 4 wR2(All data)b 0.0822 0.0924 a.R1=∑‖Fo|-|Fc‖/∑|Fo|; b.wR2={∑[w(Fo2-Fc2)2]/∑[w(Fo2)2]}1/2. 2.2 粉末衍射结果讨论
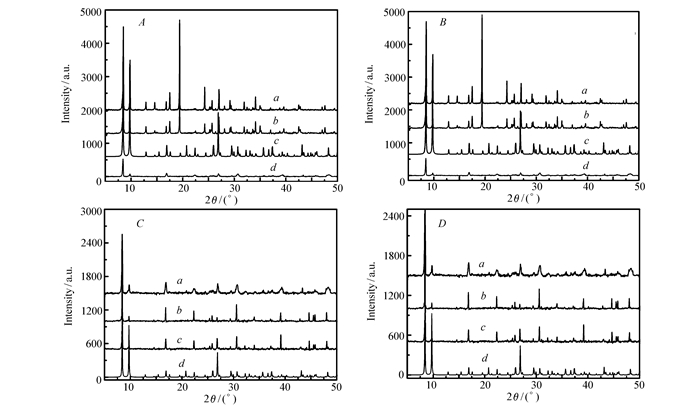
采用PXRD对粉末样品进行结构表征。如图 3所示,在pH=1的HCl溶液、pH=14的NaOH水溶液/100 ℃水以及部分常规有机溶剂中浸泡12 h后,化合物1(图 3A、3C)、化合物2(图 3B、3D)与根据单晶结构拟合的XRD数据基本一致。各特征衍射峰峰形较好,基线比较平稳,说明样品仍保持晶型,且晶相依旧良好。以上表明,该材料在酸、碱、水溶液中以及部分常规有机溶剂中能够稳定存在,具有强的稳定性。
2.3 热重分析
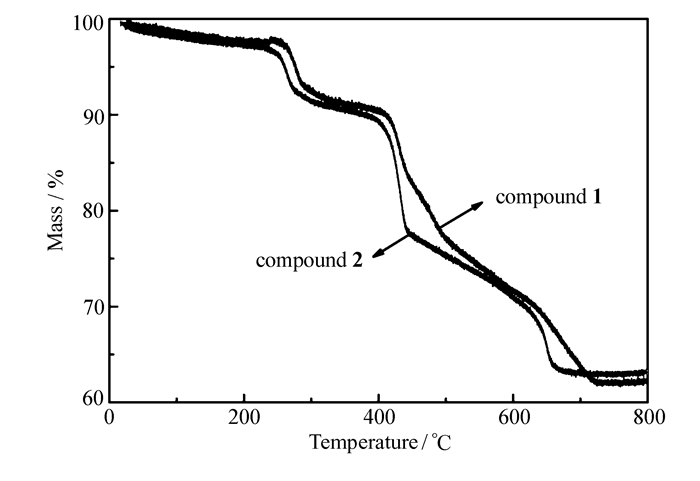
化合物1和2在空气氛下的热重曲线如图 4所示,化合物1和2的热失重情况基本相同,3个客体水分子在250 ℃内逐渐失去,失重分别为2.48%和2.44%,与理论值2.23%和2.85%基本一致。250~300 ℃之间化合物1和2分别逐渐失去3个配位水分子。当温度升至400 ℃,配体羟基乙酸逐渐分解,400 ℃之后两个化合物的整体框架逐渐瓦解,直至800 ℃,化合物1和2分解完全,剩余氧化物Gd2O3和Dy2O3分别为62.0%和63.1%。
2.4 磁学性质
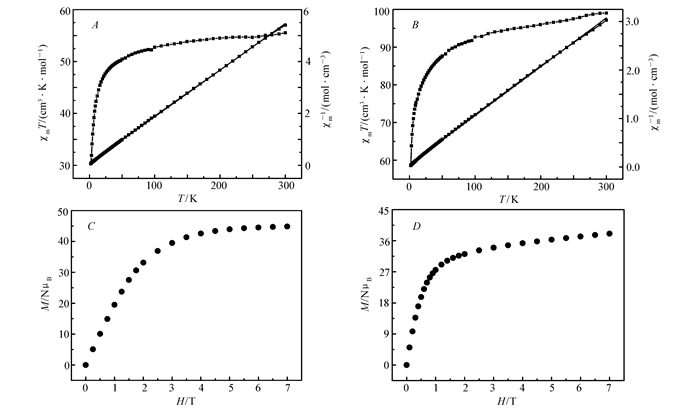
在温度(T)范围为2~300 K和1000 Oe的外磁场条件下,测试化合物1和2多晶样品的磁化率,其变温磁化率(χM)测试结果如图 5A和5B所示。在室温下,化合物1和2的变温磁化率分别为55.54和99.04 cm3·K/mol,接近于7个未耦合的Gd3+离子的变温磁化率55.12 cm3·K/mol(Gd3+:S=7:2, g=2) 和7个未耦合的Dy3+离子的变温磁化率99.17 cm3·K/mol(Dy3+:S=15:2, g=4/3)。对于化合物1,在50~300 K温度范围内,χMT值缓慢下降至50.44 cm3·K/mol, 50 K之后迅速下降,在2 K时达到最小值30.30 cm3·K/mol。化合物2具有和化合物1相同趋势的变温磁化率曲线,其在50~300 K温度范围内,χMT值亦是缓慢下降,当温度小于50 K时,χMT迅速下降,在2 K时达到最小值58.59 cm3·K/mol。化合物1和2的变温磁化率曲线说明稀土离子之间存在反铁磁相互作用。在2~300 K温度范围内,根据居里-外斯定律,对化合物1和2的χM-1-T曲线进行拟合,得到化合物1和2的居里-外斯常数分别为:C=55.71 cm3·K/mol, θ=-4.34 K; C=99.21 cm3·K/mol, θ=-5.27 K。负的居里-外斯常数θ值也进一步说明了在化合物1和2中存在反铁磁相互作用。化合物1和2在2 K下,变场(H为所加外场场强)磁化强度曲线如图 5C和5D,化合物1在2 K和7 T时的磁化强度(M)为44.84 NμB(N为Avogadro常数,μB为Bohr磁子),接近于饱和磁化强度49 NμB,而化合物2在2 K和7 T时的磁化强度为38.07 NμB,远小于饱和磁化强度70 NμB,这是由于Dy3+离子的各向异性导致的。
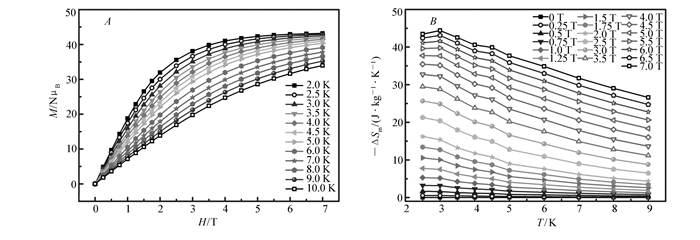
我们对化合物1进行了磁热效应研究。测试了化合物1在2~10 K温度范围内变温变场的磁化强度(图 6A),根据Maxwell公式:ΔSm(ΔH)=∫[∂M(T, H)/∂T]HdH[11].可得到化合物1的磁熵变化值ΔSm。如图 6B所示,在测试范围内,化合物1的最大-ΔSm值为44.4 J/(kg·K)(T=3 K, ΔH=7 T), 与已报道的金属配合物相比,具有较大的磁熵变,但是远小于理论计算值61.29 J/(kg·K)。理论计算值是基于7个孤立的Gd3+, 通过公式ΔSm(T)=nRln (2S+1)=7Rln (8)=14.6R(其中R为摩尔气体常数; S为金属离子的基态自旋值)得到[12]。实验值小于理论值,可归结于化合物1中反铁磁相互作用导致的。
由于Dy3+离子具有较强的磁各向异性,我们对化合物2进行了交流磁化率测试,测试是在2~10 K范围内,外加零直流场,3 Oe交流场下进行的。如图 7所示,化合物2的交流磁化率虚部(χ″)表现出了明显的频率依赖性,说明化合物2具有缓慢弛豫的性质。在外加2000 Oe直流场的情况下,化合物2交流磁化率虚部交流信号依旧没有出峰(见辅助材料图S1),即并没有达到抑制其量子隧穿效应。由于量子隧穿效应使得交流磁化率虚部信号未出现峰值,该体系的有效能垒和弛豫时间不能通过阿伦尼乌斯公式获得。
3 结论
本文采用羟基乙酸作为配体通过溶剂热法成功合成了两个具有相同结构的稀土簇基金属有机框架,单晶衍射分析表明,化合物1和2为同构物,均是由七核稀土团簇作为节点,以羟基乙酸作为配体连接而成的三维金属有机框架。粉末衍射结果证明了该稀土簇基金属有机框架具有非常好的化学稳定性,该现象在金属有机框架材料中是及其少见的。磁性研究表明,化合物1具有较大的磁热效应,在3 K和7 T下磁熵变值为44.4 J/(kg·K)。
辅助材料(Supporting Information)[化合物2交流磁化率]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
-
-
[1]
Warburg E. Magnetische Untersuchungen[J]. Annalen der Physik, 1881, 249(5): 141-164. doi: 10.1002/(ISSN)1521-3889
-
[2]
Zheng Y Z, Guo J Z, Zheng Z. Molecule-based Magnetic Coolers[J]. Chem Soc Rev, 2014, 43(5): 1462-4656. doi: 10.1039/C3CS60337G
-
[3]
Lorusso G, Sharples J W, Palacios E. A Dense Metal-Organic Framework for Enhanced Magnetic Refrigeration[J]. Adv Mater, 2013, 25(33): 4653-4656. doi: 10.1002/adma.201301997
-
[4]
Chen Y C, Qin L, Meng Z S. Study of a Magnetic-Cooling Material Gd(OH)CO3[J]. J Mater Chem A, 2014, 2(25): 9851-9858. doi: 10.1039/C4TA01646G
-
[5]
Torres F, Hernández J, Ohigas X. Giant and Time-Dependent Magnetocaloric Effect in High-Spin Molecular Magnets[J]. Appl Phys Lett, 2000, 77(20): 3248-3250. doi: 10.1063/1.1325393
-
[6]
Zhang X, Wei H, Zhang Z. Anisotropic Magnetocaloric Effect in Nanostructured Magnetic Clusters[J]. Phys Rev Lett, 2001, 87(15): 157203-157206. doi: 10.1103/PhysRevLett.87.157203
-
[7]
Karotsis G, Evangelisti M, Dalgarno S J. A Calix[4] Arene 3 d/4f Magnetic Cooler[J]. Angew Chem, 2009, 121(52): 10112-10115. doi: 10.1002/ange.200905012
-
[8]
Peng J B, Zhang Q C, Kong X J. A 48-Metal Cluster Exhibiting a Large Magnetocaloric Effect[J]. Angew Chem Int Ed, 2011, 50(45): 10649-10652. doi: 10.1002/anie.201105147
-
[9]
Peng J B, Zhang Q C, Kong X J. High-Nuclearity 3 d-4f Clusters as Enhanced Magnetic Coolers and Molecular Magnets[J]. J Am Chem Soc, 2012, 134(7): 3314-3317. doi: 10.1021/ja209752z
-
[10]
Peng J B, Kong X J, Zhang Q C, et al. Beauty, Symmetry, and Magnetocaloric Effect-Four-Shell Keplerates with 104 Lanthanide Atoms[J]. J Am Chem Soc, 2014, 136(52)7:17938-17941 doi: 10.1007/430_2016_12/fulltext.html
-
[11]
Sessoli R. Chilling with Magnetic Molecules[J]. Angew Chem Int Ed, 2012, 51(1): 43-45. doi: 10.1002/anie.201104448
-
[12]
Yang Y, Zhang Q C, Pan Y Y. Magnetocaloric Effect and Thermal Conductivity of Gd(OH)3 and Gd2O(OH)4(H2O)2[J]. Chem Commun, 2015, 51(34): 7317-7320. doi: 10.1039/C5CC01254F
-
[1]
-
图 3 化合物1(A、C)和化合物2(B、D)经过酸、碱、沸水以及常规有机溶剂中处理后的粉末衍射与拟合的对比图
Figure 3 PXRD and fitting curves of compounds 1(A, C) and 2(B, D) after treatment in HCl(pH=1), NaOH(pH=14) and boiling water and conventional organic solvent
A, B:a.experiment after HCl(pH=1); b.experiment after NaOH(pH=14); c.simulated; d.experiment after H2O(100 ℃) C, D:a.experiment after MeCN; b.experiment after EtOH; c.experiment after MeOH; d.simulated
表 1 化合物1和2的晶体数据表
Table 1. Crystal data for compounds 1 and 2
Complex Compound 1 Compound 2 Formula C16H44Cl5Gd7O38 C16H44Cl5Dy7O38 Formula mass 2 122.51 2 159.26 T/K 173 173 Crystal system hexagonal hexagonal Space group P63/m P63/m a/nm 1.211 89 (4) 1.203 92 (5) b/nm 1.211 89 (4) 12.039 2 (5) c/nm 1.810 58 (9) 1.790 34 (8) V/nm3 2.302 90 (16) 2.247 30 (16) Z 2 2 Dc/(g·cm-3) 3.061 3.191 μ/mm-1 10.329 64.800 Data/parameters 1 398/116 1 230/116 2θ/(°) 5.94~50.48 8.48~124.24 Observed reflections 1 257 1 106 F(000) 1 954 1 950.0 GOF 1.189 1.175 R1[I>2σ(I)]a 0.032 7 0.037 4 wR2(All data)b 0.0822 0.0924 a.R1=∑‖Fo|-|Fc‖/∑|Fo|; b.wR2={∑[w(Fo2-Fc2)2]/∑[w(Fo2)2]}1/2. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1067
- HTML全文浏览量: 159



 下载:
下载:






 下载:
下载:

