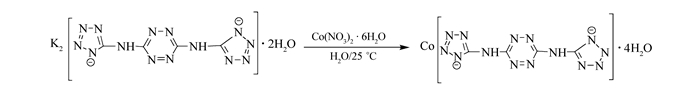
 Scheme1.
Reaction of the title compound
Scheme1.
Reaction of the title compound

Citation: YANG Jin, LIU Qing, REN Yinghui, ZHANG Xianbo, MA Haixia, XU Kangzhen, ZHAO Fengqi, HU Rongzu. A New Energetic Material-Tetrazine Cobalt Salt:Synthesis, Thermal Decomposition Kinetics and Thermal Safety[J]. Chinese Journal of Applied Chemistry, 2017, 34(8): 928-935. doi: 10.11944/j.issn.1000-0518.2017.08.160466

一种新型含能材料s-四嗪钴盐的合成、热分解动力学及热安全性
English
A New Energetic Material-Tetrazine Cobalt Salt:Synthesis, Thermal Decomposition Kinetics and Thermal Safety
-
Key words:
- s-tetrazine
- / cobalt salt
- / thermal decomposition mechanism
- / thermal safety
-
四嗪类化合物是近年来国内外研究较多的一类高氮化合物,其能量主要来源于其正生成焓,且大多不含硝基基团,感度较低,热稳定性较好;同时分子结构中的高氮、低碳氢含量不仅使其成气量大、燃烧产物少烟或者无烟,且易达到氧平衡。该类化合物被广泛应用于低特征信号推进剂、气体发生剂、无烟焰火技术等各个领域[1]。
作为四嗪类化合物之一的3, 6-双(1-氢-1, 2, 3, 4四唑-5-氨基)-1, 2, 4, 5-四嗪(BTATz)是分子中同时包含四嗪和四唑环的高氮含能化合物,最初由美国Los Alamos国家实验室的Hiskey等合成[2-3]。因其具有含氮量高(79.02%)、密度高(1.76 g/cm3)及拥有正的生成焓(+883 kJ/mol)等优势引起了国内外研究者的广泛关注[2-8]。此后众多的研究者对BTATz进行了进一步的研究,内容涉及到合成工艺的优化和量子化学[3]、燃烧性能[9]、溶解热[10]、BTATz衍生物的合成及性能[11-16]、甚至是将其部分替代黑索今(RDX)用于改性双基推进剂(CMDB)中[17]以及形成的BTATz-HNIW-CMDB(HNIW:六硝基六氮杂异伍兹烷)体系的热分解反应动力学机理及热安全性研究等方面[18]。
本文在前期研究[11-14]基础上,以BTATz钾盐为原料合成了其钴盐,并对其进行了结构表征。采用差示扫描量热仪(DSC)和热重分析仪(TG/DTG)研究了其热分解行为及热分解反应动力学,并对自加速分解温度(TSADT)、热爆炸临界温度(Tb)、热点火温度(TTIT)和绝热至爆时间(tTIAD)进行计算研究,为其在推进剂中的应用提供必要的理论基础。
1 实验部分
1.1 试剂和仪器
BTATz钾盐的制备按照文献[19]方法进行。其余试剂药品均为分析纯,购自天津市科密欧化学试剂有限公司,使用前未经进一步精制。
X-5型显微熔点测定仪(控温型)(北京泰克仪器公司);VarioELⅢ型元素分析仪(德国艾乐曼公司);EQUINOX-55型傅里叶变换红外光谱仪(KBr压片,400~4000 cm-1)(德国布鲁克公司);Agilent 7700X型电感耦合等离子体质谱仪(美国Agilent公司);比热容测定采用法国(SETARAM)Micro-DSCⅢ型微量量热仪中的连续比热容测定模式进行,测定原理及仪器校正同文献[20];DSC曲线测定选用NETZSCH DSC204型热分析仪,TG/DTG曲线测定选用的SDT Q600型热分析仪(美国TA公司)。
1.2 实验方法
将0.3684 g BTATz钾盐溶于30 mL水中,过滤,滤液于圆底烧瓶中。逐渐滴加40 mL含有0.5820 g Co(NO3)2·6H2O的水溶液,室温下搅拌。随着滴加的进行,溶液中出现黑色的沉淀,继续反应1 h后沉淀变为红棕色。滴加完毕后继续反应6 h后抽滤,滤饼多次水洗后于50 ℃下真空干燥,得到红棕色粉末,产率67%。反应历程如Scheme 1所示。
2 结果与讨论
2.1 Co(C4H2N14)·4H2O的表征
元素分析和ICP-MS分析测定值(计算值)/%:C 12.90(12.74),H 2.54(2.67),N 52.20(51.99),Co 13.00(15.63)。推测该化合物的化学式为Co(C4H2N14)·4H2O。IR(KBr), σ/cm-1:3519(O—H), 3464, 3244(N—H), 2986, 2756, 1617(NN), 1530, 1471(N—N), 1060(C—N), 995。
2.2 Co(C4H2N14)·4H2O的热分解行为及热分解动力学
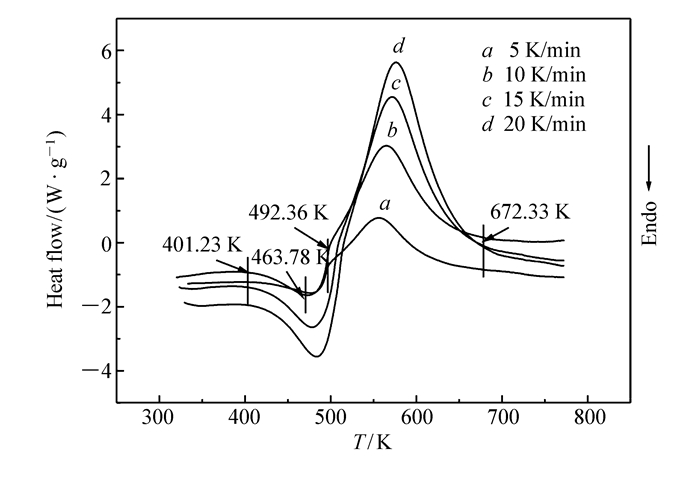
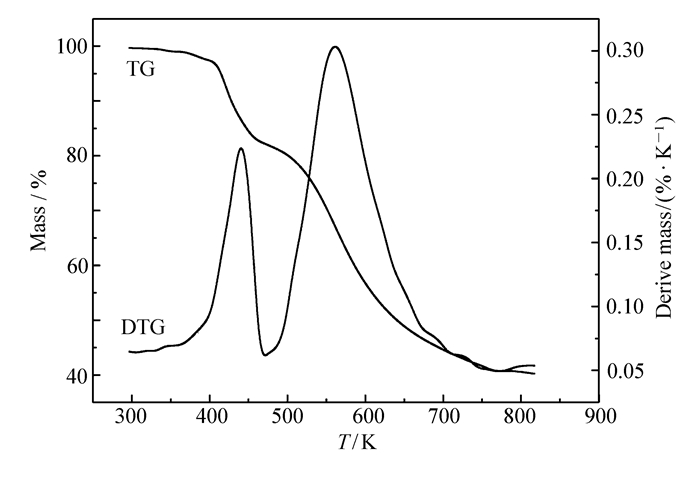
图 1为Co(C4H2N14)·4H2O在5、10、15和20 K/min升温速率下的DSC曲线,图 2为10 K/min下的TG/DTG曲线。
从图 1曲线b可知,Co(C4H2N14)·4H2O的热分解由一个吸热过程和一个放热过程组成,且吸热和放热是连续的。吸热阶段始于401.23 K,终于492.36 K,峰温为463.78 K。放热阶段始于吸热分解的终点,终于672.33 K,放热量为1152 J/g,该阶段对应TG/DTG曲线(图 2) 上第2个失重阶段。
TG/DTG图上存在两个失重阶段,第1个失重阶段出现在350~450 K温度范围内,失重率为18%,推测该阶段为失去4分子水的过程(计算值19.1%)。第2个失重阶段出现在450~800 K,最后剩余残渣45%应为形成的高熔点聚合物。
本文计算热分解动力学参数值的方法主要有Kissinger法[21]、Flynn-Wall-Ozawa法[22]和积分方程法[23]。通过常用的41种机理函数计算化合物的热分解反应动力学参数。按照文献[24-25]进行合理地选择计算方法及物质分解反应的动力学参数和机理函数。
表 1为在升温速率为5、10、15和20 K/min下由DSC曲线所获得的基本参数值(Te、Tp值和ΔH)。采用Kissinger和Ozawa两种方法求得表观活化能(Ea)、指前因子(A)和线性相关系数(r)分别列于表 3中。
 表 1
由不同升温速率下的DSC曲线得到的参数值
Table 1.
The parameters determined by DSC curves at different heating rates
表 1
由不同升温速率下的DSC曲线得到的参数值
Table 1.
The parameters determined by DSC curves at different heating rates
β/(K·min-1) 5 10 15 20 Te/K 519.75 526.15 535.35 538.85 Tp/K 553.35 564.55 571.85 576.25 ΔH/(J·g-1) 1067 1152 1230 1089 ΔHmean=(1067+1152+1230+1089)/4=1134.50 J/g.  表 2
不同升温速率下由DSC曲线得到的热分解数据
Table 2.
Thermal decomposition data determined by DSC curves at different heating rates
表 2
不同升温速率下由DSC曲线得到的热分解数据
Table 2.
Thermal decomposition data determined by DSC curves at different heating rates
α T5/K T10/K T15/K T20/K 0.02 512.73 515.28 525.81 529.28 0.04 517.66 520.79 531.10 534.48 0.06 521.37 524.99 535.11 538.41 0.08 524.46 528.40 538.43 541.69 0.10 527.13 531.47 541.35 544.57 0.12 529.52 534.08 543.97 547.09 0.14 531.69 536.49 546.31 549.41 0.16 533.77 538.80 548.51 551.54 0.18 535.56 540.81 550.56 553.58 0.20 537.35 542.83 552.46 555.42 0.22 539.05 544.74 554.32 557.26 0.24 540.66 546.48 556.03 558.98 0.26 542.17 548.15 557.75 560.59 0.28 543.68 549.83 559.39 562.21 0.30 545.12 551.44 560.95 563.76 0.32 546.51 552.98 562.51 565.24 0.34 547.89 554.49 564.00 566.73 0.36 549.28 555.93 565.49 568.15 0.38 550.60 557.40 566.98 569.57 0.40 551.89 558.81 568.47 570.93 0.42 553.18 560.28 569.89 572.29 0.44 554.50 561.69 571.30 573.71 0.46 555.75 563.03 572.79 575.07 0.48 557.01 564.44 574.21 576.42 0.50 558.33 565.85 575.62 577.78 0.52 559.59 567.25 577.11 579.14 0.54 560.91 568.66 578.55 580.49 0.56 562.23 570.07 580.05 581.88 0.58 563.55 571.48 581.58 583.27 0.60 564.91 572.95 583.15 584.69 0.62 566.26 574.42 584.71 586.18 0.64 567.71 575. 90 586.35 587.67 0.66 569.15 577.51 587.99 589.15 0.68 570.66 579.05 589.77 590.70 0.70 572.17 580.72 591.56 592.35 0.72 573.78 582.43 593.46 594.00 0.74 575.48 584.24 595.43 595.74 0.76 577.17 586.05 597.48 597.59 0.78 579.06 588.06 599.72 599.52 0.80 581.04 590.07 602.06 601.56 0.82 583.11 592.29 604.63 603.69 0.84 585.38 594.70 607.31 606.02 0.86 587.84 597.21 610.33 608.54 0.88 590.57 600.03 613.68 611.25 0.90 593.69 603.24 617.48 614.35 0.92 597.08 606.86 621.73 617.84 0.94 601.23 611.08 626.87 621.91 0.96 606.42 616.21 633.23 626.95 0.98 613.60 623.45 642.40 633.84 1.00 629.73 639.43 664.85 649.35 Note:T with the subscript of 5, 10, 15 and 20 is the temperature obtained at the heating rate of 5.0, 10.0, 15.0 and 20.0 K/min, respectively.  表 3
主要热分解阶段的动力学参数计算值
Table 3.
Calculated values of the main stage of thermal decomposition kinetic parameters
表 3
主要热分解阶段的动力学参数计算值
Table 3.
Calculated values of the main stage of thermal decomposition kinetic parameters
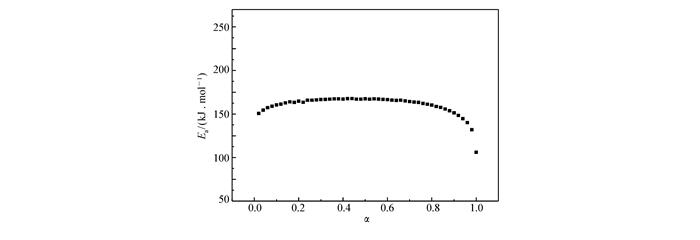
Method β/(K·min-1) Ea/(kJ·mol-1) lg (A/(s-1)) r General integral 5 153.37 12.07 0.9999 10 144.42 11.32 0.9999 15 147.81 11.58 0.9999 20 154.83 12.30 0.9999 Mac Callum-Tanner 5 154.99 12.18 0.9999 10 146.07 11.43 0.9999 15 149.65 11.71 0.9999 20 156.77 12.44 0.9999 atava-Šesták 5 154.51 12.17 0.9999 10 146.10 11.48 0.9999 15 149.48 11.73 0.9999 20 156.20 12.42 0.9999 Agrawal 5 153.37 12.07 0.9999 10 144.42 11.32 0.9999 15 147.81 11.57 0.9999 20 154.53 12.29 0.9999 Mean 150.90 11.88 Flynn-Wall-Ozawa 152.65 0.9997 150.29(Te) 0.9965 Kissinger 151.12 11.95 0.9997 表 2是在上述4个升温速率(β)下,放热分解过程任意反应分数(αi)所对应的分解温度(Ti)。将不同β对应的Ti值代入Ozawa方程,计算出各升温速率下的等转化活化能Ea,并作出对应的Ea~α曲线(图 3)。由图 3可知,将反应分数α在0.2~0.8之间时对应的活化能求算数平均值(平均值为150.90 kJ/mol),同时与以Te,Tp值利用Ozawa和Kissinger所算出的数值相比发现它们较为接近(表 3),并且不同方法算出的A值也接近,r值均大于0.98,表明计算所得结果可信。
该化合物的主要热分解反应对应37号机理函数,其最可积机理函数的积分式是f(α)=(1-α)2,微分式是G(α)=(1-α)-1-1。将f(α)=(1-α)2,E=150.90 kJ/mol,A =1011.88 s-1代入方程dα/dt=Af(α)e-E/RT中,得到Co(C4H2N14)·4H2O的热分解反应的动力学方程为:da/dt=1011.88×(1-α)2×exp(-1.51×105/RT)。
2.3 Co(C4H2N14)·4H2O的热力学函数
采用Micro-DSCⅢ微量量热仪测得Co(C4H2N14)·4H2O的比热容方程为:
计算得到298.15 K下的标准摩尔比热容为415.45 J/(mol·K)。根据方程(1) 及热力学函数与比热容的关系式(2)~(4),采用MATLAB[26]软件计算得到Co(C4H2N14)·4H2O基于298.15 K在283~353 K范围内的焓、熵和吉布斯自由能函数值。所得结果分别列于表 4中。
T/K HT-H298.15/(kJ·mol-1) ST-S298.15/(kJ·mol-1·K-1) GT-G298.15/(kJ·mol-1) 283 -6.7465 -0.0232 -0.1757 288 -4.5536 -0.0155 -0.0788 293 -2.3279 -0.0079 -0.0203 298 -0.0683 -0.0002 -0.0000 303 2.2261 0.0074 -0.0180 308 4.5554 0.0150 -0.0741 313 6.9191 0.0226 -0.1683 318 9.3161 0.0302 -0.3005 323 11.7446 0.0378 -0.4706 328 14.2022 0.0454 -0.6786 333 16.6859 0.0529 -0.9242 338 19.1920 0.0604 -1.2074 343 21.7163 0.0678 -1.5277 348 24.2538 0.0751 -1.8849 353 26.7990 0.0824 -2.2787 2.4 Co(C4H2N14) 4H2O的热安全性
2.4.1 自加速分解温度(TSADT)
自加速分解温度(TSADT)是[23, 27]将不同升温速率下所的到的Te,Tp值代入到式(5) 中,计算β→0时的峰温Te0和Tp0:
式中,n和m为常数。根据TSADT=Te0,可以得到TSADT和Tp0。最后得出TSADT=509.69 K,Tp0=539.45 K。
2.4.2 热爆炸临界温度(Tb)和热点火温度(TTIT)
式中,当Eo取Ep0,T取Tp0时计算得到热爆炸临界温度Tb;当Eo取Ee0,T取Te0时即可得到热点火温度TTIT。
将上述由Ozawa法得到的Ee0、Ep0和Te0、Tp0代入方程(6) 中,计算得到BTATz钴盐的Tb和TTIT分别为556.31和524.93 K。
2.4.3 绝热至爆时间(tTIAD)
绝热至爆时间是评价含能物质热稳定性和热安全性的重要参数指标[28-29],其值可根据热分析方法所计算得到的热动力学参数值及比热容方程进行估算。计算原理如式(7)~(9) 所示。
将Cp=11.36-0.10T+3.72×10-4T2-4.11×10-7T3,E=EK=151.12×103 J/mol,A=AK=1011.95 s-1,Q=ΔHd=1134.50 J/g,T=Tb=556.31 K,T0=Te0=509.69 K,f(α)=(1-α)2代入以上公式,求得绝热至爆时间tTIAD=88.40 s。
3 结论
合成了一种新的s-四嗪含能金属盐——BTATz的钴盐Co(C4H2N14)·4H2O。采用DSC和TG/DTG方法对其进行了热分解行为和热分解动力学研究。结果表明,该含能金属盐的热分解过程包含一个吸热阶段和一个放热阶段,采用非等温法获得了放热阶段的热分解反应机理方程为dα/dt=1011.88×(1-α)2exp(-1.51×105/RT)。计算了自加速分解温度、热爆炸临界温度、热点火温度及绝热至爆时间分别为509.69 K、556.31 K、524.93 K和88.40 s。从绝热至爆时间的大小可知,BTATz的钴盐的热安全性优于相应的Ca盐(52.98 s)[30]、Mg盐(45.42 s)[11]和Sr盐(71.93 s)[12]。从放热量来说,该钴盐在4个升温速率下放热量的平均值为1134.50 J/g(表 1) 略高于其配体BTATz(1101 J/g)。而BTATz作为燃烧催化剂已用于双基/改性双基推进剂中,并且显示了良好的催化性能[17]。由此推断标题化合物有望成为良好的燃烧催化剂。
-
-
[1]
薛金强, 尚丙坤, 王伟. 四嗪类高氮分子及离子含能化合物的研究进展[J]. 化学推进剂与高分子材料, 2011,9,(4): 91-99. XUE Jinqiang, SHANG Bingkun, WANG Wei. Research Advances in Tetrazine-based High-nitrogen Molecular and Ionic Energetic Compounds[J]. Chem Propellants Polym Mater, 2011, 9(4): 91-99.
-
[2]
Hickey M A, Chavez D E, Naud D. Preparation of 3, 3'-Azobis(6-amino-1, 2, 4, 5-tetrazine):US Patent, 6342589[P], 2002.
-
[3]
Hickey M A, Chavez D E, Naud D. 3, 6-Bis(1H-1, 2, 3, 4-Tetrazol-5-ylamino)-1, 2, 4, 5-Tetrazine or Salt Thereof:US Patent, 6657059[P], 2003.
-
[4]
岳守体, 阳世清. 3, 6-双(1-氢-1, 2, 3, 4-四唑-5-氨基)-1, 2, 4, 5-四嗪的合成及其性能[J]. 含能材料, 2004,12,(3): 155-157. YUE Shouti, YANG Shiqing. Synthesis and Properties of 3, 6-Bis(1H-1, 2, 3, 4-tetrazol-5-yl amino)-1, 2, 4, 5-tetrazine[J]. Chinese J Energ Mater, 2004, 12(3): 155-157.
-
[5]
王伯周, 来蔚鹏, 刘愆. 3, 6-双(1H-1, 2, 3, 4-四唑-5-氨基)-1, 2, 4, 5-四嗪的合成、表征及量子化学研究[J]. 有机化学, 2008,28,(3): 422-428. WANG Bozhou, LAI Weipeng, LIU Qian. Synthesis, Characterization and Quantum Chemistry Study on 3, 6-Bis(1H-1, 2, 3, 4-tetrazol-5-yl-amino)-1, 2, 4, 5-tetrazine[J]. Chinese J Org Chem, 2008, 28(3): 422-428.
-
[6]
Saikia A, Sivabalan R, Polke B G. Burn Rate Measurements of HMX, TATB, DHT, DAAF, and BTATz[J]. J Hazard Mater, 2009, 170(1): 306-311. doi: 10.1016/j.jhazmat.2009.04.095
-
[7]
张兴高, 朱慧, 阳世清. 富氮高能物质BTATz的热分解动力学和分解机理[J]. 推进技术, 2007,8,(3): 322-326. ZHANG Xinggao, ZHU Hui, YANG Shiqing. Study on Thermal Decomposition Kinetics and Mechanism of Nitrogen-rich Compound BTATz[J]. J Propul Technol, 2007, 8(3): 322-326.
-
[8]
Chavez D E, Hiskey M A, Naud D L. Tetrazine Exposives[J]. Propellants Explos Pyrotech, 2004, 29(4): 209-215. doi: 10.1002/(ISSN)1521-4087
-
[9]
Son S F, Berghout H L, Bolme C A. Burn Rate Measurements of HMX, TATB, DHT, DAAF, and BTATz[J]. Ptoc Combust Inst, 2000, 28(1): 919-924. doi: 10.1016/S0082-0784(00)80298-2
-
[10]
Li N, Zhao F Q, Luo Y. Dissolution Properties of 3, 6-Bis(1H-1, 2, 3, 4-tetrazol-5-ylamino)-1, 2, 4, 5-tetrazine in N-Methyl Pyrrolidone and Dimethyl Sulfoxide[J]. J Solution Chem, 2014, 43(7): 1250-1258. doi: 10.1007/s10953-014-0198-8
-
[11]
Zhang X B, Ren Y H, Li W. A Novel Magnesium Salt Based on BTATz:Crystal Structure, Thermal Behavior and Thermal Safety[J]. Chem Res Chinese Univ, 2013, 29(4): 627-631. doi: 10.1007/s40242-013-2350-1
-
[12]
Zhang X B, Ren Y H, Li W. 3, 6-Bis(1H-1, 2, 3, 4-tetrazol-5-yl-amino)-1, 2, 4, 5-Tetrazine-Based Energetic Strontium(Ⅱ) Complexes:Synthesis, Crystal Structure and Thermal Properties[J]. J Coord Chem, 2013, 66(12): 2051-2064. doi: 10.1080/00958972.2013.796040
-
[13]
任莹辉, 赵凤起, 仪建华, 等. BTATz含能金属配合物及其制备方法: 中国, 201110149420. 2[P], 2011.REN Yinghui, ZHAO Fengqi, YI Jianhua, et al. Energetic Metal Complexes of BTATz and Its Method of Preparation:CN, 201110149420.2[P], 2011(in Chinese).
-
[14]
李文, 任莹辉, 赵凤起. 高氮含能化合物BTATz(BTATz=3, 6-双(1-氢-1, 2, 3, 4-四唑-5-氨基)-1, 2, 4, 5-四嗪)锌盐的合成及热分解特性[J]. 功能材料, 2013,44,(22): 3326-3329. doi: 10.3969/j.issn.1001-9731.2013.22.026LI Wen, REN Yinghui, ZHAO Fengqi. Nitrogen-rich Energetic Zinc Salt on BTATz:Syntheses and Thermodynamic[J]. J Funct Mater, 2013, 44(22): 3326-3329. doi: 10.3969/j.issn.1001-9731.2013.22.026
-
[15]
李文, 任莹辉, 赵凤起. BTATz-Pb复合物对双基和RDX-改性双基推进剂的热行为、非等温动力学及燃烧性能的影响[J]. 物理化学学报, 2013,29,(10): 2087-2094. doi: 10.3866/PKU.WHXB201308301LI Wen, REN Yinghui, ZHAO Fengqi. Effects of Lead Complex-Based BTATz on Thermal Behaviors, Non-Isothermal Reaction Kinetics and Combustion Properties of DB/RDX-CMDB Propellants[J]. Acta Phys Chim Sin, 2013, 29(10): 2087-2094. doi: 10.3866/PKU.WHXB201308301
-
[16]
任莹辉, 李文, 张鲜波. 3, 6-双(1-氢-1, 2, 3, 4-四唑-5-氨基)-1, 2, 4, 5-四嗪银盐的热分解反应动力学及热安全性[J]. 应用化学, 2013,30,(9): 1036-1041. REN Yinghui, LI Wen, ZHANG Xianbo. Nonisothermal Decomposition Kinetics and Thermal Safety of Ag2(BTATz)·2H2O(BTATz=3, 6-Bis(1-H-1, 2, 3, 4-Tetrazole-5-Amino)-1, 2, 4, 5-Tetrazine)[J]. Chinese J Appl Chem, 2013, 30(9): 1036-1041.
-
[17]
Yi J H, Zhang F Q, Wang B Z. Thermal Behaviors, Non-isothermal Decomposition Reaction Kinetics, Thermal Safety and Burning Rates of BTATz-CMDB Propellant[J]. J Hazard Mater, 2010, 181(3): 432-439.
-
[18]
Yi J H, Zhao F Q, Wang B Z. BTATz-HNIW-CMDB Propellants Decomposition Reaction Kinetics and Thermal Safety[J]. J Therm Anal Calorim, 2014, 115(2): 1227-1234. doi: 10.1007/s10973-013-3400-0
-
[19]
张超. 新型高燃速组分BTATz衍生物的合成、表征及特性研究[D]. 西安: 西北大学化工学院, 2012.ZHANG Chao. Study on New High Burning Rate Component-Derivatives of BTATz:Synthesis, Characterization and Properties[D]. Xi'an:School of Chemical Engineering, Northwest University 2012(in Chinese).
-
[20]
徐抗震, 宋纪蓉, 赵凤起. 1, 1-二氨基-2, 2-二硝基乙烯的比热容、热力学性质及绝热至爆时间研究[J]. 化学学报, 2007,65,(25): 2827-2831. XU Kangzhen, SONG Jirong, ZHAO Fengqi. Special Heat Capacity, Thermodynamic Properties and Adiabatic Time-to-Explosion of 1, 1-Diamino-2, 2-dinitroethylene[J]. Acta Chim Sin, 2007, 65(25): 2827-2831.
-
[21]
Kissinger H E. Reaction Kinetics in Differential Thermal Analysis[J]. Anal Chem, 1957, 29(11): 1702-1706. doi: 10.1021/ac60131a045
-
[22]
Ozawa T B. A New Method of Analyzing Thermogravimatric Data[J]. Bull Chem Soc Jpn, 1965, 38(11): 1881-1886. doi: 10.1246/bcsj.38.1881
-
[23]
胡荣祖, 史启祯.热分析动力学[M].北京:科学出版社, 2001.HU Rongzu, SHI Qizhen. Thermal Analysis Kinetics[M]. Beijing:SciencePress, 2001(in Chinese).
-
[24]
李丹. 高氮有机金属配合物和含能离子化合物的合成、结构、热力学性质及量子化学研究[D]. 西安: 西北大学化工学院, 2010.LI Dan. High Nitrogen Organic Metal Complexes and Energetic Ionic Compounds:Synthesis, Structure, Thermodynamic Properties and Theoretical Calculation[D]. Xi'an:School of Chemical Engineering, Northwest University, 2010(in Chinese).
-
[25]
Ren Y H, Yi J H, Zhao F Q. Synthesis, Decomposition Reaction Kinetics and Thermal Safety of Bismuth Complex of Picric Acid[J]. Chinese J Explos Propellants, 2011, 33(5): 19-24.
-
[26]
黄华江.实用化工计算机模拟-MATLAB在化学工程中的应用[M].北京:化学工业出版社, 2004.HUANG Huajiang. Practical Computer Simulation of Chemical Processes-MATLAB's Application in Chemical Engineering[M]. Beijing:Chemical Industry Press, 2004(in Chinese).
-
[27]
Hu R Z, Gao H X, Zhao F Q. Estimation of Critical Temperature of Thermal Explosion for Some Furazano-fused Cyclic Compouds Using Non-isothermal DSC[J]. Chinese J Energ Mater, 2009, 17(6): 635-642.
-
[28]
王耘, 冯长根, 郑娆. 含能材料热安全性的预测方法[J]. 含能材料, 2000,8,(3): 119-121. WANG Yun, FENG Changgen, ZHENG Rao. Prediction of Thermal Safety of Energetic Materials[J]. Chinese J Energy Mater, 2000, 8(3): 119-121.
-
[29]
胡荣祖, 高红旭, 赵凤起. 1, 1'-二甲基-5, 5'-偶氮四唑-水合物和2, 2'-二甲基-5, 5'-偶氮四唑的热安全性[J]. 含能材料, 2011,19,(2): 126-131. HU Rongzu, GAO Hongxu, ZHAO Fengqi. Thermal Safety of 1, 1'-Dimethyl -5, 5'-azotetrazole and 2, 2'-Dimethyl-5, 5'-azotetrazole[J]. Chinese J Energy Mater, 2011, 19(2): 126-131.
-
[30]
张鲜波. 高氮四嗪BTATz金属盐/配合物的合成、晶体结构、热分解特性及性能研究[D]. 西安: 西北大学化工学院, 2013.ZHANG Xianbo. Synthesis, Crystal Structure, Thermal Properties and Performance of High Nitrogen Tetrazine BTATz Metal Salts/Complexes[D]. Xi'an:School of Chemical Engineering, Northwest University, 2013(in Chinese).
-
[1]
-
表 1 由不同升温速率下的DSC曲线得到的参数值
Table 1. The parameters determined by DSC curves at different heating rates
β/(K·min-1) 5 10 15 20 Te/K 519.75 526.15 535.35 538.85 Tp/K 553.35 564.55 571.85 576.25 ΔH/(J·g-1) 1067 1152 1230 1089 ΔHmean=(1067+1152+1230+1089)/4=1134.50 J/g. 表 2 不同升温速率下由DSC曲线得到的热分解数据
Table 2. Thermal decomposition data determined by DSC curves at different heating rates
α T5/K T10/K T15/K T20/K 0.02 512.73 515.28 525.81 529.28 0.04 517.66 520.79 531.10 534.48 0.06 521.37 524.99 535.11 538.41 0.08 524.46 528.40 538.43 541.69 0.10 527.13 531.47 541.35 544.57 0.12 529.52 534.08 543.97 547.09 0.14 531.69 536.49 546.31 549.41 0.16 533.77 538.80 548.51 551.54 0.18 535.56 540.81 550.56 553.58 0.20 537.35 542.83 552.46 555.42 0.22 539.05 544.74 554.32 557.26 0.24 540.66 546.48 556.03 558.98 0.26 542.17 548.15 557.75 560.59 0.28 543.68 549.83 559.39 562.21 0.30 545.12 551.44 560.95 563.76 0.32 546.51 552.98 562.51 565.24 0.34 547.89 554.49 564.00 566.73 0.36 549.28 555.93 565.49 568.15 0.38 550.60 557.40 566.98 569.57 0.40 551.89 558.81 568.47 570.93 0.42 553.18 560.28 569.89 572.29 0.44 554.50 561.69 571.30 573.71 0.46 555.75 563.03 572.79 575.07 0.48 557.01 564.44 574.21 576.42 0.50 558.33 565.85 575.62 577.78 0.52 559.59 567.25 577.11 579.14 0.54 560.91 568.66 578.55 580.49 0.56 562.23 570.07 580.05 581.88 0.58 563.55 571.48 581.58 583.27 0.60 564.91 572.95 583.15 584.69 0.62 566.26 574.42 584.71 586.18 0.64 567.71 575. 90 586.35 587.67 0.66 569.15 577.51 587.99 589.15 0.68 570.66 579.05 589.77 590.70 0.70 572.17 580.72 591.56 592.35 0.72 573.78 582.43 593.46 594.00 0.74 575.48 584.24 595.43 595.74 0.76 577.17 586.05 597.48 597.59 0.78 579.06 588.06 599.72 599.52 0.80 581.04 590.07 602.06 601.56 0.82 583.11 592.29 604.63 603.69 0.84 585.38 594.70 607.31 606.02 0.86 587.84 597.21 610.33 608.54 0.88 590.57 600.03 613.68 611.25 0.90 593.69 603.24 617.48 614.35 0.92 597.08 606.86 621.73 617.84 0.94 601.23 611.08 626.87 621.91 0.96 606.42 616.21 633.23 626.95 0.98 613.60 623.45 642.40 633.84 1.00 629.73 639.43 664.85 649.35 Note:T with the subscript of 5, 10, 15 and 20 is the temperature obtained at the heating rate of 5.0, 10.0, 15.0 and 20.0 K/min, respectively. 表 3 主要热分解阶段的动力学参数计算值
Table 3. Calculated values of the main stage of thermal decomposition kinetic parameters
Method β/(K·min-1) Ea/(kJ·mol-1) lg (A/(s-1)) r General integral 5 153.37 12.07 0.9999 10 144.42 11.32 0.9999 15 147.81 11.58 0.9999 20 154.83 12.30 0.9999 Mac Callum-Tanner 5 154.99 12.18 0.9999 10 146.07 11.43 0.9999 15 149.65 11.71 0.9999 20 156.77 12.44 0.9999 atava-Šesták 5 154.51 12.17 0.9999 10 146.10 11.48 0.9999 15 149.48 11.73 0.9999 20 156.20 12.42 0.9999 Agrawal 5 153.37 12.07 0.9999 10 144.42 11.32 0.9999 15 147.81 11.57 0.9999 20 154.53 12.29 0.9999 Mean 150.90 11.88 Flynn-Wall-Ozawa 152.65 0.9997 150.29(Te) 0.9965 Kissinger 151.12 11.95 0.9997 表 4 Co(C4H2N14)·4H2O的热力学函数
Table 4. Themodynamic functions of Co(C4H2N14)·4H2O
T/K HT-H298.15/(kJ·mol-1) ST-S298.15/(kJ·mol-1·K-1) GT-G298.15/(kJ·mol-1) 283 -6.7465 -0.0232 -0.1757 288 -4.5536 -0.0155 -0.0788 293 -2.3279 -0.0079 -0.0203 298 -0.0683 -0.0002 -0.0000 303 2.2261 0.0074 -0.0180 308 4.5554 0.0150 -0.0741 313 6.9191 0.0226 -0.1683 318 9.3161 0.0302 -0.3005 323 11.7446 0.0378 -0.4706 328 14.2022 0.0454 -0.6786 333 16.6859 0.0529 -0.9242 338 19.1920 0.0604 -1.2074 343 21.7163 0.0678 -1.5277 348 24.2538 0.0751 -1.8849 353 26.7990 0.0824 -2.2787 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1758
- HTML全文浏览量: 232


 下载:
下载:



 下载:
下载:

