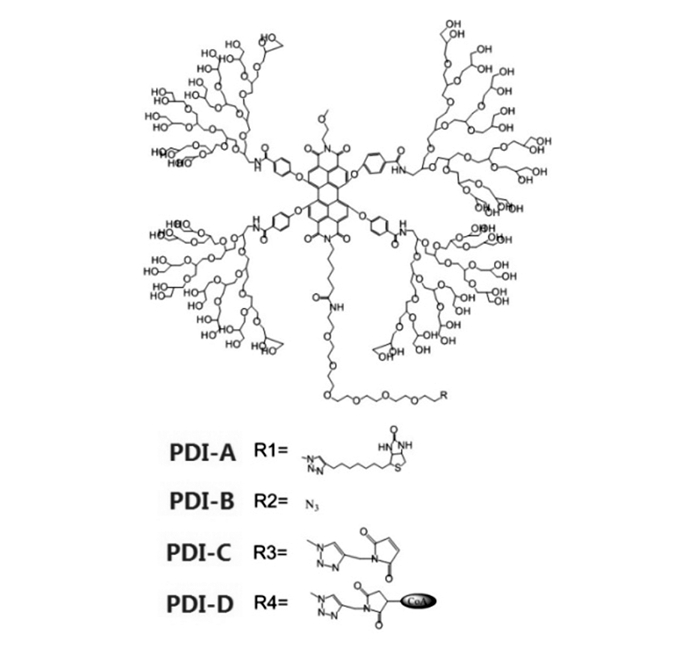
 图 1
PDI衍生物的相关结构示意图[15]
Figure 1.
Structures of the PDI derivatives[15]
图 1
PDI衍生物的相关结构示意图[15]
Figure 1.
Structures of the PDI derivatives[15]

Citation: LI Xiang, JIN Yingying, LIU Yibo, ZHAO Zhen, LI Xiao, CHENG Fang, LIU Zhonghua, HUANG Yongwei. Application and Progress of Perylenediimides Derivatives in Treating Tumor[J]. Chinese Journal of Applied Chemistry, 2017, 34(6): 611-622. doi: 10.11944/j.issn.1000-0518.2017.06.160356

苝酰亚胺衍生物在肿瘤治疗中的应用进展
English
Application and Progress of Perylenediimides Derivatives in Treating Tumor
-
Key words:
- tumor
- / perylenediimides
- / nanocarriers
- / fluorescence image
-
20世纪70年代以来,全世界癌症的发病率和死亡率一直呈上升趋势。2012年,统计数据表明世界各地新增约1410万癌症病例和820万因癌症死亡病例。其中不发达国家的癌症患病率和死亡率分别占全球病例的57%和65%[1]。分析我国72个癌症登记处的数据(2009年~2011年)(占6.5%的人口),结果显示每年新发癌症病例和因癌症死亡病例分别为429.2万人和281.4万人[2]。癌症已成为人类因重大疾病死亡的主要因素,而肿瘤治疗尚在进一步探索中。肿瘤治疗方法包括手术切除、放疗、化疗以及新近出现的免疫治疗,如嵌合抗原受体T细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy, CAR-T)等。化疗在一定程度上延长了肿瘤患者生存时间,特别是早期肿瘤的患者通过传统手术和辅助化疗,可实现肿瘤相对根治。但化疗药物均存在毒副作用,如阿霉素有强烈的心脏毒性[3]、顺铂化疗时对肾脏有毒性[4]、环磷酰胺对骨髓有强烈抑制作用[5]、长春新碱可损伤神经系统[6]等。抗肿瘤药物的毒副作用给病人机体和心理造成了巨大伤害,也额外增加了不必要的治疗并发症的花费。因此,开发新型的治疗手段和技术,如纳米材料抗肿瘤药物[7-9]、肿瘤干细胞靶向治疗[10]等具有重要现实意义。新型抗肿瘤药物的开发需要对肿瘤及其微环境深入了解。肿瘤细胞学的研究指出:肿瘤是由肿瘤细胞及其周围基质细胞和非细胞组分构成的复合体,肿瘤微环境在肿瘤的生长与转移过程中发挥至关重要的作用。肿瘤微环境以及肿瘤细胞生物学特性共同决定肿瘤的十大特征:自给自足的生长信号、抗生长信号的不敏感、抵抗细胞死亡、增殖能力强、血管生成增多、组织浸润和转移、逃避免疫监视、促进肿瘤的炎症、细胞能量代谢异常、基因组不稳定和突变[11]。越来越多的研究致力于靶向调控肿瘤细胞及其微环境,并以此开发相应的诊断试剂和治疗药物。如临床经常应用定点靶向的药物-利妥昔单抗,该抗体虽有较好的肿瘤杀伤率,但是因为生物稳定性相对较差,其副作用很大,易产生耐药性且价格昂贵。传统药物选择性差,肿瘤杀伤率低,通过纳米材料技术可开发具有靶向识别能力的药物载体,实现肿瘤早期诊断、早期定位以及早期治疗及靶向治疗等[12]。目前,国内外许多研究机构针对纳米材料应用于肿瘤治疗而开展了许多研究工作。设计新型靶向性、控释性能优异的纳米载体[13],是目前抗肿瘤药物研究人员的关注重点之一。
苝酰亚胺衍生物(Perylenediimides Derivatives, PDI)荧光性能好、荧光强度高、稳定性强、生物兼容性优异,可应用于生物荧光成像[14]。有机溶液中,PDI表现出较强的光化学稳定性,参与机体中分子代谢监测生物进程,具有作为示踪剂的潜能[15]。利用PDI荧光的高选择性和敏感性,实现细胞代谢活动进程的可视化,是当前生物医学发展的新方向之一[16]。因PDI在水溶剂中的溶解性较低,其在生物成像和药物载体方面应用受到限制,可在酰胺氮原子或苝湾上引入亲水基团,提高水溶性,改善其荧光性能、载药能力及生物兼容性。目前,对油溶性PDI的修饰方式有酰胺氮原子和苝湾取代两种方式。相比于酰胺氮原子取代基团,苝湾取代基团可对PDI的性能产生较大影响。研究表明在PDI苝湾引入特定基团,可使PDI表现出不同生物化学作用,如PDI-A(图 1)可特异定位于细胞表面结合蛋白。PDI-D(图 1)在多种酶参与下,表现出独特荧光特性。在苝湾引入基团后(图 1 PDI-B、PDI-C)PDI荧光成像的效率显著提高[15]。具有荧光的药物载体,在抗肿瘤药物开发和治疗过程中可借荧光更有效监测在体内的动态代谢过程[17-21]。
近年来,我们课题组对手性苝酰亚胺衍生物的超分子自组装行为有着浓厚研究兴趣,围绕手性苝酰亚胺衍生物开展了系列研究工作。2009年,我们曾通过离子自组装方法获得含磷酸酯的手性苝酰亚胺衍生物并对其组装行为进行了详细研究[22]。以此为基础,我们首次将亲水性葡萄糖苷引入苝酰亚胺衍生物,制备了一类新型双亲性手性苝酰亚胺衍生物,详细研究了溶剂种类对其自组装行为和组装体形态的影响[23]。随后,我们进一步研究了两侧酰胺N原子均含有葡萄糖苷的手性苝酰亚胺衍生物在DMF-H2O(N, N-Dimethylformamide,DMF)溶液体系中超分子自组装行为[24]。此外,我们还开展取代基团对手性苝酰亚胺衍生物自组装行为的研究。结果表明,酰胺N原子上烷基链长度和苝湾处取代基团对相应手性苝酰亚胺衍生物的自组装行为、组装体形态及气敏传感性能都有显著影响[25-26]。目前,我们课题组致力于含有α-吡喃糖的PDI的研究,对细胞进行转染,结果表明,链接α-吡喃糖的PDI对GLUT3(Glucose transporter 3) 高表达细胞具有一定的选择性成像能力。此外,国内许多课题组还开展PDI在生物医学其他方面的应用研究,如借光声成像敏感性检测深层组织、作为药物载体改善用药环境和治疗效果、借其荧光性能可在活体动物中作为荧光示踪剂等[27]。本文综述了PDI在肿瘤治疗中的应用进展,从药物载体、抗肿瘤药物、及荧光示踪剂三方面分别进行阐述。
1 PDI载体
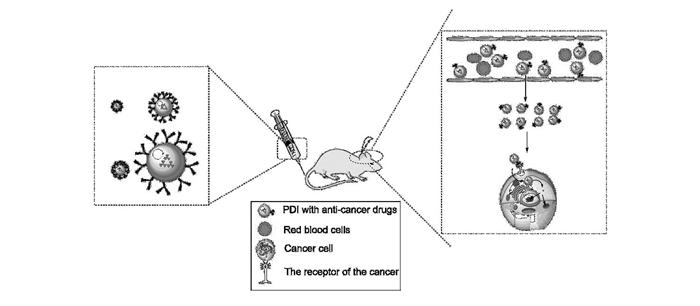
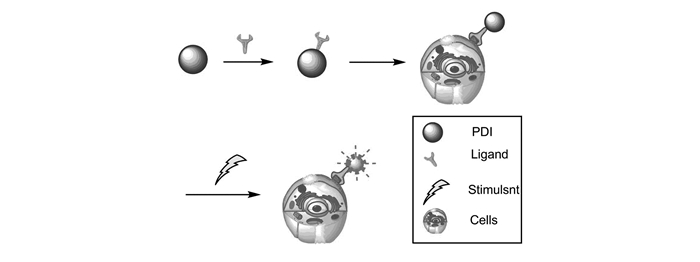
PDI是一种优良的药物载体[28-30],可自组装成纳米颗粒装载药物,再引入特定基团(如:聚乙二醇(PEG)等),将药物运载到相应的病变部位,然后通过体内或体外刺激实现定点释放(图 2),提高局部药物浓度,增强抗肿瘤效果[31-32]。还可通过PDI本身的荧光对药物实时监控。因PDI的保护作用,防止药物在循环系统中提前释放或被网状内皮系统系统捕获。最近尹梅贞课题组提出,以苝酰亚胺为核心,外周带有大量胺官能团的核-壳星状和树枝状聚合物(FNP)[33],将该类载体(FNP)与dsRNA混合于饲料中投喂给亚洲玉米螟虫幼虫,检测发现,FNP/CHT10-dsRNA能够快速穿透围食膜进入肠细胞抑制几丁质酶CHT10的表达,导致害虫发育停滞,不能脱皮,直至死亡[34]。
1.1 PDI药物载体
利用PDI作为药物纳米载体投递药物具有以下优势:循环时间长;载药量大;稳定性高;可靶向投递等[35]。相比于传统药物,PDI因其低毒性和低免疫原性,具有良好的生物兼容性。与单独药物相比,PDI装载少量的药物便可取得较好治疗效果。有研究表明,在鼠的异种移植模型中,以PDI为载体投递顺铂与单纯使用顺铂相比,前者可增强药物在体内运输与靶向能力,抑制癌细胞生长作用明显提高。但应用于临床还需解决如下问题:PDI在生理环境下可能会对人体产生一定的毒副作用;在复合物到达病灶之前,药物易漏出;靶向运输药物的能力尚待增强等[36],PDI药物载体的临床应用仍需进一步探索研究。
1.2 PDI基因载体
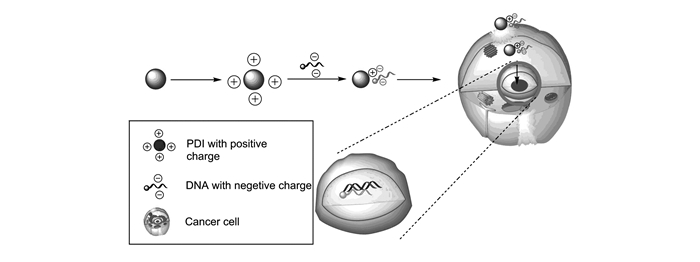
基因治疗是将有治疗作用的目的基因转运至病变细胞,作用于其DNA/RNA,调控特定蛋白的表达,从而在分子水平上治疗疾病[37]。如果仅将寡核苷酸或者DNA片段注入到人体血浆中,机体免疫系统会将其作为外来异物清除[38]。设计能运载DNA同时保护其免遭机体防御系统破坏的新型基因载体尤为重要[39]。目前基因载体分为两类:第一种是病毒载体,转染率较高,但存在储存困难、载药量小等缺陷。另外,病毒可能对人体存在着潜在威胁,导致其难以应用于临床[40];第二种是非病毒载体,目前应用研究较多的有阳离子脂质体[41-45]、阳离子聚合物[46-49]等。为探索PDI穿透细胞的能力,有研究以拟南芥为实验植物,在植物中进行DNA转运,通过荧光显微镜观察表明PDI可以穿过植物细胞壁并能将DNA运输进植物的细胞[15]。尹梅贞课题组[50]成功合成以PDI为核心的阳离子共聚物,作为载体运输基因药物。该课题组还将PDI修饰成带有正电荷的分子,通过静电作用与负电荷的DNA相互结合,复合体具有较好的稳定性,并成功将DNA投递至动物细胞中[50]。在荧光显微镜下观察发现:PDI-DNA复合体成功进入动物细胞中,其细胞转染率保持在90%以上[15];以PDI连接DNA靶向定位细胞核,可破坏肿瘤细胞DNA的结构,抑制其增殖[51]。另外,通过RNA干扰技术特异性降解信使RNA抑制相关蛋白质的表达,达到抑制肿瘤增殖的目的;利用PDI药物载体特性,可高效运载siRNA进入靶细胞[52]。
2 PDI抗肿瘤药物
因肿瘤细胞DNA发生突变,肿瘤的生长增殖不受机体正常调控机制的控制。除通过上述途径发挥抗肿瘤作用外,也可引入特定基团修饰PDI使其成为抗肿瘤药物,直接抑制肿瘤细胞增殖。目前,PDI抗肿瘤药物通过内吞作用等进入肿瘤细胞并破坏其DNA,达到杀伤肿瘤细胞的目的。
2.1 PDI本身作为肿瘤药物
PDI抑制肿瘤细胞生长机理主要为:第一,癌细胞有较强增殖能力,DNA转录复制频率较高。在此过程中,PDI易嵌插入肿瘤DNA中,在肿瘤细胞中大量地累积,从而控制肿瘤细胞的增殖(图 3)。对于非肿瘤组织,PDI则毒性较低,对机体的副作用较低。第二,PDI可结合特定的DNA片段,使其变性,破坏其正常功能,抑制和杀伤癌细胞[15]。第三,PDI可通过减弱端粒酶活性、靶向G-四链体,遏制肿瘤细胞增殖[53];有研究报道,在苝湾上连接特定基团可与细胞中的G-四链体结合,破坏肿瘤细胞的DNA[54]。第四,PDI具有紧密的平面芳香体结构,与人体DNA有结构相似性,可嵌入到人体DNA中模拟DNA骨架,但不具有DNA复制转录功能,通过此可抑制肿瘤细胞的基因表达,抑制癌细胞增殖[55-58]。嵌插入DNA双链结构中的PDI通过氧化或光诱导使DNA裂解,抑制肿瘤细胞的增殖:① 氧化DNA:PDI可以结合在DNA双螺旋结构的沟槽中,使药物与DNA之间发生氧化还原反应,进而破坏DNA的结构,或者改变DNA赖以生存的酶动力学环境,使其性质发生变化[59];② 光诱导DNA裂解:PDI直接插入进两个碱基对之间,与DNA形成共轭作用。PDI是一种稠环体系,其还原产物与DNA结合后,借助光诱导可使DNA裂解;③ 温度诱导:温度升高能够增强PDI分子间π-π相互作用,致使聚合物折叠成有序的状态[60]。PDI插入到DNA中并形成聚合物后,温度上升,聚合物排列整齐有序;温度下降,聚合物排列又杂乱无序。通过温度变化,可刺激DNA序列变化、破坏DNA稳定性使之裂解。
2.2 PDI复合物抗肿瘤作用
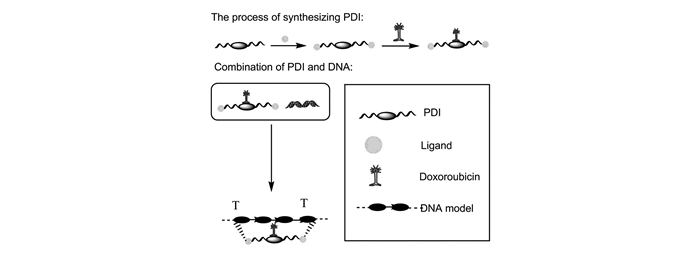
2.2.1 PDI-DOX复合物
PDI-DOX复合物中的PDI可与人染色体的G-四链体DNA相互结合,利用阿霉素(DOX)对肿瘤进行抑制(图 4)。在临床上,常用的联合药物还有1, 8-萘二甲酰胺、吖啶、氨萘非特等药物,通过利用它们能嵌合到DNA双螺旋中的特性抑制DNA转录和复制,控制肿瘤细胞的生长[61-63]。有研究通过竞争性透析实验,证明PDI与DOX之间有互相吸引并结合的趋势。研究结果显示当增加PDI浓度时,DOX生物稳定性显著增加且PDI与DOX之间连接更加稳固。以PDI作为中间体,在DOX上堆叠,依靠环状结构连接胸腺嘧啶,将DOX嵌合到DNA的凹槽内(图 4)[64]。其可稳定G-四链体,抑制端粒酶的活性[65-68],从而减少肿瘤细胞寿命,以PDI-DOX作为高效的肿瘤杀伤药物具有很好应用前景。
2.2.2 PDI-喜树碱复合物
尹梅贞课题组将喜树碱加载于PDI纳米载药胶束进行靶向肿瘤病灶的研究。利用水溶性PDI(PDI-star-(PLA-b-PEEP)8)上聚乳酸的亲油性及聚磷脂的亲水性,共聚物可自组装成60 nm的胶束并包裹药物。与正常组织细胞进行MTT实验,细胞增值率未受明显影响,PDI-star-(PLA-b-PEEP)8纳米胶束具有良好的生物兼容性。采用流式细胞(FACS)和激光扫描共焦显微镜(CLSM)分析表明,纳米胶束进入细胞能力较强。结果证明,将喜树碱与胶束装载的喜树碱作用于不同的肿瘤细胞(肝癌细胞、乳腺癌细胞、宫颈癌细胞),后者对肿瘤细胞的抑制作用更为明显[69]。这也预示着PDI胶束药物在癌症治疗和生物成像领域具有较大应用潜力[70]。以生理盐水作为对照组,对比生理盐水、荧光超分子胶束、游离喜树碱、与荧光超分子胶束-喜树碱复合物组的抗肿瘤作用,裸鼠体内实验结果显示,4组小鼠的体重变化不大,抗肿瘤效果最优异的是荧光超分子胶束-喜树碱共聚物组。这表明荧光超分子胶束生物兼容性好,对肿瘤细胞具有特异性抑制作用[70]。
3 PDI荧光示踪剂
3.1 体内荧光显像
在有机体中,有很多生物反应均是基于糖-蛋白反应[71-73],在维持机体内环境稳定方面起着重要作用,广泛参与机体的生物进程[74-76],如细胞生长、变异、增殖、营养、代谢以及对细菌病毒的炎症反应和免疫应答等[77-80]。在细胞外基质和细胞膜的表面存在负电荷:1) 负电荷的存在与细胞稳定性、接触抑制等密切相关:同时物质在细胞内外转运也受到细胞表面电荷与其本身浓度的共同作用。2) 负电荷可协助遗传物质的储存:负电荷的DNA与带正电荷的组蛋白通过静电吸附形成稳定的共聚物,保证遗传物质能在细胞中稳定地储存。在生理环境中,带正电的荧光分子可以与带负电的细胞基质互相吸引结合[81-82],进而实现机体中细胞的荧光成像。但PDI难溶于水,因分子间较强的π-π相互作用,易发生聚集,导致其荧光性能的淬灭[83]。为增加PDI水溶性,可于苝酰亚胺的侧链上引入亲水基团,如季铵盐、硫酸根、阴离子羧酸根[34]、磷酸根等;或引入连接非离子基团,如PEG[84]、碳水化合物[85]等。通过上述方式,可增加PDI的水溶性,改善其荧光性能。
为验证其荧光性能的变化与应用,Li课题组[86]实验结果显示,PDI可以与小鼠巨噬细胞表面的荧光聚合物受体结合,表明PDI可用于生物荧光成像和生物传感器。另外Petkau K等[87]的研究表明,在多价糖蛋白与某些凝集素结合后,能使得荧光淬灭或荧光增强,这种反应性荧光强度的变化为PDI应用于活细胞成像与分析提供了实验依据[88]。
3.2 体外荧光显像
经修饰带有阳离子的PDI荧光成像能力较强(图 6),其可与细胞膜表面生物分子结合呈现特异性荧光成像[89-90],且其对刺激反应敏感,可作为研究生物体的特异探针[91]。有研究将DNA与PDI通过特定的生物基团连接后,亲水的DNA减少了PDI的聚集,保护其优异的荧光性能,这种结合增加水溶性[33, 92],减少PDI聚集,增强其荧光性能[93]。Rong等[94]将生物素连接到苝酰亚胺的苝湾上形成功能化PDI,通过调控自组装形态变化实现荧光的“开关”功能:1) 当PDI凝聚时,荧光淬灭。2) 带有靶向性蛋白选择性地结合PDI,可使PDI解聚,荧光出现。PDI也可以和金属离子结合,作为金属离子探针。Lan小组[95-99]设计的带有四氮杂环基团的PDI不仅可以选择性的与Pb+结合,并且出现荧光增强,其还可以渗透细胞膜,应用于生物细胞成像等方面。
3.2.2 PEG介导荧光成像
尹梅贞等研究带负电荷可溶性PDI可与带正电荷的核蛋白结合,实现特异性配体标记功能。水溶性聚糖PDI可以作为细胞膜标记物[105]。以PDI为核心,外层修饰共聚物或阳离子基团的PDI复合物可迅速地进入活细胞中,分子的相对分子质量、形状以及其上修饰的阳离子基团是PDI细胞内化和转染效率较高的主要因素。引入聚乙二醇基团,因PDI可以通过特定基团与PEG表面连接,解聚使得荧光增强[106]。将PEG与PDI连接,可使PDI具有水溶性及长时循环的特点,可在细胞、组织甚至机体中成像。
3.2.1 甘露糖介导荧光成像
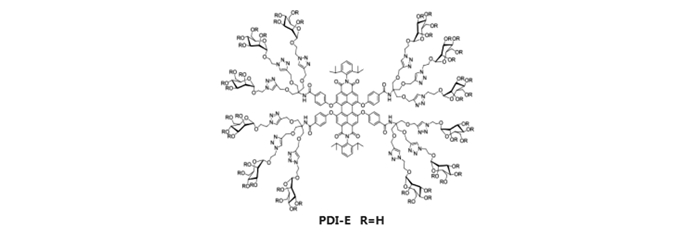
PDI修饰甘露糖可靶向识别伴刀豆蛋白A(ConA)[100]。PDI-甘露糖与ConA结合,其荧光基团的主要部分(即PDI萘环部分)进入ConA的疏水区域,因氢键和PDI疏水作用,导致其荧光淬灭;可以利用荧光性能的衰减情况推测PDI与ConA的结合的比例[16]。研究发现,水溶性的PDI-E(图 7)能选择性地连接伴刀豆蛋白A(ConA)。这种ConA功能化的PDI-E,可通过PDI解聚而诱导荧光产生[101]。但其在定点靶向目标基团方面较弱,主要通过形成多价糖蛋白分子来增强分子间作用力[102-103]。将PDI-E与ConA连接后,与巨噬细胞孵育后,发现其能与巨噬细胞表面的甘露糖受体结合,而进入细胞[15]。通过抑制实验发现,相比于对照组,有α-MMP(α-甘露糖)存在的细胞组中,PDI-E的荧光强度减弱,反映PDI-E在细胞表面对甘露糖受体的高选择性。因为大量的α细胞表面与ConA结合后可将PDI-E解离出来,此时PDI-E荧光淬灭[15]。在荧光共聚焦试验中,图 6a、6b及6c中PDI-E的红色荧光在细胞内表现为点状的荧光,PDI-E通过靶向细胞表面受体并以运输泡或吞噬体的形式进入细胞中。将一组细胞放在含有PDI-E的培养器皿中,另一组细胞放到除PDI-E外其它条件相同的培养器皿中,48 h后统计两组培养皿中细胞的存活率,统计学上没有明显的差异。结果表明,PDI-E对于细胞的毒性较低,细胞兼容性良好[104]。正常条件下PDI-E是以单分子形式存在的,在一系列溶液中可表现出不同的解聚现象,研究发现:温度增加时,PDI-E荧光增强,例如当温度从20 ℃增升高到60 ℃到时,PDI-E荧光性能增强了3倍[16]。光谱分析结果表明,温度升高引发PDI-E由聚合状态变成单分子状态,从而使其荧光强度增强。ConA可辅助糖-蛋白质反应诱导PDI-E解聚,单分子状态使PDI-E的荧光性能增强[16]。ConA的量可影响PDI-E荧光强度,当ConA低于5×10-7 mol/L时,PDI-E荧光强度无明显变化,若ConA量增加至5×10-7 mol/L时, 荧光强度增加3倍[16, 104]。这表明ConA通过糖-蛋白质反应使聚合形式的PDI-E解聚成单分子状态进而诱导其荧光增强。PDI-E因细胞转染能力较强,生物毒性低,机体中有良好兼容性,可发展用于肿瘤的诊断和检测。
4 结论
PDI在材料学方面的优良特性决定其生物医学应用的巨大潜能,通过特定基团的修饰可实现PDI定点靶向病灶并提高药物在病灶部位的有效浓度,这将是目前肿瘤治疗药物和技术的一种新的思路。PDI原先主要作为燃料应用于工作中,具有化学稳定性好、荧光产率高及易于修饰等特点。通过对PDI进行修饰,增加其水溶性和生物兼容性,经修饰后的PDI可广泛用于药物载体、肿瘤药物及荧光示踪剂等生物医学领域。用PDI纳米结构材料装载药物,通过连接靶向基团或分子,可作为靶向药物载体;PDI本身也可以作为肿瘤杀伤药物,破坏机体中异常增殖的DNA,因肿瘤细胞的DNA转录复制较为频繁,其遗传物质容易被外界的刺激所影响,从而干扰肿瘤细胞的生长;另外PDI还具有独特荧光特性,通过静电吸附等作用,将靶向DNA连接到PDI上,在活体或者在活细胞中做荧光示踪材料。通过示踪可以监测其在机体中的动态代谢过程,并据此对其施加外界刺激,以控制药物的释放。作为纳米药物装载体,其在稳定性与生物兼容性方面的研究还有待临床证据支持和进一步研究。水溶性PDI在生物学方面的应用具有很好的前景。目前将α-吡喃糖修饰的PDI对细胞进行转染实验,结果表明含有α-吡喃葡萄糖基的PDI转染效率高,这种选择性奠定了PDI作为细胞特异识别药物的基础,可能会提高临床早期诊断肿瘤的准确率,并减少治疗过程中对病人机体的毒副作用。而这需要化学、纳米材料及医学等学科研究人员的共同努力。
-
-
[1]
Torre L A, Bray F, Siegel R L. Global Cancer Statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. doi: 10.3322/caac.21262
-
[2]
Chen W, Zheng R, Baade P D. Cancer Statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. doi: 10.3322/caac.21338
-
[3]
李世红, 王绍军. 阿霉素心脏毒性发病机制新近展[J]. 临床心血管病杂志, 2005,21,(4): 249-252. LI Shihong, WANG Shaojun. Doxorubicin Cardiotoxicity Pathogenesis Recent Exhibition[J]. J Clin Cardiol, 2005, 21(4): 249-252.
-
[4]
韩琳琳, 刘颖. 超声背向散射积分参数评价顺铂对肾脏毒性的临床研究[J]. 中国超声医学杂志, 2008,24,(7): 638-640. HAN Linlin, LIU Ying. Evaluation of Cisplatin on Renal Toxicity Using Integrated Backscatter Parameters[J]. J Ultrasound Tradit Chinese Med, 2008, 24(7): 638-640.
-
[5]
田杰, 于沛, 孙文宣. 环磷酰胺对正常小鼠骨髓造血细胞的影响及其作用机制[J]. 中国实验血液学杂志, 2012,20,(6): 1316-1321. TIAN Jie, YU Pei, SUN Wenxuan. Effects of Cyclophosphamide on Bone Marrow Hematopoietic Cells in Normal Mice and Its Mechanism[J]. Chinese J Exp Hematol, 2012, 20(6): 1316-1321.
-
[6]
吴翠芳, 刘玉兰, 贾素洁. 长春新碱化疗方案引起神经毒性反应3例[J]. 药物不良反应杂志, 2009,11,(5): 362-363. WU Cuifang, LIU Yulan, JIA Sujie. Effect of Vincristine Chemotherapy on Neurotoxicity in 3 Patients[J]. Adver Drug React J, 2009, 11(5): 362-363.
-
[7]
訚亚涛, 彭英. 纳米载体在胶质瘤治疗中的研究进展[J]. 国际神经病学神经外科学杂志, 2014,41,(3): 242-245. YIN Yatao, PENG Ying. Advances in the Research of Nanomaterials in the Treatment of Glioma[J]. Int J Neurol Neurosurg, 2014, 41(3): 242-245.
-
[8]
徐宏艳, 刘鉴峰, 宋娜玲. 有机纳米材料作为药物载体在脑胶质瘤治疗中的应用[J]. 肿瘤防治研究, 2013,40,(11): 1101-1104. XU Hongyan, LIU Jianfeng, SONG Naling. Application of Organic Nanomaterials as Drug Carriers in Treatment of Brain Gliomas[J]. Cancer Res Prevent Treat, 2013, 40(11): 1101-1104.
-
[9]
张振宇, 徐健, 钟平. 纳米载体系统治疗恶性胶质瘤研究进展[J]. 国际神经病学神经外科学杂志, 2011,38,(3): 250-253. ZHANG Zhenyu, XU Jian, ZHONG Ping. Progress in the Treatment of Malignant Glioma with Nano-carrier System[J]. Int J Neurol Neurosurg, 2011, 38(3): 250-253.
-
[10]
崔畅畅, 柯学, 吕慧侠. 肿瘤干细胞靶向治疗研究进展[J]. 药学进展, 2016(1): 20-29. CUI Changchang, KE Xue, LYU Huixia. Advances in Targeted Therapy of Cancer Stem Cells[J]. Prog Pharm Sci, 2016, (1): 20-29.
-
[11]
Hanahan D, Weinberg R A. Hallmarks of Cancer:The Next Generation[J]. Cell, 2011, 144(5): 646-674. doi: 10.1016/j.cell.2011.02.013
-
[12]
丁艳萍, 季天骄, 宋晓. 纳米技术识别和调控肿瘤微环境用于肿瘤诊疗的研究进展[J]. 科学通报, 2013(24): 2436-2448. DING Yanping, JI Tianjiao, SONG Xiao. Advances in the Application of Nanotechnology to Identify and Regulate Tumor Microenvironment for Tumor Diagnosis and Treatment[J]. Chinese Sci Bull, 2013, (24): 2436-2448.
-
[13]
Jin S, Li S, Wang C. Biosafe Nanoscale Pharmaceutical Adjuvant Materials[J]. J Biomed Nanotechnol, 2014, 10(9): 2393-2419. doi: 10.1166/jbn.2014.1898
-
[14]
Chen M, Yin M. Design and Development of Fluorescent Nanostructures for Bioimaging[J]. Prog Polym Sci, 2013, 39(2): 365-395.
-
[15]
Sun M, Mullen K, Yin M. Water-soluble Perylenediimides:Design Concepts and Biological Applications[J]. Chem Soc Rev, 2016, 45(6): 1513-1528. doi: 10.1039/C5CS00754B
-
[16]
Wang K R, An H W, Rong R X. Fluorescence Turn-on Sensing of Protein Based on Mannose Functionalized Perylene Bisimides and Its Fluorescence Imaging[J]. Biosens Bioelectron, 2014, 58(1): 27-32.
-
[17]
Sharma P, Brown S, Walter G. Nanoparticles for Bioimaging[J]. Adv Colloid Interface Sci, 2006, 123/124/125/126: 471-485.
-
[18]
Kahveci Z, Vazquez-Guillo R, Martinez-Tome M J. New Red-Emitting Conjugated Polyelectrolyte:Stabilization by Interaction with Biomolecules and Potential Use as Drug Carriers and Bioimaging Probes[J]. ACS Appl Mater Interfaces, 2016, 8(3): 1958-1969. doi: 10.1021/acsami.5b10167
-
[19]
Guo Z, Park S, Yoon J. Recent Progress in the Development of Near-infrared Fluorescent Probes for Bioimaging Applications[J]. Chem Soc Rev, 2014, 43(1): 16-29. doi: 10.1039/C3CS60271K
-
[20]
Peng F, Su Y, Zhong Y. Silicon Nanomaterials Platform for Bioimaging, Biosensing, and Cancer Therapy[J]. Acc Chem Res, 2014, 47(2): 612-623. doi: 10.1021/ar400221g
-
[21]
Liu K, Xu Z, Yin M. Perylenediimide-cored Dendrimers and Their Bioimaging and Gene Delivery Applications[J]. Prog Polym Sci, 2015, 2015(46): 25-54.
-
[22]
Huang Y, Quan B, Wei Z. Self-Assembled Organic Functional Nanotubes and Nanorods and Their Sensory Properties[J]. J Phys Chem C, 2009, 113(10): 3929-3933. doi: 10.1021/jp8078452
-
[23]
Huang Y, Hu J, Kuang W. Modulating Helicity Through Amphiphilicity-Tuning Supramolecular Interactions for the Controlled Assembly of Perylenes[J]. Chem Commun(Camb), 2011, 47(19): 5554-5556. doi: 10.1039/c1cc10220f
-
[24]
Hu J, Kuang W, Deng K. Self-Assembled Sugar-Substituted Perylene Diimide Nanostructures with Homochirality and High Gas Sensitivity[J]. Adv Funct Mater, 2012, 22(19): 4149-4158. doi: 10.1002/adfm.v22.19
-
[25]
Huang Y, Wang J, Wei Z. Modulating Supramolecular Helicity and Electrical Conductivity of Perylene Dyes Through an Achiral Alkyl Chain[J]. Chem Commun(Camb), 2014, 50(61): 8343-8345. doi: 10.1039/c4cc03563a
-
[26]
Huang Y, Wang J, Zhai H. Helical Supramolecular Aggregates of Sugar-based Perylene Dyes:The Effect of Core-substituted Groups[J]. Soft Matter, 2014, 10(40): 7920-7924. doi: 10.1039/C4SM01561D
-
[27]
Fan Q, Cheng K, Yang Z. Perylene-diimide-based Nanoparticles as Highly Efficient Photoacoustic Agents for Deep Brain Tumor Imaging in Living Mice[J]. Adv Mater, 2015, 27(5): 843-847. doi: 10.1002/adma.v27.5
-
[28]
Le U M, Shaker D S, Sloat B R. A Thermo-sensitive Polymeric Gel Containing a Gadolinium(Gd) Compound Encapsulated into Liposomes Significantly Extended the Retention of the Gd in Tumors[J]. Drug Dev Ind Pharm, 2008, 34(4): 413-418. doi: 10.1080/03639040701662495
-
[29]
Quan C Y, Chen J X, Wang H Y. Core-shell Nanosized Assemblies Mediated by the Alpha-beta Cyclodextrin Dimer with a Tumor-triggered Targeting Property[J]. ACS Nano, 2010, 4(7): 4211-4219. doi: 10.1021/nn100534q
-
[30]
Lee W H, Bebawy M, Loo C Y. Fabrication of Curcumin Micellar Nanoparticles with Enhanced Anti-cancer Activity[J]. J Biomed Nanotechnol, 2015, 11(6): 1093-1105. doi: 10.1166/jbn.2015.2041
-
[31]
Jana A, Nguyen K T, Li X. Perylene-derived Single-component Organic Nanoparticles with Tunable Emission:Efficient Anticancer Drug Carriers with Real-time Monitoring of Drug Release[J]. ACS Nano, 2014, 8(6): 5939-5952. doi: 10.1021/nn501073x
-
[32]
Liu F, Li X, Zhang L. Stimuli-Responsive Nanocarriers for Drug Delivery to the Central Nervous System[J]. Curr Nanosci, 2016, 12(1): 4-17.
-
[33]
Xu Z, He B, Shen J. Fluorescent Water-soluble Perylenediimide-cored Cationic Dendrimers:Synthesis, Optical Properties, and Cell Uptake[J]. Chem Commun, 2013, 49(35): 3646-3648. doi: 10.1039/c3cc40330k
-
[34]
He B, Chu Y, Yin M. Fluorescent Nanoparticle Delivered dsRNA Toward Genetic Control of Insect Pests[J]. Adv Mater, 2013, 25(33): 4580-4584. doi: 10.1002/adma.201301201
-
[35]
Jana A, Nguyen K T, Li X. Perylene-derived Single-component Organic Nanoparticles with Tunable Emission:Efficient Anticancer Drug Carriers with Real-time Monitoring of Drug Release[J]. ACS Nano, 2014, 8(6): 5939-5952. doi: 10.1021/nn501073x
-
[36]
Jin S, Li S, Wang C. Biosafe Nanoscale Pharmaceutical Adjuvant Materials[J]. J Biomed Nanotechnol, 2014, 10(9): 2393-2419. doi: 10.1166/jbn.2014.1898
-
[37]
Jones C H, Chen C K, Ravikrishnan A. Overcoming Nonviral Gene Delivery Barriers:Perspective and Future[J]. Mol Pharm, 2013, 10(11): 4082-4098. doi: 10.1021/mp400467x
-
[38]
Niven R, Pearlman R, Wedeking T. Biodistribution of Radiolabeled Lipid-DNA Complexes and DNA in Mice[J]. J Pharm Sci, 1998, 87(11): 1292-1299. doi: 10.1021/js980087a
-
[39]
Wong P T, Tang K, Coulter A. Multivalent Dendrimer Vectors with DNA Intercalation Motifs for Gene Delivery[J]. Biomacromolecules, 2014, 15(11): 4134-4145. doi: 10.1021/bm501169s
-
[40]
Watakabe A, Sadakane O, Hata K. Application of Viral Vectors to the Study of Neural Connectivities and Neural Circuits in the Marmoset Brain[J]. Dev Neurobiol, 2016, 77(3): 354-372.
-
[41]
Chabaud P, Camplo M, Payet D. Cationic Nucleoside Lipids for Gene Delivery[J]. Bioconjug Chem, 2006, 17(2): 466-472. doi: 10.1021/bc050162q
-
[42]
Bell P C, Bergsma M, Dolbnya I P. Transfection Mediated by Gemini Surfactants:Engineered Escape from the Endosomal Compartment[J]. J Am Chem Soc, 2003, 125(6): 1551-1558. doi: 10.1021/ja020707g
-
[43]
Ewert K K, Evans H M, Zidovska A. A Columnar Phase of Dendritic Lipid-based Cationic Liposome-DNA Complexes for Gene Delivery:Hexagonally Ordered Cylindrical Micelles Embedded in a DNA Honeycomb Lattice[J]. J Am Chem Soc, 2006, 128(12): 3998-4006. doi: 10.1021/ja055907h
-
[44]
Ewert K, Ahmad A, Evans H M. Efficient Synthesis and Cell-transfection Properties of a New Multivalent Cationic Lipid for Nonviral Gene Delivery[J]. J Med Chem, 2002, 45(23): 5023-5029. doi: 10.1021/jm020233w
-
[45]
Takahashi T, Hirose J, Kojima C. Synthesis of Poly(amidoamine) Dendron-bearing Lipids with Poly(ethylene glycol) Grafts and Their Use for Stabilization of Nonviral Gene Vectors[J]. Bioconjug Chem, 2007, 18(4): 1163-1169. doi: 10.1021/bc070014v
-
[46]
Choi S H, Jin S E, Lee M K. Novel Cationic Solid Lipid Nanoparticles Enhanced p53 Gene Transfer to Lung Cancer Cells[J]. Eur J Pharm Biopharm, 2008, 68(3): 545-554. doi: 10.1016/j.ejpb.2007.07.011
-
[47]
Kim T I, Baek J U, Zhe B C. Arginine-conjugated Polypropylenimine Dendrimer as a Non-toxic and Efficient Gene Delivery Carrier[J]. Biomaterials, 2007, 28(11): 2061-2067. doi: 10.1016/j.biomaterials.2006.12.013
-
[48]
Liu Z, Winters M, Holodniy M. siRNA Delivery into Human T Cells and Primary Cells with Carbon-Nanotube Transporters[J]. Angew Chem Int Ed Engl, 2007, 46(12): 2023-2027. doi: 10.1002/(ISSN)1521-3773
-
[49]
Jones C H, Chen C K, Ravikrishnan A. Overcoming Nonviral Gene Delivery Barriers:Perspective and Future[J]. Mol Pharm, 2013, 10(11): 4082-4098. doi: 10.1021/mp400467x
-
[50]
You S, Cai Q, Zheng Y. Perylene-cored Star-Shaped Polycations for Fluorescent Gene Vectors and Bioimaging[J]. ACS Appl Mater Interfaces, 2014, 6(18): 16327-16334. doi: 10.1021/am5045967
-
[51]
Xu Z, Guo K, Yu J. A Unique Perylene-based DNA Intercalator:Localization in Cell Nuclei and Inhibition of Cancer Cells and Tumors[J]. Small, 2014, 10(20): 4087-4092.
-
[52]
Fan Q, Cheng K, Yang Z. Perylene-diimide-based Nanoparticles as Highly Efficient Photoacoustic Agents for Deep Brain Tumor Imaging in Living Mice[J]. Adv Mater, 2015, 27(5): 843-847. doi: 10.1002/adma.v27.5
-
[53]
Wang Q Q, Cheng N, Zheng X W. Synthesis of Organic Nitrates of Luteolin as a Novel Class of Potent Aldose Reductase Inhibitors[J]. Bioorg Med Chem, 2013, 21(14): 4301-4310. doi: 10.1016/j.bmc.2013.04.066
-
[54]
郭佳, 李凤然, 刘洋. DNA和RNA G-四链体及其小分子配体研究进展[J]. 国际药学研究杂志, 2012,39,(5): 358-367. GUO Jia, LI Fengran, LIU Yang. Advances in DNA and RNA G-quadruplexes and Their Small Molecule Ligands[J]. Int J Pharm, 2012, 39(5): 358-367.
-
[55]
Lyu Y, Fang Y, Miao Q. Intraparticle Molecular Orbital Engineering of Semiconducting Polymer Nanoparticles as Amplified Theranostics for in Vivo Photoacoustic Imaging and Photothermal Therapy[J]. ACS Nano, 2016, 10(4): 4472-4481. doi: 10.1021/acsnano.6b00168
-
[56]
Daublain P, Siegmund K, Hariharan M. Photoinduced Charge Separation in Pyrenedicarboxamide-linked DNA Hairpins[J]. Photochem Photobiol Sci, 2008, 7(12): 1501-1508. doi: 10.1039/b813995d
-
[57]
Menacher F, Wagenknecht H A. Ratiometric Molecular Beacons Based on the Perylene Bisimide as a Dimer Internal DNA Base Substitution[J]. Photochem Photobiol Sci, 2011, 10(8): 1275-1278. doi: 10.1039/c1pp05091e
-
[58]
徐业伟, 朱方华, 张林. 苝酰亚胺衍生物的合成及其应用进展[J]. 材料导报, 2010,24,(21): 79-85. XU Yewei, ZHU Fanghua, ZHANG Lin. Synthesis and Application of Perylene Imide Derivatives[J]. Mater Rev, 2010, 24(21): 79-85.
-
[59]
Liu H, Xu Y, Li F. Light-driven Conformational Switch of I-motif DNA[J]. Angew Chem Int Ed, 2007, 46(14): 2515-2517. doi: 10.1002/(ISSN)1521-3773
-
[60]
Yin M, Zhang S. A Unique Perylene-based DNA Intercalator:Localization in Cell Nuclei and Inhibition of Cancer Cells and Tumors[J]. Small, 2016, 12(2): 4087-4092.
-
[61]
Casagrande L, Cordeiro M M, Nor S A. Dental Pulp Stem Cells in Regenerative Dentistry[J]. Odontology, 2011, 99(1): 1-7. doi: 10.1007/s10266-010-0154-z
-
[62]
Aslan A, Gulluce M, Agar G. Mutagenic and Antimutagenic Properties of Some Lichen Species Grown in the Eastern Anatolia Region of Turkey[J]. Tsitol Genet, 2012, 46(5): 36-42.
-
[63]
Gao F, Chao H, Wang J Q. Targeting Topoisomerase Ⅱ with the Chiral DNA-intercalating Ruthenium(Ⅱ) Polypyridyl Complexes[J]. J Biol Inorg Chem, 2007, 12(7): 1015-1027. doi: 10.1007/s00775-007-0272-4
-
[64]
Xue L, Ranjan N, Arya D P. Synthesis and Spectroscopic Studies of the Aminoglycoside(neomycin)-perylene Conjugate Binding to Human Telomeric DNA[J]. Biochemistry, 2011, 50(14): 2838-2849. doi: 10.1021/bi1017304
-
[65]
Tuntiwechapikul W, Salazar M. Cleavage of Telomeric G-Quadruplex DNA with Perylene-EDTA*Fe(Ⅱ)[J]. Biochemistry, 2001, 40(45): 13652-13658. doi: 10.1021/bi011363u
-
[66]
Tuntiwechapikul W, Lee J T, Salazar M. Design and Synthesis of the G-Quadruplex-specific Cleaving Reagent Perylene-EDTA·Iron(Ⅱ)[J]. J Am Chem Soc, 2001, 123(23): 5606-5607. doi: 10.1021/ja0156439
-
[67]
Fedoroff O Y, Salazar M, Han H. NMR-Based Model of a Telomerase-inhibiting Compound Bound to G-Quadruplex DNA[J]. Biochemistry, 1998, 37(36): 12367-12374. doi: 10.1021/bi981330n
-
[68]
Rossetti L, Franceschin M, Bianco A. Perylene Diimides with Dfferent Side Chains are Selective in Inducing Different G-Quadruplex DNA Structures and in Inhibiting Telomerase[J]. Bioorg Med Chem Lett, 2002, 12(18): 2527-2533. doi: 10.1016/S0960-894X(02)00504-8
-
[69]
Hsiang Y H, Hertzberg R, Hecht S. Camptothecin Induces Protein-linked DNA Breaks via Mammalian DNA Topoisomerase Ⅰ[J]. J Biol Chem, 1985, 260(27): 14873-14878.
-
[70]
Sun M, Yin W, Dong X. Fluorescent Supramolecular Micelles for Imaging-guided Cancer Therapy[J]. Nanoscale, 2016, 8(9): 5302-5312. doi: 10.1039/C6NR00450D
-
[71]
Reichardt N C, Martin-Lomas M, Penades S. Glyconanotechnology[J]. Chem Soc Rev, 2013, 42(10): 4358-4376. doi: 10.1039/c2cs35427f
-
[72]
Jayaraman N. Multivalent Ligand Presentation as a Central Concept to Study Intricate Carbohydrate-protein Interactions[J]. Chem Soc Rev, 2009, 38(12): 3463-3483. doi: 10.1039/b815961k
-
[73]
Grunstein D, Maglinao M, Kikkeri R. Hexameric Supramolecular Scaffold Orients Carbohydrates to Sense Bacteria[J]. J Am Chem Soc, 2011, 133(35): 13957-13966. doi: 10.1021/ja2036767
-
[74]
Dube D H, Bertozzi C R. Glycans in Cancer and Inflammation-potential for Therapeutics and Diagnostics[J]. Nat Rev Drug Discov, 2005, 4(6): 477-488. doi: 10.1038/nrd1751
-
[75]
Liu F T, Rabinovich G A. Galectins as Modulators of Tumour Progression[J]. Nat Rev Cancer, 2005, 5(1): 29-41. doi: 10.1038/nrc1527
-
[76]
Ohtsubo K, Marth J D. Glycosylation in Cellular Mechanisms of Health and Disease[J]. Cell, 2006, 126(5): 855-867. doi: 10.1016/j.cell.2006.08.019
-
[77]
Ellis G A, Palte M J, Raines R T. Boronate-mediated Biologic Delivery[J]. J Am Chem Soc, 2012, 134(8): 3631-3634. doi: 10.1021/ja210719s
-
[78]
Peri F. Clustered Carbohydrates in Synthetic Vaccines[J]. Chem Soc Rev, 2013, 42(11): 4543-4556. doi: 10.1039/C2CS35422E
-
[79]
Tanaka K, Fukase K. Chemical Approach to a Whole Body Imaging of Sialo-N-Linked Glycans[J]. Top Curr Chem, 2015, 367: 201-230.
-
[80]
Akagi T, Ichiki T. Cell Electrophoresis on a Chip:What Can We Know from the Changes in Electrophoretic Mobility?[J]. Anal Bioanal Chem, 2008, 391(7): 2433-2441. doi: 10.1007/s00216-008-2203-9
-
[81]
Yin M, Shen J, Gropeanu R. Fluorescent Core/Shell Nanoparticles for Specific Cell-nucleus Staining[J]. Small, 2008, 4(7): 894-898. doi: 10.1002/smll.v4:7
-
[82]
Yin M, Feng C, Shen J. Dual-responsive Interaction to Detect DNA on Template-based Fluorescent Nanotubes[J]. Small, 2011, 7(12): 1629-1634. doi: 10.1002/smll.v7.12
-
[83]
Gorl D, Zhang X, Wurthner F. Molecular Assemblies of Perylene Bisimide Dyes in Water[J]. Angew Chem Int Ed, 2012, 51(26): 6328-6348. doi: 10.1002/anie.201108690
-
[84]
Krieg E, Shirman E, Weissman H. Supramolecular Gel Based on a Perylene Diimide Dye:Multiple Stimuli Responsiveness, Robustness, and Photofunction[J]. J Am Chem Soc, 2009, 131(40): 14365-14373. doi: 10.1021/ja903938g
-
[85]
Kasprzak M M, Laerke H N, Knudsen K E. Changes in Molecular Characteristics of Cereal Carbohydrates after Processing and Digestion[J]. Int J Mol Sci, 2012, 13(12): 16833-16852. doi: 10.3390/ijms131216833
-
[86]
Wang K R, An H W, Rong R X. Synthesis of Biocompatible Glycodendrimer Based on Fluorescent Perylene Bisimides and Its Bioimaging[J]. Macromol Rapid Commun, 2014, 35(7): 727-734. doi: 10.1002/marc.v35.7
-
[87]
Petkau K, Kaeser A, Fischer I. Pre-and Postfunctionalized Self-assembled Pi-conjugated Fluorescent Organic Nanoparticles for Dual Targeting[J]. J Am Chem Soc, 2011, 133(42): 17063-17071. doi: 10.1021/ja2075345
-
[88]
Ruff Y, Buhler E, Candau S J. Glycodynamers:Dynamic Polymers Bearing Oligosaccharides Residues-Generation, Structure, Physicochemical, Component Exchange, and Lectin Binding Properties[J]. J Am Chem Soc, 2010, 132(8): 2573-2584. doi: 10.1021/ja9082733
-
[89]
Yin M, Feng C, Shen J. Dual-Responsive Interaction to Detect DNA on Template-based Fluorescent Nanotubes[J]. Small, 2011, 7(12): 1629-1634. doi: 10.1002/smll.v7.12
-
[90]
Yin M, Shen J, Pflugfelder G O. A Fluorescent Core-Shell Dendritic Macromolecule Specifically Stains the Extracellular Matrix[J]. J Am Chem Soc, 2008, 130(25): 7806-7807. doi: 10.1021/ja8022362
-
[91]
Ozawa T, YoshimuraH , Kim S B. Advances in Fluorescence and Bioluminescence Imaging[J]. Anal Chem, 2013, 85(2): 590-609. doi: 10.1021/ac3031724
-
[92]
You S, Cai Q, Müllen K. pH-Sensitive Unimolecular Fluorescent Polymeric Micelles:From Volume Phase Transition to Optical Response[J]. Chem Commun (Cambridge, U.K.), 2014, 50(7): 823-825. doi: 10.1039/C3CC48046A
-
[93]
Yin M, Feng C, Shen J. Dual-Responsive Interaction to Detect DNA on Template-Based Fluorescent Nanotubes[J]. Small, 2011, 7(12): 1629-1634. doi: 10.1002/smll.v7.12
-
[94]
Wang K R, An H W, Rong R X. Fluorescence Turn-on Sensing of Protein Based on Mannose Functionalized Perylene Bisimides and Its Fluorescence Imaging[J]. Biosens Bioelectron, 2014, 58: 27-32. doi: 10.1016/j.bios.2014.02.038
-
[95]
Fan Q, Cheng K, Yang Z. Perylene-Diimide-Based Nanoparticles as Highly Efficient Photoacoustic Agents for Deep Brain Tumor Imaging in Living Mice[J]. Adv Mater, 2015, 27(5): 843-847. doi: 10.1002/adma.v27.5
-
[96]
Huang Y, Wang J, Zhai H. Helical Supramolecular Aggregates of Sugar-based Perylene Dyes:The Effect of Core-substituted Groups[J]. Soft Matter, 2014, 10(40): 7920-7924. doi: 10.1039/C4SM01561D
-
[97]
Huang Y, Hu J, Kuang W. Modulating Helicity Through Amphiphilicity-Tuning Supramolecular Interactions for the Controlled Assembly of Perylenes[J]. Chem Commun (Camb), 2011, 47(19): 5554-5556. doi: 10.1039/c1cc10220f
-
[98]
Huang Y, Wang J, Wei Z. Modulating Supramolecular Helicity and Electrical Conductivity of Perylene Dyes Through an Achiral Alkyl Chain[J]. Chem Commun (Camb), 2014, 50(61): 8343-8345. doi: 10.1039/c4cc03563a
-
[99]
Huang Y, Zhang W, Wang J. Probing the Sensory Property of Perylenediimide Derivatives in Hydrazine Gas:Core-substituted Aromatic Group Effect[J]. ACS Appl Mater Interfaces, 2014, 6(12): 9307-9313. doi: 10.1021/am5016765
-
[100]
Reeke G J, Becker J W, Cunningham B A. Structure and Function of Concanavalin A[J]. Adv Exp Med Biol, 1975, 55: 13-33. doi: 10.1007/978-1-4684-0949-9
-
[101]
Rusin O, Kral V, Escobedo J O. A Supramolecular Approach to Protein Labeling. A Novel Fluorescent Bioassay for Concanavalin a Activity[J]. Org Lett, 2004, 6(9): 1373-1376. doi: 10.1021/ol049781p
-
[102]
Lundquist J J, Toone E J. The Cluster Glycoside Effect[J]. Chem Rev, 2002, 102(2): 555-578. doi: 10.1021/cr000418f
-
[103]
Sansone F, Casnati A. Multivalent Glycocalixarenes for Recognition of Biological Macromolecules:Glycocalyx Mimics Capable of Multitasking[J]. Chem Soc Rev, 2013, 42(11): 4623-4639. doi: 10.1039/c2cs35437c
-
[104]
Wang K R, An H W, Rong R X. Fluorescence Turn-on Sensing of Protein Based on Mannose Functionalized Perylene Bisimides and Its Fluorescence Imaging[J]. Biosens Bioelectron, 2014, 58: 27-32. doi: 10.1016/j.bios.2014.02.038
-
[105]
Heek T, Nikolaus J, Schwarzer R. An Amphiphilic Perylene Imido Diester for Selective Cellular Imaging[J]. Bioconjug Chem, 2013, 24(2): 153-158. doi: 10.1021/bc3005655
-
[106]
Yang S K, Shi X, Park S. Monovalent, Clickable, Uncharged, Water-soluble Perylenediimide-cored Dendrimers for Target-specific Fluorescent Biolabeling[J]. J Am Chem Soc, 2011, 133(26): 9964-9967. doi: 10.1021/ja2009136
-
[1]
-
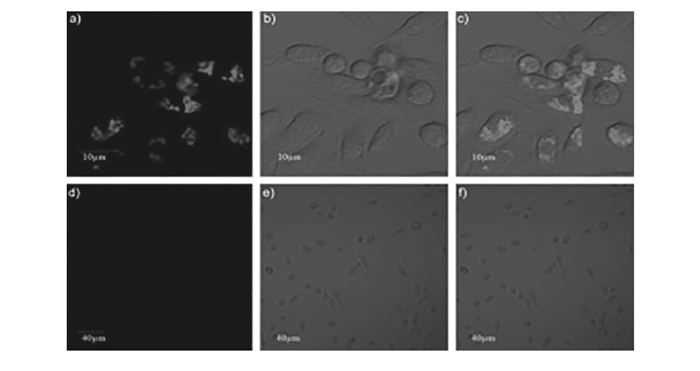
图 6 共聚焦显微镜显示细胞PDI荧光成像[16]
Figure 6 Confocal microscopic images of murine macrophage cells[16]
Confocal microscopic images of murine macrophage cells after incubation with PDI(10 μg/mL). Group withoutmannose:(a.excited at 559 nm; b.bright field; c.merge).Group with mannose(18 mg/mL) inhibition:(d.excited at 559 nm; e.bright field; f.merge)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 1634
- HTML全文浏览量: 90


 下载:
下载:






 下载:
下载:

