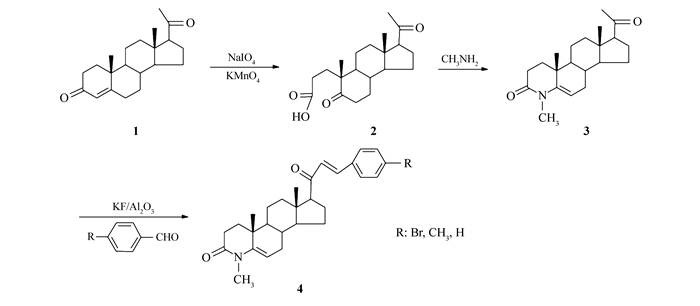
 Figure Scheme 1.
Synthesis of 4-methyl-4-aza-21E-benzylidene-5-pregnene-3, 20-dione
Figure Scheme 1.
Synthesis of 4-methyl-4-aza-21E-benzylidene-5-pregnene-3, 20-dione

Citation: CHEN Shaorui, SHEN Fengjuan. Synthesis of 4-Methyl-4-aza-21E-benzylidene-5-pregnene-3, 20-dione[J]. Chinese Journal of Applied Chemistry, 2017, 34(6): 671-675. doi: 10.11944/j.issn.1000-0518.2017.06.160354

4-甲基-4-氮杂-21E-苯亚甲基-5-孕烯-3, 20-二酮类化合物的合成
English
Synthesis of 4-Methyl-4-aza-21E-benzylidene-5-pregnene-3, 20-dione
-
甾体化合物及其衍生物广泛存在于自然界,与许多生命过程密切相关[1]。甾体是一种维持生命、保持正常生活、促进性器官发育、维持生殖的重要生物活性物质,不仅能治疗乳腺癌[2]、前列腺增生等疾病[3],而且也是计划生育及产生免疫抑制等方面不可缺少的药物[4]。苯亚甲基类化合物是一类具有多种生理活性的物质且是多种有机合成的底物,同时这类化合物可应用于治疗抗利什曼虫、抗炎、抗疟疾、抗真菌、抗艾滋病等[5-9]。利用药物设计中的拼合原理,将两大药效基团拼合得到的甾体苯亚甲基物质可以作为脱氢酶抑制剂、抗菌药物和抗肿瘤药物[10-12]。
之前对于氮杂类甾体苯亚甲基类化合物研究很少[13],本文设计合成了以黄体酮为原料,经过多步反应合成了目标化合物。在甾体分子中引入苯亚甲基这一反应中,多以甾体酮和芳醛在NaOH(KOH)作用下[14-15],通过Claisen-Schmidt缩合反应得到,但该方法反应时间比较长,使用强碱后处理较麻烦。KF/A12O3作为一种温和的固体催化剂,在有机合成上有着广泛的应用[16]。利用此方法该反应后处理简单且产率较高,为苯亚甲基甾体衍生物的合成提供了一种方便而有效的方法。
1 实验部分
1.1 仪器和试剂
X4型数字显微熔点测定仪,温度计未较正(北京福凯科技发展有限公司);AV400型核磁共振仪(美国Bruker公司);BIO-RAD-FTS-3000型傅里叶红外光谱仪(美国BIO-RAD公司);VGZAB-HS型质谱仪(英国VG公司)。
除黄体酮为工业品外,其它试剂均为市售分析纯。催化剂KF/Al2O3参考文献[17]制备。
1.2 5, 20-二羰基-A-失碳-3, 5-开裂-孕甾烷-3-羧酸(2) 的合成
将黄体酮(15 g, 47.8 mmol)和叔丁醇(450 mL)加入四口瓶中,搅拌下加入溶于水(20 mL)和无水Na2CO3(6.1 g, 57.6 mmol)的溶液,升温至回流,缓慢滴加高碘酸钠(61.4 g, 286.8 mmol)和高锰酸钾(0.45 g, 2.9 mmol)溶于热水300 mL形成的溶液,滴加完毕后回流4 h左右,停止反应,稍微冷却,过滤,用水洗涤滤饼(10 mL×3)。蒸去绝大部分叔丁醇,加入水(150 mL),HCL调节pH=2.0,二氯甲烷萃取(100 mL×3),水洗(100 mL×3)。无水硫酸镁干燥,过滤,浓缩得到14.11 g淡黄色固体2,产率88.7%。产物无需精制,直接进行下一步反应。ESI-MS(m/z):333.5(M-H)-。
1.3 4-甲基-4-氮杂-5-孕烯-3, 20-二酮(3) 的合成
将化合物2(10 g, 29.8 mmol)、乙二醇50 mL和甲胺醇40 mL加入四口瓶中,室温下搅拌一夜。加热回流18 h后反应完全,冷却至室温,加入冷水100 mL搅拌1 h,烯盐酸调pH值为2.0左右,加入二氯甲烷50 mL溶解,再用二氯甲烷(100 mL×3) 萃取,水洗(100 mL×3),无水硫酸镁干燥,过滤,旋干得粗品。柱色谱分离(V(石油醚):V(乙酸乙酯)=3:1) 得到纯品6.80 g,产率是69%。
1H NMR(500 MHz, CDCl3), δ:0.66(s, 3H, 18-CH3), 1.05(s, 3H, 19-CH3), 2.13(s, 3H, 21-CH3), 3.12(s, 3H, 4N-CH3), 5.04(m, 1H, 6-H); ESI-MS(m/z):330.3(M+H)+; C21H31NO2元素分析计算值(实测值)/%:C 76.55(76.89), H 9.48(9.31), N 4.25(2.49)。
1.4 4-甲基-4-氮杂-21E-取代苯亚甲基-5-孕烯-3, 20-二酮(4) 的合成
将化合物3(0.5 g, 1.50 mmol),无水乙醇15 mL,催化剂KF/Al2O3(0.24 g, 1.50 mmol)和芳香醛(1.65 mmol)加入三口瓶中,加热回流4 h,冷至室温过滤,浓缩得粗品,柱色谱分离(洗脱剂:V(石油醚):V(乙酸乙酯)=5:1) 得产品。
4-甲基-4-氮杂-21E-对溴苯亚甲基-5-孕烯-3, 20-二酮(4a):产率58%;1H NMR(500 MHz, CDCl3), δ:0.67(s, 3H, 18-CH3), 1.04(s, 3H, 19-CH3), 3.12(s, 3H, 4N-CH3), 5.04(m, 1H, 6-H), 6.75(d, 1H, J=16.0 Hz, 21H), 7.42(d, 2H, J=9.0 Hz, Ph—H), 7.47(d, 1H, J=16.0 Hz, 22H), 7.53(d, 2H, J=8.0 Hz, Ph—H); 13C NMR(125 MHz, CDCl3), δ:200.08, 168.68, 144.16, 140.38, 133.71, 132.24, 129.74, 127.12, 124.66, 104.73, 62.09, 56.90, 48.81, 45.07, 38.89, 35.41, 31.76, 31.34, 31.13, 30.65, 28.90, 24.62, 22.83, 21.02, 18.89, 13.58;ESI-MS(m/z):496.4(M+H)+; C28H34BrNO2元素分析计算值(实测值)/%:C 67.74(67.89), H 6.90(7.11), N 2.82(2.89)。
4-甲基-4-氮杂-21E-对甲基苯亚甲基-5-孕烯-3, 20-二酮(4b):产率68%;1H NMR(500 MHz, CDCl3), δ:0.64(s, 3H, 18-CH3), 1.07(s, 3H, 19-CH3), 2.38(s, 3H, CH3—Ph), 3.18(s, 3H, 4N—CH3), 5.08(m, 1H, 6-H), 6.72(d, 1H, J=16.0 Hz, 21H), 7.20(d, 2H, J=8.0 Hz, Ph—H), 7.46(d, 2H, J=8.0 Hz, Ph—H), 7.54(d, 1H, J=16.0 Hz, 22H); 13C NMR(125 MHz, CDCl3), δ:200.13, 170.75, 141.09, 138.95, 136.48, 134.77, 132.02, 129.83, 125.75, 104.75, 61.79, 57.21, 49.85, 44.99, 43.69, 38.77, 33.34, 30.36, 29.28, 24.78, 22.74, 21.66, 21.54, 21.46, 20.75, 13.61;ESI-MS(m/z):432.5(M+H)+; C29H37NO2元素分析计算值(实测值)/%:C 80.70(80.81), H 8.64(8.57), N 3.25(3.21)。
4-甲基-4-氮杂-21E-苯亚甲基-5-孕烯-3, 20-二酮(4c):产率56%;1H NMR(500 MHz, CDCl3), δ:0.64(s, 3H, 18-CH3), 1.09(s, 3H, 19-CH3), 3.11(s, 3H, 4N—CH3), 5.06(m, 1H, 6-H), 6.76(d, 1H, J=16.0 Hz, 21H), 7.26~7.38(m, 4H, 22H+Ph—H), 7.54~7.58(m, 2H, Ph—H); 13C NMR(125 MHz, CDCl3), δ:200.08, 179.12, 142.08, 135.64, 134.76, 130.57, 129.08, 128.68, 126.63, 104.63, 61.83, 57.14, 49.90, 45.00, 43.76, 38.73, 34.49, 33.40, 30.25, 29.82, 29.33, 24.73, 24.29, 22.70, 21.51, 13.61;ESI-MS(m/z):418.3(M+H)+; C28H35NO2元素分析计算值(实测值)/%:C 80.53(80.67), H 8.45(8.55), N 3.35(3.41)。
2 结果讨论
2.1 不同催化剂对化合物4a产率的影响
化合物3(0.5 g, 1.50 mmol),无水乙醇15 mL和对溴苯甲醛(0.303 g, 1.65 mmol)加入三口瓶中,加入不同催化剂,结果见表 1。由表 1可知:当利用KOH催化此反应时,室温下反应24 h,仍有少量原料反应不完全,有副产物的生成且与主产物的极性相近,使分离难度增大产率只有24%;当在回流状态下反应时,产物更杂产率只有20%;选用有机碱CH3ONa和t-BuOK催化此反应时需绝对无水乙醇,TLC检测发现当催化剂为CH3ONa时不反应,t-BuOK时只有约10%左右反应;自制的催化剂KF/Al2O3催化此反应时回流4 h,薄层液相色谱(TLC)检测反应完全,产率可达58%,故选用KF/Al2O3催化此反应。
2.2 不同KF/Al2O3的量对化合物4a产率的影响
化合物3(0.5 g, 1.50 mmol),无水乙醇15 mL和对溴苯甲醛(0.303 g, 1.65 mmol)加入三口瓶中,加入不同量的KF/Al2O3,结果见表 2。在n(Al2O3/KF)/n(compound 3)=0.4时,反应时间延长12 h仍有部分原料反应不完全,产率只有24%,随着催化剂量的增加,化合物4a的产率也随之增加,当n(Al2O3/KF)/n(compound 3)=1时产率可达58%,继续增加催化剂的量产率没有明显变化,故催化剂的量应选择n(Al2O3/KF)/n(compound 3)=1为宜。
 表 2
不同KF/Al2O3与化合物3的摩尔比对化合物4a产率的影响a
Table 2.
Effect of molar ratio of Al2O3/KF to compound 3 on the yield of compound 4a
表 2
不同KF/Al2O3与化合物3的摩尔比对化合物4a产率的影响a
Table 2.
Effect of molar ratio of Al2O3/KF to compound 3 on the yield of compound 4a

2.3 产物结构分析
化合物4a的1H NMR可知,δ 0.67、1.04、3.12的单峰分别为18、19、4位氮甲基峰,5.04为5位双键氢,而6.75和7.47分别是21和22位氢,且裂分为两重峰,偶合常数为16.0 Hz,当烯烃的两个H处于反式时偶合常数一般为14.0以上,由此可知经过Claisen-Schmidt缩合反应得到的烯烃为反式烯烃。7.42和7.53分别是苯环上的氢且裂分为两重峰。另外,从质谱和元素分析数据可进一步确认其结构。
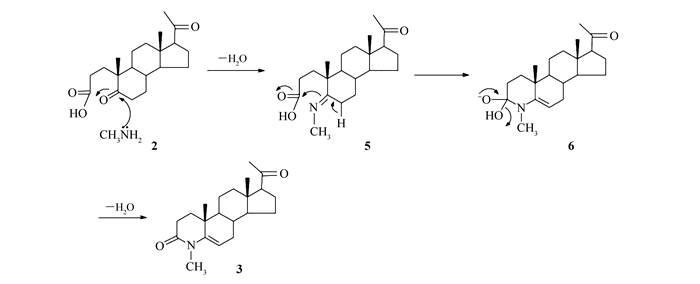
2.4 反应机理推测
由化合物2在甲胺醇溶液条件下关环合成化合物3的反应机理如Scheme 2所示。首先在室温下甲胺和化合物2中反应活性更强的5位羰基作用生成中间体亚胺5,之后5位C—H键迁移CN键电子云进攻3位羰基得过渡态6,氧负离子迁移高温脱水得目标产物3。
3 结论
以黄体酮为原料,经A环开环,在甲胺的作用下关环引入氮甲基,在KF/Al2O3的催化下取代的苯甲醛与化合物3合成4-甲基-4-氮杂-21E-取代苯亚甲基-5-孕烯-3, 20-二酮,产率56%~68%。苯环上的取代基不论是吸电子还是供电子基团对产率的影响不大。此方法后处理简单,产率较好,为4-氮杂甾体类苯亚基衍生物的合成提供了一种方便而有效的方法。
-
-
[1]
Dubey R K, Oparil S, Imthurn B. Sex Hormones and Hypertension[J]. Cardiovasc Res, 2002, 53(3): 688-708. doi: 10.1016/S0008-6363(01)00527-2
-
[2]
Takahashi M, Handa W, Umeta H. Aromatase in Activetion by 2-Substituted Derivatives of the Suide Substrate Androsta-1, 4-diene-3, 17-dione[J]. J Steroid Biochem Mol Biol, 2009, 116(3/4/5): 191-199.
-
[3]
吴学丹, 刘东志, 周雪琴. 3-羰基-4-氮杂-Δ5-雄甾烯-17-肟衍生物的合成及其抑制5α-还原酶活性研究[J]. 化学学报, 2009,67,(13): 1487-1491. doi: 10.3321/j.issn:0567-7351.2009.13.014WU Xuedan, LIU Dongzhi, ZHOU Xueqin. Synthesis and 5α-Reductase Inhibition Activity Evaluation of 3-Keto-4-aza-Δ5-androstene-17-oximido Derivatives[J]. Acta Chim Sin, 2009, 67(13): 1487-1491. doi: 10.3321/j.issn:0567-7351.2009.13.014
-
[4]
Latham K A, Zamora A, Drought H. Estradiol Treatment Redirects the Isotype of the Autoantibody Response and Prevents the Development of Autoimmune Arthritis[J]. J Immunol, 2003, 171(11): 5820-5827. doi: 10.4049/jimmunol.171.11.5820
-
[5]
Modzelewska A, Pettit C, Achanta G. Anticancer Activities of Novel Chalcone and Bis-chalcone Derivatives[J]. Bioorg Med Chem, 2006, 14(10): 3491-3495. doi: 10.1016/j.bmc.2006.01.003
-
[6]
Lawrence N J, Patterson R P, Ooi L L. Effects of Substitutions on Structure and Biological Activity of Anticancer Chalcones[J]. Bioorg Med Chem Lett, 2006, 16(22): 5844-5848. doi: 10.1016/j.bmcl.2006.08.065
-
[7]
Boeck P, Falca C A B, Leal P C. Synthesis of Chalcone Analogues with Increased Antileishmanial Activity[J]. Bioorg Med Chem, 2006, 14(5): 1538-1545. doi: 10.1016/j.bmc.2005.10.005
-
[8]
Yang H M, Shin H R, Cho S H. Structural Requirement of Chalcones for the Inhibitory Activity of Interleukin-5[J]. Bioorg Med Chem, 2007, 15(1): 104-111. doi: 10.1016/j.bmc.2006.10.007
-
[9]
Cheenpracha S, Karalai C, Ponglimanont C. Anti-HIV-1 Protease Activity of Compounds from Boesenbergia Pandurata[J]. Bioorg Med Chem, 2006, 14(6): 1710-1714. doi: 10.1016/j.bmc.2005.10.019
-
[10]
Guo H, Wu H T, Yang J. Synthesis, Characterization and Biological Evaluation of Some 16E-Arylidene Androstane Derivatives as Potential Anticancer Agents[J]. Steroids, 2011, 76(7): 709-723. doi: 10.1016/j.steroids.2011.03.015
-
[11]
Fan N J, Bai Y B, Zhang F Y. Synthesis and Cytotoxicity of Some Novel 21E-Benzylidene Steroidal Derivatives[J]. Steroids, 2013, 78(8): 874-879.
-
[12]
Banday A H, Zargar M I, Ganaie B A. Synthesis and Antimicrobial Studies of Chalconyl Pregnenolones[J]. Steroids, 2011, 76(12): 1358-1362. doi: 10.1016/j.steroids.2011.07.001
-
[13]
Mitchell H J, Danlmlich W P, Hartman G D. Design, Synthesis and Biological Evaluation of 16-Substituted 4-Azasteroids as Tissue-selective Androgen Receptor Modulators(SARMs)[J]. J Med Chem, 2009, 52(15): 4578-4581. doi: 10.1021/jm900880r
-
[14]
Bansal R, Guleria S. Synthesis of 16E-[3-Methoxy-4-(2-aminoethoxy)-benzylidene] Androstene Derivatives as Potent Cytotoxic Agents[J]. Steroids, 2008, 73(14): 1391-1399. doi: 10.1016/j.steroids.2008.07.004
-
[15]
Amr A E-G E, Abdel-Latif N A, Abdalla M M. Synthesis and Antiandrogenic Activity of Some New 3-Substituted Androstano[17, 16-C]-50-aryl-pyrazoline and Their Derivatives[J]. Bioorg Med Chem, 2006, 14(2): 373-384. doi: 10.1016/j.bmc.2005.08.024
-
[16]
Biass B E. KF/Al2O3 Mediated Organic Synthesis[J]. Tetrahedron, 2002, 58(46): 9301-9320. doi: 10.1016/S0040-4020(02)00992-4
-
[17]
Nakano Y, Niki S, Kinouchi S. Knoevenagel Reaction of Malononitrile with Acetone Followed by Double Cyclization Catalyzed by KF-Coated Alumina in Aqueous Solution[J]. Bull Chem Soc Jpn, 1992, 65(11): 2934-2939. doi: 10.1246/bcsj.65.2934
-
[1]
-
表 1 不同催化剂对化合物4a产率的影响
Table 1. Effect of different catalysts on the yield of compound 4a

表 2 不同KF/Al2O3与化合物3的摩尔比对化合物4a产率的影响a
Table 2. Effect of molar ratio of Al2O3/KF to compound 3 on the yield of compound 4a

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 406
- HTML全文浏览量: 31


 下载:
下载:

 下载:
下载:

