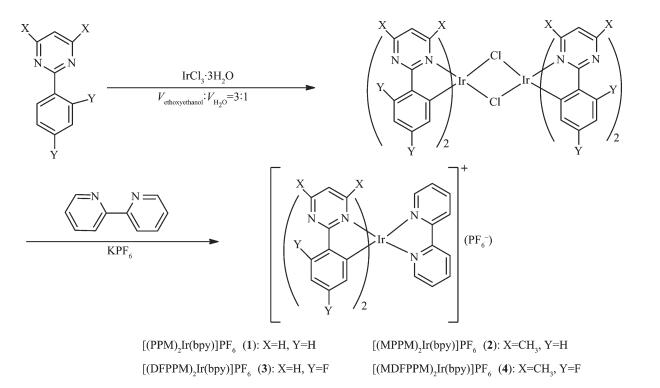
 图1
铱配合物的合成路线
Figure1.
Synthesis route of iridium(Ⅲ) complexes
图1
铱配合物的合成路线
Figure1.
Synthesis route of iridium(Ⅲ) complexes

Citation: WANG Ying, WEI Chuan-Dong, GE Guo-Ping, WANG Sui, LIANG Yun-Xiao. Syntheses, Crystal Structures and Photophysical Properties of Ionic Iridium(Ⅲ) Pyrimidine Complexes[J]. Chinese Journal of Inorganic Chemistry, 2018, 34(2): 346-352. doi: 10.11862/CJIC.2018.048

离子型嘧啶铱(Ⅲ)配合物的合成、晶体结构及发光性能
English
Syntheses, Crystal Structures and Photophysical Properties of Ionic Iridium(Ⅲ) Pyrimidine Complexes
-
Key words:
- ionic iridium(Ⅲ) complex
- / pyrimidine
- / phosphorescent material
- / OLED
-
近些年,铱配合物因其具有高的发光效率、良好的光热稳定性、良好的溶解性以及发光波长可调节等优点而成为电致发光领域研究的热点[1-3]。相对于中性铱配合物,离子型铱配合物具有合成简单、可采用惰性金属电极获得高性能器件和发光性质丰富等特点,可应用于发光电化学池(LECs)和有机发光二极管(OLED)中,用作新型显示或固态照明器件[4-5]。另外,中性铱配合物的激发态通常是MLCT态,寿命相对较短。但如果是离子型配合物,金属的电子云密度更低,更加难以被氧化,配合物的发射态相对复杂,3MLCT和3LC都有可能,在某些配合物中还可以观察到双发射现象并且寿命也较长[6]。Güdel等在早期就已经将这类现象归为3MLCT和3LC二者混合的激发态[7-8]。Lo和Neve等也对此进行了深入的研究[9]。很多研究证明,配体的结构对铱(Ⅲ)配合物的分子前线轨道分布等性质影响很大,从而影响铱(Ⅲ)配合物的发光颜色和发光强度[10]。二嗪类铱配合物由于双氮原子的影响,在改进发光性质以及配合物的稳定性等方面有一定作用[11]。目前,文献已报道了一系列性能优良的基于二嗪铱配合物的磷光材料[12-17],但这些二嗪铱配合物主要是中性铱配合物,离子型二嗪铱配合物相对较少。为了得到性能优良的基于二嗪配体的离子铱配合物,本文以嘧啶类化合物为环金属配体,2,2′-联吡啶为副配体成功制备了一系列离子型二嗪铱配合物,并对其发光性能进行了研究。
1 实验部分
1.1 试剂
2-氯嘧啶(分析纯,金坛市合恩泰化工有限公司);2-氯-4,6-二甲基嘧啶(分析纯,金坛市合恩泰化工有限公司);苯基硼酸(分析纯,宁波应发硼纳有限公司);2,4-二氟苯基硼酸(分析纯,宁波应发硼纳有限公司);三苯基膦(分析纯,国药集团化学试剂有限公司);醋酸钯(wPd≥47.4%,西安凯立化工有限公司);IrCl3·3H2O(wIr≥54%,西安凯立化工有限公司);乙二醇乙醚(分析纯,国药集团化学试剂有限公司);六氟磷酸钾(99%,阿拉丁试剂(上海)有限公司);2,2′-联吡啶(分析纯,国药集团化学试剂有限公司);其他试剂均为市售分析纯,没有经过进一步的提纯。
1.2 仪器
BRUKER Ac-400型超导核磁共振仪;Bruker APEX-Ⅱ CCD型X射线衍射仪;上海振华CHI600A电化学工作站;Shimadzu UV-2550型紫外-可见光谱仪;日立F-4600荧光分光光度计;Bruker BIFLEX Ⅲ MALDI-TOF质谱仪。
1.3 离子型环金属铱配合物的合成
按文献[17]方法合成4种环金属配体。离子型铱配合物的合成按照文献的方法制备[18]。合成路径如图 1所示:第一步是主配体与三氯化铱反应生成二聚体,该中间体无需纯化可直接用于下步反应;第二步是二聚体被副配体联吡啶解离,通过KPF6离子交换掉氯离子后降低了配合物的水溶性从而方便提纯,这个过程也同时大大增强了配合物的发光强度[19]。尽管IrCl3·3H2O或任何其它Ir(Ⅲ)化合物具有空气稳定性,但是考虑到它们在高温反应条件下中间体的氧化稳定性,涉及IrCl3·3H2O或任何其它Ir(Ⅲ)化合物的全部反应都在惰性气体氛围中进行[1]。
称取0.35 g(1 mmol) IrCl3·3H2O和0.34 g(2.2 mmol) PPM于50 mL反应瓶中,加入10 mL乙二醇单乙醚和3 mL水,在氮气保护下回流24 h,反应液冷却到室温,过滤,滤渣依次用水、乙醇、丙酮洗涤,真空干燥得墨绿色铱二聚体中间体0.54 g。
称取0.17 g(0.16 mmol)[(PPM)2IrCl]2、0.05 g(0.32 mmol) 2,2′-联吡啶于50 mL反应瓶中,加入16 mL二氯甲烷和16 mL甲醇。氮气保护下78 ℃回流4 h,冷却至室温后加入六氟磷酸钾(5倍物质的量)水溶液,继续室温下搅拌1 h,蒸除溶剂,所得固体用二氯甲烷溶解过滤,滤液旋蒸去除溶剂得固体。粗产品用硅胶柱层析分离,洗脱剂为二氯甲烷和甲醇混合溶剂(10:1,V/V),得0.23 g黄色固体[(PPM)2Ir(bpy)]PF6 (1),收率92%。其他离子型铱配合物的合成方法与1类似。MS(MALDI-TOF)(m/z):659.1[(PPM)2Ir(bpy)]+;1H NMR(400 MHz,CDCl3):δ 5.30(m,4H),5.87(m,2H),6.59(m,2H),6.80(m,2H),7.18(m,2H),7.48(m,2H),8.05(d,J=4.74 Hz,2H),8.16(m,2H),8.69(m,2H)。
[(MPPM)2Ir(bpy)]PF6 (2):黄色固体0.152 1 g, 收率90%。MS(MALDI-TOF)(m/z):715.2[(MPPM)2Ir(bpy)]+;1H NMR(400 MHz,CDCl3):δ 1.68(s,6H),2.62(s,6H),6.42(d,J=7.2 Hz,2H),6.76(s,2H),6.99~6.95(dd,J=1.50 Hz、7.50 Hz,2H),7.12(m,2H),7.39(m,2H),7.96(dd,J=0.9 Hz、5.46 Hz,2H),8.10(m,2H),8.20(dd,J=1.20 Hz、7.76 Hz,2H),8.52(dd,J=8.16 Hz,2H)。
[(DFPPM)2Ir(bpy)]PF6 (3):淡黄色固体0.14 g, 收率92%。MS(MALDI-TOF)(m/z):731.1[(DFPPM)2Ir(bpy)]+;1H NMR(400 MHz,DMSO-d6):δ 5.83(dd,J=8.26、2.22Hz,2H),6.97(m,2H),6.99(m,2H),7.30(m,2H),7.73(dd,J=7.16,5.88 Hz,2H),7.97(dd,J=2.12,6.00 Hz,2H),8.33(t,J=7.88 Hz,2H),8.89(d,J=8.2 Hz,2H), 8.97(dd,J=4.64,1.88 Hz,2H)。
[(MDFPPM)2Ir(bpy)]PF6 (4):黄绿色固体0.303 5 g, 收率89%。MS(MALDI-TOF)(m/z):787.2[(MDFPPM)2 Ir(bpy)]+;1HNMR(400 MHz,DMSO-d6):δ 1.641(s,6H),2.569(s, 6H), 5.93(dd,J=7.52, 2.32 Hz,2H),6.98(m, 2H),7.18(s,2H),7.72(m,2H),8.06(dd,J=4.68 Hz,2H),8.27(m,2H),8.80(d,J=8.12 Hz,2H)。
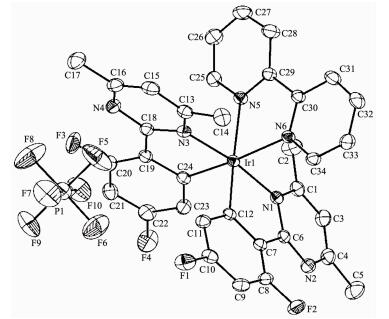
1.4 配合物的单晶X射线结构分析
配合物4的单晶是通过缓慢挥发二氯甲烷和甲醇混合溶液(4:1,V/V)得到的。选取大小为0.45 mm×0.3 mm×0.23 mm的单晶,在室温下用经石墨单色化的Mo Kα射线(λ=0.071 073 nm)作为辐射光源,由Bruker APEX-Ⅱ CCD X射线单晶衍射仪收集衍射数据。全部数据经过吸收校正,用SHELXS-97程序完成结构解析[20],SHELXL-97程序完成结构精修[21]。对于所有非氢原子采用各向异性和全矩阵最小二乘法进行修正。配合物的晶体学数据列于表 1,主要键长和键角列于表 2。
Formula C34H26F10IrN6P Z 4 Formula weight 931.78 Dc / (g·cm-3) 1.82 T/K 296.15 F(000) 1816 Crystal system Monoclinic μ/ mm-1 4.065 Space group P21/c θ range / (°) 1.89~25.35 a / nm 1.441 03(12) Reflection collected 34 912 b/ nm 1.414 89(12) Unique reflection 6 218 c / nm 1.678 29(14) Final R indexes [I/ > 2%(I)] R1=0.018 4, wR2=0.044 4 β/(°) 96.467 0(10) R indexes (all data) R1=0.021 4, wR2=0.046 5 V / nm3 3.400 1(5) GOF on F2 1.093 Irl-Nl 0.208 7(2) Irl-N5 0.2l7 7(2) Irl-Cl2 0.200 5(3) Irl-N3 0.208 6(2) Irl-N6 0.2l5 5(2) Irl-C24 0.20l l(3) N3-Irl-Nl l7l.95(8) Nl-Irl-N5 l05.89(9) Nl-Irl-N6 85.45(8) Cl2-Irl-Nl 79.87(l0) Cl2-Irl-N3 95.07(l0) C24-Irl-Nl 93.88(l0) CCDC:1585309,4。
2 结果与讨论
2.1 晶体结构
图 2给出了配合物4的分子结构。其晶体属于单斜晶系,空间群为P21/c。配合物4的单晶结构呈现出扭曲的八面体构型,配位原子中2个来自环金属配体的碳原子采取顺式构象,而2个来自环金属配体的氮原子采取反式构象,另外2个配位的氮原子来自于副配体bpy的贡献。由于副配体bpy是中性配体,因此配位之后的Ir中心部分带正电,而负电荷则由外界的PF6-提供,从而使得整个分子呈电中性。通过主要键长的比较,可以看出铱(Ⅲ)与2个环金属配体的配位模式是基本一致的。比较不同的Ir-N键长,Ir(Ⅲ)与环金属配体MDFPPM配位的Ir-N键长分别为0.208 7(2)和0.208 6(2)nm,Ir(Ⅲ)与副配体bpy配位的Ir-N键长分别为0.217 7(2)和0.215 5(2)nm。这与文献[22-26]报道的类似,由于Ir-C键具有强的反位效应,Ir-N(N^N配体)键长比Ir-N(C^N配体)键长要长。
2.2 配合物的光物理性质
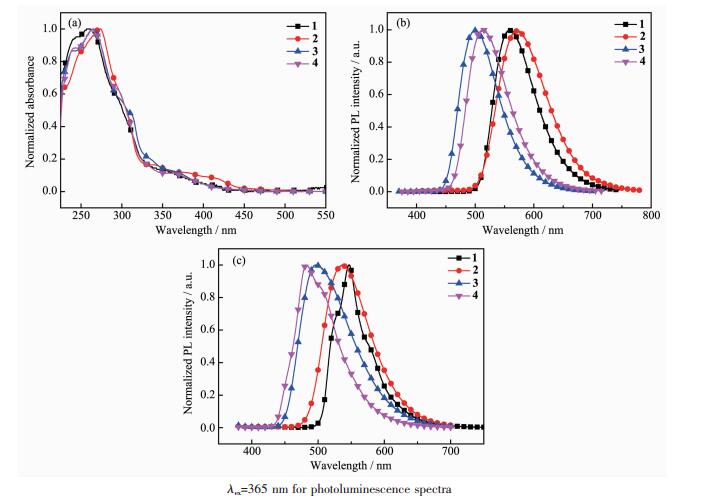
制备的4种配合物的UV-Vis吸收和发射光谱如图 3所示,从图 3(a)可以看出,4种铱配合物的紫外-可见吸收光谱比较相似,配合物在230~350 nm都有较强的多重吸收带,该吸收带源自于配体自旋允许的1LC(1π→π*)的跃迁。350~490 nm较弱的吸收带来源于1MLCT(金属到配体的电荷转移),1LLCT(配体-配体电荷转移),3MLCT,3LLCT和配体本身的3π→π*跃迁。由于铱的重原子效应,原来自旋禁阻的3MLCT,3LLCT和3π→π*跃迁变得部分允许[27],在吸收光谱中表现出一定的强度。
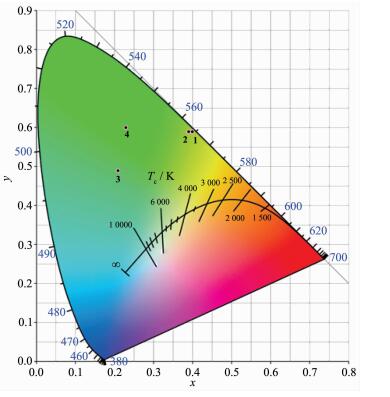
图 3(b)和图 3(c)分别为铱配合物在溶液和固态下的发射光谱图。从图中可以看出溶液状态下配合物1,2,3,4的最大发射波长分别在561、572、501、513 nm,CIE(x,y)色度坐标分别为(0.40,0.59)、(0.39,0.59)、(0.21,0.49)和(0.23,0.60)(图 4),而在固体粉末状态,配合物1,2,3,4的最大发射波长分别在552、545、500、490 nm,有一定的蓝移,这可能是在固态下,分子堆积限制了分子的转动或振动;而在溶液中由于分子的转动或振动更容易导致能量耗散一部分,从而表现出低能量的长波长发射。3和4相对于1和2有一定的蓝移,原因是:铱配合物的最高占据轨道(HOMO)主要定域于金属Ir(Ⅲ)和环金属配体的苯环上,在苯环上引入强吸电子的氟原子,会使HOMO能级降低,从而升高配合物的能级,使发射波长蓝移。
以硫酸奎宁在激发波长313 nm的荧光量子产率0.55为标准[28],测得配合物在溶液状态下的发光量子产率,列于表 3,可以看出配合物的量子产率差别较大,以2-苯基嘧啶为主配体的铱配合物1的量子产率最高为64.0%,以4,6-二甲基-2-苯基嘧啶为主配体的铱配合物2的量子产率最低为6.7%,可能是由于甲基的引入降低了配合物的刚性。同样的,相对于无甲基的配合物3(量子产率为24.7%),主配体中有甲基的配合物4也有相对较低的量子产率(10.0%)。
Complex λem(CH2Cl2) / nm λem(solid) / nm EQEa / % CIE(x, y)(CH2Cl2) 1 561 552 64.0 (0.40, 0.59) 2 572 545 6.7 (0.39, 0.59) 3 501 500 24.7 (0.21, 0.49) 4 513 490 10.0 (0.23, 0.60) a Reference: 1 mol·L-1 quinole sulfate solution in sulfuric acid with quantum yield of 0.55 2.3 配合物的理论计算
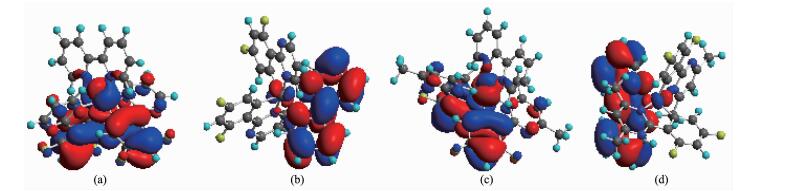
基于配合物的单晶结构,优化了配合物3和4的基态构型,并计算得到它们的分子轨道分布,如图 5所示。与其他离子型铱配合物类似[29-30],3和4的最高占据轨道(HOMO)主要定域于金属Ir(Ⅲ)和环金属配体的苯环上,最低未占有轨道(LUMO)主要定域于副配体bpy上。因此配合物的发光类型除了有MLCT跃迁之外,还有配体-配体的电荷跃迁(LLCT)。配合物3和4的氧化过程主要是Ir的d轨道和苯环的π轨道失电子的过程,其还原过程是嘧啶环的π*轨道得电子的过程。理论计算得到的配合物3的HOMO和LUMO能级分别为-8.45和-5.44 eV, Eg为3.03 eV; 配合物4的HOMO和LUMO能级分别为-8.24和-5.23 eV,Eg为3.01 eV。
3 结论
以嘧啶类化合物为环金属配体,2,2′-联吡啶为副配体合成了4个离子型环金属铱配合物。利用X射线单晶衍射仪测定了配合物4的晶体结构,晶体属于单斜晶系,空间群为P21/c。理论计算结果表明3和4的最高占据轨道(HOMO)定域于金属Ir(Ⅲ)和环金属配体的苯环上,最低未占有轨道(LUMO)主要定域于副配体bpy上,说明配合物的发光类型除了有MLCT跃迁之外,还有配体-配体的电荷跃迁(LLCT)。配合物在溶液状态下为绿光发射,波长在513~561 nm之间,量子效率在6.7%~64.0%之间,有作为有机电致发光材料的潜力。
-
-
[1]
Lamansky S, Djurovich P, Murphy D, et al. J. Am. Chem. Soc., 2001, 123(18):4304-4312 doi: 10.1021/ja003693s
-
[2]
Qin T S, Ding J Q, Wing L X, et al. J. Am. Chem. Soc., 2009, 131(40):14329-14336 doi: 10.1021/ja905118t
-
[3]
Ding J Q, Wang B, Yue Z Y, et al. Angew. Chem. Int. Ed., 2009, 48(36):6664-6666 doi: 10.1002/anie.v48:36
-
[4]
Plummer E A, Dijken A V, Hofstraat J W, et al. Adv. Funct. Mater., 2005, 15(2):281-289 doi: 10.1002/(ISSN)1616-3028
-
[5]
Slinker J D, Koh C Y, Malliaras G G, et al. Appl. Phys. Lett., 2005, 86(17):173506 doi: 10.1063/1.1919387
-
[6]
King K A, Watts R J. J. Am. Chem. Soc., 1987, 109(5):1589-1590 doi: 10.1021/ja00239a060
-
[7]
Colombo M G, Hauser A, Gudel H U. Inorg. Chem., 1993, 32(14):3088-3092 doi: 10.1021/ic00066a020
-
[8]
Colombo M G, Gudel H U. Inorg. Chem., 1993, 32(14):3081-3087 doi: 10.1021/ic00066a019
-
[9]
Neve F, Deda M L, Crispini A, et al. Organometalics, 2004, 23(24):5856-5863 doi: 10.1021/om049493x
-
[10]
Lowry M S, Bernhard S. Chem. Eur. J., 2006, 12(31):7970-7977 doi: 10.1002/(ISSN)1521-3765
-
[11]
梅群波, 翁洁娜, 童碧海, 等.物理化学学报, 2014, 30(4):589-607 doi: 10.3866/PKU.WHXB201402182MEI Qun-Bo, WENG Jie-Na, TONG Bi-Hai, et al. Acta Phys.-Chim. Sin., 2014, 30(4):589-607 doi: 10.3866/PKU.WHXB201402182
-
[12]
Duan J P, Sun P P, Cheng C H. Adv Mater., 2003, 15(3):224-228 doi: 10.1002/adma.200390051
-
[13]
张国林, 刘泽华, 郭海清, 等.高等学校化学学报, 2004, 25(3):397-400ZHANG Guo-Lin, LIU Ze-Hua, GUO Hai-Qing, et al. Chem. J. Chininese Universities, 2004, 25(3):397-400
-
[14]
张国林, 刘泽华, 郭海清, 等.物理化学学报, 2003, 19(10):889-891 doi: 10.3866/PKU.WHXB20031001ZHANG Guo-Lin, LIU Ze-Hua, GUO Hai-Qing, et al. Acta Phys.-Chim. Sin., 2003, 19(10):889-891 doi: 10.3866/PKU.WHXB20031001
-
[15]
Song Y H, Yeh S J, Chen C T, et al. Adv. Funct. Mater., 2004, 14(12):1221-1226 doi: 10.1002/(ISSN)1616-3028
-
[16]
Ge G P, Zhang G L, Guo H Q, et al. Inorg. Chim. Acta, 2009, 362(7):2231-2236 doi: 10.1016/j.ica.2008.10.001
-
[17]
Ge G P, He J, Guo H Q, et al. J. Organomet. Chem., 2009, 694(19):3050-3057 doi: 10.1016/j.jorganchem.2009.05.037
-
[18]
Zhao Q, Li F Y, Liu S J, et al. Inorg. Chem., 2008, 47(20):9256-9264 doi: 10.1021/ic800500c
-
[19]
童碧海, 梅群波, 李志文, 等.化学学报, 2012, 70(23):2451-2456TONG Bi-Hai, MEI Qun-Bo, LI Zhi-Wen, et al. Acta Chim. Sinica, 2012, 70(23):2451-2456
-
[20]
Sheldrick G M. SHELXL-97, Program for X-ray Crystal Structure Solution, University of Göttingen, Germany, 1997.
-
[21]
Sheldrick G M. SHELXL-97, Program for X-ray Crystal Structure Refinement, University of Göttingen, Germany, 1997.
-
[22]
Stagni S, Colella S, Palazzi A, et al. Inorg. Chem., 2008, 47(22):10509-10521 doi: 10.1021/ic801157k
-
[23]
Zhao Q, Liu S J, Shi M, et al. Inorg. Chem., 2006, 45(16):6152-6160 doi: 10.1021/ic052034j
-
[24]
Tamayo A B, Garon S, Sajoto T, et al. Inorg. Chem., 2005, 44(24):8723-8732 doi: 10.1021/ic050970t
-
[25]
Huang Y Q, Wang Y H, Zhao Y, et al. Inorg. Chim. Acta, 2013, 394:164-170 doi: 10.1016/j.ica.2012.07.010
-
[26]
Xu Q, Xiong W, Wang Q Q, et al. Chin. J. Struct. Chem., 2012, 31(10):1423-1428
-
[27]
Sprouse S, King K A, Spellane P J, et al. J. Am. Chem. Soc., 1984, 106(22):6647-6653 doi: 10.1021/ja00334a031
-
[28]
Liu Y, Liu M S, Jen A K Y. Acta Polym., 1999, 50(2/3):105-108
-
[29]
Lowry M S, Goldsmith J I, Slinker J D, et al. Chem. Mater., 2005, 17(23):5712-5719 doi: 10.1021/cm051312+
-
[30]
Terki R, Simoneau L P, Rochefort A. J. Phys. Chem. A, 2009, 113(3):534-541 doi: 10.1021/jp8086286
-
[1]
-
表 1 配合物4的晶体学数据
Table 1. Crystallographic data for complex 4
Formula C34H26F10IrN6P Z 4 Formula weight 931.78 Dc / (g·cm-3) 1.82 T/K 296.15 F(000) 1816 Crystal system Monoclinic μ/ mm-1 4.065 Space group P21/c θ range / (°) 1.89~25.35 a / nm 1.441 03(12) Reflection collected 34 912 b/ nm 1.414 89(12) Unique reflection 6 218 c / nm 1.678 29(14) Final R indexes [I/ > 2%(I)] R1=0.018 4, wR2=0.044 4 β/(°) 96.467 0(10) R indexes (all data) R1=0.021 4, wR2=0.046 5 V / nm3 3.400 1(5) GOF on F2 1.093 表 2 配合物4的主要的键长(nm)和键角(°)
Table 2. Selected bond lengths (nm) and angles (°) for complex 4
Irl-Nl 0.208 7(2) Irl-N5 0.2l7 7(2) Irl-Cl2 0.200 5(3) Irl-N3 0.208 6(2) Irl-N6 0.2l5 5(2) Irl-C24 0.20l l(3) N3-Irl-Nl l7l.95(8) Nl-Irl-N5 l05.89(9) Nl-Irl-N6 85.45(8) Cl2-Irl-Nl 79.87(l0) Cl2-Irl-N3 95.07(l0) C24-Irl-Nl 93.88(l0) 表 3 铱配合物的光物理性质
Table 3. Photophysical properties of iridium(Ⅲ) complexes
Complex λem(CH2Cl2) / nm λem(solid) / nm EQEa / % CIE(x, y)(CH2Cl2) 1 561 552 64.0 (0.40, 0.59) 2 572 545 6.7 (0.39, 0.59) 3 501 500 24.7 (0.21, 0.49) 4 513 490 10.0 (0.23, 0.60) a Reference: 1 mol·L-1 quinole sulfate solution in sulfuric acid with quantum yield of 0.55 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1484
- HTML全文浏览量: 314


 下载:
下载:




 下载:
下载:

