 图 1
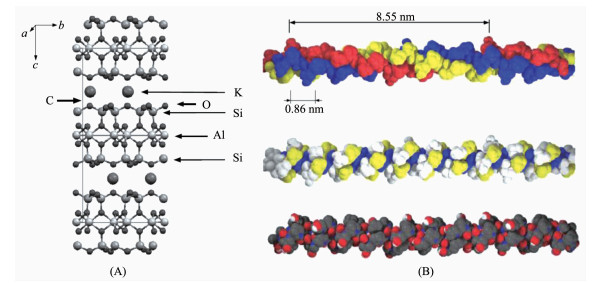
(A) 云母 (2M1 muscovite) 的二层晶体结构图; (B) 以 (Gly-Pro-Hyp)n为模型的胶原蛋白单体分子结构
Figure 1.
(A) Structure of mica (2M1 muscovite) two-layer unit cell; (B) Collagen monomer model (Gly-Pro-Hyp)n
图 1
(A) 云母 (2M1 muscovite) 的二层晶体结构图; (B) 以 (Gly-Pro-Hyp)n为模型的胶原蛋白单体分子结构
Figure 1.
(A) Structure of mica (2M1 muscovite) two-layer unit cell; (B) Collagen monomer model (Gly-Pro-Hyp)n

Citation: Li LI, ZHANG Lei, YANG De-Liang, SUN Ming, ZENG Fan-Xi, GU Wen-Hua. Creating Collagen Nanowire Arrays by 'Bottom-Up' and 'Top-Down' Approaches on Mica Lattice Planes[J]. Chinese Journal of Inorganic Chemistry, 2017, 33(5): 745-752. doi: 10.11862/CJIC.2017.100

在云母晶面上应用“自下而上”和“自上而下”两种途径制造胶原蛋白纳米线阵列
English
Creating Collagen Nanowire Arrays by 'Bottom-Up' and 'Top-Down' Approaches on Mica Lattice Planes
-
纳米科技的兴起颠覆了人们对传统材料的认识观,吸引了大量科学家在介观尺度上的基础研究,各种新型材料不断地被开发出来[1-2]。在介观尺度上,设计并合成新型的结构材料具有重要的理论与应用意义。以超材料为例,这是一类具有规则重复结构的人工复合材料,主要取决于其结构而不是其组成材料的本征特性,超材料能获得自然界天然物质所不具备的超常理化性质,譬如负折射率等[3-6]。由于超材料的基元结构与电磁波波长要适度匹配,为将其应用延伸到短波段领域,构造介观尺度上的基元结构至关重要[7]。在众多的制备方法中,在无机晶体表面利用大分子的自组装能力实现“自下而上”的结构合成和利用扫描探针的加工能力对样品进行“自上而下”的操控是两种重要的纳米结构材料的制备技术。一方面,结合众多不同微观结构的无机晶体基质选择以及有机化学带来的尺寸与功能可调的分子合成技术,在超高真空背景下利用分子束沉积技术,或在液相中利用外延生长原理在基质表面控制有机分子膜层晶体“自下而上”(bottom-up) 的有序生长为获得功能可预测的微纳光电材料与器件开启了大门[8-14]。而在另一方面,自从人类首次实验操控单个原子以来[15-16],扫描探针显微镜利用“自上而下”(top-down) 的微观材料加工工艺,并通过融合其他领域的诸如譬如微接触印刷和纳米模板印刷技术,已经能够快速地在基质表面形成具有规则排列的大分子阵列[17-19],这为制造有规则微纳基元结构的超材料提供了可能。对于生物大分子,该类技术还能保留原料的生物活性,这为制备高特异性的生物探针和生物芯片,合成新型微纳生物材料提供了一种极为有效的方法。
最近,我们发展了2种新型纳米线阵列的合成技术,所有制备操作均在室温下进行,无需净室或真空环境:(1) 在电荷周期性分布的无机晶体表面利用具有自组装能力的生物大分子通过液相外延生长“自下而上”地合成纳米线阵列的“反相生物矿化”技术;(2) 利用原子力显微镜 (AFM) 探针“自上而下”地将吸附在无机晶体表面的生物大分子膜层加工成纳米纤维阵列的“分子扫帚”技术[20]。
本文以云母 (mica,2M1 muscovite) 的 (001) 晶面为基质,以天然Ⅰ型鼠尾胶原蛋白单体为原料,同时考察了上述“自下而上”和“自上而下”的纳米线阵列的制备过程。基质云母 (mica,2M1 muscovite) 组成大致为{KAl2(AlSi3O10)(OH)2},属于单斜晶系 (a=0.529 06 nm,b=0.900 80 nm,c=2.004 70 nm,β=95.757°)[21-23]。如图 1(A)所示,在每个单层里,中心的Al与O以八面体结构组合并被表面的Si/O层包夹,而Si/O以四面体结构连接形成六边形的氧离子空洞来容纳层间的K离子。
 图 1
(A) 云母 (2M1 muscovite) 的二层晶体结构图; (B) 以 (Gly-Pro-Hyp)n为模型的胶原蛋白单体分子结构
Figure 1.
(A) Structure of mica (2M1 muscovite) two-layer unit cell; (B) Collagen monomer model (Gly-Pro-Hyp)n
图 1
(A) 云母 (2M1 muscovite) 的二层晶体结构图; (B) 以 (Gly-Pro-Hyp)n为模型的胶原蛋白单体分子结构
Figure 1.
(A) Structure of mica (2M1 muscovite) two-layer unit cell; (B) Collagen monomer model (Gly-Pro-Hyp)n
胶原蛋白是一类构成所有多细胞生物结缔组织的主要组成成分的蛋白质的总称。作为最重要的细胞外基质蛋白,胶原蛋白单体能自组装成胶原纤维来构架并支撑几乎所有无脊椎动物与脊椎动物的组织器官[24-26]。以最常见的Ⅰ型胶原蛋白为例,成纤维细胞最初合成的前胶原是由3股左手螺旋的α肽链在中部绞缠形成的右手超螺旋结构。α肽链具有重复的 (Gly-X-Y)n结构,常见的有 (Gly-Pro-Hyp)n。前胶原分泌到细胞外基质中后被内切酶切去C-末端与N-末端的球形结构而成为原胶原。这个绳状的超螺旋分子正是组成胶原纤维的蛋白单体,长约300 nm,直径约1.5 nm。每股螺旋由稍多于1000个氨基酸残基组成,相对分子量约为95 000。图 1(B)显示了以 (Gly-Pro-Hyp)n为模型的原胶原超螺旋分子结构。尽管原胶原单股螺旋的周期为8.55 nm,但超螺旋结构沿轴向的残基与电荷分布周期约为0.86 nm。在末端端肽的引导下,原胶原单体会互相错开平行排列自组装成细长的原纤维。在正常的生物矿化过程中,羟磷灰石,Ca10(PO4)6(OH)2会首先在纤维的特定位点结晶,并逐渐生长成带状小块,最后形成高度有序的交错结构。这种规范化的生物矿化之所以能顺利进行是由于矿物质晶体与胶原蛋白纤维骨架在介观尺度上均有规则的重复结构,通过诸多的静电作用,蛋白纤维与矿物质晶体能够互相识别从而有效地规范矿物质晶体生长。
1 实验部分
1.1 试剂与仪器
胶原蛋白单体 (Rat tail tendon collagen type Ⅰ,5 mg·mL-1,溶解于6 mmol·L-1的乙酸) 购自北京索莱宝科技有限公司。云母基片 (mica,2M1 muscovite) 与载玻片购自北京中镜科仪技术有限公司。胶带购自3M公司。实验室自制去离子水,室温电阻率约18 MΩ·cm。
原子力显微镜 (AFM:Bruker AXS,Dimension Icon) 与探针 (镀金和铬的硅材质,悬臂与针尖的力常数均为4.5 N·m-1,针尖高0.02 mm,锥角30°,曲率半径50 nm) 购自德国Bruker公司。聚焦离子束场发射扫描双束电镜 (SEM:Auriga FIB,配3D背散射电子取向成像系统,空间分辨率50 nm) 购自德国Zeiss公司。高分辨透射电镜 (TEM:FEI Tecnai G2 20 LaB6) 购自美国FEI公司。透射/反射光谱仪,扫描范围350~1 100 nm,扫描步长为5 nm,为实验室自制。
1.2 纳米线阵列的制备与表征
纳米线阵列制备的基本步骤为:(1) 以去离子水或磷酸盐缓冲液为溶剂配制特定浓度的天然Ⅰ型鼠尾胶原蛋白单体溶液;(2) 用透明胶带撕开新鲜的云母 (001) 晶面后,立刻滴上胶原蛋白单体溶液覆盖晶面约15 min;(3) 除去云母晶面上的蛋白质溶液后,用无蛋白的溶剂小心清洗晶面1~2次以除去吸附不牢的蛋白质;(4) “自下而上”的自组装:用无蛋白的磷酸盐缓冲溶液覆盖云母晶面培育12 h左右后即可进行表征;“自上而下”探针加工:无需培育,用去离子水覆盖云母晶面即可进行加工与表征。“自下而上”的纳米线自组装所用溶剂为pH=7.5的Na2HPO4/NaH2PO4缓冲溶液,“自上而下”的纳米线加工所用溶剂为去离子水。
在AFM接触模式 (contact mode) 下,探针在溶液中“自上而下”地进行纳米线加工。AFM轻敲模式 (tapping mode) 用于对样品进行表征:探针振幅约100 nm,驱动频率约8 kHz,接近探针悬臂在溶液中的共振频率。电子衍射实验:(1) 在TEM模式下检测到烘干样品的胶原蛋白纳米线结构之后,切换到NBD (nano-beam electron diffraction) 模式对定点获取电子衍射花样,然后进行标定分析;(2) SEM/EBSD实验前,对烘干样品表面进行镀金处理, 厚度为5 nm,EBSD实验设置加速电压为20 kV,工作距离为13 mm。透射实验:先将没有镀膜的干净基片放置于样品池做基线扫描,然后换成镀了薄膜的基片进行光谱扫描,从而得到透射光谱。
2 结果与讨论
2.1 AFM实验结果
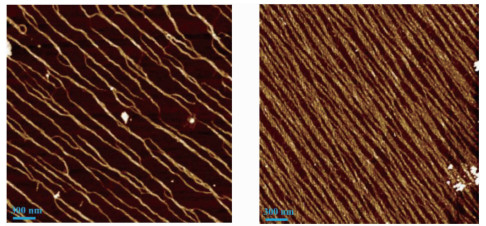
本实验分别配制了不同浓度的Ⅰ型鼠尾胶原蛋白单体溶液进行纳米线“自下而上”的的自组装。图 2显示的是胶原蛋白单体在云母 (001) 晶面上“自下而上”自组装形成的纳米线阵列的AFM图。缓冲溶液均为pH=7.5的Na2HPO4/NaH2PO4溶液,其中 (A) 图的胶原蛋白单体浓度为5 μg·mL-1,(B) 图的胶原蛋白单体浓度为10 μg·mL-1。很显然,阵列中的纳米线随胶原蛋白单体浓度增大而变得更加致密,单条纳米线更长,且纳米线之间的交联逐渐显著。测量结果表明,由不同浓度的胶原蛋白单体溶液培育出的单条纳米线的宽度与高度较为稳定,宽度约60 nm,高度约1.5 nm。
图 3是利用AFM探针在接触模式下“自上而下”制造蛋白纳米纤维的过程。蛋白单体稀释于去离子水中,浓度50 μg·mL-1。运用AFM轻敲模式对覆盖蛋白膜层的云母表面不同位置进行表征,如图 3(A)所示,未发现图 2或文献报道的自组装而成的胶原蛋白纤维阵列[27-28],这可能是单体浓度较大,蛋白质覆盖较厚所致。另外,未使用文献中的缓冲溶液也可能抑制成纤。然而在AFM接触模式下对同一区域进行2次同样的扫描,接着使用轻敲模式进行表征,得到如图 3(B)所示的胶原蛋白纳米纤维阵列图[20]。接触模式的行扫描方向平行于探针悬臂方向 (图中用箭头标出),探针作用力设置为1×10-7 N。图中单根胶原蛋白纳米纤维呈反复弯曲状,但整个纳米纤维阵列的取向较为一致,大致垂直于接触模式的探针行扫描方向。数据分析结果显示,单根蛋白纳米纤维的长度从几百纳米到几微米不等,平均高度约2 nm,宽度约150 nm,阵列中纳米纤维间距并不均匀,从互相接触到几百纳米不等。接触模式下对同一区域进行2次同样的扫描便可以得到排列规则的蛋白纳米纤维阵列,2次以上扫描对单根纳米纤维有显著改变,但对纳米纤维阵列的整体形貌影响不大。
2.2 “自下而上”的合成机理
生物矿化是动物世界普遍存在的现象。如前所述,矿物质在蛋白纤维的特定位点结晶,并逐渐生长最后形成高度有序的交错结构。这种规范化的矿化之所以能顺利进行是由于矿物质晶体与胶原蛋白纤维骨架在介观尺度上均有规则的重复结构,通过诸多静电作用,蛋白纤维与矿物晶体能够互相识别从而有效地规范矿物晶体的生长。在另一方面,利用生物大分子与矿物质在界面的相互识别也能在矿物晶体表面来调控大分子的自组装及成纤过程[27-29],我们把这种生物大分子的外延生长现象称为“反相生物矿化”。
随化学气相沉积 (CVD) 等真空外延技术发展起来的外延生长理论认为,两个因素将决定外延晶体的结构:晶体界面上两种物质分子间的结合力 (化学键、静电力、范德华力等) 以及界面上的晶格匹配度[8-9]。在CVD操作的真空环境下, 有机分子在无机晶体表面的外延生长仅受控于较弱的静电力与范德华力, 因此有机分子可在加热的基质表面漂移。尽管两种物质的晶格并不匹配, 但基质表面的电荷分布仍能对有机分子的取向起到规范作用。这样,取向被规范的有机分子单体在基质晶面上漂移时便碰撞结合形成晶种, 并生长成更大的二维晶体, 甚至形成有特定取向的纳米线阵列[13-14]。本实验中培养胶原蛋白纳米线的液相环境稍显复杂, 在界面上除了云母晶面与吸附在晶面上的胶原蛋白单体的结合力外,另一个重要的作用力就是水分子与云母晶面上单层蛋白单体之间的熵力 (entropy force), 可在常温下推动蛋白单体在云母晶面上漂移, 从而有助于胶原蛋白自组装生成纳米线纤维。由于纳米线的形成是单体分子在二维晶面上侧向结合所致, 因此在一定的单体浓度范围内, 纳米线有恒定高度和宽度。
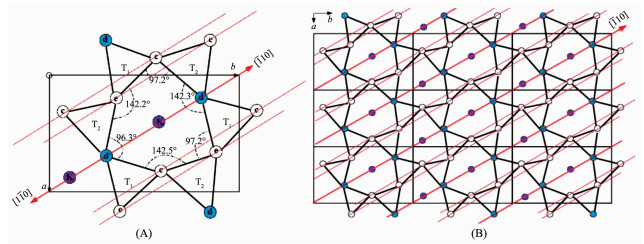
本实验所用的单斜矿物晶体云母 (mica,2M1 muscovite) 的晶胞是互成120°的双层结构[21-23],因此云母片可以层层撕开而露出与前一层原子排列成120°的崭新晶面。如图 4所示,在每个单层里,中心的Al与O以八面体结构组合并被表面的Si/O层包夹。(001) 晶面的Si/O以四面体结构连接形成六边形的氧离子空洞来容纳层间的K离子。由于Si/O四面体结构的变形导致一部分氧离子凹陷下去0.022 nm,使得氧离子空洞成不规则六边形,并在整个晶面上形成图 4所示沿[110]方向,与[001]晶轴成60°的带负电狭长凹槽,这也是 (001) 晶面上电荷分布的二次对称轴。该对称轴使得唯有沿[110]方向或垂直于[110]方向的电荷分布是唯一的。到目前为止,尽管有报道称胶原蛋白在无机晶面的自组装受晶体表面电荷分布所规范[27-28],但尚未有详实精准的晶体结构表征实验来确证该类纳米线阵列是蛋白单体在“反相生物矿化”原理下的准外延生长现象。根据云母 (001) 晶面上电荷分布的对称性以及我们观测到胶原蛋白纳米线阵列取向的单一性,我们也许可以推断蛋白单体受云母晶面上电荷分布的规导,其取向要么平行于该狭长氧负离子凹槽,即[110]方向,要么垂直于该方向,并在熵力的作用下进一步自组装成取向独特的纳米线阵列。
我们对覆盖纳米纤维膜层的云母基片进行了TEM的选区衍射 (SAED) 实验和SEM的背散射衍射 (EBSD) 实验。如图 5所示,通过对TEM的选区电镜图像和SAED衍射光斑的标定与坐标分析,纳米线的取向大致与云母[001]晶轴成60°,这与文献报道Laue衍射实验结果一致[27],但仍不能确定是沿云母[110]还是[110]方向。
幸运的是,EBSD实验得到了某特定样品选区SEM图像以及该区云母晶体衍射花纹图。如图 6所示,基于对该区多点的标定和坐标分析,纳米线取向平行于云母[001]晶轴。这可能是制样过程中对云母晶面造成破坏,使下层扭转120的晶面露出所致。这直接排除了纳米线沿云母[110]方向或垂直[110]方向。基于电子衍射实验结果,以往实验报道[27]胶原蛋白沿云母[110]方向生长可能有误。
2.3 “自上而下”的加工机理
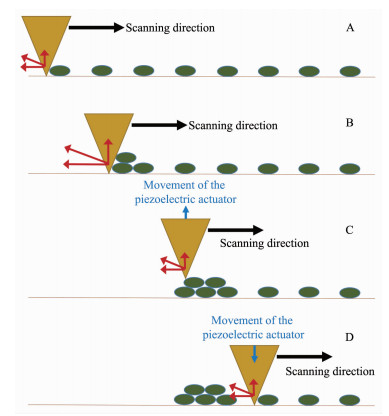
对于图 3中利用AFM探针“自上而下”地制造胶原蛋白纤维阵列,“分子扫帚”(molecular broom) 机理也许能给出最合理的解释[30]。如图 7(A)所示,样品作用于探针上的力可分解成水平与垂直方向,其中垂直方向的力会使悬臂发生弯曲。在接触模式下,垂直方向的力或悬壁的弯曲度应保持恒定,这由压电传感器通过调节悬臂高度来控制。当样品分子与基质结合力较弱时,探针将样品分子推动,像扫帚一样在图B中扫动分子并堆积起来。此时探针受力和悬臂弯曲度增大,当垂直方向的力大过阈值时,压电传感器便将悬臂上提以缓解压力。于是,探针便如图C所示滑过堆积的样品分子表面。随着垂直方向的力进一步减小,在图D中压电传动系统将探针再次放低来进行新一轮的“分子扫帚”运动。这样,每一行扫描结束后,探针会将样品分子扫成几堆。当接下来的一行扫描时,又会形成新的样品分子堆积。如果行距合适使得相邻两行的样品分子堆能相互接触,它们便随机结合形成了呈之字形弯曲的单根纤维,因此其取向大致垂直探针的行扫描方向。
为进一步印证以上的“分子扫帚”机理,我们进行了以下实验。图 8所示的是在10 000 nm×10 000 nm区域利用AFM探针在接触模式下“自上而下”地制造的蛋白纳米纤维。图中箭头平行于探针悬臂。首先,在A区域 (5 000 nm×5 000 nm) 利用AFM接触模式连续扫描2次,行扫描方向垂直于探针悬臂方向,探针作用力设置为2×10-7 N。紧接着在B区域 (2 500 nm×2 500 nm) 使用同种模式、相同方向以及相同探针作用力进行2次连续扫描。接下来,在C区域 (5 000 nm×5 000 nm) 利用接触模式连续扫描2次,行扫描方向平行于探针悬臂方向,探针作用力增加到5×10-7 N。接着,在D区域 (2 500 nm×2 500 nm) 使用同种模式和相同方向进行2次连续扫描,但是探针作用力增加到1×10-6 N。最后,我们在AFM轻敲模式下对整个区域进行表征,得到了图 8中分块的胶原蛋白纳米纤维阵列图。很显然,A区域和C区域的纳米纤维阵列的取向互相大致垂直,但均垂直于接触模式下探针的行扫描方向。对比A区域 (纤维高度约5 nm,宽度约270 nm),B区域由于扫描行间距变小产生更大重叠区域,蛋白纤维变得稀疏和粗壮 (纤维高度约5 nm,宽度约350 nm)。在C区域,由于探针作用力进一步增加,大量蛋白分子被探针带出该区域,纤维变得稀疏单薄。在D区域,由于探针作用力过大,蛋白分子基本上被探针“扫”走了。
2.4 透射实验结果
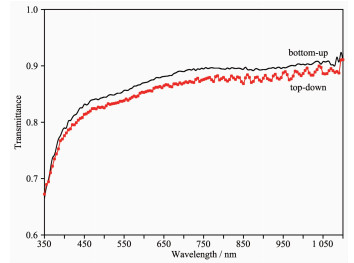
我们利用自制的透射/反射光谱仪在350~1 100 nm的范围内测量了2种不同机理制造的纳米线阵列的透射谱。如图 9所示,“自下而上”自组装形成的纳米线阵列的透射率略好于“自上而下”加工而成的纳米线阵列。这可能与云母晶面上吸附的蛋白质的量有关。但是,对于“自下而上”自组装形成的纳米线阵列,5或10 μg·mL-1的蛋白单体浓度对透射率没有统计上的影响。
3 结论
以天然Ⅰ型鼠尾胶原蛋白单体为原料,云母 (001) 晶面为基质,分别实现了“自下而上”和“自上而下”的蛋白纳米线阵列的制备,并对制备机理进行了初步探讨。在材料合成领域,有报道称通过“自下而上”和“自上而下”合成途径能殊途同归地获得性能一致的纳米颗粒材料[31]。但就我们所知,目前尚无同种生物大分子在同一基质表面利用不同机理生成纳米线阵列的文献报道。本研究属于仿生合成领域内较前沿的“过程仿生合成”范畴[32-33],其机理研究对制备生物纳米材料具有一定的指导意义。当前,利用大分子在基质表面有序排列可以构造掩模合成新型微纳光电材料与器件,生产细胞培养器皿、制备高效生物探针[32-37]。本实验则为以上诸多应用提供了2种实验条件要求相对较低,但所合成的目标材料结构可控的潜在高效制备技术。我们还需要后续的各种表征实验来探索以上技术的潜在应用。
Supporting information is available at http://www.wjhxxb.cn
-
-
[1]
杨琴, 杜莹莹, 王江林, 等.无机化学学报, 2016, 32(11):1885-1895 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20161101&journal_id=wjhxxbcnYANG Qin, DU Ying-Ying, WANG Jiang-Lin, et al. Chinese J. Inorg. Chem., 2016, 32(11):1885-1895 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20161101&journal_id=wjhxxbcn
-
[2]
朱清, 涂洛, 周幸福, 等.无机化学学报, 2016, 32(8):1319-1326 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20160802&journal_id=wjhxxbcnZHU Qing, TU Luo, ZHOU Xing-Fu, et al. Chinese J. Inorg. Chem., 2016, 32(8):1319-1326 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20160802&journal_id=wjhxxbcn
-
[3]
Shelby R A, Smith D R, Schultz S. Science, 2001, 292(5514):77-79 doi: 10.1126/science.1058847
-
[4]
Gabrielli L H, Cardenas J, Poitras C B, et al. Nat. Photonics, 2009, 3(8):461-463 doi: 10.1038/nphoton.2009.117
-
[5]
Valentine J, Li J, Zentgraf T, et al. Nat. Mater., 2009, 8(7):568-571 doi: 10.1038/nmat2461
-
[6]
Greenleaf A, Kurylev Y, Lassas M, et al. PNAS, 2012, 109(26):10169-10174 doi: 10.1073/pnas.1116864109
-
[7]
Jen Y J, Lakhtakia A, Yu C W, et al. Appl. Phys. Lett., 2011, 99(18):181117 doi: 10.1063/1.3658624
-
[8]
Forrest S R. Chem. Rev., 1997, 97(6):1793-1896 doi: 10.1021/cr941014o
-
[9]
Tersoff J, Tromp R M. Phys. Rev. Lett., 1993, 70(18):2782-2785 doi: 10.1103/PhysRevLett.70.2782
-
[10]
Shekhah O, Wang H, Paradinas M, et al. Nat. Mater., 2009, 8(6):481-484 doi: 10.1038/nmat2445
-
[11]
Nelson H. J. Cryst. Growth, 1974, 27:1-5
-
[12]
Saul R H, Lorimor O G. J. Cryst. Growth, 1974, 27:183-192 doi: 10.1016/S0022-0248(74)80063-1
-
[13]
Hla S W, Braun K F, Wassermann B, et al. Phys. Rev. Lett., 2004, 93(20):208302 doi: 10.1103/PhysRevLett.93.208302
-
[14]
Andreev A, Teichert C, Hlawacek G, et al. Org. Electron., 2004, 5:23-27 doi: 10.1016/j.orgel.2004.01.005
-
[15]
Eigler D M, Schweizer E K. Nature, 1990, 344(6266):524-526 doi: 10.1038/344524a0
-
[16]
Toumey C. Nat. Nanotechnol., 2010, 5(4):239-241 doi: 10.1038/nnano.2010.61
-
[17]
Nowak D, Morrison W, Wickramasinghe H K, et al. Sci. Adv., 2016, 2(3):e1501571 doi: 10.1126/sciadv.1501571
-
[18]
Huo F W, Zheng Z J, Zheng G F, et al. Science, 2008, 321(5896):1658-1660 doi: 10.1126/science.1162193
-
[19]
Leung O M, Goh M C. Science, 1994, 255(5040):64-66
-
[20]
孙铭, 洪玮, 疏静, 等.分析化学, 2016, 44(10):1471-1476SUN Ming, HONG Wei, SHU Jing, et al. Chin. J. Anal. Chem., 2016, 44(10):1471-1476
-
[21]
Smith J V, Yoder H S. Mineral. Mag., 1956, 31:209-235 doi: 10.1180/minmag
-
[22]
Guven N. Z. Kristallogr., 1971, 134:196-212
-
[23]
Takeda H, Ross M. Am. Mineral., 1995, 80:715-724 doi: 10.2138/am-1995-7-808
-
[24]
Puleo D A, Bizios R. Biological Interactions on Materials Surfaces:Understanding and Controlling Protein, Cell, and Tissue Responses. New York:Springer, 2009:200-218
-
[25]
Kadler K E, Holmes D F, Trotter J A, et al. Biochem. J., 1996, 316(1):1-11 doi: 10.1042/bj3160001
-
[26]
Beck K, Brodsky B. J. Struct. Biol., 1998, 122:17-29 doi: 10.1006/jsbi.1998.3965
-
[27]
Sun M, Stetco A, Merschrod E F. Langmuir, 2008, 24(10):5418-5421 doi: 10.1021/la703292h
-
[28]
Leow W W, Hwang W. Langmuir, 2011, 27(17):10907-10913 doi: 10.1021/la2018055
-
[29]
Yang G C, Woodhouse K A, Yip C M. J. Am. Chem. Soc., 2002, 124(36):10648-10649 doi: 10.1021/ja027302g
-
[30]
Lea A S, Pungor A, Hlady V, et al. Langmuir, 1992, 8(1):68-73 doi: 10.1021/la00037a015
-
[31]
Yuan P S, Wu Q S. Bull. Korean Chem. Soc., 2009, 30(12):2890-2894 doi: 10.5012/bkcs.2009.30.12.2890
-
[32]
Zan G T, Wu Q S. Adv. Mater., 2016, 28(11):2099-2147 doi: 10.1002/adma.201503215
-
[33]
Li J F, Wu Q S. New J. Chem., 2015, 39(5):3859-3864 doi: 10.1039/C4NJ01853B
-
[34]
Mirkin C A, Letsinger R L, Mucic R C, et al. Nature, 1996, 382(6592):607-609 doi: 10.1038/382607a0
-
[35]
Alivisatos A P, Johnsson K P, Peng X G, et al. Nature, 1996, 382(6592):609-611 doi: 10.1038/382609a0
-
[36]
Allred D B, Sarikaya M, Baneyx F, et al. Nano Lett., 2005, 5(4):609-613 doi: 10.1021/nl047967b
-
[37]
Li P P, Chen X, Yang W S. Langmuir, 2013, 29(27):8629-8635 doi: 10.1021/la401881a
-
[1]
-
图 1 (A) 云母 (2M1 muscovite) 的二层晶体结构图; (B) 以 (Gly-Pro-Hyp)n为模型的胶原蛋白单体分子结构
Figure 1 (A) Structure of mica (2M1 muscovite) two-layer unit cell; (B) Collagen monomer model (Gly-Pro-Hyp)n
Top trace in (B): colored by chains; Center trace in (B): colored by residues: Gly, Pro and Hyp; Bottom trace in (B): colored by atom C, O, N, H
图 4 云母晶体表面的氧负离子在 (001) 晶面上的投影
Figure 4 Oxygen atoms of mica unit cell projected onto the (001) lattice
Due to the distortion, the Od atoms are depressed below the basal plane, thus constructing a set of negatively charged troughs along the [110] direction as indicated by arrows; (A) a view around one unit cell; (B) a view of about nine parallel unit cells
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1453
- HTML全文浏览量: 312






 下载:
下载:








 下载:
下载:

