 图 1
NH2-UiO-66和Ag/AgCl@NH2-UiO-66的XRD图 (a) 和30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66和50% Ag/AgCl@NH2-UiO-66的XRD图 (b)
Figure 1.
XRD patterns of NH2-UiO-66 and Ag/AgCl@NH2-UiO-66 (a) and XRD patterns of 30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66 and 50% Ag/AgCl@NH2-UiO-66 (b)
图 1
NH2-UiO-66和Ag/AgCl@NH2-UiO-66的XRD图 (a) 和30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66和50% Ag/AgCl@NH2-UiO-66的XRD图 (b)
Figure 1.
XRD patterns of NH2-UiO-66 and Ag/AgCl@NH2-UiO-66 (a) and XRD patterns of 30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66 and 50% Ag/AgCl@NH2-UiO-66 (b)

Citation: ZHOU Xin, FENG Tao, GAO Shu-Tao, YANG Liang-Liang, WANG Zi-Chen, WANG Na, LIU Cong-Ying, FENG Cheng, SHANG Ning-Zhao, WANG Chun. Visible-Light Responsive Photocatalyst Ag/AgCl@NH2-UiO-66:Preparation and Photocatalytic Performance[J]. Chinese Journal of Inorganic Chemistry, 2016, 32(5): 769-776. doi: 10.11862/CJIC.2016.095

可见光响应光催化剂Ag/AgCl@NH2-UiO-66的制备及其光催化性能
English
Visible-Light Responsive Photocatalyst Ag/AgCl@NH2-UiO-66:Preparation and Photocatalytic Performance
-
Key words:
- Ag/AgCl
- / metal-organic framework
- / visible light
- / photocatalysis
- / degradation
-
当前,日益严峻的环境污染问题,特别是一些有毒难降解的有机污染物 (如有机染料、农药、卤代物等) 引起的水污染问题,已成为人们关注的焦点[1]。与传统污水处理技术相比,光催化技术具有洁净、安全、操作简单、无二次污染等优点,利用光催化氧化法来降解有机污染物将成为解决水污染问题的一种有效途径[2]。目前,TiO2是研究最多且最早用于光催化降解有机污染物的半导体催化剂[3-4],由于其禁带宽度较大 (3.0~3.2 eV),TiO2只能有效利用紫外光,然而紫外光仅占太阳光的3%~5%,可见光能量约占太阳光总能量的43%,因此,为有效利用太阳能,开发可见光响应的光催化剂用于降解有机污染物具有广阔的应用前景。
Ag/AgX (X=Cl,Br,I) 是一类新型等离子体光催化剂[5-8]。金属银的表面等离子共振效应及Ag-AgX独特的异质结结构使得该类催化剂能够有效地吸收可见光,同时实现光生电子-空穴的迅速分离。例如,Huang等[9-10]利用Ag2MoO4和HCl或HBr之间的离子交换反应,制备出AgCl和AgBr,进一步经光还原得到Ag/AgCl和Ag/AgBr等离子体光催化剂,用于在可见光条件下催化降解甲基橙染料,表现出较高的催化活性和稳定性。然而此类催化剂存在对有机污染物吸附能力较差和容易发生团聚等缺点,为了克服这些缺点,刘鸣华[11]采用水/油乳液法制备Ag/AgX (X=Br,Cl)/GO,Shao等[12]则利用简单溶液法合成了Ag/AgBr/rGO,一定程度上提高了催化剂对有机污染物的吸附能力,提高了光催化活性。但是相对复杂的制备方法制约了这类催化剂在光催化降解有机污染物方面的实际应用。
近年来,金属有机框架材料 (MOFs) 作为一类新型功能化无机-有机杂化材料引起广泛关注[13-14],它是由金属离子或金属簇与有机桥联配体通过配位键所形成的一类配位聚合物,具有结构可调、比表面积大和高孔隙结构等优点,已被广泛应用于气体存储[15]、药物转运[16]、化学分离[17]和非均相催化[18]等领域。此外,一些MOFs还表现出了光催化活性,例如,安徽大学Yuan等报道了以MIL-53(M)(M=Al,Cr,Fe)[19]做光催化剂,紫外光照射下降解亚甲基蓝,在添加H2O2(电子捕获剂) 的情况下,20 min内对亚甲基蓝的降解效率达到99%;最近该课题组以MIL-88A (Fe)[20]为催化剂、H2O2做电子捕获剂,在可见光照射下20 min可使98%的亚甲基蓝降解。Garcia等人的研究表明MOF-5[21]对2,6-叔丁基酚的光催化降解效率可高达100%。2015年Rocha等发现在NH2-MIL-125(Ti)[22]结构中引入Cr或Ag都能够显著提高NH2-MIL-125光催化降解亚甲基蓝的能力。Zhang等于2014年报道了一种全新的具有p-型半导体特点的MOF材料NTU-9[23],其在可见光照射下能够高效的降解亚甲基蓝和罗丹明染料。福州大学的Wu等采用水热还原方法制备了Pd@NH2-UiO-66[24]光催化剂,该催化剂能够在光催化降解有机污染物 (甲基橙、亚甲基蓝) 的同时还原Cr (Ⅵ)。但是,由于MOFs的光生电子效率和电荷分离效率均低于无机半导体材料,导致该类材料的光催化活性较低[25]。将MOFs与无机半导体复合可显著提高光生电子效率,并可抑制电子-空穴对的快速复合,从而提高光催化活性。Wee等[26]利用Ag+与Zn2+的竞争配位作用,经脱水、缩合过程在ZIF-8的表面引入了ZnO纳米棒,在紫外光条件下降解亚甲基蓝,与ZnO和ZIF-8相比ZnO@ZIF-8表现出了更高的催化活性。中国科技大学熊宇杰等[27]通过水解方法在预先制备好的Cu3(BTC)2微晶表面合成了锐钛矿型纳米TiO2,并利用超快光谱证实了MOF与无机半导体之间存在电荷转移过程,而这一过程有助于抑制光生电子-空穴对的快速复合,进而提高光催化活性,在紫外光照射下,Cu3(BTC)2@TiO2核-壳材料能够高效的催化CO2转化生成CH4。最近,我们课题组制备了Ag/AgCl@ZIF-8等离子体光催化剂,在可见光照射下 (λ≥420 nm) 该催化剂能够高效的催化分解罗丹明B (RhB) 染料[28]。
NH2-UiO-66是一类具有良好的热稳定性和化学稳定性,具有可见光响应活性的MOFs材料。为进一步提高其光催化活性,本文采用气相扩散-沉积-光还原法制备了等离子体光催化剂Ag/AgCl@NH2-UiO-66。由于Ag/AgCl和NH2-UiO-66之间的协同效应,该催化剂表现出优良的可见光光催化活性。在可见光照射下 (λ≥420 nm),该复合材料对20 mg·L-1的RhB溶液降解效率14 min内即可达到98%。
1 实验部分
1.1 试剂与仪器
氯化锆 (ZrCl4)、2-氨基对苯二甲酸由阿拉丁试剂公司提供,N,N-二甲基甲酰胺 (DMF)、盐酸 (HCl)、硝酸银 (AgNO3) 由保定华新试剂公司提供。以上试剂均为分析纯,用前未经处理。
样品形貌及尺寸通过FEI公司的Quanta 200F型场发射电子扫描电子显微镜 (SEM) 进行测试 (加速电压30 kV)。XRD采用Rigaku公司的D/max 2500型X射线衍射仪,Cu Kα辐射 (λ=0.156 04 nm), 管电压为40 kV;管电流为150 mA,石墨单色器,2θ为5°~80°。XPS价带能谱在PHI公司的Quantum 1600型光电子能谱仪上完成 (激发源为Mg Kα)。N2吸脱附实验在金埃普科技有限公司制造的APP V-Sorb 2800P型比表面分析仪上进行,在120 ℃下脱气6 h,77 K温度下测定N2吸附-脱附等温线。UV-Vis固体漫反射光谱通过岛津公司的UV-3600紫外可见分光光度计检测。光源为北京纽比特科技有限公司HSX-F/UV 300氙灯,光电流采用上海辰华生产的CHI 600D电化学工作站测试。
1.2 光催化剂的制备
1.3 光催化性能测试
Ag/AgCl@NH2-UiO-66纳米复合物的光催化活性通过降解RhB的实验进行验证。实验在室温条件下进行,以加有420 nm截止片的HSX-F/UV 300氙灯 (北京纽比特科技有限公司) 作为光源。在70 mL 20 mg·L-1罗丹明溶液中加入70 mg光催化剂,超声分散后,避光搅拌1 h以达到吸附平衡,在光照条件下每隔2 min取出3 mL分散液,离心分离除去催化剂,用紫外-可见分光光度计测定RhB的残留浓度。
1.4 光电流测试
采用上海辰华生产的CHI 600D电化学工作站测试Ag/AgCl@NH2-UiO-66的光电转化能力。在10 mL无水乙醇中加入20 mg Ag/AgCl@NH2-UiO-66催化剂,超声分散15 min形成均一溶液。在ITO导电玻璃上均匀喷涂1 mL上述溶液,空气中晾干后作为工作电极,铂片电极作对电极,饱和甘汞电极作参比电极,以0.1 mol·L-1硫酸钠溶液作电解液,加有420 nm截止片的300 W氙灯作为光源。
1.2.2 Ag/AgCl@NH2-UiO-66的合成
在40 mL 11.6 mmol·L-1硝酸银水溶液中加入100 mg NH2-UiO-66,超声分散,在避光条件下搅拌1 h,将2 mL浓盐酸放入一烧杯,与上述分散液同时放到玻璃干燥器中密封,搅拌反应1 h,再用碘钨灯照射反应1 h。最后经离心分离,水洗至中性,在80 ℃下真空干燥2 h,得到灰色的40%(w/w,下同) Ag/AgCl @NH2-UiO-66。采用相同方法制备30% Ag/AgCl@NH2-UiO-66和50% Ag/AgCl@NH2-UiO-66催化剂。
为了对比Ag/AgCl@NH2-UiO-66与纯Ag/AgCl光催化活性,在不添加NH2-UiO-66的情况下,采用相同方法制备了Ag/AgCl。
1.2.1 NH2-UiO-66的合成
参考文献[24]方法合成NH2-UiO-66。将ZrCl4(0.233 2 g,1.0 mmol) 和2-氨基对苯二甲酸 (0.181 2 g,1.0 mmol) 溶于50 mL DMF,溶液转移至100 mL高压反应釜中,120 ℃反应48 h,待反应釜冷却至室温,离心分离,用无水甲醇反复洗涤除去DMF,在80 ℃下真空干燥12 h,得到黄色的NH2-UiO-66。
2 结果与讨论
2.1 光催化剂的表征
图 1a是NH2-UiO-66和Ag/AgCl@NH2-UiO-66的XRD图。由图可知,NH2-UiO-66的特征峰与文献报道一致[24]。复合材料Ag/AgCl@NH2-UiO-66显示了NH2-UiO-66的主要特征峰,表明在制备过程中NH2-UiO-66的晶体结构没有被破坏。此外,Ag/AgCl@NH2-UiO-66在2θ=28.0°,32.4°,46.6°,55.4°,57.9°,67.9°,74.9°和77.4°的特征峰分别对应AgCl的 (111),(200),(220),(311),(222),(400),(331) 和 (420) 晶面,为立方晶相结构 (PDF:31-1238)。由于光还原出的金属Ag量较少,在图中没有观察到与Ag相对应的特征峰 (2θ=38.4°)。图 1b是30%、40%和50% Ag/AgCl@NH2-UiO-66的XRD对比图。结果表明,不同Ag/AgCl含量的光催化剂均具有AgCl的特征峰,30%和40% Ag/AgCl@NH2-UiO-66结构中还保留着NH2-UiO-66的特征峰 (2θ=7.4°,8.6°),而50% Ag/AgCl@NH2-UiO-66中NH2-UiO-66的特征峰已基本消失,说明当Ag/AgCl含量升高到50%时,NH2-UiO-66的晶体结构就会被破坏,Ag/AgCl纳米颗粒与NH2-UiO-66不能形成良好的异质结结构。后续表征除特别说明外,均以40% Ag/AgCl@NH2-UiO-66进行。
 图 1
NH2-UiO-66和Ag/AgCl@NH2-UiO-66的XRD图 (a) 和30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66和50% Ag/AgCl@NH2-UiO-66的XRD图 (b)
Figure 1.
XRD patterns of NH2-UiO-66 and Ag/AgCl@NH2-UiO-66 (a) and XRD patterns of 30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66 and 50% Ag/AgCl@NH2-UiO-66 (b)
图 1
NH2-UiO-66和Ag/AgCl@NH2-UiO-66的XRD图 (a) 和30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66和50% Ag/AgCl@NH2-UiO-66的XRD图 (b)
Figure 1.
XRD patterns of NH2-UiO-66 and Ag/AgCl@NH2-UiO-66 (a) and XRD patterns of 30% Ag/AgCl@NH2-UiO-66, 40% Ag/AgCl@NH2-UiO-66 and 50% Ag/AgCl@NH2-UiO-66 (b)
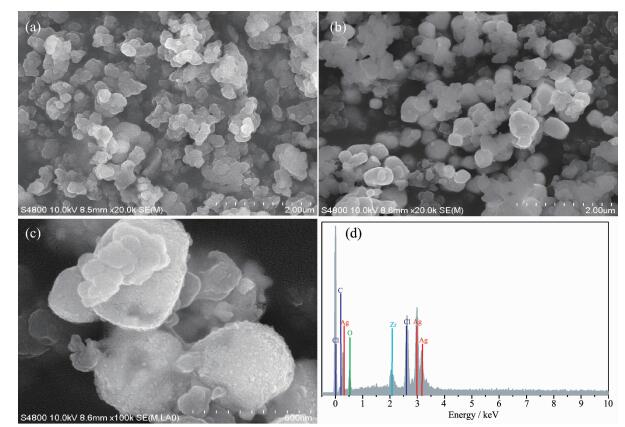
采用电子扫描显微镜考察了NH2-UiO-66和Ag/AgCl@NH2-UiO-66的形貌 (图 2),同时测定了Ag/AgCl@NH2-UiO-66的EDS能谱用以确定复合材料的元素组成。由图 2a和2b的对比可知Ag/AgCl亚微米立方体比较均匀的分散在了NH2-UiO-66框架结构中。由图 2c可以看出在Ag/AgCl表面分布着少量的无定形金属银颗粒,说明光能够还原AgCl生成金属Ag,这一结果与文献报道一致[29]。EDS能谱进一步证实Ag/AgCl@NH2-UiO-66复合材料中包含Zr、C、O、N、Ag和Cl元素。
图 3为NH2-UiO-66和Ag/AgCl@NH2-UiO-66的氮气吸附-脱附等温线。Ag/AgCl@NH2-UiO-66的BET比表面积和孔体积分别为170 m2·g-1和0.16 cm3·g-1,与NH2-UiO-66(956 m2·g-1和0.54 cm3·g-1) 相比显著减小,结合图 2b、2c的结果,可以判断NH2-UiO-66与Ag/AgCl形成了较好的复合结构,二者有很好的界面接触。
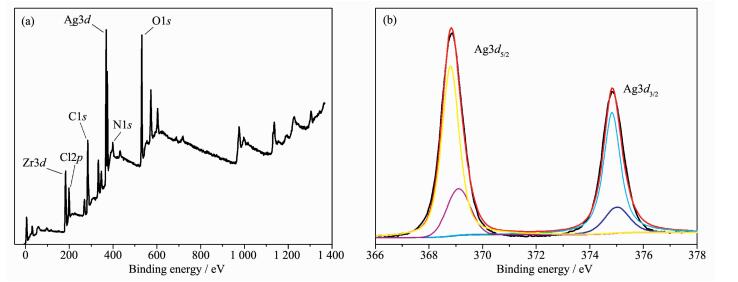
通过XPS测试进一步证实Ag/AgCl@NH2-UiO-66复合材料是由Ag,Cl,Zr,C,N和O元素组成的 (图 4a)。在图 5b中结合能为368.9和374.9 eV的2个特征峰分别归属于Ag3d5/2和Ag3d3/2。与Ag/AgCl[30]相比这2个特征峰的位置向高能区偏移了1.0 eV,造成这一现象的原因可能是由于Ag,AgCl和NH2-UiO-66之间存在相互作用。利用分峰软件进一步对2个特征峰进行分峰处理,如图 5b所示,在结合能为375.4、374.9 eV和369.4、368.9 eV处分别得到4个裂分峰。其中375.4和369.4 eV的裂分峰属于金属银Ag0,而374.9和368.9 eV属于AgCl中的Ag+。这一结果充分证实在Ag/AgCl@ NH2-UiO-66复合材料中有金属银存在。
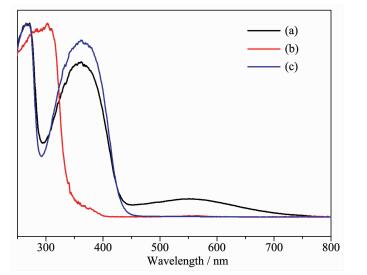
图 5为Ag/AgCl@NH2-UiO-66,AgCl和NH2-UiO-66的紫外-可见漫反射光谱。图 5b表明AgCl只对330 nm以下的紫外光有强吸收,对大于400 nm的可见光没有吸收,与文献报道的3.3 eV的带宽相一致。NH2-UiO-66也只能吸收一部分400~450 nm的可见光,与其相比,我们合成出的Ag/AgCl@NH2-UiO-66复合材料在450~700 nm处出现了较强的Ag/AgCl等离子共振吸收[7, 9],结果证明将Ag/AgCl与NH2-UiO-66进行复合能够提高对可见光的利用率,进而提高光催化活性。
2.2 光催化活性
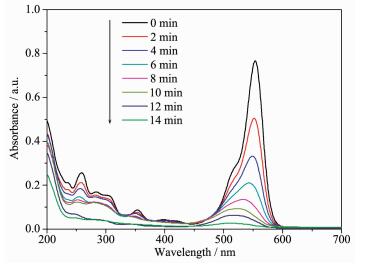
图 6为催化剂后RhB的紫外-可见吸收曲线随光照时间的变化情况,结果表明,在λ≥420 nm的可见光照射下,Ag/AgCl@NH2-UiO-66复合催化剂能够迅速降解水溶液中的RhB,其553 nm处的最大吸收峰14 min后已基本消失。
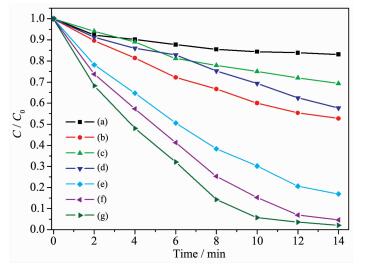
通过在可见光下 (λ≥420 nm) 对RhB的降解实验考察对比了Ag/AgCl@NH2-UiO-66纳米复合材料与其他催化剂的光催化活性,结果如图 7所示。图 7a表明在可见光下,借助RhB的敏化作用,P25(商业TiO2) 仅能降解10%左右的RhB,这可能是由于P25只能吸收紫外光造成的,这一结果同时也证明了RhB对光催化剂的敏化作用是有限的。能够吸收可见光的Ag/AgCl和NH2-UiO-66在14 min内也只能降解48%和28%的RhB (图 7b、7c)。而我们制备出的Ag/AgCl@NH2-UiO-66可见光催化剂在相同条件下能够高效的降解RhB (图 7e、7f、7g)。30%、40%和50%的Ag/AgCl@NH2-UiO-66的降解效率分别为83%、98%和95%。Ag/AgCl的含量由30%增加到40%,使得降解效率提高了15%,然而当含量增加到50%时,降解效率没有继续增加反而有所降低,这可能是由于大量的Ag/AgCl纳米颗粒与NH2-UiO-66的作用力减弱,造成异质结结构被破坏导致的。
与Ag/AgCl光催化剂相比,40% Ag/AgCl@ NH2-UiO-66的光催化降解RhB的效率提高了50%,说明Ag/AgCl与NH2-UiO-66之间存在协同效应。一方面归因于NH2-UiO-66较大的比表面积,能够吸附更多的RhB分子到催化剂表面;另一方面归因于该催化剂独特的异质结结构,能够高效的分离光生电子和空穴,从而提高光催化活性。
为了进一步证实这种协同效应的存在,我们用Ag/AgCl与NH2-UiO-66的混合物 (Ag/AgCl和NH2-UiO-66的用量与40% Ag/AgCl@NH2-UiO-66相同) 在相同条件下降解RhB,14 min内只有40%的RhB被降解 (图 7d),实验结果说明Ag/AgCl与NH2-UiO-66之间存在协同效应。
光催化降解RhB为准一级反应,适用一级反应动力学方程:
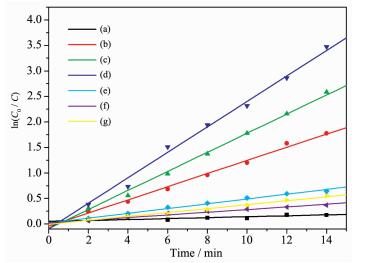
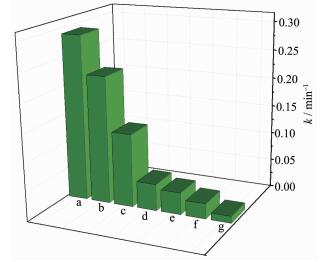
C0为RhB的初始浓度,C为不同反应时间RhB的浓度,t为反应时间,k是反应速率常数。如图 8所示,ln (C0 / C) 与反应时间t存在较好的线性关系,说明在可见光下Ag/AgCl@NH2-UiO-66催化降解RhB服从一级反应动力学。图 9为不同光催化剂的降解速率常数。40% Ag/AgCl@NH2-UiO-66的速率常数为0.29,相当于P25的29倍、Ag/AgCl与NH2-UiO-66混合物的7.6倍。
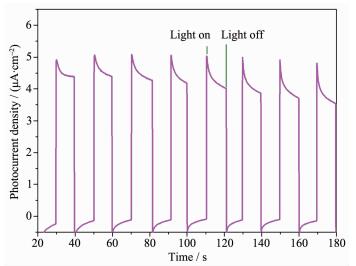
众所周知,光生电子和空穴的分离效率在光催化反应中扮演着重要角色。通常认为光电流越大,电子-空穴分离效率越高,光催化活性也就越高。图 10为Ag/AgCl@NH2-UiO-66电极的瞬态光电流曲线,结果表明制备的复合材料能够高效的分离光生电子-空穴对,与光催化活性实验结果一致。
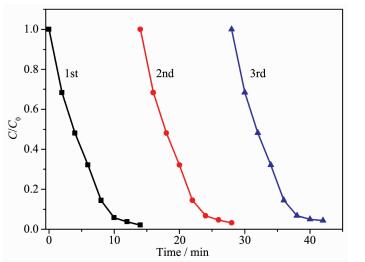
光催化剂的循环使用次数是衡量光催化剂性能的另一重要指标。为了验证Ag/AgCl@NH2-UiO-66的稳定性,我们做了重复利用实验,结果如图 11所示。在可见光下降解RhB,重复使用3次,40% Ag/AgCl@NH2-UiO-66对RhB的去除率在14 min内依然能够达到95.8%,催化活性没有明显降低,说明Ag/AgCl@NH2-UiO-66复合材料是一种催化活性高、可循环使用的可见光响应光催化剂。
2.3 光催化机理分析
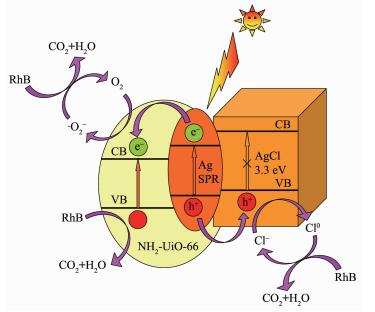
基于以上实验结果,我们提出了可能的光催化反应机理,如图 12所示。金属银纳米粒子吸收可见光,在表面产生光生电子和空穴对,电子传递到NH2-UiO-66的导带,与NH2-UiO-66吸收可见光产生的电子一起被吸附在催化剂中的O2俘获,生成活性氧基团·O2-,进而分解RhB,NH2-UiO-66价带上的空穴直接参与RhB的分解反应;而由金属银产生的空穴则通过异质结界面传递到AgCl表面,与Cl-作用生成具有强氧化性的Cl0原子,迅速氧化吸附在催化剂表面的RhB,同时Cl0被还原成Cl-从而维持整个体系的平衡。此外,NH2-UiO-66较大的比表面积有利于吸附更多的染料分子,也是Ag/AgCl@NH2-UiO-6具有高可见光催化活性的原因之一。
3 结论
采用气体扩散-沉积-光还原法制备了具有可见光响应能力的等离子体光催化剂Ag/AgCl@NH2-UiO-66。由于Ag/AgCl和NH2-UiO-66之间的协同效应,该催化剂表现出优良的可见光光催化活性。根据实验结果,提出了可能的光催化机理。该研究对于促进MOF与无机半导体复合材料光催化剂的实际应用具有重要意义。
-
-
[1]
Cui W, Wang H, Liang Y, et al. Chem. Eng. J., 2013, 230: 10-18 doi: 10.1016/j.cej.2013.03.091
-
[2]
Chen C, Ma W, Zhao J. Chem. Soc. Rev., 2010, 39:4206-4219 doi: 10.1039/b921692h
-
[3]
Tian J, Sang Y, Yu G, et al. Adv. Mater., 2013, 25:5075-5080 doi: 10.1002/adma.201302014
-
[4]
Tian J, Sang Y, Zhao Z, et al. Small, 2013, 9:3864-3872 doi: 10.1002/smll.v9.22
-
[5]
朱明山, 陈鹏磊, 刘鸣华.化学进展, 2013, 25:209-220 doi: 10.7536/PC120832ZHU Ming-Shan, CHEN Peng-Lei, LIU Ming-Hua. Prog. Chem., 2013, 25:209-220 doi: 10.7536/PC120832
-
[6]
Cui W, Wang H, Liang Y, et al. Catal. Commun., 2013, 36: 71-74 doi: 10.1016/j.catcom.2013.03.011
-
[7]
Choi M, Shin K H, Jang J. J. Colloid Interface Sci., 2010, 341: 83-87 doi: 10.1016/j.jcis.2009.09.037
-
[8]
Cui W, Wang H, Liu L, et al. Appl. Surf. Sci., 2013, 283:820-827 doi: 10.1016/j.apsusc.2013.07.025
-
[9]
Wang P, Huang B, Qin X, et al. Angew. Chem. Int. Ed., 2008, 47:7931-7933 doi: 10.1002/anie.v47:41
-
[10]
Wang P, Huang B, Zhang X, et al. Chem. Eur. J., 2009, 15: 1821-1824 doi: 10.1002/chem.v15:8
-
[11]
Zhu M S, Chen P L, Liu M H. ACS Nano, 2011, 5:4529-4536 doi: 10.1021/nn200088x
-
[12]
Meng X H, Shao X, Li H Y, et al. Mater. Lett., 2013, 105: 162-165 doi: 10.1016/j.matlet.2013.04.085
-
[13]
Ryder M R, Tan J C. Mater. Sci. Technol., 2014, 30:1598-1612 doi: 10.1179/1743284714Y.0000000550
-
[14]
Zhang T, Lin W. Chem. Soc. Rev., 2014, 43:5982-5993 doi: 10.1039/C4CS00103F
-
[15]
Tan Y X, Wang F, Kang Y, et al. Chem. Commun., 2011, 47: 770-772 doi: 10.1039/C0CC04095A
-
[16]
Ke F, Yuan Y P, Qiu L G, et al. J. Mater. Chem., 2011, 21: 3843-3848 doi: 10.1039/c0jm01770a
-
[17]
Zhao X, Xiao B, Fletcher A J, et al. Science, 2004, 306: 1012-1015 doi: 10.1126/science.1101982
-
[18]
Shang N, Gao S, Zhou X, et al. RSC Adv., 2014, 4:54487-54493 doi: 10.1039/C4RA10065D
-
[19]
Du J J, Yuan Y P, Sun J X, et al. J. Hazard. Mater., 2011, 190:945-951 doi: 10.1016/j.jhazmat.2011.04.029
-
[20]
Xu W T, Ma L, Ke F, et al. Dalton Trans, 2014, 43:3792-3798 doi: 10.1039/c3dt52574k
-
[21]
Llabrés i Xamena F X, Corma A, Garcia H. J. Phys. Chem. C, 2007, 111:80-85 doi: 10.1021/jp063600e
-
[22]
Abdelhameed R M, Simoes M M, Silva A M, et al. Chem. Eur. J., 2015, 21:11072-11081 doi: 10.1002/chem.v21.31
-
[23]
Gao J, Miao J, Li P Z, et al. Chem. Commun., 2014, 50:3786-3788 doi: 10.1039/c3cc49440c
-
[24]
Shen L, Wu W, Liang R, et al. Nanoscale, 2013, 5:9374-9382 doi: 10.1039/c3nr03153e
-
[25]
Wang S, Wang X. Small, 2015, 11:3097-3112 doi: 10.1002/smll.v11.26
-
[26]
Wee L H, Janssens N, Sree S P, et al. Nanoscale, 2014, 6: 2056-2060 doi: 10.1039/c3nr05289c
-
[27]
Li R, Hu J, Deng M, et al. Adv. Mater., 2014, 26:4783-4788 doi: 10.1002/adma.v26.28
-
[28]
Gao S T, Liu W H, Shang N Z, et al. RSC Adv., 2014, 4: 61736-61742 doi: 10.1039/C4RA11364K
-
[29]
Xu Z, Han L, Hu P, et al. Catal. Sci. Technol., 2014, 4:3615-3619 doi: 10.1039/C4CY00889H
-
[30]
Tang Y, Jiang Z, Xing G, et al. Adv. Funct. Mater., 2013, 23:2932-2940 doi: 10.1002/adfm.v23.23
-
[1]
-
图 7 不同光催化剂对RhB的降解结果
Figure 7 Photodegradationg of RhB over different catalysts
(a) P25, (b) Ag/AgCl, (c) NH2-UiO-66, (d) physical mixture of NH2-UiO-66 and AgCl, (e) 30% Ag/AgCl@NH2-UiO-66, (f) 50% Ag/AgCl@NH2-UiO-66, (g) 40% Ag/AgCl@NH2-UiO-66; Photocatalyst: 70 mg; RhB aqueous solution: 20 mg·L-1, 70 mL
图 8 不同光催化剂降解RhB的一级动力学曲线
Figure 8 First-order kinetics curves of RhB degradation in the presence different catalysts
(a) P25, (b) 30% Ag/AgCl@ NH2-UiO-66, (c) 50% Ag/AgCl@ NH2-UiO-66, (d) 40% Ag/AgCl@ NH2-UiO-66, (e) Ag/AgCl, (f) NH2-UiO-66, (g) physical mixture of NH2-UiO-66 and AgCl; Photocatalyst: 70 mg; RhB aqueous solution: 20 mg·L-1, 70 mL
图 9 不同催化剂降解RhB的速率常数
Figure 9 Degradation rate constant of RhB in the presence different catalysts
(a) P25, (b) 30% Ag/AgCl@ NH2-UiO-66, (c) 50% Ag/AgCl@ NH2-UiO-66, (d) 40% Ag/AgCl@ NH2-UiO-66, (e) Ag/AgCl, (f) NH2-UiO-66, (g) physical mixture of NH2-UiO-66 and AgCl; Photocatalyst: 70 mg; RhB aqueous solution: 20 mg·L-1, 70 mL
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1127
- HTML全文浏览量: 300



 下载:
下载:











 下载:
下载:

