
Citation: Ke Yang, Qiang Liu, Shuai Wen, Shu-xin Xu, Chen-qi Shi. Study of Cationic Copolymerization of Isobutylene and p-(Chloromethyl)styrene[J]. Acta Polymerica Sinica, 2020, 51(4): 355-365. doi: 10.11777/j.issn1000-3304.2019.19179

异丁烯与对氯甲基苯乙烯正离子共聚合研究
English
Study of Cationic Copolymerization of Isobutylene and p-(Chloromethyl)styrene
-
Key words:
- Isobutylene
- / p-(Chloromethyl)styrene
- / Reactivity ratio
- / Cationic copolymerization
- / Branching
-
卤化丁基橡胶(CIIR/BIIR)具有优异的气密性,广泛应用于无内胎轮胎气密层. 但CIIR/BIIR中的烯丙基卤素在高温下,会发生异构化甚至卤化氢的脱除反应[1];橡胶硫化后,还会残留部分烯丙基双键,这都对耐热性产生不利影响. Exxon公司通过对甲基苯乙烯和IB正离子共聚合及进一步的自由基溴化反应,成功商业化了含高活性苄基溴基团的全饱和橡胶-溴化异丁烯对甲基苯乙烯共聚物(BIMS),该橡胶表现出了更好的耐热性、耐臭氧性、耐候性[2]. 与BIMS结构类似,含苄基氯基团的氯甲基化苯乙烯(CMS)和IB共聚物(CIMS),也同样具备硫化活性[3~7],Exxon 公司将其与尼龙共混,成功制备了气密性更加优异的动态硫化热塑性弹性体[8,9].
目前,文献报道的CIMS的合成方法主要有两类:(1) p-CMS和IB的正离子共聚法直接制备[3~7,10~13];(2)通过IB与苯乙烯(St)正离子共聚合、后氯甲基化顺序合成[14]. 采用路线(1),可以省去繁琐、有毒的氯甲基化反应,具有更高的工业价值. p-CMS为双官能单体,双键可参与共聚,但共聚活性较IB低[3~5],苄基氯也可形成苄基阳离子活性中心[15];大分子链活性中心还可向p-CMS上的苯环发生分子间烷基化,导致凝胶[3~6]. 上述多种反应导致了p-CMS和IB的正离子共聚合基元反应比较复杂,可控性较差,相应的文献报道也比较少.
Jones等[3~5]曾以BF3为共引发剂,在氯乙烷中实现了p-CMS和IB的无凝胶淤浆共聚合. Exxon公司[6,7]认为淤浆聚合易产生凝胶,当采用EDC为共引发剂,在正己烷(n-Hex)和氯甲烷(CH3Cl)的混合溶剂中进行p-CMS和IB的连续法共聚合时,可以抑制凝胶,得到分子量数万的CIMS. Kennedy等[16]也曾经报道过二乙基氯化铝(AlEt2Cl)共引发的p-CMS/IB正离子共聚合,作者认为p-CMS中的苄基氯能够引发,但双键不参与共聚. Nuyken等[10]以三甲基铝为共引发剂,经过仔细研究发现,p-CMS既可以引发,又可以共聚,形成支化. Nuyken[11~13]进一步以四氧化钛(TiCl)4或者BCl3为共引发剂,在二氯甲烷(CH2Cl2)中合成了p-CMS摩尔含量分别高达58%和27%的CIMS,作者侧重于侧链改性,进一步合成了聚异丁烯-聚噁唑烷双亲接枝共聚物. 这些早期文献对p-CMS和IB的正离子共聚合已经进行了许多非常有价值的研究工作,但关于竞聚率、分子结构详细表征、聚合动力学方面的研究数据还比较少,有必要对其进行更深入的研究.
本文在 −80 °C下的n-Hex/CH2Cl2 (V/V = 6/4)混合溶剂内,首先考察了不同路易斯酸对凝胶的影响,并进一步优选TiCl4为共引发剂,研究了p-CMS和IB的共聚合,以Kelen-Tüdős与Yezreielv-Brokhina-Roskin法计算了竞聚率,分析了聚合过程中的一些基元反应,对支化结构进行了证实,初步探讨了聚合机理,为实现直接共聚法合成高分子量CIMS提供了一定的实验基础.
1. 实验部分
1.1 原料
TiCl4 (AR,西亚试剂)、枯基醇(CumOH, 97%,Aldrich)、2,6-二叔丁基吡啶(DtBP,97%,Aldrich)、AlCl3(99%,Aldrich)、二氯乙基铝(AlEtCl2,1 mol/L n-Hex溶液)和二乙基氯化铝(AlEtCl2,1 mol/L n-Hex溶液)均为江苏爱姆欧光电材料有限公司产品、倍半铝(AlEt1.5Cl1.5:AlEtCl2与AlEtCl2以1:1的摩尔比混合制得)、氯乙酰氯(AR,西亚试剂)、无水乙醇(AR,天津富宇化工). 正己烷(n-Hex,AR,国药化学试剂)、二氯甲烷(CH2Cl2,AR,国药化学试剂),高纯氮气保护下在CaH2存在下回流24 h,蒸馏后使用. 异丁烯(IB,聚合级,潍坊普鑫化工有限公司,气体经CaCl2干燥后,冷却成液态使用);对氯甲基苯乙烯(p-CMS,对位与邻位异构体混合物,西亚试剂).
1.2 聚合过程
聚合反应在氮气氛围下的聚合瓶中进行. 典型的聚合过程如下:在n-Hex与CH2Cl2体积比为6:4的混合溶剂中,导入DtBP、CumOH、IB与p-CMS共聚单体,配制单体溶液;然后用导管取22 mL配置好的单体溶液导入氮气保护的聚合瓶内,在−80 °C下的酒精浴中冷却10 min后,用注射器导入TiCl4引发聚合,到达设计时间后,加入预冷乙醇终止反应. 聚合物经过多次n-Hex/乙醇沉淀提纯,40 °C真空干燥至恒重.
1.3 测试与表征
1.3.1 p-CMS共聚含量与苄基氯含量以及支化程度的计算
根据参考文献[15,17~20], p-CMS中(―CH2Cl)亚甲基质子的吸收峰在δ = 4.56处;苄基氯引发IB聚合后,亚甲基质子(―CH2―)的吸收峰在δ = 2.75;PIB主链亚甲基质子吸收峰在δ = 1.41. 定义ICMS、
$F_{\rm CH_2Cl} $ $ {I_{{\rm{CMS}}}} = \dfrac{{\dfrac{{{A_{4.56}} + {A_{2.75}}}}{2}}}{{\dfrac{{{A_{4.56}} + {A_{2.75}}}}{2} + \dfrac{{{A_{1.41}}}}{2}}} $ (1) $ {F_{{\rm{C}}{{\rm{H}}_2}{\rm{Cl}}}} = \dfrac{{\dfrac{{{A_{4.56}}}}{2}}}{{\dfrac{{{A_{4.56}} + {A_{2.75}}}}{2} + \dfrac{{{A_{1.41}}}}{2}}} $ (2) 其中A4.56、A2.75、A1.41表示在核磁谱图中相应峰的峰面积.
苄基引发点代表了分子链中的支化点,根据GPC-RI的表观数均分子量数据(Mn),以支化点在共聚物中的摩尔比与单体聚合度的积,计算了平均每条分子链中的支化点(S)的数目,具体计算公式为:
$ {{S}} = \frac{{{M_{\rm{n}}}}}{{56 \times \left( {1 - {I_{{\rm{CMS}}}}} \right) + 152 \times {I_{{\rm{CMS}}}}}} \times \left( {{I_{{\rm{CMS}}}} - {F_{{\rm{C}}{{\rm{H}}_2}{\rm{Cl}}}}} \right) $ (3) 1.3.2 测试仪器
1H-NMR在型号为布鲁克500UltraShield核磁共振仪上测试,测试溶剂为氘代氯仿,四甲基硅烷(TMS)为标准参照物,将10.0 mg左右聚合物样品完全溶解于核磁样品管中;GPC-RI数据采用日本TOSOH株式会社型号EcoSEC8320的设备测试,柱温40 °C,以四氢呋喃为流动相,流速0.35 mL/min. 采用Wyatt公司示差折光指数仪(RI)/多角激光光散射仪(LS) /在线黏度检测器(Vis) 三台联用设备测定Mark-Houwink-Sakurada方程中的K, α值,流动相为THF,流速1.0 mL/min,柱温25 °C. 示差扫描量热仪(DSC)为瑞士梅特勒托利多仪器制造有限公司生产的DSC1型,测试温度为−120 ~ 30 °C,氮气氛围,升温速率为10 °C/min.
2. 结果与讨论
2.1 引发体系
首先,以CumOH/TiCl4、H2O/AlEtCl2、H2O/AlEt1.5Cl1.5、H2O/AlEt2Cl、H2O/AlCl3为引发体系,在n-Hex/CH2Cl2 (V/V = 6/4)的混合溶剂中引发CMS和IB共聚合. 实验现象如表1所示,H2O/AlEt2Cl引发体系没有聚合活性;H2O/AlEtCl2、H2O/AlEt1.5Cl1.5引发体系的聚合速度很快,体系从无色迅速转变为亮红色,同时有大量红色不溶物析出;苯甲醚作为给电子体时,H2O/AlCl3引发体系无聚合活性;氯乙酰氯为给电子体时,聚合速度很快,迅速产生红色凝胶;只有CumOH/TiCl4引发体系,聚合平稳,体系呈现浅黄色. 这表明,AlEt1.5Cl1.5和AlEtCl2的路易斯酸酸性太强,极易催化活性中心向苯环的分子间烷基化反应,产生凝胶. 当选用给电子性相对较强的苯甲醚时,AlCl3无聚合活性,而选用氯乙酰氯作为给电子体时,2个氯原子的吸电子诱导作用,降低了氯乙酰氯的给电子能力,此时AlCl3的路易斯酸性强,分子间烷基化催化活性很高,体系很容易产生凝胶. 因此,优选TiCl4做进一步的研究.
表 1
Initiator Co-initiator Electron donor Phenomenon CumOH TiCl4 − Polymer; no gel; pale yellow H2O AlEtCl2 − Polymer and gel; red H2O AlEt1.5Cl1.5 − Polymer and gel; red H2O AlEt2Cl − No polymer H2O AlCl3 Anisole No polymer H2O AlCl3 Chloroacetyl chloride Polymer and gel; red Reaction conditions: [co-initiator] = 0.045 mol/L, [CumOH] = 0.01 mol/L, ED/AlCl3 (molar ratio) = 1.1/1, n-Hex/CH2Cl2 = 6/4 (V/V), [IB] = 1.63 mol/L, [CMS] = 0.33 mol/L, T = − 80 °C, reaction time = 30 min 2.2 竞聚率
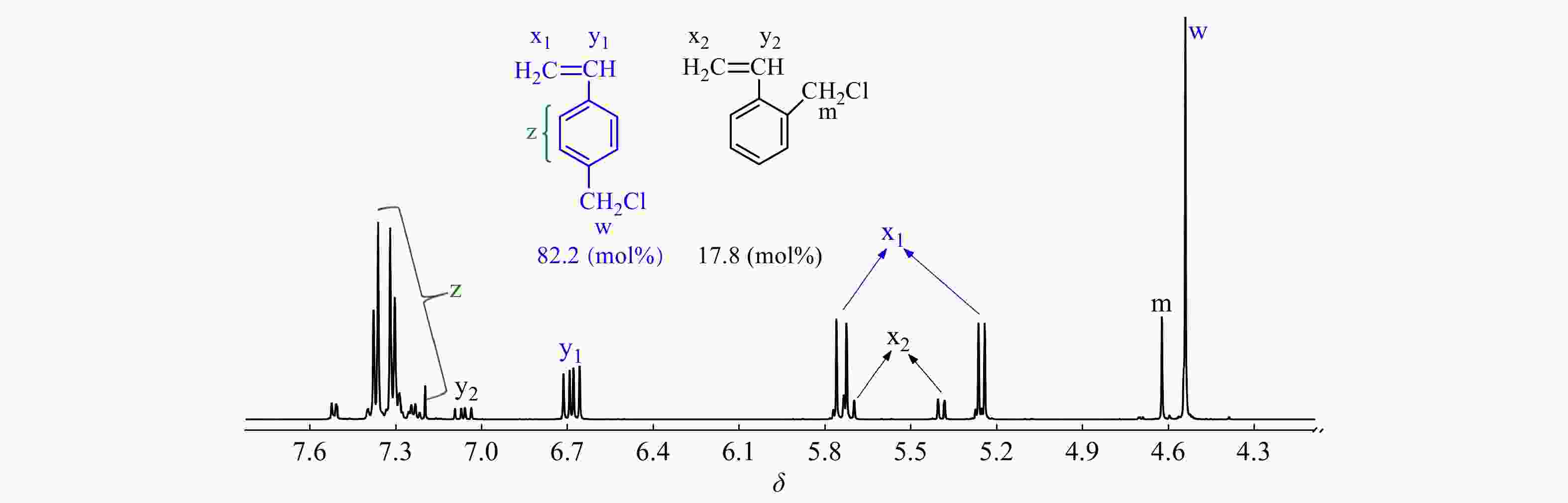
现有文献尚鲜有以TiCl4为共引发剂时CMS和IB的竞聚率数据报道. 以CMS代表邻位和对位氯甲基化苯乙烯异构体混合物,首先在CMS/IB = 2.5/100 ~ 50/10(摩尔比)的范围内进行共聚合,控制单体转化率在15%以下,以计算竞聚率. 图1为所用CMS单体的1H-NMR谱图,p-CMS的苄基质子吸收峰在δ = 4.54,o-CMS的苄基质子吸收峰在δ = 4.62,经计算,p-CMS/o-CMS的摩尔比为82.2/17.8.
图 1
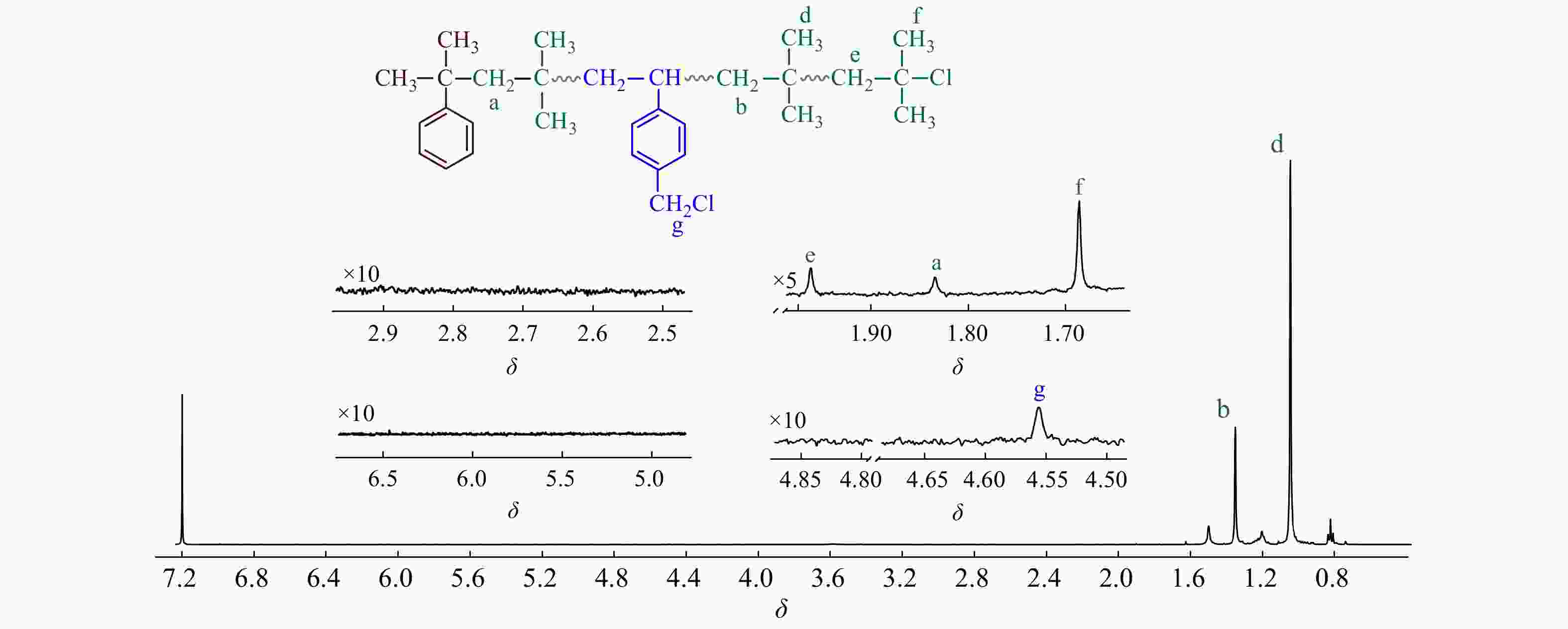
图2为CMS/IB的摩尔比为2.5/100时共聚产物的1H-NMR谱图,可清晰地观察到[17,18]:δ = 1.41处为共聚物IB单元亚甲基质子吸收峰;δ = 1.11处为IB单元侧甲基质子吸收峰;δ = 1.84处为枯基所引发的首个IB单体的亚甲基质子吸收峰;δ = 4.56处为苄氯亚甲基质子吸收峰;δ = 1.96和δ = 1.68 处为末端叔丁基氯特征峰;在δ = 4.64/4.85/5.15处未观察到PIB末端双键的特征吸收峰,表明共聚体系内不存在末端质子脱除等副反应. 从图2中还可以看到,在δ = 4.56处仅观察到一个单峰,对应p-CMS单体,这表明o-CMS无法与IB进行正离子共聚,真正有效参与共聚的单体为p-CMS.
图 2
p-CMS单体中的苄氯可以2种形式参与引发:(1)单体自身作为引发剂,引发聚合,形成端乙烯基的大分子单体;(2)共聚进入大分子链后,在侧链引发聚合. 但在图2中,δ = 2.75 处未观察到苄基引发特征吸收峰[15,19~20],δ = 5.20和5.70附近也未观察到苯乙烯基双键的吸收峰[20]. 这表明,苄基的引发活性远低于枯基[21],当单体转化率较低、反应时间较短时,共聚进入分子链中的苄基氯未起到明显的引发作用.
单体共聚的竞聚率是指单体在共聚时进入分子链的能力,计算方法主要有3种:Fineman Ross (F-R)法、Kelen-Tüdős (K-T)法、Yezreielv-Brokhina-Roskin (YBR)法[21~23]. 3种方法都是基于单体初始投料比与在聚合物中的共聚比进行计算. F-R方法计算方便但是结果准确性不高[21~23],因此本文采用K-T法与YBR法计算竞聚率. 表2给出了不同p-CMS/IB投料比下单体转化率与p-CMS共聚含量. 图3为通过K-T方法所计算的正序值与逆序值所绘制的回归线图(a为正序、b为逆序). YBR法则是通过一系列数学处理方法来计算得到竞聚率,经计算,rIB = 4.68,误差1.6%,rp-CMS = 0.69,误差3.0%. 这表明rIB 和rp-CMS 具有较高的可信度. 最终通过2种方法求得的平均值如表3所示,rIB = 4.67,rp-CMS = 0.70.
表 2
Run Conversion (%) Monomer feeding (%) Copolymer composition (%) IB p-CMS IB p-CMS − 100 0 100 0 1 11.4 97.88 2.12 99.54 0.46 2 9.5 91.65 8.35 97.96 2.04 3 13.9 82.95 17.05 95.36 4.64 4 8.5 73..95 26.05 90.94 9.06 5 7.56 64.60 35.40 88.13 11.87 6 7.3 54.89 45.11 82.02 17.98 − 0 100 0 100 Conditions: [IB] = 1.63 mol/L, [CumOH] = 0.004 mol/L, [DTBP] = 0.005 mol/L, [TiCl4] = 0.045 mol/L, reaction time = 6 min, T = −80 °C 图 3
表 3
Methods Positive sequence Reverse rIB rp-CMS rIB′ rp-CMS′ K-T 4.658 0.7195 4.6582 0.7196 YBR 4.676 ± 0.075671 0.6886 ± 0.02088 Average rIB = 4.67 rp-CMS = 0.70 2.3 共聚合时间
2.3.1 共聚合动力学
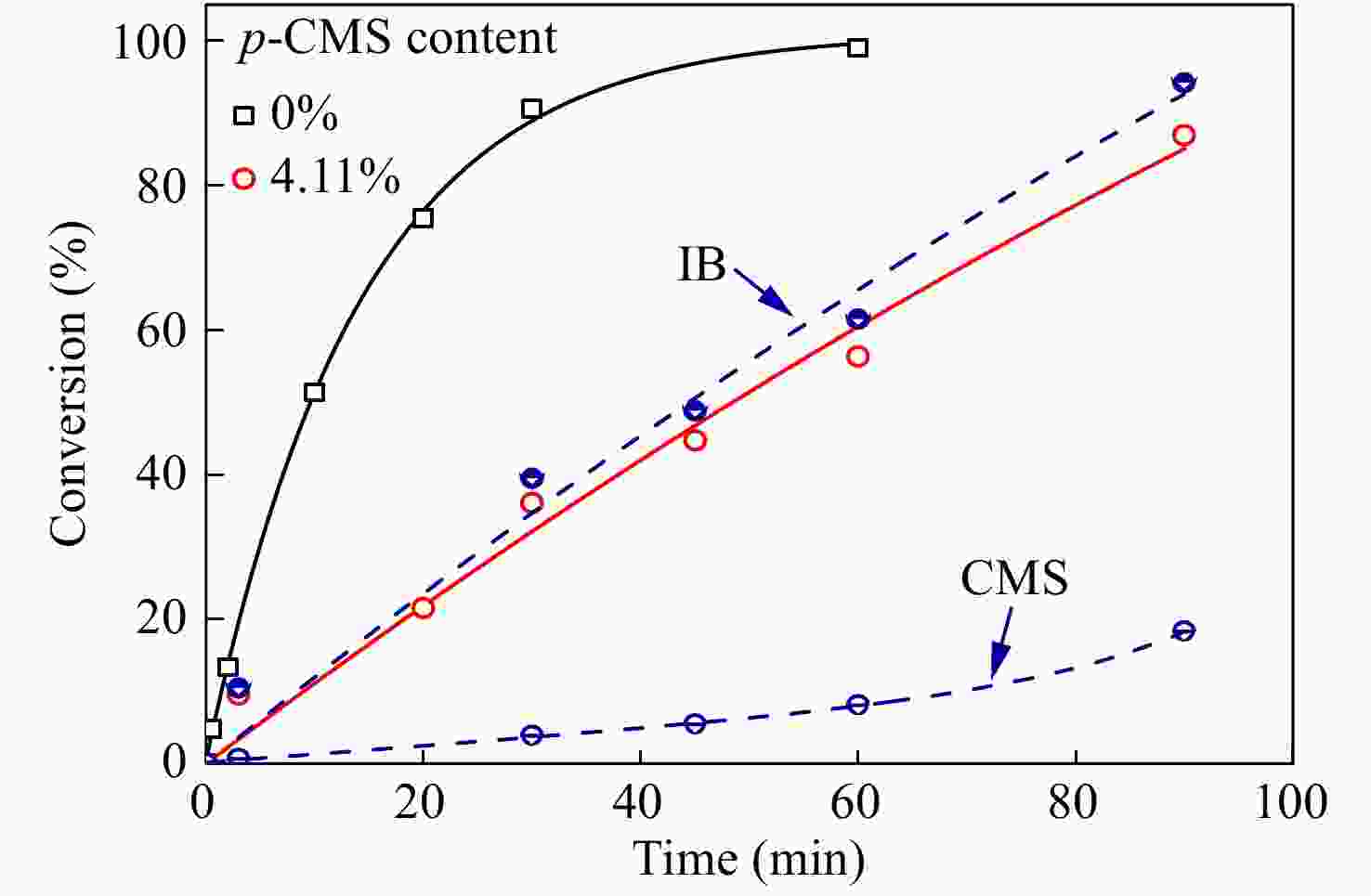
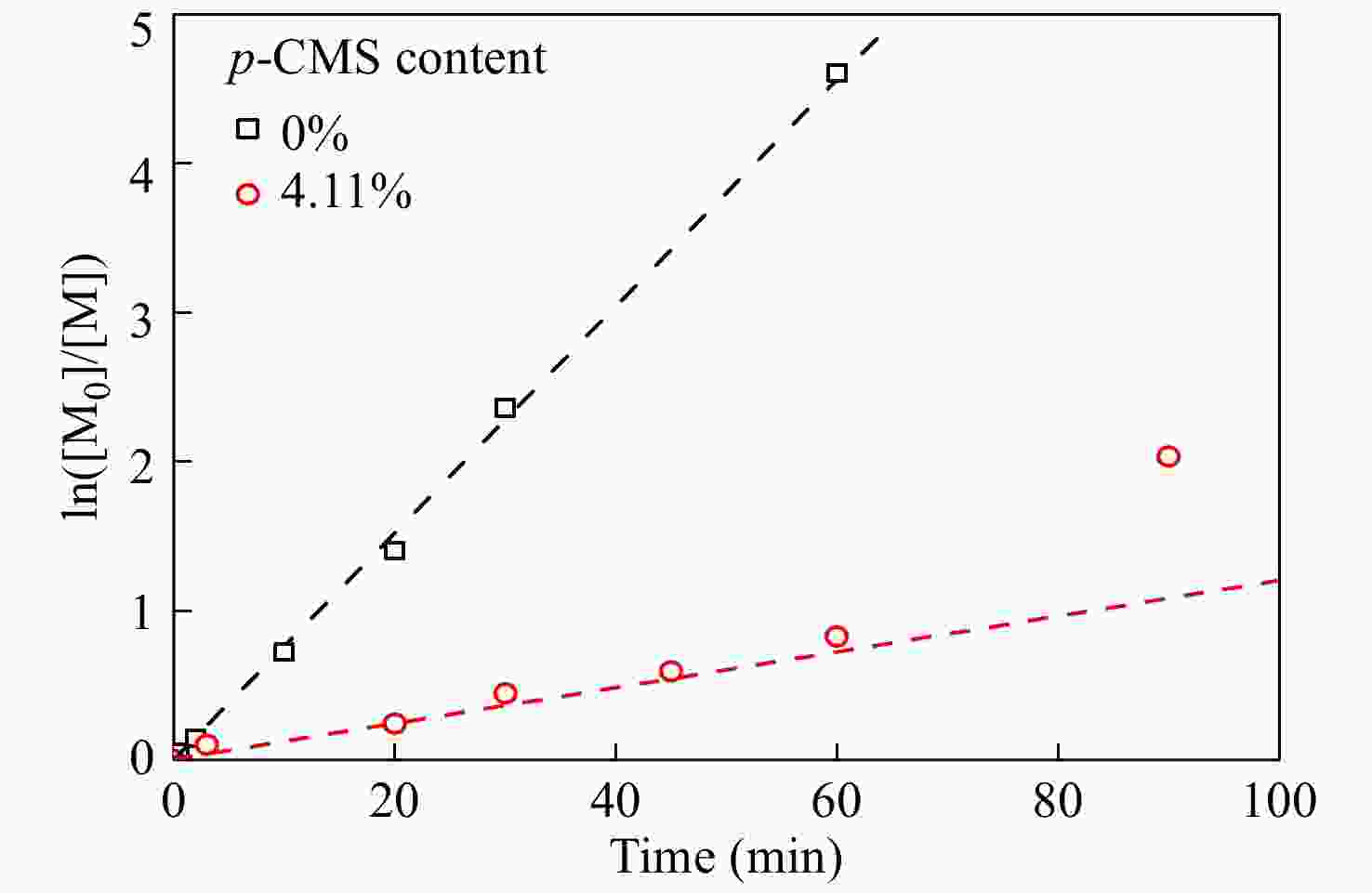
进一步在p-CMS/IB的摩尔比为4.11/100的条件下,研究共聚合时间的影响,并与IB均聚合速率作对比. 由图4共聚时间与单体转化率曲线可知,引入少量p-CMS后,整体聚合速率有所降低,但聚合反应仍能平稳进行. ln([M0]/[M])动力学曲线如图5所示,在反应时间45 min以内时,共聚速度与单体浓度呈现一级动力学关系,但在45 min以后,共聚速度与单体浓度偏离一级动力学关系,聚合速度加快,表明体系内活性中心的浓度明显增加.
图 4
图 5
2.3.2 GPC-RI 表征
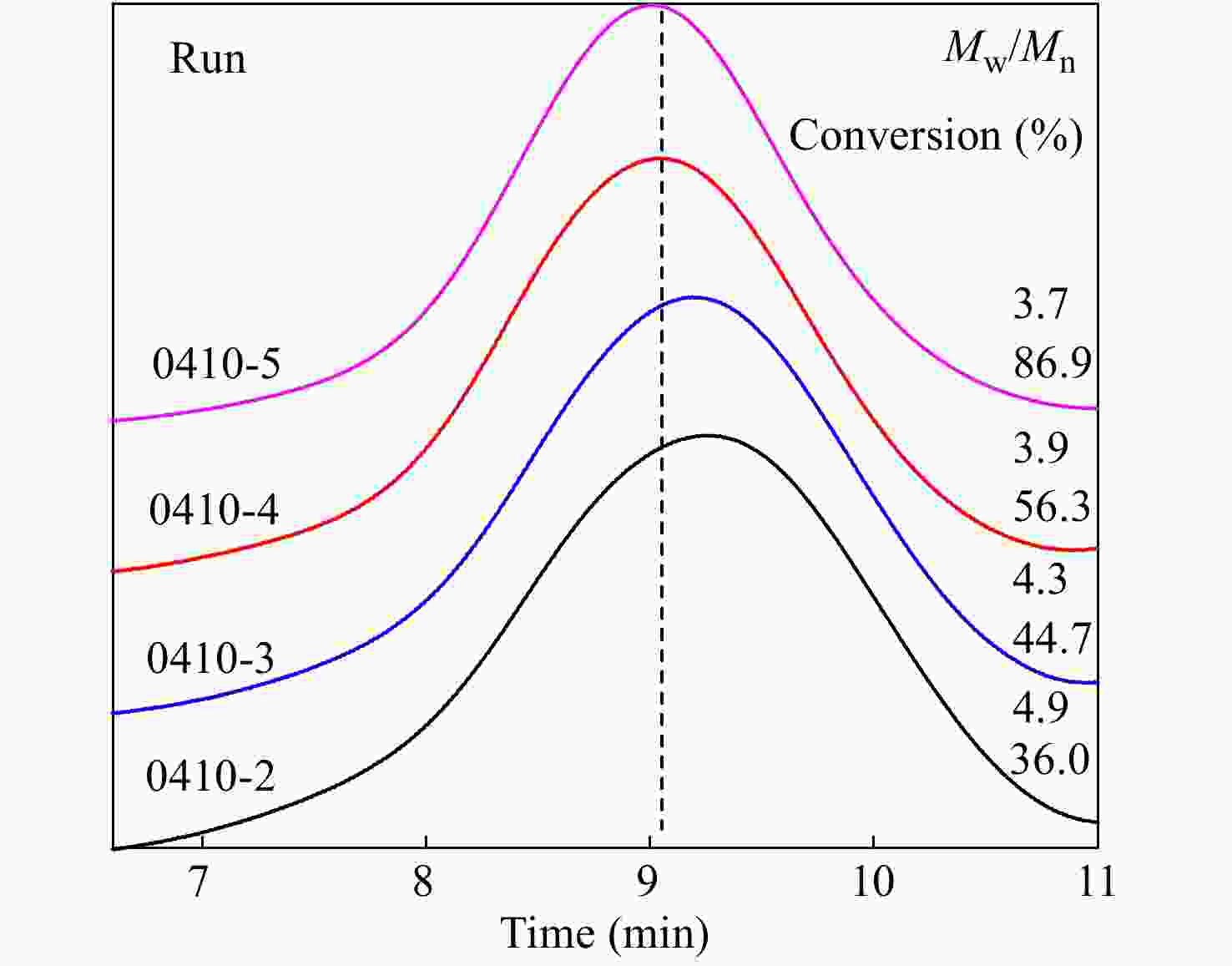
对转化率较高的共聚产物进行了GPC-IR表征,结果见图6及表4所示,共聚物的分子量分布较宽,分子量分布指数(MWD, Mw/Mn)达到4左右,但均呈单峰分布. 如前节所述,在p-CMS和IB共聚体系内,不存在末端质子脱除等副反应,大分子链末端基为有活性的叔丁基氯结构. 如图6所示,随反应时间延长和单体转化率的提高,共聚物的表观数均分子量和峰位分子量不断提高,这也证实了大分子链末端基具有活性.
表 4
Run Reaction time
(min)Mn,GPC,RI $F_{\rm CH_2 Cl} $ 

(mol%)ICMS
(mol%)Branching points
(per chain)BSB
(mol%)SSB
(mol%)0410-1 3 NA 0.69 0.69 0 100 0 0410-2 30 11700 0.8 1.08 0.58 100 0 0410-3 45 12680 0.82 1.23 0.93 72.46 27.53 0410-4 60 15670 0.76 1.45 1.93 70.92 29.08 0410-5 90 16220 0.89 2.13 3.59 59.17 40.83 图 6
2.3.3 1H-NMR表征
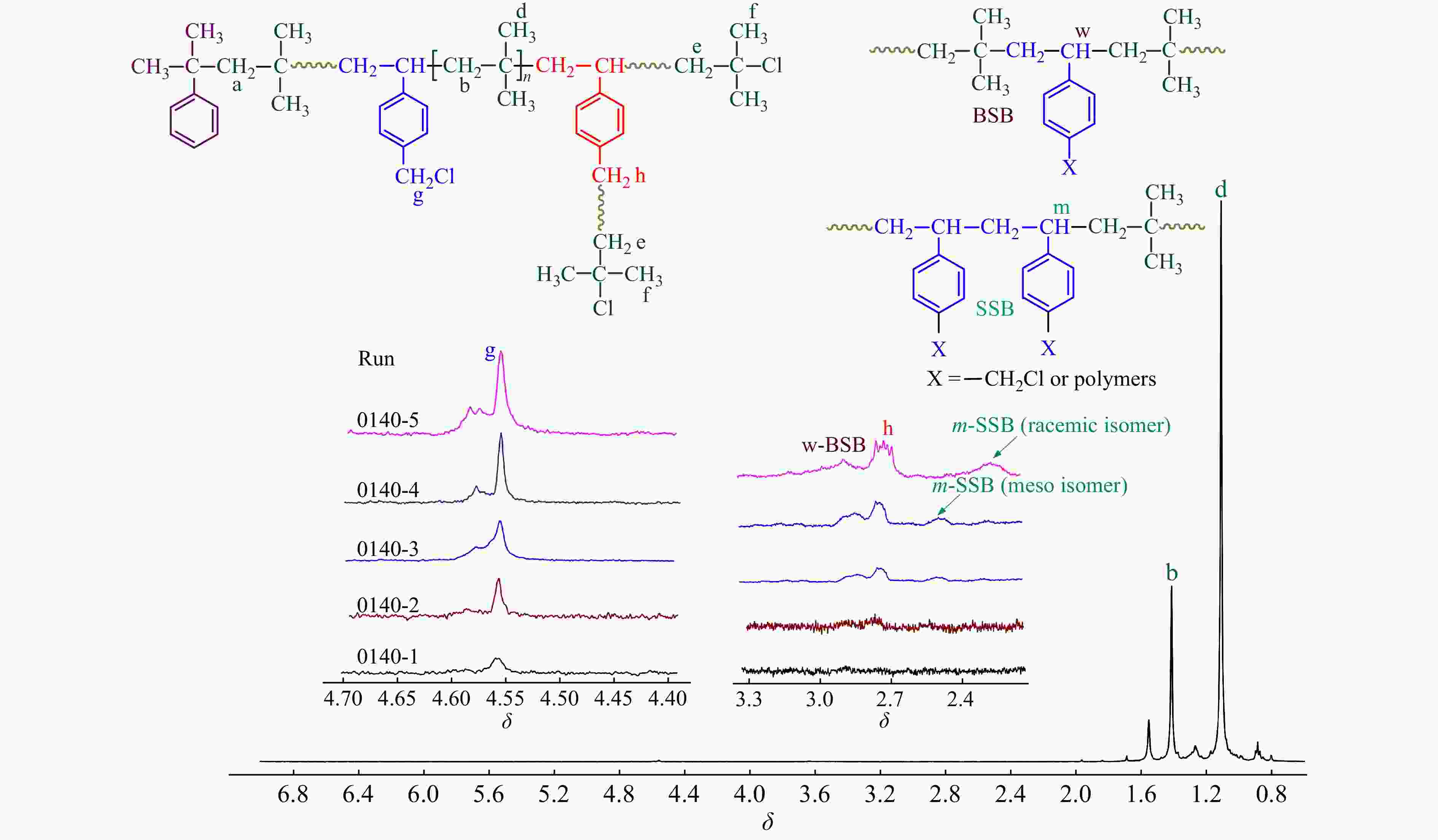
对共聚产物进行了1H-NMR表征,结果如图7所示. 可以看出:(1)随单体转化率的提升,δ = 4.56处苄基氯特征峰逐渐加强;(2) δ = 2.75处苄基氯引发特征峰也开始出现,并不断增加. 根据1H-NMR表征结果,在图4中还绘制了共聚合过程中,IB与p-CMS各自的单体转化率曲线. 从图4可以看出,IB单体的聚合速度要比p-CMS快,这对应了二者的竞聚率数据;随着共聚合时间的延长,p-CMS的浓度相对于IB的浓度不断提升,因此p-CMS在分子链中的含量逐渐增加,且增加的趋势越来越快.
图 7
相比于PIB末端叔丁基氯活性中心,p-CMS中的苄基氯为慢引发[24],在反应初期苄基氯不参与引发,共聚物为线性结构;随反应时间延长,共聚物中苄基氯的引发机率也不断提高,开始形成苄基活性中心引发聚合,形成支化,δ = 2.75处苄基氯引发特征峰强度逐渐增加. 需要特别注意的是,在不同时间下的1H-NMR核磁谱图中,均未观察到明显的苯乙烯双键残留峰,这进一步表明,p-CMS单体几乎不参与直接引发.
通过1H-NMR还可以研究p-CMS在共聚物中的序列分布. 从图7中可以看出,由于两者共聚能力相差较大,在聚合初期,p-CMS的共聚量较少,多以无规共聚(BSB)形式存在;随共聚含量的增加,δ = 2.55和2.3处SSB特征吸收峰出现,并不断增加[25].
表4给出了不同时间下,p-CMS共聚含量、苄基氯残留量以及不同序列结构含量的计算结果. 可以发现,在聚合初期,苄基氯含量达到0.69%,其残留率相对较高,接近BIMS (Exxpro 3433牌号)的苄基官能团的含量;随着时间延长,p-CMS共聚含量逐渐增加,分子链中的苄基氯参与引发,形成支化,整体苄基氯含量变化不大.
2.4 共聚合温度
为了更全面地考察p-CMS的引发活性,在−60和−40 °C下,进行了IB与p-CMS的共聚合. 表5给出了单体转化率以及产物的核磁表征结果. 可以看出,提高聚合温度,明显降低了共聚合速率,在−40 °C下,反应时间90 min时,单体转化率仅达到23%. 图8和图9分别为相近转化率时,−40和−60 °C条件下共聚物的核磁谱图. 从图8和图9中可以清晰地观察到以下特征峰:δ = 1.68和1.96 处叔丁基氯吸收峰;δ = 4.56 处苄氯亚甲基质子吸收峰;δ = 2.75处苄氯引发特征峰等. 另外,在δ = 5.2和5.7处未观察到乙烯基残留峰,表明与−80 °C下的现象一致,p-CMS单体中的苄基氯在−60和−40 °C下,同样不能引发共聚合反应.
表 5
Run Reaction
time (min)Reaction
temp. (°C)Conversion
(%)$F_{{\rm CH}_2 {\rm Cl}} $ 

(mol%)ICMS
(mol%)BSB
(mol%)SSB
(mol%)1018-4 45 −40 9.62 NA NA NA NA 1018-6 90 −40 23.08 0.88 1.61 74.00 32.00 1018-8 20 −60 15.31 NA NA NA NA 1018-9 30 −60 20.19 0.66 0.99 59.49 40.51 1018-10 45 −60 26.12 NA NA NA NA 1018-11 60 −60 39.42 0.89 1.33 56.59 43.41 1018-12 90 −60 51.92 0.71 1.6 71.83 28.17 Conditions: CMS/IB = 5/100. [IB] = 1.63 mol/L, [CumOH] = 0.004 mol/L, [DTBP] = 0.005 mol/L, [TiCl4] = 0.045 mol/L 图 8
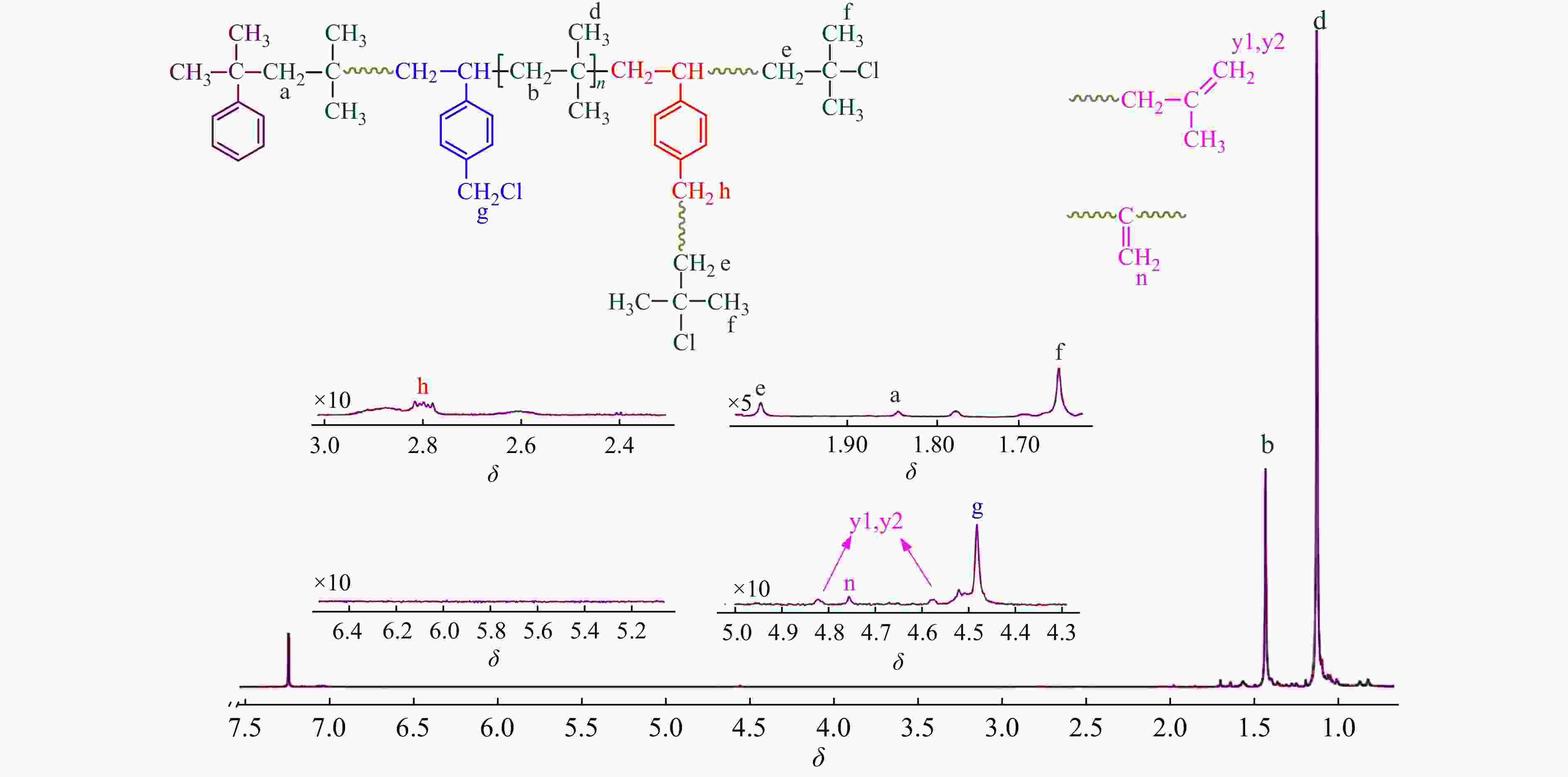 Figure 8. 1H-NMR spectrum of the resulting copolymer (run 1018-6 in Table 5)
Figure 8. 1H-NMR spectrum of the resulting copolymer (run 1018-6 in Table 5)图 9
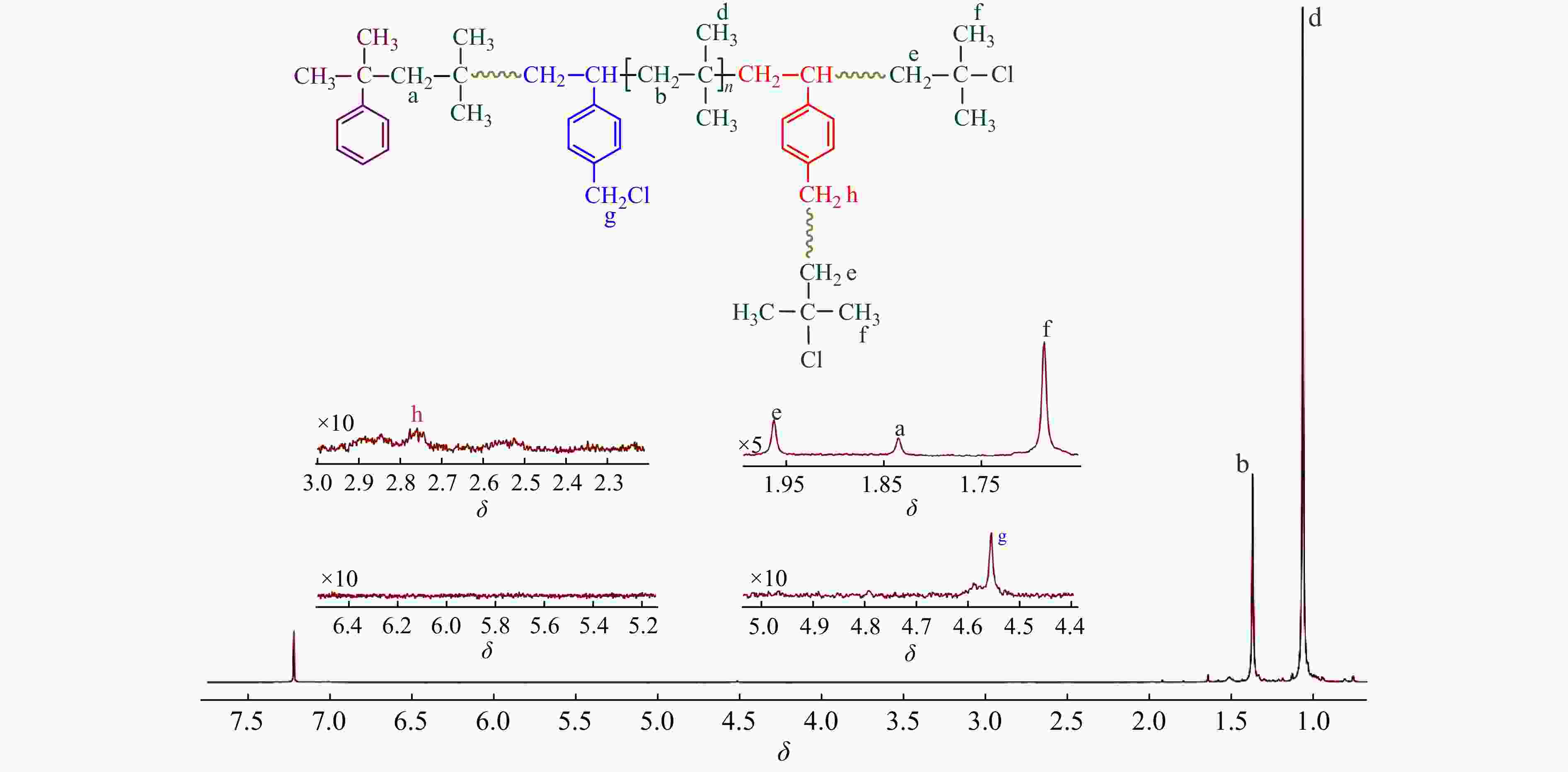 Figure 9. 1H-NMR spectrum of the resulting copolymer (run 1018-9 in Table 5)
Figure 9. 1H-NMR spectrum of the resulting copolymer (run 1018-9 in Table 5)与图2以及图9相比,在图8 δ = 4.64/4.85,以及δ = 4.79处观察到了少量PIB末端双键以及PIB活性末端双键发生异构化形成的内乙叉基特征吸收峰[18]. 末端双键和内乙叉基与叔丁基氯的摩尔比值为15%. 这表明−40 °C时,共聚体系内发生部分末端质子脱除副反应,使部分端基丧失聚合活性. Faust等[26]研究发现,TiCl4共引发的IB正离子均聚合,在−40 °C时,会出现末端质子脱除副反应,这与本文的研究结果相吻合.
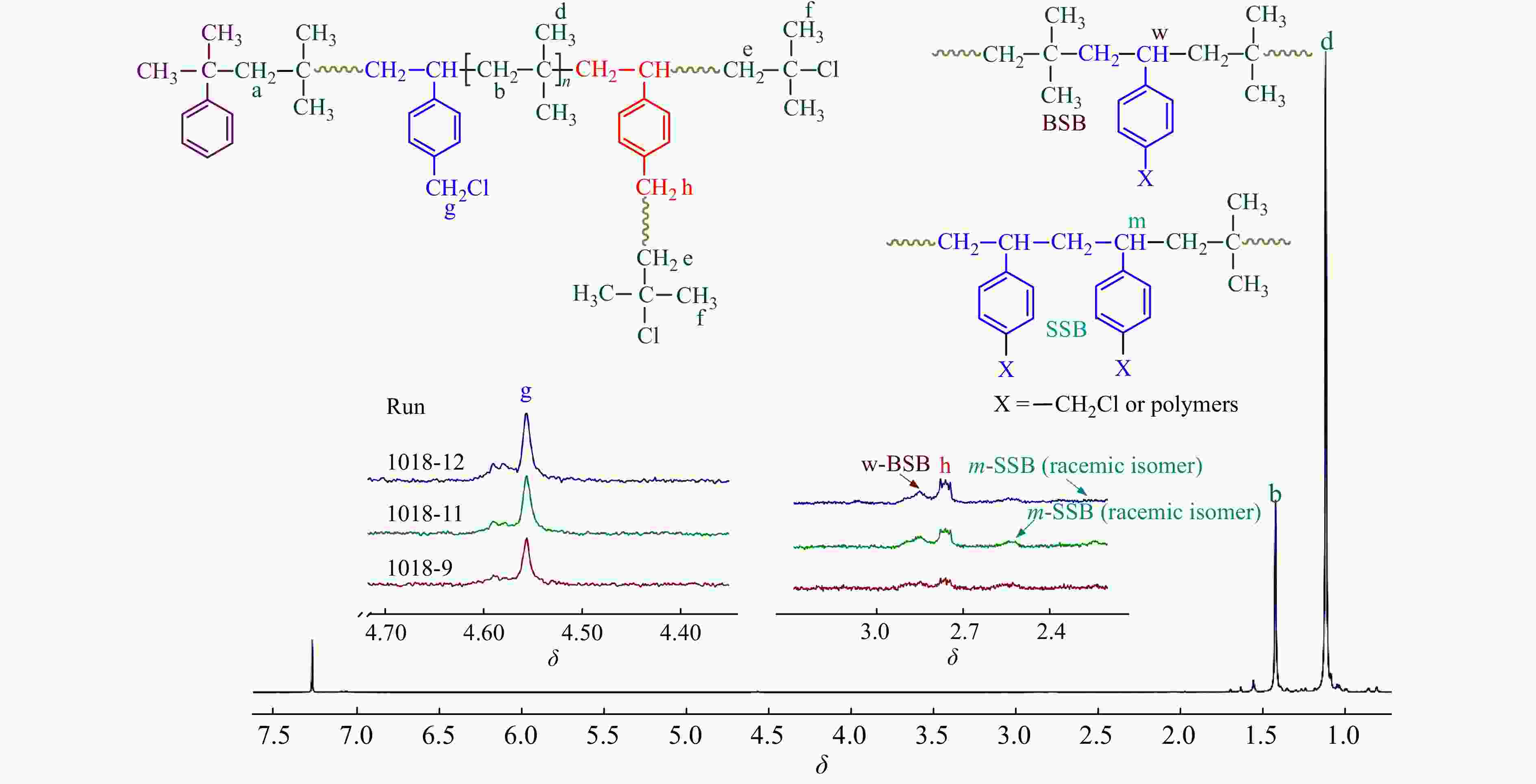
图10为−60 °C时,不同时间下共聚产物的核磁谱图. 从图10及表5中可得到与−80 °C时非常近似的结果:(1)在聚合过程中,随反应时间延长,共聚进入大分子链的p-CMS中的苄基氯不断参与引发,形成支化;(2) p-CMS多以BSB无规共聚形式参与共聚;(3)共聚物中残留苄基氯的含量在0.7% ~ 0.8%左右.
图 10
从温度实验结果看,提高聚合温度,明显降低共聚合速率,但对p-CMS的引发活性影响不明显. 因此,在进一步的研究工作中,将优选较低的聚合温度,以提高聚合速度,减少链末端质子脱除等副反应,提高共聚物分子量.
2.5 支化度
基于GPC-RI和1H-NMR数据,计算了平均每个分子链中的支化点数目,结果如表4所示. 随反应时间延长,共聚物支化点变多,支化程度不断提高. 这些聚合特征,表明TiCl4共引发的p-CMS与IB的正离子共聚合,属于自缩合乙烯基共聚合(SCVCP)聚合[27,28]:p-CMS作为inimer单体,既可以参与共聚,又可以引发聚合. 与大部分ATRP型[28]以及RAFT型[29,30]SCVCP聚合机理不同,由于苄基氯的慢引发,inimer单体p-CMS的单体自身引发现象不明显.
从表4还可以看出,当聚合时间小于45 min时,平均每个分子链中的支化点在1个以下,支化程度很低,接近于线性聚合物. 反应后期,共聚产物的支化程度不断上升,反应时间延长到90 min后,平均每分子链中的支化点达到3.59个. 显然,此时采用示差检测器,已不能够真实反映聚合物的实际分子量.
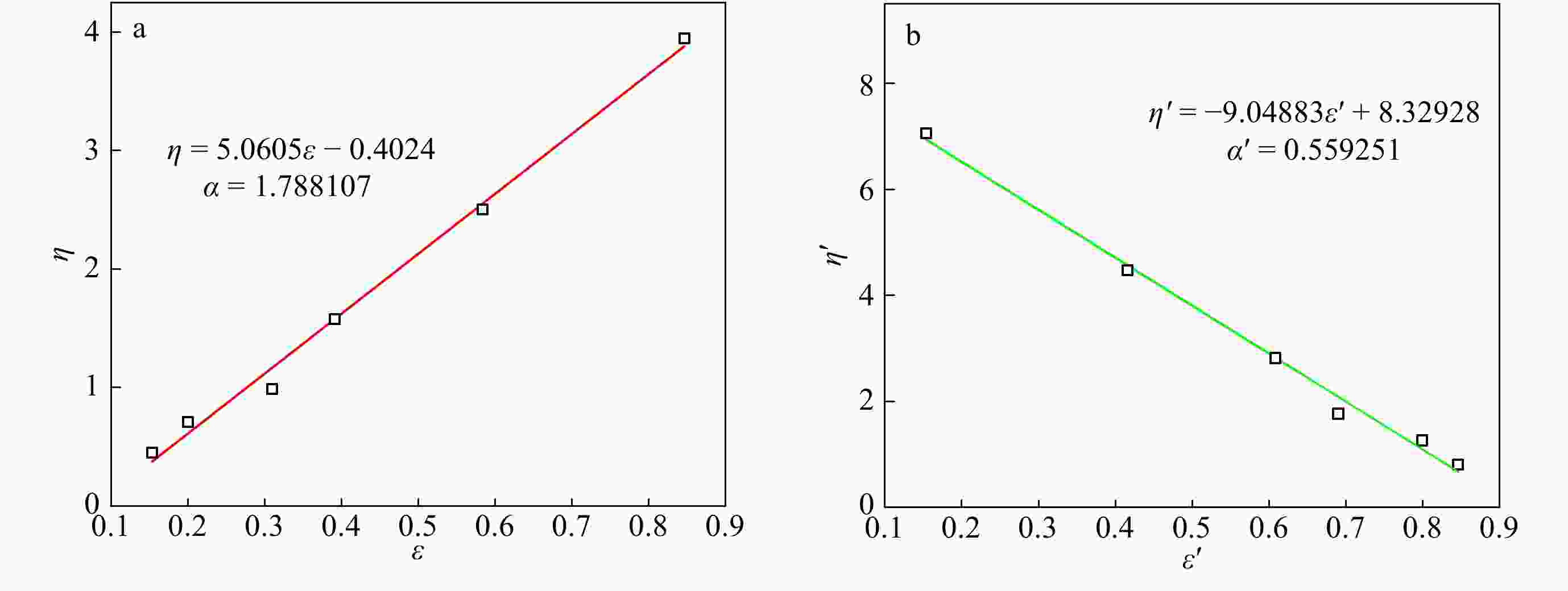
RI/LS/Vis三检测GPC可以通过多个检测器联用,得到绝对重均分子量、均方根旋转半径、特性黏度等数据. 通过特性黏度与绝对重均分子量之间的对数关系曲线,可以得到Mark-Houwink-Sakurada方程中的K, α值. 由于支化聚合物分子密度高,在同等分子量下,相比于线性聚合物具有更小的尺寸和更低的黏度. 因此,支化聚合物的α值会比线性聚合物的低. 图11给出了样品0410-5三检测GPC的测试结果,并与同样条件下TiCl4共引发得到的线性PIB作对比. 可以看出,光散射法测试的0410-5样品的绝对重均分子量明显大于GPC-RI的结果;线性PIB的α值为0.648,而共聚物样品的α值为0.535,这直观地证实了支化结构的存在.
图 11
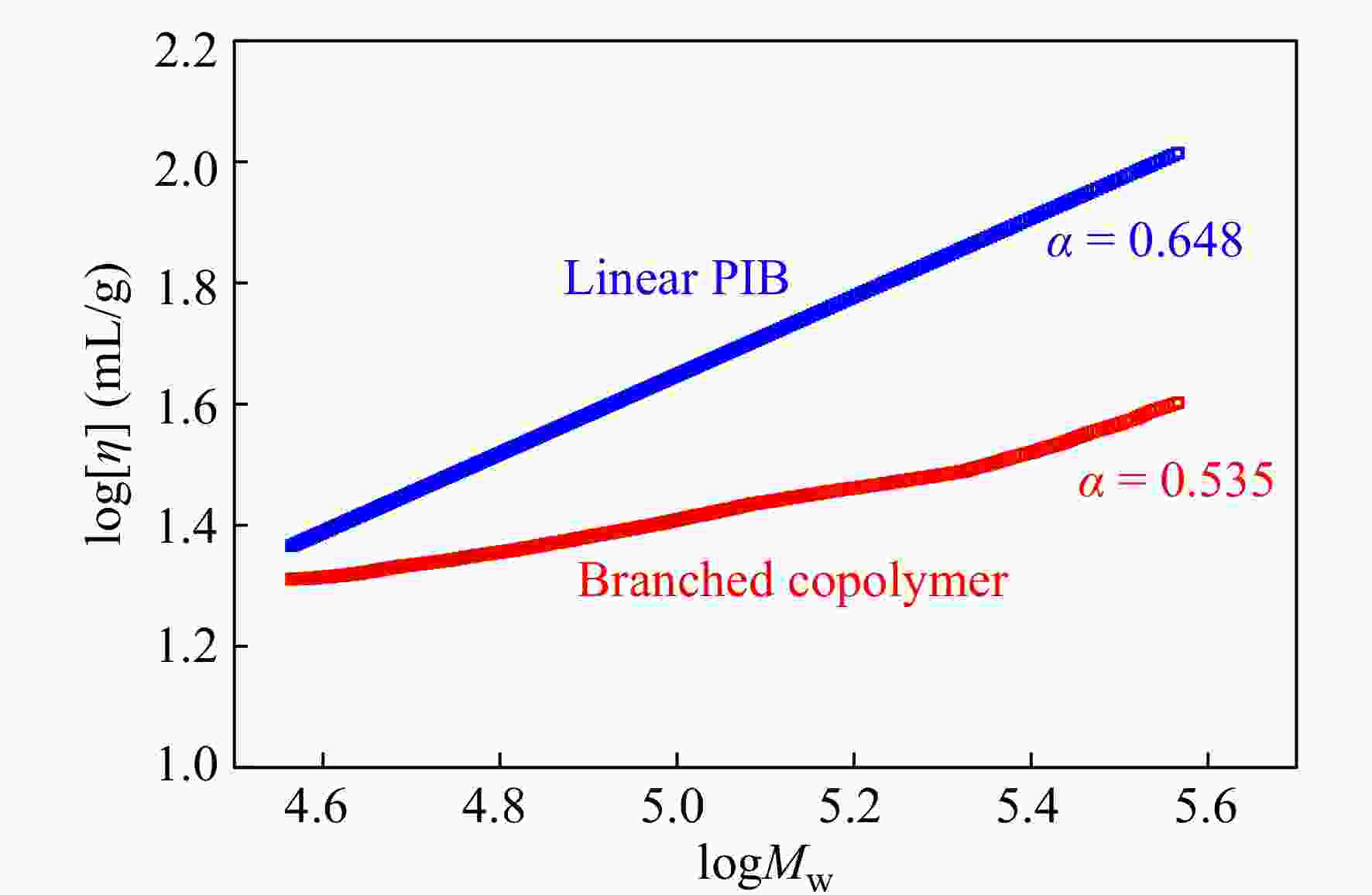 Figure 11. Mark-Houwink-Sakurada plots for linear PIB and IB/p-CMS copolymer (run 0410-5 in Table 4) (LS data: Linear PIB, Mn = 3.9 × 104, Mw = 8.6 × 104, MWD = 2.19; Copolymer, Mn = 5.3 × 104, Mw = 12.5 × 104, MWD = 2.37)
Figure 11. Mark-Houwink-Sakurada plots for linear PIB and IB/p-CMS copolymer (run 0410-5 in Table 4) (LS data: Linear PIB, Mn = 3.9 × 104, Mw = 8.6 × 104, MWD = 2.19; Copolymer, Mn = 5.3 × 104, Mw = 12.5 × 104, MWD = 2.37)2.6 DSC表征
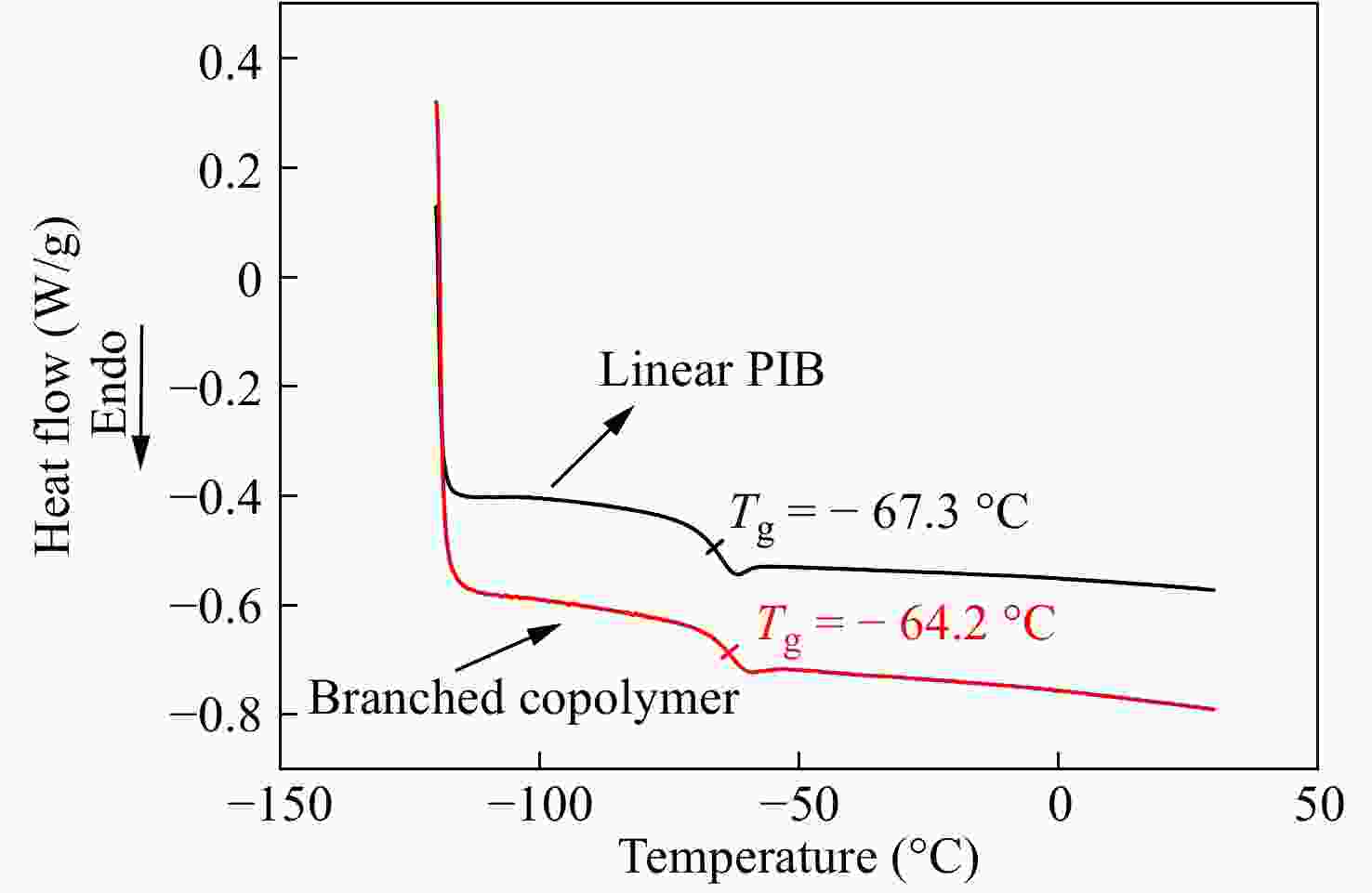
对产物还进行了DSC热分析,以观察支化对玻璃化转变温度(Tg)的影响. 图12为支化样品0410-4以及线性PIB的DSC曲线. 线性PIB的Tg = −67.3 °C,支化样品的Tg = −64.2 °C. Kennedy等[31]研究发现,IB与刚性单体苯乙烯共聚,会提高线性共聚物的玻璃化转变温度,基于PIB和PS的Tg,作者给出了理论与实验值吻合性良好的计算公式. 文献[32]给出聚对氯甲基苯乙烯的Tg = 105 °C,结合文献[31],可知未支化线性共聚物的理论Tg = −65.5 °C,这与实际测试结果非常接近. 这表明少量共聚及轻微支化对Tg影响不大,共聚物仍具有非常低的Tg,这非常有助于其在轮胎气密层中的应用.
图 12
2.7 共聚合机理
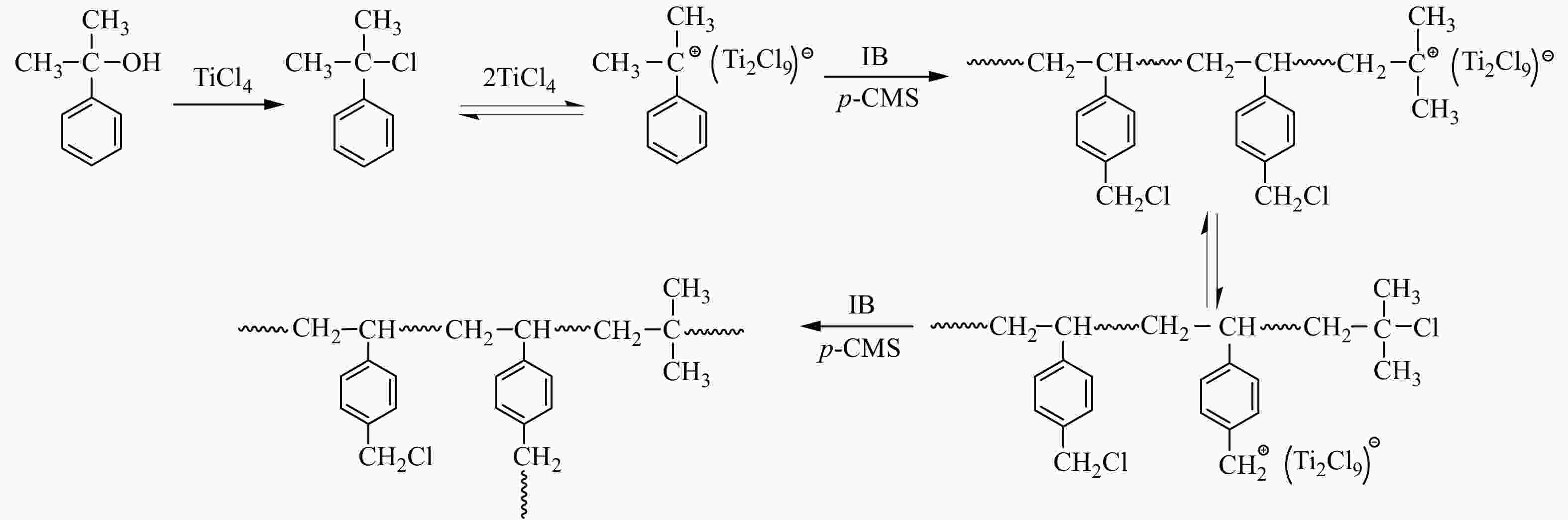
基于以上分析结果,初步归纳了TiCl4共引发p-CMS与IB正离子共聚合的机理(示意图1):TiCl4与枯基醇发生卤素交换,生成枯基氯,进而产生枯基碳正离子,引发共聚合;在聚合过程中,存在活性中心与叔丁基氯休眠种之间的平衡;随着共聚反应的进行,共聚到大分子链中的苄基氯缓慢参与引发,形成支化.
图 1
3. 结论
在−80 °C下的n-Hex/CH2Cl2 (V/V = 6/4)的混合溶剂内,采用路易斯酸性相对较弱的TiCl4作为共引发剂时,可以得到无凝胶单峰分布的p-CMS-IB共聚物(CIMS). o-CMS不能参与共聚,p-CMS的共聚活性较低. 随反应时间延长和单体转化率的提高,共聚物中p-CMS的含量以及产物分子量均逐渐增加. 相比于高活性的枯基引发剂,p-CMS单体几乎不参与引发,但随反应进行,共聚到大分子链中的苄基氯缓慢参与引发,形成支化. 支化产物具有较低的玻璃化转变温度. 提高聚合温度,共聚合速率降低,但p-CMS的引发活性未发生明显变化. 众所周知,支化结构赋予聚合物特有的流变学和物理机械性能[33,34]. TiCl4共引发可合成出链中含有高活性苄基氯基团,且同时具有支化结构的CIMS,在链中官能化PIB以及主链全饱和气密层橡胶等领域具有研究和应用价值. 如何进一步提高共聚物分子量,以及对共聚物支化结构、流变学性能以及物理性能的详细研究正在进一步进行.
致谢 感谢北京化工大学吴一弦教授课题组友情提供的三检测GPC测试.
-
-
[1]
Malmberg S E, Parent J S, Pratt D A. Macromolecules, 2010, 20: 8456 − 8461
-
[2]
Xie Zhonglin(谢忠麟). Journal of Rubber Technology Market(橡胶科技市场), 2008, (11): 7 − 8
-
[3]
Jones G D. US patent, 3067182. 1962-11-04
-
[4]
Jones G D, Runyon J R, Ong J. J Appl Polym Sci, 1961, 16: 452 − 459
-
[5]
Jones G D, Runyon J R, Ong J. Ind Eng Chem, 1961, 53: 291 − 298
-
[6]
Powers K W. US patent, 4074035. 1978-03-14
-
[7]
Powers K W. US patent, 3948868. 1976-04-06
-
[8]
Wang H C. CN patent, CN1468282A. 2004-01-14
-
[9]
Wang H C. CN patent, CN1636036A. 2005-07-06
-
[10]
Nuyken O, Gruber F, Pask S D. Makromol Chem, 1993, 194: 3415 − 3432 doi: 10.1002/macp.1993.021941220
-
[11]
Nuyken O, Sanchez J R, Voit B. Macromol Rapid Commun, 1997, 18: 125 − 131 doi: 10.1002/marc.1997.030180209
-
[12]
Grasmuller M, Rueda-sanchez J C, Nuyken O. Macromol Symp, 1998, 127: 109 − 114 doi: 10.1002/masy.19981270115
-
[13]
Nuyken O, Vierle M. Des Monomer Polym, 2005, 8: 91 − 105 doi: 10.1163/1568555053603233
-
[14]
Osman A. US patent, 5629386. 1997-05-13
-
[15]
Schafer M, Wieland, P C, Nuyken O. J Polym Sci, Part A: Polym Chem, 2002, 40: 3725 − 3733 doi: 10.1002/pola.10472
-
[16]
Kennedy J P. US patent, 4327201. 1982-04-27
-
[17]
Yan P F, Guo A R, Liu Q, Wu Y X. J Polym Sci, Part A: Polym Chem, 2012, 50: 3383 − 3392 doi: 10.1002/pola.26126
-
[18]
Liu Q, Wu Y X, Yan P F, Zhang Y, Xu R W. Macromolecules, 2011, 44: 1866 − 1875 doi: 10.1021/ma1027017
-
[19]
Kanaoka S, Sawamoto M, Higashimura T. Macromolecules, 1996, 29: 1778 − 1783 doi: 10.1021/ma951320j
-
[20]
Kamigaito M, Nakashima J, Satoh K, Sawamoto M. Macromolecules, 2003, 36: 3540 − 3544 doi: 10.1021/ma0216876
-
[21]
Ren Ping(任苹), Wu yibo(伍一波), Guo wenLi(郭文莉), Li ShuXin(李树新), Wang HongLiang(王洪亮), Xiao Fei (肖菲), Liu KeLong(刘克龙). China Elastomerics(弹性体), 2012, 22(1): 25 − 28 doi: 10.3969/j.issn.1005-3174.2012.01.006
-
[22]
Kelen T, Tüdős F. J Macromol Sci Part A, 1975, A9(1): 1 − 27
-
[23]
Cao Lina(曹丽娜), Luo Qingzhi(罗青枝), Xiao Libin(肖丽彬), Wang Desong(王德松), Dou Haiyang(窦海洋). Journal of Hebei University of Science and Technology(河北科技大学学报), 2010, 31(3): 195 − 200 doi: 10.7535/hbkd.2010yx03003
-
[24]
Held D, Ivan B, Muller A H E. Macromolecules, 2001, 34: 2418 − 2426 doi: 10.1021/ma000641e
-
[25]
Ashbaugh J R, Ruff C R, Shaffer T D. J Polym Sci, Part A: Polym Chem, 2000, 38: 1680 − 1686 doi: 10.1002/(SICI)1099-0518(20000501)38:9<1680::AID-POLA34>3.0.CO;2-Y
-
[26]
Fodor Z, Bae Y C, Faust R. Macromolecules, 1998, 31: 4439 − 4446 doi: 10.1021/ma980193z
-
[27]
Fréchet J M J, Henmi M, Gitsov I, Ashima S, Leduc M R, Grubbs R B. Science, 1995, 269: 1080 − 1083 doi: 10.1126/science.269.5227.1080
-
[28]
Simon P F W, Muller A H E. Macromolecules, 2001, 34: 6206 − 6213 doi: 10.1021/ma002156p
-
[29]
Zhang C B, Zhou Y, Liu Q, Li S X, Perrier S, Zhao Y L. Macromolecules, 2011, 44: 2034 − 2049 doi: 10.1021/ma1024736
-
[30]
Wang Z M, He J P, Tao J F, Yang L, Jiang H J, Yang Y L. Macromolecules, 2003, 36: 7446 − 7452 doi: 10.1021/ma025673b
-
[31]
Hull D L, Kennedy J P. J Polym Sci, Part A: Polym Chem, 2001, 39: 1515 − 1524 doi: 10.1002/pola.1128
-
[32]
Safa K D, Babazadeh M. Eur Polym J, 2004, 40: 1659 − 1669 doi: 10.1016/j.eurpolymj.2004.04.005
-
[33]
Voit B I, Lederer A. Chem Rev, 2009, 109: 5924 − 5973 doi: 10.1021/cr900068q
-
[34]
Gao C, Yan D. Prog Polym Sci, 2004, 29: 183 − 275 doi: 10.1016/j.progpolymsci.2003.12.002
-
[1]
-
Figure 8 1H-NMR spectrum of the resulting copolymer (run 1018-6 in Table 5)
Figure 9 1H-NMR spectrum of the resulting copolymer (run 1018-9 in Table 5)
Figure 11 Mark-Houwink-Sakurada plots for linear PIB and IB/p-CMS copolymer (run 0410-5 in Table 4) (LS data: Linear PIB, Mn = 3.9 × 104, Mw = 8.6 × 104, MWD = 2.19; Copolymer, Mn = 5.3 × 104, Mw = 12.5 × 104, MWD = 2.37)
Table 1. The experimental phenomenon with different initiating systems
Initiator Co-initiator Electron donor Phenomenon CumOH TiCl4 − Polymer; no gel; pale yellow H2O AlEtCl2 − Polymer and gel; red H2O AlEt1.5Cl1.5 − Polymer and gel; red H2O AlEt2Cl − No polymer H2O AlCl3 Anisole No polymer H2O AlCl3 Chloroacetyl chloride Polymer and gel; red Reaction conditions: [co-initiator] = 0.045 mol/L, [CumOH] = 0.01 mol/L, ED/AlCl3 (molar ratio) = 1.1/1, n-Hex/CH2Cl2 = 6/4 (V/V), [IB] = 1.63 mol/L, [CMS] = 0.33 mol/L, T = − 80 °C, reaction time = 30 min Table 2. Copolymer compositions by 1H-NMR
Run Conversion (%) Monomer feeding (%) Copolymer composition (%) IB p-CMS IB p-CMS − 100 0 100 0 1 11.4 97.88 2.12 99.54 0.46 2 9.5 91.65 8.35 97.96 2.04 3 13.9 82.95 17.05 95.36 4.64 4 8.5 73..95 26.05 90.94 9.06 5 7.56 64.60 35.40 88.13 11.87 6 7.3 54.89 45.11 82.02 17.98 − 0 100 0 100 Conditions: [IB] = 1.63 mol/L, [CumOH] = 0.004 mol/L, [DTBP] = 0.005 mol/L, [TiCl4] = 0.045 mol/L, reaction time = 6 min, T = −80 °C Table 3. sReactivity ratios of the p-CMS-IB copolymerization systems
Methods Positive sequence Reverse rIB rp-CMS rIB′ rp-CMS′ K-T 4.658 0.7195 4.6582 0.7196 YBR 4.676 ± 0.075671 0.6886 ± 0.02088 Average rIB = 4.67 rp-CMS = 0.70 Table 4. The 1H-NMR data of the resulting copolymers
Run Reaction time
(min)Mn,GPC,RI $F_{\rm CH_2 Cl} $ 

(mol%)ICMS
(mol%)Branching points
(per chain)BSB
(mol%)SSB
(mol%)0410-1 3 NA 0.69 0.69 0 100 0 0410-2 30 11700 0.8 1.08 0.58 100 0 0410-3 45 12680 0.82 1.23 0.93 72.46 27.53 0410-4 60 15670 0.76 1.45 1.93 70.92 29.08 0410-5 90 16220 0.89 2.13 3.59 59.17 40.83 Table 5. The monomer conversion and 1H-NMR data of the resulting copolymers
Run Reaction
time (min)Reaction
temp. (°C)Conversion
(%)$F_{{\rm CH}_2 {\rm Cl}} $ 

(mol%)ICMS
(mol%)BSB
(mol%)SSB
(mol%)1018-4 45 −40 9.62 NA NA NA NA 1018-6 90 −40 23.08 0.88 1.61 74.00 32.00 1018-8 20 −60 15.31 NA NA NA NA 1018-9 30 −60 20.19 0.66 0.99 59.49 40.51 1018-10 45 −60 26.12 NA NA NA NA 1018-11 60 −60 39.42 0.89 1.33 56.59 43.41 1018-12 90 −60 51.92 0.71 1.6 71.83 28.17 Conditions: CMS/IB = 5/100. [IB] = 1.63 mol/L, [CumOH] = 0.004 mol/L, [DTBP] = 0.005 mol/L, [TiCl4] = 0.045 mol/L -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 99
- 文章访问数: 7101
- HTML全文浏览量: 1271

 下载:
下载:
 下载:
下载:

