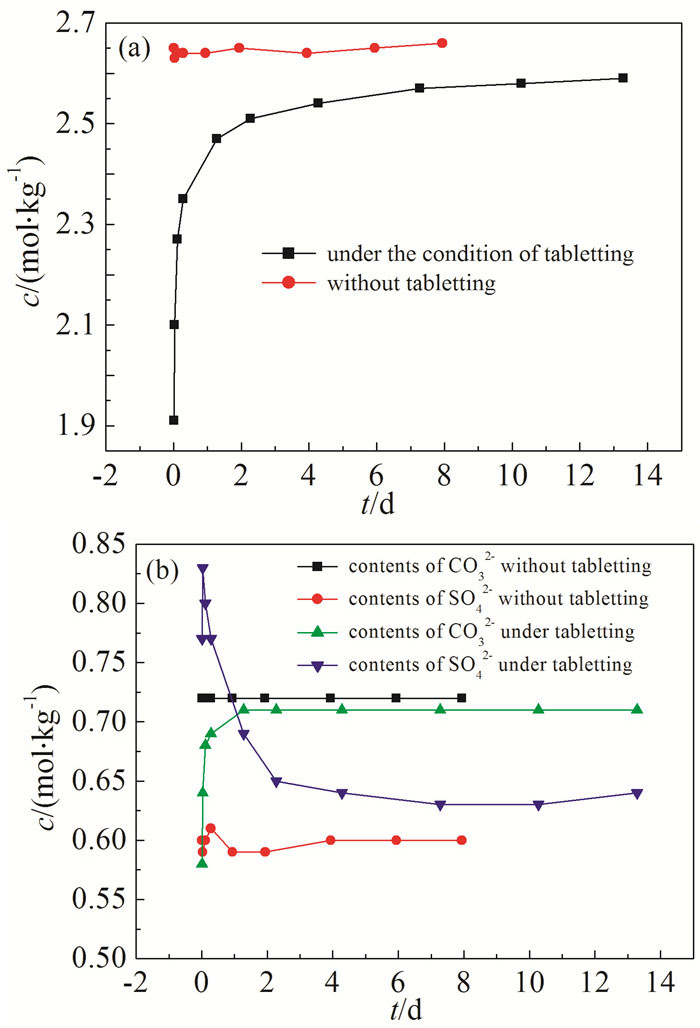
 图1
压片和不压片时Cl-、SO42-和CO32-的c-t曲线
Figure1.
Comparison of c-t curves for Cl- (a), SO42- and CO32- (b)
图1
压片和不压片时Cl-、SO42-和CO32-的c-t曲线
Figure1.
Comparison of c-t curves for Cl- (a), SO42- and CO32- (b)

Citation: Zhang Xiangfei, Bian Shaoju, Gao Dandan, Dong Yaping, Li Wu. Study on the Dissolution Kinetics of Na2CO3/Na2SO4/NaCl Mixture in Pure Water at 25℃[J]. Chemistry, 2017, 80(9): 852-857.

25℃下Na2CO3/Na2SO4/NaCl混合盐的溶解动力学研究
English
Study on the Dissolution Kinetics of Na2CO3/Na2SO4/NaCl Mixture in Pure Water at 25℃
-
Key words:
- Stirring speed
- / Common ion effect
- / Burkeite
- / Dissolution kinetics
- / Stumm model
-
西藏地区由于海拔高、生态环境脆弱、交通不便、远离电网等原因,没有建设大型化工厂的条件,因此本地区盐湖资源只能采用就地成矿、运出加工的方式进行开发利用。在西藏地区,存在大量富锂碳酸盐型盐湖,利用现有通用的盐田富集技术开发时,Li+无法富集。在利用自然能开发锂资源的技术过程中,发现经过夏季预富集的浓缩卤水在冬季会有大量含有Na2CO3、Na2SO4和NaCl的矿物析出,卤水中CO32-和SO42-含量大幅下降,过冬后的卤水有利于Li+的富集,得到富锂浓缩卤水。后续过程中,再以富锂浓缩卤水和冬季析出的Na2CO3、Na2SO4和NaCl混合盐矿为原料得到Li2CO3粗矿。该工艺技术的主要特点是盐湖现场Li2CO3粗矿的生产过程基本没有外加其他化工产品,以盐湖卤水中自带资源为原料,实现盐湖锂资源的分离提取,获得Li2CO3产品,使盐湖资源得以综合利用[1~4]。
上述工艺技术在盐湖富锂卤水分离提取Li2CO3生产中,面临提高Na2CO3、Na2SO4和NaCl混合盐矿利用率、获取高品质Li2CO3等问题,而这些问题均涉及Na2CO3、Na2SO4和NaCl混合盐的溶解动力学,但现有文献中未见这方面的研究报道。本文针对西藏盐湖锂资源分离提取过程中涉及的高碳酸根卤水制备工艺,通过模拟其冻出矿物组成,研究25℃下Na2CO3、Na2SO4、NaCl混合盐在水中的溶解过程,探究搅拌速度、加样量及氯化钠的量等不同实验条件对混合盐溶解过程的影响;同时,采用非线性拟合NaCl的溶解量与时间的关系,结合动力学模型得到其溶解的动力学方程,提出其溶解机理。
1 实验部分
1.1 试剂与仪器
无水Na2CO3、无水Na2SO4、NaCl均为分析纯级试剂,购自国药集团化学试剂有限公司。
恒温水浴槽(HH-S4,北京科伟永兴仪器有限公司);自动电子分析天平(BT224S,赛多利斯科学仪器有限公司);顶置数显搅拌器(EUROSTAR20 digital,IKA);循环水式真空泵(SHZ-D,巩义市予华仪器有限责任公司);电热恒温鼓风干燥箱(DGX-9143B,宁波海曙赛福实验仪器厂);超纯水机(UPT,西安优普仪器设备有限公司)。
1.2 实验方法
将Na2CO3、Na2SO4和NaCl三种盐分别充分研细后,在烘箱中105℃烘2h,然后按一定比例混合均匀。在压力为12MPa、保压时间为5min条件下,在直径为4cm的模具中压制高为10.60~10.70 mm的圆柱形样块,样块质量均为25.50~25.70 g左右,经计算样块的密度与NaCl晶体的理论密度相近。准确称取500g超纯水(比电阻>17MΩ·cm)加入三颈烧瓶中,置于25℃恒温水浴。当烧瓶中水温度恒定后加入经过压片处理后的样品,隔一定时间取样并分析各离子浓度,平衡后固相进行XRD测试。
1.3 分析方法
各离子分析方法:Cl-含量的测定采用汞量法,以二苯偶氮碳酰肼-溴酚蓝为混合指示剂,用标准Hg(NO3)2溶液滴定。CO32-含量测定采用GB/T 210.2-2004,以溴甲酚绿-甲基红为混合指示剂,用标准HCl溶液滴定。由BaSO4重量法[5]测定SO42-含量。固相用荷兰帕纳科公司X'Pert PRO衍射仪进行物种鉴定。
2 结果与讨论
2.1 压片对混合盐溶解的影响
两次实验的加样量均为281.18g,其中Na2CO3、Na2SO4和NaCl三种盐的质量比例为1:1.95:1.97。实验组对混合盐进行压片处理,对照组不进行压片处理,搅拌速度均为300 r/min。
图 1为Cl-、CO32-、SO42-的质量摩尔浓度(mol/kg)随时间变化曲线(c-t曲线)。可以看出,未对样品进行压片而直接进行溶解,20min左右体系达到溶解平衡,之后体系液相中Na2CO3的浓度完全不变,NaCl的浓度略有波动,而Na2SO4的浓度先增大后减小,随后趋于稳定。然而,对样品进行压片之后再进行溶解,体系要在13d左右才达到溶解平衡,溶解过程中,NaCl和Na2CO3的浓度先增加后不变,而Na2SO4的浓度先增大后减小再趋于稳定。并且相对而言,压片后体系中溶解的NaCl、Na2CO3比未压片体系中浓度低。分析认为由于压片的影响,混合盐被压成密实的块状,样块的内部不能与水直接接触,混合盐在样块表面逐层溶解,因此三种盐的溶解速度均减小。但在溶解过程中观察到样品溶解接触面上出现明显的凹凸点,凹凸点的形成与三种盐在水中溶解性的差异有关,三种盐中NaCl溶解速度最快,因此溶解过程并不完全遵循逐层溶解,最终导致液相中三种阴离子浓度出现差异。体系中NaCl浓度最高,其提供的Na+产生的同离子效应最大,因此其溶解速度成主要影响因素。NaCl溶解速度减小,体系中同离子效应影响小,Na2SO4的浓度能达到更大值;并且NaCl浓度小,Na2SO4饱和浓度增加[6],因此体系中Na2SO4可以达到更高的浓度。此时Na2SO4反过来抑制NaCl的溶解,同时与Na2CO3反应生成碳钠矾(Na6(CO3)(SO4)2),其反应方程式为:
在压片体系的平衡固相中检测出NaCl、Na2SO4和碳钠矾,而不进行压片的体系中并没有NaCl和碳钠矾(图 2)。因此在后面实验探讨其他因素对混合盐溶解的影响时,均对实验样品进行压片处理。
2.2 搅拌速度对混合盐溶解的影响
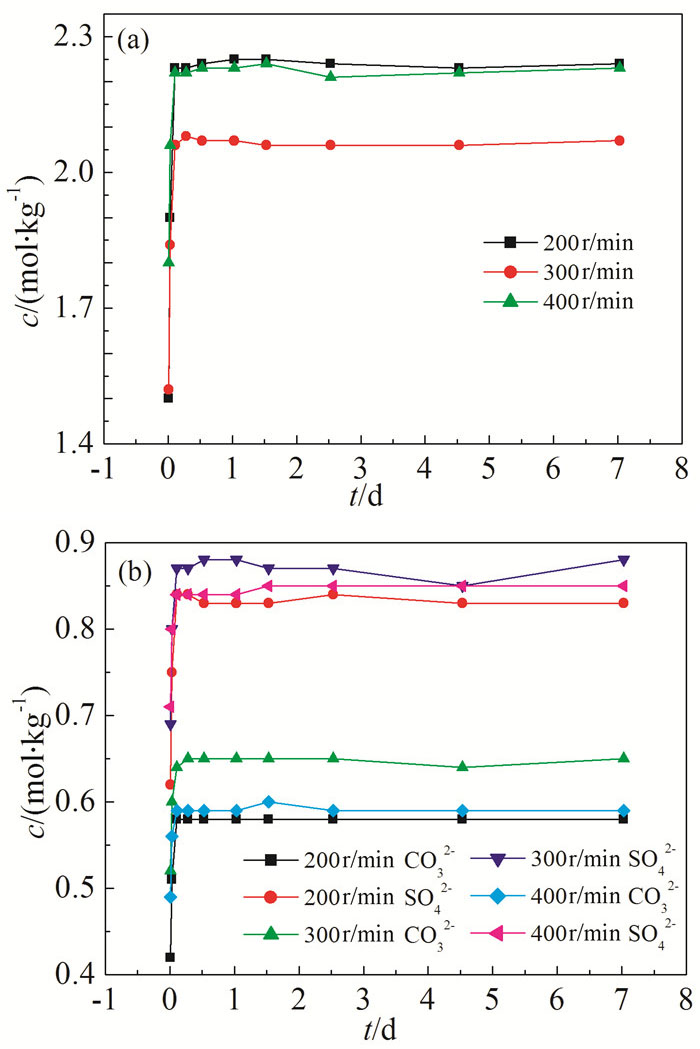
按上文描述同样的方法对混合盐进行压片处理,混合盐的比例不变,加样量均为230.70g,温度恒定为25℃,加入500g水作为溶剂,搅拌速度分别为200、300、400 r/mim,进行对比实验。
根据图 3中Cl-、CO32-、SO42-的c-t曲线可以看出,搅拌速度对NaCl溶解的影响规律不同于Na2CO3和Na2SO4。当搅拌速度为300r/min时,相比于其他两种搅拌速度,平衡时溶液中Na2CO3和Na2SO4的浓度最高,而NaCl浓度最低。分析认为,在溶解过程的前期,搅拌速度越快,盐的溶解速率越高,浓度越高;但随着溶解的进行,三种盐均为钠盐,由于此时同离子效应的影响占主导因素,因此NaCl的溶解速率会降低,所以300r/min时NaCl溶解速率最慢。同时NaCl的浓度越低,Na2SO4的饱和浓度越高,而且同离子效应的影响相对较小,因此300r/min时,Na2CO3和Na2SO4的溶解速率最高。
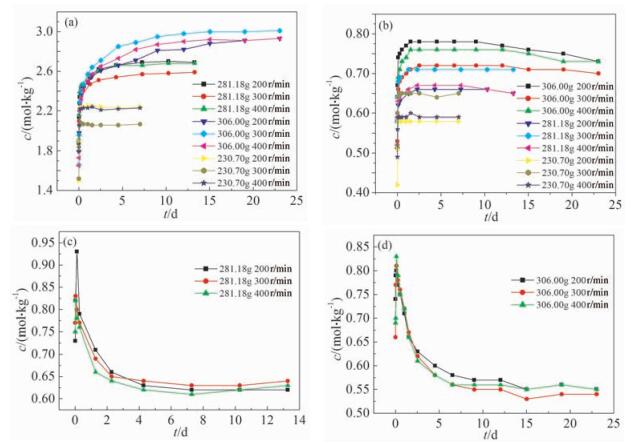
2.3 加样量对混合盐溶解的影响
样品按上文描述同样的方法进行压片处理,温度恒定为25℃,加入500g水作为溶剂,加样量分别为230.70、281.18、306.00 g,搅拌速度分别为200、300、400 r/min,进行对比实验。
根据图 4中Cl-、CO32-、SO42-的c-t变化曲线可知,加样量为281.18g、搅拌速度为300r/min时,NaCl溶解速率最慢,但Na2CO3和Na2SO4的溶解速率最高,与加样量为230.70g时一致;而当加样量增加为306.00g,搅拌速度为300r/min时,NaCl溶解速率最快,但Na2CO3和Na2SO4的溶解速率最慢,与加样量为230.70、281.18 g时相反。同时,随着加样量的增加,NaCl和Na2CO3的平衡浓度增加,但Na2SO4的平衡浓度却在减小,并且随着加样量的增加,Na2CO3的平衡浓度增加幅度变大。分析认为,随着加样量的增加,溶液中Na2CO3与Na2SO4达到一定浓度后形成碳钠矾,因此搅拌速度快的先形成碳钠矾,反过来降低两者的浓度,这时NaCl受到同离子效应影响减小,NaCl溶解速率增加。同时由于同离子效应影响,NaCl浓度高反过来抑制Na2CO3与Na2SO4的溶解,因此当加样量增加到306.00g、搅拌速度为300 r/min时,NaCl溶解速率最快,Na2CO3与Na2SO4溶解速率最慢。而Na2SO4的平衡浓度随着加样量的增加反而降低,是由于NaCl的饱和浓度增加,同离子效应使得Na2SO4的饱和浓度降低;而随着加样量的增加,Na2CO3的平衡浓度增加幅度变大则是由于体系中Na2SO4的浓度减小,因此形成的碳钠矾量减少,所以溶液中Na2CO3的平衡浓度增加幅度变大。
2.4 NaCl的量对混合盐溶解的影响
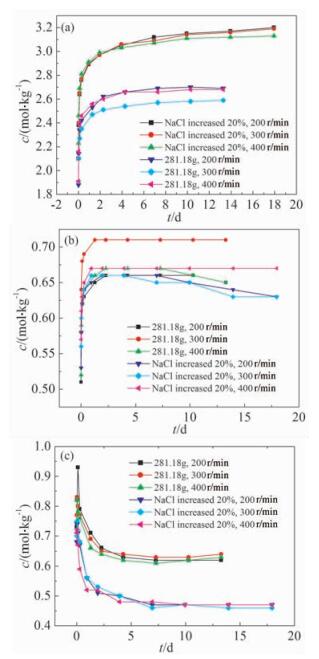
样品按上文描述同样的方法进行压片处理,温度恒定为25℃,加入500g水作为溶剂,在上述加样量为281.18g实验的基础上,Na2CO3、Na2SO4的量保持不变,增加20%的NaCl,即Na2CO3、Na2SO4和NaCl的质量比为1:1.95:2.364。搅拌速度分别为200、300、400 r/min,进行对比实验。
根据图 5中Cl-、CO32-、SO42-的c-t变化曲线可知,在加样量为281.18g的基础上增加20%的NaCl,溶解过程的初始阶段,搅拌速度为400r/min时,混合物中的三种盐的溶解速度均是三种转速下最快的,但随着溶解的进行,搅拌速度快的反而溶解速度相对较低。分析认为,混合物刚开始溶解时,三种盐的溶解速率随搅拌速度的增加而增加,但随着混合盐溶解的进行,溶液中溶解的钠盐总量增加,此时同离子效应为主要影响因素,搅拌速度为400r/min时,前期三种盐的溶解量最大,因此同离子效应最大,反过来抑制NaCl的溶解速率,因此NaCl溶解速率最低。同时,由于Na2SO4的浓度先增加后减小,相对于加样量为281.18g时,三种搅拌速度下的Na2SO4浓度的最高值均有所降低;而搅拌速度为400r/min时,Na2SO4受到NaCl的同离子效应的影响最大,浓度的最高值最低,因此我们推测此时Na2SO4浓度不足以与Na2CO3形成碳钠矾,因此体系中Na2CO3的浓度最高。
3.5 不同条件下Cl-的溶解动力学方程
当溶解受扩散过程控制时,符合Stumm模型[7]:
式中,c∞为该盐溶解的平衡浓度(或溶解度),ct为该盐在t时刻时的溶解浓度,K为表观速率常数,n为反应级数。
但当溶解过程比较复杂,除了包含界面反应和扩散过程外,还伴随着化学反应时,应采用其修正形式[8]。
采用Cl-浓度变化,通过计算机编程计算得到体系中NaCl溶解动力学方程(表 1)。
 表 1
不同条件下体系中NaCl的溶解动力学方程
Table 1.
Kinetics equation of NaCl dissolution in the system under different conditions
表 1
不同条件下体系中NaCl的溶解动力学方程
Table 1.
Kinetics equation of NaCl dissolution in the system under different conditions
加样量/g 搅拌速度/(r/min) 溶解动力学方程 R2 200 dc/dt=62.133(2.241-c)1.161 0.99921 230.70 300 dc/dt=80.486(2.068-c)1.221 0.99928 400 dc dt=113.287(2.225-c)1.360 0.99783 200 dc/dt=80.317(2.691-c)3.957+0.00726 0.99189 281.18 300 dc/dt=97.253(2.587-c)3.832+0.00523 0.99647 400 dc/dt=97.613(2.683-c)3.748+0.00507 0.99697 200 dc/dt=11.378(2.930-c)5.655+0.0109 0.99642 306.00 300 dc/dt=7.236(3.015-c)4.708+0.0105 0.98777 400 dc/dt=4.886(2.934-c)3.912+0.00779 0.99046 200 dc/dt=23.368(3.200-c)4.623+0.00863 0.99721 281.18+20%NaCl 300 dc/dt=25.305(3.191-c)4.581+0.00780 0.99810 400 dc/dt=40.628(3.128-c)4.013+0.00544 0.99768 晶体溶解过程包含了三个步骤[9]:首先,构晶离子脱离晶格束缚并发生部分水化;随后,离子迁移至固液界面;最后为扩散过程。当加样量为230.70g时,我们用式(2) 对NaCl的c-t曲线进行拟合,得出溶解过程符合Stumm模型,属于扩散过程控制。而随着加样量的增加,发现用式(2) 拟合得不到较好的拟合方程,因此采用其修正形式进行拟合,发现式(3) 能得到较好的拟合方程。分析认为当加样量增加时,体系中Na2CO3和Na2SO4反应产生碳钠矾,因此该溶解过程包括界面反应和扩散过程外,还伴随着化学反应的发生。
3 结论
为确保样块的密度和NaCl的理论密度一致,确定了混合盐的压片条件,并通过对比实验验证了对混合盐压片的必要性。混合盐在水中溶解前期搅拌速度占主导因素,随着搅拌速度的增大,三种盐的溶解速率均增加,溶液中各离子浓度增加到一定浓度时,同离子效应占主导因素,含有相同阳离子的盐的溶解相互制约。加样量的增加,体系中开始形成碳钠矾,溶液中NaCl的平衡浓度增大,Na2SO4的平衡浓度大大减小,而体系中Na2CO3受同离子效应的影响较小,主要受碳钠矾生成反应的影响。通过计算机编程计算得出该体系下NaCl溶解动力学方程符合Stumm模型,属于扩散过程控制。同时随着加样量增加,在Stumm模型里加入一个修正项,说明此时除了扩散过程和界面反应外还存在化学反应。
-
-
[1]
C C Zhu, Y Y Dong, Z Yun et al. Hydrometallurgy, 2014, 149:143~147. doi: 10.1016/j.hydromet.2014.07.006
-
[2]
董亚萍, 李武, 曾云等. CN: 105905929A, 2016-08-31.
-
[3]
董亚萍, 李武, 曾云等. CN: 105858693A, 2016-08-17.
-
[4]
董亚萍, 李武, 乔弘志等. CN: 103553087A, 2014-02-05.
-
[5]
中国科学院青海盐湖研究所分析室. 卤水和盐的分析方法. 北京: 科学出版社, 1988.
-
[6]
赵天宇, 张虎元, 王志硕等. 岩土工程学报, 2015, 37(7): 1340~1347. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ytgc201507025&dbname=CJFD&dbcode=CJFQ
-
[7]
W Stumm, J J Morgan. Aquatic Chemistry:An Introduction Emphasizing Chemical Equilibria In Natural Waters.[2nd Ed.]. 1981.
-
[8]
夏树屏, 高世扬, 刘志宏等. 盐湖研究, 2003, 11(3): 9~17. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yhyj200303001&dbname=CJFD&dbcode=CJFQ
-
[9]
夏树屏, 刘志宏, 高世扬. 无机化学学报, 1993, 9(3): 279~285. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=wjhx199303009&dbname=CJFD&dbcode=CJFQ
-
[1]
-
表 1 不同条件下体系中NaCl的溶解动力学方程
Table 1. Kinetics equation of NaCl dissolution in the system under different conditions
加样量/g 搅拌速度/(r/min) 溶解动力学方程 R2 200 dc/dt=62.133(2.241-c)1.161 0.99921 230.70 300 dc/dt=80.486(2.068-c)1.221 0.99928 400 dc dt=113.287(2.225-c)1.360 0.99783 200 dc/dt=80.317(2.691-c)3.957+0.00726 0.99189 281.18 300 dc/dt=97.253(2.587-c)3.832+0.00523 0.99647 400 dc/dt=97.613(2.683-c)3.748+0.00507 0.99697 200 dc/dt=11.378(2.930-c)5.655+0.0109 0.99642 306.00 300 dc/dt=7.236(3.015-c)4.708+0.0105 0.98777 400 dc/dt=4.886(2.934-c)3.912+0.00779 0.99046 200 dc/dt=23.368(3.200-c)4.623+0.00863 0.99721 281.18+20%NaCl 300 dc/dt=25.305(3.191-c)4.581+0.00780 0.99810 400 dc/dt=40.628(3.128-c)4.013+0.00544 0.99768 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0



 下载:
下载:




 下载:
下载:

