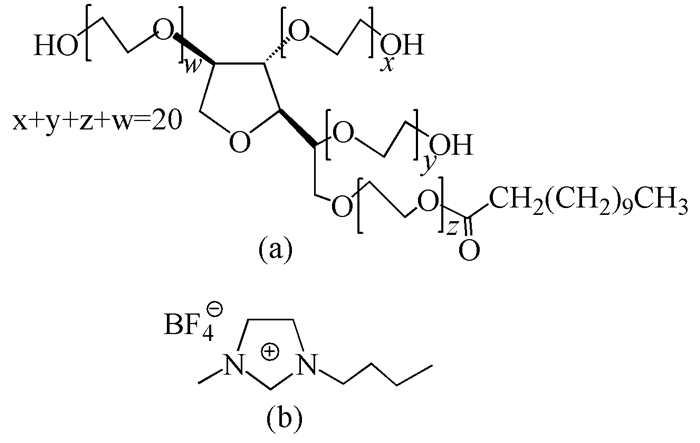
 图 1
吐温-20 (a)和[bmim][BF4] (b)的分子结构
Figure 1.
Chemical structure of Tween-20 (a) and [bmim][BF4] (b)
图 1
吐温-20 (a)和[bmim][BF4] (b)的分子结构
Figure 1.
Chemical structure of Tween-20 (a) and [bmim][BF4] (b)

Citation: Wang Guanshi, Wang Xiaoyong. Influence of Medium-low Concentration of Ionic Liquid [Bmim][BF4] on Critical Micellization Concentration and Micelle Structures[J]. Chemistry, 2017, 80(8): 777-782, 771.

添加中低浓度离子液体[bmim][BF4]对吐温-20临界胶束浓度和胶束结构的影响
English
Influence of Medium-low Concentration of Ionic Liquid [Bmim][BF4] on Critical Micellization Concentration and Micelle Structures
-
离子液体(ILs)具有液程宽、几乎可忽略的蒸气压、增溶性强、电导率高、结构性能高度可调控等一系列优异的性质[1~3],被称为“绿色溶剂”,在催化和有机合成[4]以及CO2捕集、液液及液固分离等方面有广泛应用[5, 6]。近年来,许多科研工作者研究了ILs作为溶剂对表面活性剂胶束化行为的影响。Łuczak等[7]研究了吐温-20在11种纯咪唑鎓类ILs中的胶束化过程,他们发现,随着ILs疏水链长的增加,吐温-20的临界胶束浓度(CMC)将增大1~2个数量级,并且,ILs的阴离子也对吐温-20的CMC有影响。Wu等[8]采用表面张力、冷冻蚀刻透射电镜和核磁共振研究了纯四氟硼酸1-丁基-3-甲基咪唑鎓([bmim][BF4])以及六氟磷酸1-丁基-3-甲基咪唑鎓([bmim][PF6])与吐温-20之间的分子相互作用,发现作为溶剂的ILs会和吐温-20形成氢键网络,导致吐温-20的分阶段聚集及CMC的显著变大。另一方面,一些文献也报道了添加ILs能够改变表面活性剂在水溶液中的胶束化行为。Behera等[9]发现,加入0~0.07 mol/L的[bmim][PF6]会对十二烷基硫酸钠(SDS)的CMC、反离子结合度和微粘性带来不同、甚至相反的影响。Lin等[10]发现,当加入极少量ILs(4.4、13.2 mmol/L)时,ILs与SDS胶束的缔合会使SDS的CMC略微下降。Pal等[11]通过电导法、表面张力法和荧光法研究了加入3.5mmol/L的六氟磷酸1-戊基-3-甲基咪唑鎓([C5mim][PF6])对SDS的CMC以及胶束聚集数的影响,发现ILs浓度的增加会抑制SDS胶束的聚集,形成聚集数更小的聚集体。通常添加电解质会促进表面活性剂生成胶束,所以上述文献报道的添加ILs使表面活性剂CMC的增大及胶束生成抑制作用与电解质效应并不相同。同时,也表明表面活性剂的CMC和胶束结构与添加的ILs浓度密切相关。虽然有许多文献报道了ILs对表面活性剂聚集行为的影响,但大多研究者是将ILs作为溶剂或者低浓度的添加剂(一般低于0.05mol/L)[12],系统研究ILs浓度对表面活性剂胶束化行为的影响,尤其是聚焦于ILs的加入对非离子表面活性剂胶束结构影响的报道更为有限。
本文旨在研究添加中低浓度ILs对非离子表面活性剂胶束化行为的影响。在298~328 K下,使用荧光探针法测定了吐温-20在0~0.2 mol·L-1 [bmim][BF4]中的CMC,计算了吐温-20生成胶束的热力学函数。同时,采用稳态荧光和动态光散射方法研究了[bmim][BF4]的加入对于吐温-20胶束聚集数、粒径和微粘性的影响。
1 实验部分
1.1 试剂
吐温-20(Tween-20,分析纯)、1, 6-二苯基-1, 3, 5-己三烯(DPH,98%)、芘(98%)购自Sigma Aldrich试剂有限公司([bmim][BF4],97%), 购自阿拉丁试剂有限公司;二苯甲酮(化学纯)购自国药化学集团试剂有限公司。实验用水为重蒸水,其他化学试剂均为分析纯级。吐温-20和[bmim][BF4]的分子结构如图 1所示。
1.2 临界胶束浓度
采用岛津RF-5301型荧光分光光度计测定荧光探针芘的发射光谱。使用超级恒温槽控制测试温度为298~328 K,荧光分光光度计激发和发射光的狭缝宽度均为3nm,激发波长为335nm。以芘的荧光发射光谱中373和384 nm处荧光峰强度的比值(I1/I3)表示体系的微极性[13],并确定吐温-20的CMC。
1.3 胶束聚集数
使用芘和二苯甲酮作为荧光探针和猝灭剂,采用稳态荧光猝灭法测定298K时不同浓度ILs存在下吐温-20的胶束聚集数(Nagg)。为了保证吐温-20已经形成胶束,选择吐温-20的浓度为2~3 mmol·L-1,远远高于其CMC。吐温-20的胶束聚集数通过式(1) 计算[14]:
其中,I0和I分别代表 373nm处无猝灭剂和加入猝灭剂时芘的荧光峰强度;cQ和cT分别代表猝灭剂浓度和吐温-20的浓度。
1.4 胶束粒径
使用Malvern Delsa Nano型动态光散射仪测定298K时2~3 mmol·L-1吐温-20胶束的Z均粒径分布。动态光散射测试角度为173°,每个样品连续测定3次,仪器精度为1%。
1.5 胶束微粘性
使用Perkin Elmer LS 55型荧光分光光度计测定298K时DPH探针的偏振荧光光谱。荧光各向异性值(r)通过式(2) 计算[15]:
其中,IVV和IVH分别为起偏器和检偏器两者平行(垂直/垂直)以及垂直(垂直/水平)时的荧光强度;G为仪器校正因子。
采用Perrin方程(式(3))计算吐温-20胶束微粘性(η)[16]:
2 结果与讨论
2.1 吐温-20的临界胶束浓度
在纯[bmim][BF4]中,芘的I1/I3值为1.65,这说明[bmim][BF4]具有比较强的亲水性[17]。[bmim][BF4]分子中含有的丁基碳链较短,疏水性较低,咪唑头基也具有一定位阻效应[18],这些因素也不利于[bmim][BF4]在水溶液中形成胶束。Inoue等[19, 20]发现,[bmim][BF4]在水溶液中的CMC为0.8~1 mol·L-1[21]。芘的I1/I3值在纯水中为1.78,加入0~0.2mol·L-1的[bmim][BF4]会使芘的I1/I3值下降到1.72。[bmim][BF4]分子较强的库仑力和极性导致其分子的疏水性较弱[22],所以加入0~0.2 mol·L-1的ILs只会略微降低芘的I1/I3值。
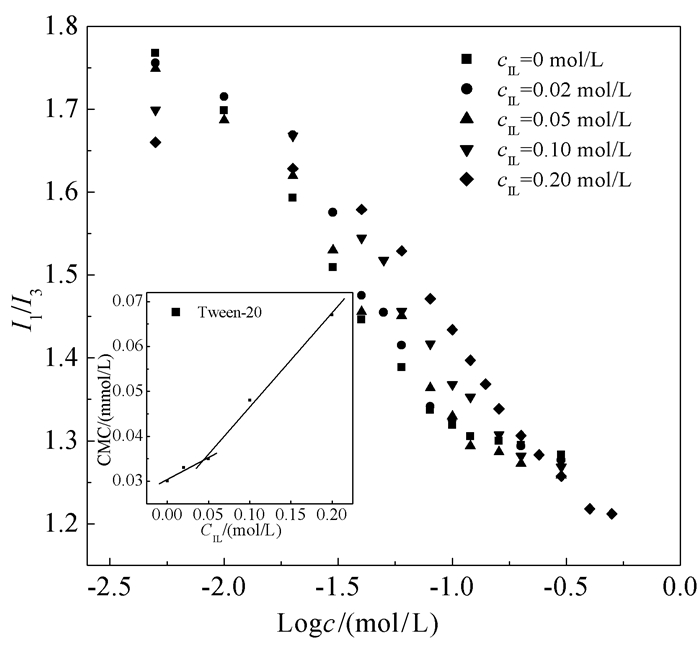
在不同浓度[bmim][BF4] (cIL)存在下,如图 2所示,芘的I1/I3值在表面活性剂浓度低于CMC时迅速下降,在高表面活性剂浓度时达到稳定,表明吐温-20胶束的生成。使用Boltzmann拟合获得了加入不同浓度ILs时吐温-20的CMC。图 2中的附图给出了吐温-20的CMC与cIL的变化曲线。通常认为吐温-20烷基链之间的疏水相互作用是其胶束生成的主要驱动力。加入[bmim][BF4]使吐温-20的CMC逐渐增大,说明ILs的加入会在一定程度上减弱表面活性剂的疏水相互作用,从而抑制吐温-20胶束的生成。这主要是如下原因:(1) 加入ILs对水分子结构的破坏会使其溶解更多的表面活性剂单体,并减弱吐温-20胶束的生成[11];(2) 分子动力模拟证明[23, 24],[bmim][BF4]咪唑基上的两个N之间C上的H原子具有很强的氢键形成能力,能够和吐温-20的含氧侧链形成氢键[8],这样会抑制吐温-20分子自身的聚集行为;(3)[bmim][BF4]中的咪唑阳离子带来的静电和位阻斥力也会使得吐温-20分子之间的疏水相互作用进一步降低[11]。特别值得注意的是,吐温-20的CMC随[bmim][BF4]浓度的变化并不呈现单一线性增大,这与Behera等[25]的研究结果一致。核磁共振研究表明ILs会缔合于表面活性剂胶束的栅栏层[26]。当cIL=0~0.05 mol/L时,[bmim][BF4]中的咪唑阳离子电荷密度较大,只有少部分ILs通过氢键缔合进入胶束栅栏层,ILs体现较大的电解质盐效应[9]。有文献报道表明,极低浓度ILs的加入会屏蔽离子型表面活性剂分子之间的静电斥力并压缩双电层,从而减小表面活性剂的CMC[10]。相比离子型表面活性剂而言,电解质是通过对疏水基的盐溶和盐析效应来影响非离子表面活性剂CMC的,所以一般影响较小[27]。但是也有报道表明,加入NaCl使吐温-20的CMC下降了0.02mmol/L[28],这是由于无机盐会破坏吐温-20胶束的水化膜,有利于吐温-20分子的紧密聚集。所以,当cIL=0~0.05 mol/L时,ILs的电解质效应会在一定程度上削弱ILs对吐温-20胶束生成的抑制作用。而cIL=0.05~0.2 mol/L时,大量ILs通过与吐温-20胶束的氢键缔合进入吐温-20胶束的栅栏层,ILs表现出明显的类助溶剂作用[25],使得吐温-20的CMC显著增大。
2.2 吐温-20胶束化热力学
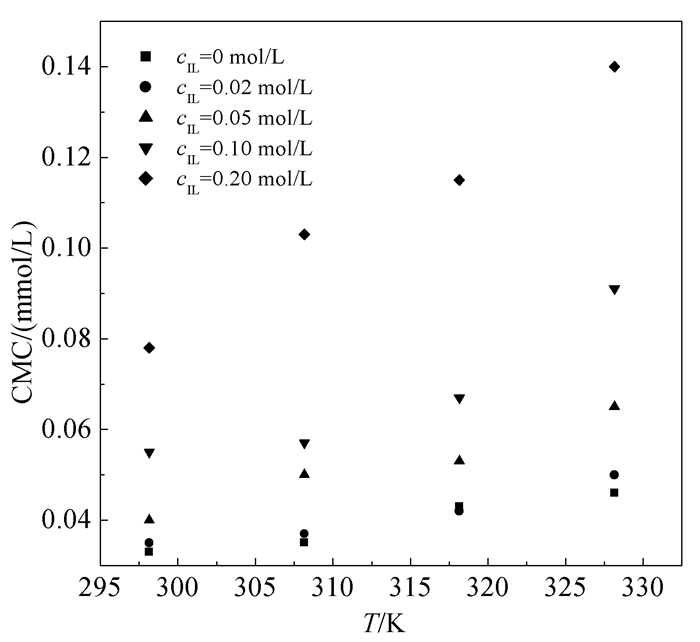
如图 3所示,当cIL=0~0.2 mol/L时,吐温-20的CMC随着温度的升高而逐渐增大。这是由于升高温度会破坏表面活性剂胶束的栅栏层及其疏水侧链周围的水结构[11],削弱表面活性剂的疏水作用[29]。在较高cIL条件下,由于大量ILs在吐温-20胶束栅栏层的缔合作用,升高温度会更容易破坏吐温-20胶束栅栏层,对吐温-20的胶束化产生更大的抑制作用。
利用不同温度下吐温-20的CMC数据,可以进一步计算吐温-20的胶束化热力学函数。根据Ghosh等[30]和Goto等[31]的研究结果,非离子表面活性剂以及含非离子表面活性剂的两相混合物的胶束化摩尔吉布斯自由能变(ΔGmic)、摩尔焓变(ΔHmic)、摩尔熵变(ΔSmic)可以分别通过式(4)、(5)、(6) 计算:
表 1列出了298~328 K时吐温-20的胶束化热力学函数。在所有条件下ΔGmic均小于0,表明吐温-20的胶束化是自发进行的。然而,增大ILs浓度会使ΔGmic的绝对值逐渐减小,这说明ILs的加入会导致吐温-20胶束化的自发性降低。ΔHmic < 0以及ΔSmic > 0表明吐温-20的胶束化是熵、焓共同驱动[11, 32]。同时,增大cIL以及升高温度都会使ΔHmic绝对值增大和ΔSmic减小,表明吐温-20的胶束化具有熵-焓补偿性[33],胶束化驱动力由熵驱动力向焓驱动力移动。ILs的加入会增强ILs与吐温-20以及ILs之间的氢键相互作用。升高温度会减弱水分子之间的氢键以及降低水分子簇断裂所需的能量[34],使得吐温-20胶束化的焓驱动力增强。
 表 1
不同温度时吐温-20胶束化的热力学函数
Table 1.
Thermodynamic parameters of Tween-20 micellization at different temperatures
表 1
不同温度时吐温-20胶束化的热力学函数
Table 1.
Thermodynamic parameters of Tween-20 micellization at different temperatures
cIL
/(mol·L-1)ΔGmic/(kJ·mol-1) ΔHmic/(kJ·mol-1) ΔSmic/(J·K-1·mol-1) 298K 308K 318K 328K 298K 308K 318K 328K 298K 308K 318K 328K 0 -25.58 -26.29 -26.59 -27.25 -8.88 -9.49 -10.12 -10.76 56.00 54.51 51.80 50.24 0.02 -25.43 -26.14 -26.66 -27.02 -8.80 -9.40 -10.02 -10.66 55.78 54.33 52.28 49.84 0.05 -25.10 -25.37 -26.04 -26.30 -11.20 -11.96 -12.75 -13.56 46.64 43.52 41.78 38.82 0.1 -24.30 -25.04 -25.63 -25.39 -11.65 -12.45 -13.27 -14.12 42.45 40.85 38.84 34.33 0.2 -23.45 -23.52 -23.99 -24.21 -13.78 -14.72 -15.69 -16.70 32.41 28.55 26.08 22.90 2.3 吐温-20胶束聚集数
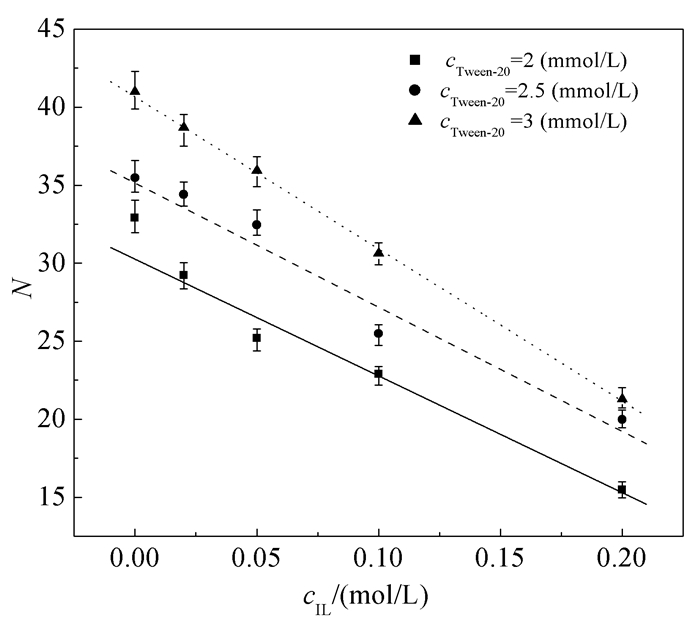
Acharya等[35]使用稳态荧光法测定了吐温-20的胶束聚集数(Nagg)。他们发现,当吐温-20浓度为0.1~6 mmol·L-1时,吐温-20的Nagg为22~82,而且其随着吐温-20浓度的增加而逐渐增大。本实验中,为了获得准确的Nagg,选择吐温-20浓度为2、2.5、3 mmol·L-1(远大于其CMC)。图 4给出了三个浓度时吐温-20的Nagg随cIL的变化曲线。无ILs时,三个浓度的吐温-20的Nagg分别为33、36和41,与文献报道值相符[36]。加入[bmim][BF4]会使吐温-20的Nagg几乎线性减小。如前所述,加入ILs会减弱吐温-20的疏水相互作用,对吐温-20胶束的生成有一定的抑制作用,使得吐温-20更容易生成聚集数更小的胶束。这一结果也表明,由于ILs缔合于吐温-20胶束的栅栏层,其咪唑基团所带电荷能够提高水分子对吐温-20胶束的渗透性[10]。
2.4 吐温-20胶束粒径
采用动态光散射(DLS)方法测定了吐温-20胶束的平均粒径。表 2列出了吐温-20胶束在不同浓度ILs存在下的平均粒径。当cIL=0~0.05 mol·L-1时,吐温-20胶束的平均粒径随着ILs浓度的增加而逐渐增大,继续增大ILs浓度反而使吐温-20胶束的平均粒径减小。加入ILs会使吐温-20具有更小的胶束聚集数。但是,ILs浓度较低时,缔合于胶束栅栏层ILs中的咪唑阳离子之间的静电和位阻斥力会使吐温-20分子聚集变得更加松散;同时,ILs与吐温-20之间的氢键作用会使吐温-20分子的乙氧基链被拉长[37],最终导致吐温-20胶束界面曲率降低和粒径增大[38]。而当cIL高于0.05mol·L-1时,吐温-20胶束聚集数减小会起到主导作用,ILs的类助溶剂作用会使吐温-20胶束的平均粒径降低。事实上,当[bmim][BF4]浓度为0.8mol·L-1时,DLS测定得到的吐温-20胶束平均粒径只有5nm左右。同时,表面活性剂浓度对于胶束粒径也有较大影响。从图 4中可以发现,随着吐温-20的浓度从2mmol·L-1增加至3mmol·L-1,不同ILs浓度下的胶束聚集数均上升了25%左右,使得混合胶束的粒径增大。从表 2可以看出,吐温-20浓度越大,ILs对胶束平均粒径变化的影响越小。这是因为较高的吐温-20浓度本身形成的胶束粒径较大,使得ILs拉长乙氧基链和类助溶剂的作用更不明显。
 表 2
不同离子液体浓度时的吐温-20胶束的平均粒径(nm)
Table 2.
Average particle sizes (nm) of Tween-20 micelles with increasing concentration of [bmim][BF4]
表 2
不同离子液体浓度时的吐温-20胶束的平均粒径(nm)
Table 2.
Average particle sizes (nm) of Tween-20 micelles with increasing concentration of [bmim][BF4]
cIL
/(mol·L-1)cTween-20/(mmol·L-1) 2 2.5 3 0 8.4 9.6 10.6 0.02 8.5 10.2 10.5 0.05 10.8 11.2 11.7 0.1 8.7 10.5 10.0 0.2 8.4 9.1 9.7 2.5 吐温-20胶束微粘性
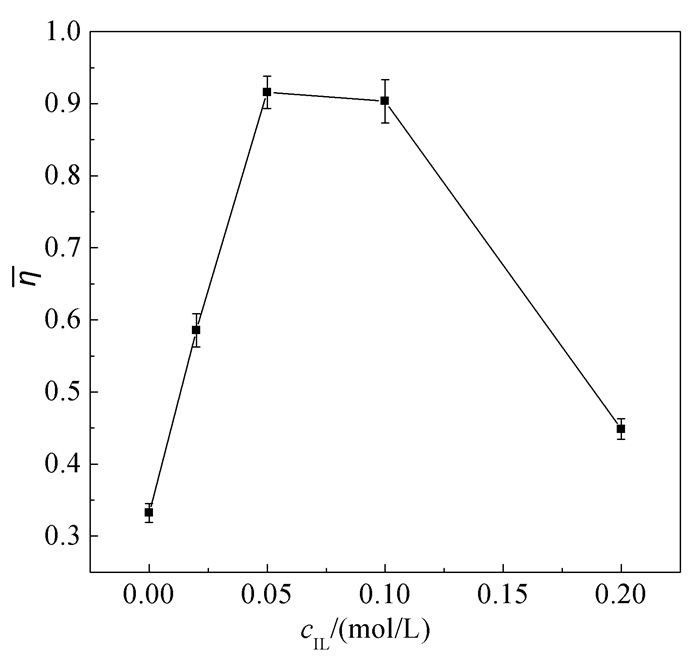
使用荧光偏振技术测定了缔合于表面活性剂胶束栅栏层的荧光探针1, 6-二苯基-1, 3, 5-己三烯(DPH)的各向异性(r),并进一步通过Perrin方程计算了吐温-20胶束的微粘度(η)。DPH探针分子的转动扩散和荧光各向异性受到其所在位置疏水微环境流动性的影响。r值越高,代表DPH在吐温-20胶束中旋转受限程度越大;η值越高,说明DPH所处的胶束疏水微区具有越大的微粘性。图 5给了3mmol·L-1吐温-20的胶束微粘性随ILs浓度的变化曲线。
随着cIL从0逐渐增大到0.2mol·L-1,η先增大后减小,在cIL=0.05mol·L-1时出现最大值。实验测定的各向异性r值均低于0.14,表明[bmim][BF4]的加入虽然在一定范围内会增大体系微粘性,但不会使得吐温-20胶束转变为囊泡[39]。当cIL较低时,ILs与吐温-20之间以及ILs自身形成的氢键作用都会对DPH的自由旋转带来一定的抑制作用[40~41],导致吐温-20胶束微粘性随着ILs浓度的增加而逐渐增大。有文献报道,加入离子会使表面活性剂体系的微粘性增加[39, 42]。在cIL低于0.05mol·L-1时,ILs表现出较强的电解质盐效应也是吐温-20胶束微粘性显著升高的原因之一。而当cIL高于0.05mol·L-1时,大量缔合于吐温-20胶束栅栏层的ILs使得水的渗透性提高[10],大大增加了疏水微区的流动性,导致吐温-20胶束微粘性逐渐减小。另外,DPH和游离ILs的结合可能也会使胶束微粘性下降。荧光偏振实验得到的结果与之前聚集数、DLS实验结果相吻合。
3 结论
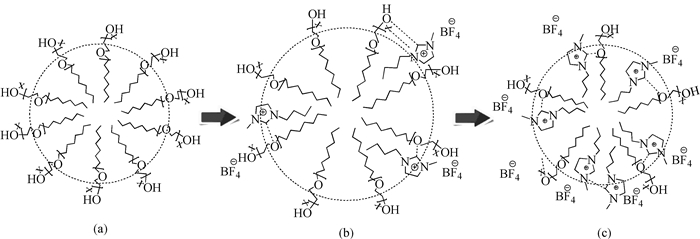
本文发现吐温-20的胶束化行为与ILs[bmim][BF4]的浓度有重要关系,图 6给出了不同浓度ILs时吐温-20的胶束结构示意图。ILs与吐温-20通过氢键和疏水作用缔合于吐温-20胶束的栅栏层,导致吐温-20临界胶束浓度的增大和胶束聚集数的减小。ILs对吐温-20胶束化的抑制作用或类助溶剂作用在其浓度高时表现得尤其明显。吐温-20胶束化行为具有熵-焓补偿性,加入ILs会使熵驱动力减小和焓驱动力增大。当ILs浓度低于0.05mol·L-1时,加入ILs会使吐温-20胶束平均粒径增大以及胶束微粘性升高。但是,当ILs浓度高于0.05mol·L-1时,吐温-20胶束聚集数的减小会占主导作用,导致吐温-20胶束平均粒径随ILs浓度的增加而减小。同时,大量水分子渗透进入吐温-20胶束,导致胶束微粘性的下降。
-
-
[1]
许锦凤. 辽宁大学硕士学位论文, 2012.
-
[2]
J Luczak, M Paszkiewicz, A Krukowska et al. Adv. Colloid Interf. Sci., 2016, 230:13~28. http://www.ncbi.nlm.nih.gov/pubmed/26329594
-
[3]
P Bharmoria, A Kumar. Biochim. Biophys. Acta, 2016, 1860(5):1017~1025. http://www.ncbi.nlm.nih.gov/pubmed/26342646
-
[4]
T Selvam, A Machoke, W Schwieger. Appl. Catal., 2012, 445~446(47):92~101. http://www.sciencedirect.com/science/article/pii/S0926860X12005273
-
[5]
D R MacFarlane, N Tachikawa, M Forsyth et al. Energy Environ. Sci., 2014, 7(1):232~250.
-
[6]
S Hwang, Y Park, K Park. J. Chem. Thermodyn., 2011, 43(3):339~343. http://www.sciencedirect.com/science/article/pii/S0021961410003046
-
[7]
J Łuczak, A Latowska, J Hupka. J. Colloids Surf. A, 2015, 471:26~37. http://www.sciencedirect.com/science/article/pii/S0927775715001284
-
[8]
J Wu, N Li, L Zheng et al. Langmuir, 2008, 24(17):9314~9322. doi: 10.1021/la801358z
-
[9]
K Behera, S Pandey. J. Colloid Interf. Sci., 2007, 316(2):803~814. http://www.sciencedirect.com/science/article/pii/S0021979707010594
-
[10]
J Lin, S Hou. J. Colloid Interf. Sci., 2016, 474:78~87. http://www.ncbi.nlm.nih.gov/pubmed/27107206
-
[11]
A Pal, S Chaudhary. J. Colloid Interf. Sci., 2013, 430(11):58~64. http://www.sciencedirect.com/science/article/pii/S0927775713002689
-
[12]
T Inoue. J. Colloids Surf. A, 2009, 337(1):240~246. http://europepmc.org/abstract/med/19435633
-
[13]
K Matsuoka, M Suzuki, C Honda et al. Chem. Phys. Lipids, 2006, 139(1):1~10. http://europepmc.org/abstract/med/16256096
-
[14]
J James, A Mandal. J. Colloid Interf. Sci., 2011, 360(2):600~605. http://europepmc.org/abstract/MED/21601865
-
[15]
R Alenaizi, S Radiman, I Rahman et al. J. Mol. Liq., 2016, 223:1226~1233. http://www.sciencedirect.com/science/article/pii/S0167732216310224
-
[16]
X Wang, J Wang, Y Wang et al. Langmuir, 2004, 20(1):53~56. http://europepmc.org/abstract/MED/15744999
-
[17]
王建英, 赵风云, 刘玉敏等. 化学学报, 2007, 65(15): 1443~1448. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb200715009&dbname=CJFD&dbcode=CJFQ
-
[18]
管孝梅. 安徽大学硕士学位论文, 2015.
-
[19]
T Inoue, H Yamakawa. J. Colloid Interf. Sci., 2011, 356(2):798~802. http://www.sciencedirect.com/science/article/pii/S0021979711000385
-
[20]
Y Hu, J Han, L Ge et al. Langmuir, 2015, 31(46):12618~12627. http://europepmc.org/abstract/MED/26536070
-
[21]
付素珍, 陈庆德, 沈兴海. 物理化学学报, 2011, 27(8): 1913~1918. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=wlhx201108021&dbname=CJFD&dbcode=CJFQ
-
[22]
Y Gao, N Li, L Hilfert et al. Langmuir, 2009, 25(3):1360~1365. http://test.europepmc.org/abstract/MED/19132875
-
[23]
T Inoue, Y Higuchi, T Misono. J. Colloid Interf. Sci., 2009, 338(1):308~311. http://www.ncbi.nlm.nih.gov/pubmed/19501832
-
[24]
D Patra, C Barakat. Spectrochim. Acta, Part A, 2011, 79(5):1823~1828. http://europepmc.org/abstract/MED/21684197
-
[25]
K Behera, S Pandey. J. Phys. Chem. B, 2007, 111(46):13307~13315. http://www.ncbi.nlm.nih.gov/pubmed/17967009
-
[26]
杨明桃. 江南大学硕士学位论文, 2008.
-
[27]
麻建国, 陈玉霞, 许时婴. 食品与生物技术学报, 2001, 20(4): 424~426. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=wxqg200104022&dbname=CJFD&dbcode=CJFQ
-
[28]
章苏宁. 光谱实验室, 2010, 27(4): 1231~1236. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gpss201004001&dbname=CJFD&dbcode=CJFQ
-
[29]
F Khan, M Sheikh, M Rub et al. J. Mol. Liq., 2016, 222:1020~1030. http://www.sciencedirect.com/science/article/pii/S0167732216311345
-
[30]
S Ghosh, S Moulik. J. Colloid Interf. Sci., 1998, 208(2):357~366. http://www.ncbi.nlm.nih.gov/pubmed/9845678
-
[31]
A Goto, M Takemoto, F Endo. Bull. Chem. Soc. Jpn., 1985, 58(1):247~251.
-
[32]
郑佩珠. 兰州大学博士学位论文, 2010.
-
[33]
马亚, 赖璐, 李峰等. 化学与生物工程, 2015, 10): 21~24. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hbhg201510006&dbname=CJFD&dbcode=CJFQ
-
[34]
J D Smith, C D Cappa, K R Wilson et al. PNAS, 2005, 102(40):14171~14174. http://europepmc.org/articles/PMC1242322/
-
[35]
K Acharya, S Bhattacharya, S Moulik. J. Photochem. Photobiol. A, 1997, 109(1):29~34. http://www.sciencedirect.com/science/article/pii/S101060309700110X
-
[36]
C Carnero, J Molina, J Aguiar et al. Colloid Polym. Sci., 2003, 281(6):531~541. doi: 10.1007/s00396-002-0801-1
-
[37]
Y Gao, N Li, X Li et al. J. Phys. Chem. B, 2009, 113(1):123~130. doi: 10.1021/jp809166f
-
[38]
K Kundu, B Paul. J. Chem. Thermodyn, 2013, 63:148~163. http://www.sciencedirect.com/science/article/pii/S0021961413001304
-
[39]
A Pan, S Rakshit, S Sahu et al. Colloids Surf. A, 2015, 481:644~654. http://www.sciencedirect.com/science/article/pii/S0927775715300510
-
[40]
S Paul, A Panda. Colloids Surf. A, 2013, 419:113~124. http://www.sciencedirect.com/science/article/pii/S0927775712008333
-
[41]
J Li, X Wang. Food Chem., 2015, 168:566~571. http://europepmc.org/abstract/MED/25172749
-
[42]
G Dutt. Langmuir, 2005, 21(23):10391~10397. http://europepmc.org/abstract/MED/16262297
-
[1]
-
表 1 不同温度时吐温-20胶束化的热力学函数
Table 1. Thermodynamic parameters of Tween-20 micellization at different temperatures
cIL
/(mol·L-1)ΔGmic/(kJ·mol-1) ΔHmic/(kJ·mol-1) ΔSmic/(J·K-1·mol-1) 298K 308K 318K 328K 298K 308K 318K 328K 298K 308K 318K 328K 0 -25.58 -26.29 -26.59 -27.25 -8.88 -9.49 -10.12 -10.76 56.00 54.51 51.80 50.24 0.02 -25.43 -26.14 -26.66 -27.02 -8.80 -9.40 -10.02 -10.66 55.78 54.33 52.28 49.84 0.05 -25.10 -25.37 -26.04 -26.30 -11.20 -11.96 -12.75 -13.56 46.64 43.52 41.78 38.82 0.1 -24.30 -25.04 -25.63 -25.39 -11.65 -12.45 -13.27 -14.12 42.45 40.85 38.84 34.33 0.2 -23.45 -23.52 -23.99 -24.21 -13.78 -14.72 -15.69 -16.70 32.41 28.55 26.08 22.90 表 2 不同离子液体浓度时的吐温-20胶束的平均粒径(nm)
Table 2. Average particle sizes (nm) of Tween-20 micelles with increasing concentration of [bmim][BF4]
cIL
/(mol·L-1)cTween-20/(mmol·L-1) 2 2.5 3 0 8.4 9.6 10.6 0.02 8.5 10.2 10.5 0.05 10.8 11.2 11.7 0.1 8.7 10.5 10.0 0.2 8.4 9.1 9.7 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:





 下载:
下载:

