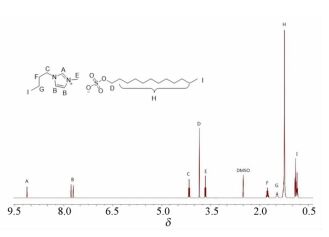
 图 1
[C4mim][C12H25SO4]的1H NMR谱图
Figure 1.
1H NMR spectrum for [C4mim][C12H25SO4]
图 1
[C4mim][C12H25SO4]的1H NMR谱图
Figure 1.
1H NMR spectrum for [C4mim][C12H25SO4]

Citation: Cui Hui, Tu Yan, Shang Yazhuo, Liu Honglai. Syntheses and Aggregation Behaviors of Ionic Liquid Surfactants 1-Butyl-3-methylimidazolium Alkyl Sulfate[J]. Chemistry, 2017, 80(7): 672-678.

离子液体表面活性剂烷基硫酸1-丁基-3-甲基咪唑鎓盐的合成及其在水溶液中的聚集行为
English
Syntheses and Aggregation Behaviors of Ionic Liquid Surfactants 1-Butyl-3-methylimidazolium Alkyl Sulfate
-
继水和超临界二氧化碳之后,离子液体(ILs)作为又一大类新型绿色溶剂和“软”功能材料,引起了全球学术界和工业界的广泛重视[1~4]。目前合成的大多数ILs主要用来替代传统的有机溶剂,在萃取、催化、分离等诸多领域有着广阔的应用前景。ILs具有独特的“可设计性”,可通过改变烷基链长或阴、阳离子的种类,设计具有表面活性的两亲分子—离子液体型表面活性剂(SAILs,也称表面活性离子液体),它兼具ILs和表面活性剂的特性。近几年,SAILs已经被广泛研究,被认为是一种新型表面活性剂,引起了胶体与界面化学领域科研工作者的研究兴趣[5~7]。
在过去几年,研究的绝大多数SAILs的疏水链位于阳离子上,且阴离子一般含有卤素。研究表明,含卤素的SAILs易于水解进而会引发环境和生物水体污染问题[8~10],因此亟待设计开发无卤素、更绿色的SAILs。近几年,研究者尝试采用烷基酸根[11~13]、氨基酸根[14~16]等阴离子替代普通ILs中的卤素阴离子,得到了无卤素的ILs,其中阴离子为烷基酸根的ILs因具有较高的技术实用性而倍受关注。2002年,Wasserscheid等[17]首次合成了阴离子为烷基硫酸根的无卤素SAILs—辛基硫酸1-丁基-3-甲基咪唑鎓盐{[C4mim][C8H17SO4]}。随后,Miskolczy等[18]采用电导率法、紫外-可见光谱法研究了[C4mim][C8H17SO4]的胶束化行为,发现它的临界胶束浓度(CMC)和反离子结合度皆小于传统表面活性剂——辛基硫酸钠(SOS)。2010年,Singh等[19]研究发现,[C4mim][C8H17SO4]水溶液的电导率随浓度的变化曲线出现两个转折点,动态光散射实验和透射电镜观测结果也显示了溶液中存在两种尺寸的聚集体。他们认为[C4mim][C8H17SO4]在水溶液中形成的聚集体结构随着浓度的增大发生了转变:第一个转折点对应的是在较低浓度时[C4mim][C8H17SO4]中的阴离子[C8H17SO4]-相互聚集形成胶朿,此时,阳离子作为反离子被吸附在胶束表面,但不参与胶束的构筑;第二个转折点对应于最初形成的阴离子聚集体的重组,该情况下阳离子[C4mim]+的烷基链朝向胶束内核,导致在单一IL型表面活性剂体系中形成了独特的混合胶束结构。Jiao等[20]采用电导率、核磁共振等手段研究了[C4mim] [C12H25SO4]在水溶液中的胶束化行为,发现其表面活性明显优于传统阴离子表面活性剂—十二烷基硫酸钠(SDS)和普通SAILs—溴化1-十二烷基-3-甲基咪唑鎓(C12mimBr)。
近年来,众多研究者[21~25]对SAILs展开了大量研究工作,获得了诸多有用的信息。但是,人们对无卤素的SAILs在水溶液中胶束化行为与活性离子所带烷基链长间的关系还缺乏规律性的认识,因此进一步的研究工作是必要的。本文利用离子交换法合成了一系列无卤素阴离子的SAILs—烷基硫酸1-丁基-3-甲基咪唑鎓盐[C4mim][CnH2n+1SO4](n=8,12,16),采用表面张力和稳态荧光光谱研究了较低浓度的此类表面活性剂在水溶液中的胶束化行为;利用稳态荧光探针法测定了表面活性剂的胶束聚集数Nagg,获得了SAILs的临界胶束聚集数[Nagg],为该类SAILs的实际应用提供理论依据。
1 实验部分
1.1 试剂
辛基硫酸钠(98%,Aladdin)、十二烷基硫酸钠(98%,Aladdin)、十六烷基硫酸钠(SHS,98%,Aladdin)、氯化1-丁基-3-甲基咪唑鎓(99%,默尼化工)、芘(99%,Aladdin)、二苯甲酮(化学纯,上海凌峰化学试剂有限公司)、二氯甲烷(分析纯,上海化学试剂有限公司)。实验用水均为超纯水,(25.0±0.1)℃时的表面张力为71.70mN/m,电阻率为18.2MΩ·cm。
1.2 SAILs的合成
本文通过离子交换法制备[C4mim][CnH2n+1SO4] (n=8,12,16),以[C4mim][C12H25SO4]为例,其具体合成方法是,将C4mimCl和SDS按照摩尔比1:1溶解于60℃的热水中并搅拌4h,常压过滤,滤纸上的白色晶体为氯化钠;将得到的滤液用二氯甲烷萃取,下层二氯甲烷相用蒸馏水洗,直至用硝酸银检验无白色沉淀后,经旋蒸去除溶剂二氯甲烷,再置于真空干燥箱(60~70 ℃)中干燥48h,最终得到产物。同理,将C4mimCl分别与SOS、SHS以摩尔比1:1进行离子交换,得到产物[C4mim][C8H17SO4]和[C4mim][C16H33SO4]。
1.3 实验方法
1.3.1 合成产物的表征
1H NMR谱由德国Bruker公司AvanceⅢ400型核磁共振谱仪在室温下测得,以DMSO-d6为氘代试剂。采用德国Elementar公司Vario EL Ⅲ元素分析仪对产物进行元素分析。
1.3.2 表面张力的测定
溶液表面张力采用德国Dataphysics公司DCAT21型表界面张力仪(精度为0.01mN/m)测量;所用Wilhelmy吊片为边长0.4cm的方形小铂片。用DC-0506恒温槽循环水控制测量体系温度为(25±0.1)℃。实验之前通过测量纯水的表面张力(71.7mN/m)校准仪器。每次测量前将铂片用去离子水冲洗干净,然后用火焰将铂片烧红,以去除杂质。测量精度设定为0.03mN/m,实验结果取3次测量的平均值。
1.3.3 稳态荧光光谱测定
采用日本Hitachi公司的F4500荧光光谱仪进行稳态荧光光谱测试。利用芘的极性标尺(第一、三发射峰强度比值I1/I3)研究分子所处微环境极性的变化来表征溶液中表面活性剂胶束或者聚集体的形成[26]。以芘的饱和水溶液(浓度为6.53×10-7mol/L)作为溶剂配制已知浓度的SAILs溶液,然后将配制好的样品放入超声池中分散20min,稳定24h后,通过稳态荧光光度仪测定其荧光光谱。本实验设定激发光的波长为335nm,激发狭缝宽度为5nm,发射狭缝宽度为2.5nm。测试时先将仪器冷态开机,预热0.5h,将样品置于比色皿中放入测量室,在350~450 nm范围内进行扫描。实验温度控制为(25±0.1)℃。
采用芘-二苯甲酮探针猝灭剂可比较准确地测定聚集数小于130的体系的胶束聚集数[27]。用无水甲醇配制一定浓度(cQ)的二苯甲酮溶液,在10mL具塞试管中用微量进样器准确注入一定量二苯甲酮的甲醇溶液,用纯N2将甲醇吹干。用移液管精确移入配制好的2~20倍CMC的SAILs的芘饱和水溶液,超声5min,恒温(25±0.1℃)放置24h后读取373nm波长处荧光强度。芘和二苯甲酮能与胶束紧密结合,二者在胶束中停留的时间相对于探针的荧光寿命长得多,如果猝灭剂对探针为静态猝灭,猝灭剂在胶束之间遵从Poisson分布,则有下式成立[27, 28]:
其中,I0和I分别为无猝灭剂和加入猝灭剂时373nm处的荧光强度;cQ为猝灭剂的浓度;cs为所测定体系中SAILs的浓度;CMC为稳态荧光法测定的ILs在此条件下的临界胶束浓度。利用ln(I0/I)对cQ作图,由斜率即可确定胶束聚集数Nagg。
2 结果与讨论
2.1 产物的结构表征
参照Obliosca等[29]的方法采用离子交换法在60℃热水中合成了一系列阴离子所带烷基链长不同的SAILs [C4mim][CnH2n+1SO4](n=8,12,16)。图 1为产物[C4mim][C12H25SO4]的1H NMR[(400MHz,DMSO-d6)δ:9.13(s,1H),7.78(t,J=1.6Hz,1H),7.71(t,J=1.6Hz,1H),4.16(t,J=7.2Hz,2H),3.85(s,3H),3.66(t,J=6.4Hz,2H),1.76(m,J=7.2Hz,2H),1.47(t,J=6.4Hz,2H),1.24(s,20H),0.90(t,J=7.2Hz,3H),0.85(t,J=6.8Hz,3H)]谱图,各个峰的相对积分面积与氢原子个数比相符。
为了进一步表征产物纯度,通过元素分析仪对合成产物的N、H及C三种元素含量进行了分析。表 1是所合成的[C4mim][CnH2n+1SO4](n=8,12,16) 中C、H、N元素百分含量以及分析结果与理论值的相对误差(D)。从元素分析的数据来看,虽然实验结果与理论值有所差异,但误差都在3%以内。
 表 1
[C4mim ][CnH2n+1SO4](n=8, 12, 16) 中C、H、N元素的含量(%)
Table 1.
The C, H, N content of surfactants[C4mim]
[CnH2n+1SO4]
(n=8, 12, 16) obtained from element analysis
表 1
[C4mim ][CnH2n+1SO4](n=8, 12, 16) 中C、H、N元素的含量(%)
Table 1.
The C, H, N content of surfactants[C4mim]
[CnH2n+1SO4]
(n=8, 12, 16) obtained from element analysis
Surfactant N C H DN/% DC/% DH/% [C4mim][C8H17SO4] 7.86 53.55 8.92 2.238 2.848 2.832 [C4mim][C12H25SO4] 6.91 59.66 9.78 0.289 0.420 1.21 [C4mim][C16H33SO4] 5.92 61.57 10.54 2.63 1.66 1.05 2.2 [C4mim][CnH2n+1SO4] (n=8,12,16) 界面性质研究
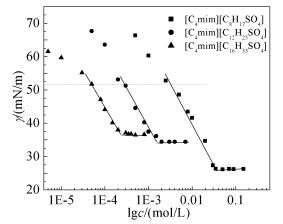
图 2为25℃时合成的3种SAILs水溶液的表面张力等温线。由图可知,同传统表面活性剂体系类似,随着SAILs浓度的提高其分子优先在气液界面上吸附,表面张力值显著降低;当其浓度提高到CMC时,表面活性剂分子在界面上已经排满,体相内开始形成聚集体,表面张力达到一个稳定值;此时对应的表面张力值是该表面活性剂水溶液最低表面张力(γCMC)。
此外,由表面张力实验我们可以得到衡量表面活性剂性能的另外两个重要的物理量:pC20(pC20=-lg(c)π=20)和ΠCMC(ΠCMC=γH2O-γCMC)。其中pC20可衡量表面活性剂降低表面张力的效率,而ΠCMC则可反应表面活性剂降低表面张力的能力。同时,根据γ-logc曲线的斜率也可以获得表面活性剂分子在气液界面上的饱和吸附量(Γmax)及最小横截面积(Amin),见式(2)、式(3)[30]:
式中,Γmax的单位是μmol/m2;R是气体常数(数值为8.314J/mol·K);T是绝对温度;c是表面活性剂的浓度(mol/L);
$\mathop {\lim }\limits_{C \to cmc} \frac{{\delta \gamma }}{{\delta \log C}}$ 为接近CMC时γ-logc曲线的斜率;Amin的单位为nm2;NA为Avogadro常数;对于1-1价离子型表面活性剂,在没有电解质存在的情况下,n值取2。表 2列出了本文合成的3种SAILs的表面活性参数。为便于比较,我们把传统阴离子表面活性剂烷基硫酸钠[31]的相关参数一并列出。
 表 2
三种离子液体产物[C4mim][CnH2n+1SO4](n=8, 12, 16) 及相应的烷基硫酸钠水溶液的表面活性参数
Table 2.
Surface active parameters of [C4mim][CnH2n+1SO4], Na[CnH2n+1SO4](n=8, 12, 16) in aqueous solution
表 2
三种离子液体产物[C4mim][CnH2n+1SO4](n=8, 12, 16) 及相应的烷基硫酸钠水溶液的表面活性参数
Table 2.
Surface active parameters of [C4mim][CnH2n+1SO4], Na[CnH2n+1SO4](n=8, 12, 16) in aqueous solution
Surfactants CMC/(mmol/L) pC20 γCMC/(mN/m) Amin/(nm2) Γmax/(μmol/m2) ΠCMC/(mN/m) [C4mim][C8H17SO4] 30.0 2.60 26.2 0.79 2.09 45.9 [C4mim][C12H25SO4] 1.67 3.51 34.4 0.86 1.93 37.7 [C4mim][C16H33SO4] 0.252 4.32 36.8 0.96 1.73 35.3 Na[C8H17SO4]a 134 - 39.1 0.515 3.10 33.0 Na[C12H25SO4]a 8.1 2.40 39.0 0.500 3.30 33.1 Na[C16H33SO4]a 0.7 - - 0.509 3.30 - a参考文献[31]。 CMC及γCMC可直接衡量表面活性剂的表面活性。由表 2可知,相比于传统表面活性剂Na[CnH2n+1SO4](n=8,12,16),[C4mim][CnH2n+1SO4] (n=8,12,16) 的CMC和γCMC值更低,具有更优良的表面活性。这说明,一方面,咪唑阳离子[C4mim]+能更有效地屏蔽烷基硫酸根{[CnH2n+1SO4]-(n=8,12,16)}的静电斥力,促进[CnH2n+1SO4]-在气液界面上的吸附和体相内的聚集;另一方面,相比于无机反离子(Na+),[C4mim]+具有较强的疏水性,其参与界面及胶束的形成,增强了表面活性剂的表面活性。此外,可以看出[C4mim][CnH2n+1SO4](n=8,12,16) 比相应的Na[CnH2n+1SO4](n=8,12,16) 具有更高的ΠCMC,说明[C4mim]+作为反离子的SAILs具有较高的降低表面张力的能力[32]。通常认为氢键的存在会使表面活性剂分子不能规则的排列,进而降低表面活性。显然,咪唑类ILs分子中广泛存在多重氢键,对于目前研究的体系而言,[C4mim]+产生的氢键引起的对分子规则排列的抑制作用要远小于其疏水作用引起的对分子有序排列的促进作用。
表面活性剂的链长是影响其表面活性的重要因素,由表 2数据可知,随着[CnH2n+1SO4]-(n=8,12,16) 中的烷基碳链的增长,[C4mim][CnH2n+1SO4]-(n=8,12,16) 的CMC明显降低,表面张力却有所增加。可见,疏水烷基碳链的增长促进了体系中胶束的形成,但却减弱了降低表面张力的作用。显然,SAILs疏水链碳原子数越多,疏水作用越强,在体相越易于聚集形成胶束,这是导致[C4mim][CnH2n+1SO4]的CMC随疏水链碳原子数的增加而降低的主要原因。此外,烷基链的柔性导致较长的烷基链在界面上方产生较大的空间位阻效应,这种效应在一定程度上抑制了[C4mim]+和[CnH2n+1SO4]-之间的有效结合,表面活性剂分子在气液界面上的排列紧密程度降低,最终使Γmax的数值减小,Amin则增大。
2.3 SAILs在水溶液中的聚集行为
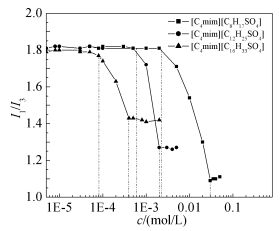
单体芘的荧光发射光谱的荧光强度及光谱形状对其所处环境的微极性非常敏感,其荧光发射光谱的第一和第三重峰比值的变化可以考察体系中活性组分的聚集行为。图 3给出了I1/I3随表面活性剂[C4mim][CnH2n+1SO4](n=8,12,16) 浓度的变化曲线。参照芘的发光原理,曲线中转折点的出现意味着溶液中微极性的变化,预示着表面活性剂聚集体的形成。由图 3可知,表面活性剂溶液I1/I3随浓度的变化出现了两个转折点,第一个转折点对应的是溶液形成预胶束时表面活性剂浓度CMC1,第二个转折点则是体系中形成胶束时的表面活性剂浓度CMC2。稳态荧光法所测得的[C4mim][CnH2n+1SO4](n=8,12,16) 水溶液的CMC2分别为30、2.0、0.37 mmol·L-1,与表面张力法测得的3种表面活性剂的CMC基本一致。
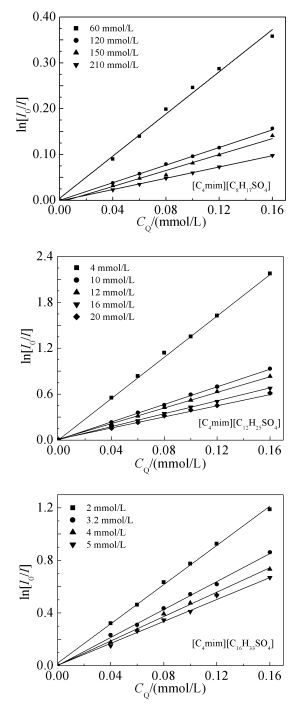
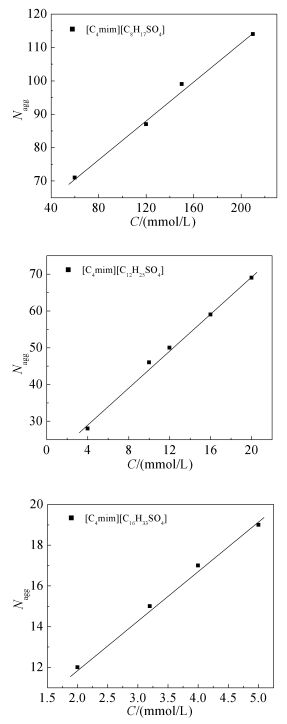
图 4为[C4mim][CnH2n+1SO4](n=8,12,16) 在不同浓度下的ln(I0/I)-cQ曲线,由斜率可确定不同浓度时SAILs在溶液中的胶束聚集数Nagg。图 5给出了Nagg与表面活性剂浓度cs的关系。由图 5可知,随着表面活性剂浓度的增加,Nagg有所增大。在实验范围内Nagg与cs呈现良好的线性关系。[C4mim][CnH2n+1SO4]系列表面活性剂的Nagg与cs之间的线性关系及相关系数列于表 3。此外,我们发现[C4mim][CnH2n+1SO4](n=8,12,16) 中的阴离子烷基链长的变化对Nagg影响很大,随着阴离子烷基链长的增加,Nagg显著降低。表面活性剂在CMC处的Nagg是少量胶束刚刚出现时相对应的胶束聚集数,是一个十分有用的常量,其不受表面活性剂浓度影响的本征值亦称为临界胶束聚集数[27],记为[Nagg],可用式(4) 求得:
 表 3
[C4mim] ][CnH2n+1SO4]的Nagg-cs回归方程及临界胶束聚集数
Table 3.
The regression equations of [C4mim][CnH2n+1SO4]and the critical aggregation number of micelles
表 3
[C4mim] ][CnH2n+1SO4]的Nagg-cs回归方程及临界胶束聚集数
Table 3.
The regression equations of [C4mim][CnH2n+1SO4]and the critical aggregation number of micelles
Surfactants The regression
equationsCorrelation
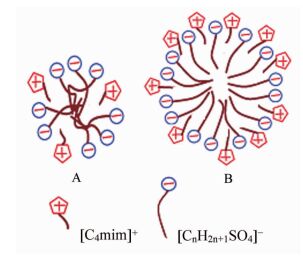
coefficients[Nagg] [C4mim][C8H17SO4] y=55.31x+0.27 0.995 63 [C4mim][C12H25SO4] y=19.13x+2.52 0.997 24 [C4mim][C16H33SO4] y=7.14x+2.41 0.999 8 根据实验结果求得[C4mim][CnH2n+1SO4]系列表面活性剂溶液的临界胶束聚集数[Nagg]并列于表 3。由表 3可知,[C4mim][CnH2n+1SO4]的[Nagg]随疏水链碳原子数的增加明显减小,这与疏水链碳原子数的增多导致其疏水作用增强,促进其在体相聚集形成胶束密切相关。同时,这也与SAILs的阳离子参与胶束的形成程度有关。显然,对于目前的研究体系而言,长烷基链的阴离子是胶束的主要组成成分,阳离子的疏水性导致其也参与胶束的形成,参与程度越大,对胶束中阴离子头基间静电屏蔽作用越明显,形成聚集体所带净电荷越少,表面活性剂排布越紧密,越利于较大聚集体的形成(图 6给出了阴离子链长不同的[C4mim][CnH2n+1SO4]形成的胶束示意图)。可见,SAILs中阴离子所带烷基链越短,越利于[C4mim]+参与胶束的形成,即阳离子参与胶束的形成几率越大。这与其界面行为研究结果一致。
3 结论
本文合成了单链无卤素SAILs [C4mim] [CnH2n+1SO4] (n=8,12,16),采用表面张力、稳态荧光光谱等系统研究了其在界面及体相的聚集行为。结果表明,与传统无机反离子相比,有机咪唑阳离子[C4mim]+作为反离子的SAILs具有较高的降低表面张力的能力,[C4mim]+产生的氢键引起的对分子规则排列的抑制作用小于其疏水作用引起的对分子有序排列的促进作用。阴离子疏水烷基碳链的增长一方面可促进胶束的形成,另一方面却在一定程度上抑制[C4mim]+参与界面或胶束的形成。长烷基链的阴离子是界面膜及胶束的主要组成成分,SAILs中阴离子所带烷基链越长,越不利于[C4mim]+参与界面膜或胶束的形成,对阴离子头基间静电屏蔽作用越不明显,表面活性剂排布越松散,界面张力越大,越不利于体系中聚集数较大的聚集体的形成。
-
-
[1]
R D Rogers, K R Seddon. Science, 2003, 302(5646):792~793.
-
[2]
T Welton. Chem. Rev., 1999, 99(8):2071~2084.
-
[3]
P J Dyson, D J Ellis, T Welton et al. Chem. Commun., 1999(1):25~26.
-
[4]
J L Anderson, J Ding, T Welton et al. J. Am. Chem. Soc., 2002, 124(47):14247~14254.
-
[5]
O A E Seoud, P A R Pires,T A Moghny et al. J. Colloid Interf. Sci., 2007, 313(1):296~304.
-
[6]
J Bowers, P Craig, P J Butts et al. Langmuir, 2004, 20(6):2191~2198.
-
[7]
S Sarkar, S Mandal, R Pramanik et al. J. Phys. Chem. B, 2011, 115(19):6100~6110.
-
[8]
D Seth, S Sarkar, N Sarkar. Langmuir, 2008, 24(14):7085~7091.
-
[9]
R P Swatloski, J D Holbrey, R D Rogers. Green Chem., 2003, 5(4):361~363.
-
[10]
G A Baker, S N Baker. Aust. J. Chem., 2005, 58(3):174~177.
-
[11]
M Anouti, J Jones, A Boisset et al. J. Colloid Interf. Sci., 2009, 340(1):104~111.
-
[12]
Z Miscolczy, K Sebok-Nagy, L Biczok et al. Chem. Phys. Lett., 2004, 400(4):296~300.
-
[13]
B Marijana, S K Malgorzata, J D Holbrey et al. Phys. Chem. Chem. Phys., 2009, 11(21):4260~4268.
-
[14]
D W Fang, J Tong, W Guan et al. J. Phys. Chem. B, 2010, 114(43):13808~13814.
-
[15]
G Tao, L He, W Liu et al. Green Chem., 2006, 8(7):639~646.
-
[16]
K Fukumoto, H Ohno. Chem. Commun., 2006(29):3081~3083.
-
[17]
P Wasserscheid, R van Hal, A B smann. Green Chem., 2002, 4(4):400~404.
-
[18]
Z Miskolczy, K Seb k-Nagy, K Biczók et al. Chem. Phys. Lett., 2004, 400(4):296~300.
-
[19]
T Singh, M Drechsler, A H E Mueller et al. Phys. Chem. Chem. Phys., 2010, 12(37):11728~11735.
-
[20]
J J Jiao, B Dong, H N Zhang et al. J. Phys. Chem. B, 2012, 116(3):958~965.
-
[21]
V Chauhan, R Kamboj, S P S Rana et al. J. Colloid Interf. Sci., 2015, 446:263~271.
-
[22]
R Kamboj, P Bharmoria, V Chauhan et al. Langmuir, 2014, 30(33):9920~9930.
-
[23]
W Xu, T Wang, N Cheng et al. Langmuir, 2015, 31(4):1272~1282.
-
[24]
W Xu, Q Yin, Y Gao et al. Langmuir, 2015, 31(46):12644~12652.
-
[25]
Y Bi, L Zhao, Q Hu et al. Langmuir, 2015, 31(46):12597~12608.
-
[26]
X Hang,Y Peng, K S Zhao et al. J. Chem. Eng. Data, 2010, 56(4):865~873.
-
[27]
J Y Chen, G T Wang, J Z Liu. Acta Physicochim. Sin., 1993, 9:461~465.
-
[28]
T W Davey, W A Ducker, A R Hayman. Langmuir, 2000, 16(6):2430~2435.
-
[29]
J M Obliosca, S D Arco, M H Huang, J. Fluoresc., 2007, 17(6):613~618.
-
[30]
E Alami, G Beinert, P Marie et al. Langmuir, 1993, 9(6):1465~1467.
-
[31]
赵国玺, 朱瑶. 表面活性剂作用原理. 北京:中国轻工业出版社, 2003:714~717.
-
[32]
M J Rosen, J T Kunjappu. Surfactants and Interfacial Phenomena. John Wiley & Sons, 2012.
-
[1]
-
表 1 [C4mim ][CnH2n+1SO4](n=8, 12, 16) 中C、H、N元素的含量(%)
Table 1. The C, H, N content of surfactants[C4mim] [CnH2n+1SO4] (n=8, 12, 16) obtained from element analysis
Surfactant N C H DN/% DC/% DH/% [C4mim][C8H17SO4] 7.86 53.55 8.92 2.238 2.848 2.832 [C4mim][C12H25SO4] 6.91 59.66 9.78 0.289 0.420 1.21 [C4mim][C16H33SO4] 5.92 61.57 10.54 2.63 1.66 1.05 表 2 三种离子液体产物[C4mim][CnH2n+1SO4](n=8, 12, 16) 及相应的烷基硫酸钠水溶液的表面活性参数
Table 2. Surface active parameters of [C4mim][CnH2n+1SO4], Na[CnH2n+1SO4](n=8, 12, 16) in aqueous solution
Surfactants CMC/(mmol/L) pC20 γCMC/(mN/m) Amin/(nm2) Γmax/(μmol/m2) ΠCMC/(mN/m) [C4mim][C8H17SO4] 30.0 2.60 26.2 0.79 2.09 45.9 [C4mim][C12H25SO4] 1.67 3.51 34.4 0.86 1.93 37.7 [C4mim][C16H33SO4] 0.252 4.32 36.8 0.96 1.73 35.3 Na[C8H17SO4]a 134 - 39.1 0.515 3.10 33.0 Na[C12H25SO4]a 8.1 2.40 39.0 0.500 3.30 33.1 Na[C16H33SO4]a 0.7 - - 0.509 3.30 - a参考文献[31]。 表 3 [C4mim] ][CnH2n+1SO4]的Nagg-cs回归方程及临界胶束聚集数
Table 3. The regression equations of [C4mim][CnH2n+1SO4]and the critical aggregation number of micelles
Surfactants The regression
equationsCorrelation
coefficients[Nagg] [C4mim][C8H17SO4] y=55.31x+0.27 0.995 63 [C4mim][C12H25SO4] y=19.13x+2.52 0.997 24 [C4mim][C16H33SO4] y=7.14x+2.41 0.999 8 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:





 下载:
下载:

