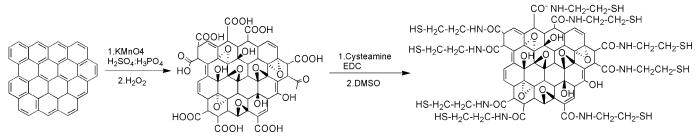
 图 图式1
GO-SH的制备
Figure 图式1.
Preparation of GO-SH
图 图式1
GO-SH的制备
Figure 图式1.
Preparation of GO-SH

Citation: Zhou Fang, Li Qiong, Jiang Xinyu. Removal of Pb(Ⅱ) Ions from Aqueous Solution by Thiol-Functionalized Graphene Oxide[J]. Chemistry, 2017, 80(4): 361-366.

巯基化石墨烯对水中Pb(Ⅱ)的吸附性能研究
English
Removal of Pb(Ⅱ) Ions from Aqueous Solution by Thiol-Functionalized Graphene Oxide
-
Key words:
- Graphene oxide
- / Cysteamine
- / Lead ions
- / Adsorption
-
铅是一种毒性较强的非生物降解的重金属污染物,来源于采矿、冶炼、化工、印染等工业排放的废水[1~4]。作为一种无机有毒物,铅在水生动植物中富集进入食物链从而危害人体健康,尤其是孕妇、儿童更易受到铅污染的侵害[5, 6]。目前处理重金属废水的手段主要是化学法、物理法和生物法,其中膜交换法、离子交换法、吸附法最为常用[7~11]。吸附法由于具有相对低的成本、操作简便、不易造成二次污染、容易再生等优点,因而应用广泛[12, 13]。
纳米碳基吸附材料(如碳纳米管、石墨烯)具有独特的管状或片状结构和大比表面积,结构缺陷可以进行修饰,可用来制备高性能吸附剂,广泛应用于环境污染物的吸附去除[14, 15]。例如,Li等[16]分别研究了碳纳米管及其复合物对金属离子、气体的吸附性能及机理。石墨烯是单层碳原子构成的二维片状结构,离域π键作用赋予其独特的热力学、机械及电子性能。氧化石墨烯(GO)是由石墨氧化制备而得,与原始石墨相比,其表面引入了大量的含氧官能团(如—COOH,—OH,C=O等),使得其具有一些独特的性能[17~20]。GO呈片状结构,理论表面积可达2630m2/g,将其作为吸附材料时其较大的比表面积具有突出优势[21];此外,还可以通过其表面的羧基及羟基与其他化合物进行反应,得到功能化的GO材料[22~25]。GO吸附去除水中的重金属离子主要依靠其表面的吸附位点以及表面的官能团[26],如羧基、羟基、环氧基等,它们可以和重金属离子发生螯合、吸附及静电作用。
Liu等[27]制备了石墨烯/壳聚糖复合材料,将其用于Au3+和Pd2+的吸附,取得了良好的效果。Chandra等[28]制备了石墨烯/聚吡咯复合物,并将此材料用于水中Hg2+的选择性吸附,且吸附作用不受Cu2+、Cd2+、Pb2+、Zn2+等离子的干扰。Liu等[29]利用三乙醇胺对GO进行改性,所制成的吸附剂TEA/GO稳定性好,对水相中Cu2+的吸附效果得到很大改善,且对于高浓度下的Cu2+吸附平衡能力强。Yari等[30]制备了巯基化石墨烯(GO-SH)材料,主要研究了其对水中Pb2+的吸附动力学性能。Madadrang等[31]通过硅烷化反应将N-(三甲氧基硅基丙基)乙二胺三乙酸钠与GO表面的羧基反应制备了功能化的GO,并研究了其对水中Pb2+的吸附性能。结果表明,该功能化石墨烯对Pb2+的最大吸附容量达479mg/g。
GO与含氨基的化合物进行功能化简单易行。巯基乙胺分子中的氨基与GO表面的羧基进行接枝后,其表面的巯基可与重金属离子形成络合物,从而更有利于重金属离子的去除,而这方面的研究开展得很少。本文采用改进的Hummers方法制备GO,并将巯基乙胺键合到GO表面,主要研究巯基乙胺对GO的形态、结构以及吸附性能的影响,并对吸附过程进行动力学及热力学拟合。
1 实验方法
1.1 化学试剂
天然鳞片石墨(天津市科密欧化学试剂有限公司,100目);巯基乙胺(AR,天津恒兴化学试剂有限公司),1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC,AR,Sigma-Aldrich公司);其他化学试剂均购自天津市科密欧试剂公司。
1.2 GO-SH的制备
GO-SH的合成线路如图式 1所示。
1.3 材料表征方法
GO和GO-SH的形貌通过JSM-6360LV扫描电镜(SEM,日本电子株式会社)进行观察;样品的官能团利用AVATAR 360傅里叶变换红外光谱仪(FT-IR)进行分析,扫描范围400~4000 cm-1;样品的化学组成及原子价态通过Kratos AXIS Ultra DLD型X射线光电子能谱仪(XPS,日本岛津公司)得到。
1.4 吸附实验
用去离子水配制初始浓度为1mg/mL的模拟含Pb2+废水溶液,室温保存,用时稀释。待吸附完成后,分别用0.45μm的聚偏氟乙烯(PVDF)过滤器过滤,滤液置于对应编号的离心管内,用原子发射光谱测定吸附后重金属离子的浓度。该材料对重金属离子的吸附容量通过公式(1) 计算。
其中,Q为吸附容量(mg/g),c0为初始浓度(mg/L),ct为t时刻浓度(mg/L),V为溶液体积(mL),m为吸附剂质量(mg)。
1.2.2 GO-SH的制备
200mg GO、1.0g巯基乙胺和500mg EDC加入到150mL圆底烧瓶中,充分混合后加入50mL二甲亚砜,超声10min后,将该混合物在40℃水浴中搅拌48h。待反应结束后,将混合物倒入离心管中,离心40min,除去上层清液,下层的固体用丙酮和超纯水各洗涤2次。每次洗涤均使用离心机进行分离。最终所得的产物进行冷冻干燥,得到GO-SH。
1.2.1 GO的制备
称取0.3g鳞片石墨与1.8g高锰酸钾置于100mL圆底烧瓶中并冷水浴处理,向混合物中缓慢滴加40mL混酸(H2SO4/H3PO4为9:1,体积比),滴加完后将圆底烧瓶置于50℃水浴中搅拌12h。待反应结束后,将混合物倒入到100mL冰水中,并缓慢滴加30%过氧化氢至无气泡产生。离心机中离心20min(转速10000r/min,下同)后去除上层清液,下层固体用10%盐酸洗涤3次,之后用蒸馏水洗涤至pH约为7,每次洗涤均进行40min离心分离。洗涤之后得到的材料进行冷冻干燥,得到GO。
1.4.2 吸附动力学实验
将母液稀释成50mg/L的Pb2+标准溶液,称取6份4.00mg GO-SH分别置于100mL锥形瓶中,然后分别移取50.0mL Pb2+于锥形瓶中。将上述锥形放置在25℃的恒温振荡箱中振荡,每隔一定时间取出测试。
1.4.1 溶液初始pH的影响
将母液稀释成浓度为50mg/L的Pb2+标准溶液,准确称取6份4.0mg GO-SH置于100mL锥形瓶中,再准确移取50.0mL Pb2+溶液于锥形瓶中。之后用0.1mol/L HCl和NaOH调溶液的pH分别为1.0、2.0、3.0、4.0、5.0和5.5,将上述锥形瓶在25℃水浴恒温振荡箱中振荡120min。
1.4.3 吸附热力学实验
将母液稀释成浓度分别为10.0、20.0、40.0、60.0、80.0和100.0 mg/L的Pb2+标准溶液,准确称取6份4.0mg GO-SH分别置于锥形瓶中,接着分别移取50.0mL不同浓度的Pb2+溶液置于锥形瓶中。分别将锥形瓶在25、35和45 ℃下恒温振荡60min达到吸附平衡。
2 结果与讨论
2.1 材料的表征
2.2 吸附性能
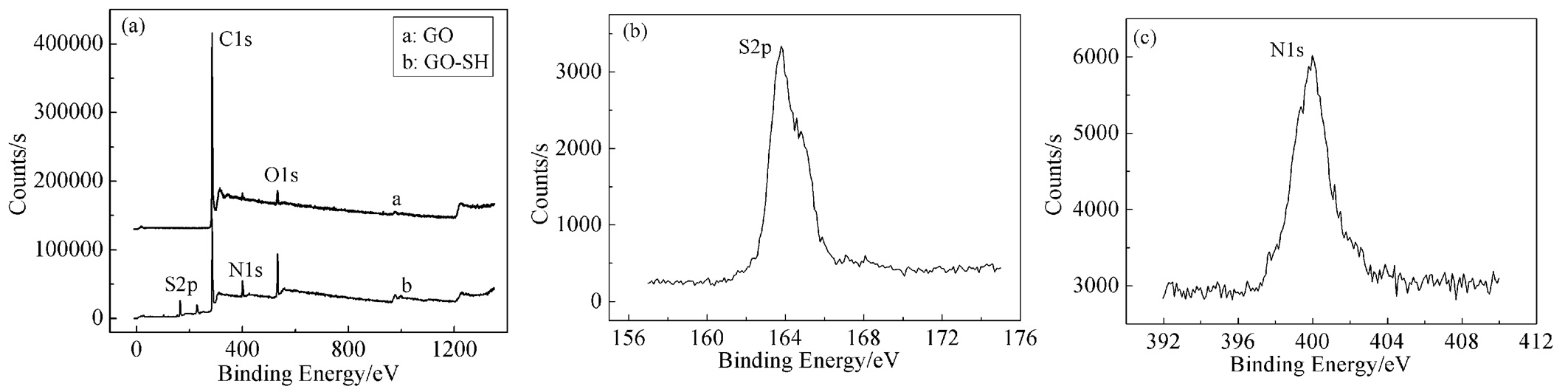
2.1.3 XPS
图 3为GO和GO-SH的XPS谱图。XPS主要用来分析材料的化学组成及价态,从图 3(a)中可以看出,GO主要由C和O元素组成,而GO-SH中出现了S和N元素。GO的XPS谱线中,284.82eV出现的峰为C1s的峰,其主要对应的是GO中的C—C,C—O和C=O键,在531.62eV处出现的峰是O1s的峰,其主要对应的是含氧官能团中的C—O和C=O键。GO-SH的XPS图中同样有C1s和O1s的峰,不同的是在163.83eV和399.9eV处出现了S2p和N1s的峰,S2p对应的是—CH2SH。这些均可以证明制备得到了GO-SH。
2.1.2 SEM
图 2为GO和GO-SH的扫描电镜图。从图 2(a)中可以看出,GO的表面光滑,呈片状结构。与GO相比较,GO-SH的尺寸更大,且同样呈片状结构,这说明在反应过程中没有改变GO的结构,这也从侧面说明GO的机械强度大,其C—C键的晶格结构不容易被破坏。
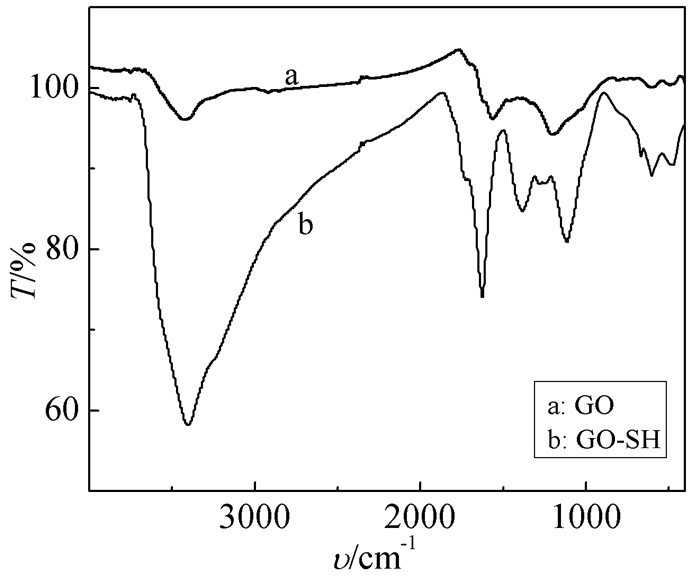
2.1.1 FT IR
图 1(a)为GO的IR图谱,其中,3430cm-1有一个较强的吸收峰,是—OH的伸缩振动吸收峰,在1720cm-1处出现的相对较弱的吸收峰是GO表面C=O的特征吸收峰,此外,在1070cm-1处出现的吸收峰为GO表面含氧官能团中C—O键的特征吸收峰。GO-SH的IR图谱(图 1(b))中,3405cm-1处的宽峰为重叠的—OH和—NH伸缩振动吸收峰,1705cm-1处为C=O的伸缩振动吸收峰;1580cm-1处为酰胺键的特征吸收峰,因此可以表明巯基乙胺成功接枝到GO的表面。对比图 1(a)和(b)可以看出,在3405cm-1处的吸收峰的强度增强,这说明经巯基乙胺修饰的GO产生了更多的活性位点,对吸附去除重金属离子是有利的。
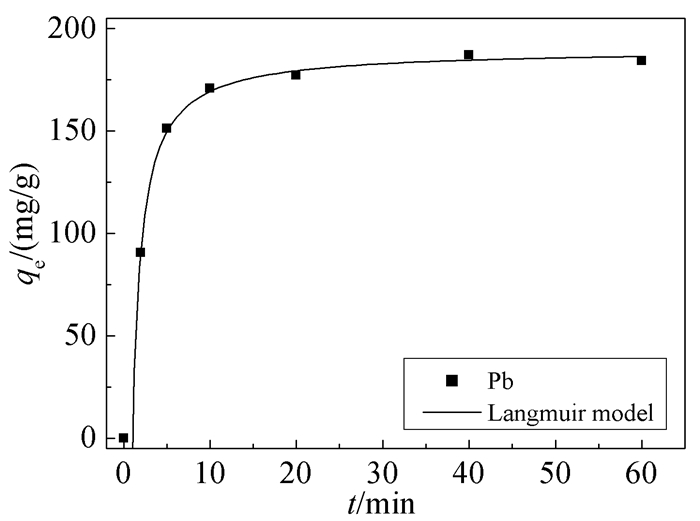
2.2.2 时间对吸附量的影响
将按公式(1) 计算得到的动力学数据,以时间t为横坐标、吸附量为纵坐标作图,从而得到GO-SH吸附Pb2+随时间变化的规律,其结果如图 5所示。由图可知,GO-SH对Pb2+的吸附在40min内能达到平衡,且吸附效果良好。在0~5 min内,GO-SH对Pb2+的吸附量快速增加,这是因为Pb2+在较短的时间内能聚集在GO-SH周围而被吸附;在5~20 min内,吸附量增加的趋势变缓,这是因为一定量GO-SH的吸附位点是有限的,因此随着作用时间的延长,吸附位点逐渐变少,最终在40min时达到吸附平衡。
2.2.3 吸附动力学
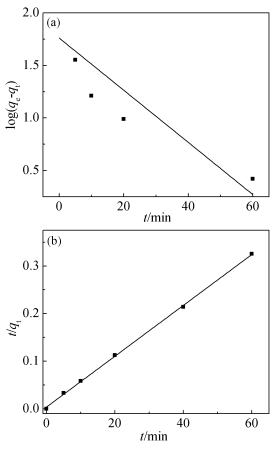
分别采用准一级动力学和准二级动力学模型[33, 34]对GO-SH吸附Pb2+的吸附动力学进行拟合,其结果如图 6(a)和(b)所示,通过拟合计算得到的相应参数列于表 1。
(1) 准一级动力学方程
其中,qt为t时刻的吸附量(mg/g);qe为平衡吸附量(mg/g);k1为准一级动力学常数(min-1)。
(2) 准二级动力学方程
其中,k2为准二级动力学常数(g·mg-1min-1)。从图 6(a)和(b)可以看出,GO-SH吸附Pb2+的过程更符合准二级动力学方程。从表 1也能得到同样的结论:GO-SH吸附Pb2+的准一级动力学相关系数(R2)为0.677,而准二级动力学拟合相关系数(R2)为0.999,因此可以得知GO-SH对Pb2+的吸附不遵循准一级动力学。
此外,由准一级和准二级动力学计算得到的吸附量(qe, cal)分别为57.66mg/g和187.27mg/g,而准二级动力学计算出的平衡吸附量更接近实验所得的平衡吸附量(qe, exp)205.25mg/g,由此可得出,GO-SH吸附Pb2+吸附过程遵循准二级动力学方程,同时也说明了吸附剂GO-SH与吸附质Pb2+之间的吸附是由速率控制的过程。
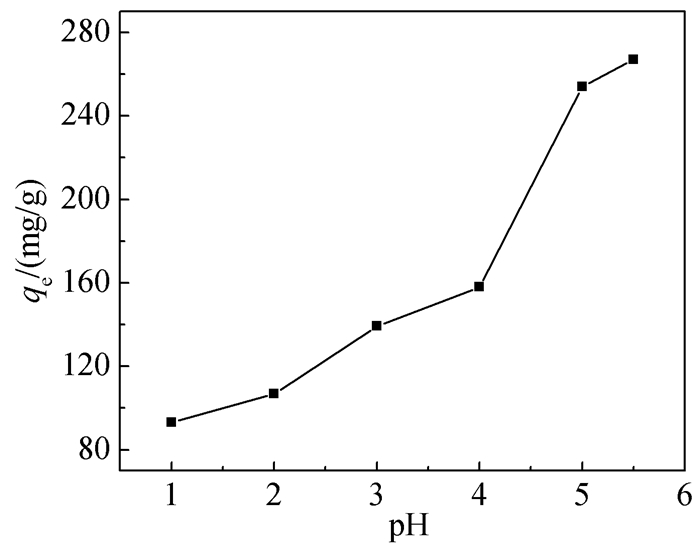
2.2.1 溶液初始pH对吸附量的影响
由于吸附量易受到材料表面所带电荷及其离子化程度的影响,而pH正是改变它们的关键,所以在吸附过程中研究溶液的初始pH很重要。由图 4可知,GO-SH对Pb2+的吸附量随着溶液pH的增大而增加,这是当pH较低时,溶液中的H+和Pb2+存在竞争吸附,因此GO-SH对Pb2+的吸附量会降低,这与文献报道的结果一致[32]。当pH大于5.5时,Pb2+与溶液中的OH-生成沉淀,对实验结果产生影响,所以将测试pH调节在2.0~5.5范围。
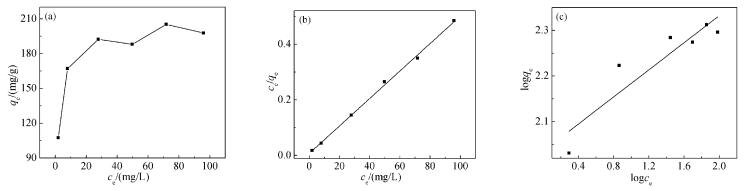
2.2.4 吸附热力学
分别采用Langmuir和Freundlich[35, 36]吸附等温线研究GO-SH对Pb2+的吸附热力学,其结果如图 7(b)和(c)所示,通过拟合得到的相应参数列于表 2。
 表 2
GO-SH吸附Pb(Ⅱ)的热力学拟合参数
Table 2.
Langmuir and Freundlich model parameters of Pb(Ⅱ) adsorption on GO-SH
表 2
GO-SH吸附Pb(Ⅱ)的热力学拟合参数
Table 2.
Langmuir and Freundlich model parameters of Pb(Ⅱ) adsorption on GO-SH

(1) Langmuir吸附等温方程
其中,ce为吸附平衡时的浓度(mg/g),qe为平衡吸附量(mg/g),qm为最大吸附量(mg/g),kd为Langmuir常数(L/mg)。
(2) Freundlich吸附等温方程
其中,kf和n为Freundlich常数。
从图 7(b)和(c)可以看出,GO-SH吸附Pb2+的过程更符合Langmuir等温方程。从表 2也能得到同样的结论:GO-SH吸附Pb2+的Langmuir等温方程拟合得到相关系数为0.998,而Freundlich等温方程拟合得到的相关系数为0.813,因此可以得出GO-SH对Pb2+的吸附过程较符合Langmuir等温模型。且由表 2可知,根据Langmuir等温线方程拟合得到的GO-SH对Pb2+的最大吸附量是202.43mg/g,这与实验所得的最大吸附量(205.25mg/g)接近,进一步说明该过程遵从Langmuir等温方程。
3 结论
在交联剂EDC的作用下将巯基乙胺与GO进行缩合,成功得到GO-SH,将其作为吸附材料用于模拟吸附去除水中重金属离子Pb2+,考察了最优吸附实验条件,并对其吸附动力学和热力学进行拟合。结果表明,GO-SH对Pb2+有很好的吸附效果,其最大吸附量为205.25mg/g,吸附过程更符合Langmuir等温方程及准二级动力学方程。本文制备的GO-SH吸附材料对于水中Pb2+的去除有潜在的应用价值。
-
-
[1]
F N Acar, Z Eren. J. Hazard. Mater., 2006, 137(2): 909~914. https://www.researchgate.net/publication/7159522_Removal_of_CuII_ions_by_activated_poplar_sawdust_Samsun_Clone_from_aqueous_solutions
-
[2]
M M Saeed, M Ahmed. Anal. Chim. Acta, 2004, 525(2): 289~297. https://www.researchgate.net/publication/223032838_Retention_kinetics_and_thermodynamics_profile_of_cadmium_adsorption_from_iodide_medium_onto_polyurethane_foam_and_its_separation_from_zinc_bulk?ev=auth_pub
-
[3]
王海东, 方凤满, 谢宏芳. 广东微量元素科学, 2010, 17(1): 14~18. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gwys201001003&dbname=CJFD&dbcode=CJFQ
-
[4]
M Suwalsky, R Castro, F Villena et al. J. Inorg. Biochem., 2008, 102(4): 842~849. https://www.researchgate.net/publication/5618270_CrIII_exerts_stronger_structural_effects_than_CrVI_on_the_human_erythrocyte_membrane_and_molecular_models
-
[5]
D Lin, X Tian, T Li et al. Environ. Pollut., 2012, 167: 138~147. https://www.researchgate.net/publication/224938403_Surface-bound_humic_acid_increased_Pb2_sorption_on_carbon_nanotubes
-
[6]
N A Kabbashi, M A Atieh, A Al-Mamun et al. J. Environ. Sci., 2009, 21: 539~544. https://www.researchgate.net/publication/26697490_Kinetic_adsorption_of_application_of_carbon_nanotubes_for_PbII_removal_from_aqueous_solution
-
[7]
M Valcárcel, S Cárdenas, B M Simonet. Anal. Chem., 2007, 79(13): 4788~4797. https://www.researchgate.net/publication/6292974_Role_of_Carbon_Nanotubes_in_Analytical_Science
-
[8]
G D Vukovič, A D Marinkovič, MČolič et al. Chem. Eng. J., 2010, 157(1): 238~248. https://www.researchgate.net/publication/222842860_Removal_of_cadmium_from_aqueous_solutions_by_oxidized_and_ethylenediamine-functionalized_multi-walled_carbon_nanotubes
-
[9]
G P Rao, C Lu, F Su. Sep. Purif. Technol., 2007, 58(1): 224~231. https://www.researchgate.net/publication/223922922_Sorption_of_divalent_metal_ions_from_aqueous_solution_by_carbon_nanotubes_A_review
-
[10]
A Gupta, S R Vidyarthi, N Sankararamakrishnan. J. Hazard. Mater., 2014, 274: 132~144. https://www.researchgate.net/publication/261996898_Enhanced_sorption_of_mercury_from_compact_fluorescent_bulbs_and_contaminated_water_streams_using_functionalized_multiwalled_carbon_nanotubes
-
[11]
C Zhang, J Sui, J Li et al. Chem. Eng. J., 2012, 210: 45~52. https://www.researchgate.net/publication/257566454_Efficient_removal_of_heavy_metal_ions_by_thiol-functionalized_superparamagnetic_carbon_nanotubes
-
[12]
S B Yang, J Hu, C L Chen et al. Environ. Sci. Technol., 2011, 45:3621~3627. https://www.researchgate.net/publication/50373493_Mutual_Effects_of_PbII_and_Humic_Acid_Adsorption_on_Multiwalled_Carbon_NanotubesPolyacrylamide_Composites_from_Aqueous_Solutions
-
[13]
X W Peng, L X Zhong, J L Ren et al. J. Agr. Food Chem., 2012, 60:3909~3916. https://www.researchgate.net/publication/223981600_Highly_Effective_Adsorption_of_Heavy_Metal_Ions_from_Aqueous_Solutions_by_Macroporous_Xylan-Rich_Hemicelluloses-Based_Hydrogel
-
[14]
C J Corwin, R S Summers. Environ. Sci. Technol., 2010, 44:5403~5408. https://www.researchgate.net/publication/44685307_Scaling_Trace_Organic_Contaminant_Adsorption_Capacity_by_Granular_Activated_Carbon
-
[15]
T Asada, K Oikawa, K Kawata. J. Health Sci., 2004, 50(6):588~593. https://www.researchgate.net/publication/246500066_Study_of_Removal_Effect_of_Bisphenol_A_and_-Estradiol_by_Porous_Carbon
-
[16]
Y H Li, J Ding, Z Luan et al. Carbon, 2003, 42(14): 2787~2792. https://www.researchgate.net/publication/223934337_Competitive_adsorption_of_Pb2_Cu2_and_Cd2_ions_from_aqueous_solutions_by_multiwalled_carbon_nanotubes
-
[17]
P M Pimentel, G González, M F A Melo et al. Sep. Purif. Technol., 2007, 56(3): 348~353.
-
[18]
L Fan, C Luo, M Sun et al. Colloid. Surf. B, 2013, 103: 523~529.
-
[19]
H Yan, L Yang, Z Yang et al. J. Hazard. Mater., 2012, 229: 371~380. https://www.researchgate.net/publication/228100821_Preparation_of_chitosanpolyacrylic_acid_magnetic_composite_microspheres_and_applications_in_the_removal_of_copperII_ions_from_aqueous_solutions
-
[20]
Y Cao, X Li. Adsorption, 2014, 20(5/6): 713~727. http://www.researchgate.net/publication/263669226_Adsorption_of_graphene_for_the_removal_of_inorganic_pollutants_in_water_purification_a_review
-
[21]
S Kim, S S Kwon, J H Woo et al. J. Electrochem. Soc., 2016 (11): 759~759.
-
[22]
P Nuengmatcha, R Mahachai, S Chanthai. Asian J. Chem., 2015, 27(11): 4167. https://www.researchgate.net/publication/280534392_Adsorption_of_Functionalized_Thiol-Graphene_Oxide_for_Removal_of_Mercury_from_Aqueous_Solution
-
[23]
M Yari, M Norouzi, A H Mahvi et al. Desalin. Water Treat., 2015: 1~16. https://www.researchgate.net/publication/276456991_Removal_of_PbII_ion_from_aqueous_solution_by_graphene_oxide_and_functionalized_graphene_oxide-thiol_effect_of_cysteamine_concentration_on_the_bonding_constant
-
[24]
L Fan, C Luo, X Li et al. J. Hazard. Mater., 2012, 215: 272~279. http://www.researchgate.net/publication/221722301_Fabrication_of_novel_magnetic_chitosan_grafted_with_graphene_oxide_to_enhance_adsorption_properties_for_methyl_blue
-
[25]
V Chandra, K S Kim. Chem. Commun., 2011, 47(13): 3942~3944.
-
[26]
D K V Ramana, J S Yu, K Seshaiah. Chem. Eng. J., 2013, 223: 806~815. https://www.researchgate.net/publication/273407971_Silver_nanoparticles_deposited_multiwalled_carbon_nanotubes_for_removal_of_CuII_and_CdII_from_water_Surface_kinetic_equilibrium_and_thermal_adsorption_properties
-
[27]
L Liu, C Li, C Bao et al. Talanta, 2012, 93:350~357. http://www.researchgate.net/publication/223965323_Preparation_and_characterization_of_chitosangraphene_oxide_composites_for_the_adsorption_of_Au(III)_and_Pd(II)
-
[28]
V Chandra, K S Kim. Chem. Commun., 2011, 47:3942~3944.
-
[29]
G Liu, S Gui, H Zhou et al. Dalton Transac., 2014, 43(19): 6977~6980. https://www.researchgate.net/publication/261138861_A_strong_adsorbent_for_Cu2_Graphene_oxide_modified_with_triethanolamine
-
[30]
M Yari, M Rajabi, O Moradi et al. J. Mol. Liq., 2015, 209: 50~57. M Yari, M Rajabi, O Moradi et al. J. Mol. Liq., 2015, 209: 50~57.
-
[31]
C J Madadrang, H Y Kim, G Gao et al. ACS Appl. Mater. Interf., 2012, 4(3): 1186~1193. http://www.researchgate.net/publication/221805079_Adsorption_behavior_of_EDTA-graphene_oxide_for_Pb_(II)_removal
-
[32]
Q Li, J Yu, F Zhou et al. Colloid. Surf. A, 2015, 482: 306~314. https://www.researchgate.net/publication/279460424_Synthesis_and_characterization_of_dithiocarbamate_carbon_nanotubes_for_the_removal_of_heavy_metal_ions_from_aqueous_solutions
-
[33]
M Nadeem, M Shabbir, M A Abdullah et al. Chem. Eng. J., 2009, 148(2): 365~370. https://www.researchgate.net/publication/222518596_Sorption_of_cadmium_from_aqueous_solution_by_surfactant-modified_carbon_adsorbents
-
[34]
J Yu, M Tong, X Sun et al. React. Funct. Polym., 2007, 67(6): 564~572. https://www.researchgate.net/publication/244359319_Biomass_Grafted_with_Polyamic_Acid_for_Enhancement_of_CadmiumII_and_LeadII_Biosorption
-
[35]
I Langmuir. J. Am. Chem. Soc., 1918, 40(9): 1361~1403. https://www.researchgate.net/publication/231519428_The_Adsorption_of_Gases_on_Plane_Surfaces_of_Glass_Mica_and_Platinum
-
[36]
Q Zhang, Y Gao, Y A Zhai et al. Carbohyd. Polym., 2008, 73(2): 359~363. https://www.researchgate.net/publication/222951536_Synthesis_of_sesbania_gum_supported_dithiocarbamate_chelating_resin_and_studies_on_its_adsorption_performance_for_metal_ions?ev=prf_cit
-
[1]
-
表 1 GO-SH吸附Pb(Ⅱ)的动力学拟合参数
Table 1. Fitting parameters of GO-SH remove Pb(Ⅱ) based on kinetics model

表 2 GO-SH吸附Pb(Ⅱ)的热力学拟合参数
Table 2. Langmuir and Freundlich model parameters of Pb(Ⅱ) adsorption on GO-SH

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0



 下载:
下载:







 下载:
下载:

