 图 1
(a)SMIPs及(b)SMIS的文献出版数量统计
Figure 1.
Published literatures of (a) SMIPs and (b) SMIS
图 1
(a)SMIPs及(b)SMIS的文献出版数量统计
Figure 1.
Published literatures of (a) SMIPs and (b) SMIS

Citation: Jiang Ruyuan, Long Zerong, Ran Wensheng, Su Yuhong. Progress in Applications of Surface Molecular Imprinting Sensors[J]. Chemistry, 2017, 80(4): 341-348.

表面分子印迹传感器的应用研究进展
English
Progress in Applications of Surface Molecular Imprinting Sensors
-
Key words:
- Molecularly imprinting polymers
- / Surface imprinting
- / Sensor
- / Selective recognition
-
表面分子印迹技术(Surface molecular imprinting technology,SMIT)是指在基质表面形成具有与模板分子相匹配的特殊尺寸、形状与作用位点的空腔,并对模板分子具有特异选择性的聚合物的制备技术[1~5],该技术是基于传统分子印迹技术发展而来。1993年Tsukagoshi等[6]首次提出了“表面分子印迹技术”这一概念,以几种不同离子为模板在羧基化聚合物微球表面上形成了具有良好选择吸附性的离子印迹结构。表面分子印迹聚合物(Surface molecular imprinting polymers,SMIPs)具有制备简单、成本低廉、选择性好、抗恶劣环境能力强、稳定性高和可重复使用等优点,在手性分离[7, 8]、色谱分离提纯[9~11]、固相萃取[12, 13]、膜分离[14]、制药[15, 16]、合成酶[17]、催化剂[18, 19]、传感器[20]等方面得到广泛应用。尤其近十年,该项技术获得了蓬勃发展。
表面分子印迹传感器(Surface molecular imprinting sensors,SMIS)是利用SMIPs对模板分子的专一识别性,通过结合光、电、热、质等传感手段转化为可分析的信号,由此获得目标物的相关信息,实现对目标分子的定性定量检测。与传统仪器检测方法(如GC、GC-MS、HPLC、LC-MS)相比,SMIS具有类似的检测准确性和高灵敏度,但检测成本要低很多;与生物传感器相比,SMIS具有与其相似的选择性和识别性,同时还具有其自身独特的优势,如机械稳定性好、制备简单、成本低廉和可重复使用等。采用SMIT构建研制的仿生传感器实现了对生物分子和蛋白等大分子的分析检测,逐渐发展成为分子印迹研究领域的一个重要方向[21~24]。然而,目前对SMIS的专题性报道还很少见。本文基于SMIS的不同制备方法,将其划分为膜传感器、玻碳电极传感器、核-壳型传感器以及中空型传感器等。按上述分类,对近十年SMIS的发展状况进行评述,特别就其使用原理以及在有机物和药物分析、食品检测、农残识别等领域的应用作了较为详尽的介绍,并对其应用前景和未来发展方向进行展望。
1 文献统计分析
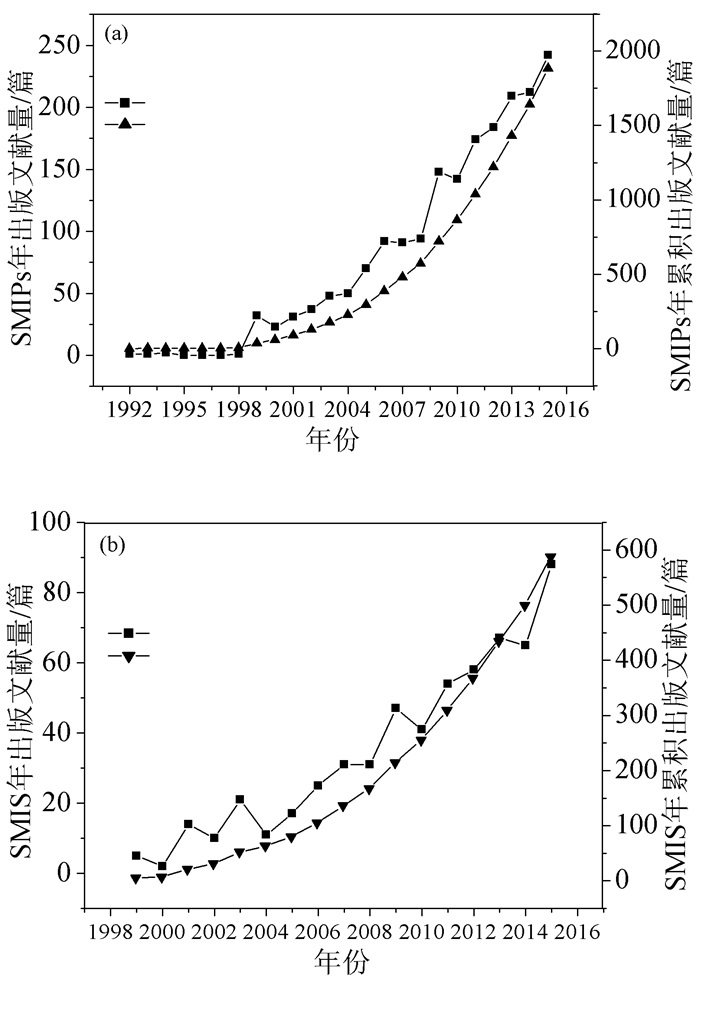
以美国科学信息研究所出版的Web of Science网络数据库之下的Web of ScienceTM核心合集作为数据来源,以“Surface Molecular Imprinting Polymers”作为主题检索词,在标题(Title)、摘要(Abstract)和关键词(Keyword)中搜索所有年的文献。SMIPs及SMIS文献出版量的年变化规律及对应的年累积量变化如图 1所示。1998年以前,SMIPs发展较缓慢,年出版数较少(≤ 2篇);1998~2015年,SMIPs相关研究迅速增长,年出版文献量和年累积出版文献量均以指数形式增长。截止至2015年,当年与SMIPs相关的文献数量达到242篇,总出版量达到1987篇,并且还有继续增长的趋势(图 1(a))。SMIPs在传感器方面的应用研究开始得较晚,但文献出版数量增长较快,2015年SMIS文献数量达到88篇,总累积出版量587篇(图 1(b))。
2 SMIS的分类
2.1 表面分子印迹膜传感器
表面分子印迹膜传感器采用由电沉积法[25]、溶胶-凝胶法[26]等制备的SMIPs作为敏感元件,当SMIPs敏感膜与目标分子结合时,产生对应的信号,再通过转换器将此信号转换成可识别的谱图来反映检测的结果,从而实现对目标分子的定性定量测定。Kupis-Rozmysowicz等[27]制备了以牛磺酸为模板的MIPs导电膜传感器。应用电化学沉积法制备了掺杂黄素单核苷酸(FMN)的3, 4-亚乙二氧基噻吩/乙酸噻吩(EDOT/AAT)的共聚牛磺酸MIPs薄膜。牛磺酸浓度范围在1.0×10-2~1.0×10-4 mol/L时,能斯特响应值(E)与牛磺酸浓度的倒数成正比,且测试过程不受钙、镁、钾等离子影响。Moreira等[28]开发了一个高效检测肌红蛋白(Mb)的膜传感器。首先将Mb通过亚胺键连接到硅珠表面上,再通过硅烷单体3-氨基丙基三甲氧基硅烷(APTMS)和丙基三甲氧基硅烷(PTMS)的聚合来填充围绕Mb的空位,最后,用草酸处理后通过亚胺裂解除去模板。将印记微球分散在聚氯乙烯(PVC)材料上形成选择性膜传感器。在pH为4的HEPES缓冲液中,Mb的检出限为1.3×10-6moL/L。此传感器具备天然受体的很多优点,无需样品前处理就可以检测到复杂样品中的分析物,而且分析物不用另行纯化,为心血管疾病现场诊断提供了可行办法。
刘晓芳等[29]采用原位聚合的方法,在一次性丝网印刷电极上原位制备地西泮的分子印迹膜,将丝网印刷电极通过电极插口与便携式电导转换仪相连接,组装成检测地西泮残留的传感器。该传感器对地西泮具有很高的灵敏度和特异性,检出限为0.008mg/L,线性范围为0.039~1.25 mg/L,对肉品进行检测的回收率在91.3%以上,可实现现场快速检测。通过更换带有印迹膜的丝网印刷电极,将微量待测样品直接滴入电极工作区,即可实现多个样品的快速检测。该传感器的敏感元件的使用寿命在4个月以上。基于MIPs膜为感受器的电导型传感仪具有检测速度快、重复性好、稳定性高、使用时间长等优点,有很大的实际应用价值。
刘蓉等[30]利用电化学聚合方法制备了对桑色素具有特异性识别能力的分子印迹膜传感器。以邻氨基酚(o-AP)为功能单体、桑色素为模板分子,在金电极表面电聚合制备具有特异性识别孔穴的桑色素分子印迹传感器膜。他们采用循环伏安法(CV)、差分脉冲伏安法(DPV)研究了分子印迹膜的性能和分子印迹效应,并比较了此传感器对其结构相似物的响应选择性。在最佳实验条件下,该传感器对桑色素浓度定量测定范围为5.0×10-8~1.7×10-6 mol/L,线性方程为I(μA)=1.0800lgc+9.3599,R=0.9934,检出限为1.0×10-8mol/L。用此传感器测定黑茶样品中桑色素的含量,加标回收率为104.0%~108.0%。Xiao等[31]首先将导电聚(苯胺基甲基三乙氧基硅烷)膜电沉积在碳糊电极表面,然后通过溶胶-凝胶法在其上共价覆盖分子印迹聚硅氧烷膜,形成对灭滴灵具有高灵敏度和高选择性的导电聚合双层分子印迹混合膜传感器。在优化条件下,检测灭滴灵的线性范围为4.0×10-7~2.0×10-4 mol/L,检出限9.1×10-8mol/L,日内相对标准偏差(RSD)为2.9%~4.7%,日间RSD为3.4%~4.2%。该传感器已经成功用于人体血浆、血清、尿样本中甲硝唑的检测。
Kobayashi等[32]以咖啡因为模板,聚丙烯腈为交联剂,采用相转化沉淀法制备了厚度约为0.1mm的MIPs膜,并将膜沉积在石英晶体微天平(QCM)金电极上,将此电极浸入含咖啡因样品中,通过电流作用将咖啡因富集吸附于电极表面,导致QCM的谐振频率下降,30min内可达到稳定,频率下降值为1Hz时,对应的电极质量增加了0.061g。左言军等[33]采用电化学聚合法首次合成了对有机磷毒剂沙林具有快速响应的高灵敏度分子印迹纳米膜,随后在QCM上制成了响应速度快(响应时间2s)、抗干扰能力强的纳米分子印迹传感器。Panasyuk等[34]应用电聚合法在金电极表面合成了膜厚度仅约16nm的苯丙氨(Phe)印迹层,与甘汞电极组成测定Phe的传感器。聚合前,利用巯基苯酚在电极表面自组装成单分子层,改善SMIPs层与金表面的结合力;聚合后,用巯基烷烃填补聚合物的缺陷。在优化条件下,吸附Phe所引起的电容变化的线性浓度范围为0.5~8 mg/mL,响应时间约15min。此传感器可应用于对模板分子浓度的监测,但该SMIPs层交联度低,导致稳定性、重复利用性都较差,基本上只能满足一次使用。
刘海等[35]使用氯甲基化聚砜膜-NH2/S2O82-引发体系,将单体苯乙烯磺酸钠与交联剂N,N′-亚甲基双丙烯酰胺聚合,采用接枝聚合与模板印迹同步进行的表面分子印迹方法制备了接枝型农药抗蚜威分子印迹敏感膜。该印迹膜对抗蚜威分子的结合容量达92μg/cm2。以与抗蚜威分子结构相似的阿特拉津作对照组,印迹膜对抗蚜威的选择性系数达4.5。在1.0×10-6~1.0×10-3mol/L浓度范围内,传感器膜电极的电位响应与抗蚜威浓度对数呈良好的线性关系(R=0.9999),检出限2.5×10-8mol/L。该电位型印迹膜传感器制作过程简单、检测灵敏、准确性高、电位响应快速(t < 10s),为构建其他类型的分子印迹膜传感器提供了新的研究思路。Tiu等[36]基于芘印迹聚噻吩纳米薄膜建立了荧光检测超痕量芘及其类似物的膜传感器。通过电化学沉积法在金表面形成聚噻吩纳米膜,纳米薄膜产生特定的荧光发射,当结合芘及其类似物时,发生荧光猝灭。其线性响应浓度范围为1.0×10-8~1.0×10-6 mol/L,RSD < 5.6%,具有良好的稳定性和再现性。此SMIS可应用于含有芘及其他多环芳香烃的水产、海洋和空气样品的监测。
1998年,Lai等[37]基于MIPs-表面等离子共振(Surface plasmon resonance,SPR)成功制备了茶碱、黄嘌呤和咖啡因分子印迹膜传感器,可对待测物进行特异性结合与快速分析检测。Yola等[38]制备了以烯丙硫醇修饰的SPR芯片,在其表面印迹阿莫西林模板,形成了MIPs-SPR膜传感器,用于分析测定鸡蛋和血浆中的阿莫西林残留。采用甲醇提取待测样,用磷酸盐缓冲液对提取液进行稀释后分析,检出限可达0.022ng/mL,线性范围为0.1~2.0 ng/mL。他们还利用上述方法对血浆中的阿拉米星(AMIK)残留进行分析[39],检出限可达4.3×10-9mol/L,RSD为4.8%。
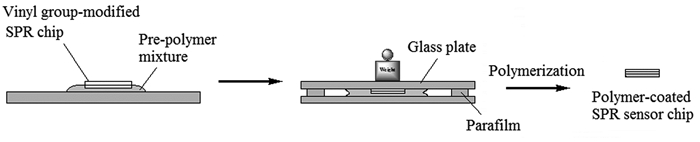
Matsunaga等[40]应用自聚合法将裸金芯片浸入N,N′-双(丙烯酰基)胱胺溶液中30min,在其表面引入乙烯基团,而后将含有模板分子溶菌酶、功能单体丙烯酸、交联剂二甲基双丙烯酰胺、引发剂过硫酸钾和一定量NaCl的分子印迹聚合体系滴涂于乙烯基化的芯片表面,得到MIPs-SPR芯片(如图 2所示),并应用此芯片进行了溶菌酶、核糖核酸酶A、细胞色素C、Mb以及乳白蛋白的分析测定。研究发现,分子印迹聚合体系中加入40mmol/L NaCl时,芯片对上述几种物质的吸附响应值最大,且响应值变化大小顺序为:溶菌酶 > 细胞色素C > 核糖核酸酶A > Mb > 乳白蛋白。采用化学方法制备MIPs,再采用电聚合的方法将印迹聚合物颗粒固定到裸金芯片表面,制备得到新型复合型SMIS,其能够利用二者的协同效应,增强了传感器的选择性识别能力。
上述研究表明,SMIPs膜具有较高的识别能力,是一种理想的分子识别单元,通过结合各种传导元件的信号输出,SMIPs膜构成的传感器既可对目标物进行识别,又可对目标物进行定性定量检测。传导元件按照信号输出的不同又可划分为电极、荧光、场效应晶体管、压电晶体和热敏电阻等。通常,为了获得最大的信号响应和最小的干扰以及能够重复使用,将识别元件以膜的形式固定在传导元件表面,从而有效地解决了SMIPs膜的制备、保存及传感器界面接触的问题,提高了检测灵敏度,且重复利用效率高。因此,近年来SMIPs膜传感器在临床诊断、食品工业、药物残留、环境保护等领域受到高度关注[5, 41, 42]。
2.2 玻碳电极型传感器
1999年,Baltussen等[43]提出了一种特殊的提取分析物的模式,称为搅拌棒吸附提取,即以聚合在玻璃棒表面上的印迹聚合物作为直接吸附介质,在提取过程中实现富集分离,是一种广泛应用于食品、环境和生物样品分析前处理的固相微萃取方法[44]。Yola等[45]应用电沉积聚合法将掺杂多金属氧酸盐(H3PW12O40,POM)、银纳米颗粒和功能化石墨烯修饰在玻碳电极上,建立了检测赭曲霉毒素A(OCH)的新型电化学分子印迹传感器。该方法利用伏安转换器检测葡萄汁和葡萄酒中的OCH,线性范围5.0×10-11~1.5×10-9 mol/L,检出限1.6×10-11mol/L。此SMIPs玻碳电极传感器具有良好的选择性和重复性,可应用于OCH的常规分析。该技术集萃取与检测一体化,实现了设备的小型化和自动化,为现场检测技术发展提供了研究思路。
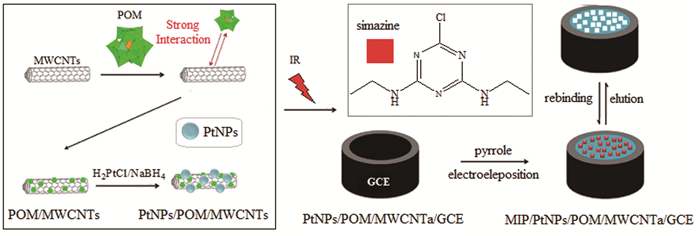
Ertan等[46]制备了一种玻碳电极传感器,并成功应用于废水中西玛津(SIM)样品检测。其制备过程如图 3所示。将该MIP/PtNPs/POM/MWCNTs/GCE电极用于废水样品中SIM的分析,检出限为2.0×10-11mol/L。与其他分析方法相比(表 1所示),其检出限最低,灵敏性最高。玻碳电极传感器集采样、分离、富集及现场检测于一身,简化了测试流程,极大节约了成本。
 表 1
文献分析方法与MIP玻碳电极传感器的性能比较
Table 1.
Comparison of the performance of the proposed MIP sensor with other analytical methods
表 1
文献分析方法与MIP玻碳电极传感器的性能比较
Table 1.
Comparison of the performance of the proposed MIP sensor with other analytical methods

2.3 核-壳型表面印迹传感器
通常可以用乙烯基[51, 52]、异氰酸酯[53]或氨基[54]对硅纳米颗粒进行功能化修饰,在模板分子存在的条件下,功能单体和交联剂在其表面印迹聚合,制备得到含有高密度印迹位点的聚合层,该聚合层能够充分将印迹位点暴露,减少“包埋”现象,提高了传质速率、选择性和吸附效率。Gao等[55]报道了在SiO2纳米粒子表面上功能单体定向印迹2, 4, 6-三硝基甲苯(TNT)分子的方法。该方法以TNT为模板,在SiO2粒子表面修饰的乙烯基官能单体层上形成厚度和识别位点可控的印迹壳层。
Tang等[56]以通过表面接枝获得的氨基改性SiO2纳米粒子作为载体,甲基对硫磷作为模板,丙烯酰胺为功能单体,3-(甲基丙烯酰氧)丙基三甲氧基硅烷(MAPS)为交联剂,制备得到核壳型SMIP。Hu等[57]制备了核-壳结构铝掺杂表面分子印迹硅氧烷改性碳糊电极,用于检测二甲硝咪唑(DMZ)。在最佳实验条件下,通过DPV法测定,浓度线性范围为1.0×10-8~1.0×10-6mol/L,检出限为3.6×10-9mol/L。该传感器成功用来重复检测鸡蛋、奶粉及猪饲料样品中的DMZ,回收率在91.4%~107.6%之间。与传统SMIPs的相比,铝掺杂提高了DMZ检测的灵敏度,实现了微量DMZ的快速检测。此传感器已经在临床试验、药物分析和环境监测等领域获得应用。龚伟等[58]以介孔硅作为敏感材料,以多巴胺为模板分子,成功合成了对多巴胺具有良好选择识别能力的SMIS。在优化实验条件下,传感器的氧化峰电流与多巴胺浓度在1.0×10-7~2.0×10-6 mol/L和2.0×10-6~1.0×10-4 mol/L浓度范围内呈良好的线性关系,相关系数分别为0.9925和0.9969,检出限为1.3×10-9mol/L。将其用于实际样品血清检测,回收率为98%~103%。该有序介孔硅表面分子印迹传感器比普通SMIS对多巴胺有更好的选择性和灵敏度,在响应稳定性和线性范围上有很大提高,对印迹介孔材料在高性能传感器方面的应用有一定的参考价值。
唐婷等[59]采用溶胶-凝胶法合成SiO2覆盖的碳纳米管(CNTs/SiO2),通过化学接枝法将MAPS接入CNTs/SiO2表面,从而获得富含烯键的MAPS-CNTs/SiO2。以MAPS-CNTs/SiO2为分子印迹载体、芦丁为模板分子、丙烯酰胺为功能单体、乙二醇二甲基丙烯酸酯为交联剂,通过自由基聚合法制备CNTs/SiO2-SMIPs,再将CNTs/SiO2-SMIPs滴涂至玻碳电极表面,构建了识别芦丁的电化学传感器。CNTs/SiO2-SMIPs传感器的电流响应与芦丁的浓度在1.0×10-7~1.0×10-4 mol/L浓度范围内呈良好的线性关系,检出限为3.2×10-8mol/L(S/N=3)。该方法已成功应用于药片中芦丁含量的测定。
Li等[60]以磁性Fe3O4纳米粒子为载体,采用接枝共聚法将温度敏感单体N-异丙基丙烯酰胺(PNIPAM)、功能性单体甲基丙烯酸(MAA)和交联剂N,N′-亚甲基双丙烯酰胺(MBA)在其表面进行共聚合,成功制备了一种牛血清蛋白(BSA)表面印迹热敏磁性复合微球。该磁性复合微球对BSA的吸附容量可达到71.85mg/g,印迹因子为1.70。与非磁性SiO2载体相比,含磁性载体的聚合物微球更容易分离。Zhang等[61]向油酸化的Fe3O4微球表面引入氨基和醛基,以藻蓝蛋白为模板分子,两步细乳液聚合法制得了荧光、磁性双响应的核-壳型MIPs。该光磁双响应蛋白质印迹微球形貌规则,粒径均一,对模板蛋白吸附效率高、选择性好,且具有较快的传质速率,在靶蛋白的富集及荧光成像分析中具有潜在的应用价值。
Huang等[62]将基于Fe3O4纳米粒子的SMIP Fe3O4/PDA-PtNPs修饰于磁性玻碳基底的表面,制得一种复合型电化学传感器。Fe3O4/PDA-PtNPs聚合物中含有聚多巴胺(PDA)组分,因此材料表面具有良好的亲水性;聚合物中复合的铂纳米粒子使其具有良好的导电性。这种复合型电化学传感器对血红蛋白(Hb)具有良好的识别性,交流阻抗变化值与Hb浓度在0.14~2.7 μg/mL浓度范围呈良好的线性关系,检出限为0.05μg/mL(S/N=3)。该印迹方法为多肽、蛋白质、DNA等生物大分子印迹传感器的制备及仿生传感提供了新思路。魏小平等[63]以辛可宁为模板、十二烷基硫醇为功能单体,在Fe3O4@Au纳米粒子表面自组装辛可宁分子印迹膜,构建了新型磁性粒子-分子印迹电化学发光传感器。辛可宁浓度在1×10-10~9×10-8mol/L范围内与电化学发光强度变化值呈现良好的线性关系,检出限为3.5×10-11mol/L,血清样品中辛可宁的加标回收率在98.8%以上。此传感器具有灵敏度高、选择性好、易于更换的优点。
具有独特荧光特性的量子点(QDs)在分子生物学、生物化学、基因组学以及蛋白质组学等领域获得广泛研究。选择QDs作为表面印迹的载体,在其表面进行印迹,制得的QDs印迹聚合物核-壳传感器可同时具有荧光效应和高选择性的优点。Wang等[64]通过SMIT将分子印迹聚合物层固定在掺杂锰元素的ZnS QDs表面,开发出了一种基于MIPs的室温磷光光电传感器。在无自发荧光和基质散射光的干扰下,采用传感器检测水样中痕量五氯酚(PCP),其检出限可达8.6×10-5moL/L,RSD为2.8%。该传感器用于河水样品中PCP的检测,回收率可达93%~106%。Zhou等[65]采用水热法将氧化石墨烯在200℃反应36h,制备了石墨烯QDs,并以此作为荧光基质,合成了以4-硝基酚为模板的荧光分子印迹聚合物。4-硝基酚的线性检测范围为0.02~3.00 mg/mL,检出限为9.0ng/mL。
Zhang等[66]基于分子印迹空腔和硼酸的亲和性制备了涂覆在CdTe纳米晶上的荧光纳米核-壳结构传感器,并将其用于选择性检测糖蛋白。MIPs与硼酸组合为一个共同的识别元件,通过CdTe纳米晶的荧光信号检测糖蛋白分子。传感器对糖蛋白的识别性能可通过pH和温度进行调控,目前已成功应用于生物体液中辣根过氧化酶(HRP)的检测。该传感器能够广泛应用于生物系统中糖蛋白的定量检测,为临床诊断糖蛋白提供了简便、高效的分析工具。Jalili等[67]通过溶胶-凝胶法制备出基于SiC QDs的识别硝苯地平(NIF)的SMIS。在优化条件下,NIF在传感器上的线性响应浓度范围为2.8×10-7~3.4×10-6mol/L,检出限7.6×10-8mol/L。此传感器被应用于测定血清和尿中的NIF,回收率在94.2%以上。
2.4 中空型表面印迹传感器
与实心球体和核-壳型印迹材料相比,中空型MIPs具有高度的单分散性和尺寸均匀性,单位质量MIPs的结合容量更大,印迹聚合层结合位点的利用率高、选择性更加突出,成为构建SMIS的优良材料之一。Wang等[68]基于表面印迹中空乙烯基SiO2粒子制备了厚度约40nm的中空微球。将其应用于实际样品中雌二醇的选择性识别和吸附,回收率在97.0%~94.8%之间,RSD为2.5%~2.7%。
Zhao等[69]制备了一种新型的单分散分子印迹多孔空心微球传感器。以介孔SiO2粒子作为核,接着采用APTMS和丙烯酰氯分别在其表面改性,然后通过沉淀聚合控制改性微球表面印迹聚合层的厚度,最后溶解掉SiO2核,形成中空结构甲氰菊酯印迹多孔空心微球。这种中空结构增加了空心微球的有效结合位点,使其对甲氰菊酯分子具有强吸附能力,提高了分离和富集的能力。将该印迹多孔空心微球用于检测白菜、梨、苹果中的甲氰菊酯,线性浓度范围为5.0×10-8~1.5×10-5 g/mL,检出限为3.07×10-8g/mL,加标回收率分别为98.9%、102.3%和97.6%,RSD < 1.5%,方法的精密度和准确性良好。
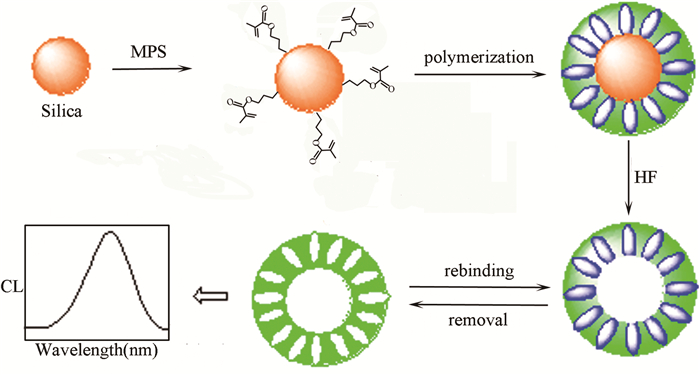
Xie等[70]基于表面分子印迹策略合成了毒死蜱(CPF)印迹的核-壳颗粒,再通过HF蚀刻制得中空结构SMIS(如图 4所示)。在1.0×10-6~2.0×10-9mol/L范围内,化学发光(CL)强度(ΔI)的对数值与CPF浓度的对数值呈线性关系,线性方程为log(ΔI)=4.3+0.2logc(R=0.9926),检出限是1.0×10-8mol/L,RSD为3.6%(n=11),比常规方法检测低2个数量级。该SMIS被成功应用于蔬菜样品中CPF的检测,不仅能显著提高CPF分析的灵敏度和选择性,而且重复测定效果好。
3 结语
SMIS是一种由选择性单元和敏感元件组成的对特定物质的识别检测装置,它具有成本低廉、制作简单、选择性高、灵敏度好的优点,近年来已成为传感器研究的重点方向。表面印迹纳米材料的比表面积大、粒径小、专一识别性强,完全满足SMIS的微型化、快速检测、准确性高等要求。其中,结合了磁性纳米颗粒的表面印迹材料有望应用于生物活体检测;与碳纳米材料结合极大地促进了SMIS的发展,例如,石墨烯在SMIS方面表现出不同于其他材料的优势,能检测生物小分子和细菌,在环境和食品安全检测等方面也有一定的应用;与碳量子点结合的表面印迹材料较以往的荧光材料更具生物安全性,对生物分子的活性干扰小,有望作为生物标记物对生物体进行长时间的检测,下一步的研究将解决如何有效地将印迹聚合物包覆在QDs上并使其表面功能化,提高测试的灵敏性和准确性。尽管SMIPs敏感材料在传感器中的应用研究已取得了较大进展[71],尤其在SMIPs的制备、检测条件、聚合物材料的识别效果[5, 72]及信号转换器的选择等方面取得了较好的成果,但也还存在一些亟待解决的问题:(1) 传感元件种类较少,可满足检测的对象有限;(2) 被分析物与芯片结合产生的信号灵敏性不够,检出限较高;(3) 识别对象大多集中在有机相中,对水相中的有机污染物的识别还有待进一步拓展;(4) 对大分子,例如蛋白质、病毒、细胞等的识别研究需要深化,尤其在提高选择性和灵敏度方面还待加强。为解决这些瓶颈问题,拓宽SMIPs的应用领域,今后应致力以下几方面研究:(1) 结合SPR图像检测技术或微流控芯片技术,通过高精度成像,配合微机电系统(MEMS)技术加工的多通道SMIPs微流控芯片,可对阵列芯片上的每个单元进行精确的液体操控[28, 73],可以连续24h自动化工作,有望实现对成百上千个样品或反应的同时检测;(2) 亲水性官能团修饰的SMIPs复合材料可解决与水相容的问题,应用前景广阔;(3) 计算机辅助设计的SMIPs使单体与交联剂的选择更加合理化,从而提高其使用效率;(4) 生物相容性SMIPs的设计与研发,有望推动对分子和细胞的检测,实现高通量的实时检测及活体检测。
-
-
[1]
S Li, G Yi, A P F Turner. Adv. Funct. Mater., 2011, 21 (6): 1194~1200. https://www.researchgate.net/publication/230280754_A_Catalytic_and_Positively_Thermosensitive_Molecularly_Imprinted_Polymer
-
[2]
C Choong, J Bendall, W Milne. Biosens. Bioelectron., 2009, 25 (3): 652~656. https://www.researchgate.net/publication/23931629_Carbon_nanotube_array_a_new_MIP_platform
-
[3]
S Xu, H Lu, X Zheng et al. J. Mater. Chem. C, 2013, 1(29): 4406~4422.
-
[4]
L Chen, S Xu, J Li. Chem. Soc. Rev., 2011, 40(5): 2911~2942.
-
[5]
L Chen, X Wang, W Lu et al. Chem. Soc. Rev., 2016, 45(8): 2137~2211. https://www.researchgate.net/publication/296678763_Molecular_imprinting_perspectives_and_applications
-
[6]
K Tsukagoshi, K Y Yu, M Maeda et al. Bull. Chem. Soc. Jpn., 1993, 66 (1): 114~120. https://www.researchgate.net/publication/244713319_Metal_IonSelective_Adsorbent_Prepared_by_Surface-Imprinting_Polymerization
-
[7]
J S Min, Y J Shin, S W Hwang et al. Int. J. Polym. Sci., 2013, 2013(21): 9714~9722. https://www.researchgate.net/publication/258391843_Recognizing_Amino_Acid_Chirality_with_Surface-Imprinted_Polymers_Prepared_in_WO_Emulsions
-
[8]
Y C Xiao, M L Hui, S Chung et al. Langmuir, 2008, 23(26): 12990~12996. https://www.researchgate.net/publication/5827451_Acetylation_of_-cyclodextrin_surface-functionalized_cellulose_dialysis_membranes_with_enhanced_chiral_separation
-
[9]
M Baniceru, C V Manda, S M Popescu. J. Pharm. Biomed. Anal., 2011, 54(1): 1~12. http://www.researchgate.net/publication/45628961_Chromatographic_analysis_of_local_anesthetics_in_biological_samples
-
[10]
M Jia, L Qin, X W He et al. J. Mater. Chem., 2011, 22(2): 707~713. M Jia, L Qin, X W He et al. J. Mater. Chem., 2011, 22(2): 707~713.
-
[11]
S A Zaidi. Electrophoresis, 2013, 34(34): 1375~1382. https://www.researchgate.net/publication/264270450_Dual-templates_molecularly_imprinted_monolithic_columns_for_the_evaluation_of_serotonin_and_histamine_in_CEC
-
[12]
F Ahmadi, E Yawari, M Nikbakht. J. Chromatogr. A, 2014, 1338(7): 9~16. https://www.researchgate.net/publication/260840444_Computational_design_of_an_enantioselective_molecular_imprinted_polymer_for_the_solid_phase_extraction_of_S-warfarin_from_plasma?ev=auth_pub
-
[13]
C Xing, Z Zhang, Y Xiao et al. Talanta, 2012, 99(17): 959~65.
-
[14]
D Djozan, B Ebrahimi, M Mahkam et al. Anal. Chim. Acta, 2010, 67(1): 40~48.
-
[15]
C J Stephenson, K D Shimizu. Polym. Int., 2007, 56(4): 482~488. https://www.researchgate.net/publication/229935633_Colorimetric_and_fluorometric_molecularly_imprinted_polymer_sensors_and_binding_assays
-
[16]
H F Hawari, N M Samsudin, A Y M Shakaff et al. Sens. Actuat. B, 2013, 187(187): 434~444. https://www.researchgate.net/publication/258278932_Highly_selective_molecular_imprinted_polymer_(MIP)_based_sensor_array_using_interdigitated_electrode_(IDE)_platform_for_detection_of_mango_ripeness
-
[17]
娄忠良, 孟子晖, 王鹏等. 有机化学, 2009, 29(11): 1744~1749. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu200911008&dbname=CJFD&dbcode=CJFQ
-
[18]
J J Becker, M R Gagne. Acc. Chem. Res., 2004, 37(10): 798~804. https://www.researchgate.net/publication/8226156_Exploiting_the_synergy_between_coordination_chemistry_and_molecular_imprinting_in_the_quest_for_new_catalysts
-
[19]
Pan J, Hang H, Li X et al. Appl. Surf. Sci., 2013, 287(12): 211~217. https://www.researchgate.net/publication/260942114_Fabrication_and_evaluation_of_temperature_responsive_molecularly_imprinted_sorbents_based_on_surface_of_yeast_via_surface-initiated_AGET_ATRP
-
[20]
J D Lee, J I Hong. Tetrahed. Lett., 2013, 54(22): 2890~2893.
-
[21]
H Shi, W B Tsai, M D Garrison et al. Nature, 1999, 398(6728): 593~597. https://www.researchgate.net/profile/Wei-Bor_Tsai/publication/31994719_Template-imprinted_nanostructured_surfaces_for_protein_recognition/links/00b4953c4df7ecb1ad000000?ev=pub_ext_doc_dl_meta
-
[22]
L Ye, K Haupt. Anal. Bio. Chem., 2004, 378(8): 1887~1897.
-
[23]
H Ju, X Zhang, J Wang. Nanobiosensing, 2011: 265~303. https://www.researchgate.net/publication/251410678_Biosensing_Applications_of_Molecularly_Imprinted_Nanomaterials
-
[24]
S Suriyanarayanan, P J Cywinski, A J Moro et al. Top. Curr. Chem., 2012, 325(10): 165~265. https://www.researchgate.net/publication/49654959_Chemosensors_Based_on_Molecularly_Imprinted_Polymers
-
[25]
Y Wang, Z Zhang, V Jain et al. Sens. Actuat. B, 2010, 146(1): 381~387. https://www.researchgate.net/publication/223450629_Potentiometric_sensors_based_on_surface_molecular_imprinting_Detection_of_cancer_biomarkers_and_viruses?ev=auth_pub
-
[26]
S W Lee, A Izumi Ichinose, T Kunitake. Langmuir, 1998, 14(10): 2857~2863. http://www.researchgate.net/publication/231679938_Molecular_Imprinting_of_Azobenzene_Carboxylic_Acid_on_a_TiO2_Ultrathin_Film_by_the_Surface_Sol-Gel_Process
-
[27]
J Kupis-Rozmysłowicz, M Wagner, J Bobacka et al. Electrochim. Acta, 2016, 188: 537~544. https://www.researchgate.net/publication/285758787_Biomimetic_membranes_based_on_molecularly_imprinted_conducting_polymers_as_a_sensing_element_for_determination_of_taurine
-
[28]
F T Moreira, R A Dutra, J P Noronha et al. Biosens. Bioelectron., 2011, 26(12): 4760~4766.
-
[29]
刘晓芳, 姚冰, 刘国艳等. 分析化学, 2010, 38(5): 683~687. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=fxhx201005021&dbname=CJFD&dbcode=CJFQ
-
[30]
刘蓉, 龙立平, 刘石泉等. 化学通报, 2015, 78(10): 918~922. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxtb201510010&dbname=CJFD&dbcode=CJFQ
-
[31]
N Xiao, J Deng, J Cheng et al. Biosens. Bioelectron., 2016, 81: 54~60. https://www.researchgate.net/publication/295245535_Carbon_paste_electrode_modified_with_duplex_molecularly_imprinted_polymer_hybrid_film_for_metronidazole_detection
-
[32]
T Kobayashi, Y Murawaki, P S Reddy et al. Anal. Chim. Acta, 2001, 435(1): 141~149. https://www.researchgate.net/publication/202178811_Molecular_imprinting_of_caffeine_and_its_recognition_assay_by_quartz-crystal_microbalance
-
[33]
左言军, 余建华, 黄启斌等. 分析化学, 2003, 31(7): 769~773. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=fxhx200307000&dbname=CJFD&dbcode=CJFQ
-
[34]
T L Panasyuk, V M Mirsky, S A Piletsky et al. Anal. Chem., 1999, 71(20): 4609~4613.
-
[35]
刘海, 孙世雄, 杜瑞奎等. 分析测试学报, 2015, 34(10): 1126~1133. http://www.cqvip.com/QK/95913X/201510/666434744.html
-
[36]
B D B Tiu, R J Krupadam, R C Advincula. Sens. Actuat. B, 2016, 228: 693~701. https://www.researchgate.net/publication/291690276_Pyrene-Imprinted_Polythiophene_Sensors_for_Detection_of_Polycyclic_Aromatic_Hydrocarbons
-
[37]
E P Lai, A Fafara, V A Vandernoot et al. Can. J. Chem., 1998, 76(3): 265~273. https://www.researchgate.net/publication/244667815_Surface_plasmon_resonance_sensors_using_molecularly_imprinted_polymers_for_sorbent_assay_of_theophylline_caffeine_and_anthine
-
[38]
M L Yola, T Eren, N Atar. Sens. Actuat. B, 2014, 195(195): 28~35. https://www.researchgate.net/publication/259993460_Molecular_imprinted_nanosensor_based_on_surface_plasmon_resonance_Application_to_the_sensitive_determination_of_amoxicillin
-
[39]
M L Yola, N Atar, T Eren. Sens. Actuat. B, 2014, 198(198): 70~76. https://www.researchgate.net/publication/261183084_Determination_of_amikacin_in_human_plasma_by_molecular_imprinted_SPR_nanosensor
-
[40]
T Matsunaga, T Hishiya, T Takeuchi. Anal. Chim. Acta, 2007, 591(1): 63~67. https://www.researchgate.net/publication/6373594_Surface_plasmon_resonance_sensor_for_lysozyme_based_on_molecularly_imprinted_thin_films
-
[41]
J R L Guerreiro, V E Bochenkov, K Runager et al. ACS Sens., 2016, 1(3): 258~264.
-
[42]
L Uzun, A P F Turner. Biosens. Bioelectron., 2016, 76: 131~144. https://www.researchgate.net/publication/280038390_Molecularly-imprinted_polymer_sensors_realising_their_potential
-
[43]
E Baltussen, P Sandra, F David et al. J. Microcolumn Sep., 1999, 11(10): 737~747.
-
[44]
M Kawaguchi, R K Ito, H Nakazawa. J. Pharm. Biomed. Anal., 2006, 40(3): 500~508. https://www.researchgate.net/publication/7524859_Novel_stir_bar_sorptive_extraction_methods_for_environmental_and_biomedical_analysis
-
[45]
M L Yola, V K Gupta, N Atar. Mater. Sci. Eng. C, 2016, 61: 368~375. https://www.researchgate.net/publication/288919674_New_molecular_imprinted_voltammetric_sensor_for_determination_of_ochratoxin_A
-
[46]
B Ertan, T Eren, I Ermis et al. J. Colloid Interf. Sci., 2016, 470: 14~21. https://www.researchgate.net/publication/295503569_Sensitive_analysis_of_simazine_based_on_platinum_nanoparticles_on_polyoxometalatemulti-walled_carbon_nanotubes
-
[47]
M S Dopico, M V González, J M Castro et al. J. Chromatogr. Sci., 2002, 40(9): 523~528. https://www.researchgate.net/publication/11034598_Determination_of_triazines_in_water_samples_by_high-performance_liquid_chromatography_with_diode-array_detection
-
[48]
S H Tseng, Y J Lin, P C Chang et al. J. Food Drug Anal., 2004, 12(3): 238~243. https://www.researchgate.net/publication/287010552_Determination_of_residual_dalapon_in_sugarcane_by_gas_chromatograph_equipped_with_electron_capture_detector_GC-ECD
-
[49]
Y Fuchiwaki, H Suzuki, N Sasaki et al. J. Sens., 2009: 11~15.
-
[50]
H Katsumata, A Fujii, S Kaneco et al. Talanta, 2005, 65(1): 129~134. https://www.researchgate.net/publication/23437414_Determination_of_simazine_in_water_samples_by_HPLC_after_preconcentration_with_diatomaceous_earth
-
[51]
P Yan, X Ying, L Jing et al. Anal. Chim. Acta, 2010, 674(2): 190~200. https://www.researchgate.net/publication/45460777_Molecularly_imprinted_polymer_layer-coated_silica_nanoparticles_toward_dispersive_solid-phase_extraction_of_trace_sulfonylurea_herbicides_from_soil_and_crop_samples
-
[52]
R Zhu, W Zhao, M Zhai et al. Anal. Chim. Acta, 2010, 658(2): 209~216. https://www.researchgate.net/publication/41148095_Molecularly_imprinted_layer-coated_silica_nanoparticles_for_selective_solid-phase_extraction_of_bisphenol_A_from_chemical_cleansing_and_cosmetics_samples
-
[53]
C Zhai, Q Lu, X Chen et al. J. Chromatogr. A, 2009, 1216(12): 2254~2262. https://www.researchgate.net/publication/23967033_Molecularly_imprinted_layer-coated_silica_nanoparticles_toward_highly_selective_separation_of_active_diosgenin_from_Dioscorea_nipponica_Makino
-
[54]
F Yang, J Mao, X W He et al. Anal. Bioanal. Chem., 2013, 405 (15): 5321~5331. https://www.researchgate.net/publication/236103955_Preparation_of_a_boronate-functionalized_affinity_hybrid_monolith_for_specific_capture_of_glycoproteins
-
[55]
D Gao, Z Zhang, M Wu et al. J. Am. Chem. Soc., 2007, 129(25): 7859~66.
-
[56]
T Lei, W Li, L He et al. J. Chromatogr. A, 2014, 1336 (7): 59~66.
-
[57]
C Hu, J Deng, X Xiao et al. Electrochim. Acta, 2015, 158: 298~305.
-
[58]
龚伟, 徐岚, 王亚琼. 化学传感器, 2011, 31(2): 42~47. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxch201102010&dbname=CJFD&dbcode=CJFQ
-
[59]
唐婷, 汤传贵, 曾延波等. 分析测试学报, 2015, 34(11): 1253~1258. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=test201511008&dbname=CJFD&dbcode=CJFQ
-
[60]
X Li, B Zhang, W Li et al. Biosens. Bioelectron., 2014, 51: 261~267.
-
[61]
Z Zhang, J Li, J Fu et al. RSC Adv., 2014, 4(40): 20677~20685.
-
[62]
黄春芳, 姚桂红, 邱建丁. 电化学, 2014, 20(6): 521~526. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=dhxx201406004&dbname=CJFD&dbcode=CJFQ
-
[63]
魏小平, 谭艳季, 李建平. 分析化学, 2015, (3): 424~428. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=fxhx201503027&dbname=CJFD&dbcode=CJFQ
-
[64]
H F Wang, Y He, T R Ji et al. Anal. Chem., 2009, 81 (81): 1615~1621. https://www.researchgate.net/publication/23949664_Surface_molecular_imprinting_on_Mn-doped_ZnS_quantum_dots_for_room-temperature_phosphorescence_optosensing_of_pentachlorophenol_in_water
-
[65]
Y Zhou, Z B Qu, Y Zeng et al. Biosens. Bioelectron., 2014, 52(52C): 317~323. https://www.researchgate.net/publication/257248113_A_novel_composite_of_graphene_quantum_dots_and_molecularly_imprinted_polymer_for_fluorescent_detection_of_paranitrophenol?ev=auth_pub
-
[66]
W Zhang, W Liu, P Li et al. Angew. Chem. Int. Ed., 2014, 53(46): 12489~12493. https://www.researchgate.net/publication/264625581_Fabrication_of_Ultralong_Hybrid_Microfibers_from_Nanosheets_of_Reduced_Graphene_Oxide_and_Transition-Metal_Dichalcogenides_and_their_Application_as_Supercapacitors
-
[67]
R Jalili, M Amjadi. RSC Adv., 2015, 5(90): 74084~74090.
-
[68]
X Wang, Q Kang, D Shen et al. Talanta, 2014, 124(13): 7~13. https://www.researchgate.net/publication/260604573_Novel_monodisperse_molecularly_imprinted_shell_for_estradiol_based_on_surface_imprinted_hollow_vinyl-SiO2_particles
-
[69]
P Zhao, J Yu, S Liu et al. Sens. Actuat. B, 2012, 162(1): 166~172. https://www.researchgate.net/publication/257354063_One_novel_chemiluminescence_sensor_for_determination_of_fenpropathrin_based_on_molecularly_imprinted_porous_hollow_microspheres
-
[70]
C Xie, H Li, S Li et al. Microchim. Acta, 2011, 174(3/4): 311~320. https://www.researchgate.net/publication/226275898_Surface_molecular_imprinting_for_chemiluminescence_detection_of_the_organophosphate_pesticide_chlorpyrifos?ev=auth_pub
-
[71]
姚婷, 李腾飞, 秦玉昌等. 分析测试学报, 2015, 34(2): 237~244. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=test201502023&dbname=CJFD&dbcode=CJFQ
-
[72]
Z R Long, W W Xu, Y Lu et al. J. Chromatogr. B, 2016, 1029~1030: 230~238.
-
[73]
Z R Long, Y Lu, M L Zhang et al. J. Sep. Sci., 2014, 37: 2764~2770.
-
[1]
-
表 1 文献分析方法与MIP玻碳电极传感器的性能比较
Table 1. Comparison of the performance of the proposed MIP sensor with other analytical methods

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:



 下载:
下载:

