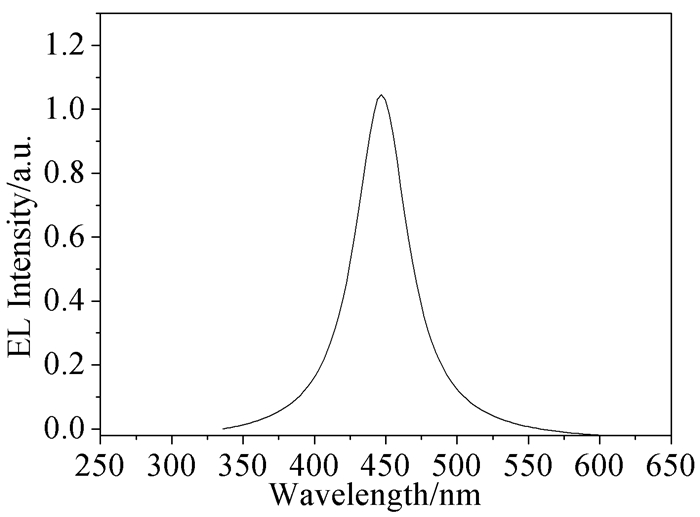
 图 1
化合物2的电致发光光谱图[7]
Figure 1.
The electroluminescence (EL) spectrum of 2[7]
图 1
化合物2的电致发光光谱图[7]
Figure 1.
The electroluminescence (EL) spectrum of 2[7]

Citation: Wang Shan, Shi Lubin, Jing Chaojun. Progress in Fluorene-Based Organic Blue Luminescent Materials[J]. Chemistry, 2017, 80(4): 315-321.

芴基有机蓝光材料的研究进展
English
Progress in Fluorene-Based Organic Blue Luminescent Materials
-
Key words:
- Fluorene
- / Organic light-emitting diode
-
有机发光二极管(Organic light-emitting diode,OLED)具有驱动电压低、发光亮度和效率高、发光视角宽、响应速度快、重量轻、厚度薄、可制作成柔性弯曲的器件、使用范围宽等优点,在全彩色平板显示和固体照明技术中具有广阔的应用前景[1~4]。在OLED显示器中,高效率和高色纯度的红、绿、蓝三基色材料是实现全彩显示的必备条件,但是相对于绿光和红光发光材料来说,已报道的高效率、高稳定性的蓝光材料[5]很少。因此,制备高发光效率、高色纯度和高稳定性的蓝光材料具有重要意义。OLED发光材料根据化合物的分子结构可分为有机化合物发光材料和聚合物发光材料,而有机小分子与高分子材料相比具有更高的荧光量子效率、发光亮度和色纯度,并且容易加工提纯,已经开始实现商品化。芴官能团具有刚性平面联苯结构,此类化合物具有较宽的能隙( > 2.90eV)、高发光效率和高热稳定性。固态芴的荧光量子效率高达60%~80%。芴的2位、7位以及9位碳原子较活泼、易修饰,通过引入不同的基团可得到一系列芴的衍生物,因而发展成为一种常见的有机蓝光材料。本文主要介绍了芴基有机蓝光材料的研究进展。
1 芴基荧光材料
发光材料按发光机理可分为荧光材料和磷光材料。芴基有机材料具有很高的荧光发光效率,是目前OLED中常用的一种蓝光材料。2001年,Lee等[6]合成了低聚芴炔化合物1,该材料发蓝光,主发射峰在402nm,可溶性较好,光致发光(Photoluminescence,PL)效率为64%。但是固体膜中分子间相互作用强烈。
同年,Kim等[7]通过溴代螺芴与蒽结合,合成了化合物2。意在通过螺旋桥连的结构降低固体状态下分子间强烈的相互作用,提高应用性能。化合物2具有良好的热稳定性和尺寸稳定性,作为发光材料制成器件后,电致发光(Electroluminescence,EL)光谱发射峰位于442nm(见图 1),启亮电压为7.7eV;在亮度为300cd/m2时,发光效率为3.2cd/A。
2008年,Peng等[8]在芴的C-2, 7和C-9位置用苯基、萘基、蒽基等取代,合成了化合物3~9。研究发现,2, 7-位取代将同时影响材料的热性能和发光性能,而9-位取代主要是影响材料的热性能。将这些芴的衍生物作为发光层制成器件,结构为ITO/CuPc/NPB/发光层/Alq3/Mg:Ag。其中,2, 7-二芘基-9′, 9-二甲基芴(化合物6) 的发光性能最好,发光效率4.8cd/A,色坐标为(0.17,0.24)。通过设置空穴阻隔层来优化发光性能,可将器件发光效率提高到5.2cd/A,色坐标为(0.15,0.21)。
Liang等[9]通过Suzuki偶联反应合成了含苯并咪唑的螺[苯并芴]衍生物10和11。将它们作为发光层制成器件,器件结构为ITO/MoO3/NPB/TCTA/发光层/LiF/Al。其EL光谱发射峰位于436nm(图 2),发光效率分别为2.63和1.96 cd/A,功率效率分别为1.56和1.34 lm/W,外量子效率分别为1.81%和2.23%,色坐标分别为(0.18,0.2) 和(0.15,0.10)。
2011年,Zhu等[10]设计合成了一类芴和蒽连接的有机蓝光材料(化合物12~15)。由芴桥连接2个蒽环为发光基团,通过在蒽环的另外一端引入电荷传输基团来调控电子/空穴传导速率。将它们分别作为发光层制成器件,最大发光效率为1.96cd/A,色坐标为(0.15,0.13)。
Huang等[11]合成了含蒽衍生物的芴基化合物16,该材料的热稳定性很好,其玻璃化转变温度(Tg)和熔点(Tm)均大于400℃,热分解温度为480℃。将16作为发光层制成器件,通过优化多层膜结构,获得最大亮度为1318cd/m2,发光效率为2.98cd/A,色坐标为(0.15,0.14)。
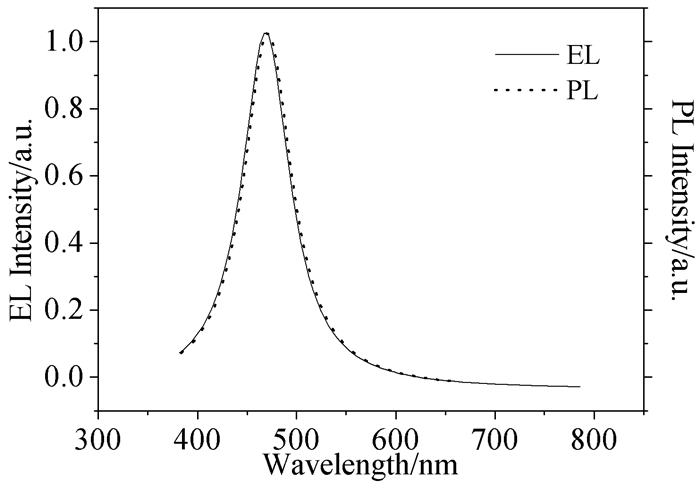
Kim等[12]将蒽的9、10位与N, N-二苯氨基芴连接,合成了化合物17(BDDFA)。在蒽上引入二苯氨基芴有助于提高空穴传输能力、增加溶解性和提高材料的热稳定性和化学稳定性。分子的非平面结构有效地抑制了分子间的相互作用,提高了发光性能。化合物17的EL和PL光谱图如图 3所示。其器件的最大亮度为4600cd/m2,发光效率为4.17cd/A,功率效率为2.11lm/W,外量子效率为3.3%,色坐标为(0.14,0.17)。
Poriel等[13]使用一锅法合成了二螺氧杂蒽茚并芴18(DSX-IF),具有良好的色彩稳定性,但是将它作为发光层制成器件,发光效率较低,仅有1cd/A。为了进一步提高器件的发光效率和色纯度,Huang[14]等合成了含有螺环的哑铃型荧光分子19(DSFX-TFB)和20(DSF-XPy)。哑铃型的分子结构可以有效抑制分子间和分子内的π-π聚集行为,提高了发光效率。
以19和20为发光层,器件结构为ITO/MoOx(2nm)/m-MTDATA(20nm)/NPB(10nm)/发光层(30nm)/TPBi(40nm)/LiF(1nm)/Al时,化合物19的发光性能较好,发光效率为7.4cd/A,外量子产率为4.6%,色坐标为(0.17,0.18)。
2014年,Xu等[15]设计合成了化合物21和22。这两种化合物无论是溶液状态下还是在固体状态下都具有良好的PL性能,其固体PL效率高达94%。将它们作为发光层制备OLED器件,多层结构为ITO/PEDOT:PSS/NPB/CBP/发光层/TPBI/Ca:Ag,其启亮电压分别为5.2和4.6 V,亮度为10320和9700 cd/m2,发光效率分别为3.4和2.3 cd/A,色坐标为(0.18,0.13) 和(0.18,0.14)。
2015年,Song等[16]通过Suzuki反应将蒽、芴、三苯基硅烷偶联合成了化合物23,该化合物具有良好的发光性能。在多层发光器件ITO/NPB/发光层/Bphen/Liq/Al中,其发光效率为2.76cd/A,功率效率为2.82lm/W,外量子效率为1.82%,色坐标(0.18,0.16)。
2014年,Chen等[17]将三苯胺与磷酸酯功能化的芴连接合成了化合物24~27。它们作为发光层在没有电子注入层的双层器件中展示了较好的EL性能,最高发光效率为2.59cd/A,色坐标为(0.163,0.097),色彩稳定性较好。
2 芴基磷光材料
在芴的分子结构中引入咔唑基团和叔丁基能够改善分子能级结构,优化材料工艺性能,提高发光效率。Qiu等[18]在已有芴/咔唑键连化合物CPF(28) 的不同位置上引入叔丁基合成了2种蓝光主体材料TBCPF(29) 和CPTBF(30),前者是在咔唑环上引入叔丁基,后者是在芴环上引入叔丁基。研究发现,在咔唑环上引入叔丁基的化合物29综合性能较好,具有空间阻碍作用的叔丁基引入,显著提高了材料的Tg(由165℃提高到212℃)。该类材料发蓝光,吸收和发射光谱见图 4。CFP除了357、374 nm两个主发射峰外,还有4个尾峰,位于405、425、452、482 nm;CPTBF除了主发射峰,仅有401、423 nm处的两个尾峰;TBCPF只有两个主峰,没有尾峰。以上结果表明,咔唑环上引入叔丁基显著压制了分子间相互作用及聚集,降低了光子的猝灭,有利于提高发光效率。在以TBCPF为主体材料、掺杂20%双(4, 6-二氟苯基吡啶-N,C2′)吡啶甲酰合铱(FIrpic,30) 客体材料的发光器件中,最大发光效率为13.0cd/A,启亮电压4.2V,最大亮度23300cd/m2。
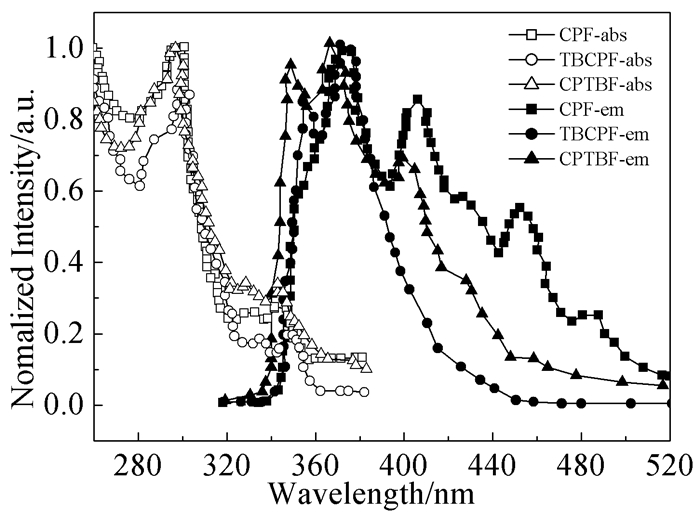 图 4
CPF、TBCPF、CPTBF的吸收和发射光谱图[18]
Figure 4.
Absorption and PL spectra for the fluorine/carbazole hybrids of CPF in solid-state film
图 4
CPF、TBCPF、CPTBF的吸收和发射光谱图[18]
Figure 4.
Absorption and PL spectra for the fluorine/carbazole hybrids of CPF in solid-state film
Qian等[19]报道了另外两种在芴的周边引入咔唑基团和叔丁基的磷光主体材料31和32。它们都具有良好的成膜性和热稳定性。在31和32掺杂FIrpic的主-客体发光器件中,启亮电压分别为5.8和5.5 V,发光效率分别为18.5和16.1 cd/A,功率效率为8.1和7.8 lm/W,外量子效率别为10.3%和9.7%。
Mondal等[20]合成了由芴桥两端分别连接苯并咪唑和咔唑的CzFCBI(33) 和CzFNBI(34)。其中,化合物34的Tg为181℃,三线态能级为3.63eV。掺杂FIrpic后制备蓝光器件,最大亮度43500cd/m2,发光效率为32.7cd/A,外量子效率为14%。
Gong等[21, 22]利用Suzuki反应合成了新的蓝光主体材料BH-1BP(35) 和BH-1SN(36)。以BD-1(37) 为掺杂剂,器件结构为ITO/DNTPD/α-NPD/发光层/5%BD-1/ET4/Al-LiF,发光效率分别为3.28和3.4cd/A,启亮电压分别是7和5 V,色坐标分别是(0.14,0.11) 和(0.15,0.08)。
Sapochak等[23]将芴和苯环通过磷氧基团(P=O)桥连起来,合成了化合物38(PO6)。材料保持了蓝光特性,成膜性能提高了,三线态能级与FIrpic相当。PO6-FIrpic主-客发光体系的EL功率效率为21.5lm/W,外量子效率为8.1%,可达到应用水平。
Lee等[24, 25]报道了一类基于螺芴的含磷氧基团的磷光主体材料39~42。其中化合物39的性能优于PO6,三线态能级为2.8eV,略高于FIrpic的2.7eV。基于它所制备的蓝色磷光器件的发光效率为31.4cd/A,外量子效率达16.3%。此后,他们又合成出了性能更加优异的螺芴类含磷氧基团化合物43。43的溶解性好,三线态能级为2.73eV。在简单的双有机层(空穴传输层/磷光发光层)OLED器件中,最高功率效率为48.5lm/W,最高外量子效率达19.5%。
Shih等[26, 27]合成了芴与咔唑和芴与三苯胺偶联的衍生物44、45,三线态能级分别为2.88和2.89 eV。掺杂FIrpic客体制备蓝光器件,发光效率分别为19.2和29.4 cd/A,外量子效率分别为10.2%和13.1%。
除咔唑外,芳胺片段也是一种电子给体,经常作为供电子基团与芴结合在一起制备有机蓝光材料。Liu等[28, 29]报道了基于芴的可湿法制膜的蓝色磷光主体材料46~48。此类发光主体材料具有良好的热稳定性和成膜性能,掺杂(30%)FIrpic制成蓝色磷光器件,最大发光效率为25.6cd/A,功率效率为12.3lm/W,色坐标为(0.14,0.23)。
Qian等[30]设计合成了蓝色磷光主体材料SFX-PF9(49),该分子三线态能级为2.82eV。掺杂FIrpic制备的蓝光器件的启亮电压为2.8V,发光效率为29.3cd/A,功率效率为28.9 lm/W,外量子效率达到14.7%。当亮度为1000cd/m2时,驱动电压低于4.0V,外量子效率为12.9%。
Chen等[31]报道含硅基的三苯胺-螺芴化合物SSTF(50)、BSSTF(51)。掺杂FIrpic客体后制备的蓝色磷光器件发光效率分别为41和44 cd/A,功率效率分别为35.2和41.5 lm/W,外量子效率分别为17.4%和18.7%。
Huang[32]等合成了多个基于螺芴-9, 9′-氧杂蒽(SFX)类有机蓝光主体材料,其中,二聚体23′ODSFX(52) 表现出优异的EL性能,以它为主体材料掺杂FIrpic应用于蓝色磷光器件中,启亮电压为2.6V,发光效率为21.7cd/A,功率效率为19.5 lm/W,外量子效率为11.9%。
在基于芴的含吸电子基团材料的研究中,经常用到的吸电子基团有咔唑、氰基、噁二唑等。引入具有电荷传输能力的基团有助于提高器件发光效率和Tg,但如果只引入吸电子或供电子基团,容易引起分子内空穴和电子注入不平衡,使器件的发光效率降低。因此,目前的研究主要集中在如何引入双极性的官能团以获得较好的发光效率。Ejabul等[33]根据上述理论进行分子设计,以咔唑作为空穴传输基团,氰基、噁二唑取代芴作为电子传输基团,制备了双极性蓝色磷光主体材料53和54。掺杂FIrpic制成蓝光器件,获得最大亮度为38200cd/m2,发光效率31.6cd/A,功率效率18.5lm/W,外量子产率15.1%。
Shu等[34]设计合成了一个基于芴的双极性主体材料PODPF(55),芴上同时连有电子给体三苯胺和电子受体二苯基磷氧单元,该化合物的三线态能级为3.04eV。掺杂FIrpic(7%)制备的蓝光器件的启亮电压降低为2.5V,功率效率为36.7lm/W,外量子效率为20.6%;在亮度为100cd/m2时,功率效率和外量子效率仍达33.8 lm/W和20.2%。
Mondal等[35]设计合成了将芴与咔唑直接相连的双极性磷光材料56和57。其三线态能级均为2.86eV。掺杂FIrpic制备的蓝光器件,启亮电压为2.5V,发光效率为15.5和23.7 cd/A,功率效率为12.8和19.0lm/W,外量子效率为6.5%和10.7%。
2014年,Liu等[36]报道了两种螺芴NSF-SF(58) 和NSF-NSF(59),其中以NSF-NSF为蓝色磷光主体分子,掺杂FIrpic制备的蓝光器件的启亮电压为2.8V,发光效率为41cd/A,功率效率为42 lm/W,外量子效率达到19.1%。亮度为1000cd/m2时,驱动电压低于4.0V,外量子产率为16.2%。
2015年,Wang等[37]将咔唑、磷氧基分别与芴相连,合成了双极性蓝色磷光主体材料60~63。这4种分子的三线态能级除化合物60为2.81eV,其余都为2.87eV。掺杂FIrpic制备的蓝光器件的启亮电压分别为3.5、3.3、3.2和2.8 V,发光效率分别为33.1、32.2、34.1和34.2 cd/A,最大功率效率分别为28.1、28.8、34.1和34.4 lm/W,量子效率分别为13.8%、13.4%、16%和18.7%。
3 结语
在蓝色电致发光器件中,芴基化合物由于其特殊的刚性平面联苯结构、较宽的能隙和较高的发光效率、结构易于修饰等因素,成为非常具有应用前景的一类化合物。虽然在过去的几十年里,研究者们已经成功合成出许多分子结构新颖、性能良好的芴基有机蓝光材料,但是较于绿色、红色有机发光材料,蓝光材料的性能在器件的寿命、发光效率和纯度方面仍然相对不足。今后对于芴基衍生物要从发光纯度、发光效率、器件寿命、启亮电压、材料对载流子的传输能力等多方面深入研究,不断优化和提高性能,以期获得更为高效的有机电致发光材料。
-
-
[1]
C W Tang, S van Slyke. Appl. Phys. Lett., 1987, 51(12): 913~915.
-
[2]
M F Wu, S J Yeh, C T Chen et al. Adv. Funct. Mater., 2007, 17(12): 1887~1895. https://www.researchgate.net/publication/229515387_The_Quest_for_High-Performance_Host_Materials_for_Electrophosphorescent_Blue_Dopants
-
[3]
Z Y Xiong, H J Li, J X Wang et al. Chin. J. Lumin., 2009, 30(3): 337~343. Z Y Xiong, H J Li, J X Wang et al. Chin. J. Lumin., 2009, 30(3): 337~343.
-
[4]
C Adachi, R C Kwong, P Djurovich et al. Appl. Phys. Lett., 2001, 79(13): 2082~2084. http://www.researchgate.net/publication/234936852_Endothermic_energy_transfer_A_mechanism_for_generating_very_efficient_high-energy_phosphorescent_emission_in_organic_materials
-
[5]
Y An, M L Xu, Z J Wang et al. Chin. J. Lumin., 2011, 32(9): 890~895. https://www.researchgate.net/publication/273683384_Synthesis_of_Novel_Blue_Light_Emitting_99%27-bianthracene_Derivatives_and_Their_Optoelectronic_Properties
-
[6]
S H Lee, T Nakamura, T Tsutsui. Org. Lett., 2001, 3(13): 2005~2007. https://www.researchgate.net/publication/11922389_Synthesis_and_Characterization_of_Oligo99-dihexyl-27-fluorene_ethynylenes_For_Application_as_Blue_Light-Emitting_Diode
-
[7]
Y H Kim, D C Shin, S K Kwon et al. Adv. Mater., 2001, 13(22): 1690~1693.
-
[8]
Z K Peng, S L Tao, X H Zhang et al. J. Phys. Chem. C, 2008, 112(6): 2165~2169. https://www.researchgate.net/publication/231643690_New_Fluorene_Derivatives_for_Blue_Electroluminescent_Devices_Influence_of_Substituents_on_Thermal_Properties_Photoluminescence_and_Electroluminescence
-
[9]
H J Liang, X X Wang, X Y Zhang et al. Dyes Pigments, 2014, 108: 57~63. https://www.researchgate.net/publication/239217314_Synthesis_of_styrylcoumarins_from_coumarin_diazonium_salts_and_studies_on_their_spectra_characteristics
-
[10]
M Zhu, T Ye, C G Li et al. J. Phys. Chem. C, 2011, 115(36): 17965~17972. https://www.researchgate.net/publication/231647946_Efficient_Solution-Processed_Nondoped_Deep-Blue_Organic_Light-Emitting_Diodes_Based_on_Fluorene-Bridged_Anthracene_Derivatives_Appended_with_Charge_Transport_Moieties
-
[11]
J H Huang, B Xu, J H Su et al. Tetrahedron, 2010, 66: 7577~7582. https://www.researchgate.net/publication/244190541_Efficient_blue_lighting_materials_based_on_truxene-cored_anthracene_derivatives_for_electroluminescent_devices
-
[12]
J W Park, P T Kang, H Park et al. Dyes Pigments, 2010, 85: 93~98. https://www.researchgate.net/publication/222340139_Synthesis_and_properties_of_blue-light-emitting_anthracene_derivative_with_diphenylamino-fluorene
-
[13]
N Cocherel, C Poriel, L Vignau et al. Org. Lett., 2010, 12(3), 452~455. https://www.researchgate.net/publication/40811463_DiSpiroXanthene-IndenoFluorene_A_New_Blue_Emitter_for_Nondoped_Organic_Light_Emitting_Diode_Applications
-
[14]
M L Sun, R C Xu, L H Xie et al. Chin. J. Chem., 2015, 33(8): 815~827.
-
[15]
X F Xu, S H Ye, B R He et al. Dyes Pigments, 2014, 101: 136~141.
-
[16]
J Y Song, S N Park, S J Lee et al. Dyes Pigments, 2015, 114: 40~46. https://www.researchgate.net/publication/279291803_Novel_fluorescent_blue-emitting_materials_based_on_anthracene-fluorene_hybrids_with_triphenylsilane_group_for_organic_light-emitting_diodes
-
[17]
D C Chen, H Zhou, X C Li et al. Org. Electron., 2014, 15(6): 1197~1204.
-
[18]
W Li, J Qiao, L Duan et al. Tetrahedron, 2007, 63(41): 10161~10168. https://www.researchgate.net/publication/244189018_Novel_fluorenecarbazole_hybrids_with_steric_bulk_as_host_materials_for_blue_organic_electrophosphorescent_devices
-
[19]
Y B Qian, F Cao, W P Guo. Tetrahedron, 2013 69(21): 4169~4175. https://www.researchgate.net/publication/256870447_High_thermal_stability_3_6-fluorene-carbazole-dendrimers_as_host_materials_for_efficient_solution-processed_blue_phosphorescent_devices
-
[20]
E Mondal, W Y Hung, Y H Chen et al. Chem. Eur. J., 2013, 19(32): 10563~10572. https://www.researchgate.net/publication/240309566_Molecular_Topology_Tuning_of_Bipolar_Host_Materials_Composed_of_Fluorene-Bridged_Benzimidazole_and_Carbazole_for_Highly_Efficient_Electrophosphorescence
-
[21]
S Ok Jeona, Y M Jeona, J W Kim et al. Synth. Met., 2009, 159: 1147~1152.
-
[22]
S Ok Jeona, Y M Jeona, J W Kim et al. Synth. Met., 2008, 9: 522~532.
-
[23]
A B Padmaperuma, L S Sapochak, P E Brrrows. Chem. Mater., 2006, 18(9): 2389~2396.
-
[24]
S E Jang, C W Joo, S O Jeon et al. Org. Electron., 2010, 11(6): 1059~1065. https://www.researchgate.net/publication/223759788_The_relationship_between_the_substitution_position_of_the_diphenylphosphine_oxide_on_the_spirobifluorene_and_device_performances_of_blue_phosphorescent_organic_light-emitting_diodes
-
[25]
S E Jang, K S Yook, J Y Lee. Org. Electron., 2010, 11(6): 1154~1157.
-
[26]
P I Shih, C L Chiang, A KDixit et al. Org. Lett., 2006, 8(13): 2799~2802.
-
[27]
P I Shih, C H Chien, F I Wu et al. Adv. Funct. Mater., 2007, 17(17): 3514~3520.
-
[28]
S H Ye, Y Q Liu, K Lu et al. Adv. Funct. Mater., 2010, 20(18): 3125~3135. https://www.researchgate.net/publication/215927868_An_Alternative_Approach_to_Constructing_Solution_Processable_Multifunctional_Materials_Their_Structure_Properties_and_Application_in_High-Performance_Organic_Light-Emitting_Diodes
-
[29]
S H Ye, J M Chen, K Lu et al. Adv. Mater., 2010, 22(37): 4167~4171. https://www.researchgate.net/publication/44665514_Solution-Processed_Solid_Solution_of_a_Novel_Carbazole_Derivative_for_High-Performance_Blue_Phosphorescent_Organic_Light-Emitting_Diodes
-
[30]
Y Qian, G H Xie, S F Chen et al. Org. Electron., 2012, 13(11): 2741~2746.
-
[31]
H Chen, Z Q Jiang, C H Gao et al. Chem. Eur. J., 2013, 19(35): 11791~11797. https://www.researchgate.net/publication/249967069_Silicon-Based_Material_with_Spiro-Annulated_FluoreneTriphenylamine_as_Host_and_Exciton-Blocking_Layer_for_Blue_Electrophosphorescent_Devices
-
[32]
M L Sun, S Z Yue, J R Lin et al. Synth. Met., 2014, 195: 321~327
-
[33]
M Ejabul, W Y Hung, H C Dai et al. Adv. Funct. Mater., 2013, 23(24): 3096~3105.
-
[34]
F M Hsu, C H Chien, C F Shu et al. Adv. Funct. Mater., 2009, 19(17): 2834~2843. F M Hsu, C H Chien, C F Shu et al. Adv. Funct. Mater., 2009, 19(17): 2834~2843
-
[35]
E Mondal, W Y Hung, H C Dai et al. Tetrahedron, 2014, 70(36): 6328~6336.
-
[36]
T X Liu, H D Sun, C Fan et al. Org. Electron., 2014, 15(12): 3568~3576. https://www.researchgate.net/publication/269414699_Hemodynamic_shear_stress_via_ROS_generation_modulates_PCSK9_expression_in_the_aorta
-
[37]
L Wang, B Pan, L P Zhu et al. Dyes Pigments, 2015, 114: 222~230. https://www.researchgate.net/publication/279291898_Construction_of_thermally_stable_36-disubstituted_spiro-fluorene_derivatives_as_host_materials_for_blue_phosphorescent_organic_light-emitting_diodes
-
[1]
-
图 4 CPF、TBCPF、CPTBF的吸收和发射光谱图[18]
Figure 4 Absorption and PL spectra for the fluorine/carbazole hybrids of CPF in solid-state film
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:



 下载:
下载:

