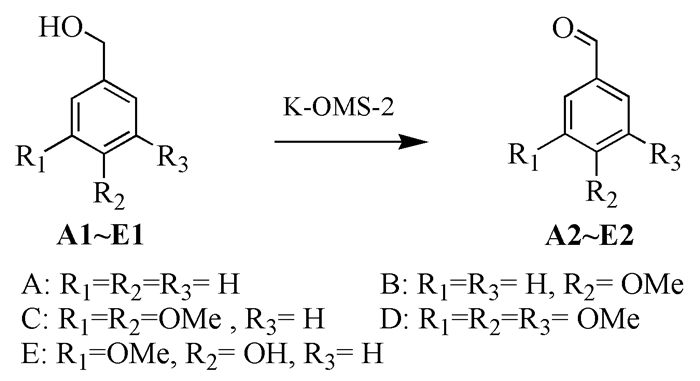
 图 图式1
K-OMS-2催化氧化芳香醇制备芳香醛
Figure 图式1.
Oxidation of aromatic alcohols to prepare aromatic aldehydes
图 图式1
K-OMS-2催化氧化芳香醇制备芳香醛
Figure 图式1.
Oxidation of aromatic alcohols to prepare aromatic aldehydes

Citation: Zhao Yan, Xu Qing, Fu Yao, Liu Yin. Preliminary study on Preparation of High-Quality Transportation Fuels from Lignin[J]. Chemistry, 2017, 80(3): 278-282.

由木质素制备高品位运输燃料初探
English
Preliminary study on Preparation of High-Quality Transportation Fuels from Lignin
-
Key words:
- Lignin
- / Oxidation
- / Condensation
- / Hydrogenation
-
我国是个能源消耗大国,目前能源年消费增长速率一直保持在5%左右。到2020年,预计能源需求量将增加到2.9~3.2亿吨,石油对外的依赖度将大于60%[1]。化石能源的使用带来了日益严重的环境问题,发展绿色可再生的资源非常必要[2]。生物质是一种可再生资源,主要由纤维素 (40%~50%),半纤维素 (25%~35%) 和木质素 (20%~30%) 组成[3]。发展生物质作为未来能源和化学品原料的主要来源逐渐受到重视[4, 5]。目前,关于纤维素、半纤维素解聚氢化制备液体烷烃燃料研究得较多,Nakagawa等[6]对由生物质中纤维素和半纤维素制备烷烃进行了总结。木质素是由大量苯环通过C—O—C和C—C键交织相连在一起构成的一种三维网状结构的大分子,结构复杂,解聚难度较高,但是木质素含有的能量也较高,占据了生物质中总能量的40%[7]。因此,研究由木质素生产芳烃类化学品和液体燃料具有重要意义[8]。
目前通过化学法降解木质素主要包括氢解[9~11]和氧化[12~15]等方法。木质素解聚后获得的产物主要是各种含有取代基的苯酚和芳香醇[16]、芳香醛[13, 17]和酸类化合物,这些化合物通常只含有6~8个碳,若直接通过加氢制备烷烃燃料,由于碳链较短,热值较低。如何进一步提高碳链长度,制备高热值的燃料,是木质素转化制备液体燃料的一个重要问题。Huber等[20]先使低碳链的5-羟甲基糠醛 (5-HMF) 中的醛基和丙酮缩合,再进行加氢反应,成功制备了C15的烷烃燃料。本文借鉴这一思路,将木质素解聚产物中的芳香醛类化合物与丙酮进行缩合反应,增长碳链长度,进一步加氢获得高品位燃料。
由于木质素解聚难度较大,一般采用模型物进行初步基础研究。我们合成的氧化锰八面体分子筛 (K-OMS-2) 催化剂在空气氛围下可将木质素模型物苄醇类化合物高效氧化为芳香醛,此外,该催化剂还可氧化木质素二聚体模型物,获得相应的芳香醛类化合物。对碱木素进行氧化时,产率并不理想,但也有一定的芳香醛产生,而且产物中醛的选择性较高。将所得到的芳香醛类化合物通过与丙酮缩合后再加氢,最后得到高热值的烷烃燃料分子。
1 实验部分
1.1 试剂和仪器
苯甲醛、苯甲醇、高锰酸钾、硫酸锰、硝酸、甲苯、氢氧化钠、乙醇、丙酮购于国药集团化学试剂有限公司;邻甲氧基苯甲醇、邻甲氧基苯甲醛、对甲氧基苯甲醇、对甲氧基苯甲醛、3, 4-二甲氧基苯甲醇、3, 4-二甲氧基苯甲醛、3, 4, 5-三甲氧基苯甲醇、3, 4, 5-三甲氧基苯甲醛、香草醇、香草醛、对羟基苯甲醇、对羟基苯甲醛、, 5-二甲氧基-对羟基苯甲醇、3, 5-二甲氧基-对羟基苯甲醛购于阿拉丁试剂公司;苄基苯基醚、碱木素、Pd/C购于Aldrich试剂公司。所用试剂均为分析纯级。
Bio-Ran FPS-40红外光谱仪 (KBr压片);Bruker DPX-400核磁共振谱仪 (CDCl3为溶剂,TMS为内标,瑞士Bruker公司);气相色谱 (GC) 检测使用RTX-65柱,以萘为内标,进样温度240℃,柱温160℃,检测器温度240℃。木质素和木质素二聚体氧化产物分析通过PolarisQ气相色谱质谱联用仪 (GC-MS) 进行,使用TR-35MS色谱柱。
1.2 催化剂合成
K-OMS-2催化剂的合成:将225mL 0.4mol/L高锰酸钾水溶液缓慢滴加到67.5mL 1.75mol/L硫酸锰水溶液和6.8mL浓硝酸的混合溶液中,得到深褐色泥浆状物,在110℃下搅拌24h,过滤,用水洗涤,110℃下烘干备用。
1.3 实验方法
1.3.1 氧化反应
木质素单体模型物 (或二聚体模型物) 的氧化:将1mmol芳香醇、10mL甲苯和0.05g K-OMS-2依次加入单口瓶中,110℃下搅拌回流4h。冷却后通过GC定量分析,计算产率。
木质素氧化裂解:将0.3g碱木素、0.15g K-OMS-2和20mL CH3OH/H2O (1 :1,体积比) 混合溶液加入反应釜中,通入3MPa氧气,搅拌,升温至190℃,保持温度反应1h,停止反应,冷却到室温。旋蒸除去反应液中的甲醇,加入硫酸调节溶液pH至 < 2,用二氯甲烷 (4×15mL) 萃取,合并有机相,用少量的无水硫酸镁干燥后过滤,旋蒸除去二氯甲烷,所得产物即氧化裂解油。取少量产物用丙酮稀释后进行GC/MS检测,得到产物的分布情况,并分析其色谱产率。
1.3.2 缩合反应
(1) 10mmol芳香醛、5mmol丙酮、8mL 95%乙醇和10mL 10% NaOH水溶液在电磁搅拌下依次加入50mL圆底烧瓶中。继续搅拌30min,抽滤,用水洗涤,固体用1mL冰醋酸和25mL 95%乙醇配成的混合液浸泡、洗涤,再次用水洗涤。将固体用无水乙醇进行重结晶,抽滤,干燥。所得产物纯度超过95%,其核磁数据如下:
A3:1H NMR (300MHz,CDCl3) δ:7.00~7.10 (d,2H),7.38 (d,2H),7.40~7.41 (m,4H),7.60~7.62 (m,4H),7.71~7.75 (d,2H);13C NMR (75MHz,CDCl3) δ:125.5,128.4,128.9,130.5,134.8,143.3,188.9。
B3:1H NMR (300MHz,CDCl3) δ:3.84 (s,6H),6.91~6.92 (d,4H),6.93 (d,2H),7.55~7.57 (d,4H),7.67~7.71 (d,2H);13C NMR (75MHz,CDCl3) δ:56.4,114.4,121.5,127.6,130.1,142.6,161.5,188.1。
C3:1H NMR (300MHz,CDCl3) δ:3.93 (s,12H),6.88 (d,2H),6.95 (d,2H),7.19 (d,2H),7.21 (d,2H),7.71 (d,2H);13C NMR (75MHz,CDCl3) δ:56.9,109.9,111.1,123.0,123.6,127.8,143.1,149.2,151.3,188.7。
D3:1H NMR (300MHz,CDCl3) δ:3.91 (s,18H),6.83 (s,4H),6.97 (d,2H),7.66 (d,2H);13C NMR (75MHz,CDCl3) δ:56.2,61.1,105.7,124.8,130.2,140.5,143.4,153.5,188.5。
(2) 10mmol香草醛、5mmol丙酮、8mL 95%乙醇和10mL 20% NaOH溶液在电磁搅拌下依次加入50mL圆底烧瓶中,继续搅拌10h,将所得液体用HCl中和至中性,用二氯甲烷进行萃取 (3×10mL),合并二氯甲烷层,旋干得到产物E3。
1H NMR (300MHz,CDCl3) δ:3.84 (s,6H),5.72 (s,2H),6.87 (s,2H),6.95 (d,2H),6.98 (d,2H),7.16 (d,2H),7.56 (d,2H);13C NMR (75MHz,CDCl3) δ:56.6,110.7,115.3,123.2,124.3,128.7,143.9,148.1,153.0,190.9。
1.3.3 加氢制备烷烃
将0.2g缩合产物、0.1g 5%Pd/C和20mL水加入反应釜中。通入4MPa H2,在200℃反应6h。反应结束后用3×10mL二氯甲烷萃取,合并后定容至50mL,通过GC/MS检测。
2 结果与讨论
2.1 芳香醛的制备
木质素是由含有甲氧基取代的芳香化合物通过C—O和C—C键连接在一起构成的。木质素解聚产物中含有许多取代的苄醇类化合物[18, 19, 21]。我们合成的K-OMS-2催化剂可以在空气氛围下高效、高选择性地氧化这些苄醇,得到相应的芳香醛。由表 1可以看出,K-OMS-2在催化氧化芳香醇类化合物反应中具有非常好的效果。氧化简单结构的苄醇时,产率为90%;随着甲氧基取代基数量增加,产率明显升高,含有3个甲氧基的3, 4, 5-三甲氧基苄醇 (D1) 选择性氧化的产率达到99%;而香草素 (E1) 氧化的产率有所降低,为88%。
序号 原料 产物 催化剂 产率/% 1 A1 A2 K-OMS-2 90 2 B1 B2 K-OMS-2 95 3 C1 C2 K-OMS-2 96 4 D1 D2 K-OMS-2 99 5 E1 E2 K-OMS-2 88 6 苄基苯基醚 苯甲醛 K-OMS-2 65 7 碱木素 芳香醛 K-OMS-2 2.37 K-OMS-2催化剂不仅能够高选择性地氧化苄醇类化合物制备芳香醛,同时在氧化木质素二聚体模型物和木质素方面也有很好的效果。苄基苯基醚的α-O-4连接结构是木质素中具有代表性的连接结构[22],同时也是木质素二聚体代表型结构之一。如表 1试验6所示,K-OMS-2催化剂可氧化苄基苯基醚得到苯甲醛,产率为65%,说明催化剂对于断裂α-O-4中的C—O键,选择性氧化获得苯甲醛具有较好的效果。木质素在氧化解聚过程同样会产生大量的芳香醛[23]。因此,我们也尝试了K-OMS-2催化剂在氧化碱木素中的应用,氧化碱木素解聚反应中芳香醛类化合物的产率是2.37%,其中主要包含香草醛和对羟基苯甲醛。
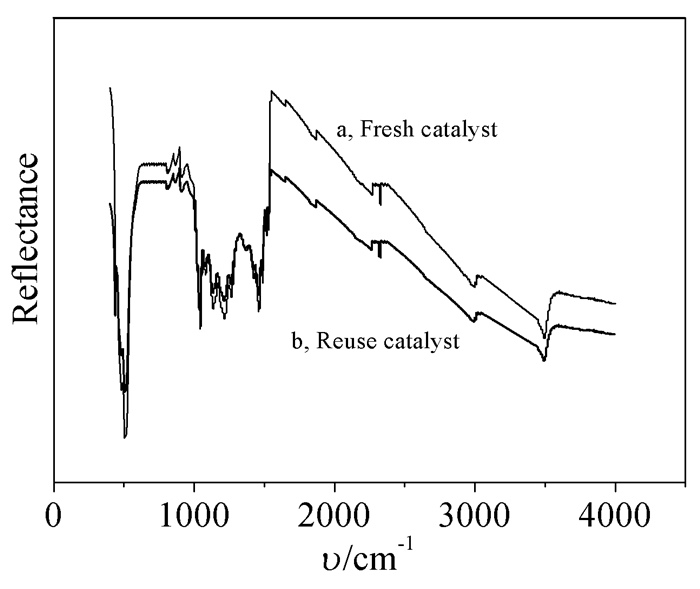
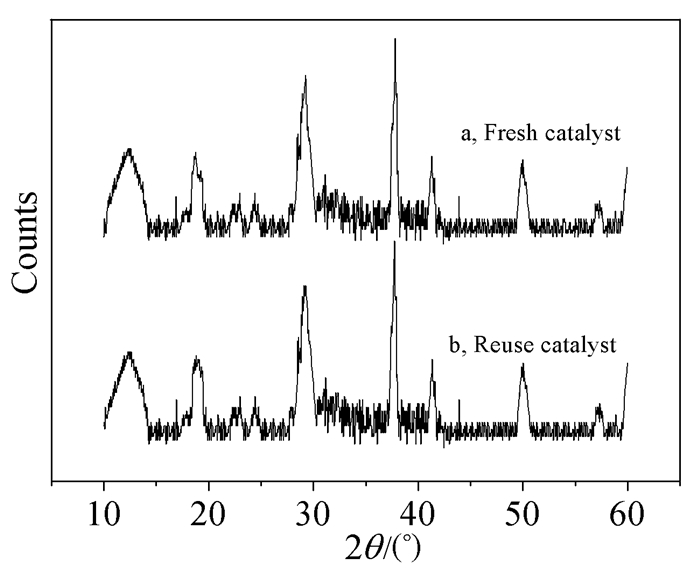
所合成的催化剂不仅具有很好的氧化能力和选择性,而且稳定性也很高。对使用前后的催化剂进行了IR和XRD检测分析,结果见图 1和图 2,从图中可以看出催化剂在使用前后没有发生变化,说明催化剂可以重复使用,降低了成本。
2.2 缩合反应
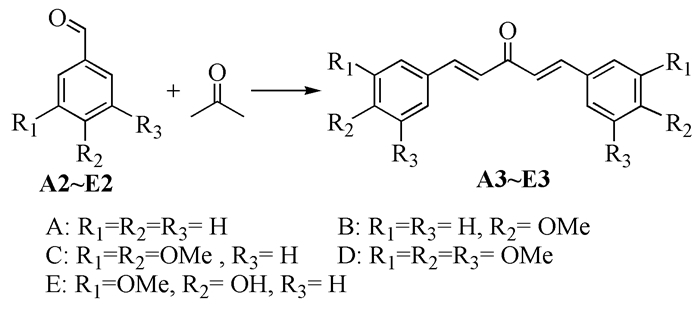
若对木质素解聚获得的小分子产物直接加氢,得到的基本都是C7左右的烷烃分子,这类分子作为燃料时热值较低。如何提高碳链的长度,利用这类分子制备高品位的液体燃料值得进一步探索。我们选用丙酮作为桥连体,将两个芳香醛和丙酮缩合,制备出二聚缩合的产物,这是一个典型的Claisen-Schmidt缩合反应。利用该反应可以制备各种α, β-不饱和羰基化合物,被广泛应用于香料和医药中间体的合成。该缩合反应一般是在NaOH或醇钠等碱类催化剂的催化下进行[24, 25]。本文中选择NaOH催化芳香醛和丙酮的缩合反应,增长碳链长度,得到化合物A3~E3 (图式2)。
如表 2所示,芳香醛进行缩合反应的产率随着甲氧基数的增加而逐渐降低。苯甲醛进行缩合反应时获得了最高的产率 (98%),而3, 4, 5-三甲氧基苯甲醛反应时产率仅75%。这是由于Claisen-Schmidt缩合反应为亲核加成反应,芳香醛苯环上OCH3取代基是供电子基团,使羰基的正电性降低,不利于亲核试剂的进攻。化合物E2中,醛基对位的羟基是吸电子基团,其诱导效应使羰基碳原子的电子云密度降低,更易受到亲核试剂的进攻,因此其缩合产率要比C2和D2高,但是因其还含有甲氧基团,使得产率并没有A2和B2高。
序号 原料 产物 产率/% 1 A2 A3 98 2 B2 B3 82 3 C2 C3 77 4 D2 D3 75 5 E2 E3 80 2.3 加氢制备高品位燃料
由芳香醛通过Claisen-Schmidt缩合反应获得了长碳链化合物,如何通过加氢除去化合物中的甲氧基、羟基,制备高品位的饱和烷烃燃料,值得深入探索。
Zhao等[24, 25]研究了较温和条件下Pd/C和无机酸作催化剂时酚类化合物的加氢除氧反应,并提出了单环酚类取代含氧化合物在Pd/C和磷酸催化下的加氢除氧反应路径,其中,苯酚加氢除氧生成环己烷需要双功能催化剂。本文选用Pd/C作催化剂,直接在水相条件下对目标产物进行加氢,获得C17饱和烷烃。如图 5和表 3所示,不同取代基的缩合产物在加氢中都有较高的产率,其中,苯甲醛的缩合产物的加氢产率为99%,甲氧基或羟基取代的缩合产物的加氢产率为62%~96%。
 表 3
氢化缩合产物制备高品位燃料的产率
Table 3.
The yield of high-grade fuels by hydrogenation of condensation products
表 3
氢化缩合产物制备高品位燃料的产率
Table 3.
The yield of high-grade fuels by hydrogenation of condensation products
序号 原料 催化剂 产率/% 1 A3 5%Pd/C 99 2 B3 5%Pd/C 69 3 C3 5%Pd/C 78 4 D3 5%Pd/C 96 5 E3 5% Pd/C 62 3 结论
本文提出了一种由木质素制备高品位燃料的思路,通过对木质素单体模型物、二聚体模型物和碱木素进行氧化,选择性地获得芳香醛类化合物,醛类化合物再和丙酮进行Claisen-Schmidt缩合,最终通过加氢获得长碳链的饱和烷烃燃料。生物质资源丰富,若能充分利用,将是解决未来面临能源危机的重要手段。将各种生物质进行转化利用,实现低质生物质原料的深层次利用,能够缓解化石燃料的短缺,并降低化石燃料使用所带来的环境污染,对提高人民生活水平、改善生态环境、保障国家能源安全等具有重要意义。
-
-
[1]
徐向阳. 自然资源学报, 2010, 25:1806-1812. http://www.cnki.com.cn/Article/CJFDTotal-ZRZX201010018.htm
-
[2]
S De, B Saha, R Luque. Bioresource Technol., 2015, 178:108-118. doi: 10.1016/j.biortech.2014.09.065
-
[3]
G W Huber, S Iborra, A Corma. Chem. Rev., 2006,106:4044-4098. doi: 10.1021/cr068360d
-
[4]
J Zakzeski, C A B Pieter, L Anna et al. Chem. Rev., 2010, 110:3552-3599. doi: 10.1021/cr900354u
-
[5]
C Somerville, H Youngs, C Taylor et al. Science. 2010, 329:790-792.
-
[6]
Y Nakagawa, S Liu, M Tamura et al. ChemSusChem, 2015, 8:1114-1132. doi: 10.1002/cssc.201403330
-
[7]
顾振涛, 卢旭, 高伟等. 化学通报, 2013, 76(2):144-149. http://www.cnki.com.cn/Article/CJFDTotal-HXTB201302007.htm
-
[8]
付霓虹, 袁玉国, 王景芸等. 化学通报, 2016, 79(4):355-359. http://www.hxtb.org/ch/reader/view_abstract.aspx?file_no=20150706001&flag=1
-
[9]
J E Holladay, J J Bozell, J F White et al. Top value-added chemicals from biomass. In:Results of Screening for Potential Candidates from Biorefinery Lignin, 2007, 2:PNNL-16983.
-
[10]
A J Ragauskas, C K Williams, B H Davison et al. Science, 2006, 311:484-489. doi: 10.1126/science.1114736
-
[11]
N Yan, C Zhao, Y Kou et al. ChemSusChem, 2008, 1:626-629. doi: 10.1002/cssc.200800080
-
[12]
J H Zhang, H B Deng, L N Lu et al. Bioresource Technol., 2010, 101:2311-2316. doi: 10.1016/j.biortech.2009.11.037
-
[13]
Y Y Ye, Y Zhang, J Fan et al. Bioresource Technol., 2012, 118:648-651. doi: 10.1016/j.biortech.2012.05.127
-
[14]
A R Gaspar, J A F Gamelas, D V Evtuguin et al. Green Chem., 2007, 9:717-730. doi: 10.1039/b607824a
-
[15]
T Voitl, R R Philipp. ChemSusChem, 2008, 1:763-769. doi: 10.1002/cssc.200800050
-
[16]
B Sedai, D U Christia, R T Baker et al. ACS Catal., 2011, 1:794-804. doi: 10.1021/cs200149v
-
[17]
M T Pope, A Müller. Angew. Chem. Int. Ed., 1991, 30:34-48. doi: 10.1002/anie.199100341
-
[18]
J Zakzeski, B M Weckhuysen. ChemSusChem, 2011, 4:369-378. doi: 10.1002/cssc.201000299
-
[19]
K Stärk, T N Nicola, A B mann et al. ChemSusChem, 2010, 3:719-723. doi: 10.1002/cssc.200900242
-
[20]
G W Huber, J N Chheda, C J Barrett et al. Science, 2005, 308:1446-1450. doi: 10.1126/science.1111166
-
[21]
G Labat, B Meunier. J. Org. Chem., 1989, 54:5008-5011. doi: 10.1021/jo00282a011
-
[22]
F S Chakar, A J Ragauskas. Ind. Crops Prod., 2004, 20:131-141. doi: 10.1016/j.indcrop.2004.04.016
-
[23]
G Fernando, F G Salesa, L C A Maranhãb et al. Chem. Eng. Sci., 2007, 625:5386-5391.
-
[24]
O C Agbaje, O O Fadeyi, C O Okoro. Tetrahed. Lett., 2011, 52:5297-5300. doi: 10.1016/j.tetlet.2011.08.004
-
[25]
A F M Motiur Rahman, A Roushown, Y D Jahng et al. Molecules, 2012, 17:571-583. doi: 10.3390/molecules17010571
-
[26]
C Zhao, Y Kou, A A Lemonidou et al. Angew. Chem. Int. Ed., 2009, 48:3987-3990. doi: 10.1002/anie.200900404
-
[27]
C Zhao, Y Kou, A A Lemonidou et al. Chem. Commun., 2010, 46:412-414. doi: 10.1039/B916822B
-
[1]
-
表 1 选择性氧化木质素制备芳香醛
Table 1. Preparation of aromatic aldehydes by selective oxidation of lignin
序号 原料 产物 催化剂 产率/% 1 A1 A2 K-OMS-2 90 2 B1 B2 K-OMS-2 95 3 C1 C2 K-OMS-2 96 4 D1 D2 K-OMS-2 99 5 E1 E2 K-OMS-2 88 6 苄基苯基醚 苯甲醛 K-OMS-2 65 7 碱木素 芳香醛 K-OMS-2 2.37 表 2 芳香醛缩合反应产率
Table 2. The yield of aromatic aldehyde condensation reaction
序号 原料 产物 产率/% 1 A2 A3 98 2 B2 B3 82 3 C2 C3 77 4 D2 D3 75 5 E2 E3 80 表 3 氢化缩合产物制备高品位燃料的产率
Table 3. The yield of high-grade fuels by hydrogenation of condensation products
序号 原料 催化剂 产率/% 1 A3 5%Pd/C 99 2 B3 5%Pd/C 69 3 C3 5%Pd/C 78 4 D3 5%Pd/C 96 5 E3 5% Pd/C 62 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0



 下载:
下载:




 下载:
下载:

