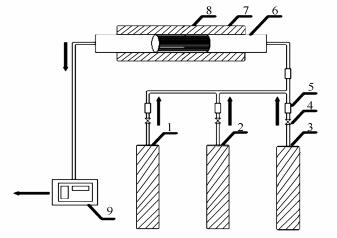
 图1
实验系统示意图
Figure1.
Experimental setup
图1
实验系统示意图
Figure1.
Experimental setup

English
-
化石燃料燃烧生成的氮氧化物(NOx)是破坏大气环境的主要污染物之一,会引起酸雨、光化学烟雾、造成臭氧层空洞等问题[1]。目前,在工业上广泛使用以氨气为还原剂的选择性催化还原法(NH3-SCR)[2]来脱除NOx,但该方法尚存在一些缺点,比如NH3运输储存困难、腐蚀设备、易泄露对环境造成二次污染等。二十世纪90年代初,有学者研究发现[3, 4],金属交换的分子筛催化剂能够催化烃类选择性地还原NO。碳氢燃料的选择性催化还原NO(HC-SCR)引起了研究人员的注意,对不同类型的催化剂的HC-SCR的特性开展了深入的研究工作[5-9]。HC-SCR的催化剂主要分为金属交换分子筛类[10]、贵金属类以及金属氧化物类[11]。贵金属催化剂价格昂贵、选择性较低、活性金属易于被烧结,同时易生成N2O等副产物[12]。金属交换分子筛催化剂的水热稳定性较差,水蒸气会导致其失活。金属氧化物催化剂因其具有较好的水热稳定性、低成本和具有催化活性的金属种类可选择性多等优点,近年来受到了广泛的关注[13-17]。目前,金属氧化物型催化剂催化碳氢燃料选择性还原NO的主要缺点是在中低温反应条件下活性较低,且催化活性易受烟气中的H2O和SO2的影响。
前期研究表明,金属铁能够直接将NO还原为N2[18, 19],同时金属铁被氧化为氧化铁,从而逐渐失去还原NO的能力。而在甲烷、乙烷、丙烷等低碳烃类与金属铁/氧化铁的共同作用下,在850 ℃以上条件下能够持续地还原90%以上的NO[20-22],且不受烟气中的SO2[23]和H2O[24]的影响。进一步研究表明,通过Al2O3溶胶-凝胶法将铁负载于蜂窝陶瓷上制备为Fe/Al2O3/cordierite催化剂,在600 ℃其催化C2H6还原NO的效率达到了95%[25],但SO2会对其产生不可逆的抑制作用[26]。研究表明,向催化剂中加入合适的金属助剂可以提高催化剂的催化活性[11]。铈具有显著的还原能力和优异的储氧能力,常被用来作为催化剂的活性组分和助剂[27-30]。Wu等[31]研究发现,经CeO2改性后的MnOx/TiO2在150 ℃,3%水蒸气和0.01%SO2条件下,催化NH3还原NO反应持续进行7 h,NO转化率始终保持在84%以上。Carja等[32]合成了Mn-Ce/ZSM-5催化剂,发现在240-500 ℃,催化NH3还原NO反应具有75%-100%的NO转化率,且SO2对其活性没有影响。Perez-Alonso等[33]用共沉淀法制备了一系列Fe-Ce混合氧化物用于分解N2O。研究发现,Fe-Ce混合氧化物形成了一种固溶体结构,具有比纯铁和纯铈氧化物更好的催化活性。然而,Ce修饰铁氧化物用于HC-SCR及其抗SO2和H2O性能的研究尚需进一步开展。
铁是环境友好的过渡金属,成本较低,且研究表明Fe2+和Fe3+铁离子间的良好的氧化-还原能力是铁基催化剂具备高HC-SCR活性的主要原因[34]。为进一步改善Fe/Al2O3/cordierite催化剂的HC-SCR特性,特别是提高其抗SO2的性能,在前期研究的基础上,采用金属铈对Fe/Al2O3/cordierite催化剂进行修饰,实验研究其催化C3H8还原NO的特性,并采用多种方法对其进行物化性质进行表征,分析Ce对于提升Fe/Al2O3/cordierite催化丙烷还原NO性能的作用机理。
1 实验部分
1.1 催化剂的制备
催化剂的制备分为蜂窝陶瓷载体的酸化、涂覆铝溶胶以及负载活性金属成分三个步骤。首先将堇青石陶瓷切成18 mm×18 mm×18 mm的立方体,在15%稀硝酸溶液中常温放置12 h,用去离子水洗涤至中性后,放入100 ℃干燥箱干燥。将干燥后的样品在铝溶胶中浸泡1 h,在110 ℃的干燥箱中干燥12 h,然后在马弗炉中空气气氛和500 ℃条件下焙烧5 h。循环操作数次,使得Al2O3负载量约为20%。涂覆了Al2O3的样品采用浸渍法负载活性金属成分,将样品在室温下依次浸渍于1 mol/L的Fe(NO3)3和0.25 mol/L的Ce(NO3)2溶液中12 h,然后在110 ℃的干燥箱中干燥12 h,在马弗炉中空气气氛和500 ℃条件下焙烧5 h,根据浸渍次数来控制负载量,制得Ce-Fe/Al2O3/cordierite催化剂。将制成的催化剂命名为xCe-Fe/Al2O3/cordierite,x表示为负载金属Ce的质量分数,x通过ICP测定。前期研究[25]表明,当Fe的负载量为5.5%时,Fe/Al2O3/cordierite催化C3H8还原NO的性能最好。因此,所有样品的Fe负载量控制在5.5%。
1.2 催化剂的表征
X射线衍射(XRD)由Rigaku公司的D/max-2550PC分析,操作管电压40 V,管电流200 mA,目标靶为Cu Kα辐射源(λ=0.154 nm),5°-80°扫描。N2吸附-脱附分析在Micromeritics公司的ASAP2460型吸附仪上测试,利用BET方程、BJH模型计算比表面积、孔容及孔径。扫描电子显微镜(SEM)由FEI公司的Quanta-250型扫描电子显微镜检测,加速电压0.2-30 kV,背散射电子像分辨率4.0 nm。氢程序升温还原(H2-TPR)测试采用自组装的程序升温还原仪器,配置气相色谱仪(GC-4000 A),催化剂用量为300 mg,实验前催化剂先在300 ℃下N2(20 mL/min)吹扫30 min,降至室温后通H2/N2(20 mL/min,5%H2),升温速率为5 ℃/min,检测器为TCD。吡啶吸附红外光谱(Py-FTIR)由PE公司FT-IR Frontier型吸附仪进行,样品在500 ℃真空处理2 h,温度降至室温后吸附吡啶,然后在170和300 ℃真空脱附扫描。
1.3 实验系统
实验装置示意图见图 1。
实验在一个水平布置的由程序控温的电加热陶瓷管反应器中进行。陶瓷管内径25 mm,加热段长度300 mm。将Ce-Fe/Al2O3/cordierite催化剂样品依次置于陶瓷管加热段中心位置,通入模拟烟气进行脱硝性能实验。实验温度为200-700 ℃,设计空速为19000 h-1 ,气体总流量为1.5 L/min,分别在惰性气体氛围(NO体积分数为0.05%,丙烷体积分数为0.1%,氮气配平)和模拟烟气氛围(NO体积分数为0.05%,丙烷体积分数为0.3%,氧气体积分数为1%,氮气配平)下进行实验。系统出口处尾气的成分通过在线烟气分析仪(德国RBR,ECOM-J2KN)进行实时监测;利用气相色谱仪(GC-4000A)检测N2O。
NO转化率、C3H8转化率、N2产率分别由下列公式计算:
式中,wNO为NO转化率,xC3H8为C3H8转化率,wN2为N2产率;φ为各气体的体积分数。
2 结果与讨论
2.1 催化剂的性能测试
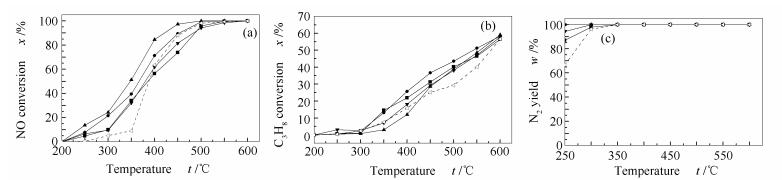
为了探究Ce-Fe/Al2O3/cordierite催化C3H8还原NO的基本规律,首先在N2氛围中进行了催化活性测试,气体组分为NO体积分数为0.05%,C3H8体积分数为0.1%,N2配平。实验结果见图 2。
由图 2(a)可知,当反应温度在350 ℃以下时,Fe/Al2O3/cordierite催化剂的NO转化率很差;加入Ce后,低温段的催化活性有所增加。在350-500 ℃,NO转化率增长迅速,在500 ℃时,各个催化剂样品的NO转化率都在90%以上,其中,3.5Ce-Fe/Al2O3/cordierite的转化效率达到了100%。与Fe/Al2O3/cordierite相比,3.5Ce-Fe/Al2O3/cordierite的反应温度向低温偏移了近50 ℃。观察整个反应曲线发现,3.5Ce-Fe/Al2O3/cordierite和2.6Ce-Fe/Al2O3/cordierite的性能曲线一直优于Fe/Al2O3/cordierite,但1.5Ce-Fe/Al2O3/cordierite和4.6Ce-Fe/Al2O3/cordierite样品的NO转化率较低,说明适量的Ce能够促进Fe/Al2O3/cordierite的催化活性,但Ce负载量过少或过多都会抑制Fe/Al2O3/cordierite催化丙烷还原NO的能力。由图 2(b)可知,所有的催化剂样品在催化丙烷还原NO的反应过程中C3H8的转化率相差不多,在低温段时丙烷转化率较低,随着反应温度的提高,C3H8转化率不断增加,当NO转化率达到100%时(即反应完全时),C3H8转化率在60%左右。由图 2(c)可知,当反应温度较低时,催化还原NO反应会有少量的NO2生成,随着反应温度的不断提高,NO能够完全地还原为N2,N2的产率达到了100%。
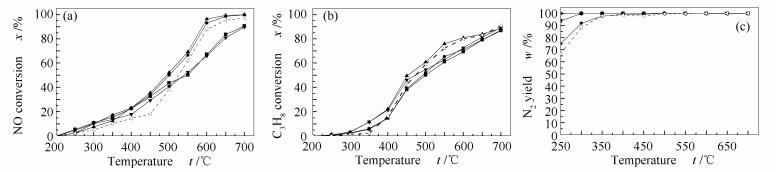
为考察烟气中的O2对该催化剂HC-SCR的影响,进行了模拟烟气氛围下(NO体积分数为0.05%,C3H8体积分数为0.3%,O2体积分数为1%,N2配平)Ce-Fe/Al2O3/cordierite催化C3H8还原NO的实验,结果见图 3。
对比图 2、图 3可以看出,整个反应性能曲线变化规律相似,但反应活性温度曲线向高温平移近100 ℃。课题组的前期研究表明[25],O2能促进NO氧化形成硝酸盐物种、有机含氮物种和异氰酸盐,从而有助于SCR反应的进行。但同时O2也会使得还原剂非选择性地完全氧化,从而会对HC-SCR反应产生一定的抑制作用。由图 3(a)可知,3.5Ce-Fe/Al2O3/cordierite的催化活性最好,当反应温度达到600 ℃时,NO转化率达到了96.5%;其次为2.6Ce-Fe/Al2O3/cordierite, 600 ℃时也能达到93%转化率;然而1.5Ce-Fe/Al2O3/cordierite和4.6Ce-Fe/Al2O3/cordierite样品的催化效果不如Fe/Al2O3/cordierite催化剂。由图 3(b)可知,各催化剂样品的C3H8转化曲线变化相似,当NO转化率达到100%时,丙烷的转化率已达到90%。由图 3(c)可知,随着反应温度的升高,催化NO的反应中其他产物(NO2)不再生成,N2的产率不断提高,最终达到100%。
2.2 SO2和H2O的影响
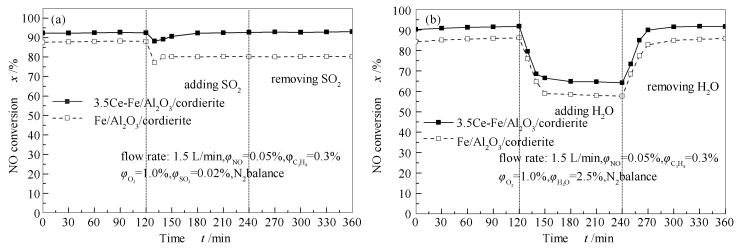
为了考察烟气中的SO2和H2O对Ce-Fe/Al2O3/cordierite催化丙烷还原NO反应的影响,对3.5Ce-Fe/Al2O3/cordierite和Fe/Al2O3/cordierite样品进行了脱硝性能暂态反应实验。测试分为三个阶段,首先将反应炉升温至600 ℃后通入反应气体稳定反应2 h;接着向管路中持续通入0.02%SO2或2.5%水蒸气2 h;然后切断SO2或H2O的供给后继续反应2 h。测试结果见图 4。
由图 4(a)可知,在刚加入SO2的一段时间内,催化曲线可能由于气体平衡被破坏而发生波动,等到稳定后,3.5Ce-Fe/Al2O3/cordierite的NO转化率始终维持在93%左右,而Fe/Al2O3/cordierite的催化丙烷还原NO的性能受SO2影响比较明显,其转化率从88%迅速下降为80%左右,停止通入SO2后,活性无法恢复。由图 4(b)可知,水蒸气的存在会使3.5Ce-Fe/Al2O3/cordierite催化活性明显下降(NO转化率从92%→64%),切断H2O供给后催化活性恢复,与Fe/Al2O3/cordierite的性能受H2O影响的变化规律相似[26]。根据暂态测试结果分析可知,助剂Ce能够改善Fe/Al2O3/cordierite的抗硫作用,但抗水性能没有得到优化。
Zhou等[26]利用原位红外实验研究了在有SO2 参与时Fe/Al2O3/CM的脱硝机理,发现在反应过程中催化剂表面会形成带有单S=O键的硫酸盐物种,对NO吸附形成NO2/NO3-物种产生抑制,从而对在催化剂表面还原NO产生了不可逆影响。Wu等[31]通过XRD、XPS对有SO2参与实验后的MnOx/TiO2和CeO2-MnOx/TiO2催化剂进行了分析,发现后者未出现硫酸盐晶相;杨青[35]对加入Ce后的铁锰复合氧化物催化剂进行了SO2-TPD等表征,发现适量的Ce可以使SO2在催化剂表面吸附量减少,从而限制了硫酸盐的形成。对于烟气中存在的水蒸气对催化还原NO的影响,一般认为,水蒸气与NOx发生活性位竞争吸附。Miyahara等[7]分析认为,催化剂优先吸附水蒸气,从而影响了SCR活性。Zhou等[26]研究表明,烟气中的H2O与NOx在催化剂表面竞争吸附,不利于生成NO2吸附物种和单齿硝酸盐物种,从而对还原NO反应产生了可逆的抑制作用。基于以上分析,加入助剂Ce无法改善反应气体在活性位的竞争吸附,因此, 催化剂的抗水性能没有得到提高。
2.3 催化剂的XRD分析
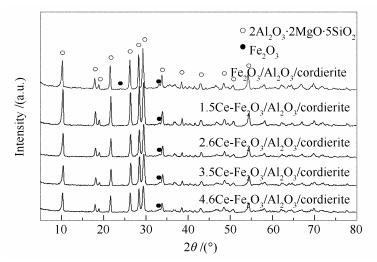
利用XRD对系列Ce-Fe/Al2O3/cordierite的晶体形态进行了研究,结果见图 5。全部样品主要呈现出堇青石衍射特征峰(JCPDS卡片,No.85-1722)。涂覆铝溶胶后,没有出现Al2O3衍射特征峰,这可能是因为大部分铝溶胶都渗透到了堇青石内部孔道,Al2O3主要以无定形态存在于堇晶石表面[36]。当负载5.5%Fe物种后,在XRD谱图上24°和33.2°处有明显的Fe2O3衍射特征峰(JCPDS卡片,No.79-1741),说明铁物种主要以Fe2O3形态存在。加入少量的金属Ce后,没有观测到明显的Ce物种的衍射特征峰,这可能是由于Ce物种在催化剂表面高度分散,因此, 在谱图上不出现明显的特征峰[37]。随着Ce负载量的增加,样品中Fe2O3的衍射特征峰强度峰逐渐减弱,但并没有出现Ce物种的衍射特征峰。Bao等[38]的研究表明,在共沉淀法制备的Fe2O3-CeO2组合催化剂时,Fe3+离子会取代Ce氧化物中Ce4+离子,因此, 在催化剂表面出现Fe-Ce固溶体和Fe2O3晶相。同样,在本研究的催化剂制备时,当引入更多的Ce物种时,部分铁和铈氧化物的离子可能发生取代反应,在催化剂表面形成了Fe-Ce固溶体,从而减少了Fe2O3晶相体的生成。
2.4 催化剂的N2吸附-脱附特性
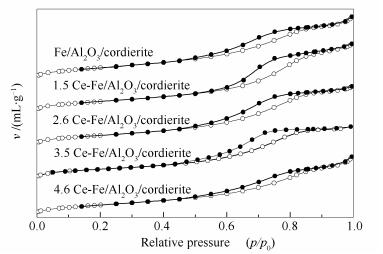
图 6为Ce-Fe/Al2O3/cordierite系列催化剂的N2吸附-脱附等温线。
由图 6可知,所有样品的N2吸附-脱附等温线均为第Ⅳ类(IUPAC分类)等温线类型,为典型的介孔材料;中间段出现了毛细管凝聚后伴随H3型滞留回环[39],表明此类介孔主要由平板状颗粒材料或缝形孔材料构成。对比Fe/Al2O3/cordierite和1.5Ce-Fe/Al2O3/cordierite的吸附-脱附等温线,发现后者的滞后环闭合点p/p0向右偏移,说明催化剂的微孔含量在减少[40];当Ce添加量继续增加,滞后环闭合点p/p0先逐渐向左偏移,后向右移动,表示其微孔含量先增加后减少,表明加入适量的助剂Ce有助于增加其微孔数量,改善其孔径分布。此前的研究报道表明,合理的孔径分布有利于提高催化剂的催化活性[41]。
通过BET方程计算得出催化剂的比表面积,BJH模型分析得到孔容和平均孔径,结果见表 1,随着Ce负载量的增加,催化剂的比表面积稍有下降,但孔容和孔径没有出现这一趋势,说明活性金属Fe、Ce物种主要分布在Al2O3/cordierite的外表面上。3.5Ce-Fe/Al2O3/cordierite的HC-SCR活性最佳,但其比表面积为23 m2/g并非为最大值,说明对于Ce-Fe/Al2O3/cordierite催化剂而言,比表面积并不是HC-SCR性能的主要影响因素。
Sample Ce wa/ (mg·g-1) ABET/(m2·g-1) vp/(mL·g-1) dp/nm Fe/Al2O3/cordierite 0 26 0.046 7.1 1.5Ce-Fe/Al2O3/cordierite 15.52 25 0.044 7.3 2.6Ce-Fe/Al2O3/cordierite 26.01 24 0.050 8.3 3.5Ce-Fe/Al2O3/cordierite 35.10 23 0.044 7.5 4.6Ce-Fe/Al2O3/cordierite 46.58 20 0.041 7.9 a: analysis result 2.5 催化剂表面形态的扫描电子显微镜(SEM)
采用扫描电子显微镜对系列催化剂的微观表面形貌进行了研究。将样品放大10000倍(尺寸为5 μm)进行观察,结果见图 7。
酸化处理后的堇青石涂覆铝溶胶后,表面变得光滑,说明在催化剂表面上形成了氧化铝薄层[42]。负载金属Fe后,载体表面上生成了分布较为均匀的纳米棒,长度为500 nm左右(图 7(b))。加入助剂Ce后,样品的微观形貌发生了一定的变化,生成的纳米棒尺寸与Fe/Al2O3/cordierite表面较为接近,但数量上有所减少,同时伴随着更小纳米颗粒生成。EDS扫描能谱分析表明,表面主要构成元素有Al、Fe、Si、O、Mg、Ce和C,且载体表面不同位置处的元素百分比存在明显差异。需要注意的是由于EDS检测的深度要大于纳米棒,因此, 检测到的Al、Si、O、Mg可能来自氧化铝和堇青石[43]。在纳米棒位置上Fe元素的原子百分比为14.28%,没有发现Ce元素,因此, 可以推断纳米棒为结晶良好的Fe2O3;在没有纳米棒的位置上Fe和Ce元素的原子百分比分别为5.23%和0.68%,说明催化剂表面可能形成了Fe-Ce固溶体。随着Ce含量的增加,Fe2O3结晶体数量明显减少,SEM观测结果与XRD谱图分析较为一致。
2.6 催化剂还原特性的氢程序升温还原(H2-TPR)分析
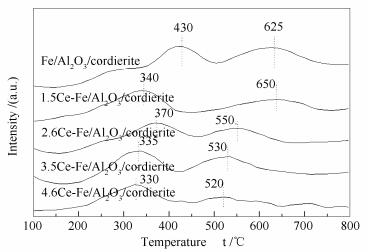
图 8为Ce-Fe/Al2O3/cordierite系列催化剂的H2-TPR分析谱图。由图 8可知,Fe/Al2O3/cordierite的H2-TPR曲线有明显的两个还原峰,分别对应为Fe2O3→Fe3O4的低温还原峰(430 ℃)和Fe3O4→Fe的高温还原峰(625 ℃)[44, 45]。加入金属Ce后,H2-TPR谱图发生了明显改变,高、低温还原峰对应温度向低温方向移动,对应的温度分别在330和530 ℃附近,说明与Fe/Al2O3/cordierite相比较,引入Ce物种后催化剂有更好的氧化还原能力,这可能与形成的Fe-Ce固溶体有关。
3.5Ce-Fe/Al2O3/cordierite样品的高、低还原峰所处温度低,且峰面积相对较大,说明其在低温处H2消耗量大,即氧化还原能力强。虽然2.6Ce-Fe/Al2O3/cordierite有两个较明显的还原峰,但其峰所处温度相对较高,因而氧化还原能力相对较弱。1.5Ce-Fe/Al2O3/cordierite和4.6Ce-Fe/Al2O3/cordierite样品的低温峰虽然较低,但还原峰的面积很小,说明其氧化还原能力相对较弱。催化剂的催化活性受其氧化还原能力的影响[46],Wu等[47]用Ce对MnOx-TiO2催化剂进行了修饰,发现加入适量的Ce后其氧化还原能力增加,SCR活性也随之增强;王明洪等[29]实验发现,催化剂的氧化还原能力越强,其SCR催化活性越好。在Ce-Fe/Al2O3/cordierite系列催化剂中,3.5Ce-Fe/Al2O3/cordierite的氧化还原能力相对最强,这可能是3.5Ce-Fe/Al2O3/cordierite催化C3H8还原NO活性最佳的原因之一。
2.7 催化剂表面酸性的吡啶吸附红外光谱(Py-FTIR)分析
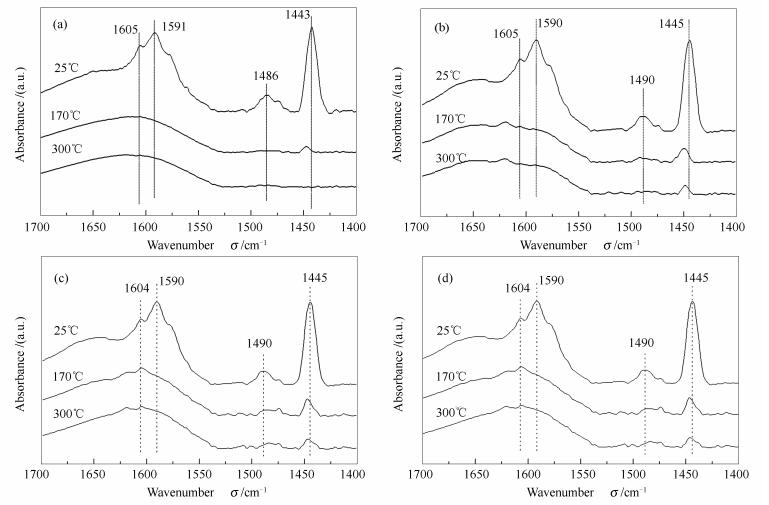
催化剂表面的酸性位的含量和种类是催化剂活性的重要影响因素[48]。吡啶吸附-红外光谱技术(Py-FTIR)是目前测定催化剂表面酸性位(Lewis酸或Brønsted酸)的有效手段。本研究对Al2O3/cordierite、Fe/Al2O3/cordierite、3.5Ce-Fe/Al2O3/cordierite和4.6Ce-Fe/Al2O3/cordierite的催化剂样品进行了Py-FTIR测试分析。图 9为催化剂的Py-FTIR谱图,表 2为表面酸性位浓度值。由图 9可知,所有测试样品均在1445、1490、1590和1605 cm-1谱带产生了吸收特征峰,这四个谱带归属于Lewis酸性位吡啶吸附的不同振动模式[49]。1490 cm-1谱带是归属于Lewis酸和Brønsted酸的重合特征峰[50]。根据研究报道[51],Lewis酸的浓度与1 450 cm-1谱带特征峰的强度成正比,结合图 9特征峰强度的变化及表 2的Lewis酸的数值,发现符合这一规律。
 表 2
Ce-Fe/Al2O3/cordierite的表面酸量
Table 2.
Concentration of acid sites of Ce-Fe/Al2O3/cordierite catalysts
表 2
Ce-Fe/Al2O3/cordierite的表面酸量
Table 2.
Concentration of acid sites of Ce-Fe/Al2O3/cordierite catalysts
Sample 170 ℃ 300 ℃ B L B L Al2O3/cordierite 0 0.00204 0 0 Fe/Al2O3/cordierite 0 0.00418 0 0.00190 3.5Ce-Fe/Al2O3/cordierite 0 0.00522 0 0.00335 4.6Ce-Fe/Al2O3/cordierite 0 0.00375 0 0.00225 由表 2和图 9可知,Al2O3/cordierite表面Lewis酸性位含量较低,只有0.00204 mmol/g,没有发现明显的Bronsted酸性位特征峰。负载了活性金属成分Fe后,催化剂表面的Lewis酸性位浓度增加,达到了0.00418 mmol/g,同样没有发现Brønsted酸性位。当加入3.5%Ce助剂后,催化剂表面的Lewis酸量变多,达到了0.00522 mmol/g。然而Ce助剂增至4.6%后,Lewis酸浓度却降至0.00375 mmol/g。Lewis酸浓度按大小排序3.5Ce-Fe/Al2O3/cordierite>Fe/Al2O3/cordierite>4.6Ce-Fe/Al2O3/cordierite>Al2O3/cordierite。学者们研究发现在选择性催化还原NO反应中Lewis酸起着重要的作用。Peña等[52]制备的M/TiO2系列催化剂中Mn/TiO2表面Lewis酸较多,其活性测试效果最佳;Yuan等[53]对CuxTi1-mixed催化剂进行实验时发现,催化活性随Lewis酸浓度变化而变化。Lewis酸被认为是电子对的接受体,来源于不饱和的金属阳离子[54]。Yuan等[53]研究发现,双金属催化剂中金属比例的变化会导致Lewis酸浓度改变,合适比例的双金属氧化物有利于提高其酸性。催化剂表面的Lewis酸能够增强对碳氢化合物的活化和促进NO氧化为NO2,从而有利于提升HC-SCR性能[55]。本研究中3.5Ce-Fe/Al2O3/cordierite样品表面具有较高浓度的Lewis酸,可能是其HC-SCR表现最佳的重要原因之一。
作者前期的研究表明[56],在载体表面形成的Fe2O3结晶体是NO氧化生成NO2/NO3-物种的活性位。Fierro等[57]的研究同样表明,对于Fe-ZSM-5上C3H8-SCR反应,载体表面上的FexOy纳米颗粒是催化反应中的重要活性位。结合前文的XRD和SEM分析,引入过多的铈会减少Fe2O3结晶体的形成,不利于在SCR反应中形成NO2/NO3-物种,从而导致NO还原效率下降。
3 结论
采用凝胶溶胶法和浸渍法制备了金属铈修饰的Fe/Al2O3/cordierite整体式催化剂,考察了丙烷在Ce-Fe/Al2O3/cordierite催化作用下的脱硝能力。通过N2吸附-脱附、XRD、SEM、H2-TPR、Py-FTIR等研究手段对催化剂进行表征。C3H8-SCR的性能测试表明,3.5Ce-Fe/Al2O3/cordierite样品的催化活性最佳,在有氧条件下,反应温度600 ℃时NO的转化效率达到96.5%,SO2对其脱硝性能没有影响,但H2O会产生可逆的抑制作用。Ce助剂能够与Fe形成良好的固溶体,增强其氧化还原能力,增加表面的Lewis酸量,进而提升HC-SCR性能。然而, 过多的铈引入会减少Fe2O3结晶体的形成,不利于在SCR反应中形成NO2/NO -3物种,从而导致NO还原效率下降。
-
Figure 2 C3H8-SCR results by Ce-Fe/Al2O3/cordierite in N2 atmosphere
(a): NO conversion; (b): C3H8 conversion; (c): N2 yield flow rate 1.5 L/min, φNO=0.05%, φC3H8=0.1%, in N2 base —■—: 1.5Ce-Fe/Al2O3/cordierite; —●—: 2.6Ce-Fe/Al2O3/cordierite; —▲—: 3.5Ce-Fe/Al2O3/cordierite; —▼—: 4.6Ce-Fe/Al2O3/cordierite;
Figure 3 C3H8-SCR results by Ce-Fe/Al2O3/cordierite in simulated flue gas atmosphere
(a): NO conversion; (b): C3H8 conversion; (c): N2 yield flow rate 1.5 L/min, φNO=0.05%, φC3H8=0.3%, φO2=1.0%, in N2 base —■—: 1.5Ce-Fe/Al2O3/cordierite; —●—: 2.6Ce-Fe/Al2O3/cordierite; —▲—: 3.5Ce-Fe/Al2O3/cordierite; —▼—: 4.6Ce-Fe/Al2O3/cordierite;
Table 1. Textual properties of Ce-Fe/Al2O3/cordierite
Sample Ce wa/ (mg·g-1) ABET/(m2·g-1) vp/(mL·g-1) dp/nm Fe/Al2O3/cordierite 0 26 0.046 7.1 1.5Ce-Fe/Al2O3/cordierite 15.52 25 0.044 7.3 2.6Ce-Fe/Al2O3/cordierite 26.01 24 0.050 8.3 3.5Ce-Fe/Al2O3/cordierite 35.10 23 0.044 7.5 4.6Ce-Fe/Al2O3/cordierite 46.58 20 0.041 7.9 a: analysis result Table 2. Concentration of acid sites of Ce-Fe/Al2O3/cordierite catalysts
Sample 170 ℃ 300 ℃ B L B L Al2O3/cordierite 0 0.00204 0 0 Fe/Al2O3/cordierite 0 0.00418 0 0.00190 3.5Ce-Fe/Al2O3/cordierite 0 0.00522 0 0.00335 4.6Ce-Fe/Al2O3/cordierite 0 0.00375 0 0.00225 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0



 下载:
下载:








 下载:
下载:

