 图1
Ni/SiO2及Ni30M/SiO2催化剂前驱体的H2-TPR谱图
Figure1.
H2-TPR profiles of the Ni/SiO2 and Ni30M/SiO2 catalyst precursors
图1
Ni/SiO2及Ni30M/SiO2催化剂前驱体的H2-TPR谱图
Figure1.
H2-TPR profiles of the Ni/SiO2 and Ni30M/SiO2 catalyst precursors

Citation: LI Feng-xu, WANG Xiao-fei, ZHENG Ying, CHEN Ji-xiang. Influence of metallic promoters on the performance of Ni/SiO2 catalyst in the hydrodeoxygenation of anisole[J]. Journal of Fuel Chemistry and Technology, 2018, 46(1): 75-83.

金属助剂对Ni/SiO2催化剂苯甲醚加氢脱氧性能的影响
English
Influence of metallic promoters on the performance of Ni/SiO2 catalyst in the hydrodeoxygenation of anisole
-
Key words:
- Ni-based catalyst
- / metallic promoter
- / anisole
- / hydrodeoxygenation
- / hydrogenolysis
- / methanation.
-
由于化石能源日益紧缺、环境问题日益严重,近年来生物质能源的开发利用为世界各国政府机构、学术及工业界密切关注。生物质经热裂解等手段可制得生物质油,其中,以木质素为原料制得的生物质油中主要含有苯酚类化合物,它们经加氢脱氧(HDO)后可转化为重要的基础化学品三苯(即苯、甲苯及二甲苯)[1]。为制得三苯,希望苯酚类化合物(如苯甲醚、愈创木酚及甲酚等)在HDO反应过程中发生C-O键断裂及甲基转移但应避免苯环加氢,这样一方面,利于提高三苯收率;另一方面,可降低耗氢量;同时,为了提高碳收率和降低耗氢量,在反应过程中也应抑制C-C键氢解及甲烷化等反应。大量研究表明[2],催化剂对加氢脱氧过程中产物分布的影响至关重要。
苯酚类化合物加氢脱氧催化剂主要为金属。虽然贵金属(Pt及Pd等)具有良好的加氢脱氧性能[3-6],但同时具有很高的苯环加氢饱和能力[7],导致三苯收率降低、耗氢量增加。考虑到贵金属催化剂成本高,研究者们也开展了低成本金属Ni催化剂苯酚类化合物加氢脱氧性能的研究,但发现单金属Ni催化剂通常也表现出很高的苯环加氢活性[8, 9]。为了调节贵金属及金属Ni催化剂苯环加氢性能,采用其他金属助剂改性贵金属或金属Ni是一种有效手段。Sun等[10]研究发现,在愈创木酚加氢脱氧反应中,Pd-Fe/C具有较高的加氢脱氧活性,并且主要产物为苯和甲苯。与单金属Pt催化剂相比,Pt-Ni和Pt-Co双金属催化剂在间甲酚的加氢脱氧过程中具有较高的脱氧选择性[11]。另有研究表明[12, 13],金属Pt与另一种亲氧性金属Sn形成的合金可以降低苯环在Pt表面的吸附强度,从而抑制苯环加氢饱和。另外,Pt-Zn双金属催化剂用于苯甲醚的加氢脱氧研究表明[14],Zn的改性提高了含苯环中间产物的选择性,原因在于Zn的加入增强了对氧原子的吸附,导致苯环远离催化剂表面,促进C-O键氢解的同时减少了苯环的过度加氢。近期也有研究表明,Ni基双金属催化剂比单金属Ni催化剂具有更优良的加氢脱氧性能[15, 16]。Lei等[17]的研究发现,甲基苯酚在Ni/SiO2催化剂加氢脱氧过程中主要生成过渡加氢产物3-甲基环己酮,而在Ni-Fe/SiO2催化剂上主要生成甲苯并且氢解产物的量非常少。Cu改性Ni基催化剂以及单金属Ni催化剂在280 ℃以及6 MPa的反应釜中进行反应时,主要以加氢途径(HYD)为主。当Cu含量不同时苯甲醚转化率以及产物选择性均受到影响[18]。
考虑到金属Ni催化剂成本显著低于贵金属,通过添加其他金属组分对金属Ni催化剂进行改性处理是一种有效手段。金属助剂对金属催化剂性能的影响主要源于其几何和电子作用[19]。一方面,金属助剂可以与金属Ni形成合金,使连续的金属Ni原子分隔开[20],即催化剂表面金属镍的几何结构发生变化;另一方面,助剂可通过和金属镍之间电子相互转移而影响Ni的电子结构[18]。金属镍的几何和电子结构变化将影响到反应物在其表面吸附及活化。如前所述,研究发现金属Fe[17]、Cu[18]等助剂能调变Ni/SiO2苯酚类化合物加氢脱氧性能。元素周期表中,Fe、Co、Ni、Cu、Zn及Ga处于同一周期,它们的加氢性能及亲氧性等存在差异,但未见有系统比较Fe、Co、Cu、Zn及Ga对金属Ni催化剂加氢脱氧性能影响。
本研究以金属助剂Fe、Co、Cu、Zn及Ga对Ni/SiO2进行改性处理,以苯甲醚加氢脱氧为模型反应,比较不同金属对Ni/SiO2结构和加氢脱氧性能的影响,获得性能良好的金属助剂改性Ni基双金属催化剂,并对催化剂构效关系进行探讨。
1 实验部分
1.1 试剂
苯甲醚(化学纯)购于国药集团化学试剂有限公司,乙苯(分析纯)购于上海阿拉丁生化科技股份有限公司,其余试剂均为分析纯。二氧化硅载体购于青岛市海洋化工有限公司。所用氢气、氮气、氦气为高纯,空气以及氨气为普纯。
1.2 催化剂的制备
采用等体积浸渍法制备金属镍及镍基双金属催化剂,金属Ni负载量30%(质量分数)。称取所需质量的Ni(NO3)2·6H2O,然后按照Ni/M原子比为30来称取相应质量的助剂金属(M)硝酸盐(Fe(NO3)3·9H2O、Co(NO3)2·6H2O、Cu(NO3)2·3H2O、Zn(NO3)2·6H2O、Ga(NO3)3·9H2O)。配制Ni及助剂金属的硝酸盐混合溶液,等体积浸渍到SiO2载体上。浸渍好的样品室温下自然干燥48 h后置于烘箱中在120 ℃干燥12 h。然后,将干燥好的样品置于马弗炉中在500 ℃焙烧4 h,制备得到氧化物状态的催化剂前驱体。催化剂在石英管反应器中于450 ℃经H2还原3 h制备得到金属Ni及Ni-M(M=Fe、Co、Cu、Zn、Ga)双金属催化剂。金属镍催化剂标记为Ni/SiO2,Ni-M双金属催化剂标记为Ni30M/SiO2。
1.3 催化剂的表征
采用自组装设备进行H2程序升温还原(H2-TPR)表征氧化态催化剂前驱体的还原性能。U形石英管反应器内径为4.0 mm,催化剂前驱体使用量为50 mg。石英管内通入60 mL/min的体积分数10% H2/N2,保持在50 ℃直至热导池检测器(TCD)信号稳定。然后样品以10 ℃/min的速率升温至1000 ℃,TCD检测H2消耗量。
采用与H2-TPR相同的设备进行NH3-TPD程序升温脱附(NH3-TPD)测试。150 mg催化剂前驱体装入石英管反应器,先用H2(60 mL/min)在450 ℃下还原1 h,待温度降到100 ℃后吸附氨30 min。在100 ℃用He(40 mL/min)吹扫物理吸附的NH3,待TCD信号稳定后以15 ℃/min速率升温,脱附氨用TCD检测。
H2化学吸附量测试也在与H2-TPR相同设备上进行。将100 mg催化剂前驱体置于石英管反应器中并在450 ℃下用H2(60 mL/min)还原1 h,然后用N2 (60 mL/min)在450 ℃吹扫1 h以除去表面吸附氢,待U形管反应器冷却至30 ℃及TCD稳定后,使用微量注射器脉冲将H2注入U形管中直至吸附饱和,计算化学吸附量。
采用D8-Focus X-ray diffractometer (Bruker, Germany)进行X射线衍射(XRD)表征,X射线为Cu-Kα(λ=0.154 nm)。采用谢乐公式计算金属晶粒粒径。
采用Quantachrome Quadrrasorb SI仪器在液氮(-196 ℃)下获得N2吸附-脱附等温线。样品为还原钝化处理后的催化剂。利用Brunauer-Emmett-Teller(BET)公式计算BET比表面积,利用Barret-Joyner-Halenda(BJH)模型计算孔径和孔容。
1.4 催化剂的活性评价
采用石英管固定床反应器(内径12 mm)考察催化剂苯甲醚加氢脱氧性能。为保持催化剂床层恒温,400 mg催化剂(粒径在60-100目)前驱体用3 g相同粒径石英砂稀释后装入反应器,催化剂床层上放置2 g石英砂(20-40目)以预热、分散原料。催化剂前驱体于450 ℃用H2(100 mL/min)原位还原3 h后温度降到300 ℃,氢气流量调至34.5 mL/min。采用微量进样泵将含质量分数8%苯甲醚的正辛烷溶液以0.118 mL/min的速率送入反应器开始反应。苯甲醚的质量空速为1.0 h-1,H2/苯甲醚物质的量比为25。液相产物用SP-3420色谱进行分析,检测器为氢火焰离子化检测器(FID),色谱柱为SE-30毛细柱(50 m × 0.32 mm × 3.0 μm),乙苯为内标进行定量分析。C1气相产物(即CO、CO2和CH4)采用在线102色谱进行分析,检测器为TCD,色谱柱为TDX-101填充柱,N2为内标进行定量分析。
2 结果与讨论
2.1 H2程序升温还原(H2-TPR)
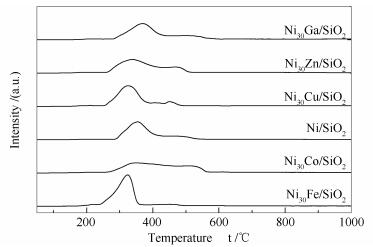
图 1为Ni/SiO2及Ni30M/SiO2 (M=Fe、Co、Cu、Zn、Ga)催化剂前驱体的H2-TPR谱图。
 图1
Ni/SiO2及Ni30M/SiO2催化剂前驱体的H2-TPR谱图
Figure1.
H2-TPR profiles of the Ni/SiO2 and Ni30M/SiO2 catalyst precursors
图1
Ni/SiO2及Ni30M/SiO2催化剂前驱体的H2-TPR谱图
Figure1.
H2-TPR profiles of the Ni/SiO2 and Ni30M/SiO2 catalyst precursors
Ni/SiO2前驱体的H2-TPR谱图中,336 ℃主还原峰及高温肩峰(约465 ℃)分别归属于NiO及硅酸镍的还原[21, 22]。与Ni/SiO2前驱体相比,Ni30Cu/SiO2与Ni30Fe/SiO2前驱体还原峰向低温方向偏移,说明少量Fe和Cu的加入促进了催化剂前驱体的还原。由于CuO较NiO易于还原,先还原生成Cu表面吸附的氢可溢流至Ni物种促进其还原[16, 23, 24]。然而,据多数文献报道,Fe氧化物较NiO难以还原[25-27],而本研究中少量Fe物种的加入促进了催化剂前驱体的还原,可能是与Fe促进了Ni物种分散有关[28]。另外,与Ni/SiO2前驱体相比,Ni30Fe/SiO2前驱体具有较大的主还原峰面积,但高温处肩峰面积明显较低,说明Fe的加入减弱了金属Ni与载体之间的相互作用[28, 29]。比较Ni/SiO2和Ni30Zn/SiO2的H2-TPR谱图可以发现,虽然少量Zn的加入对Ni物种还原有促进作用,但作用明显小于Cu和Fe助剂。与Ni/SiO2前驱体相比,Ni30Co/SiO2前驱体的低温处主还原峰强度降低,而高温处肩峰强度增加,表明少量助剂Co的加入抑制了镍物种还原,此与促进了Ni与载体之间的相互作用及Co物种自身难以还原有关[30, 31]。与Ni/SiO2前驱体相比,Ni30Ga/SiO2前驱体还原峰向高温方向偏移,即Ga的加入抑制了镍物种的还原,与金属Ga与氧的结合能力强、氧化镓难还原有关[32]。上述结果表明,少量不同金属助剂M对Ni/SiO2催化剂前驱体还原性能产生不同程度影响,反映出金属助剂与Ni之间存在一定的相互作用,这种相互作用利于金属助剂及Ni共同还原且接触紧密。
2.2 X射线衍射(XRD)与N2吸附-脱附表征
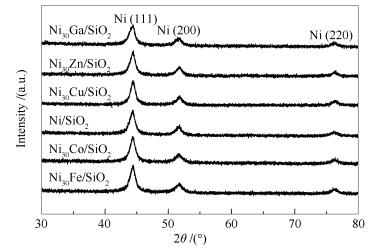
图 2为经450 ℃还原制备的Ni/SiO2及Ni30M/SiO2催化剂的XRD谱图。
Ni/SiO2的XRD谱图中,44.5°、51.8°和76.5°处的衍射峰分别归属于Ni fcc晶相的(111)、(200)和(220)晶面(PDF 04-0850)。Ni30M/SiO2催化剂的XRD谱图中仍只有归属于金属Ni的三个衍射峰,且与Ni/SiO2中金属Ni的衍射峰位置非常相近。已有文献报道Ni与M(M=Fe[27, 33]、Co[34]、Cu[34, 35]、Zn[36]、Ga[37])可以形成合金。本工作中,Ni/SiO2及Ni30M/SiO2的XRD谱图中金属Ni衍射峰未发生明显偏移,与金属助剂含量低(Ni/M原子比为30)有关。尽管不同金属助剂的原子半径与金属Ni不同,但金属Ni与助剂金属原子半径相差不是很大(Fe、Co、Ni、Cu、Zn以及Ga金属原子半径分别为:0.127、0.125、0.125、0.128、0.133及0.122 nm)[38],因而,少量助剂金属M原子有可能进入金属镍晶格而形成合金;但由于M原子含量低,即使形成Ni-M合金对金属Ni晶胞参数影响很小,即XRD衍射峰位置与金属镍无明显差异。此外,即使未形成合金,H2-TPR结果表明,金属Ni与助剂M之间具有一定的相互作用。利用谢乐公式,基于Ni (111)衍射峰计算了Ni/SiO2和Ni30M/SiO2催化剂中金属晶粒粒径。如表 1所示,加入少量金属助剂前后金属Ni及Ni-M双金属晶粒粒径非常接近,即少量助剂对金属晶粒影响不大。此外,表 1比表面积及孔结构数据还表明,加入少量金属助剂后催化剂比表面积有所增大,但孔容及孔径变化不明显。
 表 1
Ni/SiO2及Ni30M/SiO2催化剂物理化学性质
Table 1.
Physical-chemical properties of the Ni/SiO2 and Ni30M/SiO2 catalysts
表 1
Ni/SiO2及Ni30M/SiO2催化剂物理化学性质
Table 1.
Physical-chemical properties of the Ni/SiO2 and Ni30M/SiO2 catalysts
Catalyst ABET/
(m2·g-1)vp/
(cm3·g-1)dp/nm Crystallite
sizea/nmH2 uptake/
(μmol·g-1)TOFb/s-1 Relative acid amountc total acid (Ⅰ) (Ⅱ) nS/nWd Ni/SiO2 314 0.53 5.6 7.2 70 0.04 1.00 0.24 0.76 3.17 Ni30Fe/SiO2 342 0.53 6.6 6.8 1.1 2.46 1.38 0.35 1.03 2.94 Ni30Co/SiO2 330 0.52 6.6 6.7 17 0.12 1.11 0.31 0.81 2.61 Ni30Cu/SiO2 366 0.57 6.6 7.1 7.4 0.27 1.26 0.41 0.85 2.07 Ni30Zn/SiO2 341 0.54 6.6 7.7 44 0.04 1.22 0.51 0.71 1.39 Ni30Ga/SiO2 329 0.56 6.6 6.4 49 0.05 1.46 0.53 0.93 1.79 a: calculated by Scherrer equation based on the reflection of Ni (111); b: calculated from the H2 chemisorption; c: designing the total acid amount of Ni/SiO2 as 1.0 ((Ⅰ) NH3 desorption temperature < 250 ℃; (Ⅱ) NH3 desorption temperature >250 ℃); d: the ratio between the amount of strong acid (NH3 desorption temperature < 250 ℃) and weak acid (NH3 desorption temperature >250 ℃) 2.3 H2化学吸附表征
表 1给出了Ni/SiO2及Ni30M/SiO2催化剂的H2化学吸附量。Ni/SiO2的化学吸附量为70 μmol/g,加入金属助剂的Ni30M/SiO2催化剂的H2吸附量均低于Ni/SiO2,其中,Ni30Fe/SiO2、Ni30Cu/SiO2上H2吸附能力尤为偏低。导致该结果的原因包括:所采用金属助剂的H2吸附能力低于金属Ni,由于加入金属助剂后金属晶粒粒径变化不明显,双金属晶粒表面由于M的存在稀释Ni而减少了暴露Ni原子的数量;金属助剂与Ni的表面张力不同,表面张力较小的金属助剂(如Cu[34]及Fe[10])利于在双金属晶粒表面发生富集,导致暴露金属Ni原子数量进一步减少;助剂与Ni之间电子相互作用会影响Ni电子云密度,从而影响Ni对H2的吸附能力。此外,金属助剂改性Ni/SiO2后H2化学吸附量降低也反映出助剂与Ni之间接触紧密、存在一定相互作用。
2.4 NH3程序升温脱附(NH3-TPD)表征
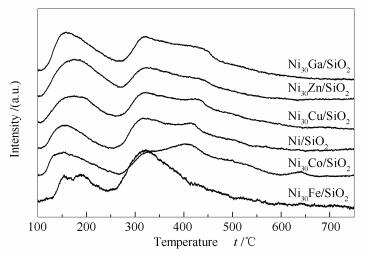
图 3为Ni/SiO2及Ni30M/SiO2催化剂的NH3-TPD谱图。由图 3可知,各催化剂均在约160及320 ℃有两个脱附峰,分别对应较弱和较强酸中心上NH3脱附。表 1给出了不同催化剂的相对酸量。与Ni/SiO2相比,Ni30M/SiO2催化剂具有较高的弱酸量(NH3脱附温度≤250 ℃)及总酸量。其中,Ni30Ga/SiO2催化剂总酸量最高。表 1还显示了不同催化剂表面较强酸及弱酸中心数量的比值(即nS/nW)。由nS/nW值大小可知,Ni/SiO2表面nS/nW比例最高(3.17),加入金属助剂后不同程度地降低了nS/nW比例,其中,Ni30Zn/SiO2表面nS/nW比例最低(1.39)。因此,虽然加入金属助剂不同程度提高了催化剂酸量,但降低了较强酸中心与较弱酸中心数量比例。已有报道表明[39, 40],Ni/SiO2催化剂表面主要为L酸中心(源自未还原的Ni物种)。可以推测,Ni30M/SiO2催化剂表面除了主要的与Ni位有关的L酸中心外,还会存在与未还原助剂金属相关的L酸中心。如前所述,Ni与M之间存在相互作用,而相互作用程度和金属助剂的本身性质均会影响催化剂酸性。
2.5 Ni30M/SiO2催化剂苯甲醚加氢脱氧活性
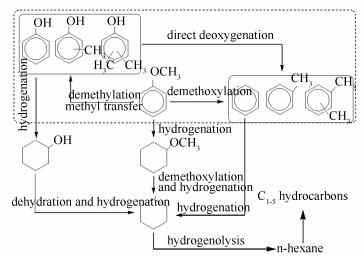
苯甲醚加氢脱氧反应过程中,Ni/SiO2及Ni30M/SiO2上气相产物中除了甲烷及C2-5低碳烷烃外,部分催化剂上生成少量CO;液态产物中检测到苯、甲苯、二甲苯、苯酚、甲酚、己烷、环己烷以及庚烷等,未检测到环己醇、环己酮以及甲氧基环己烷。如后续所述,Ni30SiO2及Ni30M/SiO2上苯甲醚加氢脱氧主要产物为苯。据文献报道[2, 41-43],苯甲醚加氢脱氧过程中通常有两条反应路径(如图 4所示),即直接脱氧(DDO)以及先加氢后脱氧(HYD)。DDO路径中,CAr-O键(CAr表示苯环上碳原子)会直接断裂(见图 4中虚线标记区域)。虽然苯甲醚脱甲氧基能直接生成苯,但经脱甲基和甲基转移会生成苯酚、甲酚和二甲酚,这些化合物也可以通过CAr-O键断裂分别转化为苯、甲苯和二甲苯。其中,苯可以通过深度加氢生成环己烷。HYD路径中,苯环首先加氢生成甲氧基环己烷和环己醇,然后再分别发生脱甲氧基-加氢和脱水-加氢反应生成环己烷。环己烷可通过C-C键氢解开环生成正己烷,正己烷可进一步发生C-C氢解生成C1-5低碳烃类。由于苯为主要产物并且没有检测到甲氧基环己烷和环己醇,可以推测DDO为主要加氢脱氧路径。由于CArO-CH3、CAr-OH和CAr-OCH3键的解离能分别为339、468和422 kJ/mol[44, 45],可以看出CArO-CH3键是最容易断裂的,其次是CAr-OCH3和CAr-OH。从键能高低的角度来看,与苯酚脱羟基生成苯相比,苯甲醚脱甲氧基生成苯更容易进行。此外,催化剂结构以及反应条件均会影响到苯甲醚加氢反应路径以及分布情况[42, 46]。例如,常压条件下利于DDO过程;HYD过程更容易在连续Ni位上进行[17]。由于本研究目的产物为三苯,故催化剂性能评价选择在常压下进行。
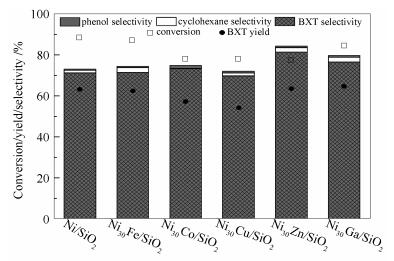
图 5-图 8为Ni/SiO2及Ni30M/SiO2催化剂的苯甲醚加氢脱氧性能。不同金属助剂对Ni/SiO2加氢脱氧、苯环加氢、C-C键氢解及甲基转移性能呈现不同程度的影响。
由图 5可知,Ni/SiO2上苯甲醚转化率为89.1%。与Ni/SiO2相比,Ni30Fe/SiO2及Ni30Ga/SiO2上苯甲醚转化率略有降低(分别为87.6%和84.6%);Ni30Co/SiO2、Ni30Cu/SiO2及Ni30Zn/SiO2相对较低(苯甲醚转化率均为约78%)。总体而言,Ni/SiO2催化剂中加入金属助剂后苯甲醚转化率呈现不同程度降低,这与加入助剂后催化剂表面金属Ni位密度(即H2化学吸附量)降低有关。然而,由表 1不同催化剂上苯甲醚TOF可知,加入Fe、Co及Cu金属助剂后提高了TOF,说明这些金属助剂与Ni存在协同作用[9, 10, 35, 47]。
由图 5还可知,不同金属助剂对三苯选择性的影响不同。Ni/SiO2催化剂上三苯选择性为71.5%。金属助剂Zn较明显提高了三苯选择性,Ni30Zn/SiO2上三苯选择性达到81.7%。Ni30Ga/SiO2及Ni30Co/SiO2催化剂上三苯选择性(分别为76.8%及73.4%)略高于Ni/SiO2,而Ni30Fe/SiO2及Ni30Cu/SiO2上三苯选择性(分别为71.7%和69.9%)与Ni/SiO2相近。各催化剂上三苯收率为54%-65%。其中,Ni30Ga/SiO2上三苯收率最高(65.0%);Ni30Zn/SiO2上三苯收率为63.8%,与Ni/SiO2催化剂上三苯收率(63.7%)相近。
图 5还显示了各催化剂上环己烷选择性。Ni30Co/SiO2催化剂上环己烷选择性趋于0,Ni/SiO2和Ni30Cu/SiO2催化剂环己烷选择性相近(约1.4%),而Ni30Fe/SiO2、Ni30Zn/SiO2及Ni30Ga/SiO2催化剂上环己烷选择性均约为2.3%。另外,各催化剂上苯酚选择性均较低(除了Ni30Co/SiO2上为1.5%,其他催化剂上均低于1%)。
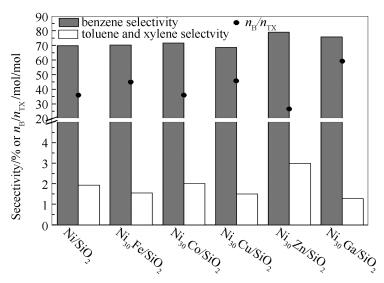
图 6为Ni/SiO2及Ni30M/SiO2催化剂上苯的选择性及甲苯、二甲苯总选择性。由图 6可知, 各催化剂上苯为主要产物(其选择性为64%-79%)。Ni30Zn/SiO2催化剂上苯选择性最高(78.7%),其次为Ni30Ga/SiO2催化剂(75.7%),Ni/SiO2催化剂上苯选择性为69.5%。此外,Ni30Zn/SiO2催化剂上甲苯和二甲苯总选择性也最高(3.0%),其次为Ni30Co/SiO2(甲苯和二甲苯总选择性为2.0%)。甲苯和二甲苯是反应过程中甲基转移的产物,本研究采用苯选择性与甲苯、二甲苯总选择性比值(标记为nB/nTX)表示催化剂甲基转移性能,nB/nTX值越低,说明催化剂的甲基转移能力越强。Ni/SiO2及Fe、Co、Cu、Zn、Ga改性催化剂上nB/nTX比值依次为35.9、44.9、35.5、45.4、26.4、58.8。一些研究表明,催化剂酸性位(尤其B酸中心)为甲基转移活性中心[22, 41, 48]。本研究中,虽然Ni30Ga/SiO2酸量最高(表 1),但甲基转移能力最弱(即nB/nTX值最高为58.8)。Ni30Zn/SiO2、Ni30Co/SiO2以及Ni30Mo/SiO2酸量略高于Ni/SiO2,并具有较低的nB/nTX值。总体而言,催化剂甲基转移能力与酸量无明显顺变关系,这可能与金属助剂自身性质不同加上助剂含量较少而导致不同的甲基转移能力有关。Zn助剂改性催化剂的甲基转移能力最强。需要说明的是,Ni/SiO2及Ni30M/SiO2催化剂的转甲基能力均较低,与其表面只存在L酸有关。
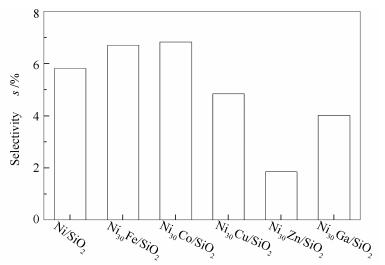
图 7为各催化剂上正己烷选择性。正己烷可由苯加氢生成的环己烷发生C-C键氢解而生成。然而,产物中也检测到大量正庚烷,正庚烷可经两个途径生成:一是通过甲基环己烷开环,二是通过溶剂正辛烷氢解。由于产物中均未检测出甲基环己烷,可推测正庚烷很可能主要来自溶剂正辛烷的氢解。该推测是合理的,因为金属Ni催化剂具有很高的C-C键氢解活性[9, 49]。基于此分析,正己烷同样可能由正辛烷通过氢解生成。因此,图 7中基于转化的苯甲醚计算得到的正己烷选择性并不是真实值;尽管如此,该值依然可用来表示催化剂的C-C键氢解活性,即计算所得的正己烷选择性越大,说明催化剂的C-C键氢解活性越高。由图 7中可以看出,Ni30Fe/SiO2和Ni30Co/SiO2催化剂上正己烷选择性分别为6.7%和6.9%,高于Ni/SiO2(正己烷选择性5.8%),说明金属Fe和Co能够促进Ni基催化剂C-C键氢解能力。金属Cu、Zn及Ga改性不同程度地降低了正己烷选择性,即抑制了Ni/SiO2催化剂的C-C键氢解活性,其中,金属Zn的作用最为明显。Ni30Zn/SiO2上正己烷选择性仅为1.9%。
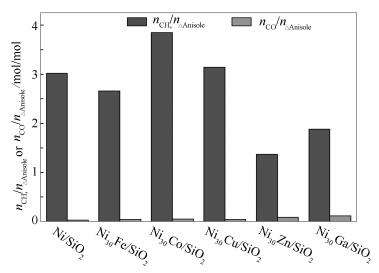
气相产物中检测到CH4和CO。CH4可源于苯甲醚中O-CH3键氢解,也可由烷烃经C-C键氢解生成。CO可能源自于CAR-OCH3(CAR表示苯环碳)氢解生成的甲醇,因甲醇可分解生成CO。理论上讲,如果未发生烷烃C-C键氢解,生成甲烷的量及转化的苯甲醚量比值(表示为nCH4/n△Anisole)应小于等于1;若发生C-C键氢解,nCH4/n△Anisole比值可能会大于1。无论如何,nCH4/n△Anisole比值也可用来表示催化剂的氢解活性,即nCH4/n△Anisole比值越高,表示催化剂的C-C键氢解活性越高。如图 8所示,各催化剂上nCH4/n△Anisole比值均大于1,表示各催化剂上均发生了C-C键氢解,其中, Ni30Zn/SiO2催化剂上nCH4/n△Anisole值最低(1.37),说明其C-C键氢解活性最低,这与由正己烷选择性分析得到的Zn明显抑制了C-C键氢解活性结果一致。此外,本研究采用生成CO的量与转化苯甲醚的量的比值(nCO/n△Anisole)表示催化剂的甲烷化能力,nCO/n△Anisole值越高表示催化剂甲烷化活性越低,越有利于降低反应过程中的耗氢量。Ni/SiO2催化剂上nCO/n△Anisole比值仅为0.03,即Ni/SiO2催化剂具有较高的甲烷化活性;加入金属助剂后不同程度提高了nCO/n△Anisole,其中,Ni30Zn/SiO2及Ni30Ga/SiO2催化剂上nCO/n△Anisole较高(分别为0.09和0.12),表明Zn及Ga相对明显抑制了Ni/SiO2催化剂的甲烷化活性。
综合比较Ni/SiO2及Ni30M/SiO2催化剂上三苯选择性及收率、nB/nTX比值、正己烷选择性、nCH4/n△Anisole及nCO/n△Anisole比值可以发现,与其他金属助剂相比,金属Zn助剂能有效改善Ni/SiO2催化剂的加氢脱氧性能。尽管向Ni/SiO2中加入Zn助剂由于H2化学吸附量降低而降低了苯甲醚转化率,但提高了三苯选择性及甲基转移能力、抑制了C-C键氢解及甲烷化活性,这有利于提高碳收率、降低耗氢量具有非常重要的实际意义。Zn对Ni/SiO2加氢脱氧性能的影响可归因于形成Ni和Zn之间相互作用及Zn的亲氧性强于Ni[50]。在Ni和Zn双金属中Ni与Zn存在相互作用,连续的Ni原子被Zn原子隔离、稀释,体现为Ni30Zn/SiO2化学吸附量低于Ni/SiO2(表 1)。由于Zn吸附苯甲醚及其中间产物中碳的能力远低于Ni,与金属Ni相比,Ni-Zn双金属晶粒表面Ni几何分布的变化将不利于苯环及C-C键吸附[20], 从而抑制了苯环加氢及C-C键氢解。同时,由于Zn的亲氧性高于金属镍,将有利于通过吸附苯甲醚中的氧而活化CAR-O键,从而促进苯甲醚加氢脱氧生成苯环类产物。
3 结论
在Ni30M/SiO2前驱体中,少量金属Cu和Fe能够明显促进催化剂中Ni物种还原,而少量金属Co及Ga抑制了前驱体中Ni物种的还原。金属助剂对催化剂前驱体中镍物种还原性能的影响表明其与Ni间存在一定相互作用。Ni30M/SiO2中,金属助剂会稀释表面连续Ni位,且部分金属趋于在双金属晶粒表面富集,这些因素导致Ni30M/SiO2催化剂(尤其Ni30Fe/SiO2及Ni30Cu/SiO2)的H2化学吸附低于Ni/SiO2。助剂金属的加入有利于增加Ni基催化剂的酸量(尤其弱酸中心酸量)。在300 ℃、0.1 MPa、苯甲醚质量空速1.0 h-1及氢油比25的反应条件下,与Ni/SiO2相比,Ni30M/SiO2催化剂上苯甲醚转化率呈现不同程度降低,与Ni30M/SiO2的H2化学吸附量较低密切相关。然而,金属助剂Ga及Zn改性明显提高了催化剂上目的产物三苯的选择性。此外,Ni30Zn/SiO2显示了较高甲基转移能力、较低C-C键氢解活性,这与Ni和Zn之间相互作用及Zn亲氧性高于Ni有关。
-
-
[1]
BRIDGWATER A V. Review of fast pyrolysis of biomass and product upgrading[J]. Biomass Bioenergy, 2012, 38(2): 68-94.
-
[2]
SAIDI M, SAMIMI F, KARIMIPOURFARD D, NIMMANWUDIPONG T, GATES B C, RAHIMPOUR M R. Upgrading of lignin-derived bio-oils by catalytic hydrodeoxygenation[J]. Energy Environ Sci, 2013, 7(1): 103-129.
-
[3]
RUNNEBAUM R C, NIMMANWUDIPONG T, BLOCK D E, GATES B C. Catalytic conversion of compounds representative of lignin-derived bio-oils:A reaction network for guaiacol, anisole, 4-methylanisole, and cyclohexanone conversion catalysed by Pt/γ-Al2O3[J]. Catal Sci Technol, 2012, 2: 113-118. doi: 10.1039/C1CY00169H
-
[4]
HONKELA M L, BJÖRK J, PERSSON M. Computational study of the adsorption and dissociation of phenol on Pt and Rh surfaces[J]. Phys Chem Chem Phys, 2012, 14(16): 5849-5854. doi: 10.1039/c2cp24064e
-
[5]
GUTIERREZ A, KAILA R K, HONKELA M L, SLIOOR R, KRAUSE A O I. Hydrodeoxygenation of guaiacol on noble metal catalysts[J]. Catal Today, 2009, 147(3/4): 239-246.
-
[6]
LIU C, SHAO Z, XIAO Z, WILLIAMS C T, LIANG C. Hydrodeoxygenation of benzofuran over silica-alumina-supported Pt, Pd, and Pt-Pd catalysts[J]. Energy Fuels, 2012, 26(2): 4205-4211.
-
[7]
HONG D Y, MILLER S J, AGRAWAL P K, JONES C W. Hydrodeoxygenation and coupling of aqueous phenolics over bifunctional zeolite-supported metal catalysts[J]. Chem Commun, 2010, 46(7): 1038-1040. doi: 10.1039/B918209H
-
[8]
JIN S H, XIAO Z H, LI C, CHEN X, WANG L, XING J C, LI W Z, LIANG C H. Catalytic hydrodeoxygenation of anisole as lignin model compound over supported nickel catalysts[J]. Catal Today, 2014, 234: 125-132. doi: 10.1016/j.cattod.2014.02.014
-
[9]
LENG S, WANG X D, HE X B, LIU L, LIU Y E, ZHONG X, ZHUANG G L, WANG J G. NiFe/γ-Al2O3:A universal catalyst for the hydrodeoxygenation of bio-oil and its model compounds[J]. Catal Commun, 2013, 41: 34-37. doi: 10.1016/j.catcom.2013.06.037
-
[10]
SUN J M, AYMAN M K, ZHANG H, KOVARIK L. Carbon-supported bimetallic Pd-Fe catalysts for vapor-phase hydrodeoxygenation of guaiacol[J]. J Catal, 2013, 306(1): 47-57.
-
[11]
DO P T M, FOSTER A J, CHEN J G, LOBO R F. Bimetallic effects in the hydrodeoxygenation of meta-cresol onγ-Al2O3 supported Pt-Ni and Pt-Co catalysts[J]. Green Chem, 2012, 14(14): 1388-1397.
-
[12]
HAMM G, SCHMIDT T, BREITBACH J, FRANKE D, BECKER C, WANDELT K. The adsorption of benzene on Pd (111) and ordered Sn/Pd (111) surface alloys[J]. Surf Sci, 2004, 562(1/3): 170-182.
-
[13]
BREITBACH J, FRANKE D, HAMM G, BECKER C, WANDELT K. Adsorption of benzene on ordered Sn/Pt (111) surface alloys[J]. Surf Sci, 2002, 507-510(2): 18-22.
-
[14]
SHI D, ARROYO-RAMIREZ L, VOHE J M. The use of bimetallics to control the selectivity for the upgrading of lignin-derived oxygenates:Reaction of anisole on Pt and PtZn catalysts[J]. J Catal, 2016, 340: 219-226. doi: 10.1016/j.jcat.2016.05.020
-
[15]
BYKOVA M V, ERMAKOV Y D, KAICHEV V V, BULAVCHEMKO O A, SARAEV A A, LEBEDEV M Y, YAKOVLEV V A. Ni-based sol-gel catalysts as promising systems for crude bio-oil upgrading:Guaiacol hydrodeoxygenation study[J]. Appl Catal B:Environ, 2012, 113-114(1): 296-307.
-
[16]
ARDIYANTI A R, KHROMOVA S A, VENDERBOSCH R H, YAKOVLEV V A, HREERES H J. Catalytic hydrotreatment of fast-pyrolysis oil using non-sulfided bimetallic Ni-Cu catalysts on aδ-Al2O3 support[J]. Appl Catal B:Environ, 2012, 117-118: 105-117. doi: 10.1016/j.apcatb.2011.12.032
-
[17]
LEI N, PRISCILLA M, FABIO B, WEI A, SOOKNOI T, RESASCO D E. Selective conversion of m-cresol to toluene over bimetallic Ni-Fe catalysts[J]. J Mol Catal A:Chem, 2014, 388-389: 47-55. doi: 10.1016/j.molcata.2013.09.029
-
[18]
KHROMVA S A, SMIRNOV A A, BULAVCHENK O A, SARAEV A A, KAICHEV V V, RESHETNIKOV S I, YAKOVEM V A. Anisole hydrodeoxygenation over Ni-Cu bimetallic catalysts:The effect of Ni/Cu ratio on selectivity[J]. Appl Catal A:Gen, 2014, 470(2): 261-270.
-
[19]
DELATTE L C, SANTOS M, MEDINA J A. Structure of Metallic Catalysts[M]. New York:Academic Press, 1975, 72(72):417-425.
-
[20]
LIU P, NÊRSKOV J K. Ligand and ensemble effects in adsorption on alloy surfaces[J]. Phys Chem Chem Phys, 2001, 3(11): 3814-3818.
-
[21]
MILE B, STIRLING D, ZAMMITT M A, LOVELL A, WEBB M. The location of nickel oxide and nickel in silica-supported catalysts:Two forms of "NiO" and the assignment of temperature-programmed reduction profiles[J]. J Catal, 1989, 20(2): 217-229.
-
[22]
LI K, WANG R, CHEN J. Hydrodeoxygenation of anisole over silica-supported Ni2P, MoP, and NiMoP catalysts[J]. Energy Fuels, 2011, 25(3): 854-863. doi: 10.1021/ef101258j
-
[23]
ROBERTSON S D, MCNICOL B D, BAAS J H, KOLET SC, JENKINS JW. Determination of reducibility and identification of alloying in copper-nickel-on-silica catalysts by temperature-programmed reduction[J]. J Catal, 1975, 37(3): 424-431. doi: 10.1016/0021-9517(75)90179-7
-
[24]
ROGATIS L D, MONTINI T, COGNIGNI A. Methane partial oxidation on NiCu-based catalysts[J]. Catal Today, 2009, 145(1/2): 176-185.
-
[25]
GA OW, LI C M, CHEN H, WU M, HE S, WEI M, EVANS D G, D X. Supported nickel-iron nanocomposites as a bifunctional catalyst towards hydrogen generation from N2H4·H2O[J]. Green Chem, 2014, 16(3): 1560. doi: 10.1039/c3gc41939h
-
[26]
ISHIHARA T, EGUCHI K, ARA H. ChemInform abstract:hydrogenation of carbon monoxide over SiO2-supported Fe-Co, Co-Ni, and Ni-Fe bimetallic catalysts[J]. Appl Catal, 1987, 18(51): 225-238.
-
[27]
PANDEY D, DEO G. Promotional effects in alumina and silica supported bimetallic Ni-Fe catalysts during CO2 hydrogenation[J]. J Mol Catal A:Chem, 2014, 382(382): 23-30.
-
[28]
MENG F H, ZHONG P Z, LI Z, CUI X X, ZHENG H Y. Surface structure and catalytic performance of Ni-Fe catalyst for low-temperature CO hydrogenation[J]. J Chem, 2014, (5): 1-72.
-
[29]
YU X, CHEN J, REN T. Promotional effect of Fe on performance of Ni/SiO2 for deoxygenation of methyl laurate as a model compound to hydrocarbons[J]. RSC Adv, 2014, 4(87): 46427-46436. doi: 10.1039/C4RA07932A
-
[30]
黄传敬, 郑小明. 担载型镍催化剂上CH4/CO2重整反应的研究Ⅱ.添加Co对Ni/Al2O3催化剂性能的影响[J]. 淮北师范大学学报(自然科学版), 2000,21,(1): 43-53. HUANG Chuan-jing, ZHENG Xiao-ming. Study on CH4/CO2 reforming reaction on Supported Nickel Catalyst Ⅱ. Effect of Co addition on the performance of Ni/Al2O3catalyst[J]. J Huaibei Normal Univ(Nat Sci Ed), 2000, 21(1): 43-53.
-
[31]
WANG X F, WANG F, CHEN M Y, REN J. Studies on nickel-based bimetallic catalysts for hydrodeoxygenation[J]. J Fuel Chem Technol, 2005, 33(5): 612-616.
-
[32]
LI C M, CHEN Y D, ZHANG S T, ZHOU J Y, WANG F, HE S, WEI M, EVANS D G, D X. Nickel-gallium intermetallic nanocrystal catalysts in the semihydrogenation of phenylacetylene[J]. ChemCatChem, 2014, 6(3): 824-831. doi: 10.1002/cctc.201300813
-
[33]
SITTHISA S, WEI A, RESASCO D E. Selective conversion of furfural to methylfuran over silica-supported Ni-Fe bimetallic catalysts[J]. J Catal, 2011, 284(1): 90-101. doi: 10.1016/j.jcat.2011.09.005
-
[34]
HUYNH T M, ARMBRUSTER U, POHL M M, SCHNEIDER M, RADNIK J, HOANG D-L, PHAN B M Q, NGUYEN D A, MARTIN A. Hydrodeoxygenation of phenol as a model compound for bio-oil on non-noble bimetallic nickel-based catalysts[J]. ChemCatChem, 2014, 6(7): 1940-1951. doi: 10.1002/cctc.v6.7
-
[35]
GANDARIA I, REQUIES J, ARIAS P L, ARMBRUSTER U, MARTIN A. Liquid-phase glycerol hydrogenolysis by formic acid over Ni-Cu/Al2O3 catalysts[J]. J Catal, 2013, 290(12): 79-89.
-
[36]
FELIX S, FRANK A P, THOMAS B, RASMUS Z S, CLAUS H C, JENS K N. Identification of non-precious metal alloy catalysts for selective hydrogenation of acetylene[J]. Science, 2008, 320(5881): 1320-1322. doi: 10.1126/science.1156660
-
[37]
SHARAFUTDINO I, ELKJAER C F, DE CARVALHO H W P, GARDINI D, CHIARELLO G G, DAMSGAARD C D, WAGNER J B, GRUNWALDT J D, DAHL S, CHORKENDORFF I. Intermetallic compounds of Ni and Ga as catalysts for the synthesis of methanol[J]. J Catal, 2014, 320: 77-88. doi: 10.1016/j.jcat.2014.09.025
-
[38]
LANGE, ADOLPH N. Lange's Handbook of Chemistry[M]. New York:Mcgraw-Hill Book Company, 1999, 5(4):687-688.
-
[39]
CHEN Y J, CHEN J X. Selective hydrogenation of acetylene on SiO2 supported Ni-In bimetallic catalysts:Promotional effect of In[J]. Appl Surf Sci, 2016, 387: 16-27. doi: 10.1016/j.apsusc.2016.06.067
-
[40]
HADJⅡVANOV K, MIHAYLOV M, KLISSURSKI D, STEFANOV P, ABADJIEVA N, VASSILEVA , MINTCHEV L. Characterization of Ni/SiO2 catalysts prepared by successive deposition and reduction of Ni2+ ions[J]. J Catal, 1999, 185(2): 314-323. doi: 10.1006/jcat.1999.2521
-
[41]
ZHU X, LOBBAN L L, MALLINSON R G, REASASCO D E. Bifunctional transalkylation and hydrodeoxygenation of anisole over a Pt/HBeta catalyst[J]. J Catal, 2011, 281(1): 21-29. doi: 10.1016/j.jcat.2011.03.030
-
[42]
FERRARI M, MAGGI R, DELMON B, GRANGE P. Influences of the hydrogen sulfide partial pressure and of a nitrogen compound on the hydrodeoxygenation activity of a CoMo/Carbon catalyst[J]. J Catal, 2001, 198(1): 47-55. doi: 10.1006/jcat.2000.3103
-
[43]
GONZALEZBORJA M A, RESASCO D E. Anisole and guaiacol hydrodeoxygenation over monolithic Pt-Sn catalysts[J]. Energy Fuels, 2011, 25(9): 4155-4162. doi: 10.1021/ef200728r
-
[44]
WANG H, MALE J, WANG Y. Recent advances in hydrotreating of pyrolysis bio-oil and its oxygen-containing model compounds[J]. ACS Catal, 2013, 3(5): 1047-1070. doi: 10.1021/cs400069z
-
[45]
FURIMSKY E. Catalytic hydrodeoxygenation[J]. Appl Catal A:Gen, 2000, 199(2): 147-190. doi: 10.1016/S0926-860X(99)00555-4
-
[46]
ROMERO Y, RICHARD F, BRUNET S. Hydrodeoxygenation of 2-ethylphenol as a model compound of bio-crude over sulfided Mo-based catalysts:Promoting effect and reaction mechanism[J]. Appl Catal B:Environ, 2010, 98(98): 213-223.
-
[47]
PHUONG T M, ANDREW J F, CHEN J, RAUL F L. Bimetallic effects in the hydrodeoxygenation of meta-cresol onγ-Al2O3 supported Pt-Ni and Pt-Co catalysts[J]. Green Chem, 2012, 14(5): 1388-1397. doi: 10.1039/c2gc16544a
-
[48]
YANG Y X, OCHOA-HERNANDEZ C, O'SHEA V A D L P, PIZARRO P, CORONADO J M, SERRANO D P. Effect of metal-support interaction on the selective hydrodeoxygenation of anisole to aromatics over Ni-based catalysts[J]. Appl Catal B:Environ, 2014, 145(1): 91-100.
-
[49]
CHEN J X, SHI H, LI L, LI K L. Deoxygenation of methyl laurate as a model compound to hydrocarbons on transition metal phosphide catalysts[J]. Appl Catal B:Environ, 2014, 144(2): 870-884.
-
[50]
SHI D M, LISANDRA A R, JOHN M V. The use of bimetallics to control the selectivity for the upgrading of lignin-derived oxygenates:Reaction of anisole on Pt and PtZn catalysts[J]. J Catal, 2006, 340: 219-226.
-
[1]
-
表 1 Ni/SiO2及Ni30M/SiO2催化剂物理化学性质
Table 1. Physical-chemical properties of the Ni/SiO2 and Ni30M/SiO2 catalysts
Catalyst ABET/
(m2·g-1)vp/
(cm3·g-1)dp/nm Crystallite
sizea/nmH2 uptake/
(μmol·g-1)TOFb/s-1 Relative acid amountc total acid (Ⅰ) (Ⅱ) nS/nWd Ni/SiO2 314 0.53 5.6 7.2 70 0.04 1.00 0.24 0.76 3.17 Ni30Fe/SiO2 342 0.53 6.6 6.8 1.1 2.46 1.38 0.35 1.03 2.94 Ni30Co/SiO2 330 0.52 6.6 6.7 17 0.12 1.11 0.31 0.81 2.61 Ni30Cu/SiO2 366 0.57 6.6 7.1 7.4 0.27 1.26 0.41 0.85 2.07 Ni30Zn/SiO2 341 0.54 6.6 7.7 44 0.04 1.22 0.51 0.71 1.39 Ni30Ga/SiO2 329 0.56 6.6 6.4 49 0.05 1.46 0.53 0.93 1.79 a: calculated by Scherrer equation based on the reflection of Ni (111); b: calculated from the H2 chemisorption; c: designing the total acid amount of Ni/SiO2 as 1.0 ((Ⅰ) NH3 desorption temperature < 250 ℃; (Ⅱ) NH3 desorption temperature >250 ℃); d: the ratio between the amount of strong acid (NH3 desorption temperature < 250 ℃) and weak acid (NH3 desorption temperature >250 ℃) -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:







 下载:
下载:

