 图 1
玉米秸秆纤维素亚/超临界乙醇液化流程示意图
Figure 1.
Procedures for the liquefaction of cellulose in sub/supercritical ethanol
图 1
玉米秸秆纤维素亚/超临界乙醇液化流程示意图
Figure 1.
Procedures for the liquefaction of cellulose in sub/supercritical ethanol

Citation: LI Wei, XIE Xin-an, TANG Cheng-zheng, LI Yan, LI Lu, WANG Ya-li, WEI Xing, FAN Di. Effects of hydroxyl and hydrogen free radicals on the liquefaction of cellulose in sub/supercritical ethanol[J]. Journal of Fuel Chemistry and Technology, 2016, 44(4): 415-421.

亚/超临界乙醇中羟基和氢自由基作用下的纤维素液化行为
English
Effects of hydroxyl and hydrogen free radicals on the liquefaction of cellulose in sub/supercritical ethanol
-
Key words:
- cellulose
- / liquefaction
- / sub/supercritical ethanol
- / free radical
- / radical trap
-
纤维素类生物质资源是地球上储量丰富的含碳氢元素的可再生资源,利用超临界流体液化生物质制取生物油及各种基本化工原料已成为生物质液化领域的重点研究方向。超临界流体液化纤维素类生物质因其具有液体产物收率高、产品选择性好等优点而倍受关注。但超临界有机溶剂是如何促进纤维素液化转化产物有较高的选择性和转化率的机理尚不明晰。陈晓菲[1]研究稻秆在超临界乙醇中的裂解机理,发现乙醇在超临界状态下生成乙基和羟基自由基,两者分别攻击木素结构单元上的碳-氧键和碳-氢键,促进了稻秆生物质的裂解液化。随着反应温度的升高,乙醇自由基活性增强、浓度增加[2, 3]。Edita等[4]、Hessein等[5]发现,纤维素的裂解液化受到溶液中自由基浓度的影响,同时也指出,在亚/超临界状态下,乙醇产生了H·、HO·以及CH3·等多种自由基。自由基的作用促进了纤维素类生物质中C-C、C-O以及-OH等键断裂[6]。
在许多化学反应过程中,反应物会产生过渡状态的不稳定活性物质,即自由基。自由基寿命很短暂,然而其对于理解和证明反应机理非常重要。自由基捕捉剂能够将这种活性物质(自由基)的活性、浓度增强或者减弱,从而可以利用添加自由基捕捉剂的方式考察这些活性物质(自由基)对反应过程的影响,进一步阐明自由基的作用机理。羟自由基能与许多有机化合物,尤其芳香族化合物发生羟化反应,通过测定反应体系的羟化产物生成量,间接检测OH·含量[7];周建政等[8]应用高效液相色谱电化学联合法检测反应体系产生的OH·,即利用水杨酸捕获OH·,通过测得生成物二羟基苯甲酸间接测定OH·的含量。Richmond等[9]应用水杨酸作为OH·的捕获剂,得到加成产物二羟基苯甲酸,后者再经衍生化,用气相色谱法测定衍生化产物,从而间接测定OH·含量。聂敏等[10]研究了微量CCl4对超声引发苯乙烯乳液聚合的影响,指出CCl4使超声引发苯乙烯乳液聚合速率提高的原因在于CCl4能进入空化泡内捕捉H·。迄今为止,关于乙醇在亚/超临界状态下产生的多种自由基对纤维素液化行为影响的研究报道极少。为了考察自由基对纤维素液化产物的影响,实验以玉米秸秆纤维素为原料,分别添加HO·捕捉剂水杨酸、H·捕捉剂四氯化碳,研究亚/超临界乙醇产生的HO·和H·对玉米秸秆纤维素液化行为的影响,以明晰其反应机理,为生物质亚/超临界乙醇液化工艺的优化和反应器的设计提供理论参考。
1 实验部分
1.1 原料与试剂
实验原料为华南农业大学实验田的玉米秸秆。将玉米秸秆自然风干并截成小段,在实验前利用微型植物粉碎机粉碎,并过40目筛,将其置于60℃烘箱内烘12h,收集于干燥器中备用。亚氯酸钠:工业级,80%;氢氧化钠、丙酮、无水乙醇均为市售分析纯;水杨酸:天津市福晨化学试剂厂,分析纯;四氯化碳:天津市富宇精细化工有限公司,分析纯。
1.2 玉米秸秆纤维素的制备
根据中国国家标准GB/T2677.1—93-GB/T2677.10―95中相关方法,去除玉米秸秆纤维素中的脂溶性物质、多糖及淀粉等水溶性物质。采用酸化的亚氯酸钠溶液除去木质素,得到综纤维素;根据纤维素和半纤维素溶解性的差异,采用氢氧化钠溶液处理,分离得到的沉淀为玉米秸秆纤维素。将所得纤维素置于烘箱,60℃干燥12h,移放于干燥器中备用。
1.3 实验方法
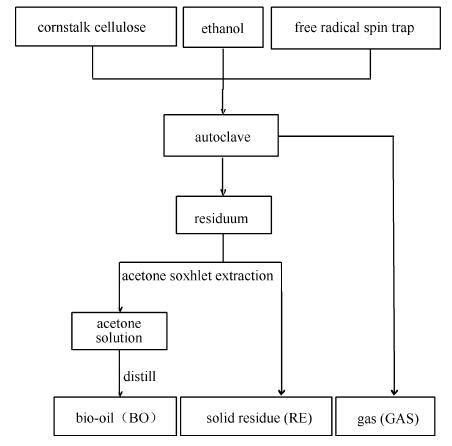
实验选用PARR-4521M型间歇式磁力搅拌高压反应釜(美国PARR公司),容积1L,最高温度350℃,最高压力13MPa。乙醇的临界温度和临界压力分别为243℃、6.34MPa。实验流程示意图见图 1(气体产物:gas,GAS;生物油:bio-oil,BO;固体残渣:solid residue,RE)。
 图 1
玉米秸秆纤维素亚/超临界乙醇液化流程示意图
Figure 1.
Procedures for the liquefaction of cellulose in sub/supercritical ethanol
图 1
玉米秸秆纤维素亚/超临界乙醇液化流程示意图
Figure 1.
Procedures for the liquefaction of cellulose in sub/supercritical ethanol
1.4 分析方法
利用傅里叶变换红外光谱(FT-IR)分析固体残渣的官能团,仪器型号为VERTEX 70。实验采用KBr压片法,由计算机采集到样品的红外光谱谱图。产物收率按以下公式计算:
2 结果与讨论
2.1 羟基自由基对纤维素液化行为的影响
2.2 氢自由基对纤维素液化行为的影响
2.3 HO·和H·对纤维素液化行为的影响
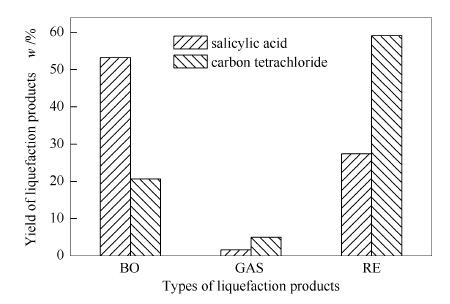
将玉米秸秆纤维素在反应温度280℃,乙醇用量100mL,反应时间60min,HO·和H·捕捉剂水杨酸、四氯化碳用量均为2mL条件下分别进行液化实验,HO·和H·对纤维素液化BO、GAS及RE产物收率见图 8。
由图 8可知,在相同反应条件下,添加2mL水杨酸液化纤维素:生物油收率达53.2%,气体产物收率1.6%,残渣收率27.4%;当添加2mL四氯化碳时,生物油收率只有20.7%,气体收率5.0%,残渣收率高达59.1%。实验结果表明,添加水杨酸使得HO·浓度和活性增加,HO·的强氧化作用促进了纤维素及中间产物发生开环、脱水、脱羧、脱羰以及异构化等多种反应,抑制小分子气体产物的生成,因而造成生物油收率相对较高,气体和残渣相对较少,证明了HO·作用加强促进了纤维素的转化;添加H·捕捉剂四氯化碳后,四氯化碳和中间产物竞争H·,参与纤维素裂解反应的H·浓度和活性降低,从而抑制了纤维素及中间产物在H·作用下断键进一步裂解液化,导致生物油收率相对较低,气体产物和残渣量相对较高,纤维素转化率相对较低,证实了H·作用减弱不利于纤维素的液化转化。
2.1.1 羟基自由基浓度(水杨酸用量)对纤维素液化行为的影响
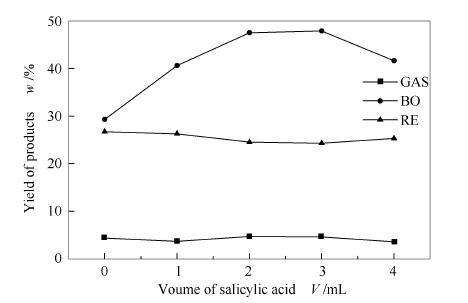
实验乙醇用量和反应停留时间固定为100mL和60min,采用不同的水杨酸添加量(1-4mL)来改变反应釜中HO·的浓度,反应温度为320℃,实验过程压力值上升至11.0-12.0MPa。图 2为该实验条件对玉米秸秆纤维素亚/超临界乙醇液化气体产物、生物油、固体残渣收率的影响。
由图 2可知,当温度在320℃时,反应压力逐渐升高至11.0-12.0MPa,乙醇产生了更多的活性自由基,促进了纤维素裂解液化,生成了更多的小分子气体片段[11];随着水杨酸用量的增加,HO·浓度增加,HO·氧化还原能力加剧,中间产物及自由基更多地转化成非气体组分,气体产物收率随水杨酸用量增加而略有下降,这是由于羟基自由基捕捉剂水杨酸提高了HO·浓度,抑制了纤维素裂解生成小分子气体产物,更多地生成一些非气体产物。
随着HO·捕捉剂水杨酸用量的增加,生物油收率逐渐升高,但当水杨酸用量达到3mL后,生物油的收率略微有下降的趋势。反应温度为320℃,未添加水杨酸时,生物油的收率只有29.3%,玉米秸秆纤维素发生裂解形成液体产物产率不高;当水杨酸用量为3mL时,生物油的收率高达47.9%,这表明,水杨酸的加入使纤维素在超临界乙醇中更容易裂解,随着水杨酸用量的增加,乙醇产生更多的活性HO·,从而使HO·的浓度增加,单位时间、单位体积内HO·与纤维素的有效碰撞机会增多,HO·氧化纤维素裂解的中间产物更完全,从而生物油产率逐渐升高。当水杨酸用量超过3mL后,HO·浓度进一步升高,HO·氧化还原能力加强,使得部分生物油发生缩聚、环化、氧化还原等二次反应,转化为固体残渣、气体等产物,导致生物油收率略微有所降低。
在320℃时,当水杨酸用量低于3mL时,随着水杨酸用量的增加,HO·的浓度也增加,有利于液化反应进行,固体残渣量急剧减少;当水杨酸用量为0、反应温度为320℃时,固体残渣率为26.7%,部分玉米秸秆纤维素发生了裂解液化;当水杨酸用量达3mL时,固体残渣率降低至24.3%,大部分纤维素发生裂解液化。但是,当水杨酸用量超过3mL后,固体残渣率略微升高,这可能由于过量的水杨酸饱和后,生物油中部分不稳定产物进一步发生缩合、环化等反应,形成了固体残渣。
2.1.3 羟基自由基活性(反应温度)对纤维素液化行为的影响
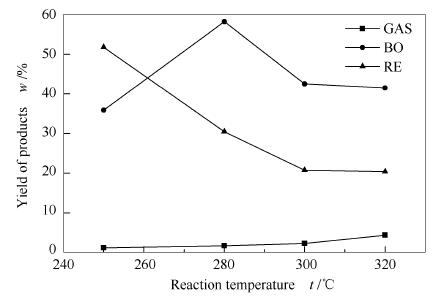
实验以玉米秸秆纤维素为原料,乙醇用量为100mL,反应时间为60min,水杨酸添加量2mL,通过改变反应温度(250-320℃)来考察反应釜中HO·活性,实验过程压力值上升至6-12MPa。图 4为上述实验条件下,不同HO·活性(反应温度)对纤维素亚/超临界乙醇液化气体产物、生物油、固体残渣收率的影响。
由图 4可知,加入2mL水杨酸后,随着温度升高,气体收率由1.2%上升至4.4%。由此得知,温度升高促进超临界乙醇产生更多的HO·、H·等多种自由基,且其浓度和活性均逐渐增强,使得纤维素更容易发生脱水、裂解、脱羰、脱羧、氧化等反应,产生更多的小分子CO、CO2以及H2等气体产物。在温度达到300℃以后,温度对液化产气影响更加明显[15],温度升高,中间产物自由基活性进一步增强,固液产物转化速率加快,气体增多。
添加2mL水杨酸后,当温度从250℃升高到280℃,生物油收率由35.9%升高至58.2%,这是由于升高反应温度促进了纤维素发生裂解液化反应,转化为液体产物[16]。当温度高于300℃时,生物油收率逐渐降低,最后趋于稳定状态。分析认为,温度低于280℃时,随着温度的升高,活性水杨酸促进乙醇裂解产生更多的HO·,HO·浓度和活性增大,HO·与中间产物自由基、中间产物自由基与中间产物自由基之间的有效碰撞亦增多,促进纤维素结构中C-C、C-H以及C-O等键裂解液化,转化为生物油产物,从而使得生物油收率急剧增多。随着温度的继续升高超过300℃,乙醇自由基与中间产物自由基、中间产物自由基与中间产物自由基之间的有效碰撞亦增多,发生缩合、重聚、氧化等反应加剧,出现生物油收率不变或降低的趋势[17],而且自由基与中间产物已充分反应,作用于纤维素裂解中间产物的二次反应也逐渐趋于平衡。
当添加水杨酸2mL时,固体残渣量由51.8%降低至20.4%,这说明添加水杨酸条件下液化效率更高,这可能是由于随着反应温度的升高,乙醇在亚/超临界条件下裂解产生自由基活性增强,对秸秆纤维素中C-C、C-O等键的作用强度增大,促进秸秆纤维素发生裂解液化反应[18]。秸秆纤维素液化过程复杂,发生开环、异构化、脱水以及脱羧等多种反应,随着反应温度的升高,各化学反应更剧烈,进一步促进纤维素发生液化,裂解形成小分子的酮类、醛类等液体产物,使得纤维素固体残渣量减少。廖艳芬等[15]研究纤维素快速热裂解实验同样也发现,随着温度的升高,纤维素裂解所生产的固体残渣量逐渐减少。当添加水杨酸后,反应体系中HO·浓度增多、活性增强,纤维素更容易发生脱水、裂解、脱羰、脱羧等反应,纤维素的液化效率进一步增强。随着体系反应温度的进一步升高,固体残渣量略微下降,这主要是由于捕捉剂水杨酸促进自由基充分反应,纤维素裂解液化所产生的小分子化合物发生的缩合、环化、氧化等反应达到了一种基本平衡状态,使得固体残渣量下降趋势减慢。
2.1.2 不同HO·浓度(水杨酸用量)下固体残渣的FT-IR分析
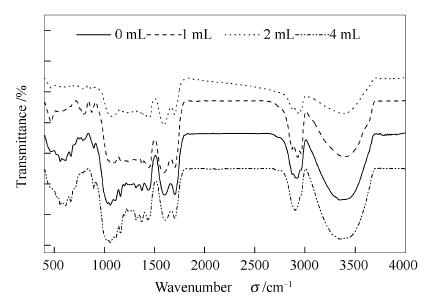
利用FT-IR对玉米秸秆纤维素在亚/超临界乙醇中液化产生的残渣进行定性分析,研究水杨酸用量对秸秆纤维素液化的影响。玉米秸秆纤维素在反应温度320℃、反应时间60min下,分别选取了水杨酸用量为0、1、2、4mL条件下秸秆纤维素液化产生的固体残渣进行FT-IR分析,具体见图 3。
由图 3可知,添加一定量捕捉剂水杨酸后纤维素-O-CH2中C-O在波长1060cm-1处振动峰逐渐减弱,这可能是由于捕捉剂水杨酸促进乙醇在亚/超临界状态下裂解产生更多的HO·等自由基,促进纤维素在此处C-O键断裂加剧,进一步发生缩合、氧化等反应;残渣中-O-H(3300-3600cm-1)的振动峰先减弱后增强,这时由于随着水杨酸的添加量增多,促进了体系产生更多的HO·、CH3·等中间自由基,促进了纤维素中C-O-C、C-C等键断裂,进一步发生缩合、氧化等反应,形成酸类、醇类物质等液体和固体物质。当水杨酸用量增加到4mL时,固体残渣中仍存在明显的-OH振动吸收峰,这可能是由于体系产生大量HO·具有较强的吸收电子能力,具有较强的氧化性,HO·与纤维素液化产物进一步发生反应,转化为含有-OH的化合物。1680-1715cm-1为-C=O振动吸收峰,当水杨酸用量较少时,残渣中-C=O相对较少,增加水杨酸用量时,-C=O明显增加,主要是因为中间自由基与纤维素结构中C-O-C、C-C、-OH等键的有效碰撞增多,使得纤维素结果中多种键的键长增加,键能减弱,促进了纤维素裂解液化形成酮类或醛类等含-C=O的物质。
2.2.1 氢自由基浓度(四氯化碳用量)对纤维素液化行为的影响
预实验过程中,发现添加四氯化碳用量在多于2mL,温度升高到300℃,实验所使用的高压反应釜腐蚀加剧,设备不稳定,防爆膜爆裂,为使实验安全进行,所选择四氯化碳用量在0-2mL。
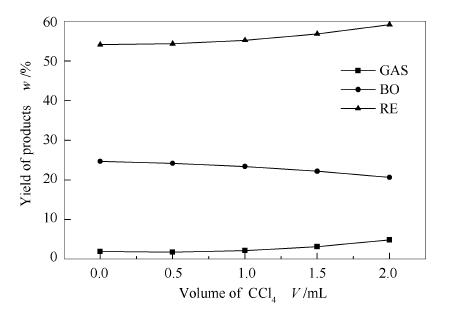
图 5为实验温度为280℃时,通过不同四氯化碳添加量(0-2mL)改变反应釜中H·浓度,对玉米秸秆纤维素亚/超临界乙醇液化气体产物、生物油及固体残渣收率的影响,乙醇用量和反应停留时间均为100mL和60min,实验过程压力值上升至8-11MPa。
由图 5可知,在280℃时,四氯化碳的用量由0增加至2mL时,气体产物收率由2.0%增加至5.0%,纤维素在液化前期阶段主要产生H2O、CO2、CH4、CO、C2H4等气体产物[19];四氯化碳捕捉H·,导致纤维素液化后期反应减弱,使得液化的部分中间产物转化为气体产物,气体收率有所升高;固体残渣收率由54.1%增加至59.1%,生物油收率由24.7%降低至20.7%,这主要是因为四氯化碳和中间小分子化合物与乙醇产生的活性H·形成竞争,随着捕捉剂用量的增加,纤维素液化后中间产物二次液化能力减弱,因此,生物油收率有所降低,固体残渣产率相对有所升高。
2.2.3 氢自由基活性(反应时间)对纤维素液化行为的影响
在亚/超临界状态下,乙醇裂解产生H·以及HO·等自由基,随着反应时间的延长,四氯化碳抑制乙醇产生H·能力增强,乙醇吸收更多的热量,乙醇中C-C键增长,键能降低形成大分子中间物质也增多。因此,延长反应时间,对自由基浓度和活性均逐渐产生一定的影响。
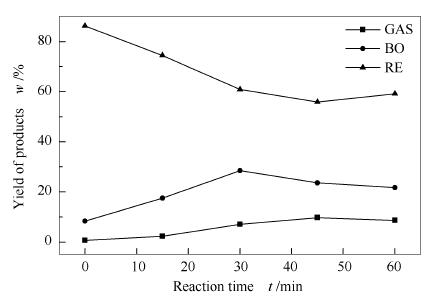
图 7是以玉米秸秆纤维素为原料,乙醇用量为100mL,捕捉剂四氯化碳用量在2mL,反应温度280℃,通过控制反应时间为0、15、30、45、60min改变H·被抑制的程度,即间接影响反应釜中H·活性,从而考察H·活性对纤维素液化产物分布的影响,实验过程压力值上升至8-10MPa。
由图 7可知,反应时间由0延长至60min时,气体产物收率由0增加至9.8%,纤维素在液化初期主要发生脱水、脱羰以及脱羧等反应,释放CO2、CH4、CO等小分子气体产物[19],同时延长反应时间,四氯化碳活性增强,与H·相作用增强,液化生成大分子中间产物的同时,含氢气体小分子物质也增多,使得气体产物收率也有所上升。纤维素液化时间由0延长至30min时,固体残渣收率由86.3%降低至60.9%,生物油收率也由8.7%升高至28.5%,这主要是由于反应时间的延长,纤维素不断进行裂解液化反应,而且随着反应时间的延长,促进纤维素液化反应完全,转化为液体和气体产物[15];当继续延长反应时间至60min发现,固体残渣逐渐升高,生物油收率逐渐下降,这可能由于液化过程中四氯化碳、小分子化合物与H·之间的竞争反应加强,导致H·活性受到抑制,使得液化反应不完全,纤维素转化率下降。
2.2.2 不同H·浓度下纤维素液化产物固体残渣的FT-IR分析
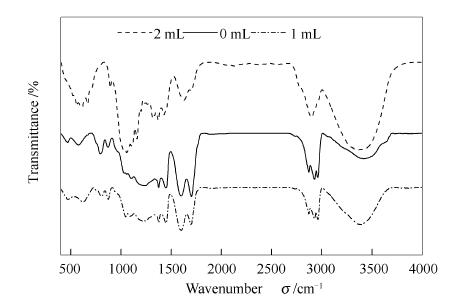
利用FT-IR对玉米秸秆纤维素在亚/超临界乙醇中液化产生的残渣进行定性分析,研究CCl4用量对秸秆纤维素液化的影响。玉米秸秆纤维素在反应温度280℃、反应时间60min下,分别选取了CCl4用量为0、1、2mL条件下秸秆纤维素液化产生的固体残渣进行FT-IR分析,具体见图 6。
由图 6可知,添加H·捕捉剂四氯化碳后纤维素-O-CH2中C-O在波长1060cm-1处振动峰逐渐加强,残渣中的糖苷键增多,这可能捕捉剂四氯化碳吸附了乙醇在亚/超临界状态下裂解产生H·自由基,抑制了纤维素在此处C-O键断裂,从而减缓进一步发生缩合、氧化等反应;残渣中-O-H(3300-3600cm-1)的振动峰逐渐增强,这时由于随着四氯化碳添加量增多,体系产生的H·、HO·、CH3·等中间自由基,减缓了纤维素中C-O-C、C-C等键断裂,氧化反应减弱,含羟基产物逐渐增多,形成酸类、醇类等液体和固体物质;1680-1715cm-1为-C=O振动吸收峰逐渐减弱,说明残渣中-C=O相对较少,主要是因为中间自由基与纤维素结构中C-O-C、C-C、-OH等键的有效碰撞减少,使得纤维素结构中多种键没有进一步断裂发生反应,抑制了纤维素进一步裂解液化形成酮类或醛类等含-C=O的物质,导致纤维素转化率及生物油收率有所降低,残渣量相应有所上升。
3 结 论
HO·捕捉剂水杨酸用量增加至3mL,生物油收率高达47.9%;液化温度升高至280℃,生物油收率最高达58.2%;水杨酸对气体产物有抑制作用。H·捕捉剂四氯化碳用量达2mL时,生物油收率由24.7%降低到20.7%;随着反应时间延长至60min,生物油收率先上升至28.5%后下降至22.1%;四氯化碳对气体产物生成有一定促进作用。
水杨酸用量增加,液化反应温度升高,促进乙醇释放更多的HO·,HO·浓度和活性均随之增强,乙醇自由基与秸秆纤维素、中间产物有效碰撞也逐渐增多,促使纤维素发生开环、脱水、脱羧、脱羰以及异构化等多种反应越完全,促进了纤维素的裂解液化,使得生物油的产率逐渐升高。
四氯化碳用量增多,捕捉H·能力增强,液化过程中四氯化碳、小分子化合物与H·之间的竞争作用随反应时间的延长而逐渐增强,致使H·活性减弱且浓度降低,减缓了秸秆纤维素发生缩合、环化、异构化等一系列裂解反应,生物油收率和纤维素转化率有一定降低。
-
-
[1]
陈晓菲. 稻秆粉末醇解产物的分析和醇解机理研究[D]. 武汉: 武汉科技大学, 2008.CHEN Xiao-fei. Analysis of the products from alkanolysis of the rice-stalk powder and related mechanism study[D]. Wuhan: Wuhan University of Science and Technology, 2008.
-
[2]
HIROIKU K, FUMIO K. Free radical behavior in thermal cracking reaction using petroleum oil and model compounds[J]. Catal Today, 1998, 43: 281-289. doi: 10.1016/S0920-5861(98)00157-6
-
[3]
黄金保, 刘朝, 魏顺安. 纤维素单体热解机理的热力学研究[J]. 化学学报, 2009,67,(18): 2081-2086. HUANG Jin-bao, LIU Chao, WEI Shun-an. Thermodynamic studies of pyrolysis mechanism of cellulose monomer[J]. Asta Chim Sin, 2009, 67(18): 2081-2086.
-
[4]
EDITA J, MATJAZ K, MATIJA S. Cellulose liquefaction in acidified ethylene glycol[J]. Cellulose, 2009, (16): 393-405.
-
[5]
HESSEIN M, KEAT T L, SUBHASH B, ABDUL R M. Sub/supercritical liquefaction of oil palm fruit press fiber for the production of bio-oil: Effect of solvent[J]. Bioresour Technol, 2010, 101: 7641-7647. doi: 10.1016/j.biortech.2010.04.072
-
[6]
陶红秀, 解新安, 郑朝阳, 汤成正, 战晓青. 玉米秸秆纤维素在亚/超临界乙醇中的液化行为研究[J]. 西北农林科技大学学报(自然科学版), 2014(01): 196-204. TAO Hong-xiu, XIE Xin-an, ZHENG Chao-yang, TANG Cheng-zheng, ZHAN Xiao-qing. Liquefaction of cornstalk cellulose in sub/super-critical ethanol[J]. J Northwest A & F Univ (Nat Sci Ed), 2014, (01): 196-204.
-
[7]
姚波, 朱彤, 林伟立. 二羟基苯甲酸的硅烷化及其在气质联用测量气相OH自由基的应用[J]. 环境化学, 2006,25,(6): 773-775. YAO Bo, ZHU Tong, LIN Wei-li. Silanization of DHBAs and measurement of gas phase hydroxyl radicals using Gas Chromatography-Mass Spectrometry[J]. Environ Chem, 2006, 25(6): 773-775.
-
[8]
周建政, 董华进. 用高效液相色谱-电化学检测器法检测Fenton反应中的羟自由基[J]. 中国药理学与毒理学杂志, 1995,9,(4): 299-302. ZHOU Jian-zheng, DONG Hua-jin. Determination of hydroxyl radical in fenton reaction by using high performance liquid chromatograph (HPLC) connected with electrochemical detector[J]. Chin J Pharmacol Toxicol, 1995, 9(4): 299-302.
-
[9]
RICHMOND R, HALLIWELL B. Formation of hydroxyl radicals from the paraquat radical cation, demonstrated by a highly specific gas chromatographic technique. the role of superoxide radical anion, hydrogen peroxide, and glutathione reductase[J]. J Inorg Biochem, 1982, 17(2): 95-107. doi: 10.1016/S0162-0134(00)80078-1
-
[10]
聂敏, 王琪, 邱桂花. 氢自由基捕捉剂对苯乙烯超声引发乳液聚合的影响[J]. 高分子学报, 2007(7): 633-637. NIE Min, WANG Qi, QIU Gui-hua. Effect of Hydrogen radical scavenger on ultrasonically initiated emulsion polymerization of styrene[J]. Acta Polym Sin, 2007, (7): 633-637.
-
[11]
郑朝阳, 解新安, 陶红秀, 郑璐丝, 李雁. 亚/超临界乙醇液化秸秆纤维素解聚反应研究与机理初探[J]. 燃料化学学报, 2012,40,(5): 526-532. ZHENG Chao-yang, XIE Xin-an, TAO Hong-xiu, ZHENG Lu-si, LI Yan. Depolymerization of stalk cellulose during its liquefaction in sub-and supercritical ethanol[J]. J Fuel Chem Technol, 2012, 40(5): 526-532.
-
[12]
SHARYPOV V I, KUZNETSOV B N. Catalytic hydroliquefaction of barzass liptobiolitic coal in a petroleum residue as a solvent[J]. Fuel, 2006, 85(7): 918-922.
-
[13]
PÜTÜN A E, ÖZCAN A, PÜTÜN E. Pyrolysis of hazelnut shells in a fixed-bed tubular reactor: Yields and structural analysis of bio-oil[J]. J Anal Appl Pyrolysis, 1999, 52(1): 33-49. doi: 10.1016/S0165-2370(99)00044-3
-
[14]
武景丽, 汪丛伟, 阴秀丽, 吴创之, 马隆龙, 周肇秋, 陈汉平. 基于TG-FTIR的生物油重质组分热解特性研究[J]. 太阳能学报, 2010,31,(1): 113-117. WU Jing-li, WANG Cong-wei, YIN Xiu-li, WU Chuang-zhi, MA Long-long, ZHOU Zhao-qiu, CHEN Han-ping. Study on pyrolysis of heavy fractions of bio-oil by using TG-FTIR analysis[J]. Acta Energ Sol Sin, 2010, 31(1): 113-117.
-
[15]
廖艳芬, 骆仲泱, 王树荣, 余春江, 岑可法. 纤维素快速热裂解机理试验研究Ⅰ.试验研究[J]. 燃料化学学报, 2003,31,(2): 133-138. LIAO Yan-fen, LUO Zhong-yang, WANG Shu-rong, YU Chun-jiang, CEN Ke-fa. Mechanism of fast pyrolysis of celluloseⅠ. Experimental research[J]. J Fuel Chem Technol, 2003, 31(2): 133-138.
-
[16]
陶红秀, 解新安, 汤成正, 田文广. 玉米秸秆纤维素在亚/超临界乙醇中液化形成酮类化合物的机理探讨[J]. 燃料化学学报, 2013,41,(1): 60-66. TAO Hong-xiu, XIE Xin-an, TANG Cheng-zheng, TIAN Wen-guang. Mechanism of ketones formation from cellulose liquefaction in sub-and supercritical ethanol[J]. J Fuel Chem Technol, 2013, 41(1): 60-66.
-
[17]
邵千钧, 彭锦星, 修树东, 文先红. 竹子在超临界甲醇中的热解油产物分析[J]. 太阳能学报, 2007,28,(9): 984-987. SHAO Qian-jun, PENG Jin-xing, XIU Shu-dong, WEN Xian-hong. Analysis of oil products by pyrolysis of bamboo in supercritical methanol[J]. Acta Energ Sol Sin, 2007, 28(9): 984-987.
-
[18]
SOARES S, RICARDO N M P S, JONES S, HEATLEY F. High temperature thermal degradation of cellulose in air studied using FT-IR and 1H and 13C solid-state NMR[J]. Eur Polym J, 2001, 37(4): 737-745. doi: 10.1016/S0014-3057(00)00181-6
-
[19]
GUO Z, BAI Z, BAI J, WANG Z, LI W. Co-liquefaction of lignite and sawdust under syngas[J]. Fuel Process Technol, 2011, 92(1): 119-125. doi: 10.1016/j.fuproc.2010.09.014
-
[1]
-
图 3 水杨酸用量对纤维素液化固体残渣的FT-IR谱图
Figure 3 FT-IR spectra of solid residues obtained for cellulose liquefaction with different amounts of salicylic acid in 100mL ethanol under 11-12MPa and 320℃ for 60min
(absorption peak[12-14]: 1060-1160cm-1 C-O; 1710-1770cm-1 -COOH; 1680-1715cm-1 -C=O; 3300-3600cm-1 -O-H)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:







 下载:
下载:

