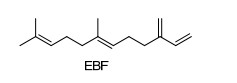
 图 1
(E)-β-farnesene的结构
Figure 1.
Structure of (E)-β-farnesene
图 1
(E)-β-farnesene的结构
Figure 1.
Structure of (E)-β-farnesene

Citation: Zhang Jingpeng, Qin Yaoguo, Li Xinlu, Song Dunlun, Liu Junjie, Yang Xinling. Design, Synthesis and Biological Activity of (E)-β-Farnesene Analogues Containing Imidogen[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 987-995. doi: 10.6023/cjoc201611028

含亚胺基 (E)-β-Farnesene类似物的设计、合成及生物活性研究
English
Design, Synthesis and Biological Activity of (E)-β-Farnesene Analogues Containing Imidogen
-
Key words:
- EBF analogues
- / imidogen
- / synthesis
- / repellent activity
- / insecticidal activity
- / structure-activity relationship
-
蚜虫是地球上最具破坏性的害虫之一, 其以尖利的口器刺吸植物汁液引起植物营养恶化, 甚至落叶、萎蔫, 而且它还能传播多种植物病毒, 造成严重的经济损失[1, 2].随着传统杀虫剂的抗性、对非靶标生物危害以及环境毒性等问题日益突出, 开发新颖蚜虫控制剂迫在眉睫.
当被天敌捕食时, 蚜虫会分泌报警信息素对同种其它个体产生报警反应, 使其停止取食, 迅速逃离危害现场[3]. Bowers[4]及Edwards[5]研究小组分别分离、鉴定出蚜虫报警信息素主要成分是反-β-法尼烯 (E-β-farnesene, 简称EBF)(图 1).除了报警活性外, EBF对蚜虫还具有其它多重生物活性[6~10].虽然EBF具有多种优异生物活性, 但其分子结构中存在不稳定的共轭双键, 使EBF易挥发、在空气中易氧化, 这些缺陷大大限制了其在害虫防治中的应用.所以, 国内外众多研究人员[11~15]对EBF结构进行了修饰和改造, 期望发现活性与稳定性兼备的EBF类似物.
本课题组针对EBF的结构改造进行了大量工作, 所设计的EBF类似物结构主要有两种类型, 一类是芳香环与EBF骨架以酯基或酰胺键的方式连接, 如含酰胺基的EBF类似物、含酯基的EBF类似物[16~18]; 另一类是EBF骨架通过亚甲基直接连接到杂环上, 例如各类含呋喃环、噻唑环、三嗪环等不同杂环取代的EBF类似物[18, 19].这些化合物不但对蚜虫表现出较好的驱避活性, 而且稳定性大大提高, 适宜田间使用, 这证明了将EBF的不稳定共轭双键环化为芳香环的设计思路是可行的.
生物电子等排是新农药分子设计的一种重要方法, 作者曾用CH2的电子等排体NH替换其中与苯环相连的亚甲基, 设计了新型的EBF类似物[20], 结果表明:苯环上含卤素取代的化合物驱避活性较高.基于上述结果, 为了进一步研究含不同类型芳香环的亚胺基EBF类似物的结构活性关系规律, 本文设计了以下三类目标化合物: (1) 含卤素相关基团取代的苯环EBF类似物, (2) 含不同芳香杂环的EBF类似物, (3) 含叔丁基的非环EBF类似物.同时对目标物的合成路线进行了优化和选择, 对合成的19个EBF类似物进行了驱避活性和杀蚜活性的筛选, 期望发现高活性的蚜虫控制剂, 目标物的合成路线见Scheme 1.
1 结果与讨论
1.1 目标物的合成讨论
芳胺与卤代烷烃的N-烷基化反应是一类比较常见的反应, 一般在常规条件下即可进行, 但存在芳胺N上二取代的副反应[21, 22], 收率比较低.我们前期针对此反应进行了系统的研究, 探索出一条最优化路线: 1 equiv. K2CO3缚酸剂、0.1 equiv. KI催化剂、乙腈作溶剂、添加3 equiv.的DDAO在25 ℃下反应4 h[20].采用此条路线 (Route 1) 制备目标物3的过程中, 发现不同的胺活性差异较大, 结果见表 1.
Compd. 
Base T/℃ Yield/% 3a t-Bu K2CO3 25 44 3b 2-Naphthyl K2CO3 25 77 3c 3-Cl-C6H4 K2CO3 25 65 3d 3-F-C6H4 K2CO3 25 75 3e 3-CF3-C6H4 K2CO3 25 62 3f 2-CF3-C6H4 NaOH Reflux 50 3g 4-CF3-C6H4 NaOH Reflux 57 3h 4-CF3O-C6H4 K2CO3 25 76 3i 6-Me-pyridin-2-yl NaOH Reflux 49 3j 5-Me-thiazol-2-yl NaOH Reflux 43 3k Benzothiazol-2-yl NaOH Reflux 52 3l Pyridin-2-yl NaOH Reflux 23 3q Thiazol-2-yl NaOH Reflux 0 表 1 胺与香叶基氯2的N-烷基化反应条件
Table 1. N-Alkylation conditions between 2 and amine从表 1数据可知, 采用此方法成功制备出目标物3a~3e和3h, 收率44%~77%;但是对强吸电子基取代的苯胺 (3f, 3g) 和杂环胺来说, 在上述条件下, 基本没有反应发生, 通过改变反应条件, 最终发现只有在强碱 (NaOH) 作缚酸剂和回流的反应条件下, 才能以稳定的收率 (43%~57%) 得到3f~3g和3i~3k.之所以出现这种反应活性的差异, 是由于该反应属于SN2亲核取代反应, 三氟甲基的强吸电子效应使得取代苯胺的N上电子云密度显著降低, 其亲核性减弱, 反应不易发生, 只有采取强的反应条件 (NaOH为缚酸剂和乙腈中回流), 增加其亲核活性, 才能使反应进行; 即使在上述强反应条件下 (NaOH为缚酸剂和乙腈中回流), 2-氨基吡啶相应的产物3l的收率仅为23%, 而2-氨基噻唑不反应, 这是因为噻唑环和吡啶环都是缺电子的芳环, 再加上杂环上N原子电负性比较大, 存在吸电子诱导效应, 使得氨基N上电子云密度极低, 很难发生亲核取代反应.
对于其余杂环类似物3l~3s的合成, 采用杂环胺和香叶醛4加成消除, 然后还原胺化.一般此类还原反应中常用的还原剂为硼氢化钠, 但本反应中的香叶醛4结构特殊, 是一种α, β-不饱和醛, 会存在硼氢化钠将α, β-不饱和双键还原的副反应.而氰基硼氢化钠是一种温和的还原剂, 选择性好, 对α, β-不饱和双键无影响, 可以实现一锅反应制备目标物[23].目标物3l~3s通过此条路线 (Route 2) 可以顺利制得, 结果见表 2. 3l~3s的收率为34%~78%, 其中3l, 3q的收率显著提高, 分别为78%和73%.此外, 针对第一种方法收率较低的化合物3f和3j, 采用还原胺化的方法收率分别由50%和43%提高至81%和68%. 3p的收率仅为34%, 这可能是由于2-氨基嘧啶环上有两个N原子, 吸电子诱导效应较强, 造成其反应活性较差. 3m、3n、3o的产率依次为72%、66%和45%, 这可能是由于取代基甲基的空间位阻造成的.随着甲基越来越靠近吡啶环上的氨基, 反应活性逐渐减弱.

Compd. 
Time/h Yield/% 3f 2-CF3-C6H4 1 81 3j 5-Me-thiazol-2-yl 1 68 3l Pyridin-2-yl 1 78 3m 5-Me-pyridin-2-yl 0.5 72 3n 4-Me-pyridin-2-yl 0.5 66 3o 3-Me-pyridin-2-yl 1 45 3p Pyrimidin-2-yl 2 34 3q Thiazol-2-yl 1 73 3r 5-Pr-(1, 3, 4-thiadiazol)-2-yl 1 61 3s 5-Me-(1, 3, 4-thiadiazol)-2-yl 1 51 表 2 胺与香叶醛4的还原胺化反应条件
Table 2. Reductive amination conditions between 4 and amine1.2 目标物的结构表征与稳定性分析
以目标物3o为例, 对其进行图谱解析.
1.3 目标物的生物活性
1.2.1 核磁氢谱
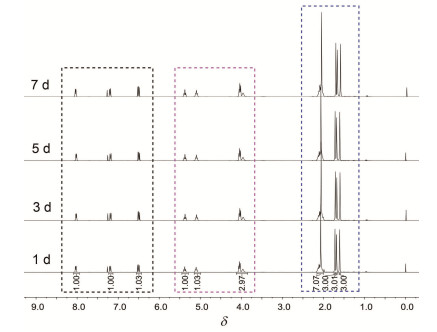
在1H NMR中 (图 3), 吡啶环上的C-12, C-13和C-14各有一个氢, 它们均受到两个异碳上H的偶合作用而裂分为dd峰. C-13上的H受到相邻两个碳上的氢的偶合作用, dd峰的两个偶合常数应该相近, 化学位移δ在6.49, 偶合常数为7.02和5.16 Hz; C-14上的H受到N原子的作用向低场移动, 化学位移δ在8.02, 偶合常数为5.04和1.14 Hz; C-12上的氢的化学位移δ在7.17, 偶合常数为7.11和0.87 Hz. C-4与C-9上的H受到相邻的亚甲基及远程偶合作用均裂分为多重峰, C-4化学位移δ在5.07~5.11之间, C-9化学位移δ在5.35~5.39之间. C-10上的H因受到相邻的C-9上的H及NH的影响化学位移δ在4.04左右, 裂分为三重峰, 偶合常数为4.95 Hz. NH上的H为一个宽单峰, 化学位移δ在3.97. C-5和C-6两个亚甲基由于裂分叠加在一起, 为多重峰, 化学位移δ在2.02~2.12. C-15是与吡啶环相连的甲基, 为一个单峰, 化学位移δ在2.07. C-1, C-2和C-7均为甲基, 它们的氢处于高场, 化学位移δ在1.67附近, 为单峰.
1.2.2 核磁碳谱
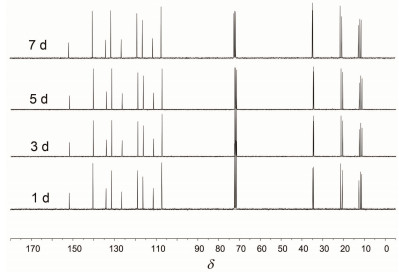
在13C NMR中 (图 4), 饱和碳共有7个, 化学位移δ分别为11.3, 11.9, 12.6, 20.6, 21.4, 34.5, 34.7;双键碳共有9个, 化学位移δ分别为107.3, 111.4, 116.4, 119.0, 126.5, 131.5, 134.0, 140.4, 151.8.
1.2.3 化合物稳定性分析
采用核磁手段对目标物稳定性进行初步研究. 3o被筛选作为代表化合物, 将其溶解在CDCl3中, 然后在室温条件下将其放置在自然光下, 分别在第1 d, 3 d, 5 d, 7 d的相应时间相继测试3o的1H NMR和13C NMR. 图 3是化合物1H NMR谱的变化图, 可以看出既没有质子信号的消失也没有新质子信号的出现, 并且质子数目保持不变. 图 4为化合物13C NMR谱的变化图, 前后4次测试的13C NMR谱的C信号的化学位移没有任何变化, 各个C之间的信号强弱也完全一致.上述分析表明, 目标化合物具有良好的稳定性.
1.3.2 杀虫活性
目标化合物、先导化合物和对照药剂对桃蚜的毒杀活性数据见表 3.生物活性测试结果 (200 μg/mL, 48 h) 显示, 所有目标化合物表现出较好的杀蚜活性, 其中绝大部分化合物的活性比先导EBF (致死率58.8%) 高或相当, 尤其是化合物3i、3l、3r和3s活性突出, 致死率分别为70.7%、72.6%、70.4%和75.5%.但是所有化合物的活性都低于对照药剂吡蚜酮 (致死率87.1%).从表 3数据可以看出, 不同的芳环表现出不同的活性:其中苯环连接的类似物除了3f之外活性均低于先导EBF, 而其它杂环连接的类似物活性均高于先导EBF, 其中以吡啶环和5-甲基-1, 3, 4-噻二唑环连接的类似物3l和3s活性最突出.
本文研究结果表明, 部分目标化合物兼具驱避和杀虫活性, 以连接吡啶环的化合物3l效果最优.这说明EBF的结构在引入芳香环代替不稳定共轭双键的修饰过程中仍然保留了对蚜虫的驱避活性, 而同时提高了对蚜虫的毒杀活性.类似物的稳定性也比EBF有很大提高, 具有更长的持效期.此外, 与吡蚜酮或传统杀虫剂相比, 这些类似物对生态环境更友好.因此, 本文所设计发现的高活性类似物有望代替一些传统杀虫剂用于蚜虫的综合治理.
1.3.1 驱避活性
以桃蚜为对象, 在5 μg剂量下测试了目标化合物的驱避活性, 结果见表 3.从表 3可以看出, 目标物对桃蚜表现出较好的驱避活性, 其中以含苯环或吡啶环的类似物3f、3g、3h、3l、3m和3q最为显著, 驱避率分别为58.7%、62.0%、53.1%、62.5%、64.6%和57.4%.虽然目标物驱避活性不及先导化合物EBF (87.4%), 但稳定性得到提高.前期报道的含噻唑环、三嗪环等杂环的EBF类似物[18, 19], 它们的结构是EBF通过亚甲基与杂环相连, 而本文的目标物是通过亚甲基的电子等排体NH将EBF与不同的芳环连接得到, 化合物的活性得到提高, 这证明了化合物设计思路的可行性.出现这一结果可能是由于结构不同造成化合物的状态有所差异, 本文高活性目标物均是可流动的液体, 比前期[18]报道的含杂环EBF类似物 (固体) 表现出更佳挥发性.比如本文的化合物3r和3s分别是粘稠的油状液体和固体 (表 3), 其驱避活性分别是31.5%和20.2%, 活性显著低于液状的3l和3m, 针对这一有趣的现象, 我们正在进行深入研究.此外, 叔丁基取代共轭双键的非环类似物3a的驱避活性很低, 说明共轭双键用含共轭性基团替代对驱避活性保持至关重要.
 表 3
目标化合物的驱避及杀虫活性 (桃蚜)a
Table 3.
Repellent and insecticidal activity of target compounds (Myzus persicae)
表 3
目标化合物的驱避及杀虫活性 (桃蚜)a
Table 3.
Repellent and insecticidal activity of target compounds (Myzus persicae)
Compd. Appearance Repellent rateb/% Mortalityc/% 3a Yellow liquid 18.9±1.6 56.6±1.8 3b Yellow liquid 38.2±3.9 67.9±4.9 3c Yellow liquid 40.8±1.8 51.9±4.9 3d Yellow liquid 42.8±1.3 32.4±1.5 3e Yellow liquid 48.7±3.7 45.9±4.3 3f Yellow liquid 58.7±5.7 65.7±4.2 3g Yellow liquid 62.0±1.5 56.2±2.1 3h Yellow liquid 53.1±2.3 55.1±2.5 3i Yellow liquid 37.1±3.2 70.7±1.5 3j Yellow liquid 42.8±2.2 66.0±2.8 3k Yellow liquid 36.4±2.2 63.9±4.9 3l Yellow liquid 62.5±4.0 72.6±2.0 3m Yellow liquid 64.6±1.7 68.8±2.0 3n Yellow liquid 36.9±2.7 61.2±1.9 3o Yellow liquid 43.6±2.3 63.7±5.6 3p Yellow liquid 34.9±5.9 67.5±1.3 3q Yellow liquid 57.4±0.4 69.7±2.4 3r Yellow oil 31.5±5.7 70.4±0.7 3s White solid 20.2±2.2 75.5±0.6 EBF Colorless liquid 87.4±2.3 58.8±2.9 PYd White solid — 87.1±2.1 a Average of three replicates.b Repellent activity was tested at a dose of 5μg. c Aphicidal activity was tested at a concentration of 200 μg/mL. dPY: Pymetrozine was used as a positive control. 表 3 目标化合物的驱避及杀虫活性 (桃蚜)a
Table 3. Repellent and insecticidal activity of target compounds (Myzus persicae)2 结论
采用香叶基氯与不同胺的N-烷基化反应和香叶醛与芳香胺的还原胺化反应两种路线合成了19个EBF类似物.所有化合物结构通过1H NMR、13C NMR及HRMS确证, 并且运用核磁手段分析验证了化合物的稳定性.生物活性测试结果表明, 目标物不但对桃蚜具有较好的驱避活性, 而且表现出一定的毒杀活性, 以化合物3l效果最优, 驱避率和致死率分别为62.5%和72.6%.构效关系显示含苯环或吡啶环的EBF类似物驱避活性突出, 含1, 3, 4-噻二唑环的EBF类似物杀蚜活性明显, 非环的EBF类似物驱避和杀蚜活性均不明显.这些结果对进一步的蚜虫控制剂研究具有重要的指导意义.
3 实验部分
3.1 仪器与试剂
Bruker DPX 300MHz核磁共振仪 (以TMS为内标, CDCl3为溶剂); Bruker APEX Ⅳ傅立叶变换高分辨质谱; PerkinElmer Spectrum 100 FT-IR红外光谱仪 (液膜法).本实验所用柱层析硅胶 (200~300目) 和薄层板均为青岛海洋化工有限公司生产; 取代苯胺均购自北京偶合科技有限公司或百灵威化学技术有限公司.所用试剂均为市售分析纯或化学纯试剂, 除特别注明外, 所用溶剂未经无水处理.
3.2 中间体的制备
香叶基氯 (2) 以香叶醇和三氯化磷为原料, 参照文献[15]方法制备香叶基氯 (2), 产率82.8%(文献产率84.6%).
香叶醛 (4) 的制备:在250 mL三口瓶中加入香叶醇15.6 g (0.1 mol) 和100 mL二氯甲烷, 搅拌条件下分批次加入戴斯马丁试剂63.6 g (0.15 mol), 继续常温搅拌反应, 薄层色谱 (TLC) 检测香叶醛反应完毕后, 缓慢滴加饱和碳酸氢钠溶液淬灭反应, 抽滤除去固体, 滤液用二氯甲烷萃取两次, 合并有机相, 无水硫酸钠干燥, 浓缩, 柱层析[V(石油醚):V(乙酸乙酯)=10:1]得黄色液体13.6 g, 收率88%.
3.3 目标物的制备
3.4 目标物生物活性测定
采用T管法测定目标化合物驱避活性, 测试所用供试昆虫为桃蚜 (Myzus persicae), 测定方法及测定浓度参照文献[19, 24]进行.
目标化合物杀蚜虫活性测定所用供试昆虫为桃蚜 (Myzus persicae), 采用浸叶法[25]对供试昆虫进行初筛, 测定浓度标准参考文献[20]及《农药生物活性测定标准操作规范 (SOP)》, 48 h后观察记录蚜虫的死亡情况.
校正死亡率 (%)=(样品死亡率-空白对照死亡率)/(1-空白对照死亡率)×100%
空白对照死亡率小于5%可不必校正, 大于20%为无效试验.
辅助材料(Supporting Information) 目标化合物的IR、1H NMR和13C NMR谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.3.2 N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-2-氨基-苯并噻唑 (3k) 的制备
向50 mL三口瓶中依次加入0.45 g (3 mmol) 2-氨基-苯并噻唑、0.06 g (0.3 mmol) 碘化钾、0.12 g (3 mmol) 氢氧化钠、6.87 g (9 mmol) 30%的十二烷基二甲基氧化胺和20 mL乙腈, 搅拌溶解均匀.然后向反应体系中加入0.53 g (3 mmol) 香叶基氯, 加热回流反应4 h.反应结束后加水洗涤, 二氯甲烷萃取, 无水硫酸钠干燥有机相, 浓缩, 柱层析纯化[V(石油醚):V(乙酸乙酯)=6:1], 得黄色液体0.45 g. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.74 (s, 3H, CH3C), 2.03~2.12 (m, 4H, CCH2CH2C), 4.01 (d, J=6.87 Hz, 2H, CH2N), 5.07 (d, J=6.54 Hz, 1H, CH=C), 5.35~5.42 (m, 1H, CH=C), 7.05~6.10 (m, 1H, Ar-H), 7.26~7.32 (m, 1H, Ar-H), 7.53~7.60 (m, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.1, 17.4, 25.3, 26.0, 39.2, 43.0, 118.3, 119.2, 120.4, 121.0, 123.5, 125.5, 130.1, 131.5, 140.4, 152.1, 167.4; IR (KBr) ν: 2922, 1738, 1613, 1550, 1447, 1366, 1217, 750 cm-1; HRMS calcd for C17H23N2S (M+H)+: 287.1576, found 287.1581.
同法制得3f、3g、3i、3j.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-2-三氟甲基苯胺 (3f):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.61 (s, 3H, CH3C), 1.69 (s, 3H, CH3C), 1.72 (s, 3H, CH3C), 2.07~2.13 (m, 4H, CCH2CH2C), 3.75 (d, J=6.51 Hz, 2H, CH2N), 4.28 (s, 1H, NH), 5.06~5.10 (m, 1H, CH=C), 5.31~5.36 (m, 1H, CH=C), 6.68~6.73 (m, 2H, Ar-H), 7.34~7.44 (m, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.3, 25.3, 26.0, 39.1, 41.3, 111.6, 115.3, 120.4, 123.4, 126.2 (q, JC-F=5.45 Hz), 126.7, 131.4, 132.7, 137.6, 139.6, 145.4; IR (KBr) ν: 3468, 2968, 2921, 2855, 1615, 1520, 1289, 1103, 749 cm-1; HRMS calcd for C17H23F3N (M+H)+: 298.1777, found 298.1780.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-4-三氟甲基苯胺 (3g):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.61 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.72 (s, 3H, CH3C), 2.03~2.12 (m, 4H, CCH2CH2C), 3.73 (d, J=6.63 Hz, 2H, CH2N), 5.06~5.10 (m, 1H, CH=C), 5.28~5.32 (m, 1H, CH=C), 6.59 (d, J=8.52 Hz, 2H, Ar-H), 7.40 (d, J=7.92 Hz, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.3, 25.3, 26.1, 39.1, 41.2, 111.5, 120.4, 123.5, 126.2 (q, JC-F=3.77 Hz), 131.4, 138.0, 139.5, 143.1, 150.4; IR (KBr) ν: 2970, 2928, 1738, 1652, 1376, 1324, 1227, 1121, 850 cm-1; HRMS calcd for C17H23F3N (M+H)+: 298.1777, found 298.1779.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-6-甲基-2-氨基吡啶 (3i):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.70 (s, 3H, CH3C), 2.03~2.10 (m, 4H, CCH2CH2C), 2.36 (s, 3H, CH3Py), 3.79 (t, J=5.91 Hz, 2H, CH2N), 4.45 (br-s, 1H, NH), 5.06 (d, J=6.75 Hz, 1H, CH=C), 5.29~5.33 (m, 1H, CH=C), 6.18 (d, J=8.31 Hz, 1H, Py-H), 6.44 (d, J=7.29 Hz, 1H, Py-H), 7.33 (t, J=7.77 Hz, 1H, Py-H); 13C NMR (CDCl3, 75 MHz) δ: 11.3, 12.6, 19.2, 20.6, 21.4, 34.4, 35.4, 97.5, 107.1, 116.1, 118.8, 126.6, 132.8, 134.0, 151.9, 153.5; IR (KBr) ν: 3391, 2968, 2923, 2856, 1599, 1462, 1376, 1228, 777 cm-1; HRMS calcd for C16H25N2 (M+H)+: 245.2012, found 245.2016.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-5-甲基-2-氨基噻唑 (3j):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.70 (s, 3H, CH3C), 2.01~2.11 (m, 4H, CCH2CH2C), 2.28 (d, J=1.11 Hz, 3H, CH3-Thiazole), 3.81 (d, J=6.54 Hz, 2H, CH2N), 5.08 (t, J=6.72 Hz, 1H, CH=C), 5.28~5.32 (m, 1H, CH=C), 6.74 (d, J=1.23 Hz, 1H, Thiazole-H); 13C NMR (CDCl3, 75 MHz) δ: 11.6, 16.1, 17.3, 25.3, 26.0, 39.1, 43.4, 119.5, 120.3, 123.5, 131.4, 134.9, 139.9, 169.0; IR (KBr) ν: 3217, 2967, 2921, 1737, 1448, 1376, 1219, 834 cm-1; HRMS calcd for C14H23N2S (M+H)+: 251.1576, found 251.1575.
3.3.1 N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-2-萘胺 (3b) 的制备
向50 mL三口瓶中依次加入1.60 g (9 mmol) 2-萘胺、0.06 g (0.3 mmol) 碘化钾、0.42 g (3 mmol) 碳酸钾、6.87 g (9 mmol) 30%的十二烷基二甲基氧化胺和20 mL乙腈, 搅拌溶解均匀.然后向反应体系中缓慢滴加0.53 g (3 mmol) 香叶基氯, 常温下反应4 h.反应结束后加水洗涤, 二氯甲烷萃取, 无水硫酸钠干燥有机相, 浓缩, 柱层析纯化[V(石油醚):V(乙酸乙酯)=30:1], 得黄色液体0.65 g. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.75 (s, 3H, CH3C), 2.03~2.16 (m, 4H, CCH2CH2C), 3.80 (d, J=6.66 Hz, 2H, CH2N), 5.08~5.12 (m, 1H, CH=C), 5.37~5.42 (m, 1H, CH=C), 6.81 (d, J=2.25 Hz, 1H, Ar-H), 6.87 (dd, J=8.25 Hz, 1H, 2.32Hz, Ar-H), 7.18 (td, J=7.96, 1.08 Hz, 1H, Ar-H), 7.35 (td, J=6.90, 1.25 Hz, 1H, Ar-H), 7.60~7.67 (m, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.1, 17.4, 25.4, 26.2, 39.3, 41.7, 104.2, 117.8, 121.0, 121.6, 123.7, 125.6, 126.0, 127.2, 127.3, 128.5, 131.4, 135.0, 139.0, 145.8; IR (KBr) ν: 3408, 2923, 1738, 1630, 1520, 1473, 1375, 1225, 827 cm-1; HRMS calcd for C20H26N (M+H)+: 280.2060, found 280.2066.
同法制得3a、3c~3e、3h.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-叔丁基胺 (3a):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.09 (s, 9H, (CH3)3C), 1.55 (s, 3H, CH3C), 1.60 (s, 3H, CH3C), 1.63 (d, J=0.75 Hz, 3H, CH3C), 1.95~2.03 (m, 4H, CCH2CH2C), 3.13 (d, J=6.75 Hz, 2H, CH2N), 5.03~5.07 (m, 1H, CH=C), 5.20~5.25 (m, 1H, CH=C); 13C NMR (CDCl3, 75 MHz) δ: 11.1, 12.5, 20.5, 21.4, 23.8, 34.5, 35.1, 45.4, 118.1, 119.1, 126.3, 132.2; IR (KBr) ν: 2970, 1738, 1441, 1365, 1227, 1217, 527 cm-1; HRMS calcd for C14H28N (M+H)+: 210.2216, found 210.2215.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-3-氯苯胺 (3c):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.61 (s, 3H, CH3C), 1.69 (s, 3H, CH3C), 1.71 (s, 3H, CH3C), 2.05~2.13 (m, 4H, CCH2CH2C), 3.68 (d, J=6.60 Hz, 2H, CH2N), 5.07~5.11 (m, 1H, CH=C), 5.29~5.33 (m, 1H, CH=C), 6.46~6.67 (m, 3H, Ar-H), 7.04~7.10 (m, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.1, 17.4, 25.3, 26.1, 39.2, 41.5, 110.9, 112.1, 116.7, 120.6, 123.6, 129.7, 131.4, 134.6, 139.2, 149.2; IR (KBr) ν: 3419, 2923, 1737, 1598, 1499, 1375, 1076, 762 cm-1; HRMS calcd for C16H23ClN (M+H)+: 264.1514, found 264.1514.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-3-氟苯胺 (3d):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.71 (s, 3H, CH3C), 2.04~2.11 (m, 4H, CCH2CH2C), 3.85 (t, J=5.88 Hz, 2H, CH2N), 4.44 (brs, 1H, NH), 5.07 (d, J=6.78 Hz, 1H, CH=C), 5.29~5.34 (m, 1H, CH=C), 6.37 (d, J=8.40 Hz, 1H, Py-H), 6.56~6.58 (m, 1H, Py-H), 7.41 (td, J=8.70, 1.89 Hz, 1H, Py-H), 8.07 (t, J=4.05 Hz, 1H, Py-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.3, 25.3, 26.1, 39.2, 39.9, 106.2, 112.3, 120.8, 123.6, 131.3, 137.0, 138.8, 147.8, 158.5; IR (KBr) ν: 2970, 1738, 1620, 1434, 1365, 1229, 1217, 755 cm-1; HRMS calcd for C16H23FN (M+ H)+: 248.1809, found 248.1811.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-3-三氟甲基苯胺 (3e):黄色液体.1H NMR (CDCl3, 300 MHz) δ: 1.61 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.72 (s, 3H, CH3C), 2.06~2.12 (m, 4H, CCH2CH2C), 3.72 (d, J=6.45 Hz, 2H, CH2N), 5.06~5.11 (m, 1H, CH=C), 5.29~5.33 (m, 1H, CH=C), 6.72~6.93 (m, 3H, Ar-H), 7.22~7.27 (m, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.3, 25.3, 26.1, 39.2, 41.4, 110.8 (q, JC-F=3.94 Hz), 113.2 (q, JC-F=3.88 Hz), 115.5, 120.4, 120.8, 123.5, 129.1, 131.0, 131.4, 139.4, 148.2; IR (KBr) ν: 3421, 2970, 2920, 1739, 1615, 1365, 1217, 1121, 780 cm-1; HRMS calcd for C17H23F3N (M+H)+: 298.1777, found 298.1775.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-4-三氟甲氧基苯胺 (3h):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.70 (s, 3H, CH3C), 2.02~2.11 (m, 4H, CCH2CH2C), 3.68 (d, J=6.60 Hz, 2H, CH2N), 5.06~5.10 (m, 1H, CH=C), 5.29~5.33 (m, 1H, CH=C), 6.55 (d, J=8.94 Hz, 2H, Ar-H), 7.03 (d, J=8.37 Hz, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.3, 25.3, 26.1, 39.2, 41.8, 112.7, 120.8, 122.0, 123.5, 131.4, 139.1, 140.0, 146.9; IR (KBr) ν: 2920, 2852, 1613, 1515, 1258, 1223, 1002, 829 cm-1; HRMS calcd for C17H23F3NO (M+H)+: 314.1726, found 314.1729.
3.3.3 N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-2-氨基-噻唑 (3q) 的制备
向50 mL三口瓶中依次加入1.00 g (10 mmol) 2-氨基噻唑、香叶醛0.76 g (5 mmol)、无水氯化锌0.14 g (1 mmol) 和15 mL甲醇, 常温搅拌反应10 min.然后向反应体系中分批次加入氰基硼氢化钠0.32 g (5 mmol), 常温下搅拌反应, TLC检测至反应完毕.加入饱和碳酸氢钠溶液淬灭反应, 过滤, 滤液用二氯甲烷萃取两次, 合并有机相, 无水硫酸钠干燥, 真空浓缩, 柱层析纯化[V(石油醚):V(乙酸乙酯)=6:1], 得黄色液体[23]0.87 g. 1H NMR (CDCl3, 300 MHz) δ: 1.59 (s, 3H, CH3C), 1.67 (s, 3H, CH3C), 1.70 (s, 3H, CH3C), 2.01~2.11 (m, 4H, CCH2CH2C), 3.82 (d, J=6.75 Hz, 2H, CH2N), 5.05~5.09 (m, 1H, CH=C), 5.30~5.35 (m, 1H, CH=C), 6.30 (brs, 1H, NH), 6.44 (d, J=3.66 Hz, 1H, Thiazole-H), 7.09 (d, J=3.63 Hz, 1H, Thiazole-H); 13C NMR (CDCl3, 75 MHz) δ: 11.3, 12.6, 20.6, 21.3, 34.4, 38.8, 101.0, 114.6, 118.8, 126.7, 133.8, 135.2, 165.7; IR (KBr) ν: 2970, 1738, 1436, 1366, 1228, 1217, 896 cm-1; HRMS calcd for C13H22N2S (M+H)+: 237.1420, found 237.1424.
同法制得3l~3p、3r、3s.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-2-氨基吡啶 (3l):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.68 (s, 3H, CH3C), 1.71 (s, 3H, CH3C), 2.04~2.11 (m, 4H, CCH2CH2C), 3.85 (t, J=5.88 Hz, 2H, CH2N), 4.44 (brs, 1H, NH), 5.07 (d, J=6.78 Hz, 1H, CH=C), 5.29~5.34 (m, 1H, CH=C), 6.37 (d, J=8.40 Hz, 1H, Py-H), 6.56~6.58 (m, 1H, Py-H), 7.41 (td, J=8.70, 1.89 Hz, 1H, Py-H), 8.07 (t, J=4.05 Hz, 1H, Py-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.3, 25.3, 26.1, 39.2, 39.9, 106.2, 112.3, 120.8, 123.6, 131.3, 137.0, 138.8, 147.8, 158.5; IR (KBr) ν: 2970, 1739, 1603, 1442, 1366, 1229, 1217, 770 cm-1; HRMS calcd for C15H22N3 (M+ H)+: 231.1856, found 231.1860.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-5-甲基-2-氨基吡啶 (3m):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.67 (s, 3H, CH3C), 1.70 (s, 3H, CH3C), 2.03~2.10 (m, 4H, CCH2CH2C), 2.17 (s, 3H, CH3Py), 3.82 (s, 2H, CH2N), 4.29 (brs, 1H, NH), 5.08 (t, J=6.69 Hz, 1H, CH=C), 5.31 (t, J=6.63 Hz, 1H, CH=C), 6.32 (d, J=8.40 Hz, 1H, Py-H), 7.23~7.27 (m, 1H, Py-H), 7.91 (s, 1H, Py-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.0, 17.3, 25.3, 26.1, 39.2, 40.2, 106.0, 121.0, 121.1, 123.6, 131.2, 138.0, 138.6, 147.3, 156.8; IR (KBr) ν: 2924, 1615, 1509, 1377, 1288, 1021, 811 cm-1; HRMS calcd for C16H25N2 (M+H)+: 245.2012, found 245.2011.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-4-甲基-2-氨基吡啶 (3n):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.59 (s, 3H, CH3C), 1.66 (s, 3H, CH3C), 1.69 (s, 3H, CH3C), 2.02~2.10 (m, 4H, CCH2CH2C), 2.21 (s, 3H, CH3Py), 3.82 (t, J=5.88 Hz, 2H, CH2N), 4.45 (brs, 1H, NH), 5.05~5.10 (m, 1H, CH=C), 5.28~5.33 (m, 1H, CH=C), 6.18 (s, 1H, Py-H), 6.39 (d, J=5.13 Hz, 1H, Py-H), 7.93 (d, J=5.22 Hz, 1H, Py-H); 13C NMR (CDCl3, 75 MHz) δ: 11.3, 12.6, 16.1, 20.6, 21.4, 34.4, 35.2, 101.8, 109.3, 116.1, 118.9, 126.6, 134.0, 142.7, 143.2, 154.0; IR (KBr) ν: 3256, 2969, 2923, 2855, 1738, 1615, 1376, 1217, 795 cm-1; HRMS calcd for C16H25N2 (M+H)+: 245.2012, found 245.2016.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-3-甲基-2-氨基吡啶 (3o):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.67 (s, 3H, CH3C), 1.71 (s, 3H, CH3C), 2.02~2.12 (m, 4H, CCH2CH2C and s, 3H, CH3Py), 3.97 ((brs, 1H, NH)), 4.04 (t, J=4.95 Hz, 2H, CH2N), 5.07~5.11 (m, 1H, CH=C), 5.35~5.39 (m, 1H, CH=C), 6.49 (dd, J=7.02, 5.16 Hz, 1H, Py-H), 7.17 (dd, J=7.11, 0.87 Hz, 1H, Py-H), 8.02 (dd, J=5.04, 1.14 Hz, 1H, Py-H); 13C NMR (CDCl3, 75 MHz) δ: 11.3, 11.9, 12.6, 20.6, 21.4, 34.5, 34.7, 107.3, 111.4, 116.4, 119.0, 126.5, 131.5, 134.0, 140.4, 151.8; IR (KBr) ν: 3452, 2969, 2920, 1738, 1601, 1470, 1376, 1217, 772 cm-1; HRMS calcd for C16H25N2 (M+H)+: 245.2012, found 245.2013.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-2-氨基嘧啶 (3p):黄色液体. 1H NMR (CDCl3, 300 MHz) δ: 1.60 (s, 3H, CH3C), 1.67 (s, 3H, CH3C), 1.70 (s, 3H, CH3C), 2.03~2.09 (m, 4H, CCH2CH2C), 3.99 (t, J=5.97 Hz, 2H, CH2N), 5.08 (brs, 1H, NH and s, 1H, CH=C), 5.32 (t, J=6.93 Hz, 1H, CH=C), 6.51 (t, J=4.83 Hz, 1H, Pyrimidine-H), 8.27 (d, J=4.77 Hz, 2H, Pyrimidine-H); 13C NMR (CDCl3, 75 MHz) δ: 16.0, 17.3, 25.3, 26.1, 39.2, 58.9, 109.9, 120.3, 123.2, 123.6, 131.3, 139.0, 157.6, 161.9; IR (KBr) ν: 3348, 2970, 2926, 1738, 1592, 1448, 1366, 1217, 801 cm-1; HRMS calcd for C14H22N3 (M+ H)+: 232.1808, found 232.1812.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-5-丙基-2-氨基-1, 3, 4-噻二唑 (3r):黄色油状液体. 1H NMR (CDCl3, 300 MHz) δ: 0.95 (t, J=7.32 Hz, 3H, CH3C), 1.55 (s, 3H, CH3C), 1.62 (s, 3H, CH3C), 1.65 (s, 3H, CH3C), 1.67~1.75 (m, CH2C), 1.99~2.06 (m, 4H, CCH2CH2C), 2.81 (t, J=7.41 Hz, 2H, CH2-Thiadiazole), 3.85 (d, J=6.69 Hz, 2H, CH2N), 5.03 (t, J=5.40 Hz, 1H, CH=C), 5.24~5.28 (m, 1H, CH=C), 6.16 (brs, 1H, NH); 13C NMR (CDCl3, 75 MHz) δ: 8.4, 11.3, 12.6, 18.0, 20.6, 21.2, 27.2, 34.3, 39.5, 114.5, 118.7, 126.6, 135.5, 154.3, 165.0; IR (KBr) ν: 3217, 2965, 2929, 2874, 1541, 1377, 1217, 748 cm-1; HRMS calcd for C15H26N3S (M+H)+: 280.1842, found 280.1842.
N-[(E)-3, 7-二甲基-2, 6-辛二烯-1-基]-5-甲基-2-氨基-1, 3, 4-噻二唑 (3s):白色固体. m.p. 57~58 ℃; 1H NMR (CDCl3, 300 MHz) δ: 1.50 (s, 3H, CH3C), 1.60 (s, 3H, CH3C), 1.65 (s, 3H, CH3C), 1.94~2.01 (m, 4H, CCH2CH2C), 2.45 (s, 3H, CH3-Thiadiazole), 3.81 (t, J=5.67 Hz, 2H, CH2N), 4.99 (d, J=5.49 Hz, 1H, CH=C), 5.22 (t, J=5.81 Hz, 1H, CH=C), 6.57 (brs, 1H, NH); 13C NMR (CDCl3, 75 MHz) δ: 10.6, 11.3, 12.6, 20.5, 21.2, 34.4, 39.4, 114.6, 118.7, 126.6, 135.3, 148.7, 165.4; IR (KBr) ν: 3375, 2969, 2924, 2855, 1544, 1438, 1217, 755 cm-1; HRMS calcd for C13H21N3S (M+H)+: 252.1529, found 252.1533.
-
-
[1]
唐平华, 陈国平, 朱明库, 任丽军, 胡宗利, 植物保护, 2013, 39, 5. doi: 10.3969/j.issn.0529-1542.2013.02.002Tang, P.-H.; Chen, G.-P.; Zhu, M.-K.; Ren, L.-J.; Hu, Z.-L. J. Plant Prot. 2013, 39, 5 (in Chinese). doi: 10.3969/j.issn.0529-1542.2013.02.002
-
[2]
Wang, G.-P.; Yu, X.-D.; Fan, J.; Wang, C.-S.; Xia, L.-Q. J. Integr. Plant Biol. 2015, 57, 770. doi: 10.1111/jipb.12319
-
[3]
Dahl, M. L. Dtsch. Ent. Z. 1971, 18, 121.
-
[4]
Bowers, W. S.; Nault, L. R.; Webb, R. E.; Dutky, S. R. Science 1972, 177, 1121. doi: 10.1126/science.177.4054.1121
-
[5]
Edwards, L.; Siddall, J.; Dunham, L. Nature 1973, 241, 126.
-
[6]
Mauchamp, B.; Pickett, J. J. Agronomie 1987, 7, 523. doi: 10.1051/agro:19870708
-
[7]
Van Oosten, A. M.; Gut, J.; Harrewijn, P.; Piron, P. G. M. Acta Phytopathol. Entomol. Hung. 1990, 25, 331.
-
[8]
Joachim, C.; Weisser, W. W. J. Chem. Ecol. 2015, 47, 267.
-
[9]
Joachim, C.; Hatano, E.; David, A.; Kunert, M.; Linse, C.; Weisser, W. W. J. Chem. Ecol. 2013, 39, 773. doi: 10.1007/s10886-013-0288-x
-
[10]
Griffiths, D. C.; Pickett, J. A. Entomol. Exp. Appl. 1980, 27, 199. doi: 10.1111/eea.1980.27.issue-2
-
[11]
Dawson, G. W.; Giffiths, D. C.; Pickett, J. A.; Plumb, R. T.; Woodcock, C. M.; Zhang, Z.-N. Pestic. Sci.. 1988, 22, l7. doi: 10.1002/ps.v22:1
-
[12]
Bowers, W. S.; Nishino, C.; Montgomery, M. E.; Nault, L. R. Insect Physiol. 1977, 23, 697. doi: 10.1016/0022-1910(77)90086-5
-
[13]
康铁牛, 凌云, 芮昌辉, 杨新玲, 范贤林, 陈馥衡, 有机化学, 2008, 28, 617. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract331967.shtmlKang, T.-N.; Ling, Y.; Rui, C.-H.; Yang, X.-L.; Fan, X.-L.; Chen, F.-H. Chin. J. Org. Chem. 2008, 28, 617 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract331967.shtml
-
[14]
李正名, 王天生, 么恩云, 陈学仁, 朱兰蕙, 王素华, 化学学报, 1987, 45, 1124. doi: 10.3321/j.issn:0251-0790.1987.12.022Li, Z.-M.; Wang, T.-S.; Me, E.-Y.; Chen, X.-R.; Zhu, L.-H.; Wang, S.-H. Acta Chim. Sinica 1987, 45, 1124 (in Chinese). doi: 10.3321/j.issn:0251-0790.1987.12.022
-
[15]
孙亮, 凌云, 王灿, 孙玉凤, 芮昌辉, 杨新玲, 有机化学, 2011, 31, 2061. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340892.shtmlSun, L.; Ling, Y.; Wang. C.; Sun, Y.-F.; Rui, C.-H.; Yang, X.-L. Chin. J. Org. Chem. 2011, 31, 2061 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340892.shtml
-
[16]
孙玉凤, 李永强, 凌云, 宇红莲, 杨绍祥, 杨新玲, 有机化学, 2011, 31, 1425. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340411.shtmlSun, Y.-F.; Li, Y.-Q.; Ling, Y.; Yu, H.-L.; Yang, S.-X.; Yang, X.-L. Chin. J. Org. Chem. 2011, 31, 1425 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340411.shtml
-
[17]
Sun, Y.-F.; Qiao, H.-L.; Ling, Y.; Yang, S.-X.; Rui, C.-H.; Paolo Pelosi; Yang, X.-L. J. Agric. Food Chem. 2011, 59, 2456. doi: 10.1021/jf104712c
-
[18]
秦耀果, 曲焱焱, 张景朋, 谭晓庆, 宋丽芳, 李文浩, 宋敦伦, 杨新玲, 有机化学, 2015, 35, 455. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344709.shtmlQin, Y.-G.; Qu, Y.-Y.; Zhang, J.-P.; Tan, X.-Q.; Song, L.-F.; Li, W.-H.; Song, D.-L.; Yang, X.-L. Chin. J. Org. Chem. 2015, 35, 455 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344709.shtml
-
[19]
Qin, Y.-G.; Zhang, J.-P.; Yang, X. L. Molecules 2016, 21, 825. doi: 10.3390/molecules21070825
-
[20]
张景朋, 秦耀果, 李文浩, 杨立波, 宋敦伦, 杨新玲, 有机化学, 2016, 36, 1883. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345518.shtmlZhang, J.-P.; Qin, Y.-G.; Li, W.-H.; Ling, Y.; Yang, L.-B.; Song, D.-L.; Yang, X.-L. Chin. J. Org. Chem. 2016, 36, 1883 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345518.shtml
-
[21]
Peat, A. J.; Buchwald, S. L. J. Am. Chem. Soc. 1996, 118, 1028. doi: 10.1021/ja953080t
-
[22]
Romera, J. L.; Cid, J. M.; Trabanco, A. A. Tetrahedron Lett. 2004, 45, 8797. doi: 10.1016/j.tetlet.2004.10.002
-
[23]
Cunha, C. R. M. D.; Neto, S. A. M.; Silva, C. C. D.; Cortez, A. P.; Gomes, M. D. N.; Martins, F. I.; Alonso, A.; Rezende, K. R.; Menegatti, R.; Magalhaes, M. T. Q. D. M.; Valadares, M. C. Eur. J. Med. Chem. 2013, 62, 371. doi: 10.1016/j.ejmech.2012.12.028
-
[24]
Masatoshi, H. J. Chem. Ecol. 1988, 24, 1425.
-
[25]
Zhang, C.-L.; Qu, Y.-Y.; Wu, X.-Q.; Song, D.-L.; Ling, Y.; Yang, X. L. J. Agric. Food Chem. 2015, 63, 4527. doi: 10.1021/acs.jafc.5b01225
-
[1]
-
表 1 胺与香叶基氯2的N-烷基化反应条件
Table 1. N-Alkylation conditions between 2 and amine
Compd. 
Base T/℃ Yield/% 3a t-Bu K2CO3 25 44 3b 2-Naphthyl K2CO3 25 77 3c 3-Cl-C6H4 K2CO3 25 65 3d 3-F-C6H4 K2CO3 25 75 3e 3-CF3-C6H4 K2CO3 25 62 3f 2-CF3-C6H4 NaOH Reflux 50 3g 4-CF3-C6H4 NaOH Reflux 57 3h 4-CF3O-C6H4 K2CO3 25 76 3i 6-Me-pyridin-2-yl NaOH Reflux 49 3j 5-Me-thiazol-2-yl NaOH Reflux 43 3k Benzothiazol-2-yl NaOH Reflux 52 3l Pyridin-2-yl NaOH Reflux 23 3q Thiazol-2-yl NaOH Reflux 0 表 2 胺与香叶醛4的还原胺化反应条件
Table 2. Reductive amination conditions between 4 and amine

Compd. 
Time/h Yield/% 3f 2-CF3-C6H4 1 81 3j 5-Me-thiazol-2-yl 1 68 3l Pyridin-2-yl 1 78 3m 5-Me-pyridin-2-yl 0.5 72 3n 4-Me-pyridin-2-yl 0.5 66 3o 3-Me-pyridin-2-yl 1 45 3p Pyrimidin-2-yl 2 34 3q Thiazol-2-yl 1 73 3r 5-Pr-(1, 3, 4-thiadiazol)-2-yl 1 61 3s 5-Me-(1, 3, 4-thiadiazol)-2-yl 1 51 表 3 目标化合物的驱避及杀虫活性 (桃蚜)a
Table 3. Repellent and insecticidal activity of target compounds (Myzus persicae)
Compd. Appearance Repellent rateb/% Mortalityc/% 3a Yellow liquid 18.9±1.6 56.6±1.8 3b Yellow liquid 38.2±3.9 67.9±4.9 3c Yellow liquid 40.8±1.8 51.9±4.9 3d Yellow liquid 42.8±1.3 32.4±1.5 3e Yellow liquid 48.7±3.7 45.9±4.3 3f Yellow liquid 58.7±5.7 65.7±4.2 3g Yellow liquid 62.0±1.5 56.2±2.1 3h Yellow liquid 53.1±2.3 55.1±2.5 3i Yellow liquid 37.1±3.2 70.7±1.5 3j Yellow liquid 42.8±2.2 66.0±2.8 3k Yellow liquid 36.4±2.2 63.9±4.9 3l Yellow liquid 62.5±4.0 72.6±2.0 3m Yellow liquid 64.6±1.7 68.8±2.0 3n Yellow liquid 36.9±2.7 61.2±1.9 3o Yellow liquid 43.6±2.3 63.7±5.6 3p Yellow liquid 34.9±5.9 67.5±1.3 3q Yellow liquid 57.4±0.4 69.7±2.4 3r Yellow oil 31.5±5.7 70.4±0.7 3s White solid 20.2±2.2 75.5±0.6 EBF Colorless liquid 87.4±2.3 58.8±2.9 PYd White solid — 87.1±2.1 a Average of three replicates.b Repellent activity was tested at a dose of 5μg. c Aphicidal activity was tested at a concentration of 200 μg/mL. dPY: Pymetrozine was used as a positive control. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 11
- 文章访问数: 1263
- HTML全文浏览量: 154


 下载:
下载:



 下载:
下载:

