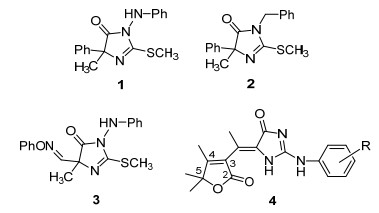
 图 1
典型的咪唑啉酮杀菌剂
Figure 1.
Typical imidazolinone fungicides
图 1
典型的咪唑啉酮杀菌剂
Figure 1.
Typical imidazolinone fungicides

Citation: Zhao Yu, Tang Bo, Liu Xinlei, Li Wanzhen, Huang Mingyi, Wang Ming'an. Regioselective Preparation of Enaminone via Enol Methyl Ether of 3-Acetyl-2-butenolide and Different Amines[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 975-986. doi: 10.6023/cjoc201611013

经由3-乙酰基-2-丁烯内酯烯醇醚与胺类衍生物区域选择性制备烯胺酮
-
关键词:
- 3-乙酰基-4-甲氧基-2-丁烯内酯
- / 3-(1-甲氧基亚乙基)-4-羰基-2-丁内酯
- / 加成-消除反应
- / 烯胺酮
English
Regioselective Preparation of Enaminone via Enol Methyl Ether of 3-Acetyl-2-butenolide and Different Amines
-
自从咪唑菌酮 (1) 被开发为新型杀菌剂以来, 咪唑啉酮类杀菌剂类化合物 (如2, 3) 成为近年来新农药创制中的热点 (图 1)[1~4].丁烯内酯是其衍生物具有显著杀虫杀菌活性的药效团之一[5], 其中3-乙酰基-5, 5-二甲基-2-丁烯内酯是典型的丁烯内酯衍生物, 因而它的含氮衍生物的合成及生物活性评价近来受到了关注[6], 文献上未见到咪唑啉酮类衍生物的研究中将3-乙酰基-5, 5-二甲基-2-丁烯内酯引入其核心结构的报道.本课题组[7, 8]在开展咪唑啉酮类杀菌剂的研究中, 首次报道[9]根据活性亚结构拼接原理将两个活性基团组合在同一分子中设计合成了5-(5, 5-二甲基-3-亚乙基)-2-氨基咪唑啉酮类化合物 (4)(图 1), 发现它们具有显著的农用杀菌活性.甲氧基丙烯酸酯是近年来使用最广的农用杀菌剂, 其中甲氧基丙烯酸结构片段对提高杀菌活性起到了至关重要的作用, 为此作者设计将前文中具有杀菌活性的5-(4, 5, 5-三甲基-3-亚乙基)-2-氨基咪唑啉酮分子中的4-甲基替换为4-甲氧基合成5-[4-甲氧基-5, 5-二甲基 (或螺环己基)-3-亚乙基]-2-氨基咪唑啉酮, 以考察甲氧基丙烯酸酯片段的存在是否可以提高该类化合物的杀菌活性.
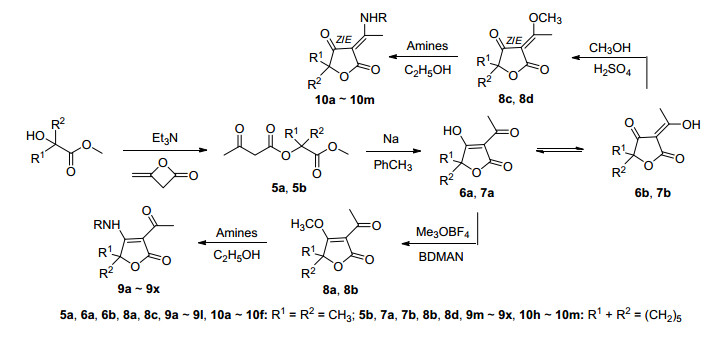
参照文献[7~9]合成路线, 中间体3-乙酰基-4-甲氧基-5, 5-二甲基-2-丁烯内酯与硫代乙内酰脲在乙醇胺催化下进行缩合时, 作者发现并未发生Knoevenagel缩合反应, 而是直接与乙醇胺发生了副反应, 为此采用2D NMR方法对该副产物的化学结构进行了研究.在此基础上通过扩展底物3-乙酰基-4-甲氧基-5, 5-二甲基 (或螺环己基)-2-丁烯内酯与不同的有机胺反应区域选择性地得到了大位阻的同类型烯胺酮类反应产物, 另一方面3-(1-甲氧基亚乙基)-4-羰基-2-丁内酯与不同的烷基和苄基胺类衍生物也可以发生区域选择性反应生成一系列具有Z/E两种异构体的烯胺酮衍生物, 但与芳胺、杂环胺以及二级胺却难以发生反应, 显示出两种烯醇醚不同的反应活性差异, 根据反应机理对这种差异进行了合理的解释.化合物的合成路线如Scheme 1所示.
1 结果与讨论
1.1 关键中间体烯醇醚的合成及其副产物的结构
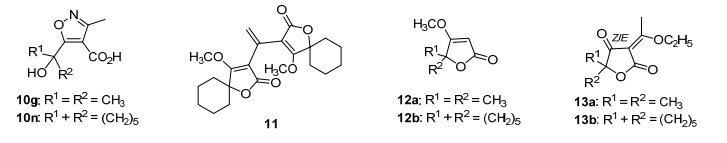
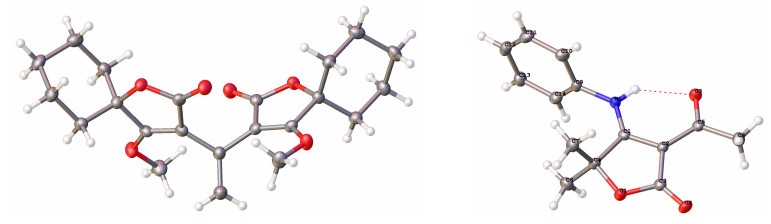
参照文献[10]我们以2-羟基-2-甲基丙酸甲酯和1-羟基环己基甲酸甲酯为原料与乙烯酮反应顺利得到乙酰乙酸酯5a和5b, 它们在金属钠作用下关环合成了关键中间体6和7 (Scheme 1), 该类化合物以钠盐形式存在易溶于水中使得收率较低, 后来通过先酸化再萃取的方式高收率地得到了化合物6和7, 化合物6和7存在6a和6b, 7a和7b两种形式的互变异构体, 但在1H NMR谱上表现并不明显.在对6的羟基进行甲基保护时, 发现常用反应条件如在干燥四氢呋喃 (THF) 中分别加入NaH/ Na2CO3/K2CO3等碱, 再滴加化学计量的CH3I, 无论在室温或加热至60 ℃条件下都无法得到预期的甲基保护产物.通过查阅文献并参照Harras等[11]的方法用三甲基氧鎓四氟硼酸盐和1, 8-双二甲胺基萘 (BDMAN) 进行甲基化反应选择性地制得单一异构体8a和8b, 在大量制备化合物8b时意外分离得到副产物11(图 2), 通过对其HRMS、1H NMR、13C NMR、HMQC和HMBC谱分析确定了结构并通过X射线衍射得到了证实 (图 3), 采用Zimmer等[12]的方法用甲醇及硫酸体系反应得到异构体8c和8d, 化合物8c和8d由于双键构型理论上存在Z/E两种异构体, 但在1H NMR谱上也没有明显的表现, 在大量制备8c和8d时分离到副产物12a和12b, 通过比较化合物8a和8b与副产物12的1H NMR和13C NMR, 发现少了一个乙酰基而多了一个烯键质子和碳原子, 推断是通过逆向Fries重排并酸性水解脱去乙酰基再甲基化得到的产物[13].
1.2 中间体烯醇醚8a和8c与硫代乙内酰脲在乙醇胺催化下的反应及产物结构分析
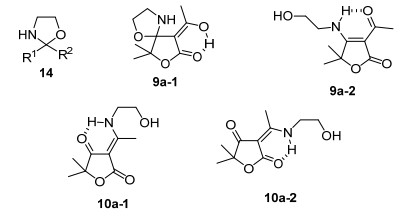
在中间体8a在乙醇胺催化下与硫代乙内酰脲的反应中, 薄层色谱 (TLC) 监测下硫代乙内酰脲并未发生变化而中间体8a的点却消失了, 经过硅胶柱层析分离后高收率得到了副产物9a, 在相同的反应条件下只加中间体8a和乙醇胺结果得到了相同的产物.为此对该副产物的化学结构进行了分析, 在该产物的1H NMR谱中除了存在中间体8a的两组甲基信号外, 还存在乙醇胺分子中的两组亚甲基和两个活泼质子的信号, 而中间体8a的4-甲氧基信号则完全消失了, 这说明中间体8a的甲氧基所在4-位与乙醇胺分子发生了化学反应. Jung等[14]报道由2-乙酰基-5-甲基呋喃与乙醇胺反应可以得到2-甲基-2-(5-甲基呋喃-2-基) 噁唑烷, 产率达到79%; Porter等[15]报道丙酮与乙醇胺反应得到相应的噁唑环产物和亚胺产物的混合物, 产率达71%, 因此人们认为乙醇胺与醛酮反应并不只是形成C=N的席夫碱衍生物, 而多是乙醇胺的O, N与羰基的碳原子相连形成噁唑环结构14 (图 4).副产物9a的1H NMR谱与预期的噁唑环结构9a-1基本吻合, 高分辨质谱中给出化合物的[M+H]+ m/z: 214.1074, 化学式C10H16NO4, 与上述预期的噁唑环结构9a-1的分子量和分子式也相符, 但是在9a的13C NMR谱中, δ 197.21为典型的酮羰基峰, 而推测9a-1结构中并没有酮羰基, 只含有一个类似半缩醛碳原子, 二者之间存在明显的矛盾, 为此测定了化合物9a的2D NMR谱.在化合物9a的异核远程化学位移相关谱 (HMBC) 谱中, 清晰地观测到与胺基相连δ 3.56的亚甲基与δ 1.67的两个同碳甲基质子和13C NMR谱中δ 178.94的同一个烯碳存在远程相关, 而与氧相连δ 3.88的亚甲基则与该烯碳不存在远程相关, 由此推断乙醇胺的胺基取代了甲氧基直接与五元环内酯的4-烯碳相连, 而羟基并未参与反应形成噁唑环结构, 所以化合物9a的正确结构式为9a-2, 这种新的烯胺酮由于分子内六元环氢键的形成稳定了化合物的结构.
在此基础上, 又以中间体8c与乙醇胺在相同条件下反应也得到了相应的烯胺酮化合物10a, 化合物的HMBC谱与预期结构完全一致.由于中间体8c理论上存在Z/E两种异构体, 所以化合物10a也应存在Z/E两种异构体10a-1和10a-2 (图 4), 实际上在化合物10a的1H NMR谱中, 除了分子骨架中的两组甲基和两组亚甲基信号基本重叠外, 化合物的活泼质子信号均出现在两处, 积分面积比例在55:45左右, 说明两种异构体的比例非常相近, 这可以从化合物的13C NMR谱中谱线成对出现且峰高大体一致来得到证明, 这与Tietze等[16]观测到的类似结果一致.化合物的HR-ESI-MS谱中获得的[M+H]+峰的精确质量与理论计算值吻合, 即化合物10a的HRMS C10H16NO4 [M+H]+, 计算值为214.1079, 测定值为214.1074.
1.3 通过烯醇醚8a~8d与不同结构的胺类衍生物的反应制备烯胺酮
在获得上述结果的基础上, 进一步考察了烯醇醚8a~8d与不同结构的胺类衍生物的反应.结果显示8a和8b与烷基胺、苄胺、芳胺、杂环胺、羟胺、肼等均可以顺利地反应得到各种新的烯胺酮类化合物9a~9x (表 1, Entries 1~12, 14~25), 但只有空间位阻小的二级胺可以顺利反应 (表 1, Entries 4, 17), 空间位阻大的二级胺则不能发生反应 (表 1, Entries 13, 26), 这可能与邻位碳上的二甲基或螺环己基的空间位阻较大密切相关.选择代表性的化合物9h进行了X射线衍射分析, 烯胺酮的结构得到了进一步的证实, 并证明了分子内氢键的存在 (图 3).另一方面对于8c和8d而言, 可以与烷基胺和苄胺反应生成新的烯胺酮类化合物10a~10m(表 1, Entries 27~29, 31~33, 40~42, 44~46), 与芳胺、杂环胺、甲氧羟胺以及二级胺均不能发生反应, 但在反应体系中却发现生成了相应的副产物烯醇乙基醚13(表 1, Entries 30, 34, 35, 37, 39, 43, 47, 48, 50, 52), 与羟胺的反应则意外生成了异噁唑甲酸类化合物10g和10n(表 1, Entries 36, 49), 与肼的反应却导致内酯环的开裂形成了新的结构 (表 1, Entries 38, 51), 此结果将在另文中再进一步讨论.类似地, 8c和8d与烷基胺和苄胺反应生成的这些新型烯胺酮类化合物10b~10f以及10h~10m也存在和10a一样的Z/E两种异构体, 它们的1H NMR谱中活泼质子信号均出现在两处, 13C NMR谱中谱线也成对地出现且峰高大体一致, 说明两种异构体的比例也非常相近[16].比较8a和8b、8c和8d与不同结构的胺类衍生物的反应结果差异, 推断可能是8c和8d分子中与甲氧基相连的烯碳还与一个给电子的甲基相连, 因超共轭效应从而降低了碳原子的亲核加成反应活性所致.
Entry Amine Enol ether Product Yield/% Entry Enol ether Product Yield/% 1 HOCH2CH2NH2 8a 9a 89 27 8c 10a 85 2 CH3NH2 8a 9b 85 28 8c 10b 81 3 n-C4H9NH2 8a 9c 81 29 8c 10c 71 4 (CH3)2NH 8a 9d 74 30 8c — — 5 C6H5CH2NH2 8a 9e 89 31 8c 10d 81 6 3-CF3C6H4CH2NH2 8a 9f 55 32 8c 10e 61 7 4-CH3OC6H4CH2NH2 8a 9g 80 33 8c 10f 61 8 C6H5NH2 8a 9h 79 34 8c — — 9 NH2C5H4N 8a 9i 75 35 8c — — 10 NH2OH 8a 9j 65 36 8c 10g 52 11 NH2OCH3 8a 9k 46 37 8c — — 12 NH2NH2 8a 9l 61 38 8c — — a 13 C6H5NHCH3 8a — — 39 8c — — 14 HOCH2CH2NH2 8b 9m 72 40 8d 10h 67 15 CH3NH2 8b 9n 87 41 8d 10i 80 16 n-C4H9NH2 8b 9o 87 42 8d 10j 82 17 (CH3)2NH 8b 9p 62 43 8d — — 18 C6H5CH2NH2 8b 9q 75 44 8d 10k 94 19 3-CF3C6H4CH2NH2 8b 9r 76 45 8d 10l 48 20 4-CH3OC6H4CH2NH2 8b 9s 75 46 8d 10m 65 21 C6H5NH2 8b 9t 79 47 8d — — 22 NH2C5H4N 8b 9u 78 48 8d — — 23 NH2OH 8b 9v 72 49 8d 10n 55 24 NH2OCH3 8b 9w 56 50 8d — — 25 NH2NH2 8b 9x 60 51 8d — — a 26 C6H5NHCH3 8b — — 52 8d — — aThese results will be presented in the other paper due to opening of lactone ring and forming novel structures. 表 1 烯醇醚8a~8d与不同结构的胺类衍生物的反应
Table 1. Reactions of enol ethers 8a~8d with different amines1.4 反应机理分析
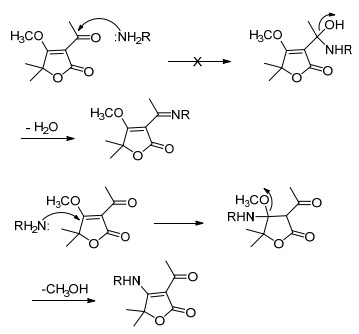
从上面的结果分析可以看到, 中间体8a~8d与有机胺类化合物反应生成了稳定的烯胺酮结构.烯胺酮是非常有用的有机合成中间体[17~23], 近年来相继报道了一些结构相对复杂的烯胺酮衍生物具有不同的生物活性[5, 18~23], 文献[24]曾总结了烯胺酮的合成方法, 但是较少见到使用具有烯醇醚结构的α, β-不饱和酮类化合物直接与有机胺反应来制备烯胺酮, 因此本文的实验结果提供了一种不使用任何催化剂直接通过含有烯醇醚结构的α, β-不饱和酮类化合物与有机胺反应来区域选择性制备烯胺酮的方法. 1, 3-二羰基化合物与胺反应是制备烯胺酮的典型方法[17, 24, 25], 大部分文献认为是酮羰基与胺发生亲核加成反应后再失去一分子水生成席夫碱的机理, 也有文献认为是1, 3-二羰基化合物先生成烯醇式结构再与胺发生Michael加成反应并失去一分子水的机理[16b, 26].最近瞿益萍等[17]还对这种反应的催化剂进行了研究, 发现氯化亚铜是这一反应的有效催化剂.这两种机理得到的中间体结构是相似的, 尚未证明哪种机理是最合理的.同时1, 3-二酮类化合物与胺反应可以得到两种可能的烯胺酮结构, 其主要产物取决于两个羰基两侧基团的体积大小, 但选择性较差.就本文的反应底物而言, 由于1, 3-二酮已经选择性地形成了稳定的烯醇醚结构, 产物中烯胺的位置与原来烯醇醚的位置完全相同, 因此推断以烯醇醚为底物与胺反应生成烯胺酮的机理不可能是酮羰基与胺发生亲核加成反应后再脱去一分子水生成共轭烯胺, 只能是烯醇醚与胺发生Michael加成反应后再消除一分子甲醇的机理.这说明烯醇醚与烯醇或酮相比具有更高的亲核加成反应活性, 以8a和胺的反应为例其反应机理如Scheme 6所示, 这种机理可以清晰地阐释烯醇醚与胺类化合物反应区域选择性地制备特定取代位置的烯胺酮的原因, 同时也可以解释由8c和8d与溶剂乙醇发生交换反应生成副产物13a和13b.具有空间位阻或环张力的烯胺酮类化合物难以通过1, 3-二羰基化合物直接与胺类化合物反应获得, 本文的结果表明这类烯胺酮类化合物可以由1, 3-二羰基化合物区域选择性制备成烯醇醚, 然后再与胺类化合物区域选择性反应来有效制备, 且5-位的偕二甲基或螺环结构对反应并未产生实际的影响.
2 结论
本文通过3-乙酰基-5, 5-二甲基/螺环己基-2-丁烯内酯的两种烯醇醚分别与多种胺类衍生物反应, 区域选择性地制备了位阻大的两类烯胺酮类化合物, 且内酯环5-位的偕二甲基或螺环结构对反应并未产生明显的不同, 推断该反应是Michael加成-消除的反应机理, 并解释了两种烯醇醚的反应活性差异, 其中3-(1-甲氧基亚乙基)-5, 5-二甲基/螺环己基-4-羰基-2-丁内酯与羟胺的反应还生成了含叔醇结构的新型3-甲基-异噁唑-4-羧酸衍生物.所有目标化合物、中间体以及目标化合物制备过程中得到的副产物结构通过1H NMR、13C NMR、X射线衍射和高分辨质谱的表征.
3 实验部分
3.1 仪器与试剂
Yanagimoto显微熔点仪 (温度计未校正); Bruker DPX 300 MHz核磁共振仪, TMS为内标, CDCl3或DMSO-d6为溶剂; Agilent 1100 LC-MSD-Trap质谱仪 (ESI-MS), Brüker Apex Ⅱ高分辨质谱仪.本实验所用柱层析硅胶为青岛海洋化工有限公司生产 (200~300目), 所用试剂均为国产或进口分析纯, 无水溶剂用常规方法干燥处理.
3.2 化合物的合成
3.2.6 化合物9h和11的晶体结构分析
将20~30 mg高纯度的9h和11分别置于50 mL三角瓶中, 分别用正己烷/无水乙醇 (V:V=15:1) 和正己烷/无水乙醇 (V:V=20:1) 溶解制备成一定浓度的稀溶液, 用保鲜膜将瓶口封好, 并扎3~5个针孔, 置于阴凉处, 让溶剂自然挥发, 大约4~8 d后析出晶莹透明符合单晶衍射所需的晶体.
分别在低温条件[103.2和105.3 K]下, 将一粒0.10 mm×0.08 mm×0.07 mm和0.25 mm×0.22 mm×0.14 mm大小的晶体置于Bruker SMART CCD IP四圆衍射仪中, 采用石墨单色器, Mo Kα (λ=0.071073 nm) 射线, 用Xscan程序收集数据, 采用w-2q 扫描方式, 在6.0°<θ<52.0°范围内分别收集到5256和2782个衍射点, 其中2504和1563个独立衍射点, R(int)=0.0238和0.0268.强度数据经半经验吸收校正, 在微机上使用SHELXTL-97程序直接法解出结构, 并由SHELXL-97程序采用最小二乘法进行结构精修, 分别得到化合物的晶体结构.化合物9h的结构参数: Mr=245.27, C14H15NO3, Monoclinic, P21/n, -13≤h≤13, -5≤k≤9, -17≤l≤18, a=1.12073(3) nm, b=0.76271(2 nm, c=1.53718(4) nm, β=104.397(3)°, V=1.27272(6) nm3, Dc=1.280 g/cm3, μ=0.090 mm-1, F(000)=520, Z=4, S=1.052, R1=0.0402, wR2=0.0903 [I>2σ(I)], R1=0.0490, wR2=0.0966 [all data].
化合物11的结构参数: Mr=388.44, C22H28O6, Orthorhombic, Aba2, -7≤h≤21, -21≤k≤20, -7≤ l≤7, a=1.74406(9) nm, b=1.77952(8) nm, c=0.64663(3) nm, V=2.00686(16) nm3, Dc=1.286 g/cm3, μ =0.093 mm-1, F(000)=832, Z=4, S=1.102, R1=0.0307, wR2=0.0867 [I>2σ(I)], R1=0.0398, wR2=0.0834 [all data].化合物9h和11的晶体结构数据已存于剑桥晶体结构数据库中, CCDC分别为1510603和1510604.
辅助材料(Supporting Information)化合物6~13的1H NMR、13C NMR和高分辨质谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.1 2-甲氧羰基异丙醇/环己醇乙酰乙酸酯 (5a和5b) 的合成
中间体5a和5b参照文献[10]方法合成.
中间体5a[10]:淡黄色油状液体8.98 g, 收率为94%. 1H NMR (300 MHz, CDCl3)δ: 3.74 (s, 3H, OCH3), 3.44 (s, 2H, CH2), 2.29 (s, 3H, CH3), 1.58 (s, 6H, 2×CH3).
中间体5b[10]:淡黄色油状液体2.90 g, 收率为92%. 1H NMR (300 MHz, CDCl3) δ: 3.70 (s, 3H, OCH3), 3.47 (s, 2H, CH2), 2.29 (s, 3H, CH3), 1.95~1.49 (m, 10H, 5×CH2).
3.2.2 3-乙酰基-4-羟基-5, 5-二甲基/螺环己基-2-丁烯内酯 (6和7) 的合成
中间体6和7参照文献[10]方法合成.
中间体6[10]:淡黄色油状液体6.15 g, 收率96%. 1H NMR (300 MHz, CDCl3) δ: 10.93 (brs, 1H, OH), 2.56 (s, 3H, CH3), 1.53~1.49 (m, 6H, 2×CH3).
中间体7[10]:淡黄色固体7.23 g, 收率97%. m.p. 40~41 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 4.43 (brs, 1H, OH), 2.23 (s, 3H, CH3), 1.68~1.25 (m, 10H, 5×CH2).
3.2.3 3-乙酰基-4-甲氧基-2-丁烯内酯8a、8b和3-(1-甲氧基亚乙基)-2-丁内酯8c、8d的合成
中间体8a和8b参照文献[11]方法合成.
中间体8a:淡黄色晶体3.21 g, 收率55%. m.p. 40~42 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 4.08 (s, 3H, OCH3), 2.47 (s, 3H, CH3), 1.44 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 195.07, 184.09, 168.79, 103.19, 80.98, 63.36, 30.39, 24.15. HR-ESI-MS calcd for C9H13O4 [M+H]+ 185.0814, found 185.0809.
中间体8b:淡黄色晶体2.06 g, 收率60%. m.p. 43~44 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 4.15 (s, 3H, OCH3), 2.60 (s, 3H, CH3), 1.79~1.61 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 195.10, 184.92, 169.34, 103.17, 82.58, 63.17, 32.72, 30.28, 23.98, 21.17. HR-ESI-MS calcd for C12H17O4 [M+H]+ 225.1127, found 225.1125.
在以硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=15:1至5:1梯度洗脱) 分离8b过程中还得到副产物11, 无色针状晶体0.78 g, 收率10%. m.p. 201~202 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 5.45 (s, 2H, =CH2), 4.19 (s, 6H, 2×OCH3), 1.78~1.22 (m, 20H, 10×CH2); 13C NMR (75 MHz) δ: 178.49, 171.59, 129.42, 125.59, 99.85, 82.65, 60.87, 32.72, 24.17, 21.42. HR-ESI-MS calcd for C22H29O6 [M+H]+ 389.1964, found 389.1955.
中间体8c和8d参照文献[12]方法合成.
中间体8c:淡黄色油状液体2.05 g, 收率58%. 1H NMR (300 MHz, DMSO-d6)δ: 3.70 (s, 3H, OCH3), 2.57 (s, 3H, CH3), 1.34 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 199.22, 195.29, 162.81, 105.69, 89.59, 51.06, 22.48, 17.77. HR-ESI-MS calcd for C9H13O4 [M+H]+ 185.0814, found 185.0808.
在硅胶柱层析 (以正己烷/乙酸乙酯为洗脱剂, V正己烷:V乙酸乙酯=20:1至8:1梯度洗脱) 分离8c过程中还得到副产物12a, 白色固体0.47 g, 收率16%. m.p. 68~69 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 4.95 (s, 1H, =CH), 3.88 (s, 3H, OCH3), 1.46 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 185.97, 171.50, 86.72, 82.11, 59.44, 24.28. HR-ESI-MS calcd for C7H11O3 [M+H]+ 143.0708, found 143.0703.
中间体8d, 淡黄色油状液体2.34 g, 收率70%. 1H NMR (300 MHz, DMSO-d6)δ: 3.80 (s, 3H, OCH3), 2.60 (s, 3H, CH3), 1.79~1.36 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 200.05, 195.30, 163.55, 107.02, 92.12, 51.42, 31.55, 24.21, 21.35, 17.92. HR-ESI-MS calcd for C12H17O4 [M+H]+ 225.1127, found 225.1123.
在硅胶柱层析 (以正己烷/乙酸乙酯为洗脱剂, V正己烷:V乙酸乙酯=16:1至6:1梯度洗脱) 分离8d过程中还得到副产物12b, 白色固体0.38 g, 收率15%. m.p. 100~101 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 4.96 (s, 1H, =CH), 3.87 (s, 3H, OCH3), 1.72~1.24 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 186.28, 171.98, 86.98, 83.80, 59.28, 33.06, 24.42, 21.67l. HR-ESI-MS calcd for C10H15O3 [M+H]+ 183.1021, found 183.1016.
3.2.5 3-(1-乙氧基亚乙基)-4-氧代-5, 5-二甲基-2-丁内酯 (13a) 和3-(1-乙氧基亚乙基)-4-氧代-5, 5-螺环己基-2-丁内酯 (13b) 的合成
以化合物13b的合成为例.在50 mL圆底瓶中加入中间体8d 224 mg (1 mmol)、甲氧基胺盐酸盐83.5 mg (1.0 mmol)、碳酸氢钠126 mg (1.5 mmol)、20 mL乙醇, 回流搅拌19 h, TLC监测反应完毕.减压除去溶剂, 加入20 mL乙酸乙酯溶解残余物, 用10 mL蒸馏水洗2次溶液, 再用10 mL饱和食盐水洗滴.有机相用无水硫酸钠干燥, 减压除去溶剂.残余物用硅胶柱层析分离 (V乙酸乙酯:V石油醚=1:6), 得到无色液体231 mg, 收率97%.采用相同方法制得化合物13a.
化合物13a:无色液体239 mg, 收率95%. 1H NMR (300 MHz, CDCl3) δ: 4.46 (q, J=7.0 Hz, 2H, OCH2), 2.56 (s, 3H, CH3), 1.48 (s, 6H, 2×CH3), 1.35 (t, J=7.0 Hz, 3H, CH3); 13C NMR (75 MHz) δ: 195.38, 184.12, 169.50, 102.86, 81.14, 72.60, 30.52, 24.44, 14.75. HR-ESI-MS calcd for C10H15O4 [M+H]+ 199.0970, found 199.0966.
化合物13b:无色液体231 mg, 收率97%. 1H NMR (300 MHz, CDCl3) δ: 4.32 (q, J=7.2 Hz, 2H, OCH2), 2.64 (s, 3H, CH3), 1.77~1.57 (m, 10H, 5×CH2), 1.35 (t, J=7.2 Hz, 3H, CH3); 13C NMR (75 MHz) δ: 199.77, 194.49, 162.75, 106.93, 91.58, 59.96, 31.25, 23.93, 21.05, 17.62, 13.92. HR-ESI-MS calcd for C13H19O4 [M+H]+ 239.1283, found 239.1278.
3.2.4 烯醇醚中间体8a~8d与胺类衍生物的反应通法
以化合物9a的合成为例.将20 mL乙醇加入50 mL三口瓶中, 再加入1.0 mmol 8a, 1.5 mmol乙醇胺, 用油浴加热至80 ℃回流10 h, TLC监测反应完毕后停止加热, 旋蒸除去溶剂后经硅胶柱层析 (200~300目硅胶, 以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离, 得到无色晶体9a 0.19 g, 收率89%.采用同样方法分别反应10~24 h并经硅胶柱层析分离得到化合物9b~9x和10a~10n.
3-乙酰基-4-(2-羟基乙基) 氨基-5, 5-二甲基-2-丁烯内酯 (9a):硅胶柱层析 (以二氯甲烷/丙酮为洗脱剂, V二氯甲烷: V丙酮=10:1至2:1梯度洗脱) 分离得无色针状晶体0.19 g, 收率89%. m.p. 109~110 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.28 (brs, 1H, NH), 3.88 (brs, 2H, CH2O), 3.65~3.60 (m, 2H, CH2N), 3.55 (brs, 1H, OH), 2.44 (s, 3H, CH3), 1.67 (s, 6H, 2×CH3); 13C NMR (75 MHz)δ: 197.21, 178.94, 169.44, 94.92, 79.08, 60.68, 46.40, 27.65, 24.84. HR-ESI-MS calcd for C10H16NO4 [M+H]+ 214.1079, found 214.1074.
3-乙酰基-4-甲基氨基-5, 5-二甲基-2-丁烯内酯 (9b):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=4:1至1:1梯度洗脱) 分离得无色针状晶体0.15 g, 收率85%. m.p. 102~103 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.05 (brs, 1H, NH), 3.18 (s, 3H, NCH3), 2.44 (s, 3H, CH3), 1.65 (s, 6H, 2×CH3); 13C NMR (75 MHz)δ: 196.69, 178.94, 168.68, 94.54, 78.30, 30.37, 27.18, 23.83. HR-ESI-MS calcd for C9H14NO3 [M+H]+ 184.0974, found 184.0967.
3-乙酰基-4-正丁基氨基-5, 5-二甲基-2-丁烯内酯 (9c):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚: V乙酸乙酯=1:1至1:3梯度洗脱) 分离得无色针状晶体0.17 g, 收率81%. m.p. 79~80 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.16 (brs, 1H, NH), 3.51~3.45 (m, 2H, CH2N), 2.49 (s, 3H, CH3), 1.73~1.67 (m, 8H, CH2+2×CH3), 1.52~1.45 (m, 2H, CH2), 1.03~0.98 (t, J=9.0 Hz, 3H, CH3); 13C NMR (75 MHz) δ: 197.12, 178.53, 169.19, 94.58, 78.76, 44.19, 32.19, 27.64, 24.80, 19.64, 13.49. HR-ESI-MS calcd for C12H20NO3 [M+H]+ 226.1443, found 226.1438.
3-乙酰基-4-(N, N-二甲基氨基)-5, 5-二甲基-2-丁烯内酯 (9d):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=3:1至2:3梯度洗脱) 分离得无色针状晶体0.16 g, 收率74%. m.p. 92~93 ℃; 1H NMR (300 MHz, CDCl3) δ: 3.16 [s, 6H, N (CH3)2], 2.56 (s, 3H, CH3), 1.68 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 193.73, 175.67, 169.42, 97.13, 79.86, 43.98, 29.56, 24.76. HR-ESI-MS calcd for C10H16NO3 [M+H]+ 198.1130, found 198.1123.
3-乙酰基-4-苄基氨基-5, 5-二甲基-2-丁烯内酯 (9e):硅胶柱层析 (以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离得无色针状晶体0.23 g, 收率89%. m.p. 117~118 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.42 (brs, 1H, NH), 7.44~7.33 (m, 3H, ArH), 7.28~7.26 (m, 2H, ArH), 4.67 (d, J=6.6 Hz, 2H, ArCH2), 2.49 (s, 3H, CH3), 1.68 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 197.40, 178.60, 169.06, 135.52, 129.22, 128.47, 126.63, 95.26, 78.90, 48.14, 27.81, 25.13. HR-ESI-MS calcd for C15H18NO3 [M+H]+ 260.1287, found 260.1278.
3-乙酰基-4-(3-三氟甲基苄基氨基)-5, 5-二甲基-2-丁烯内酯 (9f):硅胶柱层析 (以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离得无色针状晶体0.21 g, 收率55%. m.p. 125~126 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.46 (brs, 1H, NH), 7.66~7.48 (m, 4H, ArH), 4.75 (d, J=6.9 Hz, 2H, ArCH2), 2.50 (s, 3H, CH3), 1.68 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 197.64, 178.73, 168.85, 136.71, 131.68 (JCF=33.0 Hz), 129.91, 129.88, 125.42 (JCF=3.8 Hz), 123.64 (JCF=270.8 Hz), 123.56 (JCF=3.8 Hz), 95.70, 78.88, 47.65, 27.86, 25.16. HR-ESI-MS calcd for C16H17F3NO3 [M+H]+ 328.1161, found 328.1152.
3-乙酰基-4-(4-甲氧基苄基氨基)-5, 5-二甲基-2-丁烯内酯 (9g):硅胶柱层析 (以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离得无色针状晶体0.23 g, 收率80%. m.p. 103~104 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.32 (brs, 1H, NH), 7.19 (d, J=9.0 Hz, 2H, ArH), 6.92 (d, J=9.0 Hz, 2H, ArH), 4.60 (d, J=6.9 Hz, 2H, ArCH2), 3.81 (s, 3H, OCH3), 2.48 (s, 3H, CH3), 1.68 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 197.27, 178.34, 169.11, 159.70, 128.11, 127.37, 114.60, 95.07, 78.88, 55.30, 47.70, 27.77, 25.08. HR-ESI-MS calcd for C16H20NO4 [M+H]+ 290.1392, found 290.1385.
3-乙酰基-4-苯基氨基-5, 5-二甲基-2-丁烯内酯 (9h):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=5:1至2:1梯度洗脱) 分离, 无色针状晶体0.21 g, 收率79%. m.p. 145~146 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.58 (brs, 1H, NH), 7.45~7.43 (m, 3H, ArH), 7.29~7.26 (m, 2H, ArH), 2.55 (s, 3H, CH3), 1.36 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 197.33, 177.99, 168.46, 135.01, 129.21, 128.76, 128.73, 128.03, 125.00, 95.50, 79.63, 27.46, 25.52. HR-ESI-MS calcd for C14H16NO3 [M+H]+ 246.1130, found 236.1122.
3-乙酰基-4-(2-吡啶基氨基)-5, 5-二甲基-2-丁烯内酯 (9i):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=5:1至2:1梯度洗脱) 分离得无色针状晶体0.19 g, 收率75%. m.p. 172~174 ℃; 1H NMR (300 MHz, CDCl3) δ: 12.73 (brs, 1H, NH), 8.37~8.35 (m, 1H, PyH), 7.74~7.70 (m, 1H, PyH), 7.14~7.02 (m, 2H, PyH), 2.59 (s, 3H, CH3), 1.92 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 198.18, 175.48, 168.52, 149.21, 147.33, 138.26, 119.98, 114.70, 98.30, 82.76, 27.88, 24.14. HR-ESI-MS calcd for C13H15N2O3 [M+H]+ 247.1083, found 247.1073.
3-乙酰基-4-羟基氨基-5, 5-二甲基-2-丁烯内酯 (9j):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=2:1至1:2梯度洗脱) 分离得白色固体0.12 g, 收率65%. m.p. 94~95 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 10.59 (brs, 1H, NH), 2.24 (s, 3H, CH3), 1.56 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 192.95, 173.19, 168.72, 90.96, 79.36, 27.22, 24.60. HR-ESI-MS calcd for C8H12NO4 [M+H]+ 186.0766, found 186.0758.
3-乙酰基-4-甲氧基氨基-5, 5-二甲基-2-丁烯内酯 (9k):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚: V乙酸乙酯=5:1至2:1梯度洗脱) 分离得无色针状固体0.10 g, 收率46%. m.p. 86~87 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.53 (brs, 1H, NH), 3.92 (s, 3H, OCH3), 2.50 (s, 3H, CH3), 1.68 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 185.68, 168.18, 162.30, 93.66, 80.20, 63.41, 23.78, 21.93. HR-ESI-MS calcd for C9H14NO4 [M+H]+ 200.0923, found 200.0915.
3-乙酰基-4-肼基-5, 5-二甲基-2-丁烯内酯 (9l):硅胶柱层析 (以乙酸乙酯/甲醇为洗脱剂, V乙酸乙酯:V甲醇=60:1至20:1梯度洗脱) 分离得红色块状晶体0.11 g, 收率61%. m.p. 175~176 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.61 (brs, 1H, NH), 4.08 (s, 2H, NH2), 2.50 (s, 3H, CH3), 1.78 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 196.72, 179.84, 168.61, 93.97, 79.72, 27.14, 24.16. HR-ESI-MS calcd for C8H13N2O3 [M+H]+ 185.0926, found 185.0920.
3-乙酰基-4-(2-羟基乙基) 氨基-5, 5-螺环己基-2-丁烯内酯 (9m):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=2:1至1:3梯度洗脱) 分离得到无色针状晶体0.20 g, 收率72%. m.p. 112~113 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.39 (brs, 1H, NH), 3.89 (brs, 2H, CH2O), 3.73~3.67 (m, 2H, CH2N), 3.35 (brs, 1H, OH), 2.47 (s, 3H, CH3), 1.96~1.89 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 197.13, 178.35, 169.37, 95.08, 80.82, 60.54, 46.04, 32.62, 27.41, 24.09, 21.09. HR-ESI-MS calcd for C13H20NO4 [M+H]+ 254.1392, found 254.1386.
3-乙酰基-4-甲基氨基-5, 5-螺环己基-2-丁烯内酯 (9n):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=5:1至2:1梯度洗脱) 分离得无色针状晶体0.21 g, 收率87%. m.p. 178~179 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.20 (brs, 1H, NH), 3.25 (d, J=5.7 Hz, 3H, NCH3), 2.51 (s, 3H, CH3), 2.02~1.74 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 197.05, 178.81, 169.18, 95.23, 80.61, 31.98, 30.69, 27.41, 24.18, 21.05. HR-ESI-MS calcd for C12H18NO3 [M+H]+ 224.1287, found 224.1275.
3-乙酰基-4-正丁基氨基-5, 5-螺环己基-2-丁烯内酯 (9o):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=20:1至5:1梯度洗脱) 分离得无色针状晶体0.22 g, 收率87%. m.p. 175~176 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.23 (brs, 1H, NH), 3.53~3.48 (m, 2H, CH2N), 2.48 (s, 3H, CH3), 1.88~1.40 (m, 14H, 7×CH2), 0.97 (t, J=7.5 Hz, 3H, CH3); 13C NMR (75 MHz) δ: 197.36, 178.28, 169.54, 95.06, 80.87, 44.18, 32.89, 32.39, 27.76, 24.51, 21.40, 19.67, 13.56. HR-ESI-MS calcd for C15H24NO3 [M+H]+ 266.1756, found 266.1748.
3-乙酰基-4-(N, N-二甲基氨基)-5, 5-螺环己基-2-丁烯内酯 (9p):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=4:1至1:1梯度洗脱) 分离得无色针状晶体0.15 g, 收率62%. m.p. 116~117 ℃; 1H NMR (300 MHz, CDCl3) δ: 3.16 [s, 6H, N (CH3)2], 2.55 (s, 3H, CH3), 2.04~1.72 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 194.01, 175.87, 169.84, 98.15, 82.20, 44.47, 32.67, 29.78, 24.14, 21.45. HR-ESI-MS calcd for C13H20NO3 [M+H]+ 238.1443, found 238.1438.
3-乙酰基-4-苄基氨基-5, 5-螺环己基-2-丁烯内酯 (9q):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=5:1至2:1梯度洗脱) 分离得无色针状晶体0.23 g, 收率75%. m.p. 148~149 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.53 (brs, 1H, NH), 7.45~7.37 (m, 3H, ArH), 7.30~7.27 (m, 2H, ArH), 4.77 (d, J=6.6 Hz, 2H, ArCH2), 2.51 (s, 3H, CH3), 1.96~1.74 (m, 10H, 5×CH2). 13C NMR (75 MHz) δ: 197.11, 178.05, 169.10, 135.43, 128.84, 128.07, 126.33, 95.24, 80.71, 47.79, 32.89, 27.55, 24.09, 21.12. HR-ESI-MS calcd for C18H22NO3 [M+H]+ 300.1600, found 300.1593.
3-乙酰基-4-(3-三氟甲基苄基氨基)-5, 5-螺环己基-2-丁烯内酯 (9r):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=16:1至4:1梯度洗脱) 分离得无色针状晶体0.29 g, 收率76%. m.p. 212~213 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.57 (brs, 1H, NH), 7.68~7.48 (m, 4H, ArH), 4.83 (d, J=6.6 Hz, 2H, ArCH2), 2.53 (s, 3H, CH3), 1.97~1.72 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 197.42, 178.19, 168.83, 136.56, 131.30 (JCF=32.3 Hz), 129.58, 129.55, 125.04 (JCF=3.8 Hz), 123.34 (JCF=270.8 Hz), 123.27 (JCF=3.8 Hz), 95.73, 80.66, 47.33, 33.02, 27.57, 24.09, 21.09. HR-ESI-MS calcd for C19H21F3NO3 [M+H]+ 368.1474, found 368.1468.
3-乙酰基-4-(4-甲氧基苄基氨基)-5, 5-螺环己基-2-丁烯内酯 (9s):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=16:1至4:1梯度洗脱) 分离得无色针状晶体0.26 g, 收率75%. m.p. 78~79 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.44 (brs, 1H, NH), 7.20 (d, J=6.6 Hz, 2H, ArH), 6.94 (d, J=6.6 Hz, 2H, ArH), 4.69 (d, J=6.9 Hz, 2H, ArCH2), 3.84 (s, 3H, OCH3), 2.51 (s, 3H, CH3), 2.01~1.73 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 197.09, 177.81, 169.13, 159.36, 127.79, 127.28, 114.26, 95.14, 80.67, 55.00, 47.37, 32.88, 27.53, 24.14, 21.13. HR-ESI-MS calcd for C19H24NO4 [M+H]+ 330.1705, found 330.1697.
3-乙酰基-4-苯基氨基-5, 5-螺环己基-2-丁烯内酯 (9t):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=20:1至6:1梯度洗脱) 分离得无色针状晶体0.23 g, 收率79%. m.p. 149~150 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.71 (brs, 1H, NH), 7.51~7.46 (m, 3H, ArH), 7.33~7.29 (m, 2H, ArH), 2.60 (s, 3H, CH3), 1.77~1.62 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 197.58, 177.98, 168.96, 135.20, 128.86, 128.85, 128.43, 95.95, 82.04, 33.90, 27.65, 23.93, 21.03. HR-ESI-MS calcd for C17H20NO3 [M+H]+ 286.1443, found 286.1438.
3-乙酰基-4-(2-吡啶基氨基)-5, 5-螺环己基-2-丁烯内酯 (9u):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=20:1至6:1梯度洗脱) 分离的无色针状晶体0.23 g, 收率78%. m.p. 176~177 ℃; 1H NMR (300 MHz, CDCl3) δ: 12.78 (brs, 1H, NH), 8.41~8.39 (m, 1H, PyH), 7.77~7.72 (m, 1H, PyH), 7.17~7.03 (m, 2H, PyH), 2.61 (s, 3H, CH3), 1.83~1.38 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 198.40, 176.09, 168.94, 149.60, 147.35, 138.41, 120.15, 115.26, 98.74, 84.66, 31.17, 28.05, 23.82, 21.52. HR-ESI-MS calcd for C16H19N2O3 [M+H]+ 287.1396, found 287.1391.
3-乙酰基-4-羟基氨基-5, 5-螺环己基-2-丁烯内酯 (9v):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=1:1至3:1梯度洗脱) 分离得无色针状晶体0.13 g, 收率72%. m.p. 112~113 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 11.77 (brs, 1H, NH), 10.64 (brs, 1H, OH), 2.24 (s, 3H, CH3), 1.71~1.12 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 192.87, 172.44, 168.48, 90.98, 80.71, 78.94, 34.50, 31.51, 26.89, 24.19, 21.38. HR-ESI-MS calcd for C11H16NO4 [M+H]+ 226.1079, found 226.1069.
3-乙酰基-4-(甲氧基氨基)-5, 5-螺环己基-2-丁烯内酯 (9w):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=2:1至1:2梯度洗脱) 分离得无色针状晶体0.14 g, 收率56%. m.p. 100~101 ℃; 1H NMR (300 MHz, CDCl3) δ: 12.25 (brs, 1H, NH), 3.84 (s, 3H, OCH3), 2.31 (s, 3H, CH3), 1.70~1.25 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 187.19, 168.73, 167.81, 93.92, 82.36, 63.71, 31.77, 24.16, 22.72, 20.99. HR-ESI-MS calcd for C12H18NO4 [M+H]+ 240.1236, found 240.1230.
3-乙酰基-4-肼基-5, 5-螺环己基-2-丁烯内酯 (9x):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=2:1至1:2梯度洗脱) 分离得无色针状晶体0.15 g, 收率60%. m.p. 172~174 ℃; 1H NMR (300 MHz, DMSO-d6)δ: 10.57 (brs, 1H, NH), 5.09 (s, 2H, NH2), 2.26 (s, 3H, CH3), 1.57~1.19 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 194.34, 177.57, 168.94, 92.41, 81.22, 31.67, 27.20, 24.21, 21.42. HR-ESI-MS calcd for C11H17N2O3 [M+H]+ 225.1239, found 225.1237.
3-[1-(2-羟基乙基氨基) 亚乙基]-4-氧代-5, 5-二甲基-2-丁内酯 (10a):硅胶柱层析 (以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离得无色针状晶体0.18 g, 收率85%. m.p. 124~126 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.17, 10.37 (brs, 1H, NH), 4.27, 4.11 (brs, 1H, OH), 3.90 (brs, 2H, CH2O), 3.65 (brs, 2H, CH2N), 2.60 (brs, 3H, CH3), 1.39 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 201.38, 198.32, 174.40, 171.67, 171.15, 171.06, 89.78, 88.43, 85.20, 82.72, 59.76, 45.28, 45.08, 23.36, 13.99. HR-ESI-MS calcd for C10H16NO4 [M+H]+ 214.1079, found 214.1072.
3-[1-(甲基氨基) 亚乙基]-4-氧代-5, 5-二甲基-2-丁内酯 (10b):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=4:1至1:1梯度洗脱) 分离得无色针状晶体0.16 g, 收率81%. m.p. 139~140 ℃; 1H NMR (300 MHz, CDCl3) δ: 10.96, 10.20 (brs, 1H, NH), 3.15~3.12 (m, 3H, NCH3), 2.57 (brs, 3H, CH3), 1.41 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 201.49, 197.97, 174.13, 171.84, 171.10, 170.30, 89.82, 88.41, 85.10, 82.42, 29.43, 23.22, 13.32. HR-ESI-MS calcd for C9H14NO3 [M+H]+ 184.0974, found 184.0967.
3-[1-(正丁基氨基) 亚乙基]-4-氧代-5, 5-二甲基-2-丁内酯 (10c):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=16:1至4:1梯度洗脱) 分离得无色针状晶体0.21 g, 收率71%. m.p. 77~78 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.06, 10.26 (brs, 1H, NH), 3.50~3.44 (m, 2H, CH2N), 2.59 (s, 3H, CH3), 1.75~1.67 (m, 2H, CH2), 1.54~1.43 (m, 8H, CH2+2×CH3), 1.04~0.98 (m, 3H, CH3); 13C NMR (75 MHz) δ: 201.95, 198.55, 174.67, 171.17, 170.91, 170.41, 90.03, 88.63, 85.42, 82.85, 43.14, 42.88, 31.07, 30.94, 23.73, 23.66, 19.80, 13.96, 13.93, 13.47. HR-ESI-MS calcd for C12H20NO3 [M+H]+ 226.1443, found 226.1438.
3-[1-(苄基氨基) 亚乙基]-4-氧代-5, 5-二甲基-2-丁内酯 (10d):硅胶柱层析 (以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离得无色针状晶体0.21 g, 收率81%. m.p. 106~107 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.31, 10.56 (brs, 1H, NH), 7.41~7.25 (m, 5H, ArH), 4.64 (d, J=7.0 Hz, 2H, CH2N), 2.61 (s, 3H, CH3), 1.41 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 201.96, 198.56, 174.37, 171.45, 170.81, 170.64, 134.79, 134.58, 129.15, 129.10, 128.27, 128.29, 127.10, 126.97, 90.47, 89.13, 85.54, 82.91, 47.23, 46.85, 23.68, 23.61, 14.08. HR-ESI-MS calcd for C15H18NO3 [M+H]+ 260.1287, found 260.1279.
3-[1-(3-三氟甲基苄基氨基) 亚乙基]-4-氧代-5, 5-二甲基-2-丁内酯 (10e):硅胶柱层析 (200~300目硅胶, 以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离得黄色针状晶体0.23 g, 收率61%. m.p. 76~77 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.39, 10.63 (brs, 1H, NH), 7.67~7.54 (m, 4H, ArH), 4.76 (d, J=6.5 Hz, 2H, CH2N), 2.66 (s, 3H, CH3), 1.46 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 202.27, 198.68, 174.39, 171.69, 170.97, 170.50, 136.06, 135.81, 131.65 (JCF=32.5 Hz), 131.61 (JCF=32.5 Hz), 130.42, 130.40, 130.28, 130.26, 129.92, 129.86, 125.35 (JCF=3.8 Hz), 124.14 (JCF=3.8 Hz), 123.95 (JCF=3.8 Hz), 123.48 (JCF=270.5 Hz), 90.95, 89.60, 85.88, 83.15, 46.76, 46.38, 23.71, 23.64, 14.13, 14.12. HR-ESI-MS calcd for C16H17F3NO3 [M+H]+ 328.1161, found 328.1153.
3-[1-(4-甲氧基苄基氨基) 亚乙基]-4-氧代-5, 5-二甲基-2-丁内酯 (10f):硅胶柱层析 (以二氯甲烷/丙酮为洗脱剂, V二氯甲烷:V丙酮=10:1至2:1梯度洗脱) 分离得黄色针状晶体0.18 g, 收率61%. m.p. 76~77 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.27, 10.61 (brs, 1H, NH), 7.33~7.22 (m, 2H, ArH), 6.98~6.94 (m, 2H, ArH), 4.60 (d, J=6.6 Hz, 2H, CH2N), 3.86 (s, 3H, OCH3), 2.66 (s, 3H, CH3), 1.46 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 202.01, 198.69, 174.46, 171.18, 170.80, 170.57, 159.71, 159.65, 128.71, 128.57, 126.68, 126.49, 114.65, 114.61, 90.43, 89.10, 85.59, 82.98, 55.29, 46.92, 46.54, 23.75, 23.69, 14.18. HR-ESI-MS calcd for C16H20NO4 [M+H]+ 290.1392, found 290.1386.
3-甲基-5-(2-羟基-2-丙基) 异噁唑-4-羧酸 (10g):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=5:1至2:1梯度洗脱) 分离得白色固体0.11 g, 收率52%. m.p. 237~238 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.40 (br, 1H, CO2H), 7.36 (br, 1H, OH), 2.35 (s, 3H, CH3), 1.44 (s, 6H, 2×CH3); 13C NMR (75 MHz) δ: 178.83, 167.25, 160.88, 112.81, 68.44, 29.09, 11.67. HR-ESI-MS calcd for C8H12NO4 [M+H]+ 186.0766, found 186.0761.
3-[1-(2-羟基乙基氨基) 亚乙基]-4-氧代-5, 5-螺环己基-2-丁内酯 (10h):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=1:1至1:3梯度洗脱) 分离得浅黄色液体0.20 g, 收率67%. 1H NMR (300 MHz, CDCl3) δ: 11.22, 10.36 (brs, 1H, NH), 3.92 (brs, 2H, CH2O), 3.63 (brs, 2H, CH2N), 2.61 (brs, 3H, CH3), 1.59~1.31 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 201.26, 198.09, 174.40, 171.63, 171.39, 171.02, 90.35, 88.98, 87. 05, 84.43, 59.75, 45.24, 45.06, 31.89, 31.73, 24.22, 21.08, 14.07, 13.95. HR-ESI-MS calcd for C13H20NO4 [M+H]+ 254.1392, found 254.1386.
3-[1-(甲基氨基) 亚乙基]-4-氧代-5, 5-螺环己基-2-丁内酯 (10i):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=4:1至1:1梯度洗脱) 分离得无色针状晶体0.21 g, 收率80%. m.p. 150~151 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.02, 10.20 (brs, 1H, NH), 3.15~3.12 (m, 3H, NCH3), 2.59~2.57 (brs, 3H, CH3), 1.80~1.26 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 201.48, 197.92, 174.65, 172.01, 171.25, 170.85, 90.50, 89.12, 87.09, 84.32, 31.95, 31.81, 29.60, 29.39, 24.30, 21.14, 21.08, 13.58, 13.45. HR-ESI-MS calcd for C12H18NO3 [M+H]+ 224.1287, found 224.1275.
3-[1-(正丁基氨基) 亚乙基]-4-氧代-5, 5-螺环己基-2-丁内酯 (10j):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=16:1至4:1梯度洗脱) 分离得无色针状晶体0.19 g, 收率82%. m.p. 180~182 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.08, 10.24 (brs, 1H, NH), 3.45~3.37 (m, 2H, CH2N), 2.57 (s, 3H, CH3), 1.79~1.40 (m, 14H, 7×CH2), 0.97 (t, J=7.2 Hz, 3H, CH3); 13C NMR (75 MHz) δ: 201.85, 198.45, 175.07, 171.36, 171.18, 170.42, 90.63, 89.26, 87.33, 84.68, 43.16, 42.89, 32.33, 32.15, 31.18, 31.01, 29.64, 24.68, 24.65, 21.47, 21.43, 19.87, 13.98, 13.52. HR-ESI-MS calcd for C15H24NO3 [M+H]+ 266.1756, found 266.1748.
3-[1-(苄基氨基) 亚乙基]-4-氧代-5, 5-螺环己基-2-丁内酯 (10k):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=15:1至4:1梯度洗脱) 分离得无色针状晶体0.30 g, 收率94%. m.p. 132~134 ℃. 1H NMR (300 MHz, CDCl3) δ: 11.38, 10.60 (brs, 1H, NH), 7.46~7.27 (m, 5H, ArH), 4.65 (d, J=7.0 Hz, 2H, CH2N), 2.63 (s, 3H, CH3), 1.80~1.61 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 201.59, 198.17, 174.49, 171.21, 170.80, 170.60, 134.66, 134.41, 128.92, 128.86, 128.11, 128.02, 126.86, 126.66, 90.82, 89.52, 87.19, 84.46, 46.99, 46.56, 32.01, 31.84, 24.34, 24.31, 21.35, 21.09, 13.91, 13.86. HR-ESI-MS calcd for C18H22NO3 [M+H]+ 300.1600, found 300.1593.
3-[1-(3-三氟甲基苄基氨基) 亚乙基]-4-氧代-5, 5-螺环己基-2-丁内酯 (10l):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=16:1至5:1梯度洗脱) 分离得无色针状晶体0.18 g, 收率48%. m.p. 192~193 ℃; 1H NMR (300 MHz, CDCl3) δ: 11.37, 10.59 (brs, 1H, NH), 7.63~7.44 (m, 4H, ArH), 4.69 (d, J=7.5 Hz, 2H, CH2N), 2.60 (s, 3H, CH3), 1.72~1.66 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 201.82, 198.19, 174.43, 171.36, 170.65, 170.55, 135.86, 135.56, 131.38 (JCF=32.3 Hz), 130.07, 129.88, 129.61, 129.54, 125.04 (JCF=3.8 Hz), 123.79 (JCF=3.8 Hz), 123.55 (JCF=3.8 Hz), 123.32 (JCF=270.8 Hz), 91.24, 89.92, 87.47, 84.64, 46.44, 46.02, 31.99, 31.82, 24.29, 21.10, 21.05, 13.88, 13.83. HR-ESI-MS calcd for C19H21F3NO3 [M+H]+ 368.1474, found 368.1468.
3-[1-(4-甲氧基苄基氨基) 亚乙基]-4-氧代-5, 5-螺环己基-2-丁内酯 (10m):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=16:1至5:1梯度洗脱) 分离得淡黄色液体0.22 g, 收率65%. 1H NMR (300 MHz, CDCl3) δ: 11.26, 10.51 (brs, 1H, NH), 7.21~7.15 (m, 2H, ArH), 6.91~6.86 (m, 2H, ArH), 4.53 (d, J=6.0 Hz, 2H, CH2N), 3.78 (s, 3H, OCH3), 2.58 (s, 3H, CH3), 1.74~1.54 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 201.39, 198.06, 174.42, 170.87, 170.86, 170.30, 159.33, 128.39, 128.19, 126.55, 126.31, 114.27, 114.22, 90.55, 87.00, 84.32, 77.06, 54.93, 46.54, 46.12, 31.98, 31.81, 24.31, 21.12, 21.07, 13.90, 13.82. HR-ESI-MS calcd for C19H24NO4 [M+H]+ 330.1705, found 330.1698.
3-甲基-5-(1-羟基环己基)-异噁唑-4-羧酸 (10n):硅胶柱层析 (以石油醚/乙酸乙酯为洗脱剂, V石油醚:V乙酸乙酯=10:1至2:1梯度洗脱) 分离得白色粉末固体0.17 g, 收率55%. m.p. 154~155 ℃; 1H NMR (300 MHz, CDCl3) δ: 12.41 (br, 1H, CO2H), 8.35 (br, 1H, OH), 2.21 (s, 3H, CH3), 1.91~1.59 (m, 10H, 5×CH2); 13C NMR (75 MHz) δ: 172.00, 166.64, 166.68, 99.37, 82.88, 33.00, 24.25, 22.31, 11.66. HR-ESI-MS calcd for C11H16NO4 [M+H]+ 226.1079, found 226.1071.
-
-
[1]
Travert, N.; Al Mourabit, A. J. Am. Chem. Soc. 2004, 126, 10252. doi: 10.1021/ja047574e
-
[2]
Paola. V.; Athina, G.; Kitka, A.; Matteo, I.; Franca, Z. Bioorg. Med. Chem. 2006, 14, 3859. doi: 10.1016/j.bmc.2006.01.043
-
[3]
Patel, J. B.; Desai, V. A. Int. J. Drug Desi. Discovery 2011, 2, 393.
-
[4]
Miqdad, O. A.; Abunada, N. M.; Hassaneen, H. M.; Abu Samaha, A. M. Int. J. Chem. 2011, 3, 20.
-
[5]
(a) Nauen, R.; Jeschke, P.; Velten, R.; Beck, M. E.; Ebbinghaus-Kintscher, U.; Thielert, W.; Wolfel, K.; Haas, M.; Kunz, K.; Raupach, G. Pest Manage. Sci. 2015, 71, 850.
(b) Jeanmart, S.; Edmunds, A. J. F.; Lamberth, C.; Pouliot, M. Bioorg. Med. Chem., 2016, 24, 317. -
[6]
(a) Leite, L.; Jansone, D.; Veveris, M.; Cirule, H.; Popelis, J.; Melikyan, G.; Avetisyan, A.; Lukevics, E. Eur. J. Med. Chem. 1999, 34, 859.
(b) Melikyan, G. S.; Hovhannisyan, A. A.; Hayotsyan, S. S. Synth. Commun. 2012, 42, 2267. -
[7]
雷建平, 韩金涛, 徐志红, 董宏波, 王明安, 有机化学, 2012, 32, 1993. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341402.shtmlLei, J. P.; Han, J. T.; Xu, Z. H.; Dong, H. B.; Wang, M. A. Chin. J. Org. Chem. 2012, 32, 1993 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341402.shtml
-
[8]
雷建平, 董宏波, 汤博, 王明安, 农药学学报, 2012, 14, 669. doi: 10.3969/j.issn.1008-7303.2012.06.14Lei, J. P.; Dong, H. B.; Tang, B.; Wang, M. A. Chin. J. Pestc. Sci. 2012, 14, 669 (in Chinese). doi: 10.3969/j.issn.1008-7303.2012.06.14
-
[9]
Tang, B.; Yang, M. Y.; Zhao, Y.; Kong, L. Q.; Wang, W. W.; Wang, M. A. Molecules 2015, 20, 13740. doi: 10.3390/molecules200813740
-
[10]
Lacey, R. N. J. Chem. Soc., 1954, 832.
-
[11]
Harras, M.; Bauer, T.; Kempe, R.; Schobert, R. Tetrahedron 2013, 69, 3677. doi: 10.1016/j.tet.2013.03.004
-
[12]
Zimmer, H.; Amer, A.; Pham, C. V.; Schmidt, D. G. J. Org. Chem. 1988, 53, 3368. doi: 10.1021/jo00249a049
-
[13]
(a) Eflenberger, V. F.; Klenk, H.; Reid, P. L. Angew. Chem. 1973, 85, 819.
(b) Jackson, L. B.; Waring, A. J. J. Chem. Soc., Perkin Trans. 1 1988, 1791.
(c) Jackson, L. B.; Waring, A. J. J. Chem. Soc., Perkin Trans. 2 1990, 1893.
(d) Martin, R.; Lafrance, J. R.; Demerseman, P. Bull. Soc. Chim. Belg. 1991, 100, 539. -
[14]
Jung, M. E.; Street, L. J. J. Am. Chem. Soc. 1984, 106, 8327. doi: 10.1021/ja00338a071
-
[15]
Porter, N. A.; Carter, R. L.; Mero, C. L.; Roepel, M. G.; Curran, D. P. Tetrahedron 1996, 52, 4181. doi: 10.1016/0040-4020(96)00077-4
-
[16]
(a) Tietze, O.; Schiefner, B.; Ziemer, B.; Zschunke, A. Fresenius' J. Anal. Chem. 1997, 357, 477.
(b) Hu, Y.; Wang, J. J.; Lu, A. M.; Yang, C. L. Bioorg. Med. Chem. Lett. 2014, 24, 3772.
(c) Zhang, L. Z.; Ren, Z. J.; Lu, A. M.; Zhao, Z.; Xu, W. Q.; Bao, Q. Q.; Ding, W. J.; Yang, C. L. Chem. Res. Chin. Univ. 2015, 31, 228. -
[17]
瞿益萍, 王龙翔, 周晓玉, 冯秀娟, 包明, 有机化学, 2013, 33, 860. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341909.shtmlQu, Y. P.; Wang, L. X., Zhou, X. Y.; Feng, X. J.; Bao, M. Chin. J. Org. Chem. 2013, 33, 860 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341909.shtml
-
[18]
(a) Stanovnik, B.; Svete, J. Chem. Rev. 2004, 104, 2433.
(b) Elassar, A-Z. A.; El-Khair, A. A. Tetrahedron 2003, 59, 8463. -
[19]
El-Apasery, M. A.; Al-Mousawi, S. M.; Mahmoud, H.; Elnagdi, M. H. Int. Res. J. Pure Appl. Chem. 2011, 1, 69. doi: 10.9734/IRJPAC
-
[20]
Al-Mousawi, S. M.; El-Apasery, M. A.; Mahmoud, H.; Elnagdi, M. H. Int. Res. J. Pure Appl. Chem. 2012, 2, 77. doi: 10.9734/IRJPAC
-
[21]
Martinez, J. C. G.; Duchowicz, P. R.; Estrada, M. R.; Zamarbide, G. N.; Castro, E. QSAR Comb. Sci. 2009, 28, 1376. doi: 10.1002/qsar.v28:11/12
-
[22]
Liu, Y. X.; Zhao, H. P.; Wang, Z. W.; Li, Y. H.; Song, H. B.; Riches, H.; Beattie, D.; Gu, Y. C.; Wang, Q. M. Mol. Diversity 2013, 17, 701. doi: 10.1007/s11030-013-9466-6
-
[23]
Zeng, R. J.; Sheng, H. T.; Rao, B.; Feng, Y.; Wang, H.; Sun, Y. H.; Chen, M.; Zhu, M. Z. Chem. Res. Chin. Univ. 2015, 31, 212. doi: 10.1007/s40242-015-4388-8
-
[24]
(a) Li, M. ; Guo, W. S. ; Wen, L. R. ; Yang, H. Z. Chin. J. Org. Chem. 2006, 26, 1192 (in Chinese).
(李明, 郭维斯, 文丽荣, 杨华铮, 有机化学, 2006, 26, 1192. )
Deng, J. A. ; Shen, D. S. ; Jin, Y. P. Chem. Res. Appl. 2010, 22, 276 (in Chinese).
(邓爵安, 申东升, 靳亚萍, 化学研究与应用, 2010, 22, 276. ) -
[25]
魏振中, 肖兰, 王永秋, 李品华, 有机化学, 2014, 34, 985. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344368.shtmlWei, Z. Z.; Xiao, L.; Wang, Y. Q.; Li, P. H. Chin. J. Org. Chem. 2014, 34, 985 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344368.shtml
-
[26]
Shandala, M. Y.; Ayoub, M. T.; Mohammad, M. J. J. Heterocycl. Chem. 1984, 21, 1753. doi: 10.1002/jhet.v21:6
-
[1]
-
表 1 烯醇醚8a~8d与不同结构的胺类衍生物的反应
Table 1. Reactions of enol ethers 8a~8d with different amines
Entry Amine Enol ether Product Yield/% Entry Enol ether Product Yield/% 1 HOCH2CH2NH2 8a 9a 89 27 8c 10a 85 2 CH3NH2 8a 9b 85 28 8c 10b 81 3 n-C4H9NH2 8a 9c 81 29 8c 10c 71 4 (CH3)2NH 8a 9d 74 30 8c — — 5 C6H5CH2NH2 8a 9e 89 31 8c 10d 81 6 3-CF3C6H4CH2NH2 8a 9f 55 32 8c 10e 61 7 4-CH3OC6H4CH2NH2 8a 9g 80 33 8c 10f 61 8 C6H5NH2 8a 9h 79 34 8c — — 9 NH2C5H4N 8a 9i 75 35 8c — — 10 NH2OH 8a 9j 65 36 8c 10g 52 11 NH2OCH3 8a 9k 46 37 8c — — 12 NH2NH2 8a 9l 61 38 8c — — a 13 C6H5NHCH3 8a — — 39 8c — — 14 HOCH2CH2NH2 8b 9m 72 40 8d 10h 67 15 CH3NH2 8b 9n 87 41 8d 10i 80 16 n-C4H9NH2 8b 9o 87 42 8d 10j 82 17 (CH3)2NH 8b 9p 62 43 8d — — 18 C6H5CH2NH2 8b 9q 75 44 8d 10k 94 19 3-CF3C6H4CH2NH2 8b 9r 76 45 8d 10l 48 20 4-CH3OC6H4CH2NH2 8b 9s 75 46 8d 10m 65 21 C6H5NH2 8b 9t 79 47 8d — — 22 NH2C5H4N 8b 9u 78 48 8d — — 23 NH2OH 8b 9v 72 49 8d 10n 55 24 NH2OCH3 8b 9w 56 50 8d — — 25 NH2NH2 8b 9x 60 51 8d — — a 26 C6H5NHCH3 8b — — 52 8d — — aThese results will be presented in the other paper due to opening of lactone ring and forming novel structures. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 1586
- HTML全文浏览量: 206


 下载:
下载:





 下载:
下载:

